Тиф вызывается бактериями или вирусами
Обновлено: 12.05.2024
Бактериофаги – это вирусы, которые поражают только бактерий. В ходе инфекции они влияют на все процессы жизнедеятельности бактериальной клетки, фактически превращая ее в фабрику по производству вирусного потомства. В конце концов клетка разрушается, а вновь образованные вирусные частицы выходят наружу и могут заражать новые бактерии.
Несмотря на огромное число и разнообразие природных фагов, встречаемся мы с ними редко. Однако бывают ситуации, когда деятельность этих вирусов не остается незамеченной. Например, на предприятиях, где производят сыры, йогурты и другие молочно-кислые продукты, часто приходится сталкиваться с вирусной атакой на бактерии, сбраживающие молоко. В большинстве таких случаев фаговая инфекция распространяется молниеносно, и полезные бактерии гибнут, что приводит к значительным экономическим потерям (Neve et al., 1994).
Именно благодаря прикладным исследованиям в интересах молочной промышленности, направленным на получение устойчивых к бактериофагам штаммов молочно-кислых бактерий, был открыт ряд механизмов, с помощью которых бактерии избегают инфекции. Параллельно были изучены способы, с помощью которых вирусы, в свою очередь, преодолевают бактериальные системы защиты (Moineau et al., 1993).
Кто защищен – тот вооружен
На сегодня известно пять основных, весьма хитроумных механизмов защиты, которые бактерии выработали в непрестанной борьбе с вирусами: изменение рецептора на поверхности клетки; исключение суперинфекции; системы абортивной инфекции; системы рестрикции-модификации и, наконец, системы CRISPR-Cas.
К средствам противовирусной защиты бактерий относятся и системы рестрикции-модификации, в которые входят гены, кодирующие два белка-фермента – рестриктазу и метилазу. Рестриктаза узнает определенные последовательности ДНК длиной 4—6 нуклеотидов и вносит в них двуцепочечные разрывы. Метилаза, напротив, ковалентно модифицирует эти последовательности, добавляя к отдельным нуклеотидным основаниям метильные группы, что предотвращает их узнавание рестриктазой.
Врага нужно знать в лицо
Системы CRISPR-Cas являются уникальным примером адаптивного иммунитета бактерий. При проникновении в клетку ДНК фага специальные белки Cas встраивают фрагменты вирусной ДНК длиной 25—40 нуклеотидов в определенный участок генома бактерии (Barrangou et al., 2007). Такие фрагменты называются спейсерами (от англ. spacer – промежуток), участок, где происходит встраивание, – CRISPR-кассета (от англ. Clustered Regularly Interspaced Short Palindromic Repeats), а сам процесс приобретения спейсеров – адаптацией.
Чтобы использовать спейсеры в борьбе с фаговой инфекцией, в клетке должен происходить еще один процесс, управляемый белками Cas, названный интерференцией. Суть его в том, что в ходе транскрипции CRISPR-кассеты образуется длинная молекула РНК, которая разрезается белками Cas на короткие фрагменты – защитные криспрРНК (крРНК), каждая из которых содержит один спейсер. Белки Cas вместе с молекулой крРНК образуют эффекторный комплекс, который сканирует всю ДНК клетки на наличие последовательностей, идентичных спейсеру (протоспейсеров). Найденные протоспейсеры расщепляются белками Cas (Westra et al., 2012; Jinek et al., 2012).
Системы CRISPR-Cas обнаружены у большинства прокариот – бактерий и архей. Хотя общий принцип действия всех известных систем CRISPR-Cas одинаков, механизмы их работы могут существенно отличаться в деталях. Наибольшие различия проявляются в строении и функционировании эффекторного комплекса, в связи с чем системы CRISPR-Cas делят на несколько типов. На сегодняшний день описаны шесть типов таких неродственных друг другу систем (Makarova et al., 2015; Shmakov et al., 2015).

Наиболее изученной является система CRISPR-Cas I типа, которой обладает излюбленный объект молекулярно-биологических исследований – бактерия кишечная палочка (Esсherichia coli). Эффекторный комплекс в этой системе состоит из нескольких небольших белков Cas, каждый из которых отвечает за разные функции: разрезание длинной некодирующей CRISPR РНК, связывание коротких крРНК, поиск, а затем разрезание ДНК-мишени.
Гонка вооружений
Бактериофаги, как факторы среды, вызывают направленные изменения в геноме бактерий, которые наследуются и дают бактериям явное преимущество, спасая от повторных инфекций. Поэтому системы CRISPR-Cas можно считать примером ламарковской эволюции, при которой происходит наследование благоприобретенных признаков (Koonin et al., 2009)
Некоторые бактериофаги реагируют на наличие в бактериальной клетке систем CRISPR-Cas выработкой особых анти CRISPR-белков, способных связываться с белками Cas и блокировать их функции (Bondy-Denomy et al., 2015). Еще одно ухищрение — обмен участков генома вируса, на которые нацелена система CRISPR-Cas, на участки геномов родственных вирусов, отличающихся по составу нуклеотидной последовательности (Paez-Espino et al., 2015).

Благодаря постоянному совершенствованию биоинформатических алгоритмов поиска, а также включению в анализ все большего количества прокариотических геномов, открытие новых типов CRISPR-Cas систем является делом недалекого будущего. Предстоит также выяснить и детальные механизмы работы многих недавно открытых систем. Так, в статье, опубликованной в 2016 г. в журнале Science и посвященной анализу системы CRISPR-Cas VI типа, описан белок С2с2, образующий эффекторный комплекс с крРНК, который нацелен на деградацию не ДНК, а РНК (Abudayyeh et al., 2016). В будущем такое необычное свойство может быть использовано в медицине для регулирования активности генов путем изменения количества кодируемых ими РНК.
Изучение стратегий борьбы бактерий с бактериофагами, несмотря на свою кажущуюся фундаментальность и отвлеченность от задач практической медицины, принесло неоценимую пользу человечеству. Примерами этого могут служить методы молекулярного клонирования и редактирования геномов – направленного внесения или удаления мутаций и изменения уровня транскрипции определенных генов.
Благодаря быстрому развитию методов молекулярной биологии всего лишь через несколько лет после открытия механизма действия систем CRISPR-Cas была создана работающая технология геномного редактирования, способная бороться с болезнями, ранее считавшимися неизлечимыми. Доступность и простота этой технологии позволяют рассматривать ее как основу для медицины, ветеринарии, сельского хозяйства и биотехнологий будущего, которые будут базироваться на направленных и безопасных генных модификациях.
Нет никаких сомнений, что дальнейшее изучение взаимодействия бактерий и их вирусов может открыть перед нами такие возможности, о которых мы сейчас даже не подозреваем.
Abudayyeh O. O., Gootenberg J. S., Konermann S. et al. C 2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector // Science. 2016. V. 353: aaf5573.
Barrangou R., Fremaux C., Deveau H. et al. CRISPR provides acquired resistance against viruses in prokaryotes // Science. 2007. V. 315. P. 1709–1712.
Bikard D., Marraffini L. A. Innate and adaptive immunity in bacteria: mechanisms of programmed genetic variation to fight bacteriophages // Curr. Opin. Immunol. 2012. V. 1 P. 15–20.
Bondy-Denomy J., Garcia B., Strum S. et al. Multiple mechanisms for CRISPR-Cas inhibition by anti-CRISPR proteins // Nature. 2015. V. 526. P. 136–139.
Calendar R., Abedon S. T. The Bacteriophages // 2nd Ed., Oxford University Press. 2006.
Datsenko K. A., Pougach K., Tikhonov A. et al. Molecular memory of prior infections activates the CRISPR/Cas adaptive bacterial immunity system // Nat. Commun. 2012. V. 3. P. 945
Jiang W., Marraffini L. A. CRISPR-Cas: New Tools for Genetic Manipulations from Bacterial Immunity Systems // Annu. Rev. Microbiol. 2015. V. 69. P. 209–28.
Jinek M., Chylinski K., Fonfara I., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity // Science. 2012. V. 337. P. 816–821.
Koonin E. V., Wolf Y. I. Is evolution Darwinian or/and Lamarckian? // Biol. Direct. 2009. V. 4. P. 42.
Lopez-Pascua L., Buckling A. Increasing productivity accelerates host-parasite coevolution // J. Evol. Biol. 2008. V. 3. P. 853–860.
Makarova K. S., Wolf Y. I., et al. An updated evolutionary classification of CRISPR-Cas systems // Nat. Rev. Microbiol. 2015. V. 11. P. 722–736.
Moineau, S., Pandian S., Klaenhammer T. R. Restriction/modification systems and restriction endonucleases are more effective on lactococcal bacteriophages that have emerged recently in the dairy industry // Appl. Envir. Microbiol. 1993. V. 59. P. 197–202.
Neve H., Kemper U., et al. Monitoring and characterization of lactococcal bacteriophage in a dairy plant // Kiel. Milckwirtsch. Forschungsber. 1994. V. 46. P. 167–178.
Nuñez J. K., Harrington L. B., et al. Foreign DNA capture during CRISPR-Cas adaptive immunity // Nature. 2015a. V. 527. P. 535–538.
Nuñez J. K., Kranzusch P. J., et al. Cas1-Cas2 complex formation mediates spacer acquisition during CRISPR-Cas adaptive immunity // Nat. Struct. Mol. Biol. 2014. V. 21. P. 528–534.
Nuñez J. K., Lee A. S., Engelman A., Doudna J. A. Integrase-mediated spacer acquisition during CRISPR-Cas adaptive immunity // Nature. 2015b. V. 519. P. 193–198.
Paez-Espino D., Sharon I., et al. CRISPR Immunity Drives Rapid Phage Genome Evolution in Streptococcus thermophilus // MBio. 2015. V. 6: e00262–15.
Shmakov S., Abudayyeh O. O., Makarova K. S., et al. Discovery and Functional Characterization of Diverse Class 2 CRISPR-Cas Systems. // Mol. Cell. 2015. V. 60. P. 385–397
Tan D., Svenningsen S. L., Middelboe M. Quorum sensing determines the choice of antiphage defense strategy in Vibrio anguillarum. // mBio 2015. V. 6: e00627–15.
Westra E. R., van Erp P. B., Künne T., et al. CRISPR immunity relies on the consecutive binding and degradation of negatively supercoiled invader DNA by Cascade and Cas3 // Mol. Cell. 2012. V. 46. P. 595–605.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Хеликобактериоз: причины появления, симптомы, диагностика и способы лечения.
Определение
Хеликобактериоз – инфекционное заболевание, поражающее пилорический отдел желудка, или привратник, и двенадцатиперстную кишку. Его возбудителем является уникальная патогенная микроаэрофильная грамотрицательная бактерия хеликобактер пилори (H. pylori). Свое название бактерия получила за счет отдела желудка, в котором она обитает – пилорического.
В результате микроорганизм еще сильнее колонизирует слизистую оболочку, формирует ее повышенную восприимчивость к соляной кислоте и провоцирует воспаление, приводящее к развитию язвенных дефектов.
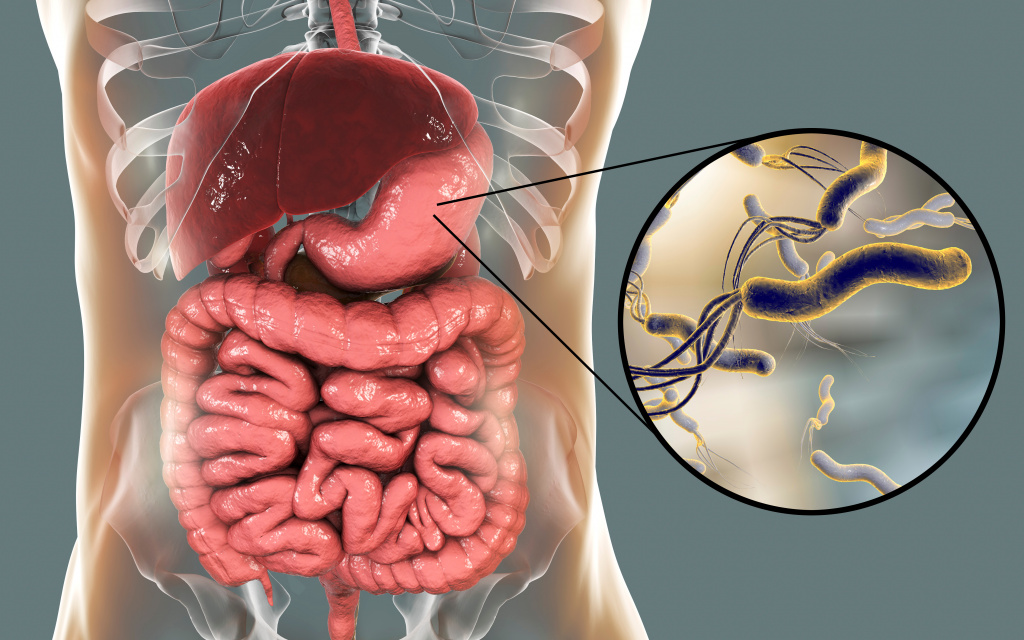
Хеликобактер пилори – спиралевидная бактерия длиной 3,5 и шириной 0,5 микрон. Она имеет жгутики, с помощью которых свободно перемещается по стенке желудка либо надежно на ней закрепляется. Бактерия H. pylori очень изменчива, ее штаммы (разновидности) отличаются друг от друга способностью прикрепляться к слизистой оболочке желудка, вызывать воспалительный процесс и обладают разной степенью патогенности.

Хеликобактер пилори, колонизирующая слизистую оболочку желудка, — частая причина ее воспалительных изменений, она признана этиологическим фактором гастрита, а сам гастрит — инфекционным заболеванием. В зависимости от состояния защитных факторов желудка возникший инфекционный процесс может протекать латентно или с выраженной клинической симптоматикой воспаления. Согласно современным представлениям, H. pylori вызывает хронический гастрит у всех зараженных лиц. Это может привести к язвенной болезни, атрофическому гастриту, аденокарциноме желудка или низкодифференцируемой лимфоме желудка. H. pylori относится к канцерогенам первого порядка.
Результаты многочисленных исследований дают основание предполагать возможную патогенетическую или опосредованную роль инфекции H. pylori в развитии и/или течении заболеваний, не относящихся к пищеварению: кардио-, цереброваскулярных, аутоиммунных заболеваний, заболеваний крови, кожи, нервной системы и многих других.
Патоген отличается относительной устойчивостью к окружающей среде: при кипячении хеликобактерии гибнут практически мгновенно, при обработке дезинфицирующими составами — в течение нескольких минут.
Причины появления хеликобактериоза
Заразиться бактерией можно при контакте с загрязненной водой или продуктами питания. Инфицирование возможно во время проведения эндоскопии и при использовании других плохо стерилизованных медицинских инструментов, которые имели прямой контакт со слизистой желудка пациента.
Бытовой способ передачи (например, через поцелуи, личные вещи и проч.) также возможен, о чем свидетельствует выделение бактерии из слюны и зубного налета.
Распространенность инфекции варьируется в зависимости от географического региона, возраста пациента, его этнической принадлежности и социально-экономического статуса. По данным Департамента здравоохранения г. Москвы (2019), распространенность этой инфекции в Москве составляет 60,7–88%, в Санкт-Петербурге - 63,6%, в Восточной Сибири достигает 90%.
Классификация заболеваний
Заболевания, связанные с H. pylori:
- гастрит,
- дуоденит,
- гастродуоденит,
- эзофагит,
- язвенная болезнь желудка,
- язвенная болезнь двенадцатиперстной кишки,
- железодефицитная анемия неясного генеза,
- рак желудка,
- рак двенадцатиперстной кишки.
Основной жалобой, с которой больные с признаками Helicobacter-инфекции обращаются к врачу, являются желудочные боли. Локализация симптома может меняться и переходить в область расположения двенадцатиперстной кишки.
Боли бывают острыми, ноющими, тупыми, возникают в верхних отделах живота слева и по центру в околопупочной области. Дискомфорт может возникать при длительном голодании, натощак или через определенное время после приема пищи.
Симптоматика хеликобактериоза зависит от клинической формы заболевания и может включать:
- чувство тяжести в животе после еды;
- нарушение аппетита, связанное с внезапными приступами тошноты (если слизистая желудка сильно травмирована);
- беспричинная рвота на фоне нормальной температуры тела;
- изжога (жгучие ощущения в пищеводе и даже гортани) и отрыжка с неприятным кислым или горьким привкусом;
- хронические запоры (отсутствие дефекации в течение трех суток и более);
- разжижение каловых масс, появление пенистой или водянистой консистенции;
- кишечные спазмы и вздутие живота.
- снижение аппетита до полного его отсутствия;
- тошнота может сменяться рвотой со сгустками крови;
- резкое снижение массы тела, не являющееся нормой;
- сухость во рту и привкус металла;
- появление белого налета на языке;
- неприятный запах изо рта при отсутствии кариеса;
- заеды в уголках рта;
- кровоточивость десен.
Диагностика хеликобактериоза
Долгое время хеликобактериоз может никак себя не проявлять, при этом провоцируя развитие язвы, аденокарциномы или мальтомы желудка. В особой зоне риска люди, чьи родственники имеют эти заболевания в анамнезе.
Диагностика может быть инвазивной (эндоскопия с последующей биопсией желудочных тканей) и неинвазивной (лабораторные исследования).
Согласно международным рекомендациям, методами выбора для диагностики бактерии и оценки эффективности лечения H. pylori служат дыхательный̆ тест с мочевиной, меченной 13С и определение специфических антигенов H. pylori в кале иммунохроматографическим методом.
Синонимы: Дыхательный тест с 13С-меченной мочевиной. 13 UBT; 13C-UBT. Краткая характеристика 13С-уреазного дыхательного теста Дыхательный тест в текущей модификации предназначен для лиц старше 12 лет. 13С-уреазный дыхательный тест относится к неинвазивным безопасным методам исследования.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Вирус в настоящее время известен как коронавирус 2 тяжелого острого респираторного синдрома (Severe acute respiratory syndrome-related coronavirus 2 - SARS-CoV-2), и вызванное им заболевание называется коронавирусной болезнью 2019 (COronaVIrus Disease 2019 - COVID-19).
Механизм передачи инфекции — это способ перемещения инфекционного возбудителя из зараженного организма в восприимчивый. Каждое инфекционное заболевание имеет свой характерный путь передачи возбудителя, который сформировался в процессе эволюции для сохранения возбудителя как вида. Механизм передачи возбудителя включает три фазы:
- Выведение возбудителя из организма хозяина в окружающую среду.
- Пребывание возбудителя в окружающей среде.
- Внедрение возбудителя в новый восприимчивый организм.
Основной механизм передачи коронавирусной инфекции – воздушно-капельный (или воздушно-пылевой), при котором возбудители локализуются в слизистой оболочке дыхательных путей и переносятся в новый организм через воздух.
При этом пути передачи возбудитель поступает во внешнюю среду при чихании и кашле с каплями жидкости и внедряется в организм человека при вдыхании воздуха, содержащего инфицированные частицы. Если частицы маленькие, они какое-то время находятся в воздухе в виде аэрозоля (капли, взвешенные в воздухе), а если частицы крупнее, то они оседают на различные поверхности на расстоянии до двух метров вокруг больного человека. Очень часто это предметы частого пользования: ручки двери, поручни в транспорте, мобильные телефоны и т.д. Прикасаясь к своему лицу человек заносит вирус на слизистые носа, рта, глаз.

Рисунок 1. Схема движения жидкого секрета (который может содержать вирусы) при кашле, чихании или разговоре.
1 – Крупные частицы, которые оседают на поверхностях на расстоянии до двух метров вокруг больного человека.
2 – Движение мелких частиц, которые некоторое время находятся в воздухе в виде аэрозоля (3)
Пребывание вируса в окружающей среде
- Нахождение вируса в воздухе В эксперименте, проведенном учеными – биологами, было обнаружено, что вирус может оставаться в воздухе в течение трех часов. Результаты других исследований говорят о том, что в большинстве реальных ситуаций вирус находится в воздухе до 30 минут, прежде чем осесть на какую-либо поверхность.
- Нахождение вируса на различных поверхностях Большие исследования, которые проводились после предыдущих вспышек коронавирусной инфекции, показали, что на стальных поверхностях некоторые из коронавирусов могут сохраняться до 4 дней даже при температуре 40°С. На бумаге, при комнатной температуре, вирус может сохраняться 4-5 дней, на стеклянных поверхностях – 4 дня, на пластике -6 дней.
На основе этих данных ученые предположили такую же устойчивость и у COVID-19.
Инкубационный период
Инкубационный период – это период времени от момента внедрения возбудителя в организм и до появления первых клинических симптомов болезни.
Для COVID-19 (на основании полученных данных) инкубационный период составляет от 2 до 14 дней, в среднем для большинства заболевших – 5,2 дня.
Длительность инкубационного периода зависит от ряда факторов:
- Вида микроорганизма
- Инфицирующей дозы (минимальное количество патогена, которое способно вызвать болезнь)
- Вирулентности (степени способности вируса заражать организм)
- Пути проникновения в организм
- От состояния организма, в который внедряется вирус
Во время инкубационного периода коронавирус проникает в эпителиальные клетки слизистой оболочки бронхолегочной системы и начинает свое воспроизведение. В процессе воспроизведения новых вирусов зараженная клетка чаще всего погибает.
Симптомов заболевания в инкубационном периоде еще нет, но в организме уже происходят патологические реакции, которые направлены на борьбу с инфекционным агентом и если этих мер защиты оказывается недостаточно, то инфекционный процесс развивается дальше.
Кто может быть заразен?
Период времени в течение которого человек заразен точно не определен, но данные некоторых исследований указывают на то, что человек с COVID-19 способен распространять вирус до появления каких-либо симптомов (за 1-3 дня до первых признаков болезни). Наиболее заразными считаются люди в момент, когда заканчивается инкубационный период и появляются симптомы заболевания.
Продолжительность выделения вируса может быть различна и зависеть от тяжести течения заболевания. На практике, если пациент находился в больнице, то он считается здоровым после двух отрицательных тестов на COVID-19, взятых с интервалом в 24 часа. При лечении в домашних условиях необходимо соблюдение трех условий:
- С момента появления симптомов прошло не менее 7 дней.
- Нет симптомов коронавирусной инфекции (кашель, одышка и др.).
- В течение трех суток температура тела не повышалась.
Базовое репродуктивное число показывает то количество человек, которых может заразить вокруг себя один заболевший. Например, базовое репродуктивное число для гриппа равно 1-2, для кори - 12-18. Для COVID-19 (по оценке китайских эпидемиологов) – около 4. Таким образом, можно сделать вывод о том, что новый коронавирус в 3-4 раза менее заразен, чем корь и в 2-3 раза более заразен, чем грипп.
Тяжесть течения заболевания, симптомы, возрастные особенности и группы риска
В феврале 2020 года китайские ученые опубликовали отчет, который был составлен на анализе более 70 тыс. случаев COVID-19. В настоящее время это самое крупное исследование.
Статистические данные этого исследования таковы:
Возрастные особенности:
Основная группа заболевших -87% - это были люди в возрасте от 30 до 79 лет, старше 80 лет - 3 % пациентов, заболевшие дети до 10 лет составляли 1%, подростки (от 10 до 19 лет) – 1% заболевших.
Основываясь на имеющейся в настоящее время информации и клиническом опыте, пожилые люди и люди любого возраста, которые имеют серьезные основные заболевания, подвержены высокому риску тяжелого течения COVID19.
Данные исследований однозначно выделяют в основную группу высокого риска тяжелого течения коронавирусной инфекции следующие заболевания:
- Гипертоническая болезнь (артериальная гипертензия)
- Ишемическая болезнь сердца
- Бронхиальная астма (средней и тяжёлой степени течения заболевания)
- Хроническая обструктивная болезнь легких (ХОБЛ) и другие заболевания легких
- Сахарный диабет
- Ожирение (ИМТ более 40)
- Хронические болезни почек, в том числе находящиеся на программном гемодиализе
- Люди с хроническими заболеваниями печени
Состояния, которые существенно утяжеляют течение COVID-19 связаны с заболеваниями, влияющими на иммунную систему человека: онкологические заболевания и проводимая химиотерапия, прием препаратов, подавляющих иммунитет (пациенты после трансплантации органов и тканей) и иммунодефицитные состояния.
Некоторые исследователи выделяют лабораторные данные, которые также в свою очередь могут повышать риск тяжелых осложнений коронавирусной инфекции. К ним относится низкое содержание лимфоцитов (лимфопения); увеличение уровня лактатдегидрогеназы и креатининфосфокиназы; повышение уровня маркеров воспаления (С- реактивного белка); изменение в системе гемостаза (удлинение протромбинового времени, повышение D- димера).
- Официальный сайт Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека .
- Kampf G, Todt D, Pfaender S, Steinmann E. Persistence of coronaviruses on inanimate surfaces and their inactivation with biocidal agents. J Hosp Infect, 2020 тMar;104(3):246-251
- Xiaobo Yang, Yuan Yu et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. The Lancet, 2020.
- Рекомендации ВОЗ для населения. Вопросы и ответы о коронавирусной инфекции COVID-19.
- Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, Xiang J, Wang Y, Song B, Gu X, Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020 Mar 28;395(10229):1054-1062
- Zunyou Wu, MD, PhD; Jennifer M. McGoogan, PhD. Characteristics of and Important Lessons From the Coronavirus Disease 2019 (COVID-19) Outbreak in ChinaSummary of a Report of 72 314 Cases From the Chinese Center for Disease Control and Prevention. JAMA. 2020;323(13):1239-1242.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Брюшной тиф: причины появления, симптомы, диагностика и способы лечения.
Определение
Брюшной тиф – это острое инфекционное заболевание, проявляющееся лихорадкой и симптомами интоксикации. Его возбудителями являются бактерии Salmonella Typhi, которые обнаруживаются в воде, мясных и молочных продуктах. В организме человека бактерии начинают выделять эндотоксин, который вызывает симптомы заболевания.
Бактерии чрезвычайно устойчивы к неблагоприятным факторам окружающей среды, резким перепадам температуры, но при этом они погибают при кипячении.
Причины появления брюшного тифа
Источниками инфекции чаще всего являются больные люди или носители бактерий.
Механизм передачи – фекально-оральный, возбудитель выделяется в окружающую среду с мочой, фекалиями, зачастую бактерии остаются на плохо вымытых руках и попадают через продукты питания в рот.
Редко и в основном среди детей болезнь может распространяться контактно-бытовым путем - через посуду и предметы гигиены. Значимую роль в распространении брюшного тифа играют мухи, которые разносят микрочастицы фекалий на лапках, поэтому пик заболеваемости приходится на летне-осенний период.
Брюшной тиф встречается повсеместно, но больше всего он распространен в странах с плохой санитарной обстановкой и низким уровнем гигиены, в перенаселенных городах с отсутствием доступа к чистой питьевой воде.
Классификация заболевания
Существует три формы течения болезни:
- Типичное течение. Характеризуется медленно нарастающей лихорадкой, тяжелыми симптомами интоксикации, типичными поражениями желудочно-кишечного тракта и кожных покровов.
- Атипичное течение:
- стертая форма (заболевание протекает легче, лихорадка может отсутствовать, симптомы поражения желудочно-кишечного тракта выражены слабо);
- бессимптомная форма (симптомов нет совсем, но в крови выявляются специфические антитела);
- носительство Salmonella Typhi.
- Редкие формы (пневмотиф, менинготиф, нефротиф, колотиф, аппендикотиф, холангиотиф, тифозный гастроэнтерит).
По характеру течения выделяют:
- Циклический брюшной тиф (наиболее часто встречающийся вариант) - характеризуется циклическими патологическими изменениями в кишечнике в среднем в течение 6 недель. Цикл проходит стадии от постепенного формирования язв на слизистой кишечника до полного их заживления и выздоровления больного.
- Рецидивирующий брюшной тиф (встречается в 10–15% случаев) - характеризуется возобновлением симптоматики после периода нормализации температуры в течение не менее 14 дней. В среднем наблюдается до 5 рецидивов, но протекают они легче первого проявления болезни.
Симптомы брюшного тифа
Симптомы брюшного тифа обычно развиваются через 1-2 недели после заражения человека бактериями Salmonella typhi.
При типичном течении заболевания выделяют начальный период, который длится около недели и характеризуется ежедневно нарастающей лихорадкой (температура тела до 40–40,5оС) и симптомами интоксикации.
К симптомам интоксикации относят головную боль, слабость и повышенную утомляемость, боль в мышцах, потливость, потерю аппетита и веса, нарушение сна.
В ряде случаев отмечается снижение артериального давления, появляются сухой кашель, болезненность в нижних отделах живота и запор.
В разгар болезни пациенты жалуются на заторможенность, сонливость, оглушенность. Характерными симптомами являются бледность кожи и одутловатость лица.
Поражение желудочно-кишечного тракта проявляется белым налетом и отечностью языка. В животе отмечается характерное урчание, болезненность, вздутие, стул становится жидким, зеленоватым.
На 8–10-й день болезни на коже груди, живота, реже на конечностях появляется красноватая сыпь.
Острая стадия заболевания продолжается около 1–2 недель.

В период выздоровления к больному возвращается аппетит, нормализуется сон. Однако остается выраженная слабость, эмоциональная неустойчивость. Длительное время может сохраняться субфебрильная температура тела (не выше 37,5оС).
Диагностика брюшного тифа
Установление диагноза начинается с осмотра больного, сбора жалоб, истории болезни, обязательного учета предыдущих поездок, контактов с заболевшими людьми, употребления зараженных продуктов питания.
Для подтверждения диагноза врач назначит лабораторные и инструментальные методы обследования:
-
Клинический анализ крови с развернутой лейкоцитарной формулой (помогает выявить воспалительные изменения).
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Читайте также:

