Тромбоцитопения при вирусных заболеваниях у детей
Обновлено: 22.04.2024
Тромбоцитопеническая пурпура после вирусных инфекций - клиника, диагностика
Эпидемиологическая анкета и специальные исследования показывают, что у детей младше 8 лет, вирусные инфекции предшествуют тромбоцитопенической пурпуре в 85% случаев и лишь 15% являются очевидно идиопатическими.
Болезнь наступает внезапно, обычно спустя 1—3 недель после вирусной инфекции, особенно дыхательных путей; бывают случаи, когда период после инфекции и до появления пурпуры продолжительнее — до 4 месяцев. Согласно McClure, вирусную этиологию можно установить по меньшей мере в 50% случаев из 413 исследованных детей.
Пурпура появилась спустя 3—6 недель, с одинаковой частотой у мальчиков и девочек, в то время как у взрослого преобладают женщины в пропорции 2/1 или даже 3/1.
Вирусная этиология была наглядно доказана у детей с тромбоцитопенической пурпурой, родившихся с краснухой (Luscher и сотр., Wallace, Svenigsen, Zinkham и сотр.), при которой обнаруживаются антивирусные антитела после состояния виремии.
Вполне возможно, что механизм тромбоцитопении происходит по поводу поражений типа III, благодаря иммунным комплексам, но не по поводу антитромбоцитарных антител. Виремия, как и при других вирусных инфекциях, находится лишь на 7 дней раньше и два дня после вирусного высыпания, следовательно задольго до пурпурного высыпания.
Вирусная этиология определяется после некоторых вирусных инфекций, проявляющих максимальную частоту в холодные времена года или в начале весны, как например различные высыпные лихорадки, корь, ветряная оспа, оспа, а также и инфекции с Pertussis. Бывают случаи и после инфекционных мононуклеозов, а также и после вирусных герпесов, инфекций с цитомегаловирусом, свинкой и даже после гепатита Боткина.
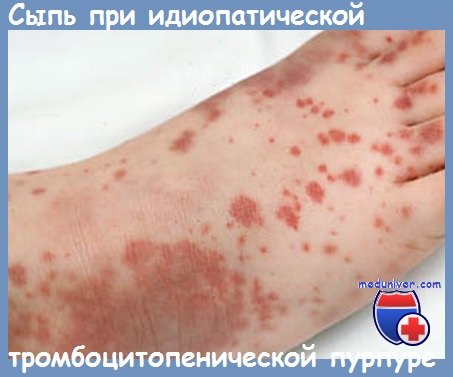
Вирусная этиология была доказана несомненно при тромбоцитопенической пурпуре после противокоревой или противооспенной вакцинации, но только в редких случаях (Alter и сотр., Oski и сотр., Bachand и сотр.). Реже можно ссылаться на иммунную этнологию после бактериальных инфекций (Clement и Diamond) или после интрадермореакций на туберкулин.
Следует обращать особое внимание на тромбоцитопеническую пурпуру, появляющиеся в разгаре септического состояния, микробного или вирусного, при котором механизм тромбоцитопении иной. В этих случаях микробные токсины, как при стрептококковых, пневмококковых, менингококковых инфекциях, а также и вследствие других граммотрицательных агентов, детерминируют появление во время септического периода синдрома с вторичной тромбоцитопенией путем явления Sanarelli-Schwartzmann.
Микробные токсины, но особенно вирусные частицы, могут прямо вызывать агглютинацию тромбоцитов и тяжелый прогрессивный синдром по поводу уничтожения тромбоцитов на уровне РЭС. Это тромбоцитопени-ческие расстройства по поводу снижения тромбоцитов на периферии, к которому добавляется однако и дефицит производства благодаря прямому поражению мегакариоцитов, которые являются очень благоприятной средой для размножения вирусов (Dalton и сотр.).
В разгаре вирусной инфекции или после вакцинации число мегакариоцитов понижается, они представляют дефекты созревания и дегенеративные поражения с вакуолями и многочисленными свободными ядрами, в то время как число тромбоцитов снижается. При тяжелых тромбоцитопениях констатируется признак разрушения тромбоцитов с повышением в сыворотке кислотных фосфатаз.
Подобные механизмы с периферическим лизисом возникают и при других инфекциях, как например лихорадка денга, токсоплазмоз, а также и при таиландской геморрагической лихорадке, вызв шной вирусом миэлодепрессивного действия (Bierman и Nelson). Эти данные смешанного патогенеза необходимы для диагностицирования известных вторичных форм путем изучения непосредственного действия инфекционных агентов, таких как вирусные агенты, антитела, иммунные комплексы, а также тромбоцитарного турновера и функций мегакариоцитов.
С клинической точки зрения, поствирусные формы у детей имеют в основном характер идиопатической тромбоцитопенической пурпуры. В обширной статистике, McClure находит, наряду с пурпурой у всех больных, эпистаксис у 30%, гематурию у 5— 10% и органиченную частоту для других кроворечений, как например гемоторакс. Внутричерепные кровоизлияния, хотя и редкие (1,2%), являются причиной смерти у 30% исследованных больных в период пурпуры.
Спленомегалии и иногда умеренные гепатомегалии появляются в 10% случаев и детерминированы скорее вирусной инфекцией, чем тромбоцитопеническим заболеванием.
С точки зрения эволюции, 50% случаев излечиваются после острого приступа за 1—2 и реже 3 месяца. В пропорции 10—20% случаев, тромбоцитопения с вариабильными значениями, с явлениями легкой или акцентуированной пурпуры персистирует от одного до нескольких лет.
У 8—10% случаев, после периода излечения, пурпура рецидивирует или принимает стойкий хронический характер, с акцентуированными приступами, детерминированными вероятно реинфекциями, которые усугубляют процесс самопродолжения путем генерирования новых иммунных комплексов или даже путем появления автоиммунного механизма после разрыва толерантности.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Коронавирусная болезнь 2019 (COVID-19) - это инфекционное заболевание, вызванное тяжелым острым респираторным синдромом (SARS), связанным с коронавирусом 2 (SARS-CoV-2). SARS-CoV-2 принадлежит к семейству коронавирусов, которые представляют собой оболочечные вирусы со сферической морфологией и геномом одноцепочечной РНК (оцРНК). Шипованные гликопротеины (S-белок) проходят через пеплос вируса и образуют короноподобную поверхность. Через домен связывания рецептора (RBD) , расположенный в S1 - субъединицу белка S, вирус может лигировать к рецепторной клетки - хозяина ангиотензин-превращающего фермента (2) ACE2 и вторгнуться в клетку.
Клиническая картины ковида
Во многих случаях у людей, инфицированных SARS-CoV-2, наблюдаются симптомы гриппа, такие как лихорадка, усталость и сухой кашель. Головная боль, миалгия, боль в горле, тошнота и диарея также наблюдаются у пациентов с COVID-19. В тяжелых случаях возникают одышка и гипоксемия. В критических случаях заболевание быстро прогрессирует, и у пациентов может развиться септический шок и полиорганная дисфункция. Таким образом, COVID-19 может быть системным заболеванием, поражающим несколько систем органов, включая кожу, почки, дыхательную систему, сердечно-сосудистую систему, пищеварительную систему, нервную систему и гематологическую систему. Нарушение регуляции иммунного ответа и повышение провоспалительных цитокинов, вызванных SARS-CoV-2, способствуют патогенезу заболевания и повреждению органов, что привлекло внимание к иммунорегулирующей терапии при лечении COVID-19.
Сходство ковида с аутоиммунными заболеваниями
COVID-19 имеет сходство с аутоиммунными заболеваниями по клиническим проявлениям, иммунным ответам и патогенетическим механизмам. Аутоантитела как признак аутоиммунных заболеваний также могут быть обнаружены у пациентов с COVID-19. Сообщалось, что у некоторых пациентов после заражения COVID-19 развились аутоиммунные заболевания, такие как синдром Гийена-Барре или системная красная волчанка. Предполагается, что SARS-CoV-2 может нарушать самотолерантность и вызывать аутоиммунные реакции за счет перекрестной реактивности с клетками-хозяевами.
Иммунный ответ - это палка о двух концах при COVID-19, на результаты которого влияет степень цитокинового дисбаланса и активация иммунных клеток. Избыточное производство и высвобождение провоспалительных цитокинов и хемокинов может вызвать серьезное повреждение органов в критических случаях, что также наблюдается при аутоиммунных заболеваниях. У пациентов с COVID-19 повышались провоспалительные цитокины и хемокины, включая интерлейкин (IL) -1, IL-2, IL-6, IL-8, IL-10, IL-17, IL-18, CXCL10 и CCL2. значительно и уровни экспрессии некоторых из этих цитокинов, таких как IL-1, IL-6, IL-10 и IL-18, были связаны с тяжестью заболевания. Подобно аутоиммунным заболеваниям, молекулярные паттерны, связанные с повреждениями (DAMP), также участвуют в патогенезе COVID-19 и связаны с исходом заболевания. Уровни S100A8 / A9 и HMGB1 в сыворотке крови значительно повысились у пациентов с тяжелой формой COVID-19 и значительное повышение двух DAMPs было связано с более высокой смертностью.
Активация и инфильтрация иммунных клеток участвуют в патогенезе повреждения органов у пациентов с COVID-19. Синдром активации макрофагов (MAS) может быть континуумом синдрома цитокинового шторма, приводящего к опасным для жизни осложнениям при COVID-19. В этом состоянии активированные макрофаги будут производить чрезмерное количество провоспалительных цитокинов, поляризоваться в воспалительный фенотип M1 и проявлять цитотоксическую дисфункцию. Тучные клетки, активированные SARS-CoV-2, могут выделять гистамин, повышая уровень IL-1, чтобы инициировать цитокиновый шторм и уcилить повреждение легких. Исследователи обнаружили экстрафолликулярную активацию В-клеток у пациентов с COVID-19 в критическом состоянии, аналогично тому, что наблюдалось при аутоиммунных заболеваниях. Кроме того, активация экстрафолликулярных В-клеток сильно коррелировала с производством высоких концентраций нейтрализующих антител, специфичных для SARS-CoV-2, и плохим исходом заболевания. Субпопуляции В-клеток периферической крови изменяются во время COVID-19. У пациентов с COVID-19 атипичные B-клетки памяти (CD21 lo / CD27 - / CD10 - ) значительно увеличились, в то время как классические B-клетки памяти (CD21 + / CD27 + / CD10 - ) были значительно уменьшены. Анализ иммунных профилей пациентов с тяжелой формой COVID-19 выявил повышенную долю зрелых естественных киллеров (NK) и снижение доли Т-клеток.
Подобно некоторым аутоиммунным и иммуноопосредованным тромбовоспалительным заболеваниям, включая волчанку, антифосфолипидный синдром и ANCA-ассоциированный васкулит, активация нейтрофилов и образование внеклеточной ловушки нейтрофилов (НЕТоз), по-видимому, играют патогенную роль при COVID-19.
Риск заражения ковидом пациентов с аутоиммунными заболеваниями
Было описано, что ген лейкоцитарного антигена человека (HLA) и его полиморфизм связаны с развитием различных аутоиммунных заболеваний / нарушений . В последнее время исследователи пытаются понять, как генетика человека может повлиять на распространение и заражение нынешнего вируса SARS-Cov-2. Что касается упомянутых выше доказательств связи между вирусом SARS-Cov-2 и аутоиммунитетом, неудивительно, что ученые выявили сильную связь между генетическим полиморфизмом covid-19 и HLA.
Результаты поперечного исследования, проведенного на северо-востоке Италии, показали, что пациенты с аутоиммунными заболеваниями имели схожую частоту инфицирования SARS-CoV-2 по сравнению с населением в целом. Другое итальянское исследование, проведенное в Милане, также подтвердило, что аутоиммунное заболевание не является фактором риска заражения COVID-19. Интересно, что исследование из Милана показало, что пациенты с аутоиммунными заболеваниями не имеют худшего прогноза по сравнению с людьми, не страдающими аутоиммунными заболеваниями. Однако испанское исследование показало, что госпитализированные пациенты с аутоиммунными заболеваниями имеют более тяжелое течение COVID-19.
Напротив, результаты многоцентрового ретроспективного исследования, проведенного в провинции Хубэй, Китай, показали, что пациенты с аутоиммунными заболеваниями могут быть более восприимчивыми к инфекции SARS-CoV-2 по сравнению с контрольной группой. Кроме того, в этом исследовании были изучены члены семей пациентов, которые проживали в той же среде во время вспышки, что и контрольная группа.
В настоящее время, пока не появится больше данных, крайне важно подчеркнуть важность физического дистанцирования, ношения масок и частого мытья рук для всех, особенно для наших пациентов с аутоиммунными заболеваниями. Приверженность к лекарствам также очень важна для предотвращения вспышек аутоиммунных заболеваний, которые могут привести к повреждению органов.
Аутоантитела при ковиде
Аутоантитела, встречающиеся при ряде аутоиммунных заболеваний, были обнаружены у пациентов с COVID-19. Исследователи выявили наличие антинуклеарных антител (ANA), антицитоплазматических нейтрофильных антител (ANCA) и антиантифосфолипидных (APL) антител у пациентов с COVID-19. Результаты показали, что 45% пациентов были положительными по крайней мере на одно аутоантитело, а пациенты с положительными аутоантителами имели тенденцию иметь худший прогноз и значительно более высокую частоту дыхания при поступлении. Положительный показатель для ANA составил 33%, положительный показатель для антикардиолипиновых антител (IgG и / или IgM) составил 24%, а у трех пациентов были получены положительные результаты на антитела против β2-гликопротеина-I (IgG и / или IgM) (9%). Однако ANCA был отрицательным у всех пациентов.
Коагулопатия - опасное осложнение инфекции SARS-CoV-2. Недавно в Медицинском центре Монтефиоре было проведено когортное исследование для оценки положительности антикоагулянтов при волчанке у пациентов с COVID-19. Исследователи обнаружили, что пациенты с COVID-19 имели повышенную частоту положительных результатов на антикоагулянтную волчанку по сравнению с контрольной группой, у которых был отрицательный результат с помощью ПЦР с обратной транскриптазой COVID-19. Кроме того, у пациентов с COVID-19 с положительным результатом антикоагулянта против волчанки наблюдалась повышенная частота тромбозов. Некоторые авторы также продемонстрировали более высокую частоту антител APL у пациентов с тяжелым и критическим COVID-19, и что присутствие антител APL, по-видимому, связано с гипервоспалительным состоянием с чрезвычайно высокими уровнями ферритина, С-реактивного белка и IL-6, а также при тромбоэмболии легочной артерии. Обсужденные выше данные дают возможное объяснение состояния гиперкоагуляции в тяжелых и критических случаях COVID-19 и указывают на то, что SARS-CoV-2 может вызывать аутоиммунные реакции.
Клинический аутоиммунитет после ковида
Аутоиммунные заболевания, такие как: синдром Гийена-Барре , синдром Миллера-Фишера (MFS) , антифосфолипидный синдром , иммунная тромбоцитопеническая пурпура , системная красная волчанка (SLE) и Болезнь Кавасаки - выявлялись у пациентов с инфекцией COVID-19. Кроме того, обонятельную дисфункцию можно наблюдать при ряде аутоиммунных заболеваний, таких как: SLE, рассеянный склероз и миастения (MG).
Молекулярная мимикрия инфекционных патогенов
Возможно, одним из наиболее известных примеров молекулярной мимикрии аутоиммунитета является иммунный ответ на вирус Эпштейна-Барра (EBV) у пациентов с волчанкой. Аномальный иммунный ответ на ядерный антиген-1 вируса Эпштейна-Барра (EBNA-1) может вызвать аутоиммунный ответ, нацеленный на системы аутоантигенов Sm и Ro. Также была продемонстрирована перекрестная реактивность между антителами против EBNA-1 и основным белком миелина у пациентов с рассеянным склерозом. Более того, EBNA-1 обнаружил структурное сходство с β-синуклеином, белком мозга, участвующим в рассеянном склерозе, и предположительно связывает HLA класса II DR2b (HLA-DRB1 * 15: 01). Анализ in-silico показал, что белок оболочки эндогенных ретровирусов человека (HERV) имеет сходную последовательность с тремя белками миелина, которые вызывают аутоиммунный ответ при рассеянном склерозе и, как было предсказано, связываются с HLA-DRB1 * 15: 01. Инфекция, вызванная вирусом Коксаки B3 (CVB3), может индуцировать образование аутореактивных Т-клеток в отношении множества антигенов.
Лимфоциты при ковиде
Лечение ковида препаратами для терапии аутоиммунных заболеваний
Аутоиммунные заболевания неоднородны и связаны с нарушением регуляции иммунной системы. Большинство пациентов с аутоиммунными заболеваниями получали или получают иммуномодулирующие препараты или биологические агенты. Во время пандемии COVID-19 часть пациентов с аутоиммунным заболеванием прекратила прием лекарств из-за опасений иммуносупрессивного эффекта лекарств или их отсутствия и сократила количество посещений врача из-за опасений заразной природы SARS-CoV. -2. Однако нарушение непрерывности оказания медицинской помощи и несоблюдение режима приема лекарств связаны с обострениями ревматологических заболеваний и ухудшением активности заболевания.
Некоторые лекарства, используемые для лечения аутоиммунных ревматологических заболеваний, могут оказывать терапевтический эффект у пациентов с тяжелыми вариатами инфекции COVID-19, что обращает внимание на взаимосвязь между COVID-19 и аутоиммунными заболеваниями. Риск заражения и прогноз COVID-19 у пациентов с аутоиммунными заболеваниями остаются спорными, но строго рекомендуется соблюдение пациентом режима приема лекарств для предотвращения обострений аутоиммунных заболеваний.
В тяжелых и критических случаях применялись иммуномодулирующие препараты и биологические агенты, нацеленные на провоспалительные цитокины, для сдерживания устойчивого иммунного ответа при COVID-19. Кортикостероиды, ингибиторы JAK, блокаторы IL-1 и антагонисты рецепторов IL-6, которые знакомы ревматологам, используются для лечения пациентов с COVID-19.
Вакцинация против ковида и аутоиммунные заболевания

Гематологические осложнения часто наблюдаются при системной красной волчанке (СКВ). Сюда входят гемолитическая анемия с ретикулоцитозом, лейкопения (
Анемия, лейкопения и тромбоцитопения могут возникать в результате недостаточности костного мозга или чрезмерного разрушения периферических клеток, оба из которых могут быть иммуноопосредованными. Другие частые причины - наркотики , включая психотропные препараты, и инфекция. Несмотря на то, что многим пациентам не требуется специфического лечения цитопении при системной красной волчанке , CS остаются основой лечения. Другие традиционные методы лечения включают AZA, CYC и нормальный иммуноглобулин человека. Совсем недавно MMF стал играть роль агента, сохраняющего CS и CYC.
Лейкопения
Нейтропения
Нейтропения также является частым признаком СКВ с распространенностью порядка 47%, и это может быть опосредовано антинейтрофильными антителами. Нарушение функции мононуклеарной фагоцитарной системы, позволяющей сенсибилизированным клеткам оставаться в кровотоке, может частично компенсировать это. Уровни G-CSF обычно повышены у пациентов с СКВ с нейтропенией. Это может отражать сниженную чувствительность миелоидных клеток к G-CSF или присутствие антител против G-CSF иммуноглобулина G (IgG) и иммуноглобулина M (IgM). Увеличение сывороточного TNF-связанного лиганда, индуцирующего апоптоз при СКВ, также может способствовать нейтропении из-за чрезмерного апоптоза нейтрофилов.
Хотя аутоиммунитет является наиболее вероятным объяснением нейтропении при СКВ, другие патологии, такие как миелофиброз, также могут иногда иметь значение. Как и лимфопения, нейтропения в легкой форме часто не имеет клинических последствий, но иногда может быть связана с опасным для жизни сепсисом . Нейтропения при СКВ также часто связана с приемом лекарств и, в отличие от тромбоцитопении, не связана с повышенной смертностью.
Тромбоцитопения
Сообщается, что тромбоцитопения имеет распространенность от 7 до 30% в большой группе пациентов с СКВ. Повышенная периферическая деструкция тромбоцитов, связанная с наличием антитромбоцитарных антител, является наиболее вероятным патогенетическим механизмом. Также могут быть задействованы aPL, наряду с антителами против тромбопоэтина (TPO) , рецептора TPO c-Mpl и CD40L. Также сообщалось о повышенных уровнях TPO. Тромбоцитопения при СКВ может быть острой в начале и чрезвычайно тяжелой. Это проявление обычно связано с активным заболеванием в других системах органов и, как правило, реагирует на CS. Также распространена более хроническая форма, менее связанная с активностью заболевания, и обычно менее поддается лечению CS. Иммунная тромбоцитопения может предшествовать СКВ у 16% пациентов, появляясь за 10 лет до того, как СКВ становится клинически очевидной.
В дополнение к терапии высокими дозами кортикостероидов (CS), тромбоцитопения является независимым фактором риска повышенной смертности при СКВ. ретроспективном исследовании 126 пациентов с СКВ поздняя тромбоцитопения была связана с повышенной смертностью. Не было обнаружено связи с aPL, и увеличение смертности не было связано с тромбоэмболическими событиями. Более недавнее ретроспективное исследование 632 пациентов выявило особенно высокую распространенность тромбоцитопении, которая присутствовала у 58% на момент постановки диагноза [ 38 ]. Была очевидна связь с активностью заболевания, повышенной смертностью и гипокомплементемией.
Тромбоцитопения может также возникать в других контекстах при СКВ, например, как осложнение лекарственной терапии, например, иммунодепрессантами, такими как АЗА и редко HCQ. Тромботическая тромбоцитопеническая пурпура (ТТП) также хорошо известна, но, к счастью, встречается редко. Сообщается также о тромботической микроангиопатической гемолитической анемии в сочетании с СКВ [ 41 ], характеризующейся тромбоцитопенией, микроангиопатической гемолитической анемией, лихорадкой, неврологическими симптомами и поражением почек.
Тромбоцитопения и анемия
Тромбоцитопения при СКВ часто связана с гемолитической анемией, наличием других цитопений и aPLs. Хотя может наблюдаться связь между антителами к дцДНК и гемолитической анемией, эта связь не очевидна в случаях тромбоцитопении.
Оценка причин цитопении при системной красной волчанке
Подробная история приема лекарств при лечении системной красной волчанки очень важна. При этом следует учитывать как препараты, назначаемые непосредственно для лечения этого патологического состояния, так и препараты для лечения его осложнений, такие как статины, антибиотики и ингибиторы АПФ. Лейкопения и тромбоцитопения могут осложнять лечение СКВ с помощью AZA, MTX и, реже, CSA, MMF или HCQ. Нейтропения может следовать за импульсным CYC, с надиром, обычно возникающим на 10-й день после инфузии, что частично зависит от дозы.
Выявление морфологии лимфоцитов может быть диагностикой конкретных лимфопролиферативных заболеваний. Сопутствующая анемия требует анализа крови, количества ретикулоцитов и прямого теста Кумба. Другие соответствующие исследования включают лактатдегидрогеназу (ЛДГ) в сыворотке крови, функциональные тесты печени, иммуноглобулины и электрофорез белков сыворотки. Исследования перестройки гена периферической крови (гена тяжелой цепи иммуноглобулина или перестройки гена рецептора Т-клеток) следует рассматривать, если есть высокий индекс подозрения на лимфопролиферативное заболевание.
Измерение антитромбоцитов и других антител в рутинной клинической практике является более спорным. Доступен ряд анализов для измерения антител к тромбоцитам, в основном направленных против гликопротеинов IIb / IIIa и Ib / IX. Из-за их стоимости, ограниченной доступности и времени, необходимого для получения результата, измерение антител к тромбоцитам с использованием таких методов, вероятно, не является необходимым. Однако их использование следует рассматривать в случаях тяжелой тромбоцитопении, особенно если они не поддаются лечению. Есть некоторые свидетельства того, что их уровень может коррелировать с активностью заболевания. Когда уровень тромбоцитов нормализуется у пролеченных пациентов, антитела к тромбоцитам могут значительно снизиться или стать неопределяемыми . Однако отсутствие антитромбоцитарных антител не исключает аутоиммунную этиологию тромбоцитопении у отдельного пациента с СКВ.\
IgG и IgM антинейтрофильные и антилимфоцитарные антитела также могут быть измерены с помощью IIF с использованием проточной цитометрии. Это определит клеточную специфичность и класс иммуноглобулинов антитела. Специфичность антител против лимфоцитов может быть дополнительно исследована с помощью ELISA на антитела HLA класса I. Тест хемилюминесценции нейтрофилов также используется некоторыми лабораториями. Он измеряет ответ человеческих моноцитов на опсонизированные антителами нейтрофилы пациента, положительный результат подтверждает наличие антител, реагирующих с нейтрофилами. Ограничения анализов, используемых для измерения антинейтрофильных антител у пациентов с нейтропенией, недавно были пересмотрены. APL также могут быть связаны с тромбоцитопенией и гемолитической анемией и обычно измеряются в большинстве лабораторий. Другие антитела, которые могут иметь патогенетическое значение при цитопении, связанной с волчанкой, например, против G-CSF и рецептора TPO , обычно не измеряются.
Исследование костного мозга
Аспирацию костного мозга (КМ) и трепан следует рассматривать во всех случаях тяжелой или стойкой лейкопении или тромбоцитопении у пациентов с СКВ. Точно так же обследование костного мозга важно в случаях панцитопении, особенно если пациент получает миелотоксическую терапию, такую как AZA, MMF или CYC. В костном мозге могут присутствовать специфические признаки, указывающие на миелотоксичность, вызванную лекарственными средствами. Например, AZA может вызывать апластическую анемию, гипоплазию эритроидов и мегалобластные изменения. Исследование BM также может выявить злокачественные гематологические заболевания и гемофагоцитоз. Посев на BM показан при лихорадке неизвестного происхождения у пациентов с подавленным иммунитетом и СКВ. Общие аномалии костного мозга у пациентов с СКВ включают увеличение предшественников гемопоэза, что свидетельствует о периферической деструкции или, альтернативно, гипоцеллюлярности, вызванной СКВ. Некроз BM с изменениями стромы также является частым. У пациентов с тромбоцитопенией может наблюдаться ряд аномалий мегакариоцитов. Эти клетки могут быть сгруппированными, гиполобулированными и пикнотическими и могут иметь оголенную цитоплазму.. Это подтверждает гипотезу о том, что костный мозг может быть органом-мишенью при болезни и что нормальные механизмы клиренса дефектны и / или подавлены при СКВ
Лечение цитопении при системной красной волчанке
Лейкопения и тромбоцитопения при СКВ часто протекают в легкой форме и не требуют специальной лекарственной терапии.
Кортикостероиды
Азатиоприн и др.
АZA традиционно используется в качестве стероидсберегающего средства при лечении тромбоцитопении при СКВ. Однако рандомизированных контролируемых испытаний его использования в этом контексте не проводилось. CSA является альтернативным иммунодепрессивным препаратом при лечении цитопении, связанной с волчанкой. В открытом исследовании с участием 16 пациентов с СКВ уровни тромбоцитов и лейкоцитов вернулись к норме у пациентов с тромбоцитопенией или лейкопенией, получавших CSA 3-5 мг / кг / день в течение среднего периода лечения 30 месяцев. Однако не рекомендуют использовать эти дозы из-за риска нефротоксичности и предпочитаем дозы до 2,5 мг / кг / день с тщательным контролем функции почек и артериального давления. . Кроме того, другие рекомендовали использовать еще более низкие дозы. Недавно сообщалось о его успехе в качестве стероидсберегающего средства при тромбоцитопении, связанной с волчанкой, с минимальными побочными эффектами . Несмотря на это, ассоциация гипертонии и почечных осложнений с циклоспорином предполагает, что его следует использовать с осторожностью и тщательно наблюдать за пациентами. Комбинация преднизолона и HCQ может быть адекватной альтернативой для контроля тромбоцитопении у многих пациентов.
Спленэктомия
Если лечение тромбоцитопении преднизолоном или стероидсберегающими препаратами оказалось безуспешным, следует рассмотреть возможность спленэктомии. Ответ на спленэктомию при тромбоцитопении, связанной с волчанкой, обычно благоприятен. Учитывая важную роль селезенки в клиренсе иммунных комплексов, после спленэктомии при СКВ предполагался риск обострения активности заболевания, но на практике это обычно не подтверждается .Важность соответствующих профилактических мер против инфицирования после спленэктомии при СКВ невозможно переоценить. Это включает использование вакцин против пневмококка, гемофильного гриппа типа B, менингита C и гриппа, а также профилактических антибиотиков, таких как пенициллин V, особенно у пациентов с дополнительной хронической гипокомплементемией. Пневмококковая вакцинация может потребоваться повторить через 5 л
Иммуноглобулинемия G
IVIG может быть очень эффективным у некоторых пациентов с тромбоцитопенией, связанной с волчанкой. Кроме того, при иммунной тромбоцитопении , IVIG может как блокировать активирующие, так и повышать ингибирующие рецепторы Fcγ. Даназол - еще один вариант специфического лечения тромбоцитопении при СКВ. Как правило, это безопасно и хорошо переносится, и в этом контексте можно применять IVIG в отличие от даназола во время беременности. Терапевтическая доза IVIG при тяжелой тромбоцитопении, осложняющей СКВ, составляет 2 г / кг, обычно вводимая пятью последовательными ежедневными дозами по 400 мг / кг. Также сообщалось о поддержании ремиссии с помощью повторных доз IVIG при тяжелой тромбоцитопении, осложняющей СКВ.
Механизм действия IVIG при системной красной волчанке , вероятно. мультмодален и включает в себя: понижающую регуляцию продукции аутоантител нейтрализацию патогенных аутоантител, антиидиопатическими антителами , ингибирование комплемент - опосредованного повреждения модулояцию продукции цитокинов , индукцию апоптоза лимфоцитов и моноцитов , модуляцию функции В - и Т - лимфоцитов.
Рефрактерные цитопении
Лечение тяжелой цитопении и апластической анемии при СКВ может потребовать лечения более сильными цитотоксическими средствами, включая CYC. Терапия CYC (назначается из расчета 0,75–1,0 г / м 2 площади поверхности тела или 10–15 мг / кг), вводимая внутривенно каждый месяц в течение не менее 4 месяцев, оказывается полезной при лечении тяжелой тромбоцитопении, связанной с волчанкой, не поддающейся стандартным методам лечения . Более низкие дозы, применяемые чаще, например, каждые 2 недели, все чаще используются в некоторых учреждениях для улучшения переносимости без потери эффективности. Сбалансировать риски и преимущества такой терапии может быть сложно, особенно при наличии тяжелой нейтропении. Однако сообщалось об успешном использовании высоких доз CYC в / в при лечении апластической анемии, осложняющей СКВ. Анализ BM перед терапией особенно полезен в этой ситуации, поскольку повышенное количество предшественников эритроцитов или лейкоцитов в костном мозге предполагает, что ответ на терапию более вероятен. Кроме того, одновременное использование рекомбинантного человеческого G-CSF (rhG-CSF) и антибиотиков снижает риск этой формы подхода.
MMF
Иммуноаблативная доза CYC и трансплантация стволовых клеток
ечение тяжелых и особенно рефрактерных аутоиммунных заболеваний было несколько улучшено за счет введения интенсивной иммуноаблативной иммуносупрессии с использованием трех различных подходов. Это аллогенная трансплантация гемопоэтических стволовых клеток (HSCT), аутологичная HSCT (с использованием костного мозга или периферической крови) и иммуноаблативная иммуносупрессия высокими дозами без поддержки стволовых клеток. Испытания при СКВ, включая пациентов с тяжелыми гематологическими проявлениями, и при других аутоиммунных заболеваниях показывают, что иммуносупрессивная терапия высокими дозами с поддержкой аутологичных гематопоэтических стволовых клеток или без нее может вызвать ремиссию ранее резистентного заболевания
Таким образом, альтернативным подходом является использование высоких доз CYC без трансплантации стволовых клеток. Это успешно применялось при апластической анемии и других аутоиммунных заболеваниях, включая СКВ
Анти-В-клеточная терапия
Центральная роль В-клеток в патогенезе СКВ дает основание для использования моноклонального антитела против CD20 ритуксимаба в его лечении. CD20 экспрессируется на промежуточных стадиях развития В-клеток, но теряется на терминальных стадиях и отсутствует в плазматических клетках. Ритуксимаб представляет собой химерное моноклональное антитело против CD20 человека, которое быстро истощает CD20-положительные В-клетки периферической крови за счет опосредованной комплементом и антителозависимой клеточной цитотоксичности. Хотя изначально ритуксимаб использовался для лечения рецидивов В-клеточной фолликулярной неходжкинской лимфомы низкой степени злокачественности, впоследствии он успешно применялся при лечении хронической иммунной тромоцитопении. Было показано, что у пациентов с СКВ ритуксимаб истощает популяции аутореактивных В-клеток и снижает продукцию аутоантител плазматическими клетками. При введении с использованием протокола повышения дозы от разовой дозы 100 мг / м 2 до четырех еженедельных доз 375 мг / м 2ритуксимаб приводил к истощению В-клеток, что коррелировало со снижением проявлений заболевания. Ритуксимаб также успешно применялся при лечении аутоиммунной гемолитической анемии, осложняющей СКВ.
Альтернативный подход включает аутореактивный стимулятор B-лимфоцитов фактора выживания B-клеток (BLyS). BLys - цитокин, связанный с TNF, может быть нацелен несколькими способами, например, через рецепторы-ловушки и моноклональные антитела против BLyS. LymphoStat-B (белимумаб) - полностью человеческое моноклональное антитело, которое связывается с BLyS с высокой аффинностью и нейтрализует биоактивность BLyS человека in vitro и in vivo. У пациентов, получавших белимумаб, наблюдалось более длительное время до обострения болезни по сравнению с плацебо, и наблюдалось снижение титров анти-дцДНК. В анализе подгрупп пациенты с серологически активным заболеванием значительно лучше ответили на терапию белимумабом. Хотя его влияние на цитопении при СКВ еще не известно, оно может представлять собой дополнительный терапевтический подход к их лечению. Abetimus (LJP 394), который индуцирует толерантность В-клеток к антителам против дцДНК, до сих пор исследовался только для предотвращения почечных обострений при волчанке.
Даназол
Ингибитор продукции гонадотропных гормонов. Вызывает обратимое подавление продукции ЛГ и ФСГ гипофизом у мужчин и женщин. Не обладает эстрогенной и гестагенной активностью. Обладает слабой андрогенной активностью с сопутствующим анаболическим эффектом. Подавляет пролиферацию и вызывает атрофию нормальной и эктопической ткани эндометрия. Уменьшает потерю менструальной крови, механизм данного действия окончательно не установлен. Ингибирует овуляцию и уменьшает уровень 17β-эстрадиола в плазме крови. Остается неясным, является ли ингибирование пролиферации эндометрия следствием уменьшения уровня эстрадиола или прямого влияния даназола на эстрогеновые рецепторы эндометрия. После отмены даназола овуляция обычно возобновляется в течение 5 недель, что сопровождается характерным резким повышением ЛГ и небольшим повышением ФСГ. Стандартны показания к назначению даназола : эндометриоз с сопутствующим бесплодием, доброкачественные новообразования молочной железы (фиброзно-кистозная мастопатия), первичные меноррагии, предменструальный синдром, гинекомастия; наследственный ангионевротический отек. Противопоказания : тяжелые нарушения функции печени и/или почек, хроническая сердечная недостаточность, порфирия, тромбоэмболические нарушения (в т.ч. в анамнезе), андрогенозависимые опухоли, вагинальное кровотечение неясного генеза, рак молочной железы, карцинома, беременность, период лактации, повышенная чувствительность к даназолу. Не рекомендуется применять даназол у детей и у лиц с заболеванием почек.
Новаторские подходы
Элтромбопаг - это агонист рецепторов тромбопоэтина на поздних стадиях развития для лечения тромбоцитопении. Недавно были опубликованы испытания фазы II, изучающие его роль в иммунной тромбоцитопении и в тромбоцитопении, связанной с инфекцией гепатита С. В исследовании ITP элтромбопаг вводили перорально в дозе 30, 50 или 75 мг в день 118 пациентам с количеством тромбоцитов 50 × 10 9 / л на 43-й день. Это было достигнуто в 28, 70 и 81% в трех группах дозировки элтромбопага, соответственно, по сравнению с 11% в группе плацебо. Среднее количество тромбоцитов на 43-й день составляло 26 × 10 9 / л, 126 × 10 9./ л, 183 × 10 9 / л и 16 × 10 9 / л соответственно.
Ромиплостим (AMG 531) - еще один агонист рецепторов ТПО, который в настоящее время лицензирован для лечения хронической рефрактерной иммунной тромбоцитопении. Он состоит из компонента Fc IgG 1, связанного с пептидным доменом с четырьмя сайтами связывания для Mpl, рецептора ТРО. В отличие от рекомбинантного фактора роста и развития мегакариоцитов первого поколения, ромиплостин не имеет гомологии последовательности с ТПО, следовательно, существует меньший риск выработки антител против эндогенного ТПО. Он имеет высокое сродство к рецептору ТПО и увеличивает дифференцировку мегакариоцитов. Его вводят в виде еженедельных подкожных инъекций, и ответ зависит от дозы, достигая пика на 12-15 дни
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Тромбоцитопения: причины появления, при каких заболеваниях возникает, диагностика и способы лечения.
Определение
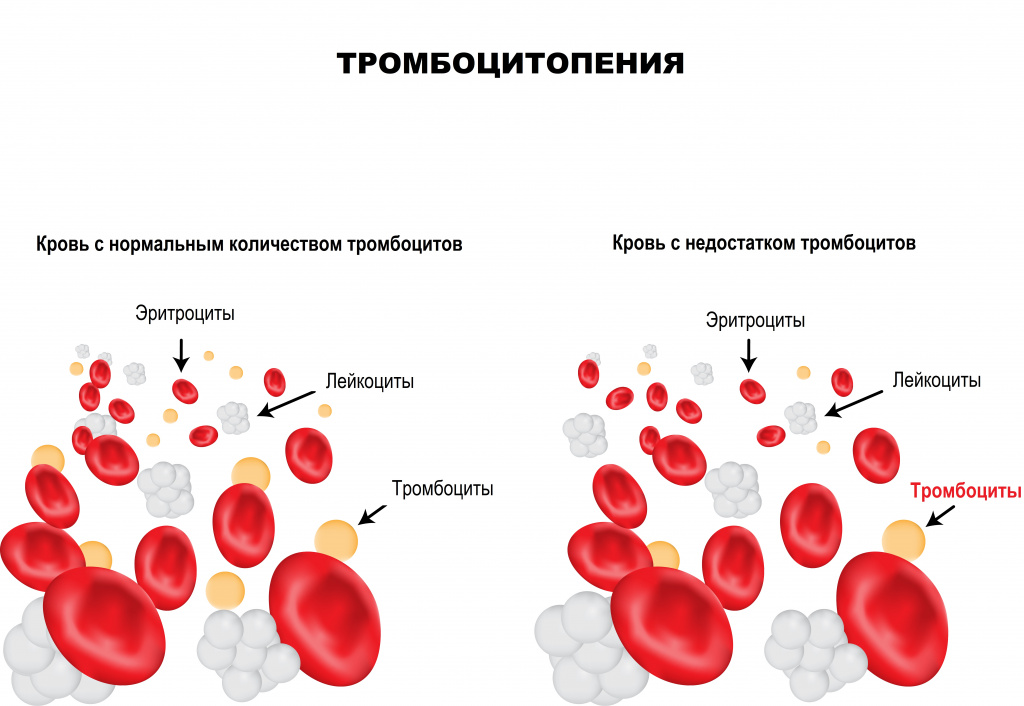
Тромбоциты – клетки крови, имеющие форму пластинки, которые участвуют в процессах свертывания крови. Их основная функция – закрытие раны при кровотечении путем образования тромба, или сгустка крови. Тромбообразование является естественным процессом защиты от массивной кровопотери при любых травмах. Дефицит тромбоцитов в крови называется тромбоцитопенией. Данное состояние достаточно часто протекает бессимптомно, однако может являться опасным для жизни при значительном уменьшении числа тромбоцитов крови.
Помимо остановки кровотечения (гемостаза), тромбоциты выполняют ряд важных функций в организме человека: выделение веществ, суживающих сосуды при кровотечении; стимуляция восстановления тканей при любой травме; регулирование процессов местного воспаления и иммунитета.
Эти функции активизируются при любом повреждении эндотелия (внутреннего слоя, покрывающего стенки сосудов). Недостаток тромбоцитов приводит к нарушению системы свертывания крови и, как результат, повышенной кровоточивости, гематомам (синякам) и темно-красной сыпи на коже и слизистых (при надавливании такая сыпь не исчезает).
Продолжительная кровоточивость десен, большой объем кровотечений из маленьких ран и при менструациях – тревожный сигнал, говорящий о возможной проблеме системы свертывания крови.
Разновидности тромбоцитопении
Под тромбоцитопенией понимают уменьшение количества тромбоцитов в периферической крови ниже 150 тыс./мкл. Среди всех тромбоцитопений выделяют следующие состояния:
- Тромбоцитопения разведения – возникает при массивных кровотечениях и восполнении объема циркулирующей крови растворами.
- Тромбоцитопения распределения – часто возникает при избыточной патологической утилизации тромбоцитов в увеличенной селезенке.
- Продуктивная тромбоцитопения – возникает при нарушении функции костного мозга в результате различных заболеваниях или лучевой терапии.
- Тромбоцитопения потребления – возникает при ДВС-синдроме (диссеминированном внутрисосудистом свертывании крови – патологическом состоянии, когда образуются тромбы в кровеносном русле многих органов) или при постоянном аутоиммунном повреждении эндотелия сосудов. Происходит патологическая активация тромбоцитов и их быстрое расходование (потребление) организмом.
- Псевдотромбоцитопения – возникает при нарушении техники проведения анализа с развитием агрегации тромбоцитов.
Одной из частых причин тромбоцитопении является избыточное потребление тромбоцитов в организме, например, при ДВС-синдроме.
Иммунная форма тромбоцитопении считается самой частой иммунной патологией крови. Развивается быстро, с подъемом температуры тела и появлением обильной сыпи на коже нижних конечностей, ягодиц, вокруг крупных суставов, иногда достигая лица. Сыпь представляет собой мелкие кровоизлияния в кожу, часто сопровождается болью в суставах, отеками и нарушением движения в пораженных суставах. Иногда проявляется схваткообразной болью в животе, тошнотой, рвотой и жидким стулом. Описаны случаи появления крови в моче.
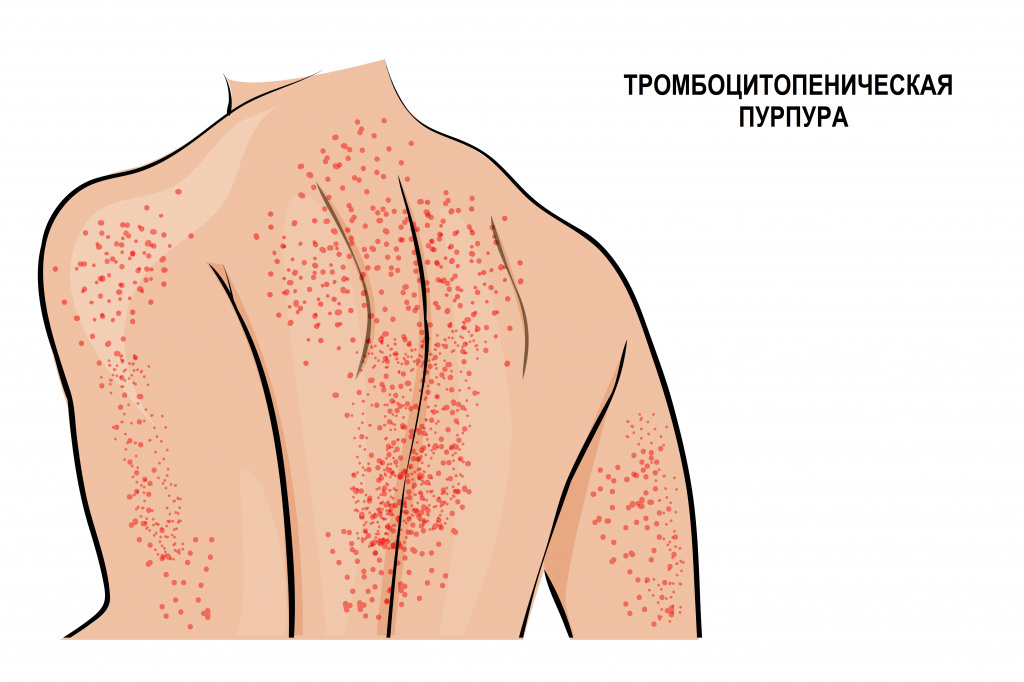
Аутоиммунная тромбоцитопения (идиопатическая тромбоцитопеническая пурпура, болезнь Верльгофа) вызвана уменьшением продолжительности жизни тромбоцитов из-за воздействия антитромбоцитарных аутоантител. Такая тромбоцитопения может протекать волнообразно – с чередованием периодов обострения и ремиссии. Нередко заболевание дает о себе знать на фоне инфекционных заболеваний: гриппа, вируса иммунодефицита человека (ВИЧ), вируса Эпштейна–Барр (ВЭБ), парвовируса В19, цитомегаловирусной инфекции (ЦМВ), вирусных гепатитов В и С.
Среди продуктивных тромбоцитопений особое место занимают апластические анемии, опухолевые процессы в костном мозге, лучевые поражения.
Для всех перечисленных состояний характерно резкое снижение гемопоэтической (кроветворной) функции костного мозга за счет тех или иных структурных изменений.
Апластическая анемия характеризуется уменьшением продукции всех трех ростков кроветворения: эритроцитов, лейкоцитов и тромбоцитов. Каждый росток отвечает за определенные функции в организме, и уменьшение производимых клеток приводит к появлению соответствующих симптомов. Уменьшение тромбоцитов ведет к повышенной кровоточивости, снижение количества эритроцитов говорит о признаках анемии (бледность, утомляемость, ломкость волос, боль за грудиной), а уменьшение лейкоцитов ведет к инфекционным осложнениям в виде рецидивирующих ангин, пневмоний и др. В некоторых случаях костный мозг замещается жировой тканью, что также нарушает образование клеток крови.
При В12- и фолиеводефицитной анемиях происходит нарушение созревания будущих тромбоцитов, они погибают еще до стадии созревания. Заболевание проявляется бледностью кожи, учащенным сердцебиением, одышкой. При выраженном дефиците витамина В12 возможны нарушение чувствительности, парезы и параличи.
Различные виды лейкозов приводят к появлению опухолевых клеток, которые делятся с огромной скоростью и вскоре замещают собой костный мозг. При этом нарушается функция всех трех ростков кроветворения. В костном мозге и крови появляются незрелые клетки, неспособные выполнять свою функцию.
Медикаментозная тромбоцитопения может развиться в результате приема некоторых лекарственных препаратов, например, цитостатиков, которые угнетают образование тромбоцитов в костном мозге.
Заболевания, сопровождающиеся увеличением размера селезенки (спленомегалией), способны привести к повышенному разрушению тромбоцитов, или гиперспленизму (увеличению утилизации тромбоцитов селезенкой). Помимо тромбоцитов также разрушаются эритроциты, что ведет к развитию не только тромбоцитопенического состояния, но и к гемолитической анемии.
К таким заболеваниям относят цирроз печени, в том числе алкогольной этиологии, хроническую сердечную недостаточность, лимфопролиферативные заболевания.
Диагностика и обследования при тромбоцитопении
При выявлении признаков тромбоцитопении врач назначит комплекс лабораторно-инструментальных методов исследования:
-
клинический анализ крови: общий анализ с подсчетом тромбоцитов, лейкоформула, СОЭ (с микроскопией мазка крови при наличии патологических сдвигов);
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Читайте также:

