Убитые вакцины для профилактики вирусных инфекций
Обновлено: 23.04.2024
Классификация вирусных вакцин. Типы вирусных вакцин.
Современной науке известны сотни видов патогенных вирусов, относящихся к 26 семействам, избирательно поражающим различные системы организма человека и животных. Природное многообразие вирусных болезней вызывало необходимость наряду с санитарно-гигиеническими мерами прибегнуть к специфической профилактике с использованием широкого круга вакцинных препаратов.
Вакцинопрофилактика занимает ведущее место в борьбе со многими вирусными заболеваниями человека и животных. Несмотря на большое разнообразие вирусов и вызываемых ими заболеваний, имеются общие принципы приготовления и применения вирусных вакцин. Однако в настоящее время не все вирусные болезни в одинаковой степени удается контролировать с помощью вакцинации.
Вакцинация должна сопровождаться развитием иммунологической памяти. В идеале, это поддержание специфических антител в высокой концентрации в сыворотке крови и на месте внедрения вируса. В тоже время Т-клетки, ответственные за специфический клеточный иммунитет, должны находиться в состоянии готовности быстро синтезировать свои летальные продукты (т.е. гранзимы и перфорины), когда происходит инфицирование. Все существующие на сегодня вакцины можно разделить на три общие группы: инактивированные (убитые), живые (аттенуированные) и компонентные (субъединичные) вакцины. Каждая из этих категорий вакцин имеет свои преимущества и недостатки.
В зависимости от технологии изготовления различают несколько типов вирусных вакцин:
1. Живые реплицирующиеся вакцины:
— вакцины из природно ослабленных или гетерологичных вирусов;
— вакцины из вирусов, аттенуированных пассажами в гетерологичных организмах или в культурах клеток при обычной или пониженной температуре, или реассортацией вирусных генов.

2. Нереплицирующиеся вакцины, содержащие природные вирусные антигены:
- вакцины из инактивированных целых вирионов и неструктурных вирусных белков;
- вакцины из нативных вирусных субъединиц.
3. Вакцины, полученные с помощью рекомбинантной ДНК или других новых технологий:
- вакцины, полученные путем делеции гена (генов) или точечного мутагенеза;
- вакцины на основе вирусных белков, экспрессированных in vitro в клетках эукариотов или прокатиотов;
- вакцины из вирусных белков, собранных в вирусоподобные частицы;
- вакцины, экспрессирующие вирусные антигены с помощью вирусных векторов;
- вакцины на основе вирусных химер;
- ДНК-вакцины.
4. Синтетические полипептидные вакцины.
Живые вакцины содержат авирулентные штаммы вирусов, аттенуированные разными способами, и отличаются способностью размножаться в привитом организме (реплицирующиеся антигены). Остальные типы вакцин готовят из инактивированных вирусов или их антигенных и иммуногенных компонентов (нереплицирующиеся антигены).
Используя другие принципы классификации, вакцинные препараты можно разделить на две большие группы: цельновирионные и компонентные (субъединичные). Причем к первой группе относятся как традиционные живые, так и инактивированные вакцины. Живые гомологичные вакцины, в свою очередь, могут различаться способом получения и быть представленными природно аттенуированными или искусственно ослабленными штаммами, включая рекомбинантные и реассортантные, а также штаммы, аттенуированные цельнонаправленными изменениями генома биотехнологическими методами.
К компонентным (субъединичным) вакцинам можно отнести все, которые не входят в рубрику цельновирионных вакцин. Прежде всего, сюда относятся вакцины, полученные из компонентов вирионов или вирус-инфицированных клеток после их разрушения. Кроме них к этой категории относятся субъединичные вакцины, приготовленные из вирусных белков, экспрессируемых клонированными вирусными генами в эукариотических или прокариотических системах. Сюда же можно отнести живые рекомбинантные вакцины, которые по своей сути являются реплицирующимися субъединичными вакцинами. Клонированные гены, реплицируясь в составе вирусного вектора, обеспечивают экспрессию белков, ответственных за индукцию специфического иммунитета.
Вакцины на основе вирусспецифических пептидов, получаемых синтетическим путем, в известном смысле, тоже можно отнести к разряду субъединичных (эпитопных) вакцин.
Анализ имеющихся данных свидетельствует о достаточно высокой эффективности многих вирусных вакцин, применяемых в медицинской и ветеринарной практике. Это, прежде всего, относится к живым вакцинам, применяемым для контроля таких массовых и опасных заболеваний человека, как полиомиелит, желтая лихорадка, корь, эпидемический паротит, краснуха и др. Аналогичным примером из практики ветеринарной медицины могут служить живые вакцины против чумы свиней, крупного рогатого скота и плотоядных, против ньюкаслской болезни и другие. Примером инактивированных вакцин могут служить вакцины против полиомиелита, гриппа, ящура и многих других болезней.
Некоторые из живых вакцин (оспа человека, полиомиелит, желтая лихорадка, корь, чума крупного рогатого скота, классическая чума свиней и др.) отвечают требованиям безопасности (генетическая стабильность, отсутствие реверсии, слабая реактогенность), обеспечивают длительный напряженный иммунитет и могут служить образцом для вновь создаваемых вакцинных препаратов.
Возбудители многих вирусных заболеваний (полиомиелит, грипп, ящур, катаральная лихорадка овец, чума лошадей и др.) существуют в виде нескольких антигенных типов. Поскольку иммунизация против одного из этих типов не защищает от заражения другими, эффективная профилактика возможна только при вакцинации поливалентной вакциной, содержащей антигены нескольких антигенных типов данного вируса. Вакцины, содержащие антигены более чем одного вида возбудителя, называют комбинированными (ассоциированными).
Большинство применяемых в настоящее время вакцин содержит антигены, идентичные или подобные антигенам вирулентного вируса, против которого предполагается создать иммунитет. Такие вакцины называют гомологичными. В некоторых случаях для приготовления вакцин используют гетерологичные вирусы, содержащие перекрестно-реагирующие антигены и создающие достаточный иммунитет. Такие вакцины называются гетерологичными.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Вирусные вакцины.Вакцинация имеет большое значение в профилактике вирусных инфекций. В результате вакцинации в организме вырабатывается иммунитет, обусловленный гуморальными и клеточными факторами, и организм становится невосприимчивым к инфекции. Эффективные вакцины созданы против многих вирусных инфекций. В результате вакцинации во всем мире ликвидирована оспа, побежден полиомиелит, ведется успешное наступление на корь, желтую лихорадку и другие инфекции.
В настоящее время известны следующие виды вирусных вакцин:
1. Вакцины из живых аттенуированных вирусов.
2. Корпускулярные (вирионные) убитые вакцины.
3. Субъединичные вакцины.
4. Генноинженерные вакцины.
5. Синтетические вакцины.
Последние два типа вакцин находятся в стадии разработки и применяются при определенных случаях.
Прививки против оспы, полиомиелита и кори являются обязательными. В связи с ликвидацией оспы во всем мире вакцинация против оспы в ряде стран отменена и проводится лишь ограниченная вакцинация особо угрожаемым контингентам населения. Вакцинация против желтой лихорадки, бешенства, клещевого и японского энцефалитов проводится лицам с риском заражения.
Живые вакцины готовятся из аттенуированных вирусов, полученных разными приемами — отбором мелких колоний, ts-мутантов, адаптированных в холоду мутантов и т. п. Вакцинные штаммы должны быть генетически стабильными и не давать реверсий к дикому типу.
Живые вакцины отличаются от убитых тем, что они имитируют образование естественного иммунитета, так как при введении в организм вакцинальные штаммы размножаются, вызывая развитие вакцинальной реакции, сходной с естественным процессом, но отличающейся отсутствием или слабой выраженностью патологических явлений. Поэтому живые вакцины вызывают развитие совершенного иммунитета, сопровождающегося выработкой как гуморальных (IgG), так и секреторных (IgA) антител и появлением стимулированных Т-эффекторов и клеток памяти. Однако живые вакцины имеют ряд недостатков.
Естественной живой вакциной был вирус коровьей оспы, который Э.Дженнер в 1796 г. привил ребенку. От англ. vacca — корова — получили свое название вакцины. Примером эффективности вакцинопрофилактики является выдающийся успех в борьбе с оспой, завершившейся ее ликвидацией во всем мире. Большие успехи достигнуты в борьбе с полиомиелитом. В нашей стране была получена живая полиомиелитная вакцина из штаммов А. Сейбина, установлена ее безопасность и высокая эффективность, после чего началось ее массовое применение в нашей стране, а затем и в большинстве стран мира. В результате плановой массовой вакцинации ликвидированы эпидемии полиомиелита и имеют место лишь спорадические случаи заболеваний.
Имеются успехи в борьбе с корью. В нашей стране разработана живая коревая вакцина и организована массовая вакцинация против кори. В результате в 8—10 раз снижена заболеваемость ею. При правильной организации прививок можно ожидать полную ликвидацию кори. Получена живая вакцина против паротита, которая применяется в ассоциации с коревой вакциной. Разработано несколько вариантов живой гриппозной вакцины. На очереди разработка живых вакцин против гепатита А и краснухи.
Корпускулярные убитые вакцины готовят из очищенного концентрированного вируса, инактивированного формальдегидом, аминометилольными соединениями (соединения формальдегида с аминокислотами) или ультрафиолетовым облучением (последний метод не всегда бывает надежным). Достоинством этих вакцин является точная дозировка антигена и, следовательно, более или менее стандартный иммунный ответ. Недостатком убитых вакцин является необходимость многократного введения и инъекционный путь введения, в результате чего не происходит образования секреторных иммуноглобулинов класса А.
В нашей стране разработаны и применяются ряд инактивированных вакцин, например вакцина против гриппа и полиомиелита. Получена убитая вакцина против герпеса, которая применяется при рецидивирующих формах кожных, глазных, стоматологических вирусных заболеваний и при половом герпесе.
Первая вакцина против клещевого энцефалита была разработана советскими учеными в 1939 г. В последующие годы препарат совершенствовали в целях снижения его реактогенности и повышения эффективности. В настоящее время получены ареактогенные культуральные вакцины. Применяются вакцины против бешенства, полученные из мозга лабораторных животных и в культуре клеток. Получены вакцины против лошадиных западного и восточного энцефаломиелитов, японского энцефалита.

В стадии внедрения находится вакцина против гепатита В, полученная из HBs-антигела. Количество убитых вакцин в ближайшие годы будет значительно увеличено.
Поствакцинальные осложнения. Вирусные вакцины и другие профилактические вирусные препараты контролирует Государственный научно-исследовательский институт стандартизации и контроля медицинских биологических препаратов им. Л. А. Тарасевича МЗ РФ, где проверяют безвредность препаратов для человека, иммуногенность, стерильность и другие их свойства. Для каждого препарата составляется инструкция по его применению. Тем не менее, бывают случаи поствакцинальных осложнений, которые можно разделить на две группы. К первой группе относятся осложнения, связанные с нарушением технических правил вакцинации, введением вакцин аллергизированным или ослабленным лицам. Ко второй группе относятся осложнения, вызванные использованием несовершенных препаратов. Высокая реактогенность вакцин может быть обусловлена рядом причин, в том числе биологическими особенностями производственного штамма вируса, недостаточной инактивацией вируса, контаминацией живой вакцины диким штаммом и т. д. Например, тяжелые осложнения могут появиться при использовании вакцин против бешенства и клещевого энцефалита, полученных из мозга лабораторных животных. Поэтому эти вакцины теперь получают на культурах клеток, что значительно снижает их реактогенность.
Вакцины контролируют на стерильность, специфическую безвредность (убитые и субьединичные вакцины не должны содержать живой вирус), реактогенность и иммуногенность. Последняя изучается сначала на животных, а затем на волонтерах. При этом определяют сероконверсию — нарастание титра антител к данному вирусу после иммунизации, а если прививки многократные, то через две недели после каждой прививки. Окончательная оценка эпидемиологической эффективности проводится в шифрованных опытах, в которых равным количествам добровольцев вводят исследуемую вакцину и плацебо — индифферентная жидкость, имитирующая вакцину.
Субъединичные вакцины. В корпускулярных вакцинах, приготовляемых из сложно устроенных вирионов, лишь поверхностные протективные антигены, составляющие обычно около 10% вирусных белков, вызывают развитие вирусспецифического иммунитета. Остальные белки и липиды лишь усиливают реактогенность и вызывают развитие аллергических реакций. Поэтому акономерным является получение субъединичных вакцин, содержащих протективные антигены. Как промежуточный этап применяются расщепленные (сплит) вакцины, для приготовления которых вирус обрабатывают эфиром или другими жирорастворителями, удаляя липиды. Такие вакцины менее реактогенны, нежели корпускулярные, однако в них сохранены балластные вирусные белки, не играющие роли в создании протективного иммунитета.
Субъединичные вакцины лишены этих недостатков. Они готовятся следующим образом. Очищенные препараты вируса разрушают детергентами — химическими веществами, растворяющими липиды, затем отделяют поверхностные протективные антигены от нуклеокапсидов либо путем центрифугирования, либо путем хроматографии на колонках. Очищенные препараты стерилизуют и концентрируют, удаляя детергент с помощью диализа. Полученные таким путем субъединичные вакцины обладают минимальной реактогенностью, однако иммуногенные свойства их обычно слабее, чем у корпускулярных вакцин. Субъединичные вакцины приготовлены из вирионов гриппа, на очереди — субъединичные вакцины против вирусов герпеса, бешенства и других сложно устроенных вирусов.
Синтетические вакцины создают путем синтеза антигенных детерминант протективных вирусных бел ков. Однако чистый антиген, выделенный из состава вируса или искусственно созданный, не всегда обладает достаточной иммуногенностью, и иммунитет в ряде случаев не возникает. Антигены, вызывающие слабый иммунный ответ, должны быть конъюгированы с носителями и иммуностимуляторами, усиливающими иммунный ответ.
Вакцины будущего — синтетические вакцины — представляются в виде чистых протективных антигенов, полученных путем клонирования синтезированных участков генов в клетках высших эукариотов.
Генноинженерные вакцины. Экспрессия генов инсулина, соматотропного гормона (гормона роста), интерферона человека в прокариотических системах показала широкие возможности генетической инженерии и поставила на очередь задачу получения вакцин против инфекционных болезней и, в первую очередь, против вирусных инфекций.
Однако экспрессия многих вирусных генов в прокариотических системах отсутствует или незначительна в силу того, что указанные вирусы в ходе эволюции приспособились к паразитированию в организме человека и высших животных и используют для репродукции биосинтетические системы клетки хозяев, имеющие существенные отличия от биосинтетических систем прокариотов. Лишь в тех случаях, когда белки (антигены) относительно просты, возможно использование прокариотических систем. Наряду с прокариотическими системами целесообразно использование простых эукариотических систем, какими являются дрожжи. Однако и дрожжевые клетки не могут обеспечить синтез полноценных антигенов ряда вирусов человека и животных и для экспрессии их генов необходимы клетки высших эукариотов, что значительно усложнит и удорожит производство. Вакцины против полиомиелита и гриппа вряд ли будут широко производиться на перевиваемых клетках обезьян и человека методами генной инженерии, так как проще и дешевле производить эти вакцины, заражая клетки вирусом. Для вируса гепатита А этот путь наиболее перспективен в связи с трудностью накопления его в лабораторных условиях. Для вируса гепатита В генноинженерные вакцины также решают проблему контроля вакцины, требующего использования дорогостоящих пород обезьян. Получены рекомбинантные плазмиды, клонированные в кишечной палочке, однако стабильной экспрессии HBs-антигена в прокариотах получить не удалось. Она достигнута в клетках низших эукариотов — дрожжах. Достоинством дрожжевой вакцины является ее относительно высокая иммуногенность, полная безвредность, отсутствие необходимости контроля на обезьянах, дешевизна. Экспрессия HBs-антигена осуществлена в культуре клеток млекопитающих (грызуны), и такая вакцина может конкурировать с дрожжевой.
Перспективным является также использование в качестве вектора геномов крупных ДНК-содержащих вирусов и в первую очередь вируса осповакцины.
Антиидиотипические антитела — это антитела к антителам против вирусных антигенов, которые по своей структуре сходны с антигенами и способны индуцировать гуморальный и клеточный иммунный ответ. Предполагается в будущем использование их в качестве эффективных и безвредных вакцин.
Указанные новые направления особенно перспективны для осуществления специфической профилактики инфекций, вызываемых вирусами, которые не культивируются в лабораторных условиях, имеют много серотипов или антигенно нестабильны и вызывают лишь кратковременный иммунитет.
Проектное задание к модулю
В качестве проектного задания студентам предлагается написание рефератов по следующим темам:
1. Иммунологические методы диагностики вирусных инфекций
2. Природа и продуцирование интерферонов
3. Антивирусная активность интерферонов
4. Вирусная интерференция
4. Индукция специфического иммунного ответа на вирусы
5. Клеточные эффекторные механизмы
6. Гуморальные эффекторные механизмы
7. Семейство тогавирусов. Особенность репродукции и инфекционного процесса.
8. Вирус клещевого энцефалита.
9. Вирус бешенства
10. Вирусная персистенция
11. Вирусные гепатиты
12. Эпидемический паротит. Биология возбудителя. Особенности патогенеза.
13. Вирус кори. Биология возбудителя. Особенности патогенеза
14. Вирус натуральной оспы. Биология возбудителя. Особенности патогенеза
15. Что такое птичий грипп ? Мифы и реальность
16. Новые противовирусные химиотерапевтические препараты. Механизм их действия
17. Вирусные включения, их многообразие и роль в идентификации вирусов
18. Вирусы – возбудители лейкозов человека
19. Герпетические вирусные инфекции. Возбудители. Пути распространения. Клиника.
20. Вирусы, вызывающие подострые спонгиозные энцефалопатии.
21. Атипичная пневмония и возможность происхождения новых вирусов
22. Эпидемиология вирусных инфекций (возникновение и распространение)
23. Роль вирусов в возникновении злокачественных опухолей
24. Санитарно-вирусологические исследования объектов окружающей среды
Тест рубежного контроля
1. Атабеков И.Г. Практикум по общей вирусологии // М. МГУ, 2001. с.192
2. Букринская А.Г. Вирусология // М. 1986, с.336
3. Вирусология // Итоги науки и техники, Т.16, М. 1998.с.198
4. Власов Ю.И., Ларина Э.К.Сельскохозяйственная вирусология // М. 1982, с.240
5. Гиббс А., Харрисон Б. Основы вирусологии растений // Мир, М.,1987,429 с.
6. Доморадский И.В. Основы вирусологии для экологов // М. 2007, с.76
7. Ершов Е.М. Вирусные инфекции // Минск. 2007. с.184
8. Жданов В.М., Гайдамович С.Я. Общая вирусология, ч.1 // М. 1982, с.492
9. Журавлев Ю.Н. Фитовирусы в целом растении и в модельных системах//М. 1999.с.248
10. Мэтьюз Р. Вирусы растений//Мир,М., 1973, 600 с.
11. Смородинцев АА.,Лузянина Т.Я. Основы противовирусного иммунитета //Л.,1995, с.312
Прошло много лет с тех пор, как, пытаясь обезопасить себя от натуральной оспы, китайцы стали вкладывать в ноздри высушенные оспенные струпья, а индейцы — втирать их в надрезы кожи. Только Э.Дженнер (эмпирически) и Л.Пастер (научно) разработали основы создания и применения предохранительных прививок из живых микробов. Первыми в 1880–1885 гг. Л.Пастер получил вакцины против куриной холеры, сибирской язвы и бешенства. Вакцины — биопрепараты для создания у людей иммунитета к инфекционным заболеваниям. Корпускулярные вакцины содержат аттенуированные или убитые микробы (вирионы), некорпускулярные — продукты их химического расщепления (химические вакцины), обезвреженные экзотоксины бактерий или яды (анатоксины). Вакцины различаются по числу антигенов, входящих в их состав: моновакцины и поливакцины (ассоциированные). По видовому составу вакцины могут быть бактериальными, вирусными, риккетсиозными.
Убитые вакцины (моно- и поли-) используются для профилактики тифа, паратифов, коклюша, холеры, лептоспироза, дизентерии, гриппа, полиомиелита, клещевого энцефалита и др. Эти вакцины отличаются невысокой иммуногенностью, создают непродолжительный иммунитет (до 1 года), вероятно из-за технологической денатурации антигенов.
Полные антигены микробов, очищенные от примесей, представляют собой химические вакцины. Они характеризуются низкой реактогенностью, по эффективности превосходят убитые вакцины. Применяются для профилактики брюшного тифа, паратифов А и В (вакцина ТАВte со столбнячным анатоксином), коклюша, туберкулеза.
Анатоксины (столбнячный, дифтерийный, гангренозный, ботулинический, стафилококковый) — мало реактогенны, способны формировать напряженный иммунитет на 4–5 лет.
В настоящее время в распоряжении врача насчитывается около 30 вакцин. К антибактериальным относится 16 (дифтерийная, коклюшная, бруцеллезная, туляремийная, чумная, сибиреязвенная, туберкулезная и др.), к противовирусным — 8 (против натуральной оспы, бешенства, гриппа, полиомиелита, кори и др.). Кроме этого, успешно используются две риккетсиозные (сыпной тиф, Ку-лихорадка) и антилептоспирозная вакцины. Перспективным является создание синтетических, рекомбинантных и антиидиотипических вакцин.
Фаги представляют собой вирусы, способные проникать в бактериальную клетку, репродуцироваться и вызывать ее лизис. Бактериофаги применяются для фагопрофилактики и фаготерапии инфекционных заболеваний. Преимущество фаготерапии заключается в возможности избирательного лизирования определенных микробов и безвредности для пациента. Назначают бактериофаги при различных кишечных инфекциях, дисбактериозе, гнойных инфекциях и др. Возможно сочетание фаго- и химиотерапии.
Вакцинопрофилактика. Вирусные вакцины.
Вакцинопрофилактика по праву считается одним из крупнейших достижений биологии. Характерная черта развития биологии на современном этапе — стремительное преодоление расстояния, отделяющего фундаментальные открытия от их практического применения. Этот процесс наиболее отчетливо проявляется в области разработки средств специфической профилактики вирусных заболеваний. В настоящее время трудно назвать область биологической науки, где бы столь быстро и эффективно использовались новейшие достижения.
Благодаря этому в последние годы достигнуты большие успехи в области вакцинопрофилактики многих опасных вирусных заболеваний. С помощью глобальной вакцино профилактики во всем мире искоренена натуральная оспа человека (1979 г.) существует эффективный контроль ряда опасных вирусных заболеваний людей (полиомиелит, корь, грипп, бешенство, гепатиты и др.) и животных (ящур, чума свиней, чума жвачных и плотоядных, болезнь Марека, ньюкаслская болезнь и др.).
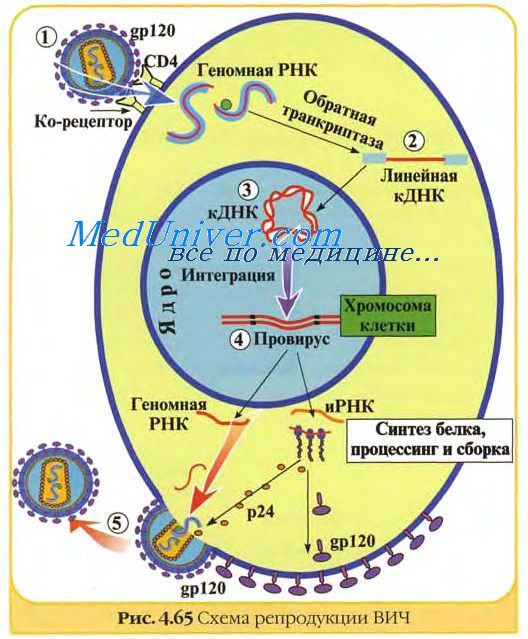
Достаточно сказать, что на сегодняшний день практически нет эпидемий и эпизоотии вирусной этиологии. Создание высокоэффективных вакцин и широкомасштабных методов их производства позволили разработать национальные и международные программы контроля и искоренения ряда вирусных заболеваний человека и животных.
Профилактика многих вирусных болезней животных достигла исключительно широких масштабов и стала неотъемлемой частью технологии ведения животноводства, особенно на индустриальной основе. Например, инактивированную вакцину против ящура и живую вакцину против ньюкаслской болезни изготовляют в количестве, исчисляемом многими миллиардами доз. Предотвращенный экономический ущерб, благодаря применению вакцин, достигает огромных размеров. Только отмена прививок против оспы людей в связи с ликвидацией болезни позволило сэкономить многие миллиарды долларов США.
В настоящее время в медицинской и ветеринарной практике широко применяют живые и инактивированные вакцины, производство которых основывается на современных достижениях биологической науки и технологических разработках. Производство и методы контроля таких препаратов стали достаточно сложными и трудоемкими, значительно возросло их качество и безопасность применения. У живых вакцин основные трудности связаны с получением стабильного иммуногенного вакцинного штамма вируса и разработкой методов его контроля. При изготовлении инактивированных вакцин основной проблемой является получение большого количества безопасного вирусного антигена, по возможности в неденатурированном и концентрированном виде. Существует большое разнообразие в способах изготовления живых и инактивированных вакцин. Важное значение придается стандартности вирусных вакцин, в связи с чем постоянно совершенствуются методы контроля и ужесточаются требования к готовому препарату. В живой вакцине вирус сохраняет потенциальную способность изменяться в сторону снижения антигенности или повышения реактогенности или даже вирулентности.
В культуре клеток и куринных эмбрионах, используемых в качестве субстратов для размножения вакцинных вирусных штаммов, могут присутствовать другие, трудно обнаруживаемые вирусы, загрязняющие вакцину. В инакти-вированной вакцине вирус может быть обезврежен не полностью, а ее производство таит в себе опасность попадания возбудителя во внешнюю среду. Кроме вирусных частиц и продуктов вирусспецифического синтеза с инактивированной вакциной в организм поступает масса иммунологически активных балластных клеточных белков и чужеродных нуклеиновых кислот, что крайне нежелательно.
Успехи в области изучения функциональной роли вирусных структур открывают принципиально новые возможности для создания и усовершенствования вакцин. Установлено, что иммунный ответ при вирусных инфекциях направлен не на вирус как таковой, и даже не на вирусный белок, а лишь на небольшое количество антигенных детерминант, представляющих не всю белковую молекулу, а только отдельные участки. С учетом этого разрабатываются вакцины из вирусных компонентов, получаемых путем расщепления вирусных частиц или выделением из инфицированных вирусом клеток, либо генно-инженерными методами.
Достигнутый уровень разработки эффективных препаратов не снимет проблемы их совершенствования и создания вирусных вакцин нового поколения на основе достижений биотехнологии.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Вакцины. Виды антигенов вакцин. Классификация вакцин. Виды вакцин. Живые вакцины. Ослабленные ( аттенуированные ) вакцины. Дивергентные вакцины.
Вакцины — иммунобиологические препараты, предназначенные для активной иммунопрофилактики, то есть для создания активной специфической невосприимчивости организма к конкретному возбудителю. Вакцинация признана ВОЗ идеальным методом профилактики инфекционных заболеваний человека. Высокая эффективность, простота, возможность широкого охвата вакцинируемых лиц с целью массового предупреждения заболевания вывели активную иммунопрофилактику в большинстве стран мира в разряд государственных приоритетов. Комплекс мероприятий по вакцинации включает отбор лиц, подлежащих вакцинации, выбор вакцинного препарата и определение схемы его использования, а также (при необходимости) контроль эффективности, купирование возможных патологических реакций и осложнений. В качестве Аг в вакцинных препаратах выступают:
• цельные микробные тела (живые или убитые);
• отдельные Аг микроорганизмов (наиболее часто протективные Аг);
• токсины микроорганизмов;
• искусственно созданные Аг микроорганизмов;
• Аг, полученные методами генной инженерии.
Большинство вакцин разделяют на живые, инактивированные (убитые, неживые), молекулярные (анатоксины) генно инженерные и химические; по наличию полного или неполного набора Аг — на корпускулярные и компонентные, а по способности вырабатывать невосприимчивость к одному или нескольким возбудителям — на моно- и ассоциированные.
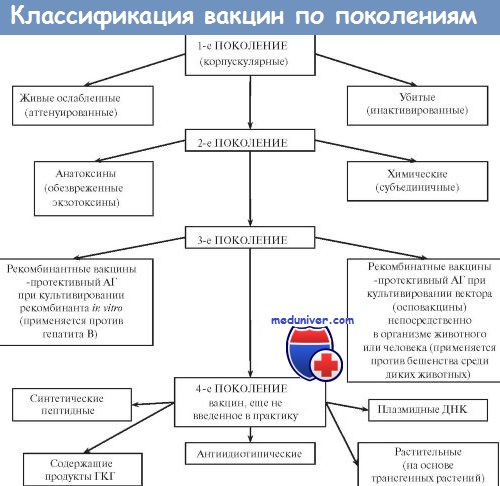
Живые вакцины
Живые вакцины — препараты из аттенуированных (ослабленных) либо генетически изменённых патогенных микроорганизмов, а также близкородственных микробов, способных индуцировать невосприимчивость к патогенному виду (в последнем случае речь идёт о так называемых дивергентных вакцинах). Поскольку все живые вакцины содержат микробные тела, то их относят к группе корпускулярных вакцинных препаратов.
Иммунизация живой вакциной приводит к развитию вакцинального процесса, протекающего у большинства привитых без видимых клинических проявлений. Основное достоинство живых вакцин— полностью сохранённый набор Аг возбудителя, что обеспечивает развитие длительной невосприимчивости даже после однократной иммунизации. Живые вакцины обладают и рядом недостатков. Наиболее характерный — риск развития манифестной инфекции в результате снижения аттенуации вакцинного штамма. Подобные явления более типичны для противовирусных вакцин (например, живая полиомиелитная вакцина в редких случаях может вызвать полиомиелит вплоть до развития поражения спинного мозга и паралича).
Ослабленные ( аттенуированные ) вакцины
Ослабленные (аттенуированные) вакцины изготавливают из микроорганизмов с пониженной патогенностью, но выраженной иммуногенностью. Введение вакцинного штамма в организм имитирует инфекционный процесс: микроорганизм размножается, вызывая развитие иммунных реакций. Наиболее известны вакцины для профилактики сибирской язвы, бруцеллёза, Ку-лихорадки, брюшного тифа. Однако большая часть живых вакцин — противовирусные. Наиболее известны вакцина против возбудителя жёлтой лихорадки, противополи-омиелитная вакцина Сэйбина, вакцины против гриппа, кори, краснухи, паротита и аденовирусных инфекций.
Дивергентные вакцины
В качестве вакцинных штаммов используют микроорганизмы, находящиеся в близком родстве с возбудителями инфекционных болезней. Аг таких микроорганизмов индуцируют иммунный ответ, перекрёстно направленный на Аг возбудителя. Наиболее известны и длительно применяются вакцина против натуральной оспы (из вируса коровьей оспы) и БЦЖ для профилактики туберкулёза (из микобактерий бычьего туберкулёза).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

