Удк кардиохирургические операции у вич инфицированных
Обновлено: 19.04.2024
АИК (аппарат искусственного кровообращения) – медицинский аппарат, применяемый при операциях на отрытом сердце, поддерживающий все физиологические параметры гемодинамики во время операции. Любой аппарат искусственного кровообращения состоит из двух блоков: физиологического и механического. Физиологический блок включает в себя детали, которые соприкасаются с кровью. Механический блок включает в себя собственно сам АИК, который имеет центрифужные и роликовые насосы, электронные системы контроля и безопасности. АИК оказывает негативно воздействие на организм, вызывает гипероксию, гипотермию, гемодилюцию, повреждаются форменные элементы крови, запускается воспалительный процесс, а также кровоток становится не пульсирующим, что приводит к нарушению постоянства внутренней среды организма. Главной целью модификации и внедрения в АИК дополнительных составляющих, является обеспечение наибольшей безопасности пациента, во время проведения операции и минимизация послеоперационных осложнений. Достижением перфузионных технологий является применение мини-контуров, гепариновых и биосовместимых покрытий. Применение мини-контуров без кардиотомных резервуаров позволили сократить контактную поверхность и уменьшить нарушение целостности ткани. Также инновационным в техники перфузии стало лейкодипиляция и ультрафильтрация, а также добавление в прайм (первичный объем заполнения) кортикостероидов, донорских NO-соединений и апротинина. Все это позволяет уменьшить негативное влияние АИК на организм человека и способствует быстрейшему восстановлению в послеоперационной период.

1. Зюзин С.О., Голованов А.В., Сидорова М.А. Актуальность искусственного кровообращения в современной медицине // Научный альманах 2018. № 1-2(39). С.101-104
2. Евтушенко С.А. Оптимизация искусственного кровообращения при кардиохирургических вмешательствах без использования донорской крови: дисс. канд.мед.наук. Новосибирск, 2009. 114с.
3. Аверина Т.В. Искусственное кровообращение ФГБУ Научный центр сердечно-сосудистой хирургии им. А.Н. Бакулева РАМН, Москва. 2013. С2.
4. Локшин Л.С., Лурье Г.О., Дементьева И.И. Искусственное и вспомогательное кровообращение в сердечно-сосудистой хирургии. М.: Пресса; 1998.
5. Groom R.C., Froebe S., Martin J. et al. Update on pediatric perfusion practice in North America. 2005. Survey. JECT. 37: 343–50.
6. Brix-Cristensen V. The systemic inflammatory response after cardiac surgery with cardiopulmonary bypass in children. Acta Anaesthesiol. Scand. 2001. 45: 671–9.
7. Быков И.В. Вспомогательное кровообращение на базе осевых насосов (математическое моделирование процессов управления): дис.кан.био.наук. Москва, 2014. 126 с.
8. Байжигитов Н.Б. Кулимбет М.Б. Мереке А.А. Клинические эффекты применения модифицированной ультрафильтрации крови у детей раннего возраста // КазНМУ Вестик. 2016. №3. С.72-75.
9. Сидоров Р.В., Федерякин Д.В., Анохин А.В. Опыт использования миниинвазивного экстракорпорального контура (месс-перфузии) с оценкой динамики когнитивных функций у больных после операции аорто-коронарного шунтирования // Вестник Национального медико-хирургического Центра им. Н.И. Пирогова 2017. №3. С13-15.
Применение аппаратов искусственного кровообращения в кардиохирургии стало на сегодняшний день достаточно распространенной практикой. Но, несмотря на накопленный клинический опыт, этот метод остается небезопасным. Главным образом это связано с применением донорской крови. В результате её использования возникают различные осложнения, для устранения которых многие исследователи искали альтернативные растворы для первичного заполнения АИК [1]. Также немаловажную роль в развитии осложнений в послеоперационный период играют физиологические, технические, хирургические и деонтологические аспекты.
С течением времени аппараты искусственного кровообращения постоянно модифицировались, появились дополнительные устройства, позволяющие минимизировать повреждающее действие на организм, такие как оксигенаторы, экстракорпоральные контуры с минимальным первичным объемом заполнения, изготовляемые из биосовместимых материалов.
Но, несмотря на все достижения кардиохирургии в этом направлении до сих пор высок риск послеоперационных осложнений, так как эта процедура расстраивает все звенья гомеостаза.
Пациентом современной кардиохирургической клиники всё чаще становится человек, находящийся в очень тяжелом состоянии: новорожденный, ребёнок с малым весом или тяжелым врожденным пороком сердца или же взрослый, подвергающийся повторному хирургическому вмешательству или имеющий сопутствующие патологии [2].
Главной целью перфузиолога, как и много лет назад, является обеспечение наибольшей безопасности пациента во время проведения операции и минимизация послеоперационных осложнений.
Целью работы является проведение анализа литературных источников, научных статей и статистических данных по вопросу применения аппарата искусственного кровообращения в кардиохирургической практике.
Материалы и методы исследования
Материалами исследования послужили научные публикации отечественных и зарубежных ученых, опубликованные за последние 10 лет.
Результаты исследования и их обсуждение
Перфузиология – интенсивно развивающаяся отрасль медицины, которая изучает использование аппарата искусственного кровообращения при оперативных вмешательствах на сердце, которые предполагают выключение сердца из кровообращения.
Первые аппараты искусственного кровообращения (АКИ) были применены в клинической практике более 60 лет назад, причем довольно-таки успешно. С развитием кардиохирургии аппараты для перфузии длительно совершенствовались, многократно модифицировались и корректировались; в практику вводились новые методы искусственного кровообращения.
Первая успешная операция на человеке с выключением сердца из кровообращения при ушивании дефекта между предсердиями была проведена 6 мая 1953 года. В России же операции, проводимые с использованием АИК вошли в практику чуть позже, в 1957 году (первые операции были проведены под руководством А.А. Вишневского).
Тем не менее, долгое время подобные операции не находили широкого применения ввиду большого количества недостатков аппарата и высокими показателями послеоперационных осложнений. АИК для своего заполнения требовал до 4-6 литров донорской крови, аппараты были крайне ненадежны, так как физиологические узлы аппарата использовались многократно, да и способы управления таким устройством были крайне тяжелыми.
С момента первой операции аппараты постоянно усовершенствовались, появились оксигенаторы с минимальными первичными объемами заполнения; кроме того постоянно внедрялись новые биосовместимые материалы. Все это минимизировало неблагоприятное воздействие перфузии на организм. Разработка и внедрение гемодилюции (Panico F., Neptune W., 1959 г.), гипотермии в сочетании с искусственным кровообращением (Sealy W., 1958 г.) и защиты миокарда (Melrose D.G., 1955 г.) способствовали оптимизации перфузионных протоколов и повлекли за собой ряд фундаментальных исследований, посвященных изучению патофизиологических и клинических аспектов этих направлений [3].
АИК состоит из двух блоков: механического и физиологического. Механический блок включает в себя собственно сам АИК, который имеет центрифужные и роликовые насосы [7], электронные системы контроля (температуры, давления, уровня в кардиотомном резервуаре, пузырьков воздуха) и безопасности. Главным узлом механического блока является артериальный насос, замещающий функцию сердца и регулирующий минутный объем крови. Другие роликовые насосы используются в качестве коронарных отсосов, для нагнетания раствора, а также осуществляют ультрафильтрацию [4].
Физиологический блок состоит из одноразового экстракорпорального контура, выполняющего роль оксигенатора, то есть замещающего легкие. Его основная функция заключается в насыщении крови кислородом и выведении углекислого газа. Для пациентов разных возрастных и весовых категорий применяются оксигенаторы с различной максимальной производительностью и разными объёмами первичного заполнения. ЭК-контур состоит из кардиотомного резервуара, который может быть как жестким, так и мягким; насосного сегмента; теплообменника; артериального фильтра-ловушки; двух или трех магистралей для отсосов и артериальной/венозной линий.
Перед тем, как начать искусственное кровообращение, ЭК-контур заполняют, диаэрируют, и только после этого подсоединяют к сердечно-сосудистой системе [9].
Существуют различные схемы и методы подключения ЭК-контура к сердцу, в зависимости от патологической причины, которую будут устранять во время операции. При стандартном подсоединении используется следующая схема: верхняя полая вена (ВПВ), нижняя полая вена (НПВ), аорта (Ао) (рис. 1a).
Схемы подключения ЭК-контура к сердцу: а – стандартная, б – двухсекционная, в - обходная.
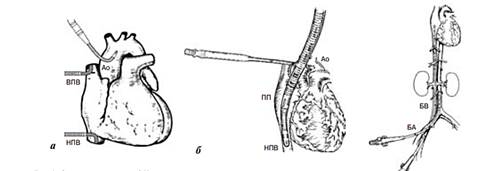
При проведении операций без вскрытия камер сердца или при остановке кровообращения с глубокой гипотермией считается достаточным применение одного венозного катетера. Также существует метод двухсекционного подключения, при котором один порт забора подсоединяют к сердцу на уровне правого предсердия, а другой – на уровне нижней полой вены. (Рис. 1б). В случаях, когда операцию проводят на аорте, а именно на восходящей её части или дуге, а также при повторных вмешательствах канюлю присоединяют к бедренной артерии. (Рис 1в).
Редкими случаями подключения являются бедренно-бедренный метод канюлирования и метод левожелудочкового обхода. Последний метод широко используется при реконструктивных операциях торакоабдоминального отдела аорты, для создания частичного сердечно-легочного обхода.
Для определения размера аортальных канюль, использующихся при присоединении ЭК-контура, учитывают максимальный минутный объем кровообращения индивидуальный для каждого конкретного пациента, а также пропускную способность канюли определенного диаметра. Выбор диаметра венозного катетера зависит от массы тела пациента и от диаметра полых вен, который хирург определяет визуально. В норме диаметр катетера должен быть не более 2/3 от просвета сосуда.
Если невозможно обеспечить адекватный венозный отток крови, в частности из-за низкой пропускной способности катетеров, применяют технику вспомогательного венозного дренажа. Эта методика является эффективной и безопасной благодаря тому, что улучшается венозный возврат без изменения градиента между кардитомным резервуаром и правыми камерами сердца, не травмируются форменные элементы крови, а также не происходит образование микроскопических эмболов.
Как только хирург подключил катетеры к магистральным сосудам, начинается перфузия. Существует две её разновидности: параллельная и полная. Параллельной перфузия считается до момента пережатия полых вен и, соответственно, прекращения притока крови к сердцу, а полной – после пережатия полых вен.
После снятия турникетов с полых вен и зажима с аорты начинается параллельная перфузия, которая может проводиться с полными объемными скоростями, когда необходимый минутный объем крови обеспечивается аппаратом искусственного кровообращения, и во вспомогательном режиме, когда часть минутного объема крови обеспечивается работой сердца, а часть – производительностью артериального насоса.
Составы первичного объема заполнения (прайма) разнообразны и зависят от многих показателей (объема циркулирующей крови, возраста и массы тела пациента, исходного гематокрита и т. д.). К основным компонентам прайма относят кристаллоидные и корригирующие растворы (KCl, NaHCO3), эритроцитарную массу, гепарин, растворы естественных (альбумин, сверхзамороженная плазма) и синтетических коллоидов (гидроксиэтилкрахмал и производные желатины), маннитол, апротинин и антибиотик [5].
АИК оказывает негативно воздействие на организм, вызывает гипероксию, гипотермию, гемодилюцию; его использование повреждает форменные элементы крови и запускает воспалительный процесс; кроме того при его использовании кровоток становится непульсирующим, что приводит к нарушению постоянства внутренней среды организма [4].
В результате этого развивается синдром системной воспалительной реакции (ССВР), к его развитию приводят активация фибринолиза, коагуляции, системы комплемента и калликреин-кининовой системы. Активируются тромбоциты и лейкоциты, повреждаются клетки эндотелия сосудов. Все это приводит к увеличению проницаемости сосудов, накоплению жидкости в интерстициальном пространстве, нарушению микроциркуляции и гипоперфузии ткани с морфофункциональными изменениями [6]. Могут возникнуть такие осложнения, как кровотечение и повреждение легких.
Клиническими проявлениями чрезмерного иммунного ответа является постперфузионный синдром, включающий в себя лихорадку, респираторные нарушения, почечную недостаточность, коагулопатии, дисфункцию миокарда и неврологические осложнения. Новорожденные и дети первого года жизни наиболее подвержены негативным влияниям переливания крови, это связано с морфофункциональными особенностями молодого организма и незрелостью иммунной системы.
Достижением перфузионных технологий является применение мини-контуров, гепариновых и биосовместимых покрытий. Применение мини-контуров без кардиотомных резервуаров позволили сократить контактную поверхность и уменьшить нарушение целостности ткани [8]. А это в свою очередь исключает возникновение ССВР за счет повышения биологической совместимости применяемых материалов, так как уменьшается контакт с чужеродной поверхностью.
Усовершенствованные оксигенаторы минимально травмируют форменные элементы и белки крови, а также обеспечивают оптимальный газовый состав.
Инновационными внедрениями в технику перфузии стали лейкодеплеция (уменьшение числа лейкоцитов) и ультрафильтрация, а также добавление в прайм (первичный объем заполнения) кортикостероидов, донорских NO-соединений и апротинина. Активированные лейкоциты повреждают эндотелий сосудов, поэтому их непрерывное удаление из переливаемой крови предотвращает возникновение воспалительного процесса. Также с донорскими лейкоцитами возможен перенос различных вирусных заболеваний (ВИЧ-инфекция, гепатиты B и C). В связи с этим для удаления лейкоцитов применяют специальные фильтры, гидрофильная синтетическая поверхность которых имеет высокое сродство к лейкоцитам, что обеспечивает высокую степень очистки.
Для новорожденных и маловесных детей разрабатываются педиатрические ЭК-контуры, которые позволяют не только уменьшить контактирующую поверхность, но и минимизируют первичный объем заполнения этих систем вплоть до полного отказа от компонентов донорской крови.
Значительный вклад в развитие кардиохирургии принесло внедрение гипотермии в процесс искусственного кровообращения. Гипотермия оказывает на организм как положительные, так и отрицательные воздействия. К положительным характеристикам гипотермии, улучшающим показатели гемодинамики при применении аппарата искусственного кровообращения, относятся снижение интенсивности метаболических процессов и потребности организма в кислороде. Благодаря этому увеличивается устойчивость организма к гипоксии. За счет увеличения растворимости газов и снижения парциального давления углекислого газа в крови наблюдается сдвиг кислотно-щелочного равновесия в кислую сторону. К отрицательным эффектам относятся централизация кровообращения за счет резкого снижения скорости кровотока в мышцах, коже и жировой ткани, повышение вязкости крови, а также увеличение сродства гемоглобина к кислороду, благодаря сдвигу кривой диссоциации оксигемоглобина влево.
Метаболизм катехоламинов в организме значительно снижается при гипотермии, в результате чего кровоснабжение сердечных и скелетных мышц ухудшается. При полной перфузии из кровотока выключаются легкие, что также негативно влияет на организм, так как в них происходит инактивация многих гормонов и вазоактивных веществ.
В современной кардиохирургии имеется тенденция к ограничению использования низких температур, однако в хирургии сложных врожденных пороков сердца гипотермическая перфузия по-прежнему остается предпочтительным методом [5].
Современные технологии позволяют минимизировать негативное влияние АИК на организм человека и значительно снижают риск возникновения послеоперационных осложнений. Общей тенденцией в дальнейшем совершенствовании аппаратов является модифицирование физиологического блока для одноразового пользования, микропористых фильтров в артериальной линии и переход к мембранным оксигенаторам.
Бабенко С. И., Муратов Р. М., Соркомов М. Н., Сачков А. С., Титов Д. А.
ФГБНУ НЦССХ им.А.Н.Бакулева;
Инфекционный эндокардит (ИЭ) является одним из самых тяжелых осложнений парентерального употребления наркотиков. Заболеваемость ИЭ у внутривенных наркоманов составляет 2% до 5% в год. Распространенность ВИЧ-инфекции среди инъекционных наркоманов колеблется от 30% до 70% в развитых странах мира. Чаще всего инфекционному разрушению подвергается трикуспидальный клапан (от 60% до 70%).
Цель исследования:
проанализировать результаты хирургического лечения инфекционного эндокардита у ВИЧ-инфицированных пациентов в отделении неотложной хирургии приобретенных пороков сердца за последние 5 лет.
Материал и методы.
Всего прооперировано 19 пациентов, 14 (74%) мужчин и 5 (26%) женщин. Средний возраст 33,7±13,5 (от 21 до 48 лет). Длительность заболевания от 3 месяцев до 14 лет. Этиология порока: инфекционный эндокардит – 16 пациентов, постинфарктная митральная недостаточность -1, миксома левого предсердия – 1, тромбоз аортального протеза – 1. Сопутствующий хронический гепатит С- 14 (74%), гепатит В 5 (26%), из них у 3 пациентов гепатит В и С. В IY ФКнаходилось 11 пациентов, в III ФК – 6 и во II ФК – 2 пациента. По классификации ВИЧ инфекции и расширенной системе интерпретации клинических случаев СПИД (MMWR 1992a) к А классу относились -3 пациента, к В – 13 и к С- 3 пациента. У 9 пациентов при поступлении в отделение СD4 было меньше 500 и они получали противовирусную терапию.
Результаты.
Изолированное протезирование аортального клапана выполнено 2 пациентам, митрального – 3, трикуспидального – 4, двухклапанное протезирование - 3 пациентам (+ редукция восходящей аорты у 1 пациента), пластика трикуспидального клапана – 1, протезирование митрального клапана и вентрикулопластика левого желудочка – 1, репротезирование аортального клапана – 1, удаление миксомы левого предсердия -1, протезирование аортального клапана и пластика митрального или трикуспидального клапанов - 3. Госпитальной летальности не было (0%). Средний реанимационный койко/день- 1,6. Средний койко/день госпитализации -12,8. Пролонгированная вентиляция (больше 24 часов) –у 3 пациентов была связана с исходной сердечной недостаточностью. Инфекционных осложнений не было.
Выводы:
Сердечная хирургия у ВИЧ-инфицированных пациентов с инфекционным эндокардитом клапанов сердца не ухудшает прогноз, т.к. искусственное кровообращение не повлияло на иммунный статус в раннем послеоперационном периоде. Никаких инфекционных осложнений в послеоперационном периоде не было. Прогноз ВИЧ-инфекции и естественного течения болезни без коррекции порока должны быть основными факторами, которые необходимо учитывать при планировании операций у этой категории пациентов. Обеспокоенность вызывает риск заражения инфекцией персоналом во время проведения операции. Особенно это касается хирургов игнорирующих меры предосторожности. Необходимо использовать весь спектр современных универсальных средств. Существует реальный риск заражения гепатитом, который передается легче, чем СПИД.
Комментарии посетителей
Комментарии могут отправлять участники данного мероприятия или члены Ассоциации.
Преимущества членства в ассоциации
Аннотация. В статье представлен анализ данных литературы, характеризующих современные представления о распространенности, этиологии, особенностях клинического течения, локализации клапанного повреждения, осложнениях, диагностике, лечения, прогнозе и исходах инфекционного эндокардита (ИЭ) у пациентов с различными стадиями ВИЧ-инфекции. Обсуждены вопросы тактики ведения таких пациентов, в том числе на стадии СПИДа, особенности медикаментозной терапии, показания к кардиохирургическому лечению. Необходимы дальнейшие исследования проблемы ИЭ на фоне ВИЧ-инфекции с целью улучшения диагностики и прогноза. Эффективное междисциплинарное взаимодействие специалистов (кардиологов, кардиохирургов, инфекционистов) позволяет добиться во многих случаях излечения клапанной инфекции, уменьшения вирусной нагрузки и восстановления клеточного иммунитета, обеспечения в дальнейшем удовлетворительного качества жизни пациентов с ИЭ на фоне ВИЧ-инфекции.
В период пандемии новой коронавирусной инфекции проблема инфекционного эндокардита (ИЭ) не утратила своего значения [1]. Заболеваемость ИЭ в последнее десятилетие не снижается, несмотря на очевидные и впечатляющие достижения в области диагностики и лечения этой патологии [2, 3]. Установление диагноза ИЭ остается сложным, а связанная с ним смертность высокой. Даже у выживших и вылеченных от ИЭ пациентов, как правило, сохраняются серьезные последствия [4], т.е. ИЭ – заболевание, угрожающее жизни и здоровью [1–4]. Среди современных факторов риска ИЭ одними из наиболее значимых остаются потребление инъекционных наркотиков и заражение вирусом иммунодефицита человека (ВИЧ) [2, 4].
ИЭ у пациентов с ВИЧ-инфекцией встречается нечасто [3], преимущественно у потребителей инъекционных наркотиков (ПИН) [10, 12, 15]. ВИЧ непосредственно не действует на эндокард, но ВИЧ-инфекция создает условия для поражения эндокарда различными инфекционными агентами, прежде всего бактериями [16]. Развитие тяжелой бактериальной инфекции кровотока, вызывающей разрушение сердечных клапанов, поражение внутренних органов на фоне клеточной иммуносупрессии при ВИЧ-инфекции, представляет несомненный интерес как для исследователей, так и практических врачей.
УСЛОВИЯ ВОЗНИКНОВЕНИЯ, РАСПРОСТРАНЕННОСТЬ СОЧЕТАНИЯ ИНФЕКЦИОННОГО ЭНДОКАРДИТА И ВИЧ-ИНФЕКЦИИ
Внутривенное введение наркотических веществ в нестерильных условиях служит источником бактериемии для инфекции кровотока. Соответственно ПИН – группа повышенного риска развития ИЭ [2, 15, 20]. Внутривенная наркомания остается одним из ведущих путей распространения ВИЧ, хотя и уступает половому пути передачи инфекции [5–8]. ВИЧ-инфекция значительно распространена среди ПИН, составляя в этой группе от 40 до 90% [6]. Сведения о распространенности ВИЧ-инфекции среди ПИН с ИЭ значительно различаются: от 18–25 [12] до 84% [18].
В 2003 г. были описаны 8 случаев ИЭ у ВИЧ-инфицированных пациентов, не употреблявших наркотики [21]. В другом исследовании упоминаются 14 подобных пациентов при анализе свыше 4000 наблюдений ИЭ на фоне ВИЧ-инфекции, все остальные больные были внутривенными наркоманами [22]. Развитие ИЭ преимущественно у ПИН и крайне редко у ВИЧ-инфицированных пациентов, не употребляющих наркотики, позволило авторам предположить, что именно внутривенное введение наркотиков, а не ослабленный иммунитет – наиболее значимый фактор риска возникновения ИЭ у ВИЧ-позитивных пациентов [3, 21, .
Статья посвящена оценке функциональных результатов и определению частоты инфекционных осложнений при операции эндопротезирования тазобедренного сустава у ВИЧ-инфицированных пациентов. Пятилетний анализ результатов операций показал хорошую функциональную активность искусственных тазобедренных суставов, рентгенологическую стабильность компонентов и отсутствие осложнений. Опираясь на собственный опыт и данные зарубежной литературы в статье сделана попытка в качестве дискуссии выявить причинно- следственную связь между возникновением АНГБК и ВИЧ инфекцией, определить важность уровня CD4 лимфоцитов и его влияние на развитие инфекционных осложнений. Подводя итоги обзора литературы и личного клинического опыта, можно сказать, что возраст людей, пораженных АНГБК, страдающих ВИЧ инфекцией ниже, чем у тех, кто обладает ВИЧ отрицательным статусом. Так же можно сделать вывод, что наличие ВИЧ не является главной причиной возникновения асептического некроза, более того исследования показывают, что развитие осложнений происходит примерно с одинаковой вероятностью как у ВИЧ-отрицательных, так и у ВИЧ положительных людей. Именно по этой причине эндопротезирование тазобедренного сустава может существенно улучшить качество жизни ВИЧ инфицированных пациентов с заболеваниями тазобедренного сустава.

1. Barre-Sinoussi F. Chermann J.C., Rey F., Nugeyre M.T., Chamaret S., Gruest J., et al. Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS). Science 1983;220:868–871.
2. Chang C.H., Tsai S.W., Chen C.F., Wu P.K., Wong W.W., Chang M.C., Chen W.M. Optimal timing for elective total hip replacement in HIV-positive patients Orthop Traumatol Surg Res. 2018 Jun 27. S1877-0568.
6. Измайлов З.А., Морозов Д.П., Валитов М.Р. Проблема роста числа зараженных ВИЧ-инфекцией в современной России и возможные пути решения сложившейся ситуации // Молодой ученый. – 2016. – № 12. – С. 491–493.
7. Nicolai Lohse et al, Survival of Persons with and without HIV Infection in Denmark, 1995–2005. Ann Intern Med. Jan. 16, 2007;146:87-89.
8. Тихилов Р.М., Шубняков И.И., Плиев Д.Г., Денисов А.О., Мясоедов А.А., Гончаров М.Ю., Муравьева Ю.В., Коваленко А.Н., Базаров И.С., Артюх В.А., Карагодина М.П., Шильников В.А., Бояров А.А., Малыгин Р.В., Божкова С.А., Кочиш А.Ю., Шнейдер О.В., Разоренов В.Л., Билык С.С. Руководство по хирургии тазобедренного сустава. СПб., 2015. – Т. 2. – С. 356.
9. Pretell-Mazzini J., Subhawong T., Hernandez V.H., Campo R. HIV and orthopaedics: musculoskeletal manifestations and outcomes. J. Bone Joint Surg. Am. 2016;98:775–786.
10. Kirk D. Miller, et all. High Prevalence of Osteonecrosis of the Femoral Head in HIV-Infected Adults FREE.. Ann. Intern. Med. 2002;137(1):17-25.
13. Habermann B., Eberhardt C., Kurth A.A. Total joint replacement in HIV positive patients. J. Infect. 2008; 57(1):41-46
14. Wieser K., Zingg P.O., Betz M., Neubauer G., Dora C. Total hip replacement in patients with history of illicit injecting drug use. Arch Orthop Trauma Surg. 2012 Jul;132(7):1037-1044.
15. Hicks, Ribbans, Buzzard, et al. Infected joint replacements in HIV-positive patients with haemophilia. J Bone Joint Surg [Br] 2001;83-B:1050–1054.
16. Lubega N, Mkandawire N C, Sibande G C, Norrish A R, Harrison W J. Joint replacement in Malawi. Journal of Bone and Joint Surgery - British Volume. 2009;91-B(3):341–343.
17. Tornero E., García S., Larrousse M., Gallart X., Bori G., Riba J., Rios J., Gatell J., Martinez E. Total hip arthroplasty in HIV-infected patients: a retrospective, controlled study. HIV Med. 2012. Nov;13(10):623-9.
18. Brijlall Arthroplasty in HIV-infected patients — A 5 year follow-up. Journal of Bone and Joint Surgery – British Volume. 2008;90-B(SUPP_III):473.
19. Ta-I Wang a, Cheng-Fong Chen a,b, Wei-Ming Chen a,b,, Chao-Ching Chiang a,b, Ching-Kuei Huang a,b, Chien-Lin Liu a,b, Tain-Hsiung Chen a,b Joint replacement in human immunodeficiency virus-infected patients Journal of the Chinese Medical Association 75 (2012) 595-599.
20. Graham S.M., Lubega N., Mkandawire N., Harrison W.J. Total hip replacement in HIV-positive patients. Bone Joint J. 2014 Apr;96-B(4):462-6.
22. Green S., Kong V.Y., Laing G.L., Bruce J.L., Odendaal J., Sartorius B., Clarke D.L. The effect of stage of HIV disease as determined by CD4 count on clinical outcomes of surgical sepsis in South Africa. Ann. R. Coll. Surg. Engl. 2017 Jul; 99(6): 459–463.
23. Horberg M.A., Hurley L.B., Klein D.B., Follansbee S.E., Quesenberry C., Flamm J.A., et al. Surgical outcomes in human immunodeficiency virus-infected patients in the era of highly active antiretroviral therapy. Arch. Surg 2006;141: 238–245.
24. Davison S.P., Reisman N.R., Pellegrino E.D., Larson E.E., Dermody M., Hutchison P.J. Perioperative guidelines for elective surgery in the human immunodeficiency virus-positive patient. Plast. Reconstr. Surg. 2008;121: 1831–1840.
Среди впервые выявленных в 2015 г. ВИЧ-позитивных с установленными факторами риска заражения 53,6% инфицировались при употреблении наркотиков нестерильным инструментарием, 42,8% – при гетеросексуальных контактах, 1,5% – при гомосексуальных контактах, 2,1% составляли дети, инфицированные от матерей во время беременности, родов и при грудном вскармливании [4, 5, 6].
В настоящее время для лечения ВИЧ-инфекции используются высокоэффективные антиретровирусные препараты (ВААР терапия), которые включают мощные ингибиторы протеазы или ингибиторы обратной транскриптазы. Использование данных препаратов привело к увеличению продолжительности жизни ВИЧ-инфицированных и снижению развития оппортунистических инфекций.
Исследование N. Lohse позволяет прогнозировать более чем 35-летнюю выживаемость молодых ВИЧ-инфицированных людей, получающих современную терапию [7].
Наряду с этим все большее внимание врачей привлекают заболевания, возникающие у ВИЧ-положительных пациентов. Одним из таких заболеваний является асептический некроз головки бедренной кости (АНГБК). Асептический некроз головки бедренной кости (АНГБК) — тяжелое хроническое заболевание, вызванное недостаточностью местного кровообращения, которое ведет к разрушению костной ткани в головке бедра.
На ранних стадиях заболевание, как правило, протекает бессимптомно, а уже при наличии болевого синдрома остается чаще всего только один вариант лечения – хирургический. Боль, связанная с аваскулярным некрозом бедра, может сосредоточиться в паховой области, бедрах или крестцово-подвздошном сочленении, маскируя проблему и вынуждая пациентов долгое время получать лечение у неврологов по поводу остеохондроза позвоночника.
Почему асептический некроз головки бедренной кости является проблемой у ВИЧ-инфицированных людей?
Некоторые эксперты считают, что это может быть результатом хронической ВИЧ-инфекции. Другие считают, что длительное применение препаратов, таких как ингибиторы протеазы или стероиды, может привести к повреждению кровеносных сосудов, питающих головку бедра. Третьи считают, что метаболические изменения в организме, которые являются общими у ВИЧ-положительных людей, могут иметь значение в развитии асептического некроза [8].
И ВИЧ-инфекция, и лечение ВААРТ являются факторами риска для остеонекроза головки бедренной кости [9]; риск в 100 раз выше для ВИЧ-инфицированных пациентов, чем для населения в целом.
Американские ученые обнаружили необычайно высокий процент асептического некроза головки бедренной кости при МРТ-исследовании у ВИЧ-инфицированных. Данное исследование проведено у 339 ВИЧ-инфицированных пациентов, и процент с асептическим некрозом головки бедренной кости составил 4,4% [10].
В настоящее время не существует лечения, которое останавливает или лечит асептический некроз. Наркотические и ненаркотические обезболивающие препараты можно использовать краткосрочно для снятия симптомов. Нестероидные противовоспалительные средства могут уменьшать отек и воспаление в области тазобедренного сустава и могут использоваться для купирования болевого синдрома, связанного с асептическим некрозом.
Существуют, конечно, хирургические методы лечения, которые направлены на улучшение притока крови к пораженной области, однако чаще всего требуется тотальное эндопротезирование тазобедренного сустава для восстановления функции нижней конечности.
Распространено мнение, что иммунодефицит у ВИЧ-инфицированных больных увеличивает частоту инфекционных осложнений тотального эндопротезирования тазобедренного сустава. Parvizi с соавторами при анализе 21 операции тотального эндопротезирования тазобедренного сустава у ВИЧ-позитивных пациентов отметили возникновение глубокой инфекции у 6 пациентов. Авторы связали частоту осложнений со снижением количества СD4-лимфоцитов до 239±112 мкл [11].
По данным Калифорнийского университета в США в период c 2002 по 2008 гг. в США выполнено 8229 операций эндопротезирования у ВИЧ-инфицированных больных, что составило 0,14% от общего количества операций эндопротезирования. При этом эндопротезирование тазобедренного сустава составило 6449 пациентов – 79%. Частота инфекционных осложнений у ВИЧ-инфицированных больных в 2 раза превысила количество данных осложнений у ВИЧ-негативных пациентов и составила 0,6% [12].
Haberman с коллегами сообщили о развитии инфекции после тотального эндопротезирования тазобедренного сустава в 12,7% случаев в группе из 41 ВИЧ-инфицированного пациента, при этом не отмечено снижения CD4-лимфоцитов [13].
При исследовании пациентов, имеющих в анамнезе наркоманию и перенесших тотальное эндопротезирование тазобедренного сустава, Wieser с соавторами отметили возникновение септических осложнений в 70% случаев за период в 10 лет наблюдений и не нашли связи септических осложнений с положительными серологическими реакциями на ВИЧ [14].
Hicks с соавторами в результате многоцентрового ретроспективного анализа показали, что существует повышенный риск развития септических осложнений после тотального эндопротезирования тазобедренного сустава у ВИЧ-положительных, больных гемофилией [15].
Наблюдения Lubega не обнаружили различий в послеоперационном периоде при краткосрочном наблюдении за 14 пациентами (перенесшими 18 ТЭП), которые были ВИЧ-положительными, и 28 пациентами, которые были ВИЧ-отрицательными [16].
Tornero E. в своем исследовании показывает, что исход эндопротезирования тазобедренного сустава у ВИЧ-положительных пациентов не хуже, чем у ВИЧ-отрицательных пациентов [17].
Ta-I Wang с соавторами сообщили о 6 ВИЧ-положительных пациентах, которым в общем выполнено 10 оперативных вмешательств с 2000 по 2009 гг. Из них 7 – эндопротезирование тазобедренного сустава, два – коленного сустава и одно – эндопротезирование плечевого сустава. За период наблюдения в 38,6 месяца инфекционных осложнений не выявлено [19].
Graham SM сообщил о краткосрочном наблюдении и функциональном результате после тотального эндопротезирования тазобедренного сустава в группе ВИЧ-инфицированных пациентов, которые не страдают гемофилией и не имеют в анамнезе внутривенного употребления наркотиков. В общей сложности 29 пациентов подверглись 43 операциям тотального эндопротезирования тазобедренного сустава со средним сроком наблюдения от 6 месяцев до 3 лет. В группе было 10 женщин и 19 мужчин, средний возраст которых составил 47 лет и 7 месяцев (от 21 года до 59 лет и 5 месяцев). В период наблюдения инфекционных осложнений не было. Средняя предоперационная оценка по шкале Харриса была 27 (от 6 до 56), средняя послеоперационная была 86 (от 73 до 91), давая среднее улучшение на 59 пунктов [20].
Таким образом, при анализе зарубежной литературы мы не выявили единого мнения на предмет увеличения частоты инфекционных осложнений у ВИЧ-инфицированных пациентов, подвергшихся плановой операции тотального эндопротезирования тазобедренного сустава и влияния уровня CD4-лимфоцитов.
Цель исследования. На собственном клиническом материале выяснить причинно-следственные связи между ВИЧ-инфекцией и АНГБК, а также сравнить пред- и послеоперационный период после тотального эндопротезирования тазобедренного сустава у здоровых и больных людей. Оценить риски развития осложнений.
Материалы и методы. За последние 5 лет в период с 01.01.2011 по 31.12.2015 гг. в ФБГУ РНИИТО им. Р.Р. Вредена были госпитализированы 166 ВИЧ-инфицированных пациентов. Из них экстренная госпитализация у 50 пациентов (30%), плановая – у 116 (70%). Средний возраст пациентов 29,9 лет, от 22 до 66 лет. Среди всех госпитализированных ВИЧ-инфицированных преобладали мужчины ¾ 115 (69,3%) человек, женщины составили 51 человека (30,7%). Жители Санкт-Петербурга составили 85 (51,2%), Ленинградской области ¾ 25 (15%).
С патологией тазобедренного сустава госпитализировались 43 пациента, что составило 25,9% от общего числа ВИЧ-госпитализированных больных и 37% от числа плановых госпитализаций ВИЧ-инфицированных пациентов.
В отделении № 11 в период с 2012 по 2016 гг. выполнено 15 оперативных вмешательств у 13 ВИЧ-инфицированных пациентов, из них 3 операции реэндопротезирования у пациентов с асептической нестабильностью, на момент первичного эндопротезирования у этих больных ВИЧ не диагностировался, одно реэндопротезирование после установки спейсера, который был установлен пациентке с септическим некрозом головки бедренной кости после металлоостеосинтеза перелома шейки бедра. У двух пациентов выполнено двустороннее эндопротезирование с периодом между операциями 6 месяцев. У всех прооперированных пациентов уровень CD4-лимфоцитов перед операцией был более 300 клеток в 1 мм 3 . У троих пациентов на основании анамнеза зафиксировано внутривенное употребление наркотических препаратов, однако последняя инъекция произведена более чем за 3 года до операции.
Таким образом, подводя итоги обзора литературы и личного клинического опыта, можно сказать, что возраст людей, пораженных АНГБК, страдающих ВИЧ-инфекцией, ниже, чем у тех, кто обладает ВИЧ-отрицательным статусом.
Также можно сделать вывод, что наличие ВИЧ не является главной причиной возникновения асептического некроза. Более того, исследования показывают, что развитие осложнений происходит примерно с одинаковой вероятностью как у ВИЧ-отрицательных, так и у ВИЧ-положительных людей. Именно по этой причине эндопротезирование тазобедренного сустава может существенно улучшить качество жизни ВИЧ-инфицированных пациентов с заболеваниями тазобедренного сустава.
Однако предыдущие доклады по этой проблеме показали высокие показатели инфицирования ВИЧ-положительных пациентов, которым выполнялось тотальное эндопротезирование тазобедренного сустава [21, 22].
При глубоком и осмысленном анализе литературы всплывает еще одна патология, которая сопровождает ВИЧ-инфекцию, – гемофилия, представляющая собой патологию коагуляционной системы. И большинство негативных результатов с возникновением ранней перипротезной инфекции возникает у такой группы пациентов.
Так, в ретроспективном исследовании 102 случаев эндопротезирования тазобедренного сустава у ВИЧ-положительных пациентов из 8 центров гемофилии уровень инфицирования составил 18,7% при первичной артропластике и 36,3% при ревизии (средний срок наблюдения составил 5,7 лет) [15]. Кроме того, частота инфекционных осложнений у таких больных была значительно выше в группе с более низким предоперационным количеством CD4-лимфоцитов – в 49% случаев.
В другом исследовании из 27 артропластик коленного сустава и 7 – тазобедренного сустава у пациентов с ВИЧ-положительным статусом с гемофилией уровень ранних инфекционных осложнений составил 29,6% и 14,3% соответственно [21].
В исследовании, проведенном более 20 лет назад американскими коллегами, сообщалось, что 66 ВИЧ-положительных пациентов с предоперационным числом CD4 ≤ 200 клеток/мм 3 имели уровень инфицирования, достигающий 15,1% [22]. Авторы также сообщают об увеличении смертности у пациентов с ВИЧ-положительным статусом с числом лимфоцитов CD4
В настоящее время некоторые иностранные эксперты [20] предположили, что лучшее время для выполнения тотальной артропластики – когда количество CD4 составляет> 200 клеток/мм 3 , а другие > 400 клеток/мм 3 и не обнаруживается вирусная нагрузка [9].
К слову сказать, в немногих исследованиях упоминается вирусная нагрузка в качестве критерия повышения риска осложнений, в том числе инфекционных. В исследовании европейских коллег [23] 332 пациентов с ВИЧ-положительным статусом после ортопедических операций с вирусной нагрузкой из 30 000 к/мл имели высокий уровень осложнений, а другие исследователи сообщают об увеличении осложнений у ВИЧ-положительных пациентов с вирусной нагрузкой > 10 000 к. [24].
Таким образом, нет однозначного мнения и ясной картины о результатах и осложнениях после артропластики у ВИЧ-инфицированных пациентов.
В настоящий момент для решения вопроса о целесообразности эндопротезирования у данной группы пациентов, опираясь на опыт коллег из Европы, мы ориентируемся лишь на уровень CD4-лимфоцитов, а также на отсутствие терминальной стадии СПИД.
Исследования в этом направления будут продолжаться с целью разработки абсолютных противопоказаний для артропластики у ВИЧ-инфицированных пациентов или возможных корректирующих схем подготовки к этой плановой высокотехнологичной операции.
Коллективный опыт тотального эндопротезирования тазобедренного сустава в любом отечественном или западном медицинском учреждении небольшой и ограниченный, что требует дальнейшего изучения данной проблемы.
3. Клюшин Н.М., Ермаков А.М., Абабков Ю.В., Кушнаре С.В. Значение клинико-рентгенологических исследований в диагностике и лечении больных с перипротезной инфекцией после эндопротезирования тазобедренного сустава // Гений ортопедии. – 2017. – Т. 23., №3. – С. 341-345.
4. Национальные рекомендации по диспансерному наблюдению и лечению больных ВИЧ-инфекцией (клинический протокол) – 2015. – 205 с.
6. Хоминец В.В., Метленко П.А., Богданов А.Н., Кудяшев А.Л., Мироевский Ф.В. Ближайшие результаты лечения больных с перипротезными переломами бедренной кости после эндопротезирования тазобедренного сустава // Травматология и ортопедия России. – 2015. – №4. – С. 70-78.
Актуальность исследования. Операция по замене тазобедренного суставапозволяет человеку вернуться к полноценной жизни и распрощаться с теми артрозными симптомами, которые мешали испытывать жизненные радости много лет подряд. Как показывают исследования, осложнения после эндопротезирования тазобедренного сустава развиваются у 1% молодых людей и у 2,5% пожилых пациентов [3, с.341; 6, с.70]. По данным Joseph T., King Jr. (Yale University School of Medicine) и его коллег в исследовании, посвященном послеоперационной летальности у ВИЧ-инфицированных пациентов при эндопротезировании тазобедренного сустава, смертность в тридцатидневный период после операций составила 3,4%, тогда как у людей без ВИЧ-инфекции – 1,6% (разница в 2,11 раза) [3, с.341; 4; 6, с.71]. Послеоперационная смертность у ВИЧ-инфицированных была выше, чем у людей без ВИЧ, при любом уровне CD4-клеток, однако, уровень CD4-клеток значимо влиял на таковые риски в пределах группы ВИЧ-инфицированных [3, с.142; 6, с.72].
После корректировки потенциально значимых факторов исследователи обнаружили, что по сравнению с ВИЧ-отрицательной группой ВИЧ-инфицированные, которые имели 500 или больше CD4-клеток, имели риски 30-дневной послеоперационной летальности в 1,92 выше, чем у ВИЧ-отрицательных; при иммунном статусе (ИС)от 200 до 499 CD4-лимфоцитов – в 1,89 раза выше; при ИС от 50 до 199 клеток – в 2,66 раза; и при уровне CD4 менее 50 клеток/мкл – в 6,21 [1; 2; 4, с.133; 5].
Цель исследования – изучить актуальные вопросы эндопротезирования тазобедренного сустава у ВИЧ-инфицированных пациентов по данным литературы и по клиническим случаям больниц города Пермь.
Задачи исследования. Одной из важных задач является выявление всевозможных причин развития постоперационных осложнений у ВИЧ-инфицированных пациентов при эндопротезировании. Провести выборку и рассмотреть истории болезни пациентов травматологических отделений с ВИЧ-статусом, перенесших эндопротезирование тазобедренного сустава. Провести анализ полученных данных.
Нами изучены доступные литературные источники по проблеме эндопротезирования тазобедренного сустава у ВИЧ-инфицированных пациентов, в которых найдены ответы на такие вопросы как показания к операции, особенности хода операций, нюансы постоперационного ведения ВИЧ-инфицированных пациентов, возможные постоперационные осложнения, тактика борьбы с ними, постоперационная смертность ВИЧ-положительных пациентов ввиду развития осложнений.
Показания для эндопротезирования: Вполне естественно, что к выполнению замены тазобедренного сустава искусственным протезом должны быть весомые показания. В их основе лежит такое разрушение компонентов сочленения, при котором человек либо испытывает мучительную боль, либо не в состоянии выполнять элементарные движения пораженной конечностью. Другими словами, сустав перестает соответствовать своему физиологическому предназначению и становится ненужной частью организма, так как резко ухудшает качество жизни. В таких случаях эндопротезирование является единственным выходом их ситуации. К таким ситуациям относится: двусторонний деформирующий артроз II-III степени; односторонний деформирующий артроз II-III степени; деформирующий коксартроз III степени и анкилоз одного из крупных суставов на этой же конечности; односторонний коксартроз II-III степени одного тазобедренного сустава и анкилоз конрлатерального; двусторонний фиброзный или костный анкилоз тазобедренных суставов (болезнь Бехтерева); посттравматический коксартроз III степени на почве тяжелых повреждений вертлужной впадины; перелом и ложный сустав шейки бедренной кости у больных старше 70 лет; опухолевые процессы в головке и шейке бедренной кости, требующие резекции патологического очага.
Неприятные патологические ситуации, связанные с имплантацией, возникают нечасто. Однако они фиксируются, о чем должен быть проинформирован пациент. Согласно проводимым рандомизированным контролируемым исследованиям, получены следующие данные о наиболее распространенных проблемах: вывих головки протеза развивается примерно в 1,9 % случаев; септический патогенез – в 1,37 %;тромбоэмболия– в 0,3 %; перипротезный перелом возникает в 0,2 % случаев [3, с.341].
Второе по частоте неблагоприятное явление, характеризующееся активизацией тяжелых гнойно-воспалительных процессов инфекционной природы происхождения в районе установленного имплантата. Инфекционные антигены заносятся интраоперационно через недостаточно стерильные хирургические инструменты (редко) или после вмешательства по кровеносному руслу перемещаются от любого проблемного органа, имеющего болезнетворно-микробную среду (часто). Плохая обработка раневой зоны или слабое заживление (при диабете) также способствует развитию и размножению бактерий.
Гнойный очаг пагубно воздействует на прочность фиксации эндопротеза, вызывая его расшатывание и нестабильность. Гноеродная микрофлора трудно поддается лечению и, как правило, предполагает снятие имплантата и проведение повторной установки спустя продолжительное время. Основный принцип лечения – тест на установление вида инфекции, долгая и дорогостоящая антибиотикотерапия, обильный лаваж раны антисептическими растворами.
Для ВИЧ-инфицированных пациентов необходимо рассмотреть такой вопрос, как действие наркозного пособия. Общая анестезия существенно влияет на иммунную систему, приводя к еще большему ее угнетению. Ряд препаратов (тиопентал, сукцинилхолин, изофлюран, дроперидол, фентанил, кетамин) вызывает угнетение системы комплемента, подавление фагоцитоза и антителозависимой цитотоксичности, снижая потенциал антибактериальной защиты. В результате воздействия этих анестетиков в крови больных увеличивается скорость синтеза фактора некроза опухоли, α- и β-интерферонов, что вызывает гиперактивацию лимфоцитов, а значит – усиливает проявления воспаления.
Наиболее прогностически значимым является уменьшение содержания NK-клеток – естественных киллеров, осуществляющих противоопухолевую и противовирусную защиту, поскольку именно они являются наиболее чувствительным звеном этого воздействия и считаются самыми информативными критериями реактивности организма после операции. Оперативные вмешательства, выполненные под общей анестезией, могут приводить к нарушениям клеточного и гуморального иммунитета, снижению фагоцитарной активности и естественных киллеров, угнетению противоопухолевой защиты.
Таким образом, пациенты с тяжелой сопутствующей патологией и неблагоприятным фоновым заболеванием в форме ВИЧ-инфекции относятся к категории пациентов с потенциально высоким риском гематогенной диссеминации как источника инфекции в области эндопротеза.
В группе выборки, состоящей из 11 ВИЧ-инфицированных пациентов, которым было проведено одностороннее эндопротезирование тазобедренного сустава, наблюдалось постоперационное осложнение в форме парапротезного остеомиелита. У 9 пациентов данный процесс развивался в большом вертеле бедренной кости, у 2 пациентов процесс распространялся так же на вертлужную впадину. У всех исследуемых заболевание в течение трех месяцев перешло в форму хронического остеомиелита. Рецидив в форме обострения остеомиелита также наблюдался у всех пациентов. В течение года 10 пациентов погибли, у 9 из которых был установлен диагноз диссеминированного молниеносного септического состояния, 1 пациент умер от передозировки наркотическими препаратами. У 11-го пациента заболевание рецидивирует в течение последних 6 лет. На сегодняшний день у него определяется полный лизис большого и малого вертела, нарушение костной структуры вертлужной впадины с ее переломом и вклинением в малый таз чаши эндопротеза и полным вывихом головки эндопротеза (рис. 1).

Рис. 1. Рентгенография левого тазобедренного сустава в 2-х проекциях
(На рентгенограмме левого тазобедренного сустава (вынужденное положение - пациент не может разогнуть левую нижнюю конечность в положение стандартной укладки), произведено рентгеноскопическое исследование с прицельным снимком левого тазобедренного сустава в прямой проекции: состояние после эндопротезирования левого тазобедренного сустава, неадекватное стояние протеза: чаша фиксирована одним шурупом, вывернута, пролябирует в полость малого таза, крыша вертлужной впадины четко не определяется, головка эндопротеза расположена вне чаши, стояние ножки и централизатора эндопротеза в проекции центральной оси диафиза бедра)
Читайте также:

