Угнетают проникновение вируса в клетку
Обновлено: 18.04.2024
Несмотря на огромное разнообразие клеток и вирусов, можно выделить несколько основных типов их взаимодействия.
- Клетка гибнет и при этом образуется новое поколение вирусных частиц. Такой тип взаимодействия вируса и клетки называется продуктивным или литическим. Вирусы, вызывающие лизис клеток-хозяев, носят название вирулентных. Так протекает большинство вирусных инфекций независимо от того, являются ли вирусы крупными и сложно устроенными (например, вирусы герпеса, оспы) или мелкими (ВТМ, аденовирусы).
- Инфекционный процесс носит абортивный характер – клетка выживает, вирус не образуется. Иногда погибают оба партнера – и вирус, и клетка.
- Возникает интеграция двух геномов, которые сосуществуют более или менее мирно на протяжении многих поколений. Такой тип взаимодействия называется вирогенией. Вирусы, способные вызывать вирогению, называются умеренными. В случае бактериофагов, такое встраивание генома вируса в ДНК клетки-хозяина носит наименование лизогении, а сами фаги, способные к такому взаимодействию с клеткой, именуются лизогенными.
Кроме лизогенных фагов (например, фаг X) интегративный процесс характерен для ретровирусов, многих ДНК-содержащих онкогенных вирусов (у них может происходить интеграция не только всего генома, но и его части), а также некоторых других вирусов (например, гепаднавирусов). Интегративный процесс часто приводит к трансформации клетки – приобретению ею новых гено- и фенотипических признаков.
Рассмотрим типы вирусных инфекций. В зависимости от степени антагонизма двух геномов – вирусного и клеточного – возможны несколько типов инфекции. Феноменологически различают персистентные инфекции, при которых вирус выделяется из организма-хозяина в течение значительно большего времени, чем при обычных ли- тических инфекциях, завершающихся гибелью клеток- хозяев. При латентной инфекции вирус находится в организме хозяина в скрытой форме и выделяется в периоды рецидивов болезни. Медленные вирусные инфекции характеризуются очень длительным инкубационным периодом, который может длиться годами.
ОБЩАЯ ХАРАКТЕРИСТИКА ПРОДУКТИВНОГО ПРОЦЕССА
Циклы репродукции всех вирусов имеют общие черты (рис. 3.1). В течение некоторого времени после заражения клетки в ней практически не удается обнаружить вирусных частиц. Этот период известен как фаза эклипса (затмения). В это время вирусная частица находится в клетке в дезинтегрированном состоянии. Период эклипса найден у всех без исключения вирусов, и его наличие в настоящее время рассматривается как один из критериев для отнесения того или иного биологического объекта к вирусам.
За периодом эклипса следует период созревания – интервал, в течение которого вирионы потомства накапливаются внутри клетки с экспоненциальной скоростью. Фаза созревания завершается выходом потомства из клетки, что знаменует собой окончание латентного (инкубационного) периода – минимального промежутка времени, в течение которого вирусные частицы отсутствуют в окружающей клетку среде. Цикл репродукции вирусов продолжается от 30-40 мин (у многих бактериофагов) до более чем 40 ч (герпесвирусы). При этом урожай вирионов широко варьирует и иногда достигает десятков тысяч частиц в расчете на одну клетку (вирус полиомиелита).

Рис. 3.1. Кривые, демонстрирующие цикл размножения бактериофага Т1 в клетках Е. coli
СИСТЕМА ИНТЕРФЕРОНА
Место интерферона среди факторов защиты организма от вирусных инфекций
Гуморальный иммунный ответ находит свое выражение в продукции противовирусных антител. Главный результат активности антител – очистка сыворотки крови от вирусных частиц, что предотвращает передвижение вируса к неинфицированным клеткам и снижает нагрузку на другие защитные механизмы организма.
Связывание антител с вирионами приводит к активации системы комплемента, которая также способствует нейтрализации вирусных частиц. Участие системы комплемента имеет особо важное значение на ранних стадиях инфекции, когда в организме синтезируются еще ограниченные количества низкоаффинных антител.
Как предполагают, в борьбе с вирусными инфекциями более эффективен, в сравнении с гуморальным, клеточный тип иммунитета. Это предположение вытекает из следующих наблюдений.
- Врожденные дефекты клеточного иммунитета проявляются в предрасположенности прежде всего к вирусным инфекциям (и в гораздо меньшей степени – к бактериальным).
- В случае СПИДа происходит снижение соотношения числа клеток Т-хелперов (CD4+) к числу клеток Т-супрес- соров (CD8+) с 1,2 (нормальный уровень) до 0,2. При этом практически все больные начинают страдать от различных оппортунистических вирусных инфекций (вызванных, например, вирусами простого герпеса, цитомегало- вирусами, вирусом Эпштейна-Барр), которые присутствовали и до развития СПИДа, но были тогда подавлены ин- тактной иммунной системой.
Клеточно-опосредованный иммунитет находит свое выражение в уничтожении (лизисе) вирус-инфицированных клеток с участием так называемых NK-клеток (нормальных киллеров) и ЦТЛ (цитотоксических лимфоцитов).
Другим и, по-видимому, более важным фактором защиты организма-хозяина от вирусных инфекций является продукция им интерферона. Действительно, клеточный и особенно гуморальный иммунные ответы – слишком медленные, чтобы защитить организм от быстро реплицирующихся вирусов, особенно в том случае, когда не было предварительного контакта его с вирусом. В этом отношении более мобильной является система интерферона.
В 1957 г. английский вирусолог А. Айзекс совместно со своим стажером из Швейцарии Д. Линденманном обнаружили, что заражение некоторых клеток вирусом делает их и соседние с ними клетки менее восприимчивыми к последующему заражению тем же или другим вирусом. Затем было установлено, что это явление связано с образованием в зараженной клетке особого вещества белковой природы – интерферона. В настоящее время известно, что интерфероны относятся к важнейшим факторам неспецифической резистентности клетки и организма.
Общепринято следующее определение: интерфероны – это гетерогенный класс гормоноподобных белков, которые продуцируются клетками позвоночных (от рыб до человека включительно) в ответ на вирусную инфекцию или воздействие различных агентов (индукторов) и осуществляют в организме функции, направленные на сохранение гомеостаза.
Несмотря на такой обобщенный характер определения, оно указывает на два кардинальных свойства интерферо- нов, а именно:
- интерфероны – это биологически активные белки;
- для образования их в клетке необходима специальная индукция.
Когда вирус инфицирует клетку, это вызывает ответную защитную реакцию в форме синтеза интерферона. О значении интерферона свидетельствует тот факт, что у экспериментальных животных, которым после заражения вирусами вводят антисыворотку против интерферона, вирусные инфекции протекают гораздо тяжелее, чем у контрольных животных, инфицированных теми же вирусами.
Система интерферона включает в себя три взаимосвязанных звена: индукцию, продукцию и действие.
Индукция интерферона может осуществляться многочисленными природными и синтетическими веществами, которые, в свою очередь, подразделяют на высоко- и низкомолекулярные индукторы. В настоящее время известны сотни таких индукторов. Индукторами интерферона являются: метилированный альбумин, гистоны, некоторые гормоны, антибиотики и т.д. Наиболее активные индукторы – двухцепочечные природные и синтетические полирибонуклеотиды. Характерно, что синтез интерферона способны стимулировать не только инфекционные, но нередко и инактивированные вирусы.
Наибольший индуцирующий эффект проявляют вирусы с медленным репликативным циклом, например, парамиксо- и альфавирусы. Слабыми индукторами являются вирусы, выраженно блокирующие синтез клеточных мРНК и протеинов, например, герпес- и аденовирусы.
В отсутствии индукторов клеточные гены, кодирующие синтез интерферонов, обычно не экспрессируются. Предполагается, что в результате взаимодействия индуктора с цитоплазматической мембраной происходит дерепрессия генов интерферона согласно модели репрессии-дерепрессии Жакоба и Моно, разработанной для синтеза ин- дуцибельных ферментов у бактерий. Непременное условие для запуска синтеза интерферонов – сохранение способности клетки к синтезу белка вообще. При этом похоже, что прямого взаимодействия индукторов с репрессорами интерфероновых генов нет, поскольку показано, что, например, высокомолекулярные индукторы (а также иммобилизованные низкомолекулярные) в клетки не проникают.
Продукция интерферона является результатом транскрипции гена интерферона с последующей трансляцией мРНК клеточной белоксинтезирующей системой. После соответствующего процессинга интерферон секретируется в окружающую среду.
Интерфероны подразделяются на три антигенных типа: а, (3 и у.
Интерферон-а – лейкоцитарный интерферон – продуцируется преимущественно лейкоцитами периферической крови. Имеется, по крайней мере, 15 молекулярных видов этого интерферона, некоторые из них отличаются лишь по одной аминокислоте. Все гены (около двадцати), кодирующие интерферон-а, у человека локализуются на 9-й хромосоме. Основными индукторами являются вирусы, природные и синтетические полинуклеотиды. Зрелый белок (молекулярная масса 17 ООО) содержит 143 аминокислоты.
Интерферон-β – фибробластный интерферон – продуцируется преимущественно фибробластами при использовании тех же индукторов, которые вызывают синтез ин- терферона-а. Способность к образованию этого интерферона кодирует единственный ген, также расположенный на 9-й хромосоме. Зрелый белок состоит из 145 аминокислот и, в отличие от интерферона-а, гликозилирован.
Интерферон-у – иммунный интерферон – продукт стимулированных Т-лимфоцитов, нормальных киллеров и (возможно) макрофагов. Способность к образованию кодирует один ген 12-й хромосомы. Зрелый белок содержит 146 аминокислот и гликозилирован. По первичной структуре имеет очень мало общего с описанными выше интер- феронами а и (3. Этот вид интерферона до сих пор остается наименее изученным.
Основные биологические свойства иитерфероиов
Противовирусная активность (наиболее детально изученное биологическое свойство итерферонов) имеет следующие основные черты:
- универсальность – интерфероны активны против широкого круга как РНК-, так и ДНК-содержащих вирусов;
- видоспецифичность – каждый биологический вид продуцирует свои уникальные белки, порой весьма похожие по структуре и физико-химическим свойствам, но не способные проявлять антивирусное действие в условиях организма другого вида. Другими словами, интерфероны высокоактивны только в гомологичных системах и слабоактивны (или неактивны) в гетерологичных. Так, огромное количество интерферона, выделенного из мышиной ткани, оказывается неспособным защищать от вирусов ткань куриных фибробластов, и наоборот;
- последействие – даже после удаления интерферона в обработанных им клетках сохраняется способность подавлять репродукцию вирусов в течение довольно длительного времени;
- внутриклеточную точку приложения – интерферон не действует непосредственно на вйрионы или их нуклеиновые кислоты, а подавляет процесс их внутриклеточной репродукции.
Развитие индуцируемого интерфероном состояния противовирусной резистентности имеет характерную динамику. Резистентность начинает отмечаться спустя 1,5-2 ч после контакта клетки с интерфероном и достигает максимума к 5-6 ч. При этом достигаемый уровень резистентности зависит от сочетания таких параметров, как концентрация интерферона, время его добавления по отношению к началу вирусной инфекции, множественность заражения и т.д.
Интерферон обладает обширным спектром непротивовирусных эффектов. Из них наиболее важными считаются антипролиферативный, иммуномодуляторный и радио- протекторный.
Механизмы действия интерферона
Эксперименты показали, что антивирусным эффектом обладает непроникающий в клетки комплекс интерферона с высокополимерным углеводом – сефарозой. Следовательно, стадия проникновения интерферона в соседнюю клетку для придания ей антивирусного состояния не является необходимой. В настоящее время установлено, что для активирования генов, ответственных за развитие антивирусного состояния, достаточно интерферону адсорбироваться на специальных рецепторах, локализующихся на клеточных мембранах.
Как отмечалось выше, интерферон не действует на вирионы или выделенную из них РНК, а действует лишь на вегетативную форму вирусов. Причем тот факт, что ингибирующий эффект обнаруживается даже при использовании для заражения клеток инфекционных РНК, служит доказательством того, что интерферон не затрагивает ранние фазы размножения вирусов – адсорбцию, проникновение и раздевание.
Многочисленными экспериментами доказано, что основной эффект интерферона заключается в нарушении способности вирусных мРНК транслироваться. К такому результату действия интерферона приводят следующие биохимические события.
Интерферон активирует ряд генов. Некоторые из них кодируют образование ферментов с прямым антивирусным действием – РНК-активируемой протеинкиназы (рис. 3.13) и 2’-5’-олигоаденилатсинтетазы (рис. 3.14). Индуцируемая протеинкиназа обладает способностью фосфорилировать в белках остатки серина и треонина. При связывании с двухцепочечной вирусной РНК она активируется, аутофосфорилируется, а затем фосфорилирует белковый фактор eIF2a. В норме eIF2a в комплексе с ГТФ заставляет мет-тРНК связаться с 40S рибосомальной субъединицей, что инициирует синтез белка. Фосфорилирование фактора инициации трансляции eIF2a приводит его к инактивации, вследствие чего рассматриваемая стадия синтеза белка блокируется. При этом избирательное подавление трансляции вирусных матриц обусловлено, по-видимому, несколько большей чувствительностью вирусной системы трансляции к фосфорилированию упомянутого фактора.

Рис. 3.13. Механизм действия интерферона, опосредованный индукцией протеинкиназы

Рис. 3.14. Механизм действия интерферона, опосредованный индукцией 2*-5’-олигоаденилатсинтетазы
2 , -5’-олигоаденилатсинтетаза активируется в присутствии двухцепочечной РНК и полимеризует из АТФ семейство олигоаденилатов с общей формулой (2’-5’)рррА(рА)д. В молекулах этих соединений остатки аденозина соединены друг с другом не обычными (3’-5’-, как в РНК), а так называемыми изомеризованны- ми 2’-5’-фосфодиэфирными связями. Для обозначения важнейшего (наиболее активного) из них – тринуклеотида (2’-5’)рррА(рА)2 – принято сокращение 2’-5’А (рис. 3.15).

Образовавшийся 2’-5’А активирует латентную (неактивную) РНКазу-L, присутствующую в клетках, не обработанных интерфероном. Наконец, активированная РНКаза-L разрушает свободные (не связанные с рибосомами) вирусные и клеточные РНК.
Блокирование стадии инициации трансляции мРНК и разрушение самих мРНК обусловливает универсальный механизм действия интерферона. Следует отметить, что платой за такую универсальность является приостановка в клетке-хозяине биосинтеза белка вообще. С этим, кстати, связан антипролиферативный эффект интерферона. Таким образом, отрицательный эффект действия интерферона имеет и положительную сторону – подавление опухолевого роста.
Следует отметить, что интерферон может воздействовать и на другие стадии вирусной репродукции. Например, в ряде случаев происходит блокирование депротеи- низации нуклеокапсида (стадии раздевания вириона) или выхода зрелых вирусных частиц из клетки-хозяина.
Далее а- и б-интерфероны (но не у-интерферон) активируют один из генов, находящихся на 21-й хромосоме человека. Продукт экспрессии этого гена – белок Мх – ингибирует транскрипцию генома вируса гриппа (но не других вирусов!). Точный механизм ингибирования пока не расшифрован.
Общепринято, что система интерферона представляет собой один из основных факторов, обусловливающих выздоровление человека от вирусных инфекций. Например, при отсутствии осложнений больные гриппом выздоравливают обычно спустя 3 дня. В то же время иммунитет (даже обусловленный выработкой в организме иммуноглобулинов класса IgM) развивается не ранее чем через 4-5 дней.
Справедливости ради необходимо отметить, что, несмотря на то что система интерферона является довольно мощной (причем широко специфичной и поэтому, казалось бы, надежной) защитной системой клетки, некоторым вирусам удается с легкостью преодолевать этот эшелонированный защитный редут. Среди таких вирусов можно упомянуть вирус осповакцины, который в значительной мере устойчив к действию интерферона. Исследования показали, что эта устойчивость обусловлена тем, что вирус сам способен направлять синтез белка, по первичной структуре гомологичного клеточному белку eIF2, и таким образом в значительной мере нивелировать действие интерферониндуцированной клеточной протеин- киназы.
Реовирусный капсидный белок оЗ экранирует молекулы двухцепочечных РНК, препятствуя активации РНК- активируемой протеинкиназы.
При транскрипции ДНК аденовирусов синтезируются две небольшие молекулы РНК, которые не кодируют никакой информации и обладают двухспиральной структурой. Эти короткие РНК прочно связываются с РНК-активируемой протеинкиназой, что ингибирует ее активность.
В цикле репликации вируса Эпштейна-Барр также есть такие короткие РНК, которые защищают вирус от действия интерферона.
Препараты этой группы используются для профилактики и лечения вирусных заболеваний. Они могут связывать вирусы в крови (до внедрения в клетки макроорганизма), блокировать проникновение их в клетку, угнетать созревание вирусов (в клетке), повышать резистентность клеток макроорганизма к вирусам.
До внедрения в клетку макроорганизма вирусы представляют собой нуклеиновую кислоту, окруженную белковой оболочкой. В этот период они мало чувствительны к химиотерапевтическим препаратам. Сбрасывая оболочку, вирус проникает в клетку макроорганизма и модифицирует ее биосинтез. Являясь паразитами, они используют биосинтетическую систему клетки. Поэтому избирательно действующие противовирусные средства с большой широтой терапевтического действия весьма немногочисленны. Обычно величины концентраций, воздействующих на вирус и на клетки макроорганизма, весьма близки, и большинство препаратов этой группы применяется местно.
Средства, оказывающие влияние на вирус до его внедрения в клетку, используются для профилактики вирусных инфекций.
Оксолин убивает вирусы гриппа и герпеса. Его используют наружно в виде мази для профилактики и лечения аденовирусных
инфекций и герпеса в офтальмологии, оториноларингологии, дерматологии. Оксолин раздражает ткани и может вызывать чувство жжения на месте применения.
Для профилактики и лечения начальной стадии гриппа можно использовать римантадин (ремантадин), затрудняющий проникновение вирусов в клетку. Препарат применяется внутрь. У некоторых пациентов вызывает боль в желудке.
Метисазон угнетает репродукцию вирусов оспы и герпеса. У некоторых пациентов при его применении наблюдается тошнота рвота, головокружение, что требует снижения дозы.
Для профилактики и лечения вирусных инфекций используются также обладающие видовой специфичностью к клеткам макроорганизма интерфероны - биогенные вещества, продуцируемые в клетках человека и животных в ответ на внедрение вирусов. Они нарушают процесс репликации вирусов и являются одним из факторов неспецифического иммунитета, придавая клеткам частичную или полную резистентность к вирусным инфекциям. В клинике используют интерферон человеческий лейкоцитарный (реаферон) и препарат интерлок, активным началом которого является интерферон. Реаферон применяют внутримышечно и местно при вирусных и опухолевых заболеваниях. .
Есть противовирусные препараты, воздействующие только на ферменты, индуцируемые в клетках макроорганизма вирусами. Так, ацикловир (зовиракс, виролекс), проникая в клетку микроорганизма, ингибирует вирусную ДНК-полимеразу и предотвращает синтез вирусной ДНК, то есть останавливает размножение вируса, не влияя на процессы, происходящие в клетках макроорганизма. Он наиболее эффективен в отношении вируса герпеса. Применяется внутривенно, внутрь и местно. В качестве побочных эффектов могут развиваться тошнота, рвота, понос, головная боль, аллергические реакции.
Назначают внутрь (после еды).
Выпускается в таблетках по 0,05 г.
Выпускается 0,25%, 0,5%, 1%, 2%, 3% мазь и порошок (для приготовления растворов).
Применяется внутрь, внутривенно и наружно.
Выпускается во флаконах по 0,25 г, в таблетках по 0,2 г; в виде 3% мази и 5% крема.
Лекарства для лечения вирусных инфекций
Вирусы состоят в основном из генетического материала (нуклеиновой кислоты) и защитной оболочки, образованной белками, которая часто покрыта фосфолипидным бислоем со встроенными белками. У них отсутствует метаболическая система, а рост и репликация зависят от инфицированной клетки.
Целенаправленная терапевтическая супрессия репликации вируса достигается за счет ингибирования метаболических процессов, которые являются специфическими для вирусной репликации в инфицированных клетках.
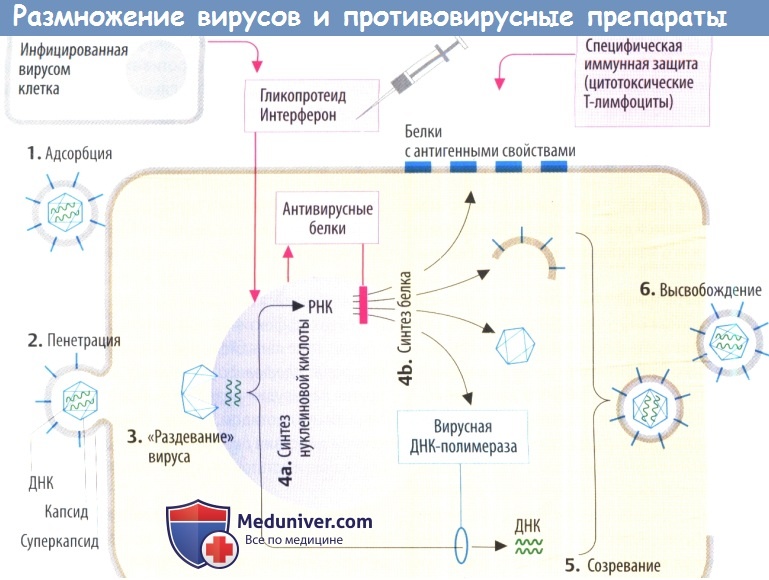
II. Противовирусные механизмы. Организм нарушает репликацию вируса с помощью цитотоксических Т-лимфоцитов, которые распознают и разрушают вируспродуцирующие клетки (на их поверхности находятся вирусные белки) или с помощью антител, которые связывают и инактивируют внеклеточные вирусные частицы. Вакцинация разработана с целью запуска специфической иммунной защиты.
а) Интерфероны (IFN) — гликопротеиды, которые в отличие от других препаратов высвобождаются из инфицированных вирусом клеток. В соседних клетках интерферон стимулирует образование антивирусных белков. Они ингибируют синтез вирусных белков за счет (предпочтительного) разрушения вирусной ДНК или ингибирования трансляции. Интерфероны не направлены против конкретного вируса, а имеют широкий спектр антивирусной активности, который, тем не менее, является видоспецифическим.
Следовательно, интерферон для использования у человека необходимо получать из его клеток, а именно лейкоцитов (IFN-a), фибробластов (IFN-β; или лимфоцитов (IFN-y). Интерфероны используются при лечении определенных вирусных заболеваний, а также злокачественных новообразований и аутоиммунных расстройств. Например, IFN-a применяется при хроническом гепатите С, волосатоклеточном лейкозе и рассеянном склерозе.
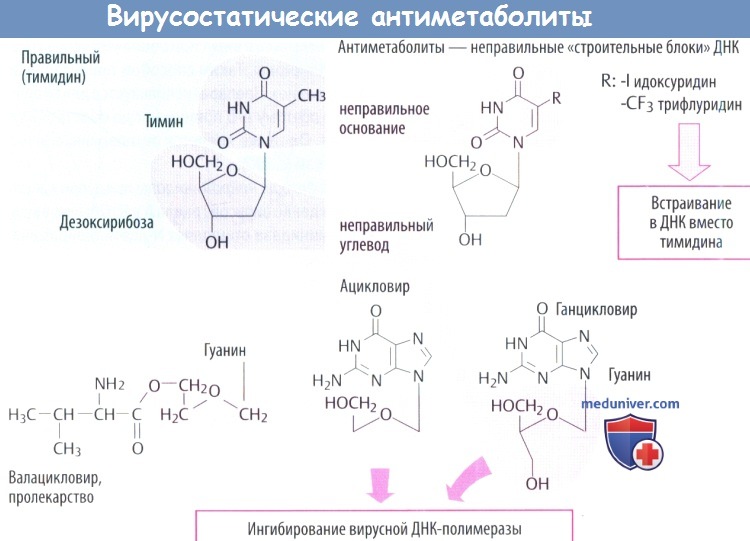
в) Идоксуридин и синергисты встраиваются в ДНК с отрицательными последствиями, в т. ч. нарушением синтеза ДНК человека. Поэтому идоксуридин и аналоги подходят только для местного использования (при простом герпетическом кератите).
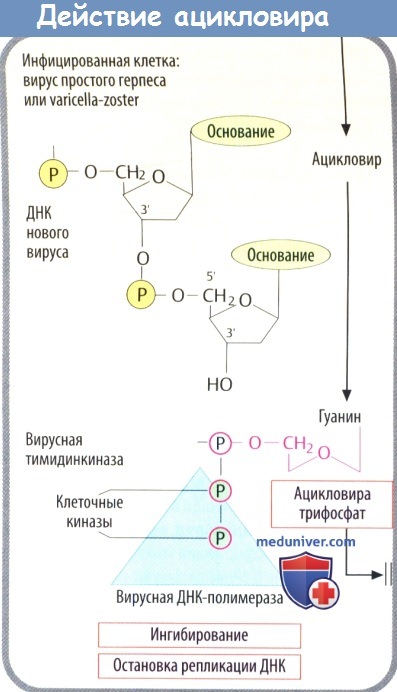
г) Среди вирусостатических антиметаболитов ацикловир имеет высокую специфичность, т. к. его биоактивация происходит только в инфицированных клетках, где он предпочтительно ингибирует синтез вирусной ДНК.
1. Кодируемая вирусом тимидинкиназа (специфичная для вирусов простого герпеса и ветряной оспы) осуществляет первый этап фосфорилирования. Два других фосфатных остатка присоединяются клеточной киназой.
2. Полярные фосфатные остатки делают мембрану непроницаемой для ацикловира трифосфата, что приводит к его накоплению в инфицированных клетках.
3. Ацикловира трифосфат является предпочтительным субстратом вирусной ДНК-полимеразы. Он ингибирует активность ферментов, а после встраивания в вирусную ДНК вызывает расщепление нити, т. к. у него отсутствует З'-ОН-группа дезоксирибозы, которая необходима для присоединения дополнительных нуклеотидов. При тяжелых инфекциях, вызванных вирусом простого герпеса (энцефалит, генерализованная инфекция) и вирусом ветряной оспы (тяжелый опоясывающий лишай), его вводят в виде в/в инфузии.
Ацикловир также применяют внутрь, несмотря на неполное (15-30%) кишечное всасывание. Кроме того, он используется местно.
г) У валацикловира гидроксильная группа этерифицирована с аминокислотой L-валином. Это позволяет использовать дипептидный переносчик тонкой кишки, что почти удваивает скорость кишечного всасывания препарата по сравнению с ацикловиром. В дальнейшем при отщеплении остатка валина образуется ацикловир.
д) Ганцикловир используется при лечении тяжелых цитомегаловирусных инфекций (тоже принадлежащих к группе герпеса). Они не образуют тимидинкиназу, поэтому фосфорилирование начинается другим вирусным ферментом. Ганцикловир хуже переносится, нередко приводит к развитию лейкопении и тромбопении. Он вводится в виде инфузии или внутрь как эфир валина (валганцикловир).
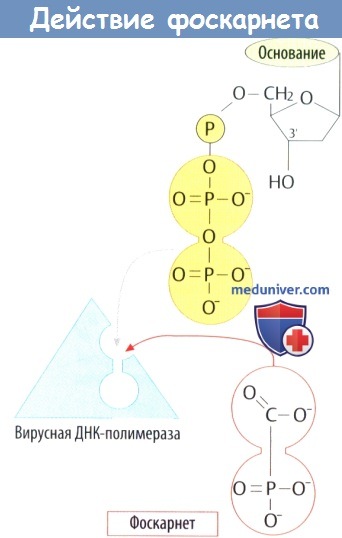
е) Фоскарнет представляет собой аналог дифосфата. Встраивание нуклеотида в нить ДНК приводит к отщеплению дифосфатного остатка. Фоскарнет ингибирует ДНК-полимеразу за счет взаимодействия со связывающим участком. Показания: системная терапия тяжелых цитомегаловирусных инфекций у больных СПИДом; местное лечение герпесвирусных инфекций.
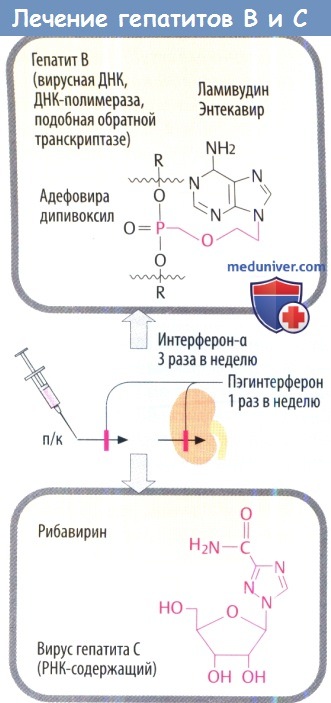
ж) Препараты для лечения вирусных гепатитов. Интерферон-а действует против вирусов гепатитов В и С (HBV, HCV) во время репликации. Присоединение молекулы полиэтиленгликоля к IFN-a (пегилирование) позволяет пегилированному IFN-a медленнее высвобождаться из места инъекции и выводиться почками, что увеличивает продолжительность действия пегилированного препарата.
Вирусостатические антиметаболиты необходимо рассматривать индивидуально в зависимости от возбудителя. Гепатит В: ламивудин, первоначально использовавшийся только как анти-ВИЧ препарат, в низких дозах эффективен против HBV. Телбивудин и энтекавир тоже являются производными нуклеозидов. Фосфонат адефовира дипивоксил, который активен против ламивудин-резистентного HBV, является атипичным нуклеотидом. Гепатит С: молекулярный механизм действия рибавирина, в котором изменены основание и остаток сахара (D-рибоза), неясен.
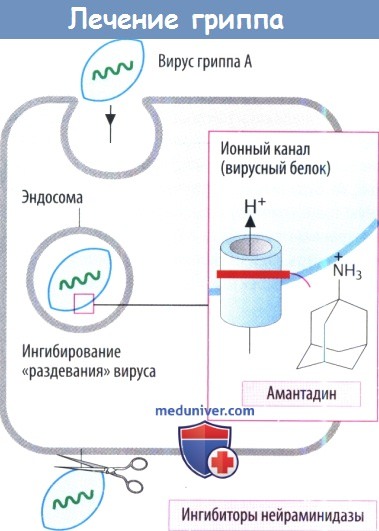
Препарат используется для профилактики, и поэтому его принимают до обострения симптомов. Он также является антипаркинсоническим средством.
Ингибиторы нейраминидазы предупреждают высвобождение вирусов гриппа А и В. Обычно вирусная нейраминидаза отщепляет N-ацетилнейраминовые (сиаловые) кислотные остатки на поверхности клеточной оболочки, что дает возможность вновь образованным вирусным частицам отделиться от клетки хозяина. Занамивир вводится в виде ингаляции. Оселтамивир подходит для применения внутрь, т. к. представляет собой сложный эфир пролекарства. Он используется при лечении и профилактики инфекций, вызванных гриппом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Нейтрализация вирусов. Нейтрализация аденовирусов и вирусов гриппа в организме.
Нейтрализующие антитела являются одними из основных средств защитного иммунитета, развивающегося в результате вакцинации или инфицирования. Во взаимодействии нейтрализующих антител с вирусными антигенами много неясного. Вместе с тем, каков бы ни был механизм нейтрализации, несомненно то, что прикрепление нейтрализующих антител к вирусным частицам ведет к потере инфекционности. Однако для достижения нейтрализации требуется нечто большее, чем просто связывание антитела с поверхностью вируса. Применительно к некоторым вирусам можно различить нейтрализующие и не нейтрализующие антитела, направленные на различные белки. Более того, имеются антитела, связывающиеся с вирусными антигенами, ответственными за нейтрализацию (например, вируса гриппа или полиовируса), но не вызывающие потери инфекционности.
Оказалось, что для нейтрализации оболочечных и безоболочечных вирусов достаточно относительно небольшого количества молекул антител. Так, для нейтрализации 50% вируса гриппа требовалось около 50 молекул антител к НА-антигену, а для достижения такого же эффекта нейтрализации полиовируса оказалось достаточным присоединения одной молекулы на одну вирусную частицу. Если учесть, что на поверхности вируса гриппа имеется около 1000 отростков, содержащих НА, а в капсиде полиовируса — 60 идентичных антигенных субъединиц, то окажется, что нейтрализация вируса достигается достаточно небольшим количеством молекул антител. Вирус гепатита А, в отличие от полиовируса, по-видимому, обладает одним доминантным нейтрализующим участком. Для нейтрализации вирусов достаточно, чтобы к каждой вирусной частице прикреплялась более чем одна молекула антител, но гораздо меньше, чем требуется для полного насыщения эпитопов нейтрализации антителами.
Относительно связывания нейтрализованного вируса с клетками хозяина существуют разноречивые данные. Некоторые нейтрализованные вирусы эффективно связываются с чувствительными клетками (полиовирус, вирусы оспы кроликов, гриппа А), так как места связывания вируса с клеткой отличаются от мест, ответственных за нейтрализацию.
Аденовирусные частицы после нейтрализации антисывороткой к гексону или пентону адсорбировались на клетках HeLa с такой же скоростью, как и необработанные, хотя при этом становились чувствительными к ДНКазе. Антитела к отросткам вириона вызывали агрегацию вирусных частиц и ускоряли в 3-5 раз адсорбцию на клетках. Нейтрализующие антитела лишь частично подавляли прикрепление вируса бешенства к клеткам и его интернализацию. Нейтрализация вируса гепатита В оказалась связанной с блокированием участка прикрепления вируса (пре-SI -антиген) к гепатоцитам. Связывание нейтрализованного вируса с клетками зависит от класса антител. Секреторные IgA и IgM нейтрализуют вирус, препятствуя его прикреплению к клеткам.
Вирус гриппа, обработанный IgG или мономерным IgA, адсорбируется и проникает в клетки с такой же скоростью, как и нативный вирус. Нейтрализация вируса завершается внутриклеточно. Секреторные IgA и IgM полностью блокируют прикрепление вирионов к клеткам. Нейтрализация в этом случае происходит, повидимому, за счет стерического изменения в структуре вирусного капсида. Полагают, что в основе нейтрализации вируса гриппа антителами лежит перестройка поверхностных структур НА, приводящая к нарушению транскрипции генома вируса гриппа в клетках. Нейтрализация вирусов протекает как двухфазный процесс в виде температуронезависимой фазы соединения вируса с антителами и температурозависимой собственно нейтрализации вируса. Она зависит, кроме того, от концентрации антител и их альтернативной антигенной специфичности. Опыты с коронавирусом свиней показали, что с повышением концентрации нейтрализующих антител усиливался антивирусный эффект.
Так, низкие концентрации антител в основном нейтрализовали вирус, средние и высокие, кроме того, подавляли связывание его с клеткой и предотвращали интернализацию.
Для эффективной нейтрализации флавивирусов необходимо связывание антител более чем с одной антигенной детерминантой. Бивалентное связывание антител оказалось важным условием нейтрализации полиовируса и вируса гриппа.
Одновременная обработка вируса ньюкаслской болезни двумя моноклональными антителами к белку HN вызывала более выраженную нейтрализацию по сравнению с действием каждого из них в отдельности. Синергический эффект выявлен при нейтрализации вируса трансмиссивного гастроэнтерита свиней комбинацией двух моноклональных антител, специфичных по отношению к разным антигенным сайтам вирусного гликопротеина.
Антитела к гликопротеину Н вируса простого герпеса нейтрализуют его, препятствуя проникновению адсорбированного вируса в клетку.
Взаимодействие моноклональных и поликлональных антител с полиовирусом, приводящее к нейтрализации инфекционной активности вирионов, сопровождается агрегацией вирусных частиц.
Нейтрализация поликлональными антисыворотками, по-видимому, является суммарным результатом действия различных механизмов нейтрализации, благодаря кооперативному действию антител на различные нейтрализующие детерминанты. Если вирусы имеют немного различных иммунодоминантных детерминант, то в реакции нейтрализации поликлональные сыворотки и моноклональные антитела не будут значительно различаться между собой.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

