Установления наличия вирусов это
Обновлено: 24.04.2024
Главная задача биологии — это развитие представлений у человека о живых организмах, о многообразии видов, обо всех закономерностях развития живых существ, а также об их взаимодействии с окружающей природой. Предмет основы безопасности жизнедеятельности (ОБЖ) позволяет получить знания и умения, которые помогут сохранить жизнь и здоровье в опасных ситуациях. Эти ситуации всегда возникают неожиданно, но, тем не менее, большинство из них предсказуемы и к ним можно подготовиться заранее. ОБЖ учит нас предвидеть возможные опасности и минимизировать потери от той или иной ситуации. Сегодня мы сталкиваемся с новым видом вирусной опасности COVID-19,о котором поговорим с точки зрения биологии и ОБЖ.
Что такое вирус?
Вирус — это неклеточный инфекционный агент. Сегодня нам известно около 6 тысяч различных вирусов, но их существует несколько миллионов. Вирусы не похожи друг на друга и могут иметь как форму сферы, спирали, так и форму сложного асимметричного сплетения. Размеры вирусов варьируются от 20 нм до 300 нм.
Как устроен вирус?
В центре агента находится генетический материал РНК или ДНК, вокруг которого располагается белковая структура — капсид.
Капсид служит для защиты вируса и помогает при захвате клетки. Некоторые вирусы дополнительно покрыты липидной оболочкой, т.е. жировой структурой, которая защищает их от изменений окружающей среды.
Вирусолог Дэвид Балтимор объединил все вирусы в 8 групп, из которых некоторые группы вирусов содержат 1-2 цепочки ДНК. Другие же содержат 1 цепочку РНК, которая может удваиваться или достраивать на своей матрице ДНК. При этом каждая группа вирусов производит себя в различных органеллах зараженной клетки.
Вирусы имеют определенный диапазон хозяев, т.е. он может быть опасен для одних видов и абсолютно безвреден для других. Например, оспой болеет только человек, а чумкой только некоторые виды плотоядных. Вирус не способен выжить сам по себе, поэтому активируется только в хозяйской клетке, используя ее ресурсы и питательные вещества. Цель вируса — создание множества копий себя, чтобы инфицировать другие клетки!
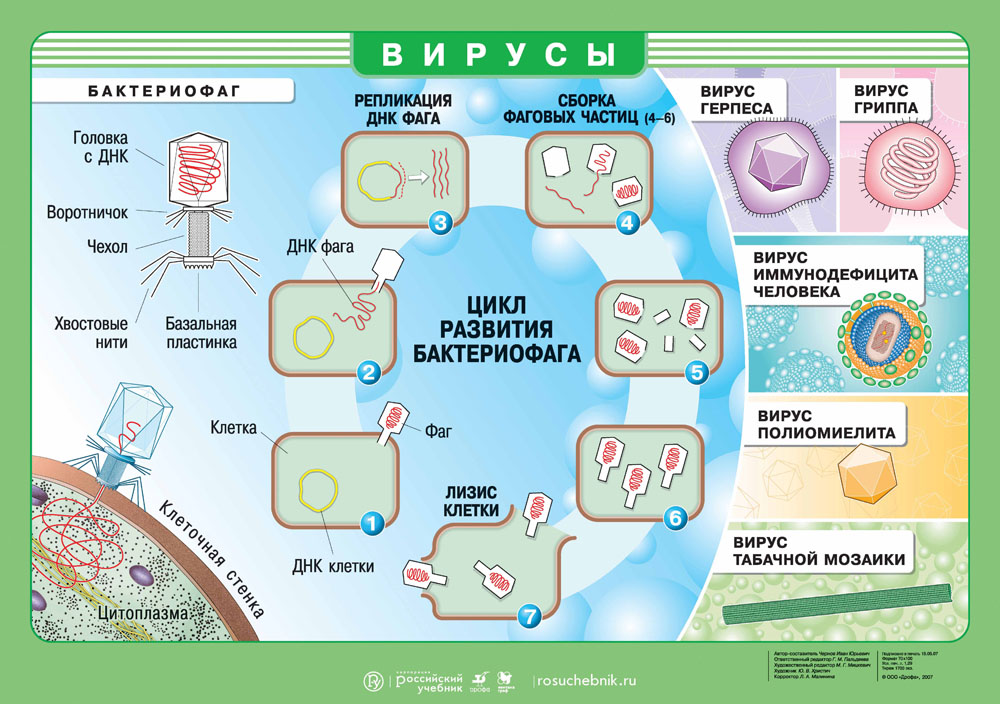
Как вирус попадает в организм?
- через физические повреждения (например, порезы на коже)
- путём направленного впрыскивания (к примеру, укус комара)
- направленного поражения отдельной поверхности (например, при вдыхании вируса через трахею)
- к эпителию слизистых оболочек (это например вирус гриппа)
- к нервной ткани (вирус простого герпеса)
- к иммунным клеткам (вирус иммунодефицита человека)

Геном вируса встраивается в одну из органелл или цитоплазму и превращает клетку в настоящий вирусный завод. Естественные процессы в клетке нарушаются, и она начинает заниматься производством и сбором белка вируса. Этот процесс называется репликацией. И его основная цель — это захват территории. Во время репликации генетический материал вируса смешивается с генами клетки хозяина — это приводит к активной мутации самого вируса, а также повышает его выживаемость. Когда процесс репликации налажен, вирусная частица отпочковывается и заражает уже новые клетки, в то время как инфицированная ранее клетка продолжает производство.
Выход вируса
Вирус создал множество собственных копий, клетка оказывается изнуренной из-за использования ее ресурсов. Больше вирусу клетка не нужна, поэтому клетка часто погибает и новорожденным вирусам приходится искать нового хозяина. Это и есть заключительная стадию жизненного цикла вируса.
Скорость распространения вирусной инфекции
Размножение вирусов протекает с исключительно высокой скоростью: при попадании в верхние дыхательные пути одной вирусной частицы уже через 8 часов количество инфекционного потомства достигает 10³, а концу первых суток − 10²³.
Вирусная латентность
Как вирус распространяется?
- воздушно-капельный (кашель, чихание)
- с кожи на кожу (при прикосновениях и рукопожатиях)
- с кожи на продукты (при прикосновениях к пище грязными руками вирусы могут попасть в пищеварительную и дыхательную системы)
- через жидкие среды организма (кровь, слюну и другие)
Почему с вирусами так тяжело бороться?
Сегодня людям уже удалось победить некоторые вирусы, а некоторые взять под жесткий контроль. Например, Оспа (она же черная оспа). Болезнь вызывается вирусом натуральной оспы, передается от человека к человеку воздушно-капельным путем. Больные покрываются сыпью, переходящей в язвы, как на коже, так и на слизистых внутренних органов. Смертность, в зависимости от штамма вируса, составляет от 10 до 40 (иногда даже 70%), На сегодняшний день вирус полностью истреблен человечеством.
Кроме того, взяты под контроль такие заболевания, как бешенство, корь и полиомиелит. Но помимо этих вирусов существует масса других, которые требуют разработок или открытия новых вакцин.
Коронавирус
Виновником эпидемии, распространяющейся сегодня по миру, стал коронавирус, вирусная частица в 0,1 микрона. Свое название он получил благодаря наростам на своей структуре, своеобразным шипам. Внутри вируса спрятан яд, с помощью которого он подчиняет себе зараженный организм. Этот вирус воздействует не только на человека, но и на птиц, свиней, собак и летучих мышей. В настоящий момент выделяют от 30 до 39 разновидностей коронавирусной инфекции. Но для человека патогенно всего 6. И как любой другой вирус COVID-19 мутирует.

К наиболее распространенным симптомам COVID-19 относятся повышение температуры тела, сухой кашель и утомляемость. К более редким симптомам относятся боли в суставах и мышцах, заложенность носа, головная боль, конъюнктивит, боль в горле, диарея, потеря вкусовых ощущений или обоняния, сыпь и изменение цвета кожи на пальцах рук и ног. Как правило, эти симптомы развиваются постепенно и носят слабо выраженный характер. У некоторых инфицированных лиц болезнь сопровождается очень легкими симптомами.
Сколько же может жить этот вирус вне организма? Все зависит от типа вируса и от той поверхности, на которую вирусы попали. В качестве примера было рассмотрено 3 вируса, по которым велись исследования. Изучали время, на которое может задерживаться вирус на различных поверхностях. Данные приведены в таблице.

Поскольку пока не изобретено вакцины от COVID-19, в целях защиты от инфекции самым важным для нас является соблюдение гигиены.
Гигиена — раздел медицины, изучающий влияние жизни и труда на здоровье человека и разрабатывающая меры (санитарные нормы и правила), направленные на предупреждение заболеваний, обеспечение оптимальных условий существования, укрепление здоровья и продление жизни.
Сегодня следует соблюдать определенные правила гигиены:
- Соблюдение режима труда и отдыха, не допускающего развития утомления и переутомления.
- Выполнение условий, обеспечивающих здоровый и полноценный сон (свежий воздух, отсутствие шума, удобная постель, оптимальная продолжительность).
- Правильное здоровое питание в соответствии с потребностями организма.
- Комфортный микроклимат в жилище (температура, влажность и подвижность воздуха, естественная и искусственная освещенность помещений).
- Содержание в чистоте тела и тщательный уход за зубами.
- Спокойное и корректное поведение в конфликтных ситуациях.

ИДЕНТИФИКАЦИЯ ВИРУСОВ (позднелат. identificare отождествлять; вирусы) — определение родовой и видовой принадлежности вирусов, установление их тождественности или отличия при сопоставлении с уже известными вирусами.
И. в. является заключительным этапом при лабораторной диагностике вирусных заболеваний; широко проводится также при эпидемиол, исследованиях и при работе в области теоретической вирусологии.
И. в. осуществляется путем изучения их морфологии, физ.-хим. свойств, биол, особенностей и антигенной структуры; ее проводят на основе существующей классификации вирусов. При И. в. сначала определяют их принадлежность к определенной классификационной группе. Если группа представляет собой семейство, дополнительно определяют род вируса (напр., принадлежность изучаемого пикорнавируса к энтеро- или риновирусам). Далее устанавливают вид вируса, а для видов, подразделяющихся на типы (напр., вирусы полиомиелита, гриппа), также их тип.
Групповая принадлежность вируса обусловливается видом входящей в его состав нуклеиновой к-ты и ее мол. весом, местом формирования (сборки) капсида в клетке, числом капсомеров, видом симметрии нуклеокапсида, наличием или отсутствием оболочки, липидов, размерами вириона. Практически для И. в. обычно достаточно определения лишь нескольких, наиболее важных из перечисленных показателей.
После установления рода определяют вид вируса (а для определенных вирусов также тип) путем изучения его антигенной структуры с помощью иммунных сывороток к типичным представителям различных видов (и типов) вирусов данного рода. Реже с той же целью используют другие методы.
Наиболее сложной является И. в., которые по своим характеристикам не могут быть отнесены ни к одной из существующих классификационных групп. Очень ответственным является заключение, что изучаемый вирус отличен от всех известных; оно может быть сделано лишь после изучения всего комплекса его свойств.
И. в., как правило, проводится после их размножения в лаборатории, поэтому для исследования берутся органы зараженных животных, ткани и жидкости эмбрионов птиц, питательная среда или клетки инфицированных клеточных и тканевых культур. Если вирус не удается культивировать в лабораторных условиях, то для И. в. используют материал, взятый непосредственно от больного или погибшего организма.
Размеры вируса наиболее точно определяют при помощи электронной микроскопии (см.), к-рая одновременно дает возможность получить сведения о структуре вириона. Для электронномикроскопического исследования необходимо иметь высокоочищенный и конц. материал. Для этой цели предпочтительно использовать скоростное центрифугирование в градиенте плотности сахарозы (см. Ультрацентрифугирование), что позволяет не только очистить вирус от балластных веществ, но при наличии в материале нескольких вирусов и разделить их, если они отличаются по величине.
При некоторых вирусных инфекциях с целью быстрой диагностики электронноскопически исследуют материал, взятый без предварительной обработки непосредственно от больного (напр., содержимое пустул для дифференциации оспы и ветрянки). Метод этот находит все более широкое применение при диагностике вирусных инфекций.
Определение размеров вирусов с помощью фильтрации через целлюлозные мембранные фильтры (см. Ультрафильтрация, в вирусологии) является менее точным. Необходимо иметь набор фильтров с различным диаметром пор. Далее для каждого фильтра должен быть определен поправочный коэффициент адсорбции, показывающий соотношение между диаметром пор и максимальным размером вирионов, которые могут через них проходить. С этой целью фильтр калибруют, используя частицы известной величины. Исследуемый материал должен быть освобожден от грубых частиц путем пропускания через стерилизующий фильтр или центрифугирования в течение 10—15 мин. при скорости 2000— 3000 об/мин. Для уменьшения адсорбции вируса предварительно фильтруют какое-либо капиллярноактивное вещество (бульон, р-р пептона и т. п.) или его прибавляют к вирусной взвеси. Фильтрацию материала выполняют последовательно, начиная с наиболее крупнопористого фильтра. Размер вируса получают путем умножения величины пор мембраны, частично его задерживающей, на коэффициент адсорбции для фильтра данной пористости.
Для определения типа входящей в состав вируса нуклеиновой к-ты ее выделяют путем обработки вирусной взвеси водонасыщенным фенолом, анионными детергентами, напр, додецилсульфатом натрия и другими, с последующим хим. анализом. Если вирус размножается в культурах клеток, тип нуклеиновой к-ты часто определяют косвенным методом, который основан на способности галоидопроизводных дезоксиуридина, в частности 5-бром-2-дезоксиуридина, избирательно подавлять размножение ДНК-содержащих вирусов и не влиять на репродукцию большинства РНК-содержащих. Препарат вносят в питательную среду в дозе от 40 до 100 мкг/мл при заражении клеточной культуры вирусом.
Ориентировочные данные о типе нуклеиновой к-ты вирусов можно получить по окраске инфицированных клеток флюорохромами, напр, акридином оранжевым (его используют в разведении 1:10000 — 1:20000 в изотоническом р-ре хлорида натрия с фосфатным буфером pH 7,2—7,4). При соединении с РНК акридин оранжевый флюоресцирует красным, а после реакции с ДНК — зеленым. Этот метод позволяет определить тип нуклеиновой к-ты вирусных компонентов в местах их скоплений внутри клеток. На нем основан метод дифференциальной диагностики ряда респираторных инфекций: делают мазок-отпечаток с нижней носовой раковины больного; после окраски акридином оранжевым внутриклеточные включения вирусов гриппа и парагриппа начинают светиться красным, а при аденовирусной инфекции и герпесе — зеленым.
Наличие или отсутствие в оболочке вирусов липидов устанавливают по чувствительности к действию растворителей липидов, напр, эфира. Вирусную взвесь соединяют с равным объемом эфира, встряхивают в течение 20 мин. при комнатной температуре, затем выдерживают 18—20 час. при t° 4° в плотно закрытой посуде. Далее пробу наливают в чашку Петри и выдерживают для испарения эфира 30 мин. при t° 36—37°, после чего ее титруют параллельно с необработанным материалом для определения количества вируса. При наличии в оболочке вируса липидов он при воздействии эфира инактивируется.
Проведение этих исследований обычно позволяет отнести изучаемый штамм к определенной классификационной группе или к числу неклассифицированных вирусов. Дальнейшую И. в. проводят внутри группы путем их сопоставления с типичными представителями отдельных видов. В ряде случаев исследования внутри группы могут быть ограничены. Так, вирусы семейства пикорна испытывают на устойчивость в кислой среде. Риновирусы при pH 3,0—5,3 в течение 1 — 3 час. инактивируются, в то время как энтеровирусы сохраняют свою инфекционность.
И. в. с помощью серол, реакций проводят путем их испытания с сыворотками к известным вирусам или, наоборот, приготовленные к изучаемым штаммам иммунные сыворотки испытывают с известными вирусами.
Серол, идентификацию нередко осуществляют в два этапа. Сначала вирус изучают в реакции связывания комплемента (см.), или, если он обладает гемагглютинирующей активностью, в реакции торможения гемагглютинации (см.), а затем с помощью реакции нейтрализации. РСК в отношении многих вирусов не является строго специфичной. Так, аденовирусы человека и большинства животных имеют общий комплементсвязывающий антиген. Общий антиген имеют все известные реовирусы. В отношении других вирусов, напр, вирусов гриппа, РСК более специфична и позволяет определить их типовую принадлежность. То же самое относится к РТГА: она позволяет определить тип реовируса и очень специфична в отношении вирусов гриппа, но в то же время дает групповые реакции при идентификации тогавирусов.
Наиболее специфичной является реакция нейтрализации: в большинстве случаев она позволяет установить как видовую, так и типовую принадлежность вируса (для видов, подразделяющихся на типы). Ее осуществляют различными способами. Чаще всего готовят смесь вируса с сывороткой, к-рую затем испытывают тем или иным способом на наличие ненейтрализованного вируса.
Значительно реже И. в. проводят путем перекрестного испытания иммунитета: животных иммунизируют неизвестным вирусом, а затем заражают известным или наоборот.
Весьма широко для И. в. используют иммунофлюоресценцию (см.). Чаще всего инфицированные неизвестным вирусом клеточные культуры исследуют с флюоресцирующим иммуноглобулином к известному вирусу. Реже исследуют т. о. материал от больных (мазки из глотки при гриппе, мозг больных подострым склерозирующим панэнцефалитом на коревой антиген, мозг погибших от бешенства).
Преципитацию в агаре используют для И. в. довольно редко. В материале из кожных поражений больных оспой этим методом можно обнаружить вирусный антиген.
Некоторые виды вирусов пе удается достаточно четко дифференцировать путем изучения их антигенной структуры. В таких случаях прибегают к дополнительным тестам — определяют патогенность для животных, размножение в различных клеточных культурах и др. Т. о., напр., идентифицируют вирусы оспенной группы. Возбудитель натуральной оспы не вызывает поражений на скарифицированной коже кролика и не размножается в культурах клеток при t° выше 38,5°. В то же время вирусы осповакцины и оспы коров вызывают изменения на коже кролика и размножаются при t° до 40°. Отличаются вирусы также по морфологии поражений на хорионаллантоисной оболочке куриного эмбриона.
Библиография: Гайдамович С. Я. Классификация и идентификация арбовирусов, Вестн. АМН СССР, № б, с. 25, 1972; Лабораторная диагностика вирусных и риккетсиозных заболеваний, под ред. Э. Леннета и Н. Шмидт, пер. с англ., М., 1974; Лурия С. и Дарнелл Дж. Общая вирусология, пер. с англ., М., 1970; Соколов М. И., С и н и ц к и й А. А. и P е-м e з о в П. И. Вирусологические и серологические исследования при вирусных инфекциях, Л., 1972.
ПЕРСИСТЕНЦИЯ ВИРУСОВ (лат. persistere оставаться, упорствовать; вирусы) — длительное сохранение вируса в организме хозяина или в клеточной культуре.
При острой инф. болезни время пребывания вируса в организме определяется длительностью инкубационного периода и периода неосложненного клин, течения болезни. Сохранение вируса дольше этого срока представляет собой П. в.; в ряде случаев П. в. длится месяцами и годами, иногда всю жизнь.
В зависимости от наличия или отсутствия внешних проявлений феномена персистенции патогенных или потенциально патогенных вирусов различают: латентные вирусные инфекции (см.) с периодическими обострениями (или без них), в промежутках между ними вирус не обнаруживается; хронические вирусные инфекции с постоянно выделяющимся вирусом, более или менее выраженными признаками заболевания организма (или поражения клеток); медленные вирусные инфекции (см.), характеризующиеся длительным, иногда многолетним инкубационным периодом с последующим неуклонным развитием заболевания, приводящего к гибели организма. Ряд исследователей включает в эту классификацию группу персистентных вирусных инфекций, протекающих бессимптомно, не сопровождающихся постоянным выделением в окружающую среду вируса. П. в., протекающую без симптомов или с мало выраженными признаками поражения, называют также вирусоносительством (см. Носительство возбудителей инфекции). В 1963 г. Смит (W. Smith) выделил в качестве особой формы П. в. вирусный симбиоз — ассоциацию непатогенного вируса с клетками хозяина, представляющую взаимную выгоду для того и другого; существование этой формы П. в. признается не всеми. Границы между разными проявлениями феномена П. в. в значительной мере условны.
Определение П. в. и исследование механизмов персистенции являются основой для изучения этиологии и патогенеза ряда вирусных заболеваний, что позволяет разрабатывать эффективные меры их профилактики и лечения. П. в: может играть роль в формировании невосприимчивости организма к вирусной инфекции за счет интерференции вирусов (см.), продукции интерферона (см.) и антител (см.), повышения неспецифической резистентности организма (активизации фагоцитоза, специфической сенсибилизации организма). Особую эпидемиол, опасность представляют персистентные вирусные инфекции, при которых в окружающую среду выделяется вирус. В то же время П. в. имеет большое значение в экологии возбудителей, т. к. способствует сохранению вируса как вида.
П. в. зависит от степени резистентности организма (см.) или культивируемых клеток: чем менее восприимчив организм к данному вирусу, тем чаще наблюдаются скрытые формы инфекции. Относительная устойчивость организма (или клеток) к некоторым вирусам может быть обусловлена генетическими и иммунол, факторами. Важную роль при этом играют иммунол, толерантность, иммунодепрессивное действие вирусов, образование иммунных комплексов, в которых антитела нейтрализуют активность вируса, наличие иммунодефицитов, подавление выработки интерферона и исчезновение с поверхности зараженных клеток вирусных детерминант под влиянием антител. Нередко П. в. способствует происходящая в ходе вирусной инфекции селекция малочувствительных клеток из общей клеточной популяции. В процессе П. в. свойства вирусной популяции также могут изменяться: возможно снижение степени вирулентности, утрата гемагглютинирующей активности, изменение морфологии, а иногда и антигенной структуры вирионов.
В результате изменения реактивности клеток и свойств вирусов клин, проявления П. в. могут существенно отличаться от симптомов острой инфекции, вызванной тем же вирусом.
Изучение механизмов П. в. на уровне макроорганизма связано с большими трудностями, поэтому основные сведения получены на модельных системах в культурах клеток человека и животных. В зависимости от чувствительности клеток, от свойств вирусов и от условий постановки опытов наблюдаются различные реакции клеток на заражение вирусами: от острой инфекции с тотальной деструкцией клеток до П. в. с мало выраженным цитопатическим эффектом или его отсутствием с резкой активизацией клеточного деления — цитопролиферативным эффектом (см. Клетка, вирусная цитопатология).
П. в.— интеграция вирусного генома с клеточным в единую генетическую структуру. Этот феномен, являющийся результатом рекомбинационного механизма, был впервые обнаружен при изучении взаимодей-вия бактерий с умеренными фагами. Было установлено присутствие в клетках животных ряда ДНК-содержащих онкогенных вирусов, а также некоторых аденовирусов и вируса обычного герпеса. РНК-содержащие Онкогенные вирусы животных с помощью фермента — обратной транскриптазы (ревертазы) образуют ДНК-транскрипты, интегрирующие с клеточным геномом. В. М. Жданов предположил, что одним из возможных механизмов длительной персистенции в клетках неонкогенных РНК-содержащих вирусов является образование ДНК-транскриптов с помощью ревертазы онкогенного вируса, латентно пе репетирующего в той же клетке.
Как правило, при П. в. в клеточных культурах вирус присутствует лишь в отдельных клетках. Периодическая гибель инфицированных клеток и размножение клеток, сохранивших жизнеспособность, обусловливают смену циклов деструкции хронически инфицированных культур циклами репопуляции, т. е. восстановления клеточного слоя. Количество инфицированных клеток при П. в. в популяции может варьировать в зависимости от интенсивности продуцирования интерферона в клеточной популяции, а также от способности вируса в данной культуре передаваться от клетки к клетке, минуя выход в культуральную среду, от добавления в среду специфических антител, интерферона или ингибиторов. В целом для П. в. в клеточных культурах в отличие от острой инфекции, как правило, характерна пониженная продукция вируса.
Установление П. в. часто представляет значительные трудности, особенно при латентной инфекции. Кроме того, выявление П. в. затрудняется в связи с своеобразием клин, проявлений П. в., особенно при медленных вирусных инфекциях, изменением биол, свойств вируса в процессе персистенции, а также маскировкой вируса специфическими антителами.
Важным методом индикации П. в. служит электронная микроскопия (см.), позволяющая обнаружить в части клеток не только стандартные вирионы, но и ряд субвирусных структур. Косвенные указания на П. в. могут быть получены также с помощью цитологических, цитогенетических и цитохимических методов исследования.
Для выявления антигенов персистирующих вирусов применяют метод флюоресцирующих антител (см. Иммунофлюоресценция) и иммуноэнзимный метод, основанный на метке антител или антигенов пероксидазой, локализацию которой в клетке определяют цитохимически. Присутствие в клетке вирусоспецифических последовательностей нуклеотидов при интеграционном механизме П. в. обнаруживают методом молекулярной гибридизации очищенной клеточной ДНК с нуклеиновой к-той вируса. Кроме того, с целью индикации П. в. используют способность персистирующих вирусов интерферировать с индикаторными вирусами, феномен длительного сохранения IgM-антител в сыворотке крови при П. в. и др.
Библиография: Бочаров А. Ф. и Бочаров Е. Ф. Персистенция вирусов, Новосибирск, 1979; Гаврилов В. И., Семенов Б. Ф. и Жданов Б.М. Хронические вирусные инфекции и их моделирование, М., 1974; Зуев В. А. Лабораторная диагностика латентных, хронических и медленных вирусных инфекций, М., 1979; Соловьев В. Д., Хесин Я. Е, и Быковский А. Ф. Очерки по вирусной цитопатологии, М., 1979; Тимаков В. Д. и 3уев В. А. Медленные инфекции, М., 1977; H о t-ch i n J. Persistent and slow virus infections, Basel a. o., 1971.
Диагностика инфекционных заболеваний является одной из самых сложных проблем в клинической медицине. Лабораторные методы исследования при ряде нозологических форм играют ведущую, а в целом ряде клинических ситуаций решающую роль не только в диагностике, но и в определении конечного исхода заболевания.
Диагностика инфекционных заболеваний почти всегда предусматривает использование комплекса лабораторных методов.
- бактериологические;
- серологические;
- метод полимеразной цепной реакции (ПЦР) для обнаружения ДНК или РНК возбудителя инфекционного заболевания в исследуемом материале.
У одних пациентов для диагностики этиологии инфекционно-воспалительного процесса достаточно провести бактериологическое исследование, в других клинических ситуациях решающее значение имеют данные серологических исследований, в третьих, предоставить полезную информацию может только метод ПЦР. Однако наиболее часто в клинической практике врачу-клиницисту необходимо использовать данные различных методов лабораторных исследований.
Бактериологические методы исследования
Бактериологические исследования наиболее часто проводят при подозрении на гнойно-воспалительные заболевания (составляют 40-60% в структуре хирургических заболеваний) с целью их диагностики, изучения этиологической структуры, определения чувствительности возбудителей к антибактериальным препаратам. Результаты бактериологических анализов способствуют выбору наиболее эффективного препарата для антибактериальной терапии, своевременному проведению мероприятий для профилактики внутрибольничных инфекций.
Возбудителями гнойно-воспалительных заболеваний являются истинно-патогенные бактерии, но наиболее часто условно-патогенные микроорганизмы, входящие в состав естественной микрофлоры человека или попадающие в организм извне. Истинно-патогенные бактерии в большинстве случаев способствуют развитию инфекционного заболевания у любого здорового человека. Условно-патогенные микроорганизмы вызывают заболевания преимущественно у людей с нарушенным иммунитетом.
Бактериологические исследования при заболеваниях, вызываемых условно-патогенными микроорганизмами, направлены на выделение всех микроорганизмов, находящихся в патологическом материале, что существенно отличает их от аналогичных исследований при заболеваниях, вызванных истинно патогенными микроорганизмами, когда проводится поиск определенного возбудителя.
Для получения адекватных результатов бактериологического исследования при гнойно-воспалительных заболеваниях особенно важно соблюдать ряд требований при взятии биоматериала для анализа, его транспортировки в лабораторию, проведения исследования и оценки его результатов.
- микроскопическое исследование мазка (бактериоскопия) из доставленного биоматериала;
- выращивание культуры микроорганизмов (культивирование);
- идентификацию бактерий;
- определение чувствительности к антимикробным препаратам и оценку результатов исследования.
Доставленный в бактериологическую лабораторию биоматериал первоначально подвергается микроскопическому исследованию.
Микроскопическое исследование мазка (бактериоскопия), окрашенного по Граму или другими красителями, проводят при исследовании мокроты, гноя, отделяемого из ран, слизистых оболочек (мазок из цервикального канала, зева, носа, глаза). Результаты микроскопии позволяют ориентировочно судить о характере микрофлоры, ее количественном содержании и соотношении различных видов микроорганизмов в биологическом материале, а также дают предварительную информации об обнаружении этиологически значимого инфекционного агента в данном биоматериале, что позволяет врачу сразу начать лечение (эмпирическое). Иногда микроскопия позволяет выявить микроорганизмы, плохо растущие на питательных средах. На основании данных микроскопии проводят выбор питательных сред для выращивания микробов, обнаруженных в мазке.
Культивирование микроорганизмов. Посев исследуемого биоматериала на питательные среды производят с целью выделения чистых культур микроорганизмов, установления их вида и определения чувствительности к антибактериальным препаратам. Для этих целей используют различные питательные среды, позволяющие выделить наибольшее количество видов микроорганизмов. Оптимальными являются питательные среды, содержащие кровь животного или человека, а также сахарный бульон, среды для анаэробов. Одновременно производят посев на дифференциально-диагностические и селективные (предназначенные для определенного вида микроорганизмов) среды. Посев осуществляют на стерильные чашки Петри, в которые предварительно заливают питательную среду для роста микроорганизмов.
Микроскопия мазков, окрашенных по Граму
1 - стрептококки; 2 - стафилококки; 3 - диплобактерии Фридленда; 4 - пневмококки
Колонии отсевают на плотные, жидкие, полужидкие питательные среды, оптимальные для культивирования определенного вида бактерий.
Выделенные чистые культуры микроорганизмов подвергают дальнейшему изучению в диагностических тестах, основанных на морфологических, ферментативных, биологических свойствах и антигенных особенностях, характеризующих бактерий соответствующего вида или варианта.
Определение чувствительности к антибактериальным препаратам. Чувствительность к антимикробным препаратам изучают у выделенных чистых культур микроорганизмов, имеющих этиологическое значение для данного заболевания. Поэтому в направлении на бактериологические анализы требуется указать диагноз заболевания у больного. Определение чувствительности бактерий к спектру антибиотиков помогает лечащему врачу правильно выбрать препарат для лечения больного.
Оценка результатов исследования. Принадлежность условно-патогенных микроорганизмов к естественной микрофлоре организма человека создает ряд трудностей при оценке их этиологической роли в развитии гнойно-воспалительных заболеваний. Условно-патогенные микроорганизмы могут представлять нормальную микрофлору исследуемых жидкостей и тканей или контаминировать их из окружающей среды. Поэтому для правильной оценки результатов бактериологических исследований необходимо знать состав естественной микрофлоры изучаемого образца. В тех случаях, когда исследуемый биоматериал в норме стерилен, как, например, спинномозговая жидкость, экссудаты, все выделенные из него микроорганизмы могут считаться возбудителями заболевания. В тех случаях, когда исследуемый материал имеет собственную микрофлору, как, например, отделяемое влагалища, кал, мокрота, нужно учитывать изменения ее качественного и количественного состава, появление несвойственных ему видов бактерий, количественную обсемененность биоматериала. Так, например, при бактериологическом исследовании мочи степень бактериурии (число бактерий в 1 мл мочи), равная и выше 10 5 , свидетельствует об инфекции мочевых путей. Более низкая степень бактериурии встречается у здоровых людей и является следствием загрязнения мочи естественной микрофлорой мочевых путей.
Установить этиологическую роль условно-патогенной микрофлоры помогают также нарастание количества и повторность выделения бактерий одного вида от больного в процессе заболевания.
Врач-клиницист должен знать, что положительный результат бактериологического исследования в отношении биологического материала, полученного из в норме стерильного очага (кровь, плевральная жидкость, спинномозговая жидкость, пунктат органа или ткани), всегда тревожный результат, требующий немедленных действий по оказанию медицинской помощи.
Серологические методы исследования
В основе всех серологических реакций лежит взаимодействие антигена и антитела. Серологические реакции используются в двух направлениях.
2. Установление родовой и видовой принадлежности микроба или вируса. В этом случае неизвестным компонентом реакции является антиген. Такое исследование требует постановки реакции с заведомо известными иммунными сыворотками.
Серологические исследования не обладают 100%-й чувствительностью и специфичностью в отношении диагностики инфекционных заболеваний, могут давать перекрестные реакции с антителами, направленными к антигенам других возбудителей. В связи с этим оценивать результаты серологических исследований необходимо с большой осторожностью и учетом клинической картины заболевания. Именно этим обусловлено использование для диагностики одной инфекции множества тестов, а также применение метода Western-blot для подтверждения результатов скрининговых методов.
В последние годы прогресс в области серологических исследований связан с разработкой тест-систем для определения авидности специфических антител к возбудителям различных инфекционных заболеваний.
Авидность - характеристика прочности связи специфических антител с соответствующими антигенами. В ходе иммунного ответа организма на проникновение инфекционного агента стимулированный клон лимфоцитов начинает вырабатывать сначала специфические IgM-антитела, а несколько позже и специфические IgG-антитела. IgG-антитела обладают поначалу низкой авидностью, то есть достаточно слабо связывают антиген.
Затем развитие иммунного процесса постепенно (это могут быть недели или месяцы) идет в сторону синтеза лимфоцитами высокоспецифичных (высокоавидных) IgG-антител, более прочно связывающихся с соответствующими антигенами. На основании этих закономерностей иммунного ответа организма в настоящее время разработаны тест-системы для определения авидности специфических IgG-антител при различных инфекционных заболеваниях.
Высокая авидность специфических IgG-антител позволяет исключить недавнее первичное инфицирование и тем самым с помощью серологических методов установить период инфицирования пациента. В клинической практике наиболее широкое распространение нашло определение авидности антител класса IgG при токсоплазмозе и цитомегаловирусной инфекции, что дает дополнительную информацию, полезную в диагностическом и прогностическом плане при подозрении на эти инфекции, в особенности при беременности или планировании беременности.
Метод полимеразной цепной реакции
Полимеразная цепная реакция (ПЦР), являющаяся одним из методов ДНК-диагностики, позволяет увеличить число копий детектируемого участка генома (ДНК) бактерий или вирусов в миллионы раз с использованием фермента ДНК-полимеразы. Тестируемый специфический для данного генома отрезок нуклеиновой кислоты многократно умножается (амплифицируется), что позволяет его идентифицировать.
Сначала молекула ДНК бактерий или вирусов нагреванием разделяется на 2 цепи, затем в присутствии синтезированных ДНК-праймеров (последовательность нуклеотидов специфична для определяемого генома) происходит связывание их с комплементарными участками ДНК, синтезируется вторая цепь нуклеиновой кислоты вслед за каждым праймером в присутствии термостабильной ДНК-полимеразы. Получается две молекулы ДНК. Процесс многократно повторяется. Для диагностики достаточно одной молекулы ДНК, то есть одной бактерии или вирусной частицы.
Введение в реакцию дополнительного этапа - синтеза ДНК на молекуле РНК при помощи фермента обратной транскриптазы - позволило тестировать РНК-вирусы, например, вирус гепатита С. ПЦР - это трехступенчатый процесс, повторяющийся циклично: денатурация, отжиг праймеров, синтез ДНК (полимеризация). Синтезированное количество ДНК идентифицируют методом иммуноферментного анализа или электрофореза.
В ПЦР может быть использован различный биологический материал - сыворотка или плазма крови, соскоб из уретры, биоптат, плевральная или спинномозговая жидкость и т.д. В первую очередь ЦПР применяют для диагностики инфекционных болезней, таких как вирусные гепатиты В, С, D, цитомегаловирусная инфекция, инфекционные заболевания, передающиеся половым путем (гонорея, хламидийная, микоплазменная, уреаплазменная инфекции), туберкулез, ВИЧ-инфекция и т.д.
Кровь считается внутренней средой организма, увлажняющей органы и ткани человека. Сила сокращения сердца обеспечивает циркуляцию крови по закрытой системе сосудов, при этом кровяные клетки не сообщаются с другими тканями тела в результате наличия гистогематических препятствий. Благодаря выполнению кровяными клетками своих непосредственных функций, человек получает нейтрализацию и вывод итоговых продуктов метаболизма.
В организм могут проникнуть различные микробы, бактерии и вредоносные организмы. Для выявления инфекции и вируса в составе крови проводятся лабораторные исследования. Благодаря полученным результатам, специалисты смогут определить количество и тип вредных микроорганизмов, а также провести соответствующее эффективное лечение.
Разновидность анализов крови на вирусы
В современных клинических лабораториях выполняется множество видов анализов крови на вирусы. К ним относят серологический анализ, иммуноферментное обследование, полимеразную цепную реакцию.
ИФА применяется с целью диагностирования антигенов либо антител в составе кровяных клеток. Существует качественный (установление наличия либо отсутствия антител, антигенов) и количественный метод обследования (определение количества антигенов, антител). Также иммуноферментный анализ: дает возможность выявить уровень иммунологических комплексов, гормонов и других биоактивных веществ. Как правило, ИФА назначается в следующих целях:
- Обследование крови на наличие вируса Эпштейна-Барра, гепатита, герпеса;
- Исследование кровяных клеток на половые инфекции (гонорея, хламидиоз, уреаплазма, трихомонада, сифилис, микоплазма);
- Установление уровня гормонов;
- Диагностирование онкологических патологий;
- Выявление иммунодефицита;
- Диагностика аллергических реакций.
Серологическое исследование проводится с целью установления инфекционной патологии, а также определения стадии процесса заражения. Подобный метод обследования основан на взаимодействии антигенов с антителами. Еще он дает возможность выявить наличие вируса различных патологических явлений.
Определение вируса Эпштейна-Барра в анализе кровяных клеток
Вирусная инфекция Эпштейна-Барра считается наиболее распространённой и входит в семейство герпесвирусных. В обследовании крови на вирусы она проявляется в случае, если в составе клеток и головном мозге развиваются лимфомы Беркитта. Также инфекционный мононуклеоз указывает на присутствие вируса в анализе кровяных клеток. Заразиться вирусной инфекцией можно через слюну, нередко при трансплантации костного мозга и переливании крови. Инфекция может выделяться через ротоглотку во внешнюю среду на протяжении 1,5 года после инфицирования. Как правило, у взрослых пациентов при вирусной инфекции Эпштейна-Барра в кровяных клетках обнаруживают антитела, которые свидетельствуют о хроническом заражении.
Диагностика вируса герпеса в крови
Помимо вышеуказанных анализов, проводится еще одно исследование — анализ крови на вирус герпеса. Данное обследование применяется с целью определения простой вирусной инфекции герпеса в кровяных клетках. Патологическое состояние протекает в виде незначительных болезнетворных язв, напоминающих волдыри, которые возникают на слизистых оболочках и коже (поверхность мочеиспускательного канала, влагалища, прямой кишки, рта, носа, горла). Герпес может проявляться единичными высыпаниями, но как правило, у человека возникает несколько вспышек.
Различают несколько типов вируса герпеса:
- инфекция простого герпеса — 1 — герпетическая лихорадка, возникающая на губах, которая передается через совместное использование бытовых приборов и поцелуи. При данной форме герпеса язвы могут возникать и на половых органах;
- инфекция простого герпеса — 2 — генитальный герпес, который может возникнуть у малышей, рожденных естественным образом, у матерей которых диагностирован положительный результат крови на герпетическую инфекцию.
Анализы кровяных клеток на герпетический вирус назначаются чаще всего при заражении гениталий. Для диагностики может использоваться кровь, спинномозговая жидкость, моча либо слезы. В ходе исследование происходит обнаружение антител, вырабатывающихся иммунитетом для борьбы с болезнью. Данный анализ применяется достаточно редко, поскольку его результаты не всегда точные. К тому же, при обследовании определить форму проявления патологии (хроническое либо первичное инфицирование) нельзя, поскольку на процесс выработки антител требуется время. Только некоторые анализы способны определить тип болезни.
Считается, что герпетическая инфекция неизлечима. После заболевания, вирусные бактерии постоянно присутствуют в организме. Они остаются в определённых нервных клетках и способствуют образованию высыпаний, множественных язв. Повторное заражение возникает в последствии переутомления, пережитого стресса, воздействия других инфекций, солнечного света.
Анализ кровяных клеток проводится с целью выяснения следующих факторов:
- вызывает ли высыпания вокруг рта либо области гениталий именно герпетическая инфекция;
- тип вируса;
- передалась ли инфекция половому партнеру пациента с генитальными язвами;
- присутствует ли инфекция у ребенка, рожденного у матери с генитальным герпесом.
Результаты различных исследований получают спустя определенные временные промежутки. К примеру, результаты экспресс-анализа вирусной культуры будут готовы через 2-3 дня. Заключение стандартного исследования получают на протяжении двух недель. Результаты обследования на антигены можно забрать через день.
Интерпретация анализа крови на вирус
Существует множество разновидностей обследований кровяных клеток на наличие вируса, однако интерпретация результатов исследования у каждого индивидуальна. Это зависит от используемого диагностического метода и вида устанавливаемой инфекции. К примеру, при гепатите С проводится анализ крови на вирусы, при этом расшифровка обследования инфекции данного вида не должна показать уровень вирусной нагрузки. Если при интерпретации иммуноферментного анализа на гепатит С определен иммуноглобулин G, это указывает на то, что данный возбудитель присутствовал в организме раньше. К нему сформировались антитела для борьбы с болезнью, поэтому лечение не потребуется. Если обследование установило наличие антител группы G и М, это может свидетельствовать о хроническом течении болезни в острой форме, которое нуждается в неотложном лечении. Когда иммуноферментный анализ кровяных клеток показал присутствие иммуноглобулинов группы М — это показатель развития первичной инфекции вируса гепатита С. При интерпретации результатов исследования крови на данный вид вирусной инфекции указывают количество выявленных антител. Для более точного разъяснения всех исследований следует проконсультироваться с доктором.
При герпесе также назначается обследование крови на вирусы. Расшифровка анализа кровяных клеток на вирусную инфекцию данного вида может принимать следующую значимость:
- IgM-, IgG- (иммунитет к вирусу отсутствует, что говорит о высокой вероятности первичного заражения);
- IgM-, IgG+ (риск к первичной инфекции отсутствует, однако риск повторного обострения будет зависеть от состояния иммунитета);
- IgM+, IgG- (наличие первичного инфицирования, которое нуждается в терапевтическом воздействии);
- IgM+, IgG+ (выявление вторичного обострения болезни).
Анализы на вирусы — комплекс лабораторных исследований, с помощью которых можно выявить различные вирусные инфекции и бактерии, проникающие в организм человека. Благодаря результатам исследования доктор может подобрать и назначить наиболее оптимальный и результативный способ лечения выявленного патологического состояния.
Данная статья размещена исключительно с целью ознакомления в познавательных целях и не является научным материалом или профессиональным медицинским советом. За диагностикой и лечением обратитесь к врачу.
Читайте также:

