Устойчивость вируса к лекарственному препарату называется
Обновлено: 23.04.2024
Химиорезистентность у вирусов. Резистентность вирусов к терапии ( к лекарственным средствам ). Устойчивость вирусов к ацикловиру, ганцикловиру, зидовудину, невирапину, рибавирину.
Устойчивость вирусов чаще развивается при многократном применении препаратов и передаётся последующим поколениям. Известно, что практически ко всем, заведомо немногочисленным противовирусным средствам, можно экспериментально получить устойчивые штаммы возбудителей. В основе изменения наследственных свойств вирусов лежат два различных процесса — мутация и селекция; для каждого из них важную роль играет внешняя среда как индуктор мутаций и как селективный фактор. Принимая во внимание тот факт, что спонтанные мутации вирусов позвоночных животных возникают с частотой 10 -5 -10 -6 , появление природных мутантов — достаточно редкое явление, и первоочередная роль в формировании резистентных штаммов принадлежит процессам селекции.
Ацикловир. Выделены устойчивые штаммы герпесвирусов, малопатогенные для лиц с нормальным иммунным статусом, но представляющие серьёзную угрозу для больных с иммунодефицитами, так как такие штаммы способны вызывать диссеминированные поражения, включая поражения ЦНС. Механизм резистентности обусловлен отсутствием или модификациями структуры тимидин киназы; реже устойчивость опосредуют мутации генов, кодирующих структуру ДНК-полимеразу, что делает её невосприимчивой к эффектам прочих ингибиторов фермента.
Ганцикловир. Устойчивость обусловлена снижением уровня фоефорилирования ЛС в заражённых клетках в связи с изменениями структуры вирусной фосфотрансферазы и ДНК-полимеразы.
Зидовудин. Наблюдают почти 100% резистентность штаммов ВИЧ, выделенных от пациентов, получавших препарат более 6 мес, что в некоторой степени парадоксально, так как известны случаи длительного выживания больных со СПИДом, получавших препарат более 15 мес. Устойчивость обусловлена мутациями генов, кодирующих структуру ревертазы, что приводит к снижению аффинитета фермента к ЛС, но не способности транскрибировать РНК вируса.
Невирапин. Устойчивость развивается довольно быстро, иногда через несколько недель после начала химиотерапии; основные механизмы обусловлены точечными мутациями, вызывающими изменения структуры взаимодействующего с ЛС фрагмента молекулы обратной транскриптазы.
Цитозинарабинозид и рибавирин. В отличие от прочих известных противовирусных препаратов, до настоящего времени не выявлены штаммы, резистентные к цитозинарабинозиду и рибавирину.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Противомикробные препараты, включающие в себя антибиотики, противовирусные, противогрибковые и противопаразитические средства, представляют собой лекарственные средства, применяемые для профилактики и лечения инфекций у людей, животных и растений.
Что такое устойчивость к противомикробным препаратам?
Устойчивость к противомикробным препаратам (УПП) возникает в результате постепенной мутации бактерий, вирусов, грибков и паразитов и утраты ими восприимчивости к лекарственным препаратам, затрудняя лечение инфекций и повышая риск распространения, тяжелого течения и летального исхода болезней.
Лекарственная устойчивость приводит к утрате эффективности антибиотиков и других противомикробных препаратов и постепенно осложняет или делает невозможным лечение инфекций.
Почему устойчивость к противомикробным препаратам вызывает обеспокоенность во всем мире?
Портфель клинических разработок новых противомикробных препаратов крайне мал. В 2019 г. ВОЗ выявила 32 антибиотика, которые находятся на этапе клинической разработки и предназначены для лечения болезнетворных возбудителей, включенных в список приоритетных патогенов ВОЗ, из которых только шесть антибиотиков отнесены в категории инновационных. Кроме того, серьезной проблемой остается недостаточная доступность качественных противомикробных препаратов. Нехватку антибиотиков испытывают страны всех уровней развития, и особенно учреждения систем здравоохранения стран.
По мере распространения лекарственной устойчивости во всем мире эффективность антибиотиков неуклонно снижается, и это приводит к появлению трудноизлечимых инфекций и смерти людей. Существует острая потребность в новых противомикробных препаратах, например для лечения карбапенем-резистентных грамотрицательных бактериальных инфекций, внесенных ВОЗ в список приоритетных патогенов. Вместе с тем без изменения нынешней практики использования антибиотиков человеком новые антибиотики, как и нынешние, будут утрачивать свою эффективность.
УПП наносит значительный урон экономике и системам здравоохранения стран, поскольку уменьшает производительность пациентов и ухаживающих за ними лиц в связи с удлинением сроков госпитализации и потребностью в более дорогостоящих и интенсивных видах терапии.
Без эффективных инструментов профилактики и надлежащего лечения лекарственно устойчивых инфекций и расширения доступа к существующим и новым качественным противомикробным препаратам число людей, не излечивающихся или умирающих от инфекций, будет расти. Более рискованными станут такие медицинские вмешательства, как хирургические операции, в том числе кесарево сечение или эндопротезирование тазобедренного сустава, химиотерапия онкологических заболеваний и трансплантация органов.
Какие факторы ускоряют формирование и распространение устойчивости к противомикробным препаратам?
Устойчивость к противомикробным препаратам развивается со временем естественным образом, обычно в результате генетических мутаций. Устойчивые к противомикробным препаратам микроорганизмы присутствуют у людей и животных, в продуктах питания, растениях и окружающей среде (в воде, почве и воздухе). Они могут передаваться от человека к человеку или между людьми и животными, в том числе с пищей животного происхождения. Основными причинами возникновения устойчивости к противомикробным препаратам являются неправильное и чрезмерное применение противомикробных препаратов; отсутствие доступа людей, а также животных к чистой воде, средствам санитарии и гигиены; неудовлетворительная профилактика инфекций и инфекционный контроль в медицинских учреждениях и на сельскохозяйственных предприятиях; ограниченный доступ к качественным и приемлемым по цене лекарственным препаратам, вакцинам и средствам диагностики; низкий уровень осведомленности и знаний; и отсутствие контроля за соблюдением законодательства.
Текущая ситуация
Лекарственная устойчивость бактерий
Во всем мире наблюдаются высокие показатели устойчивости к антибиотикам, используемым для лечения таких распространенных бактериальных инфекций, как инфекции мочевыводящих путей, сепсис, инфекции, передаваемые половым путем, и некоторые формы диареи, что свидетельствует об истощении нашего арсенала эффективных антибиотиков. Так, в странах, представляющих данные в Глобальную систему эпиднадзора за устойчивостью к противомикробным препаратам (GLASS), частота случаев устойчивости к антибиотику ципрофлоксацину, обычно применяемому для лечения инфекций мочевыводящих путей, варьируется в диапазоне от 8,4% до 92,9% для Escherichia coli и от 4,1% до 79,4% для Klebsiella pneumoniae.
Klebsiella pneumoniae – распространенная кишечная бактерия, которая может вызывать опасные для жизни инфекционные поражения. В настоящее время во всех регионах мира распространилась устойчивость K. pneumoniae к препаратам последнего резерва (антибиотикам класса карбапенемов). K. pneumoniae является одной из ведущих причин таких внутрибольничных инфекций, как пневмония, инфекции кровотока и инфекции у новорожденных и пациентов отделений интенсивной терапии. В некоторых странах из-за формирования устойчивости карбапенемы не подходят для лечения более половины пациентов, инфицированных K. pneumoniae.
Широкое распространение получила устойчивость E. coli к противомикробной активности фторхинолонов, используемых для лечения инфекций мочевыводящих путей.
В ряде стран различных регионов мира данная терапия перестала быть эффективной в более чем половине случаев.
Колистин остается единственным препаратом последнего резерва, подходящим для лечения опасных для жизни инфекций, вызываемых карбапенем-устойчивыми энтеробактериями (т.е. E.coli, Klebsiella и т.д.). В ряде стран и регионов уже выявлены колистин-резистентные бактерии, вызывающие инфекции, против которых в настоящее время не имеется эффективных антибиотиков.
Бактерии Staphlylococcus aureus присутствуют в микрофлоре кожных покровов человека, а также нередко вызывают распространение инфекций в быту и медицинских учреждениях. По оценкам, вероятность смерти больного, инфицированного метициллин-резистентной Staphylococcus aureus, на 64% выше, чем пациента с восприимчивой к препарату инфекцией.
Широко распространенная лекарственная устойчивость значительно различающихся между собой штаммов N. gonorrhoeae сводит на нет усилия по профилактике и лечению гонореи. Быстро развивается устойчивость инфекций к сульфаниламидам, пенициллинам, тетрациклинам, макролидам, фторхинолонам и цефалоспоринам первых поколений. В настоящее время единственным вариантом эмпирической монотерапии гонореи является применение инъекционного цефалоспорина широкого спектра действия цефтриаксона.
Лекарственная устойчивость mycobacterium tuberculosis
Устойчивые к антибиотикам штаммы mycobacterium tuberculosis (палочки Коха) угрожают достижениям в борьбе с глобальной эпидемией туберкулеза. По оценкам ВОЗ, в 2018 г. в мире произошло около полумиллиона новых случаев заболевания туберкулезом с устойчивостью к рифампицину (РУ-ТБ); в подавляющем большинстве случае они представляли собой туберкулез с множественной лекарственной устойчивостью (МЛУ-ТБ) – форму туберкулеза, характеризующуюся невосприимчивостью к двум наиболее мощным противотуберкулезным препаратам. При этом только треть из около полумиллиона пациентов, заболевших МЛУ/РУ-ТБ в 2018 г., была выявлена и включена в отчетность. По сравнению с нерезистентным туберкулезом для лечения МЛУ-ТБ требуются более продолжительные, менее эффективные и гораздо более дорогостоящие схемы лечения. Успешное излечение от МЛУ/РУ-ТБ наступает у менее 60% больных.
В 2018 г. доля случаев МЛУ-ТБ/РУ-ТБ оценивалась на уровне 3,4% среди ранее не болевших пациентов и на уровне 18% среди уже получавших лечение; таким образом, формирование устойчивости к новым противотуберкулезным препаратам последнего резерва, предназначенным для лечения лекарственно устойчивых форм туберкулеза, является крайне опасным явлением.
Лекарственная устойчивость вирусов
Устойчивость к противовирусным препаратам, формирующаяся в результате непрерывной репликации вирусов под длительным воздействием лекарственных средств и отбора резистентных штаммов, представляет собой растущую угрозу для пациентов с ослабленным иммунитетом. В настоящее время проблема устойчивости затрагивает большинство противовирусных препаратов, включая антиретровирусные (АРВ).
Формирование лекарственно устойчивой ВИЧ-инфекции (ЛУ-ВИЧ) может привести к частичной и полной утрате эффективности всех препаратов АРВ, в том числе относящихся к новым классам. Инфицирование ЛУ-ВИЧ может происходит как у пациентов, уже получающих антиретровирусную терапию, так и у заражающихся ВИЧ впервые. В большинстве стран Африки, Азии и Латинской Америки, в которых ведется мониторинг ситуации, доля случаев ЛУ-ВИЧ с дотерапевтической резистентностью к ненуклеозидным ингибиторам обратной транскриптазы (ННИОТ) на этапе до начала лечения среди взрослых, которым назначается терапия первой линии, превышает 10%. Тревожно высокой является распространенность дотерапевтической резистентности среди младенцев. В странах Африки к югу от Сахары носителями устойчивого к ННИОТ вируса являются более 50% младенцев с недавно диагностированной ВИЧ-инфекцией. С учетом данных обстоятельств в последнем варианте руководящих принципов ВОЗ по АРВ-терапии содержится рекомендация о применении в качестве предпочтительной терапии первой линии у взрослых и детей нового препарата долутегравир. Назначение данного препарата является особенно актуально для предотвращения негативных последствий устойчивости к ННИОТ.
Рост показателей устойчивости порождает и значимые экономические последствия, поскольку препараты второй и третьей линии являются гораздо более дорогостоящими по сравнению с препаратами первой линии. В рамках программы ВОЗ по борьбе с лекарственной устойчивостью ВИЧ-инфекции ведется мониторинг тенденций передачи инфекции и формирования ее устойчивости к более старым и новым препаратам против ВИЧ во всем мире.
Лекарственная устойчивость малярийных паразитов
Появление лекарственно устойчивых малярийных паразитов представляет собой одну из самых серьезных угроз для борьбы с малярией и приводит к увеличению заболеваемости малярией и смертности от нее. Рекомендуемым методом лечения первой линии при неосложненной малярии, вызванной P. falciparum, является артемизинин-комбинированная терапия (АКТ), применяемая в большинстве эндемичных по малярии стран. АКТ – комбинация компонента артемизинина и дополнительного лекарственного компонента. В рамках исследований, проведенных в 2001–2019 гг. в таких регионах ВОЗ, как Регион стран Западной части Тихого океана и Регион Юго-Восточной Азии, частичная устойчивость к артемизинину и устойчивость к ряду дополнительных лекарственных компонентов АКТ была подтверждена в Камбодже, Лаосской Народно-Демократической Республике, Мьянме, Таиланде и Вьетнаме. Это усложняет подбор эффективных лекарственных средств и требует пристального мониторинга процесса лечения.
В некоторых странах Региона Восточного Средиземноморья ВОЗ устойчивость P. falciparum к сульфадоксину-пириметамину сделала неэффективной терапию артезунатом в сочетании с сульфадоксином-пириметамином и потребовала перехода к другому варианту ACT.
В отношении стран Африки недавно были опубликованы данные, свидетельствующие о появлении мутаций, вызывающих частичную устойчивость паразита к артемизинину, в Руанде. На сегодняшний день апробированные варианты АКТ сохраняют высокую эффективность. Однако дальнейшее распространение устойчивости к артемизинину и дополнительным лекарственным компонентам АКТ может создать серьезную проблему для здоровья населения и поставить под угрозу важнейшие достижения в борьбе с малярией.
Лекарственная устойчивость грибков
Это приводит к появлению новых случаев заражения трудноизлечимыми грибковыми инфекциями, терапевтическим неудачам, затягиванию госпитализаций и к переходу на гораздо более дорогостоящие схемы лечения. ВОЗ проводит всеобъемлющий обзор грибковых инфекций в мире и намерена опубликовать перечень приоритетных для общественного здравоохранения патогенных грибков с анализом ситуации в области разработки новых противогрибковых препаратов.
Необходимость согласованных действий
Насущной задачей является активизация инновационной деятельности и наращивание капиталовложений в таких областях, как оперативные исследования, поиск и разработка новых противомикробных препаратов, вакцин и средств диагностики, особенно предназначенных для борьбы с наиболее серьезными грамотрицательными бактериями, в частности карбапенем-резистентными энтеробактериями и Acinetobacter baumannii. Значительному сокращению недостатка финансирования в этой области может способствовать создание Многостороннего партнерского целевого фонда по борьбе с устойчивостью к противомикробным препаратам (МПЦФ УПП), Глобального партнерства по научным исследованиям и разработкам антибиотиков, Фонда действий в отношении УПП и других фондов и инициатив. Правительства ряда стран, включая Швецию, Германию, США и Соединенное Королевство, апробируют модели возмещения затрат компаний-производителей новых препаратов. Для выработки долгосрочных решений круг этих инициатив должен быть расширен.
Глобальный план действий (ГПД) по борьбе с устойчивостью к противомикробным препаратам
Страны мира взяли на себя обязательство осуществлять рамочные принципы, изложенные в Глобальном плане действий (ГПД) по борьбе с УПП[1], принятом на сессии Всемирной ассамблеи здравоохранения в 2015 г., а также разработать и осуществлять многосекторальные планы действия на национальном уровне. ГПД был впоследствии одобрен руководящими органами Продовольственной и сельскохозяйственной организации Объединенных Наций (ФАО) и Всемирной организации охраны здоровья животных (МЭБ). Для обеспечения неуклонного улучшения ситуации во всем мире страны необходимо обеспечить финансированием и осуществлять национальные планы действий в целом ряде секторов. До одобрения ГПД в 2015 г. глобальные усилия по противодействию УПП осуществлялись, в частности, в рамках Глобальной стратегии ВОЗ по сдерживанию устойчивости к противомикробным препаратам, которая была разработана 2001 г. и описывает комплекс мероприятий, направленных на замедление процесса формирования и распространения УПП.
Трехсторонний совместный секретариат по проблеме устойчивости к противомикробным препаратам
Всемирная неделя правильного использования противомикробных препаратов
Глобальная система по надзору за устойчивостью к противомикробным препаратам (GLASS)
Глобальная система эпиднадзора за устойчивостью к противомикробным препаратам была создана ВОЗ в 2015 г. в целях непрерывного сбора недостающих данных, необходимых для стратегического планирования на всех уровнях. GLASS призвана систематически накапливать данные эпиднадзора за лекарственно устойчивыми инфекциями у человека, информацию о применении противомикробных препаратов и о лекарственно устойчивых инфекциях в продовольственных системах и окружающей среде. GLASS обеспечивает стандартизированный подход к сбору, анализу, интерпретации и распространению данных по странам, территориям и районам и позволяет отслеживать состояние существующих и новых национальных систем эпиднадзора, уделяя особое внимание качеству и репрезентативности собираемых данных. В некоторых регионах ВОЗ созданы сети эпиднадзора, обеспечивающие оказание технической поддержки странам и упрощающие присоединение к GLASS.
Глобальные исследования и выбор приоритетов в области борьбы с УПП
В 2017 г. ВОЗ разработала список приоритетных патогенов, призванный служить ориентиром для проведения научных исследований и разработки новых противомикробных препаратов. Он будет обновлен в 2022 г. Для оценки прогресса в разработке препаратов против приоритетных патогенов из списка ВОЗ Организация ежегодно анализирует антибактериальные препараты, находящиеся на стадии доклинической оценки и клинических испытаний. На сегодняшний день исследованиями и разработками по-прежнему не охвачен целый ряд направлений, в частности по разработке препаратов против грамотрицательных карбапенем-резистентных бактерий.
Глобальное партнерство по научным исследованиям и разработкам антибиотиков (GARDP)
Данное совместное начинание ВОЗ и Инициативы по лекарственным средствам против забытых болезней направлено на стимулирование исследований и разработок на основе государственно-частных партнерств. К 2025 г. Партнерство должно разработать и внедрить пять новых лекарственных препаратов, эффективных в отношении наиболее опасных с точки зрения ВОЗ лекарственно устойчивых бактерий.
За последнее десятилетие антиретровирусная терапия (АРТ) получила беспрецедентно широкое распространение в мире и позволила спасти жизнь десяткам миллионов людей, живущих с ВИЧ/СПИДом. По состоянию на конец 2020 г. АРТ получали 27,5 млн человек из 37,7 млн мирового контингента ВИЧ-инфицированных.
Распространение препаратов для лечения ВИЧ сопровождается формированием лекарственной устойчивости ВИЧ, масштабы которой в последние годы неуклонно растут.
Устойчивость ВИЧ к лекарственным препаратам вызвана изменениями в генетической структуре ВИЧ, влияющими на способность препаратов блокировать репликацию вируса. Риск частичной или полной утраты активности в результате появления лекарственно устойчивой разновидности вируса угрожает всем антиретровирусным препаратам, в том числе относящимся к более новым классам. В случае отсутствия упреждающих мер лекарственная устойчивость ВИЧ может поставить под угрозу эффективность препаратов, используемых для терапии ВИЧ, что приведет к росту числа случаев заражения ВИЧ и увеличению ВИЧ-ассоциированной заболеваемости и смертности.
Масштабы проблемы
Эпиднадзор за лекарственной устойчивостью ВИЧ позволяет странам получать фактические данные, на основании которых можно добиваться оптимальных исходов лечения на уровне отдельных пациентов и соответствующих групп населения. ВОЗ рекомендует странам регулярно проводить репрезентативные в национальном масштабе обследования для отслеживания лекарственной устойчивости ВИЧ среди различных категорий населения, включая взрослых, детей и подростков.
В Докладе ВОЗ об устойчивости ВИЧ к лекарственным препаратам 2021 г. отмечается значительный прогресс в разработке национальных планов действий по профилактике, мониторингу и сдерживанию лекарственной устойчивости ВИЧ, а также в проведении репрезентативных общенациональных обследований в странах с низким и средним уровнем дохода. По состоянию на 2021 г. национальные планы действий были разработаны в 64% стран с тяжелым бременем ВИЧ. За период с 2004 по 2021 г. обследования по вопросу о лекарственной устойчивости ВИЧ с применением рекомендованных ВОЗ стандартных методов провели 66 стран, а еще 34 страны планируют провести такие обследования в ближайшие два года.
Лекарственная устойчивость ВИЧ до начала лечения
У некоторых людей лекарственная устойчивость инфекции может быть установлена еще до начала лечения. Такая устойчивость может быть передана в момент заражения или сформирована в ходе предыдущего лечения, например у женщин, получающих антиретровирусные препараты для профилактики передачи ВИЧ-инфекции от матери ребенку.
Доля взрослых пациентов с лекарственной устойчивостью к препаратам класса ННИОТ в начале лечения может составлять до 10%. Лекарственная устойчивость к препаратам класса ННИОТ до начала лечения почти в три раза чаще встречается среди людей, ранее принимавших антиретровирусные препараты. Высока распространенность лекарственно устойчивой ВИЧ-инфекции среди детей младше 18 лет, у которых выявляется ВИЧ впервые. По данным обследований, проведенных в 10 странах Африки к югу от Сахары (2012–2020 гг.), почти половина младенцев, у которых впервые выявляется ВИЧ-инфекция, перед началом лечения имеют ННИОТ-резистентный вариант вируса.
Глобальная распространенность устойчивости к ННИОТ среди взрослых и младенцев свидетельствует о необходимости ускорить переход к рекомендованным ВОЗ схемам лечения на основе долутегравира.
Приобретенная устойчивость ВИЧ к лекарственным препаратам
Подавление вирусной нагрузки, составляющее цель терапии ВИЧ, позволяет предупредить формирование лекарственной устойчивости вируса. Когда подавление вирусной нагрузки достигнуто и поддерживается с течением времени, вероятность формирования лекарственной устойчивости ВИЧ снижается. В ходе 14 репрезентативных национальных обследований, проведенных в 2015–2020 гг., было установлено, что у взрослых, получающих АРТ, терапия обеспечивает в целом высокий уровень подавления вирусной нагрузки. В Африке сводные показатели подавления вирусной нагрузки составили 94% (95%, ДИ 92–96%) среди взрослых, получающих АРТ первой линии, и 84% (95%, ДИ 79–88%) среди взрослых, получающих АРТ второй линии. В странах Америки сводные показатели подавления вирусной нагрузки составили 81% (95%, ДИ 75–87%) среди взрослых, получающих АРТ первой линии, и 70% (95%, ДИ 67–72%) среди взрослых, получающих АРТ второй линии.
Иногда формирование лекарственной устойчивости ВИЧ нельзя исключать даже при терапии высокоэффективными препаратами и строгом соблюдении схемы лечения. Ведение эпиднадзора за приобретенной устойчивостью ВИЧ в лекарственным препаратам среди пациентов, получающих АРТ, позволяет получить ценную информацию о том, как оптимально подбирать и корректировать схемы АРТ-терапии. Среди пациентов, у которых АРТ на основе ННИОТ не приводит к желаемым результатам, доля случаев устойчивости инфекции к широко применяемым ННИОТ составляет от 50% до 97%.
Высокая доля случаев лекарственной устойчивости ВИЧ к ННИОТ среди лиц с неудачным результатом лечения говорит о необходимости более широкой диагностики вирусной нагрузки и мотивационного консультирования для повышения приверженности к лечению, а также по своевременной корректировки лечения, если оно оказывается неэффективным.
К счастью, страны быстро переходят к лечению взрослых и детей при помощи схем на основе долутегравира. Установлено, что применение АРТ на основе долутегравира обеспечивает очень высокие показатели подавления вирусной нагрузки и реже приводит к появлению приобретенной лекарственной устойчивости у не реагирующих на лечение пациентов. На данный момент в мире не имеется достаточных данных о формировании устойчивости ВИЧ-инфекции к долутегравиру.
ВОЗ рекомендует странам регулярно осуществлять эпиднадзор за приобретенной лекарственной устойчивостью ВИЧ у получающих АРТ взрослых, детей и подростков, используя для этого либо лабораторный метод определения вирусной нагрузки, либо метод выборочного тестирования пациентов на АРТ в медицинских учреждениях. Выбор метода зависит от существующего в стране охвата тестированием на определение вирусной нагрузки и от доступности деперсонализированных демографических данных.
Предэкспозиционная профилактика ВИЧ-инфекции
Многие люди, обстоятельства жизни которых, как считается, связаны с высоким риском заражения ВИЧ, ежедневно принимают препараты для снижения вероятности инфицирования. ВОЗ рекомендует обеспечивать возможность прохождения предэкспозиционной профилактики (ПрЭП) в качестве дополнительного способа предупреждения ВИЧ-инфекции.
Среди лиц, пользующихся ПрЭП, заражение ВИЧ происходит нечасто, особенно если они соблюдают режим приема препаратов. Вместе с тем у лиц, заражающихся ВИЧ несмотря на применение ПрЭП, часто развивается лекарственная устойчивость. Поскольку профили резистентности антиретровирусных препаратов, используемых для ПрЭП и лечения, частично пересекаются, это может ограничить выбор препаратов на этапе лечения ВИЧ.
В целях мониторинга дальнейшей эффективности лекарственных препаратов, используемых как для лечения, так для профилактики ВИЧ, ВОЗ рекомендует странам проводить репрезентативные в национальном масштабе обследования, направленные на контроль показателей лекарственной устойчивости ВИЧ среди лиц, начинающих лечение, продолжающих лечение, а также среди лиц, инфицируемых ВИЧ на фоне ПрЭП.
Деятельность ВОЗ
Сведение к минимуму интенсивности формирования и распространения лекарственной устойчивости ВИЧ – важнейшее направление более широких глобальных усилий по борьбе с устойчивостью к противомикробным препаратам, требующее скоординированных действий всех государственных ведомств и всех слоев общества.
- Какие существуют методы профилактики и лечения вирусных заболеваний, мероприятия по мониторингу распространения вирусных заболеваний?
- Какие существуют современные технологии сокращения негативного воздействия факторов среды?
- Каковы современные стратегии создания противовирусных препаратов?
- Какая связь существует между возникновением эпидемий гриппа и проведением вакцинации?
Глоссарий по теме:
Вирус – неклеточная форма жизни, состоящая из молекулы ДНК или РНК, окруженная белковым капсидом - оболочкой.
Паразитизм представляет собой взаимосвязь, при которой один из организмов (паразит) может использовать другой вид организмов (хозяина) как место обитания, и как постоянный источник питания, оказывая негативное влияние на хозяина.
Вирион – сформированная полностью инфекционная частица, которая способна заражать клетки.
Вакцинация (прививка) — это введение в организм антигенного материала для формирования иммунитета к болезни, который либо предотвратит процесс заражения или ослабит его последствия – например, вызовет протекание болезни в более легкой форме.
Штамм – это генетически однородное потомство микроорганизмов (используется по отношению к бактериям и иным микроорганизмам, но чаще употребляется в контексте исследования вирусов.
Резистентность – устойчивость вируса к определенному лекарственному препарату (его действующему веществу).
Основная и дополнительная литература по теме урока (точные библиографические данные с указанием страниц):
1. Естествознание. 11 класс [Текст]: учебник для общеобразоват. организаций: базовый уровень / И.Ю. Алексашина, К.В. Галактионов, И.С. Дмитриев, А.В. Ляпцев и др. / под ред. И.Ю. Алексашиной. – 3-е изд., испр. – М.: Просвещение, 2017. : с 149-157.
2. Брюханов, А.Л. Молекулярная микробиология: Учебник для вузов / А.Л. Брюханов, К.В. Рыбак, А.И. Нетрусов. - М.: Изд. МГУ, 2011. – с. 67-89.
Открытые электронные ресурсы по теме урока (при наличии);
Теоретический материал для самостоятельного изучения
Вирус – это неклеточная форма жизни, состоящая из молекулы ДНК или РНК, окруженная белковым капсидом. Вирусы по своей природе являются паразитами, поскольку паразитируют на живых клетках, используя их для размножения.
В настоящее время существует несколько теорий происхождения вирусов, однако ученые не пришли к единому мнению на этот счет. Наиболее поддерживаемой является гипотеза о том, что вирусы получили свое происхождения от молекулы нуклеиновой кислоты, которая приобрела способность реплицироваться и восстанавливаться в случае повреждений, независимо от клетки. Считается, что вирусы произошли от одноклеточных организмов, которые, перейдя к паразитическому образу жизни, существенно упростили свою организмами, редуцировав часть органелл.
Вирусы – это живые существа, которые не имеют клеточного строения. Наиболее мелкие вирусы достигают размера 20-30 нм, а наиболее крупные – около 300-400 нм. Вирусы примерно в 50 раз меньше по размеру, чем бактерии.
Строение вирусов достаточно простое. Вирусы состоят из трех основных элементов:
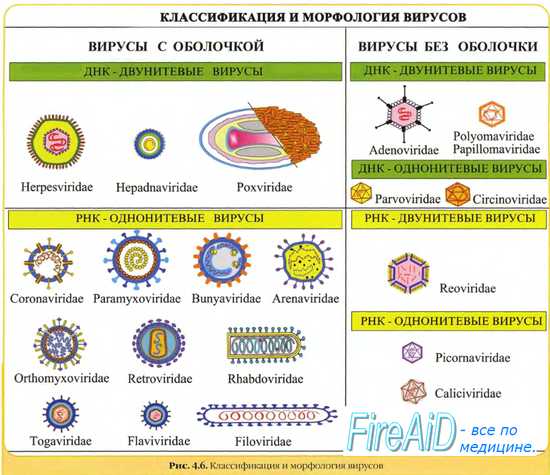
1. Сердцевина, которая представлена генетическим материалом вируса (молекула ДНК или РНК). В настоящее время вирусы принято классифицировать по признаку того ДНК или РНК в их основе. По данному признаку выделяют ДНК-вирусы и РНК-вирусы. ДНК или РНК вируса несёт информацию о белках, которые нужны для образования нового вируса – то есть размножения вируса.
2. Белковая оболочка – капсид. Оболочка вирусов построена на основе полипептидных цепей – из повторяющихся единиц – капсомеров. Как правило таким образом образуются симметричные структуры.
3. Дополнительная оболочка, образующаяся из мембраны клетки-хозяина, в которую внедряется вирус. Дополнительная оболочка есть у сравнительно больших по размерам вирусов (например, вирусы гриппа, герпеса и др.).
Сформированная полностью инфекционная частица, которая способна заражать клетки, называется вирионом. Несмотря на то, что вирусы обладают наследственностью и способны к размножению, они могут воспроизводить себя только находясь внутри живой клетки. Вне клетки вирусы неактивны, и только при попадании в клетку начинают вести себя, как живые организмы.
Вирусы, как и многие другие организмы, могут приспосабливаться к условиям внешней среды – то есть к организму (клеткам и межклеточному пространству) хозяина.
Вирусное заболевание в организме человека возникает из-за повреждения клеток организма (проникновения в них вируса). Вирус, ввиду того, что активно размножается, губит здоровые клетки – поскольку в цикле размножения вирус как правило проникает в клетку, использует вещества клетки для собственного размножения и тем самым убивает клетку.
Современной науке известно достаточно большое количество заболеваний. Например, долгое время был смертельным вирус оспы. В период с 16 по 18 век, оспа унесла жизни 1,5 млн. человек, что сопоставимо с жертвами таких болезней, как чума и холера (вызываются бактериями). Вакцина от оспы была разработана английским врачом Э. Дженнером, именно он предложил вакцинацию, как средство борьбы с вирусами и бактериями. Вакцинация (прививка) — это введение в организм антигенного материала для формирования иммунитета к болезни, который либо предотвратит процесс заражения или ослабит его последствия – например, вызовет протекание болезни в более легкой форме.
Сегодня смертельным является вирус имунодефицита человека – ВИЧ. Смертность от него составляет более 99% (сегодня не существует информации о людях, вылечившихся от ВИЧ). Такая высокая смертность от ВИЧ обусловлена тем, что ВИЧ поражает клетки иммунной системы – Т-лимфоциты, тем самым лишая организм возможности осуществлять иммунный ответ – противостоять другим инфекциям и грибковым заболеваниям. Строго говоря, человек умирает не от ВИЧ, а от любого сопутствующего заболевания, например, от простуды.
Сложность лечения ВИЧ состоит в том, что вирус, проникнув в организм человека, первоначально не проявляет себя, а в дальнейшем симптомы заболевания не специализированы (например, это слабость, низкий иммунитет, частые простуды, расслоение ногтей и др.), что не позволяет поставить диагноз без специального анализа крови. ВИЧ может передаваться через переливание зараженной крови, при половых контактах, а также через плохо простерилизованные стоматологические инструменты или инструменты для маникюра (вероятность заражения этим путем значительно ниже). Также ВИЧ может передаваться при беременности от матери к ребенку, однако сегодня существует терапия, которая позволяет избежать заражения плода.
Современные антиретровирусные препараты позволяют обеспечить людям с ВИЧ достаточно долгую и полноценную жизнь, однако для этого важно диагностировать заболевание вовремя. ВААРТ эффективна на любой стадии болезни, за исключением агонального состояния.
Некоторые вирусы онкогенны – то есть могут провоцировать онкологические заболевания. Например, это вирус папилломы человека, который может вызывать рак шейки матки у женщин. Именно поэтому наиболее эффективным средством борьбы с вирусными заболеваниями является вакцинация.
Среди современных средств борьбы с вирусами, можно выделить такую методику, как высокоактивная антиретровирусная терапия (ВААРТ) – наиболее современный, комплексный метод терапии ВИЧ (ВИЧ относят к семейству ретровирусов), который состоит в приёме трёх или четырёх препаратов, один из которых повышает иммунитет, другой – снижает вирусную нагрузку, третий – уменьшает интенсивность размножения вируса. Благодаря ВААРТ большинство больных ВИЧ могут вести нормальный образ жизни и жить до 60-70 лет.
Вирус – это неклеточная форма жизни, состоящая из молекулы ДНК или РНК, окруженная белковым капсидом. Вирусы по своей природе являются паразитами, поскольку паразитируют на живых клетках, используя их для размножения.
Вирусы состоят из трех основных элементов:
1. Сердцевина, которая представлена генетическим материалом вируса (молекула ДНК или РНК). В настоящее время вирусы принято классифицировать по признаку того ДНК или РНК в их основе. По данному признаку выделяют ДНК-вирусы и РНК-вирусы. ДНК или РНК вируса несёт информацию о белках, которые нужны для образования нового вируса – то есть размножения вируса.
2. Белковая оболочка – капсид. Оболочка вирусов построена на основе полипептидных цепей – из повторяющихся единиц – капсомеров. Как правило таким образом образуются симметричные структуры.
3. Дополнительная оболочка, образующаяся из мембраны клетки-хозяина, в которую внедряется вирус. Дополнительная оболочка есть у сравнительно больших по размерам вирусов (например, вирусы гриппа, герпеса и др.).
Защиту бактерий от действия лекарственных средств ( лс ) обеспечивает комплекс факторов, основными из которых считают ферментативную инактивацию препаратов и удаление либо маскировку рецепторов для них. Гены, кодирующие синтез продуктов, обусловливающих лекарственную устойчивость, могут быть хромосомными либо включенными в состав R-плазмид, передаваемых в бактериальной популяции.
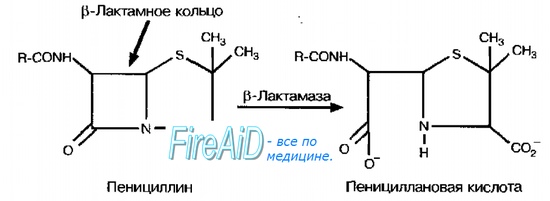
Ферментативная инактивация лекарственных средств ( лс )
Ферментативная инактивация лекарственных средств ( лс ) реализуется внеклеточно и внутриклеточно. Изменения активности ферментов связаны с мутациями генов, кодирующих их структуру, либо с увеличением образования числа копий генов, кодирующих его (амплификация).
В-Лактамазы. Механизм действия обусловлен разрушением b-лактамного кольца в молекулах антибиотиков. Стафилококки секретируют ферменты после попадания препарата в окружающую их среду, что приводит к снижению его концентрации. Для них характерна популяционная резистентность — большая доза инфекционного агента вызывает более интенсивное развитие устойчивости. Синтез ферментов кодируют индуцибельные гены, то есть b-лактамазы более интенсивно образуются в присутствии препарата. Более тонкая клеточная стенка грамотрицательных бактерий позволяет антибиотикам проникать внутрь клетки, где они взаимодействуют с b-лактамазами в периплазматическом пространстве.
Грамотрицательные бактерии (эшерихии, синегнойная палочка) проявляют более выраженную резистентность (по сравнению с грамположительными бактериями), не зависящую от дозы инфекционного агента. По специфичности действия b-лактамазы, продуцируемые грамотрицательными бактериями, разделяют на несколько групп (взаимодействующие только с пенициллинами, или цефалоспоринами, или и с обеими группами антибиотиков). У грамотрицательных бактерий синтез b-лактамаз происходит перманентно, вне зависимости от наличия JIC.
Ацетилтрансферазы, фосфорилазы и нуклеотидазы стрептококков, стафилококков, энтеробактерий и синегнойной палочки модифицируют аминогликозиды, препятствуя их связыванию с рибосомами (механизм действия хлорамфеникол ацетилтрансферазы, продуцируемой стафилококками и энтеробактериями аналогичен действию ацетилтрансфераз аминогликозидов). Ферменты расположены на поверхности ЦПМ и инактивируют лишь часть препарата, проникшего в клетку, так что концентрация препарата в биологических жидкостях снижается незначительно (не более чем на 0,5%).
- Вернуться в оглавление раздела "Микробиология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

