Устойчивость вирусов к ацикловиру
Обновлено: 17.04.2024
Ацикловир — белый кристаллический порошок, максимальная растворимость в воде (при 37 °C) 2,5 мг/мл, молекулярная масса 225,21. Ацикловира натриевая соль — максимальная растворимость в воде (при 25 °C) превышает 100 мг/мл, молекулярная масса 247,19; приготовленный раствор (50 мг/мл) имеет pH примерно 11.
Фармакологическое действие
Фармакология
Является синтетическим аналогом пуриновых нуклеозидов. После поступления в инфицированные клетки, содержащие вирусную тимидинкиназу, ацикловир фосфорилируется и превращается в ацикловира монофосфат, который под влиянием клеточной гуанилаткиназы преобразуется в дифосфат, и затем под действием нескольких клеточных ферментов — в трифосфат. Ацикловира трифосфат взаимодействует с вирусной ДНК-полимеразой, включается в цепочку вирусной ДНК , вызывает обрыв цепи и блокирует дальнейшую репликацию вирусной ДНК без повреждения клеток хозяина.
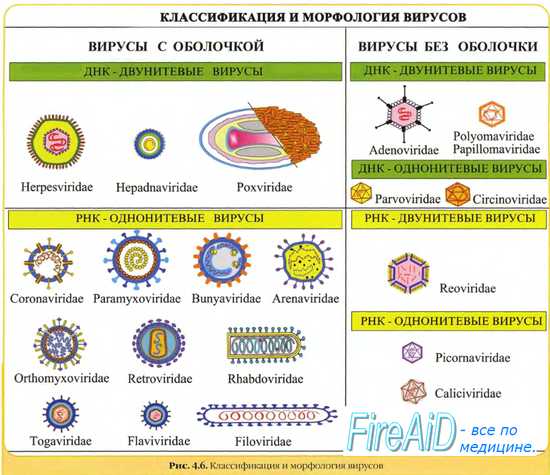
Ацикловир ингибирует in vitro и in vivo репликацию герпесвирусов человека, включая следующие (перечислены в порядке снижения противовирусной активности ацикловира в культуре клеток): вирус Herpes simplex 1 и 2 типов, вирус Varicella zoster, вирус Эпштейна-Барр и ЦМВ.
При длительном лечении или повторном применении ацикловира у больных с выраженным иммунодефицитом развивается устойчивость вирусов Herpes simplex и Varicella zoster к ацикловиру. В большинстве клинических изолятов, полученных от ацикловир-резистентных больных, обнаруживается относительный дефицит вирусной тимидинкиназы, либо нарушение структуры вирусной тимидинкиназы или ДНК-полимеразы.
При герпесе предупреждает образование новых элементов сыпи, снижает вероятность кожной диссеминации и висцеральных осложнений, ускоряет образование корок, снижает боль в острой фазе опоясывающего герпеса. Оказывает иммуностимулирующее действие.
Фармакокинетика
При приеме внутрь частично абсорбируется из ЖКТ , биодоступность — 20% (15–30%), не зависит от лекарственной формы, снижается с увеличением дозы; пища не оказывает значимого влияния на всасывание ацикловира. После приема внутрь по 200 мг ацикловира каждые 4 ч у взрослых средние равновесные значения Cmax — 0,7 мкг/мл и Cmin — 0,4 мкг/мл; Tmax — 1,5–2 ч.
После в/в капельного введения взрослым средние значения Сmax через 1 ч после инфузии в дозе 2,5; 5 и 10 мг/кг составляли 5,1; 9,8 и 20,7 мкг/мл соответственно. Сmin через 7 ч после инфузии соответственно равнялись 0,5; 0,7 и 2,3 мкг/мл. У детей старше 1 года значения Сmax и Сmin при введении в дозе 250 и 500 мг/м 2 были аналогичны таковым у взрослых при дозах 5 и 10 мг/кг соответственно. У новорожденных и младенцев в возрасте до 3 мес, которым ацикловир вводился в дозе 10 мг/кг в/в капельно в течение 1 ч каждые 8 ч Сmax составляла 13,8 мкг/мл), Cmin — 2,3 мкг/мл.
Связывание с белками низкое (9–33%). Проходит через ГЭБ , плацентарный барьер, обнаруживается в грудном молоке (при дозе 1 г/сут внутрь с молоком матери в организм ребенка поступает 0,3 мг/кг). Хорошо проникает в органы, ткани и жидкости организма, включая головной мозг, почки, печень, легкие, водянистую влагу, слезную жидкость, кишечник, мышцы, селезенку, матку, слизистую оболочку и секрет влагалища, сперму, спинно-мозговую жидкость, содержимое герпетических пузырьков. Наиболее высокие концентрации обнаруживаются в почках, печени и кишечнике. Концентрация в спинно-мозговой жидкости составляет 50% таковой в плазме крови. Метаболизируется в печени, под действием алкоголь- и альдегиддегидрогеназы и, в меньшей степени, альдегидоксидазы в неактивные метаболиты. Метаболизм ацикловира не связан с ферментами цитохрома P450.
Основной путь элиминации — через почки путем клубочковой фильтрации и канальцевой секреции. При приеме внутрь в неизмененном виде выводится примерно 14%, при в/в введении — 45–79%. Основной метаболит, обнаруживаемый в моче — 9-карбоксиметоксиметилгуанин. На долю основного метаболита приходится до 14% (при нормальной функции почек). Менее 2% выводится с фекалиями, следовые количества определяются в выдыхаемом воздухе.
T1/2 при приеме внутрь у взрослых — 2,5–3,3 ч. T1/2 при в/в введении: у взрослых — 2,9 ч, у детей и подростков от 1 года до 18 лет — 2,6 ч, у детей в возрасте до 3 мес — 3,8 ч (при введении в/в капельно 10 мг/кг в течение 1 ч 3 раза в сутки). У пациентов с хронической почечной недостаточностью T1/2 — 19,5 ч, во время проведения гемодиализа — 5,7 ч, при постоянном амбулаторном перитонеальном диализе — 14–18 ч. При однократном сеансе гемодиализа в течение 6 ч концентрация ацикловира в плазме снижается на 60%, при перитонеальном диализе клиренс ацикловира значительно не изменяется.
При нанесении на пораженную кожу (например при опоясывающем герпесе) всасывание умеренное; у больных с нормальной функцией почек концентрации в сыворотке крови составляют до 0,28 мкг/мл, при нарушении функции почек — до 0,78 мкг/мл. Выводится почками (примерно 9% суточной дозы).
Глазная мазь легко проникает через эпителий роговицы и создает терапевтическую концентрацию в глазной жидкости.
Канцерогенность, мутагенность, влияние на фертильность, тератогенность
У крыс и мышей, получавших в течение жизни ацикловир в дозах до 450 мг/кг/сут через желудочный зонд (при этом значения Cmax были выше наблюдаемых у человека в 3–6 раз у мышей и в 1–2 раза у крыс), канцерогенного действия не обнаружено.
Ацикловир проявлял мутагенное действие в некоторых тестах: из 16 in vivo и in vitro тестов на генную токсичность ацикловира результаты 5 тестов были позитивными.
Ацикловир не оказывал влияния на фертильность и репродукцию у мышей при введении внутрь в дозах 450 мг/кг/сут и у крыс при п/к введении в дозе 50 мг/кг/сут, при этом плазменные уровни были в 9–18 раз выше (у мышей) или в 8–15 раз выше (у крыс), чем у человека. При высшей дозе (50 мг/кг/сут п/к) у крыс и кроликов (плазменные уровни составляли 11–22 или 16–31 таковых у человека) установлено снижение эффективности имплантации.
Тератогенность. Ацикловир не оказывал тератогенного действия при введении в период органогенеза мышам (450 мг/кг/сут, внутрь), кроликам (50 мг/кг/сут, п/к и в/в), а также в стандартном тесте у крыс (50 мг/кг/сут, п/к).
Исследований канцерогенности ацикловира при наружном применении не проводили.
Химиорезистентность у вирусов. Резистентность вирусов к терапии ( к лекарственным средствам ). Устойчивость вирусов к ацикловиру, ганцикловиру, зидовудину, невирапину, рибавирину.
Устойчивость вирусов чаще развивается при многократном применении препаратов и передаётся последующим поколениям. Известно, что практически ко всем, заведомо немногочисленным противовирусным средствам, можно экспериментально получить устойчивые штаммы возбудителей. В основе изменения наследственных свойств вирусов лежат два различных процесса — мутация и селекция; для каждого из них важную роль играет внешняя среда как индуктор мутаций и как селективный фактор. Принимая во внимание тот факт, что спонтанные мутации вирусов позвоночных животных возникают с частотой 10 -5 -10 -6 , появление природных мутантов — достаточно редкое явление, и первоочередная роль в формировании резистентных штаммов принадлежит процессам селекции.
Ацикловир. Выделены устойчивые штаммы герпесвирусов, малопатогенные для лиц с нормальным иммунным статусом, но представляющие серьёзную угрозу для больных с иммунодефицитами, так как такие штаммы способны вызывать диссеминированные поражения, включая поражения ЦНС. Механизм резистентности обусловлен отсутствием или модификациями структуры тимидин киназы; реже устойчивость опосредуют мутации генов, кодирующих структуру ДНК-полимеразу, что делает её невосприимчивой к эффектам прочих ингибиторов фермента.
Ганцикловир. Устойчивость обусловлена снижением уровня фоефорилирования ЛС в заражённых клетках в связи с изменениями структуры вирусной фосфотрансферазы и ДНК-полимеразы.
Зидовудин. Наблюдают почти 100% резистентность штаммов ВИЧ, выделенных от пациентов, получавших препарат более 6 мес, что в некоторой степени парадоксально, так как известны случаи длительного выживания больных со СПИДом, получавших препарат более 15 мес. Устойчивость обусловлена мутациями генов, кодирующих структуру ревертазы, что приводит к снижению аффинитета фермента к ЛС, но не способности транскрибировать РНК вируса.
Невирапин. Устойчивость развивается довольно быстро, иногда через несколько недель после начала химиотерапии; основные механизмы обусловлены точечными мутациями, вызывающими изменения структуры взаимодействующего с ЛС фрагмента молекулы обратной транскриптазы.
Цитозинарабинозид и рибавирин. В отличие от прочих известных противовирусных препаратов, до настоящего времени не выявлены штаммы, резистентные к цитозинарабинозиду и рибавирину.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Изменения проницаемости клеточной стенки для лекарственных средств ( лс ). Прочие факторы формирования лекарственной устойчивости.
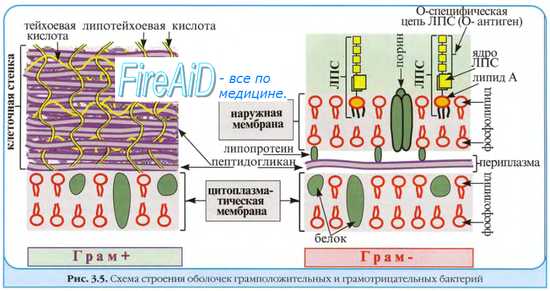
Способность к проникновению лекарственных средств ( лс ) в бактерию детерминирована самой природой клеточной стенки. Например, большинство антибиотиков легко попадает внутрь грамположительных бактерий, в то время как оболочка грамотрицательных микроорганизмов служит барьером для многих из них, в особенности, если мишени расположены в цитоплазме и препараты проявляют выраженную гидрофильность (тетрациклины, аминогликозиды, макролиды и др.).
Порины — образующие каналы в мембране энтеробактерий белки, опосредующие проникновение многих гидрофильных антибиотиков; различные факторы (например, мутации) изменяют структуру канала и тем самым снижают проницаемость клеточной стенки. ЛПС ингибируют проникновение через клеточную стенку гидрофобных (липофильных) антибактериальных агентов.
R-формы, лишённые полисахаридной капсулы и содержащие незначительные количества ЛПС, обычно чувствительны к большинству антибиотиков. Изменения электронного транспорта.
Проникновение аминогликозидов прямо зависит от переноса электрона к атому кислорода; такие препараты неэффективны против анаэробов и факультативных бактерий, пребывающих в анаэробных условиях (например, при образовании абсцессов). Ферментирующие бактерии (например, стрептококки) также резистентны к их действию.
Прочие факторы формирования лекарственной устойчивости
Отмечена способность ряда бактерий отвечать на фармакологическое воздействие повышением синтеза транспортных белков, выводящих препараты (например, тетрациклины) из клетки. Отдельные микроорганизмы (например, Streptococcus pneumoniae) способны трансформировать бактерицидную активность антибиотиков в бактериостатическую, эффект достигается уменьшением проницаемости клеточной стенки и связыванием ЛС аутолитическими ферментами (муреингидролазами).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Цель анализа заключается в определении степени чувствительности организма к препарату ацикловиру для наиболее эффективного использования его в противовирусной химиотерапии при герпетических инфекциях.
О медицинском препарате ацикловир

Ацикловир представляет собой противовирусное лекарственное средство первой линии, наиболее эффективное по отношению к герпетическим инфекциям.
Различные типы вируса простого герпеса (ВПГ) существенно разнятся по степени чувствительности к лекарству.
Для препарата ацикловир характерно проявление:
- высокой избирательности действия (только инфицированные ВПГ клетки);
- относительно низкой токсичности для организма в целом;
- воздействия исключительно на реплицирующийся вирус, то есть в его активном, а не в латентном состоянии;
- наличия способности к формированию резистентных штаммов ВПГ по отношению к лекарству, зависящей, в том числе, от нерационального применения, продолжительности курса, иммунного статуса, а именно, состояния иммунодефицита.
Механизм действия ацикловира
Ацикловир является представителем группы ациклических аналогов нуклеозидов, естественных компонентов ДНК, конкретно - дезоксигуанизина.
В силу подобной аналогии химической структуры молекулы лекарства ошибочно воспринимается вирусной ДНК-полимеразой подходящим субстратом при синтезе ДНК вируса, приводит к его прерыванию и блокировке репродукции вируса.
Процесс протекает исключительно в клетках, подвергшихся инфицированию ВПГ, осуществляется ферментом тимидинкиназой вируса.
Неодинаковое содержание этого фермента в клетке ВПГ разных типов обуславливает наблюдаемые отличия в чувствительности к препарату.
Суть исследования

Кому назначается анализ
- с герпетическими инфекциями, обусловленными разными типами ВПГ;
- с иммунодефицитом;
- с ВИЧ-инфекцией.
Результаты анализа и их интерпретация
- при нормальном иммунитете она варьирует от 0,1 до 0,5%, у пациентов с выявленным иммунодефицитом составляет порядка 5%;
- при отсутствии резистентности предполагают высокую чувствительность изученных штаммов ВПГ к противовирусной химиотерапии ацикловиром.
Тем не менее, эти данные используются при выборе тактики химиотерапии ацикловиром, ее продолжительности.
Когда эффективный тест к Ацикловиру?

Исследование на восприимчивость к Ацикловиру результативно при определении чувствительности, а также степени переносимости человеческим организмом сильного противовирусного препарата, обладающего иммуномодулирующими характеристиками.
- herpes simplex 1 (герпесвирус первого типа, HSV-I), для которого характерна герпетическая сыпь на поверхности кожи губ;
- herpes simplex 2 (герпесвирус второго типа, HSV-II), которому свойственны специфические поражения слизистой половых органов;
- патоген ветрянки, опоясывающего лишая (Varicella Zoste, Herpes simplex 3, HSV-III, простой герпес третьего типа);
- герпетический вирус 4 типа (Эпштейна-Барр, HSV-IV), провоцирующий развитие болезни Филатова, высокоагрессивной неходжкинской лимфомы Беркитта;
- цитомегалию (HSV-V), вызывающую патологические изменения слюнных желез, глаз, внутренних органов.
Действующим компонентам Acyclovirum свойственно просачиваться в клетки, ранее подвергающиеся заражению вирусом, а также препятствовать процессу деления вирусных частичек. В то же время негативного воздействия на здоровые клетки организма данное средство не оказывает. Следовательно, накануне применения назначенного препарата, с целью исключения отрицательных реакций, пациенту рекомендуется пройти иммунологическое исследование на восприимчивость к Ацикловиру.
Диагностическая значимость

При продолжительной терапии либо пострецидивном использовании Ацикловира у пациентов, страдающих выраженной формой иммунодефицита, формируется резистентность вирусов простого герпеса 1, 2, 3 типов. Среди большинства клинических изолятов, сформированных от ацикловир-устойчивых пациентов, диагностируется условная нехватка внутриклеточного фермента (вирусной тимидинкиназы), изменение её структуры либо фермента, участвующего в репликации вирусной ДНК.
Своевременный анализ чувствительности к Ацикловиру при герпесе позволяет предупредить формирование новых участков сыпи, снизить риск их распространения на коже, предотвратить внешние осложнения, ускорить корковое образование, снизить болевой порог при острой форме развития опоясывающего герпеса, определиться с тактикой иммуностимулирующей терапии.
В то же время медикаментозные средства Ацикловира отличаются биодоступностью. Для каждого отдельного препарата ряда Acyclovirum она будет различной, поскольку определяется их фармакокинетическими свойствами, которые обусловлены специфическими структурами. Очень важно оценивать степень восприимчивости герпесвирусной инфекции, спровоцированной HSV-I, HSV-III, к Ацикловиру, поскольку аккумулирование вируса в леммоцитах либо его диссеминация из спинномозгового узла происходит периневрально (путём формирования концентрических слоёв), перриаксонально, так или иначе затрагивая леммоциты.
Особенности диагностики

В качестве биоматериала для диагностики восприимчивости к Ацикловиру используется проба крови, взятая из вены. Забор образца для исследования осуществляется рано утром на голодный желудок в манипуляционной лабораторного центра.
Исследование выполняется методом иммунопероксидазной реакции (наиболее чувствительной тест-системы лабораторной диагностики).
Перед проведением теста пациенту рекомендуется исключить стресс, психоэмоциональные нагрузки, тяжёлый физический труд, курение, употребление алкоголя.
Преимущества и недостатки исследования
Неоспоримыми достоинствами оценки чувствительности к Acyclovirum являются:
- высокая точность диагностики;
- отсутствие противопоказаний к проведению;
- избирательность;
- отсутствие негативных реакций после теста.
Среди недостатков стоит выделить разную эффективность к различным типам герповирусной инфекции, влияние лишь на распространяющийся вирус, формирование устойчивости к лекарству.
Вероятность риска резистентности к препарату соразмерна продолжительности его приёма, что весьма часто характерно для иммунодефицитных пациентов и подтверждает надобность своевременного назначения иммунотерапии, позволяющей сократить необходимый период приёма противовирусного медикамента.
Ацикловир — белый кристаллический порошок, максимальная растворимость в воде (при 37 °C) 2,5 мг/мл, молекулярная масса 225,21. Ацикловира натриевая соль — максимальная растворимость в воде (при 25 °C) превышает 100 мг/мл, молекулярная масса 247,19; приготовленный раствор (50 мг/мл) имеет pH примерно 11.
Фармакологическое действие
Фармакология
Является синтетическим аналогом пуриновых нуклеозидов. После поступления в инфицированные клетки, содержащие вирусную тимидинкиназу, ацикловир фосфорилируется и превращается в ацикловира монофосфат, который под влиянием клеточной гуанилаткиназы преобразуется в дифосфат, и затем под действием нескольких клеточных ферментов — в трифосфат. Ацикловира трифосфат взаимодействует с вирусной ДНК-полимеразой, включается в цепочку вирусной ДНК , вызывает обрыв цепи и блокирует дальнейшую репликацию вирусной ДНК без повреждения клеток хозяина.
Ацикловир ингибирует in vitro и in vivo репликацию герпесвирусов человека, включая следующие (перечислены в порядке снижения противовирусной активности ацикловира в культуре клеток): вирус Herpes simplex 1 и 2 типов, вирус Varicella zoster, вирус Эпштейна-Барр и ЦМВ.
При длительном лечении или повторном применении ацикловира у больных с выраженным иммунодефицитом развивается устойчивость вирусов Herpes simplex и Varicella zoster к ацикловиру. В большинстве клинических изолятов, полученных от ацикловир-резистентных больных, обнаруживается относительный дефицит вирусной тимидинкиназы, либо нарушение структуры вирусной тимидинкиназы или ДНК-полимеразы.
При герпесе предупреждает образование новых элементов сыпи, снижает вероятность кожной диссеминации и висцеральных осложнений, ускоряет образование корок, снижает боль в острой фазе опоясывающего герпеса. Оказывает иммуностимулирующее действие.
Фармакокинетика
При приеме внутрь частично абсорбируется из ЖКТ , биодоступность — 20% (15–30%), не зависит от лекарственной формы, снижается с увеличением дозы; пища не оказывает значимого влияния на всасывание ацикловира. После приема внутрь по 200 мг ацикловира каждые 4 ч у взрослых средние равновесные значения Cmax — 0,7 мкг/мл и Cmin — 0,4 мкг/мл; Tmax — 1,5–2 ч.
После в/в капельного введения взрослым средние значения Сmax через 1 ч после инфузии в дозе 2,5; 5 и 10 мг/кг составляли 5,1; 9,8 и 20,7 мкг/мл соответственно. Сmin через 7 ч после инфузии соответственно равнялись 0,5; 0,7 и 2,3 мкг/мл. У детей старше 1 года значения Сmax и Сmin при введении в дозе 250 и 500 мг/м 2 были аналогичны таковым у взрослых при дозах 5 и 10 мг/кг соответственно. У новорожденных и младенцев в возрасте до 3 мес, которым ацикловир вводился в дозе 10 мг/кг в/в капельно в течение 1 ч каждые 8 ч Сmax составляла 13,8 мкг/мл), Cmin — 2,3 мкг/мл.
Связывание с белками низкое (9–33%). Проходит через ГЭБ , плацентарный барьер, обнаруживается в грудном молоке (при дозе 1 г/сут внутрь с молоком матери в организм ребенка поступает 0,3 мг/кг). Хорошо проникает в органы, ткани и жидкости организма, включая головной мозг, почки, печень, легкие, водянистую влагу, слезную жидкость, кишечник, мышцы, селезенку, матку, слизистую оболочку и секрет влагалища, сперму, спинно-мозговую жидкость, содержимое герпетических пузырьков. Наиболее высокие концентрации обнаруживаются в почках, печени и кишечнике. Концентрация в спинно-мозговой жидкости составляет 50% таковой в плазме крови. Метаболизируется в печени, под действием алкоголь- и альдегиддегидрогеназы и, в меньшей степени, альдегидоксидазы в неактивные метаболиты. Метаболизм ацикловира не связан с ферментами цитохрома P450.
Основной путь элиминации — через почки путем клубочковой фильтрации и канальцевой секреции. При приеме внутрь в неизмененном виде выводится примерно 14%, при в/в введении — 45–79%. Основной метаболит, обнаруживаемый в моче — 9-карбоксиметоксиметилгуанин. На долю основного метаболита приходится до 14% (при нормальной функции почек). Менее 2% выводится с фекалиями, следовые количества определяются в выдыхаемом воздухе.
T1/2 при приеме внутрь у взрослых — 2,5–3,3 ч. T1/2 при в/в введении: у взрослых — 2,9 ч, у детей и подростков от 1 года до 18 лет — 2,6 ч, у детей в возрасте до 3 мес — 3,8 ч (при введении в/в капельно 10 мг/кг в течение 1 ч 3 раза в сутки). У пациентов с хронической почечной недостаточностью T1/2 — 19,5 ч, во время проведения гемодиализа — 5,7 ч, при постоянном амбулаторном перитонеальном диализе — 14–18 ч. При однократном сеансе гемодиализа в течение 6 ч концентрация ацикловира в плазме снижается на 60%, при перитонеальном диализе клиренс ацикловира значительно не изменяется.
При нанесении на пораженную кожу (например при опоясывающем герпесе) всасывание умеренное; у больных с нормальной функцией почек концентрации в сыворотке крови составляют до 0,28 мкг/мл, при нарушении функции почек — до 0,78 мкг/мл. Выводится почками (примерно 9% суточной дозы).
Глазная мазь легко проникает через эпителий роговицы и создает терапевтическую концентрацию в глазной жидкости.
Канцерогенность, мутагенность, влияние на фертильность, тератогенность
У крыс и мышей, получавших в течение жизни ацикловир в дозах до 450 мг/кг/сут через желудочный зонд (при этом значения Cmax были выше наблюдаемых у человека в 3–6 раз у мышей и в 1–2 раза у крыс), канцерогенного действия не обнаружено.
Ацикловир проявлял мутагенное действие в некоторых тестах: из 16 in vivo и in vitro тестов на генную токсичность ацикловира результаты 5 тестов были позитивными.
Ацикловир не оказывал влияния на фертильность и репродукцию у мышей при введении внутрь в дозах 450 мг/кг/сут и у крыс при п/к введении в дозе 50 мг/кг/сут, при этом плазменные уровни были в 9–18 раз выше (у мышей) или в 8–15 раз выше (у крыс), чем у человека. При высшей дозе (50 мг/кг/сут п/к) у крыс и кроликов (плазменные уровни составляли 11–22 или 16–31 таковых у человека) установлено снижение эффективности имплантации.
Тератогенность. Ацикловир не оказывал тератогенного действия при введении в период органогенеза мышам (450 мг/кг/сут, внутрь), кроликам (50 мг/кг/сут, п/к и в/в), а также в стандартном тесте у крыс (50 мг/кг/сут, п/к).
Исследований канцерогенности ацикловира при наружном применении не проводили.
Читайте также:

