Устойчивость вирусов к дезинфицирующим средствам
Обновлено: 18.04.2024
Коронавирусы (семейство Coronaviridae ) – РНК-содержащие вирусы, имеющие внешнюю липосодержащую оболочку. Механизмы передачи – воздушно-капельный, контактный, фекально-оральный. По устойчивости
к дезинфицирующим средствам относятся к вирусам с низкой устойчивостью.
Согласно последним данным, вирус COVID-19 способен оставаться жизнеспособным вне организма от 3 часов до 4 дней в зависимости от поверхности объекта. Наиболее стабильно вирус сохраняется на нержавеющей стали (2 суток) и пластике (3 суток), однако его концентрация снижается.
В связи с вышеизложенным, дезинфицирующие мероприятия являются жизненно необходимыми в условиях пандемии COVID-19. Безусловное выполнение дезинфицирующих мероприятий существенно снижает риск заражения, а так же распространения короновирусной инфекции.
Дезинфекция это комплекс мероприятий, направленный на уничтожение возбудителей инфекционных заболеваний и разрушение токсинов на объектах внешней среды для предотвращения попадания их на кожу, слизистые и раневую поверхность. Дезинфекция подразделяется на профилактическую и очаговую (текущую, заключительную) дезинфекцию. Для проведения дезинфекции в условиях пандемии COVID – 19 необходимо использовать дезинфицирующие средства, применяемые для обеззараживания объектов при вирусных инфекциях.
Профилактическая дезинфекцияпри COVID-19
Профилактическая дезинфекция начинается немедленно при возникновении угрозы заболевания с целью предупреждения проникновения и распространения возбудителя заболевания в коллективы людей на объектах, в учреждениях, на территориях и т.д., где это заболевание отсутствует, но имеется угроза его заноса извне.
В настоящее время все учреждения и организации в крайне высокой степени подвержены проникновению возбудителя заболевания коронавирусной инфекцией COVID-19 и обязаны проводить дезинфекционные мероприятия безотлагательно и систематически.
Профилактическая дезинфекция включает меры личной гигиены, частое мытье с мылом или обработку кожными антисептиками рук, дезинфекцию столовой посуды, регулярное проветривание помещений, проведение влажной уборки с дезинфицирующими средствами.
Для профилактической дезинфекции применяют наименее токсичные средства, прошедшие государственную регистрацию. Дезинфекция поверхностей помещений способом орошения проводится в отсутствии людей и обязательном использовании средств индивидуальной защиты (респиратор, очки, перчатки).

Для обеззараживания воздуха в помещениях рекомендуется использовать рециркуляторы ультрафиолетового излучения согласно методических указаний к приборам.
Не менее важно проведение профилактической дезинфекции объектов на открытых пространствах населенных пунктов и мест общего пользования в многоквартирных жилых домах.
Очаговая дезинфекция при COVID-19 включает в себя текущую и заключительную дезинфекцию.
Текущая дезинфекция в очаге регулярно проводится в течение всего времени болезни. Целью данной дезинфекции является исключение возможности распространения COVID – 19. В условиях стационара дезинфекцию проводят специально подготовленный персонал. В настоящее время все чаще выявляют заболевших с бессимптомной или легкой формой течения заболевания, которых не госпитализируют, а оставляют на самоизоляции под амбулаторным наблюдением.
Необходимо помнить, что при отсутствии симптомов заболевания пациент также является заразным, и проведение текущей дезинфекции в помещении, где он прибывает, крайне необходимо.
Заключительную дезинфекцию проводят после выбытия больного из очага (выписка, госпитализация, перевод в другое ЛПУ).
Задачей заключительной дезинфекции является достижение полного обеззараживания всех объектов внутри очага. В лечебных учреждениях обработка проводится силами сотрудников. Для обработки очага вне лечебного учреждения привлекаются специалисты санитарно эпидемиологических служб. При обработке поверхностей в помещениях применяют способ орошения дезинфицирующими препаратами с более высокой концентрацией активных веществ. Одежду и постельные принадлежности больного обрабатывают посредством дезинфекционной камеры.

Внимание. Все дезинфицирующие средства обязательно должны иметь регистрацию в соответствии с требованиями закона Российской Федерации и использоваться строго согласно инструкции по применению.
(c) Управление Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека по Республике Алтай, 2006—2015 г.
Все права на материалы, размещенные на сайте, охраняются в соответствии с законодательством РФ, в том числе об авторском праве и смежных правах.
При использовании материалов сайта необходима ссылка на источник
Адрес: 649002, Республика Алтай, г. Горно-Алтайск, проспект Коммунистический, 173

Эл. почта:
Инфекции, связанные с оказанием медицинской помощи (ИСМП), являются глобальной проблемой здравоохранения. Этому способствует расширение спектра и тяжести лечебно-профилактических и диагностических вмешательств, внедрение в практику новой высокотехнологичной медицинской техники на фоне отсутствия должных условий для оказания медицинских услуг, увеличение доли пациентов со сниженным иммунным ответом, нерациональное применение антимикробных препаратов.
Основные факторы передачи внутрибольничных инфекций — руки медицинского персонала, изделия медицинского назначения, а также больничная среда.
ИСМП поражают от 5 до 10 % всех пациентов, находящихся в стационарах, и занимают десятое место в ряду причин смертности населения. По самым скромным расчетам экономический ущерб от ИСМП в России может достигать 10–15 миллиардов рублей в год. Это обуславливает повышенное внимание специалистов сферы здравоохранения к проблеме госпитальных инфекций.
С целью профилактики ИСМП в каждой медицинской организации должна быть создана система эпидемиологической безопасности.
Повышение эффективности дезинфекционных мероприятий — одна из основных задач Национальной концепции профилактики ИСМП.
К росту числа ИСМП и формированию резистентности возбудителей инфекций к дезинфектантам приводит в том числе неправильное применение дезинфекционных средств.
УСТОЙЧИВОСТЬ МИКРООРГАНИЗМОВ К ДЕЗСРЕДСТВАМ
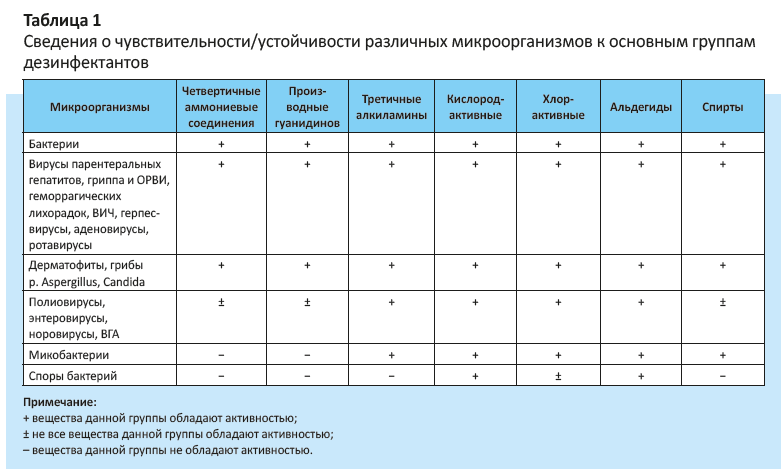
Выделяют природную (естественную) и приобретенную устойчивость микроорганизмов к дезсредствам.
Естественная устойчивость обусловлена особенностями строения микроорганизмов и связана с природными, закрепленными на генетическом уровне механизмами их защиты от неблагоприятных химических воздействий внешней среды. В большей степени природная резистентность характерна для грамотрицательных бактерий, спор, микобактерий и некоторых вирусов.
Сведения о чувствительности/устойчивости различных микроорганизмов к основным группам дезинфектантов должны использоваться при выборе дезсредств для нужд медицинских организаций (табл. 1).
Приобретенная устойчивость микроорганизмов к дезсредствам является новой проблемой для мирового здравоохранения. Причиной ее формирования служит адаптация микроорганизмов к воздействию одного или нескольких дезинфектантов. Чаще резистентность формируется к дезредствам из таких групп, как четвертичные аммониевые соединения, производные гуанидинов, третичные алкиламины. Причина данного явления заключается в том, что перечисленные химические соединения в качестве дезинфектантов применяются в заниженных концентрациях.
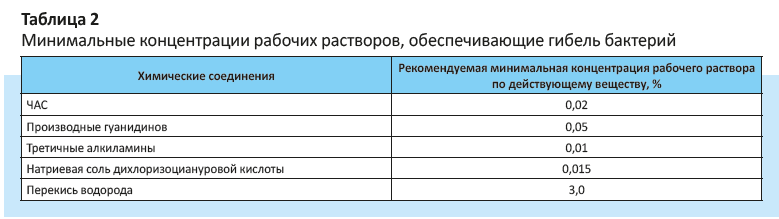
Учитывая возможность формирования устойчивости бактерий к дезинфектантам, при выборе и использовании дезсредств следует обращать внимание на минимальные концентрации рабочих растворов, обеспечивающие гибель бактерий (табл. 2).
ТИПЫ МОНИТОРИНГА УСТОЙЧИВОСТИ МИКРООРГАНИЗМОВ К ДЕЗСРЕДСТВАМ
При эпидемиологическом благополучии в медицинской организации чаще всего применяют направленный мониторинг, который позволяет отслеживать чувствительность культур микроорганизмов, циркулирующих в отделениях повышенного риска возникновения ИСМП.
К сведению
К отделениям риска относятся отделения реанимации и интенсивной терапии, ожоговые отделения, отделения гемодиализа, хирургические отделения различного профиля.
- все культуры микроорганизмов, выделенные от пациентов с ИСМП;
- все культуры микроорганизмов, выделенные от медицинского персонала;
- все культуры микроорганизмов, выделенные из эпидемиологически значимых объектов внешней среды (медицинское оборудование, инструменты, растворы);
- выборочно наиболее значимые с эпидемиологической точки зрения микроорганизмы, госпитальные штаммы, лидирующие в этиологической структуре или в микробном пейзаже отделения;
- выборочно культуры микроорганизмов от пациентов с инфекциями, не связанными с оказанием медицинской помощи;
- выборочно культуры микроорганизмов, выделенные из внешней среды при производственном контроле.
К сведению
Госпитальные штаммы — штаммы микроорганизмов, обладающие множественной лекарственной устойчивостью, более высокой вирулентностью и резистентностью по отношению к неблагоприятным факторам окружающей среды. Формирование госпитальных штаммов — результат их адаптации к особым условиям деятельности медицинских организаций.
Чаще всего в медицинских организациях применяется комбинированный тип мониторинга устойчивости микроорганизмов к дезсредствам, который представляет собой сочетание первых двух типов. Это позволяет получать объективные результаты динамической оценки с минимумом затрат.
Обратите внимание!
При ухудшении эпидемиологической обстановки, появлении предвестников ее осложнения возможен переход на тотальный тип мониторинга, при котором исследованию на чувствительность к дезсредствам подлежат все микроорганизмы, выделяемые в медицинской организации.
Решение о проведении сплошного мониторинга принимает врач-эпидемиолог или комиссия по профилактике ИСМП (комиссия по эпидемиологической безопасности).
РЕЖИМЫ МОНИТОРИНГА УСТОЙЧИВОСТИ МИКРООРГАНИЗМОВ К ДЕЗСРЕДСТВАМ
Режим мониторинга выбирают в зависимости от эпидемиологической обстановки в учреждении, его профиля и структуры, характеристик микробного пейзажа. Во внимание необходимо принимать и особенности дезинфекционного режима, в частности химический состав, спектр антимикробной активности применяемых дезсредств, масштабы и длительность использования дезинфектантов.
Периодический режим мониторинга рекомендуется для всех типов медицинских организаций при эпидемиологическом благополучии. В среднем его проводят 1 раз в квартал. Плановый периодический мониторинг позволяет своевременно обнаружить наличие устойчивых к дезсредствам штаммов бактерий, отследить тенденции изменения чувствительности микрофлоры к дезинфектантам.
Усиленный режим мониторинга проводится по показаниям 1 раз в месяц или чаще.
Необходимость усиления контроля за чувствительностью микроорганизмов может быть продиктована следующими обстоятельствами:
- распространение в отделениях риска или медицинской организации в целом устойчивых к дезсредствам штаммов;
- смена стадии чувствительности микрофлоры к дезсредствам;
- появление информации о неэффективности используемого дезсредства;
- переход медицинской организации на другие дезсредства;
- ухудшение эпидемиологической обстановки.
Решение об усилении мероприятий выносит врач-эпидемиолог или комиссия по профилактике ИСМП.
Постоянный режим мониторинга нужно осуществлять в отделениях высокого риска возникновения ИСМП, где наблюдается распространенность устойчивости микроорганизмов к дезсредствам и стабильное выявление госпитальных штаммов. В такой ситуации при выделении любого микроорганизма наряду с оценкой антибиотикорезистентности определяют его чувствительность к основным группам дезинфектантов.
ОБЪЕМ МЕРОПРИЯТИЙ В РАМКАХ МОНИТОРИНГА УСТОЙЧИВОСТИ МИКРООРГАНИЗМОВ К ДЕЗСРЕДСТВАМ
Объем мероприятий по мониторингу определяется эпидемиологом медицинской организации и зависит от характера оказываемой медицинской помощи, особенностей микробного пейзажа, состояния чувствительности микрофлоры к дезсредствам, эпидемиологической ситуации и характеристик дезинфекционного режима.
В любом случае объем исследований должен составлять не менее 100 единиц в год. При этом ежеквартально исследуется чувствительность минимум 25 культур микроорганизмов. Это обусловлено тем, что распространенность резистентности к дезсредствам в медицинских организациях варьирует в пределах 1,1–5,8 на 100 исследований, что свидетельствует о необходимости обеспечения достаточного объема мониторинга наряду с правильным отбором культур для выявления устойчивых штаммов.
Для проведения исследований в рамках мониторинга используют дезинфицирующие средства из разных групп химических соединений, применяемые в медицинской организации и планируемые к применению, а также дезсредства для проведения ротации и дезсредства с разными действующими веществами в пределах одной группы химических соединений.
СТАДИИ ЧУВСТВИТЕЛЬНОСТИ МИКРОФЛОРЫ К ДЕЗСРЕДСТВАМ
I. Стадия чувствительности микрофлоры медицинской организации к дезинфектанту
Для этой стадии характерны следующие признаки:
1) отсутствие устойчивых к дезсредству штаммов микроорганизмов, выделенных от пациентов и из внешней среды;
2) отсутствие штаммов микроорганизмов с неполной чувствительностью к дезсредству или выделение единичных подобных культур, но на ограниченной территории и только от больных или только из внешней среды.
При чувствительности микрофлоры к протестированному дезсредству, используемому в учреждении, не нужны изменения в существующую тактику дезинфекционных мероприятий. Рекомендуется направленный или комбинированный тип мониторинга с установленной плановой периодичностью (например, 1 раз в квартал) без проведения дополнительных исследований.
II. Стадия формирования устойчивости микрофлоры медицинской организации к дезинфектанту
1) отсутствие устойчивых к дезсредству штаммов микроорганизмов;
2) наличие и распространенность по отделениям штаммов микроорганизмов с неполной чувствительностью к дезсредству, выделенных от пациентов и из внешней среды;
3) среди штаммов микроорганизмов с неполной чувствительностью к дезсредству преобладают культуры, на которые дезсредство оказывает неполное биоцидное действие;
4) при применении дезсредства в нескольких режимах неполная чувствительность проявляется только к одному из режимов с наименьшей концентрацией и/или экспозицией.
На стадии формирования устойчивости микрофлоры к дезинфектанту тактику дезинфекционных мероприятий медицинской организации оставляют без изменений. Рекомендуется провести исследование чувствительности госпитальной микрофлоры к другим дезсредствам этой же группы химических соединений с иными действующими веществами, чтобы выявить сочетаннуую устойчивость.
Требуется усиление мониторинга за счет увеличения объема исследований, расширения перечня объектов исследований, ежемесячного наблюдения. Тип мониторинга может оставаться прежним — направленным либо комбинированным.
III. Стадия сформированной устойчивости, ограниченной по территории
Характеризуется следующими признаками:
1) наличие устойчивых к дезсредству штаммов микроорганизмов, выделенных от пациентов и/или из внешней среды;
2) присутствие в одном из отделений медицинской организации как устойчивых к дезсредству штаммов, так и штаммов с неполной чувствительностью;
3) широкое распространение микроорганизмов с неполной чувствительностью к дезсредству, особенно штаммов, на которые дезинфектант оказывают суббактерицидное действие;
4) ограниченность выделения устойчивых к дезсредству штаммов по территории (одно или несколько отделений);
5) отсутствие стабильности выделения устойчивых к дезсредству штаммов;
6) при применении дезсредства в нескольких режимах устойчивость проявляется только к одному из режимов с наименьшей концентрацией и/или экспозицией.
При выявлении в медицинской организации сформированной устойчивости к дезсредству, ограниченной по территории, рекомендуется усилить мониторинг за счет введения тотального типа наблюдения, ежемесячного планового характера исследований, а также исследований по эпидемиологическим показаниям. Также требуется увеличить объем исследований и расширить перечень объектов исследований.
Дальнейшее применение протестированного дезсредства не рекомендуется.
Если невозможно немедленно от него отказаться, компромиссный вариант — ограничение использования данного дезинфектанта только теми режимами, к которым штаммы проявляют полную чувствительность. При этом необходимо мониторить устойчивость микрофлоры в постоянном режиме и исследовать чувствительность к данному дезсредству, к другим дезсредствам с действующими веществами этой же группы химических соединений для выяснения вопроса о наличии сочетанной резистентности, а также к дезсредствам других групп химических соединений с целью подбора средств для ротации.
IV. Стадия распространенной устойчивости микрофлоры к дезинфектанту
При этом состоянии отмечаются:
1) наличие устойчивых к дезсредству штаммов микроорганизмов, культур с неполной чувствительностью к дезсредству, выделенных от пациентов и из внешней среды;
2) широкая распространенность устойчивости в различных отделениях;
3) широкая распространенность неполной чувствительности, особенно штаммов, на которые дезсредство оказывает суббактерицидное действие;
4) стабильность выделения устойчивых к дезсредству штаммов микроорганизмов и штаммов с неполной чувствительностью к дезсредству в одних и тех же отделениях в динамике, на протяжении длительного периода;
5) при применении средства в нескольких режимах устойчивость и/или неполная чувствительность проявляется более чем в одном режиме.
При выявлении распространенной устойчивости микрофлоры к дезинфектанту требуется усиление мониторинга с введением сплошного типа наблюдения в постоянном режиме. Необходимо максимально увеличить объем исследований и расширить перечень исследуемых объектов.
Прибегают как к отказу от применения исследованного дезсредства во всех режимах, так и к временному запрету на использование в целях дезинфекции всей группы химических соединений. Подбирают новые дезинфектанты из других групп дезсредств, в отношении которых при проведении исследований была выявлена полная чувствительность госпитальной микрофлоры.
РЕЗЮМЕ
Вышеперечисленные стадии в медицинской организации могут быть по-разному представлены в отношении различных дезинфектантов и иметь различную продолжительность. Это определяется целым рядом факторов, таких как:
- физико-химическая природа действующих веществ в составе дезсредства. Чувствительностьи микрофлоры может значительно варьировать при применении разных групп дезинфектантов;
- характеристика дезинфекционного режима с использованием данного дезсредства, а именно длительность его применения, число и типы объектов, подвергающихся обработке, режимы применения дезсредства и т. д.;
- ведущие микроорганизмы в конкретном отделении;
- факторы, определяющие возможность формирования и широкой циркуляции госпитальных штаммов, что способствует распространению устойчивости и неполной чувствительности штаммов к дезинфектантам.
Научно доказано, что в медицинских организациях происходит последовательная смена стадий от состояния чувствительности через формирование штаммов с неполной чувствительностью к состоянию устойчивости микрофлоры к дезинфицирующим средствам.
Динамическое наблюдение позволяет выявлять на начальных стадиях негативные тенденции в медицинской организации и проводить своевременную ротацию дезсредств, чтобы избежать формирования устойчивых штаммов микроорганизмов и возникновения вспышек ИСМП у пациентов и персонала.
В настоящее время проблема инфекций, связанных с оказанием медицинской помощи (ИСМП), является крайне острой и актуальной. ИСМП поражают в среднем от 5 до 15 % госпитализированных пациентов, а в отделениях высокого риска — до 40 %.
Согласно позиции Всемирной организации здравоохранения, ни одно лечебно-профилактическое учреждение в мире не может назвать себя свободным от риска возникновения ИСМП. В то же время заболеваемость ИСМП может быть минимизирована путем управления рисками возникновения и распространения инфекций за счет качественных своевременных профилактических и противоэпидемических мероприятий, в том числе дезинфекции.
Рассмотрим два современных метода дезинфекции, которые могут применяться в медицинских организациях для предотвращения случаев внутрибольничных инфекций.
Аэрозольная дезинфекция
В основу аэрозольной дезинфекции положен принцип преобразования жидкого дезинфицирующего средства в мелкодисперсный аэрозоль с помощью специального оборудования.
Антимикробное действие мелкодисперсного аэрозоля дезинфицирующего средства достигается за счет испарения частиц препарата, их конденсации на микробном субстрате. В то же время неиспарившиеся молекулы дезинфектанта выпадают на поверхности обеззараживаемых объектов и образуют бактерицидную пленку.
Любой прибор должен иметь сертификат соответствия, декларацию о соответствии и руководство по эксплуатации на русском языке.
Технические характеристики оборудования и скорость распыления дезинфектанта напрямую влияют на эффективность и безопасность обработки.
Обратите внимание!
Все средства в обязательном порядке должны проходить предрегистрационные испытания, подтверждающие, что они являются эффективными в режимах аэрозольной дезинфекции воздуха и поверхностей.
В медицинских организациях для аэрозольного метода дезинфекции допускается использовать готовые к применению средства или концентраты, рабочие растворы которых относятся к IV классу малоопасных или III классу умеренно опасных химических соединений при введении в желудок и при нанесении на кожу.
Как правило, в аэрозольном состоянии эти же средства относятся ко II классу высоко опасных или I классу чрезвычайно опасных химических соединений. В связи с этим аэрозольная дезинфекция должна осуществляться строго в отсутствие людей (как пациентов, так и медицинского персонала) при соблюдении необходимых мер безопасности и применении средств индивидуальной защиты лицами, участвующими в проведении обработки.
К сведению
Порядок проведения аэрозольной дезинфекции
При проведении аэрозольной дезинфекции необходимо придерживаться стандартных мер предосторожности.
Перед началом эксплуатации нового оборудования в медицинских организациях врач-эпидемиолог и инженер по медицинской технике согласовывают режимы применения аппарата, оценивают состояние вентиляции, энергоснабжения помещений, подлежащих дезинфекции.
Обратите внимание!
Перед проведением дезинфекции аэрозольным методом помещение максимально герметизируют, отключают электроприборы, закрывают окна и двери. Необходимость отключения систем вентиляции и кондиционирования воздуха уточняется в инструкции по применению дезинфицирующего средства.
Сотрудник, выполняющий дезинфекционную обработку, должен находиться за пределами обрабатываемого объекта и при необходимости экстренного входа в помещение надевает средства индивидуальной защиты глаз, кожи, органов дыхания.
После активного распыления аэрозоля и выдержки экспозиции, время которой определяется в соответствии с инструкцией по применению конкретного дезсредства, проводят проветривание с целью снижения остаточного содержания распыленного средства в воздухе до безопасного уровня.
Аэрозольный метод может использоваться в рамках следующих мероприятий:
- плановая профилактическая дезинфекция с целью уменьшения микробной обсемененности объектов внешней среды и предупреждения возможности размножения микроорганизмов. Чаще всего в плановом порядке аэрозольную дезинфекцию совмещают с проведением генеральных уборок;
- профилактическая дезинфекция по эпидемиологическим показаниям для предотвращения распространения возбудителей инфекций, связанных с оказанием медицинской помощи. Выполняется при выявлении источников инфекций, связанных с оказанием медицинской помощи, а также при неудовлетворительных результатах санитарно-бактериологического производственного контроля;
- заключительная очаговая дезинфекция с целью удаления заразного начала с объектов внешней среды после выписки, перевода, выздоровления или смерти пациента, являющегося источником инфекции.
К сведению
Аэрозольная дезинфекция может применяться для обработки систем вентиляции и кондиционирования воздуха, а также перед сносом и перепрофилированием медицинских организаций.
Во время генеральных уборок в операционных блоках, перевязочных, процедурных, манипуляционных, палатах отделений хирургического профиля предпочтение следует отдавать режимам обработки, эффективным в отношении бактерий, вирусов, грибов рода Кандида. В соматических отделениях, кабинетах амбулаторного приема, физиотерапии, лечебной физкультуры, функциональной диагностики и т. д. дезинфекцию осуществляют по бактериальному режиму.
Для проведения заключительной дезинфекции выбираются средства и режимы обеззараживания, обеспечивающие гибель соответствующего возбудителя при использовании аэрозольного метода.
Биологическая дезинфекция
Биологическая дезинфекция предполагает использование бактериофагов — особых вирусов, уничтожающих бактерии. Бактериофаги строго специфичны — каждая разновидность вируса способна взаимодействовать исключительно с определенным видом бактерий.
Для дезинфекции биологическим методом применяют препараты лечебно-профилактических бактериофагов, которые содержат комплексы вирулентных (строго литических) бактериальных вирусов, вызывающих гибель гомологичных видов бактерий. Эффект применения бактериофагов достигается за счет внутриклеточного размножения и разрушения бактериальной клетки, что сопровождается выходом зрелых фаговых частиц, способных к заражению новых бактериальных клеток.
Важно!
Применение умеренных бактериофагов в условиях медицинских организаций недопустимо, поскольку подобные вирусы могут осуществлять генетический обмен между бактериями. Это, в свою очередь, может привести к передаче генов резистентности к антибиотикам между различными штаммами микроорганизмов и ухудшению эпидемиологической ситуации.
По своему составу лечебно-профилактические бактериофаги подразделяются на монокомпонентные препараты, содержащие вирулентные фаги бактерий одного рода или вида (например, стафилококковый, стрептококковый, синегнойный бактериофаги), и комбинированные бактериофаги, содержащие несколько видов монокомпонентных бактериофагов (например, бактериофаг коли-протейный, пиобактериофаг поливалентный, секстафаг).
Дезинфекция биологическим методом с использованием бактериофагов наиболее целесообразна в отделениях эпидемиологического риска, к которым принято относить клинические отделения медицинских организаций, где существует высокая вероятность возникновения инфекций, связанных с оказанием медицинской помощи и других осложнений вследствие широкого применения инвазивных методик лечения, агрессивных медицинских манипуляций, а также госпитализации высоковосприимчивых пациентов, имеющих иммунодефицитные состояния и другие факторы риска.
Высокая вероятность развития ИСМП наблюдается в отделениях анестезиологии и реанимации, трансплантологии, гемодиализа, ожоговых, онкогематологических отделениях. Применение химических дезинфицирующих средств в отделениях риска нередко ограничено невозможностью регулярного освобождения помещений от пациентов, большим количеством сложной медицинской техникой и аппаратов.
Широкое применение антибактериальных препаратов в совокупности с другими факторами медицинской агрессии способствует формированию и распространению в отделениях риска госпитальных штаммов бактерий, которые отличаются устойчивостью к антибиотикам и химическим дезинфицирующим средствам, обладают высоким эпидемическим потенциалом и приводят к возникновению случаев ИСМП.
Биологическая дезинфекция с использованием бактериофагов — дополнительное направление, значительно повышающее эффективность профилактических и противоэпидемических мероприятий, направленных на предотвращение распространения внутрибольничных инфекций.
Важно!
Допускается использовать только те жидкие препараты лечебно-профилактических бактериофагов, которые прошли регистрацию на территории Российской Федерации в установленном порядке.
Препараты лечебно-профилактических бактериофагов не должны обладать токсическим действием или вызывать аллергические реакции у пациентов и медицинского персонала.
Лечебно-профилактические бактериофаги представляют собой стерильные очищенные фильтраты фаголизатов соответствующих видов бактерий. В промышленных условиях их освобождают от продуктов жизнедеятельности бактерий, эндо- и экзотоксинов, продуктов фаголизиса бактериальных клеток, белковых и антигенных комплексов питательных сред.
Преимущества биологической дезинфекции:
- ее можно проводить в присутствии людей, в том числе недоношенных детей и беременных женщин;
- бактериофаги устойчивы во внешней среде, совместимы со многими химическими дезинфицирующими средствами.
Обратите внимание!
Перед применением бактериофагов в медицинских организациях необходимо определить чувствительность к ним бактериального возбудителя инфекционного заболевания. Активность бактериофагов определяется по методу Аппельмана или методом Грациа (агаровых слоев). Обе методики подробно изложены в МР 3.5.1.0101-15.
Эффективная дезинфекция биологическим методом с использованием бактериофагов в медицинской организации возможна при постоянном осуществлении и реализации программы микробиологического мониторинга, которая включает оценку микробного пейзажа отделений учреждения, динамическое наблюдение за циркулирующими микроорганизмами, а также их чувствительностью к антибактериальным препаратам, дезинфицирующим средствам и антисептикам.
Показания к проведению биологической дезинфекции:
- регистрация эпидемиологического неблагополучия в медицинской организации или конкретном ее отделении, связанного с возникновением бактериальных инфекций;
- высокий риск появления и распространения инфекций, оцениваемый по данным эпидемиологического анализа и микробиологического мониторинга;
- наличие признаков формирования госпитального штамма бактерий;
- выявление штаммов микроорганизмов, устойчивых к антибиотикам и химическим дезинфицирующим средствам.
Существуют две схемы дезинфекции биологическим методом с использованием бактериофагов: интермиттирующая и однократная.
Врач-эпидемиолог выбирает схему дезинфекции на основании имеющихся эпидемиологических данных с учетом конкретной эпидемиологической ситуации в медицинской организации и прогнозом ее развития.
Интермиттирующая схема используется как мера профилактики возникновения и распространения инфекционных болезней при высоком риске заноса (распространения) известного возбудителя инфекции. Она предполагает проведение биологической дезинфекции регулярно, через каждые 3 дня. Обработка проводится в течение времени, равного трем инкубационным периодам инфекционного заболевания, в отношении которого осуществляется профилактика (в среднем до 3 недель).
Интермиттирующую схему используют в отделениях реанимации и интенсивной терапии, гнойной хирургии, ожоговом и других отделениях высокого эпидемиологического риска.
Однократная схема дезинфекции биологическим методом с использованием бактериофагов используется при интенсивном обсеменении больничной среды полирезистентным возбудителем или госпитальным штаммом микроорганизма, а также при заключительной дезинфекции после выведения больного инфекционным заболеванием из очага в медицинской организации.
При формировании эпидемического очага инфекционной болезни применяется как интермиттирующая, так и однократная схема. Не рекомендуется непрерывное длительное (более 3 инкубационных периодов) использование бактериофага из-за риска формирования резистентных к фагу микроорганизмов.
При отсутствии возбудителя бактериофаг элиминируется из больничной среды в течение 3 суток.
Порядок проведения биологической дезинфекции
Решение о проведении дезинфекции биологическим методом с использованием бактериофагов принимает заместитель главного врача по эпидемиологической работе (врач-эпидемиолог) медицинской организации. Биологическая дезинфекция проводится медицинским персоналом учреждения, который проходит соответствующий инструктаж.
Перед использованием проводят визуальную оценку качества жидкого бактериофага в заводской упаковке. Препарат должен быть прозрачным, не содержать осадка или хлопьев.
Вскрывают флакон с бактериофагом с соблюдением правил асептики. Перед использованием флакон тщательно встряхивают. Вскрытый флакон должен быть использован в течение 2 часов.
При проведении дезинфекции биологическим методом жидкий препарат наносится на поверхности в помещениях, медицинскую мебель, оборудование, изделия медицинского назначения. Доза препарата – 1–2 мл/м 2 .
Для достижения максимального эффекта бактериофаг наносится на объекты внешней среды способом орошения (распыления). Для этого целесообразно использовать беспропеллентные аэрозольные упаковки однократного применения.
Чтобы снизить мешающий эффект вспенивания препарата, допускается его разведение физиологическим раствором в соотношении 1:1.
Обратите внимание!
Особое внимание при проведении биологической дезинфекции следует уделять возможным местам скопления возбудителей: рабочим и манипуляционным столам, поверхностям шкафов с лекарственными препаратами, стойкам для инфузионных систем, медицинской аппаратуре, стенам, прикроватным тумбочкам, столам и стульям в палатах, раковинам, поручням кроватей, ручкам дверей и т. д.
С целью элиминации возбудителя из наркозно-дыхательной аппаратуры бактериофаг вносится в увлажнитель.
При регистрации очагов внутрибольничного сальмонеллеза или других бактериальных острых кишечных инфекций обработка соответствующим возбудителю бактериофагом проводится в палатах для пициентов, туалетных и санитарных комнатах.
Дезинфекция биологическим методом с использованием бактериофагов проводится в любое время суток, желательно за 3–4 часа до выполнения текущей или заключительной дезинфекции химическими дезинфицирующими средствами или же через аналогичное количество времени после ее осуществления.
При правильном распылении на участках нанесения бактериофага становится заметным мелкодисперсный слой. Это обеспечивает интенсивную циркуляцию вирусов во внешней среде и резко повышает вероятность их контакта с соответствующими бактериями, определяя высокую эффективность использования бактериофагов.
В процессе проведения биологической дезинфекции врач-эпидемиолог или помощник врача-эпидемиолога осуществляет визуальный контроль, который предполагает оценку соблюдения технологии применения препарата.
Чтобы проконтролировать качество дезинфекции биологическим методом с использованием бактериофагов, в бактериологической лаборатории проводят микробиологические исследования смывов с обработанных поверхностей через 6–8 часов после проведения дезинфекции в соответствии со следующим алгоритмом:
[1] Утв. Главным государственным санитарным врачом РФ 06.04.2015, 28.09.2015.
[2] Утв. Постановлением Главного государственного санитарного врача РФ от 18.05.2010 № 58 (в ред. от 10.06.2016).
[3] Утверждены руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом РФ 27.05.2015 (далее — МР 3.5.1.0101-15).
Обсуждаются результаты систематического обзора публикаций оригинальных исследований, посвященных устойчивости бактерий к дезинфектантам. Целью работы являлось проведение эпидемиологической оценки распространенности генов qac, smr, cep устойчивости бактерий к четвертичным аммониевым соединениям. В качестве методов использованы извлечение данных, критическая оценка и обобщение результатов исследований, опубликованных в электронных базах данных. Были получены данные о распространенности генов резистентности smr, qac A,B,C,G,H,Z у клинических штаммов актуальных возбудителей инфекций, связанных с оказанием медицинской помощи. Полученные сведения необходимо учитывать при проведении эпидемиологического и микробиологического мониторингов за данными микроорганизмами. Таким образом, практика составления систематических обзоров по вопросам устойчивости бактерий к антимикробным препаратам являются необходимым инструментом получения доказательной информации об эпидемическом потенциале возбудителей ИСМП, а также факторах, влияющих на эффективность дезинфектантов и антисептиков.

1. Ковалишена О.В. Эколого-эпидемиологические особенности госпитальных инфекций и многоуровневая система эпидемиологического надзора: дис. … д-ра мед. наук (14.02.02) / Ковалишена Ольга Васильевна; НижГМА Минздрава России. – Нижний Новгород, 2010. – 376 с.
3. Abuzaid A., Hamouda A., Amyes S.G. Klebsiella pneumoniae susceptibility to biocides and its association with cepA, qacΔE and qacE efflux pump genes and antibiotic resistance // J Hosp Infect. – 2012. – № 81(2). – P. 87-91.
4. Bischoff M. First detection of the antiseptic resistance gene qacA/B in Enterococcus faecalis // Microb Drug Resistance. – 2012. – № 18 (1). – P. 7-12.
5. Braga T.M. Involvement, and dissemination, of the enterococcal small multidrug resistance transporter QacZ in resistance to quaternary ammonium compounds / T.M. Braga [et al] // J Antimicrob Chemother. – 2011. – № 66(2). – P. 283-286.
6. Heir E., Sundheim G., Holck A. The Staphylococcus qacH gene product: a new member of the SMR family encoding multidrug resistance / E. Heir, G. Sundheim, A.L. Holck / FEMS Microbiology Letters. – 1998. – № 163. – P. 49-56.
7. Kayaoglu G. Possible role of the adhesin ace and collagen adherence in conveying resistance to disinfectants onEnterococcus faecalis / G. Kayaoglu, H. Erten, D. Ørstavik // Oral MicrobiolImmunol. – 2008. – № 23(6). – Р. 449-454
8. Mahnzounieh M. Detection of Antiseptic-Resistance Genes in Pseudomonas and Acinetobacter spp. isolated from burn patients // Jundishapur J Nat Pharm Prod. – 2014. – № 3; 9(2):e15402.
9. Pastrana-Carrasco J. QacEdelta1 gene frequency and biocide resistance in extended-spectrum beta-lactamase producing enterobacteriaceae clinical isolates // Rev Invest Clin. – 2012. – № 64. – P. 535-540.
10. Warnke P.H. The ongoing battle against multi-resistant strains: in-vitro inhibition of hospital-acquired MRSA, VRE, Pseudomonas, ESBL E. coli and Klebsiella species in the presence of plant-derived antiseptic oils / P.H. Warnke [et al] // J Craniomaxillofac Surg. – 2013. – № 41(4). – Р. 321-326.
Методология поиска. В период 2013–2015 года осуществлялся поиск информации по ключевым словам в электронных базах данных PubMed, e-library.ru, TRIP, без ограничений по языку и дате публикации. Критерии отбора: эпидемиологические исследования (клинические испытания, когортные, перекрестные исследования, исследования до-после и др). Основной критерий: наличие и распространенность генов резистентности (напр., генов smr, qac A,B,C,G,H для четвертичных аммониевых соединений) (ЧАС).
Кроме того, мы обращали внимание на источники, содержащие информацию следующего типа: сравнение минимальных ингибирующих концентраций (МИК) изучаемых культур с таковыми для тест-штаммов микроорганизмов; количественная оценка устойчивости штаммов к ДС среди изучаемых культур. В отношении нескольких публикаций для выяснения деталей эксперимента мы вели переписку с авторами этих работ.
Были определены следующие критерии исключения: повторные публикации, содержащие сходные данные; публикации исследований, представляющие информацию только о резистентности указанных микроорганизмов к антибиотикам; документы, в которых приводилась только оценка методов определения чувствительности к ДС на основе тест-штаммов микроорганизмов. Критериями качества исследований, включенных в настоящий систематический обзор, являются четкое описание методики определения чувствительности бактерий к ДС, а также наличие в тексте цифровых данных, а именно – точное указание на объем выборки, количество чувствительных и устойчивых культур и т.п. Под устойчивостью (естественной и приобретенной) бактерий понимали свойство микробов противостоять повреждающему действию механических, физических и химических факторов [2]. При выполнении поиска использовались следующие термины (одиночные и в сочетании с другими терминами): bacterial resistance, susceptibility, biocide, disinfectant, resistancegene, minimal inhibitory concentration, antiseptic, staphylococcusaureus, pseudomonasaeruginosa, еnterococcus, klebsiella, enterobacter, acinetobacter, chlorhexidine, triclosan, quaternary ammonium compound, benzalkonium. В отобранных публикациях объектами исследования выступали культуры микроорганизмов, полученные от пациентов и из внешней среды. Просмотр результатов исследований и извлечение данных проводились независимо двумя авторами. Структура поисковых запросов информации была выстроена по следующему принципу, например:
- в базах данных PubMed: ((resistance[ti] AND ("disinfectants" [Pharmacological Action] OR "disinfectants"[MeSH Terms] OR "disinfectants"[All Fields] OR "biocide"[All Fields])) AND ("staphylococcus aureus"[MeSH Terms] OR ("staphylococcus"[All Fields] AND "aureus"[All Fields]) OR "staphylococcus aureus" [All Fields])) AND "staphylococcus aureus" [MeSH Terms].
Результаты и обсуждение. Установлено, что использованные нами электронные ресурсы содержали достаточно ограниченное число описаний оригинальных исследований, посвященных изучаемой проблематике. Несколько публикаций не соответствовали критериям включения. Также ряд ссылок и URL-адресов на момент проведения данного исследования не функционировали, хотя и были проиндексированы в выбранных нами биомедицинских базах данных.
Хронологические рамки публикаций, вошедших в исследование, по изучению устойчивости Klebsiellaspp – 1980–2013 гг., P. aeruginosa – 1972–2011 гг., Acinetobacterspp – 1987–2014 гг., S. aureus – 1960–2013 гг., Enterococcusspp – 1990–2014 гг. В данный систематический обзор вошло всего 111 работ, удовлетворявших условиям поиска (распределение публикаций по видам микроорганизмов показано на схеме). В PubMed было найдено более 60 % вошедших в настоящую работу исследований. Анализ опубликованных работ показал, что подходы исследователей к оценке устойчивости микроорганизмов к ДС и стиль представления данных постоянно менялись: количественная оценка резистентных штаммов (абсолютные числа и доля от общего числа культур), определение МИК и минимальных бактерицидных концентраций. Ключевым моментом стало выявление и оценка распространенности генов устойчивости к ДС. Более того, часто авторы при оценке устойчивости ориентировались на взаимодействие биоцида с бактериальными составляющими биопленок. В ряде публикаций вывод об отсутствии устойчивости микроорганизмов к ДС был сделан по факту выявляемого снижения контаминации объектов внешней среды, а также уменьшения степени колонизации пациентов.
Проведенный систематический обзор публикаций позволил извлечь из них данные по большому количеству торговых марок ДС или в ряде случаев – в отношении активно действующих веществ. В то же время данные по чувствительности/устойчивости бактерий к ним достаточно противоречивы. Спектр протестированных субстанций включал в себя ЧАС, спирты, бигуаниды, тяжелые металлы, хлор- и кислородсодержащие ДС. Например, больше всего исследований было посвящено вопросам изучения устойчивости микроорганизмов к хлоргексидинабиглюконату, ЧАС и бензалкония хлориду: 39, 22 и 19 работ соответственно. Триклозан был объектом изучения в меньшем числе исследований (6 публикаций). Указанные ДС, как известно, активно применяются в медицинских организациях различного типа, входят в рецептуры многих торговых марок, оттого интерес к ним вполне закономерен.
Данные нашего систематического обзора позволяют говорить о различиях в методологических подходах к изучению чувствительности всех выбранных нами микроорганизмов к различным биоцидам. Нами сделан акцент на систематизации и критической оценке сведений о распространении генов резистентности к ЧАС: qacA,B,C,Z,E,ED1 и smr. Отметим, что особенности распространения гена smr были описаны только в шести работах. Несмотря на небольшое количество публикаций по этому вопросу (всего 17), в настоящее время исследование устойчивости к ДС на молекулярном уровне становятся крайне важными, наряду с традиционно осуществляемой в разных странах большой работой относительно антибиотиков.
S. aureus традиционно рассматривается как неотъемлемый компонент молекулярно-генетических исследований, проводимых в рамках эпидемиологического надзора за стафилококковой инфекцией. Характер распространенности генов qac в популяции стафилококков был изучен в 8, а гена smr – в 5 работах. В подавляющем количестве публикаций как объекты исследования авторами рассматривались MRSA, что объясняется их значимостью в возникновении ИСМП. Обращает на себя внимание разброс полученных в них показателей. Так, по данным разных авторов, гены qacA/B суммарно выявлялись в 0,7–94,6 % исследованных культур S.aureus. В отношении только MRSA от 2,1 до 94,6 % подобных вариантов стафилококка являлись носителями указанных генов. Обобщая информацию о представленности разных генов устойчивости к ЧАС из группы qac, у нас появляются основания говорить о гетерогенности показателей: от полного отсутствия (показательный пример с qacG) до наличия на высоком уровне. Распространенность гена smr находилась на достаточном уровне, при этом он идентифицирован в 3,6–44,2 % стафилококков. Ожидаемым результатом стала также широкая распространенность qacA, хотя показатели существенно варьировали (от 0,6 до 33,7 %). В то же время, более низкой она была для qacС (5,3–10,8 %), qacН (3,3–7,1 %), а также для гена qacВ (1,5 %).
Среди возбудителей ИСМП из семейства Enterobacteriaceae особый интерес у ученых вызывают штаммы Klebsiellaspp, являющиеся продуцентами β-лактамаз расширенного спектра действия (БЛРС). В ходе выборочных исследований при изучении резистентности клинических штаммов K. pneumoniae к бензалконию ген qacDE1 обнаруживался в диапазоне от 53,1 до 68,0 % [9]. В одном исследовании давалась оценка распространенности другого важного гена – qacE, который идентифицирован в 1,6 % случаев (1/64). Авторами высказано предположение, что данный механизм способствовал формированию устойчивости бактерии к двум компонентам биоцида торговой марки Trigene, относящимся к ЧАС (бензалконий, додециламин-сульфат). При проведении систематического обзора были получены публикации, посвященные обнаружению среди клебсиелл гена cepA, распространенность которого находилась на высоком уровне, составив 87,5 % [3].
Количество публикаций по изучению устойчивости Enterobacterspp, удовлетворявшихся критериям включения, было намного меньше по сравнению с другими рассматриваемыми микроорганизмами. В работах, посвященных распространению генов устойчивости к ДС, главным образом поднимались вопросы наличия у бактерий гена qacDE1. По обобщенным данным, он обнаруживался у клиническим штаммов Enterobacterspp в достаточном количестве, с колебаниями от 55 до 100 % случаев.
Неферментирующие грамотрицательные бактерии (НГОБ) неизменно являются объектами изучения чувствительности к антибиотикам. В то же время в настоящий момент крайне мало количество публикаций по оценке вклада различных механизмов в формирование устойчивости к ДС и антисептикам. На момент проведения нашего обзора из баз данных была извлечена одна публикация с описанием результатов подобного исследования на малой выборке. В нем у нескольких клинических штаммов Acinetobacterspp, изолированных в ожоговых центрах, присутствовали гены qacE (2/5) и qacDE1 (практически у всех изученных штаммов – 4/5). Авторы отмечают меньшее количество ацинетобактеров-носителей подобных генов по сравнению с синегнойной палочкой, выделенной ими в тех же условиях [8]. Важно отметить, что в подавляющем количестве публикаций, касающихся устойчивости НГОБ к ДС, обычно приводится описание того или иного механизма резистентности без количественной оценки распространенности возможных генов устойчивости в конкретной популяции.
В настоящее время ЧАС находят широкое применение в здравоохранении и различных отраслях народного хозяйства (в частности, пищевой промышленности). Полярность таких биоцидов обусловлена наличием у них поверхностно-активных свойств, отсутствие коррозирующего действия на обрабатываемые предметы, а также относительно низкой токсичностью. В то же время практика использования ДС на основе ЧАС требует проведения эпидемиологического и микробиологического мониторинга ввиду доказанного риска быстрого формирования к ним устойчивости у бактерий. Понимание молекулярных механизмов формирования устойчивости к ним существенно изменилось. Было установлено, что подобная резистентность ассоциирована с присутствием генов qacA и qacB, а также smr. Они кодируют синтез трансмембранных эффлюксных белков, которые обусловливают устойчивость микроорганизмов к липофильным катионным веществам, в т.ч. ЧАС, а также красителям (напр., этидия бромиду). Важной находкой было обнаружение у гена qacA способности влиять на появление устойчивости и к хлоргексидину. Гены qac можно обнаружить, как показано в ряде исследований, на крупных плазмидах.
Механизмы устойчивости грамнегативных бактерий к дезинфектантам, как правило, определяются генами, ассоциированными с резистентностью к ЧАС, а именно наличие у таких микроорганизмов генов qacE и qacDE. При этом представляется важным их мониторинг не только у штаммов с явными признаками резистентности к антибиотиками (к примеру, продукция БЛРС), но у вариантов бактерий с другими маркерами внутрибольничного эковара.
Методические особенности в представлении разными авторами результатов исследования устойчивости некоторых микроорганизмов к биоцидам, в частности, НГОБ обусловливают необходимость расширения информационного поиска, оптимизации параметров систематического обзора публикаций и проведения динамической оценки.
Заключение
Для объективной оценки устойчивости микроорганизмов к антимикробным препаратам необходимо осуществлять систематические обзоры не только по антибиотикорезистентности, но и устойчивости к ДС. В методическом отношении важно учитывать наличие на данный момент ограниченного числа исследований, результаты которых отличаются существенной гетерогенностью. Подобные обзоры, организованные с учетом принципов доказательной медицины, должны быть, безусловно, доступны специалистам на русском языке. Ряд вопросов, касающихся проблемы резистентности актуальных возбудителей ИСМП к ДС, применяемым в практическом здравоохранении, остаются изученными не в полной мере. Это является основанием для проведения молекулярно-генетического мониторинга устойчивости к ДС, внедрение унифицированной методики изучения чувствительности микроорганизмов к биоцидам.
Читайте также: