Вакцина против сальмонеллезного аборта лошадей инактивированная
Обновлено: 23.04.2024
Сальмонеллез лошадей — инфекционная болезнь, проявляющаяся у жеребых кобыл абортом, у жеребят — поносом, высокой температурой тела, воспалением суставов и истощением.
Экономический ущерб, наносимый сальмонеллезом лошадей коневодству, заключается в недополучении приплода и нарушении цикла воспроизводства стада.
В настоящее время паратифозный аборт лошадей встречается в странах Западной Европы, США, Англии, в странах Азиатского континента, в России и странах СНГ.
Возбудитель болезни — Sal. abortus equi Сальмонеллез лошадей иногда может вызвать Sal. typhi murium.. Сальмонеллы мышиного типа у людей являются причиной пищевых токсикоинфекций.
Сальмонеллезный аборт лошадей преимущественно регистрируется в зимне-весенний период (март-май) и часто протекает в виде энзоотии, охватывающей в короткий промежуток времени значительное количество животных. К болезни наиболее восприимчивы молодые 4-6-летние кобылы, которые не имеют иммунитета и более подвержены влиянию неблагоприятных факторов тебеневки.
Возникновению и распространению болезни способствует снижение иммунобиологической реактивности жеребых кобыл вследствие неблагополучных условий тебеневки (недостаток в рационе белка, витаминов, макро- и микроэлементов, несвоевременная подкормка, глубокий снег, гололедица).
Возможность возникновения сальмонеллеза возрастает при концентрации кобыл для подкормки и выжеребки, обмене жеребчиками без учета эпизоотического благополучия.
В неблагополучных пунктах болезнь регистрируется через 2-3 года. Периодичность обуславливается снижением напряженности иммунитета, развивающегося после переболевания.
Для профилактической иммунизации лабораторией по разработке микробных препаратов Якутского НИИ сельского хозяйства и отделом вирусологии ВИЭВ разработана инактивированная вакцина из штамма Sal. abortus equi БН-12 (авторы М.П. Неустроев, К.П Юров, Н.П. Тарабукина, И.А.Ордахов, А.А. Баишев, С.Г. Петрова) [51].
Научная новизна разработки подтверждены двумя патентами.
Вакцину применяют для профилактической иммунизации кобыл против сальмонеллезного аборта в соответствии с инструкцией, утвержденной Россельхознадзором (2006 г.). В неблагополучных по сальмонеллезу хозяйствах кобыл вакцинируют с 4 по 7 месяц жеребости.
В целях повышения эффективности вакцинации перед иммунизацией проводят дегельминтизацию препаратами ивомек, аверсект или другими эффективными средствами широкого действия.
При внедрении вакцинопрофилактики в отдельном неблагополучном хозяйстве экономический эффект на 100 голов кобыл составляет 64400 руб., а на 1 рубль затрат 10,7 руб. Деловой выход жеребят повышается 10-20%.
Основное значение для профилактики абортов кобыл имеет организация кормовой базы, в частности, улучшение пастбищного содержания лошадей, заготовка высококачественного сена, правильное сбалансирование рационов. Рекомендуется минерально-витаминная подкормка жеребых кобыл по рецептам, разработанным сотрудниками лаборатории продуктивного коневодства Якутского НИИСХ.
Сотрудниками Якутского НИИСХ разработан комплекс мероприятий по биологическому обеззараживанию и переработке навоза и птичьего помета в условиях Крайнего Севера (авторы Н.П. Тарабукина, А.И. Степанов, М.П. Неустроев). Мероприятия предусматривают площадочное компостирование с торфом, сапропелем, соломой (оптимальный срок закладки компостов с мая по сентябрь-октябрь) и добавление микроба-антагониста штамма бактерий Вас. subtilis ТНП-3 из расчета 0,5% от массы компоста с выдержкой до 80 дней в летний период [32, 37, 55].
Мыт
Мыт — острая инфекционная болезнь лошадей, преимущественно жеребят проявляющаяся катарально-гнойным воспалением слизистой оболочки носоглотки регионарных (подчелюстных, заглоточных и других) лимфатических узлов. Болезнь распространена повсеместно и регистрируется в большинстве хозяйств занимающихся коневодством.
Возбудитель – Str. equi (мытный стрептококк серогруппы С).
Мытом болеют чаще жеребята от 6-месячного возраста и молодые лошади до 5 лет реже – жеребята-сосуны 1-2-месячного возраста. Основными источниками возбудителя болезни служат больные животные. Переболевшие и здоровые лошади также могут быть носителями возбудителя инфекции. Возбудитель мыта идентифицируется также из органов абортированных плодов.
Заболевание возникает при ослаблении естественной резистентности организма под влиянием неблагоприятных факторов внешней среды - таких, как неполноценное белково-витаминно-минеральное питание, несвоевременная подкормка, резкие колебания температуры воздуха, длительные перегоны. Распространению мыта также способствует концентрация значительного поголовья взрослых лошадей и жеребят на одном месте в осенний период для подкормки и проведения зооветеринарных мероприятии.
Мыт протекает остро, подостро и иногда хронически. Различают типичную, абортивную и метастатическую формы.
При содержании больных жеребят в плохих условиях и при несвоевременном проведении лечебных мероприятий может возникнуть осложненная — метастатическая форма мыта. Абсцессы образуются в околоушных, плечевых, коленных, а иногда лимфатических узлах грудной и брюшной полостей и паренхиматозных органах. Наблюдаются признаки гнойной бронхопневмонии и перитонита. Иногда болезнь осложняет вирусные инфекции (грипп, ринопневмония) или протекает в виде смешанном бактериальной инфекции, совместно с сальмонеллезом. В таких случаях летальность может достигать до 22% [43, 50].
Для лечения используют:
- бицилин-3 или 5 в сочетании с этонием (внутримышечно в область верхней трети шеи или интраназально) двукратно с интервалом 7-10 дней).
В целях профилактики проводят следующие мероприятия:
- введение в рацион (в зимний период) витаминно-минеральной смеси, содержащей минеральные вещества, витамины А, Е, С и иммуностимуляторы;
- четырехкратное ежемесячное введение в течении зимнего содержания бициллина с этонием в профилактических дозах;
- биотермическое обезвреживание навоза компостированием (патент №2105810, 27.02.1998);
- иммунизация вакциной с иммуномодулятором дважды с интервалом 14 дней (патенты на изобретение №2080381, 27.05.1997, №2122428. 27.11.1998 №2143279, 27.11.1999), согласно наставлению по применению вакцины против мыта лошадей инактивированной с иммуномодулятором (утверждено Департаментом ветеринарии МСХ РФ, 29.02.2000) [43, 50].
Ринопневмония
Ринопневмония лошадей (вирусный аборт лошадей) - вирусная болезнь, характеризующаяся воспалением слизистых оболочек верхних дыхательных путей, а у кобыл – абортами во второй половине жеребости.
Вирусный аборт распространен во многих странах мира, включая России и страны СНГ.
Возбудитель герпетический вирус первого типа (герповирус 1).
К ринопневмонии восприимчивы все лошади независимо от возраста и пола. Особенно чувствительны чистопородные животные и молодняк до 1 года. Лошади местных пород более устойчивые.
Аборты наступают на 5-11 месяце жеребости, но чаще аборты происходят на 10 месяце. Периодичность вспышек ринопневмонии в хозяйствах составляет 3-4 года. Переболевшие лошади приобретают различной продолжительности иммунитет. Кобылы после аборта остаются невосприимчивыми в течение нескольких лет. У жеребят вырабатывается непродолжительный иммунитет, они могут повторно заболеть через 1,5-2 месяца.
Различают несколько форм клинического проявления ринопневмонии: респираторную, аборты, генитальную и нервную.
После установления диагноза больных и подозреваемых по заболеванию ринопневмонией изолируют. Запрещают перегруппировку, ввоз и вывоз племенных лошадей. Заболевших жеребят лечат симптоматически. Для предупреждения возникновения вторичной бактериальной инфекции (мыт, сальмонеллезы) используют антибиотики (бициллин – 1, 3, 5 и др.). Ограничительные мероприятия снимают через 2 месяца после последнего случая аборта или рождения нежизнеспособного приплода, а при наличии в хозяйстве конематок во второй половине жеребости – после благополучной выжеребки.
Абортированные плоды, плодовые оболочки, навоз сжигают. Места аборта обрабатывают дезинфицирующими средствами (2%-ный раствор гипохлорита кальция и параформальдегида).
Для профилактической и вынужденной иммунизации используют сухую культуральную вирусвакцину из штамма СВ/69. Жеребят вакцинируют в возрасте 3-х месяцев и ревакцинируют через 3-4 месяца. Жеребых кобыл иммунизируют двукратно: первый раз на 1-3 месяцах жеребости, повторно через 3-4 месяца, но не позднее 7-го месяца жеребости. Остальных лошадей вакцинируют двукратно с интервалом в 3-4 месяца. Вакцинацию проводят в соответствии с наставлением по применению (1984 г.) [59].
Сотрудниками ЯНИИСХ доказана целесообразность одновременного использования с вакциной полирибоната или культуральной жидкости штамма бактерий Вас. subtilis ТНП-3 в целях повышения эффективности иммунизации.
Вакцинация является основой профилактических мероприятий против ринопневмонии – вирусного аборта кобыл. При этом необходимо проводить общие ветеринарно-санитарные мероприятия, включающие: наложение ограничений на неблагополучное хозяйство с запрещением ввоза и вывоза лошадей на срок до двух месяцев после последнего случая абортов; обязательную дезинфекцию мест выжеребки; контроль кобыл и жеребцов путем лабораторных серологических или вирусологических исследований.
Грипп
Грипп (заразный катар верхних дыхательных путей, инфлюэнца лошадей) – острая высококонтагиозная болезнь, характеризуется поражением органов дыхания, непостоянной лихорадкой, угнетением, нарушением сердечной деятельности. Могут отмечаться конъюнктивит, слезотечение.
Гриппом болеют лошади всех возрастов. Характеризуется высокой контагиозностью и быстрым охватом большого числа лошадей, обычно поголовно. Возникает в любое время года, но обычно в осенне-зимний период. Болеют лошади независимо от породы, возраста, условий содержания (в табунах, конюшнях и т.д.) Тяжесть течения болезни обусловливают плохое содержание и кормления, концентрация большого поголовья на одном месте, особенно в осенне-зимний период (в период отъема жеребят). В сырую и холодную погоду при снижении защитных сил организма у больных лошадей могут развиться осложнения в виде бронхопневмонии, гнойного фарингита, конъюнктивита и других, вызываемые патогенными стрептококками (мытного и гнойного).
Грипп протекает в типичной, атипичной и злокачественной форме.
Для лечения применяют:
- бициллин или другие антибактериальные препараты для предупреждения развития вторичной бактериальной инфекции;
В целях специфической профилактики проводят иммунизацию лошадей поливалентной инактивированной вакциной.
Лептоспироз
Лептоспироз – инфекционная болезнь животных и людей, вызываемая бактериями из обширной группы лептоспироз и характеризирующаяся, как правило, желтухой.
Относится природноочаговым инфекциям. Естественным источником возбудителей служат грызуны разных видов, собаки.
Лептоспироз у лошадей проявляется спорадически. Болеют животные различного возраста, чаще 2-7 лет. Жеребые кобылы могут абортировать. Вспышки лептоспироза возникают в дождливые годы в пастбищный период, при этом болезнь характеризуется типичным клиническим проявлением и острым течением. Однако случаи заболевания возможны круглый год. Лошади не являются естественным хозяином этих возбудителей [59].
Лечение симптоматическое. Для профилактики используют противолептоспирозную вакцину.
Производство кумыса
В условиях республики при круглогодичном пастбищном содержании лошадей кобыл можно поддаивать в летний сезон в течение 3 мес, с начала июня до конца августа. Якутские лошади могут дать за 6 мес лактации в среднем 1750л молока, при хорошем кормлении и правильном доении за летний сезон можно надаивать от каждой кобылы до 400л молока на производство кумыса.
Для организации кумысопроизводства рекомендуется создавать дойные косяки из высокомолочных добронравных кобыл среднего возраста (от 9 до 14 лет) и с хорошей молокоотдачей. Наиболее молочными показали себя кобылы, имеющие хорошо развитое вымя чашевидной формы с развитыми и удобно расположенными для доения сосками.
Начинать поддаивать кобыл 3-4 раза в день через каждые 2,5-3,0ч рекомендуется через 30 дней после выжеребки, а жеребят днем во время дойки следует содержать в специально оборудованных сараях, давая им вволю зеленую траву, сено и 1-2кг концентратов. Вечером, после дойки, жеребят следует выпускать на пастбище вместе с кобылами, а осенью, после окончания кумысного сезона, жеребята снова остаются под матками при круглосуточном подсосе.
Доение кобыл должно проводиться быстро и напоминать сосание. Доить кобыл следует с левой стороны или тремя пальцами, не оттягивая при этом соски, а подвергая их своеобразным зажимам. Правой рукой обычно выдаивается правая сторона вымени, левой-левая. Кобылы скоро привыкают к доению, но встречаются такие, которых приходится фиксировать веревкой, чтобы кобыла не лягалась.
Можно использовать для доения кобыл специальный доильный аппарат ДДА-2. Он очень прост и удобен в обращении: его легкие стаканы из пластмассы соответсвуют форме соска кобыл. Работа аппарата автоматически согласуется с силой струи молока. Рабочие параметры аппарата: число пульсаций – 80-90 раз/мин, величина вакуума – 0,40-0,45 кг/см³. После некоторой переделки, с учетом особенностей вымени и молокоотдачи кобыл, можно использовать электродоильные аппараты ДА-3М, применяемые в скотоводстве.
Существуют два способа приготовления кумыса: народный – когда кумыс в течение 2-3 суток выдерживается в посуде, и современный – с ускоренным созреванием кумыса, применяемого для лечебных и профилактических целей.
При первом способе в качестве кумысной закваски используется национальный молочно-кислый продукт – сорат или пахта с ячменным отваром. В объеме готового продукта кобылье молоко должно составлять 70%, по 15% - пастеризованное цельное молдоко и питьевая кипяченая вода.
При втором способе прменяются специальные кумысные чистые культуры, в этом случае кумыс приготовляют только из кобыльего молока по технологической инструкции (ОСТ-46-69-77).
Заключение
По расчетам ученых ВНИИ коневодства, табунное коневодство является наиболее экономически выгодной отраслью пастбищного животноводства. Отличительной особенностью аборигенных пород лошадей, разводимых табунным способом, является низкорослость и невысокая живая масса, неприхотливость к условиям кормления и содержания, обусловленные высокими приспособительными качествами этих пород к экстремальным условиям разведения. В настоящее время селекционная работа с лошадьми табунного содержания, в отличие от приемов и методов, применяемых в коннозаводстве, имеет свою специфику и направлена на увеличение размеров тела лошадей при сохранении их высоких приспособительных качеств.
У табунных лошадей приспособительные качества, в отличие от культурных пород, имеют прямое хозяйственно -полезное значение, так как приспособительные качества непосредственно влияют на воспроизводительные качества маток. Таким образом, более приспособленные к экстремальным условиям лошади в течение хозяйственного использования приносят больше приплода с наименьшими затратами труда и средств.
На основе изучения эколого-физиологических механизмов адаптации лошадей якутской породы к экстремальным условиям Севера, нами найдены морфологические и физиологические признаки адаптации якутской лошади к условиям разведения. В частности, как селекционный признак предложен применить показатель эйрисомности (массивнасти) типа телосложения лошадей. Именно лошади с таким типом телосложения наиболее приспособлены к косячно-тебеневочному содержанию, отличаются кондиционной устойчивостью, высокими воспроизводительными качествами и, наконец, при одинаковых показателях промеров высоты в холке, они выгодно отличаются высокой живой массой, в отличие от лошадей лептосомного типа телосложения. Таким образом, эйрисомность (массивность) типа телосложения, наряду с показателем крупности, является одним из ведущих селекционных признаков при работе с местными породами лошадей.
При селекции лошадей местных пород табунного содержания по данным бонитировки лошадей анализируется структура данной популяции по фенотипу (по данным высоты в холке и индексу массивности). Вторым, после показателей промеров и живой массы лошадей, важным селекционным признаком для отбора табунных лошадей служат их приспособительные качества, к которым относятся: выше описанный показатель эйрисомности (массивности); степень развития и качество зимнего шерстного покрова; нагульная и нажировочная способность; кондиционная устойчивость, а также косячные качества жеребцов-производителей.
Не все лошади аборигенных пород одинаково высокоадаптированы к существующим условиям разведения. Среди них имеются и лошади со средними и даже с низкими адаптивными качествами. Как правило, 10-20 процентов из маточного поголовья относятся и стрессчувствительным типам реактивности и большая часть из них абортируют при воздействии сильных зимних холодов.
Изучение наследуемости типа стрессреактивности лошадей показало, что эти качества передаются по материнской линии, т.е. какой тип у матери –такой и будет у потомка. Исходя из этого, отбор по этому признаку необходимо провести среди маточного состава табуна, начиная с отъемного возраста.
При табунном методе содержания лошадей основным хозяйственным показателем коневодства является производство конского мяса и молока. Исходя из этих требований, в зависимости от экологических условий региона разведения лошадей, структура табуна соответственно неодинакова и не идентична со структурой при их конюшенном содержании. Как правило, основным убойным контингентом при этом служат молодняк в возрасте 6-ти месяцев или в 2,5 лет. В первом случае доля маточного поголовья составляет 50-55% от табуна, а во втором случае оно составляет 35-42%. Первый вариант структуры табуна используется в регионах с наиболее экстремальными условиями разведения (Якутия и сходные с ним), а второй вариант применяется в регионах, где экологические условия разведения лошадей более мягкие (юг Сибири, Башкортостан, Поволжье, и.т.д.).
В современных условиях развития животноводства, основная задача селекционной работы с породами табунного содержания заключается в увеличении размеров тела лошадей с целью повышения их мясных качеств при обязательном сохранении их высоких приспособительных качеств. Здесь направление селекции и естественный отбор как бы противоречат друг другу. При этом на первый план выдвигается требование улучшения условий кормления и содержания лошадей, соответствующих их организму противостоять воздействию экстремальных условий среды. Для этого нужно иметь необходимые запасы резервов грубого корма и фуража для организации подкормки табунных лошадей в критические периоды зимовки. Только в этом случае селекция достигнет своей основной цели– усовершенствования продуктивных качеств пород лошадей табунного содержания.
Одним из важных мероприятий, повлияющих на значительное повышение показателей делового выхода жеребят и на сохранность конепоголовья, является своевременное проведение профилактических ветеринарных работ в табунном коневодстве. Среди них важное значение имеет проведение вакцинаций против мыта и паратифозного аборта кобыл, которые разработаны сотрудниками ЯНИИСХ РАСХН и широко внедряются в хозяйствах Республики Саха (Якутия).
В статье рассматриваются вопросы диагностики и профилактики сальмонеллезного аборта кобыл. Приводятся результаты исследований по изучению культурально – морфологических, биохимических и антигенных свойств эпизоотических штаммов сальмонелл, выделенных от абортированного плода кобыломатки.

1. Матвиенко Б.А. Характеристика живой сухой вакцины против паратифозного аборта кобыл из штамма Е-841// Вестн. с.-х. науки Казахстана. 1973. – № 4. – С. 107–110.
2. Юров К.П., Амирбеков М.А. Поствакцинальный иммунитет при вакцинации у жеребых кобыл // Тр. ВИЭВ. Всесоюзный институт экспериментальной ветеринарии. 1984. – Т. 61. – С. 72–76.
3. Матвиенко Б.А, Бияшев К.Б., Жанузаков Н.Ж. Вакцинопрофилактика сальмонеллезного аборта кобыл // Вестник с.-х. науки Казахстана. – 1977. – № 5. – С. 77–80.
4. Шустер Б.Ю. Вакцины из аттенуированных штаммов сальмонелл: дисс….докт. Вет. наук. – М.: 1988. – С. 103–115.
5. Определитель Bergey’s Manual of Systematic Bacteriology /Department of Microbiology and Molecular Genetics: Michigan State University: USA, 2005, Volum 2. Part В. p. 764–799.
6. Бутковский В.Ф., М.П. Неустроев и др. Профилактика и лечение болезней лошадей в Якутской АССР: Методические рекомендации. – Якутск, 1987. – 12 с.
7. Бутковский В.Ф. Изучение сальмонеллеза лошадей в Республике Саха (Якутия) // Эпизоотология и профилактика болезней животных в условиях Якутии. – Новосибирск, 1994. – С. 28–34.
8. Петрова С.Г. Иммунопрофилактика абортов лошадей сальмонеллезной и ринопневмонийной этиологии в условиях Якутии: Автореферат дисс…канд. Вет. наук. – Якутск, 2006. – С. 23–25.
9. Неустроев М.П., Тарабукина Н.П Разработка новых ветеринарных препаратов в условиях крайнего севера // Эпизоотология и профилактика болезней животных в условиях Якутии. – Новосибирск, 1994. – С. 41–45.
В статье рассматриваются вопросы диагностики и профилактики сальмонеллезного аборта кобыл, который часто регистрируется на территории Казахстана. Мониторинговыми исследования установлено, что с 2010 по 2015 годы выход жеребят на 100 голов кобыломаток стабильно снижается. С целью выяснения причины снижения рождаемости жеребят, изучена эпизоотическая ситуация по сальмонеллезному аборту кобыл в хозяйствах Алматинской области. При вспышках болезни проводили выделение возбудителя инфекции от абортплодов кобыл. Приводятся результаты исследований по изучению культурально – морфологических, биохимических и антигенных свойств эпизоотических штаммов сальмонелл, выделенных от абортированных плодов кобыломаток. Авторами описаны биологические свойства аттенуированного вакцинного штамма, на основе которого изготавливается безопасная, высокоиммуногенная вакцина против сальмонеллезного аборта кобыл. Вакцина прививается жеребым кобылам однократно, продолжительность иммунитета – один год.
Цель – выделение культур из абортированных плодов кобыл, их идентификация на основании изучения биологических свойств, разработка методов специфической профилактики сальмонеллезного аборта кобыл.
Сальмонеллезный аборт кобыл – распространенная болезнь жеребых кобыл, сопровождающаяся преждевременными родами (абортами) и рождением нежизнеспособного плода. Возбудитель Salmonella abortus-equi открыт в 1893 году Smith и Kilborne в Америке, в 1901 году Д.В. Поляковым в России. В литературе иногда встречается под названием Salmonella abortiva-equina (синоним) [2]. Аборты могут принимать массовый характер, в табуне абортируют до 80 % кобыл. У больных сальмонеллезом кобыл изредка рождаются больные жеребята, у которых болезнь сопровождается бактериемией, тяжелым токсикозом, истощением, приводящим к гибели. Первые сведения по эпизоотологии болезни в республике были опубликованы в 1940 и 1950 годах, из которых вытекает, что инфекционные аборты среди кобыл в Казахской ССР регистрировались с начала 30-х годов прошлого века. В разные годы аборты кобыл достигали 6 – 30 %, из них свыше 50 % сальмонеллезной этиологии. В 1970 и 1971 годах в хозяйствах республики регистрировались массовые аборты сальмонеллезной этиологии: так в Енбекши-Казахском районе Алма-Атинской области аборты отмечены у 44 % конематок, Нарынколском районе – 20-40 %; Чиликском районе – 30 % конематок абортировало; Аксуском районе Талды-Курганской области – 43 %; Капальском и Каратальском районах отмечались аборты сальмонеллезной этиологии. В 1969 – 1974 годах аборты отмечались в хозяйствах Восточно-Казахстанской (около 40 %), Жамбылской (20 %), Кызылординской (до 25 %) областях. В 1981 году в хозяйствах Мангыстауской области из 1000 кобыл абортировало 384 (38, 4 %). В декабре 1985 года в Атырауской области из 260 жеребых кобыл абортировало 155 (59, 5 %).
В настоящее время в связи с тем, что основное поголовье лошадей от общего числа в республике сосредоточено в личных подворьях граждан и фермерских хозяйствах, возросла актуальность профилактики сальмонеллезного аборта кобыл, а также ведения статистического учета заболеваемости [3]. Мониторинговыми исследования установлено, что с 2010 по 2015 годы выход жеребят стабильно снижается – 59/100; 56/100; 53/100; 50/100; 45/100 голов кобыломаток соответственно. С целью выяснения причины такого снижения рождаемости жеребят нами изучена эпизоотическая ситуация по сальмонеллезному аборту кобыл в хозяйствах Алматинской области. При вспышках болезни проводили выделение возбудителя инфекции от плодов абортировавших кобыл.
В Алматинской области расположены 16 районов, во всех районах области разводятся лошади, в том числе племенные. На 10 июля 2015 г. в области содержатся 288592 головы лошадей. Наибольшее количество животных сосредоточено в частных подворьях населения (641 836 голов). В хозяйствах населения области находятся 150720 голов лошадей, в крестьянских и фермерских хозяйствах находятся 143404 головы, а в сельхозпредприятиях содержится 16 500 голов лошадей. Выход жеребят по области на 100 кобыломаток составляет не более 50. Ситуация осложняется тем, что наибольшее количество лошадей сосредоточено в хозяйствах и частных подворьях населения, где не ведется учет заболеваемости животных. Частные владельцы зачастую скрывают случаи абортов у кобыл.
В 2015 году в Алматинской области получено 64915 жеребят. Наибольшее количество лошадей находится в Кербулакском, Жамбылском и Райымбекском районах. Однако в них выход жеребят в среднем составляет 45 %. Например, в Енбекшиказахском районе в текущем году получено 2281 жеребенок, что составляет всего 34 %, в Кербулакском районе в текущем году получено 3978 жеребят, что составляет всего 41 %, в Жамбылском – 45 %, в Саркандском районе – 43 %, в Балхашском районе – 52 %, в Райымбекском – 56 %. В связи с тем, что основное поголовье лошадей от общего числа в республике сосредоточено в личных подворьях граждан и фермерских хозяйствах, возросла актуальность профилактики сальмонеллезного аборта кобыл, а также ведения статистического учета заболеваемости [4].
Материалы и методы исследования
Отбор проб из паренхиматозных органов абортплода кобылы приведен на рис 1.

Рис. 1. Отбор проб от абортплода кобылы для бактериологических исследований
Результаты исследования и их обсуждение
Диагностика заболевания осуществляется на основании клинико-эпизоотологических, патологоанатомических данных, а также результатов бактериологического и серологических исследований. Посевы из патологического материала делали на МПА, МПБ, среды Клиглера и Эндо, висмут – сульфитный агар из печени, сердца, селезенки, костного мозга из бедренной кости плода. От всех абортированных плодов выделили культуру сальмонелл, которую затем дифференцировали по культурально – морфологическим, биохимическим и антигенным свойствам [4]. На питательных средах отмечался обильный рост сальмонелл. На МПА росли круглые, блестящие, выпуклые влажные колонии с голубоватым оттенком, на среде Клиглера – ярко-желтые круглые колонии, на агаре Эндо – типичные колонии светло-розового цвета, на висмут-сульфитном агаре –бесцветные блестящие колонии. При микроскопии окрашенных по Граму мазков наблюдались полиморфные грамотрицательные мелкие палочки с закругленными концами. Культура агглютинировалась в РА (реакции агглютинации) на стекле с поливалентной и монорецепторными сыворотками производства Краснодарской биофабрики. Все выделенные культуры агглютинировались сыворотками О – IV (++++), ХII (+++), H – enx (++++) [5].
При посеве культур уколом на ПЖА наблюдалась характерная подвижность сальмонелл (подвижные палочки). Выделенные культуры идентифицировали методом изучения биохимических свойств путем культивирования на среде Гисса. Все культуры были идентичны и не изменяли инозит, глицерино – фуксиновый бульон, раффинозу, салицин; сероводород не образовывали (этот признак отличает Salmonella abortus-equi от других сальмонелл) и не продуцировали индола; ферментировали глюкозу, маннит, арабинозу, дульцит, ксилозу, рамнозу, галактозу. Для выявления протеолитической способности испытуемые штаммы засевали на МПЖ. В пробирках, где под действием ферментов бактерий проиcходил протеолиз желатина, среда разжижалась. При постановке биопробы на белых мышах гибель животных наступалв на 3-4 сутки после заражения.
На основании клинико-эпизоотологических данных, изучения культурально – морфологических, тинкториальных, биохимических и антигенных свойств выделенные эпизоотические штаммы сальмонелл отнесены к Salmonella abortus-equi. Во всех случаях возбудителем аборта у кобыл являлась Salmonella abortus-equi. По культурально – морфологическим, биохимическим и антигенным свойствам штаммы были идентичны выделенным эпизоотическим изолятам сальмонелл, выделенным ранее и эталонному коллекционному штамму Salmonella abortus-equi 7/1.
Проводили электронную микроскопию сальмонеллезной культуры, приготовленную из суточной агаровой культуры Salmonella abortus-equi. Бактериальную взвесь (концентрация 500 млн микробных клеток/см3 по оптическому стандарту ГИСК (Государственный институт стандартизации и контроля им. Л.А. Тарасевича) наносили пастеровской пипеткой на парафин в чашке Петри. При нанесении на парафин капля взвеси принимала округлую форму и не растекалась (всего 2–3 капли). Затем методом флотации погружали специальную золотистую сеточку в каплю суспензии сальмонелл на 1 минуту. Чашку Петри с сеточкой, на которой находилась бактериальная взвесь, закрывали на 24 часа и оставляли для высушивания. Через сутки капля микробной суспензии высыхала. Высохшую каплю контрастировали следующим образом: через сутки на парафин в чашке капали каплю контрастера – 2 % раствор фосфорно – вольфрамовой кислоты (ФВК) пастеровской пипеткой, сеточку топили в капле подложкой вверх. Контрастировали 1,5–2 минуты. Затем сеточку пинцетом аккуратно вынимали, удаляли лишнюю жидкость прикосновением фильтровальной бумаги. Сеточку промывали от контрастера дистиллированной водой из шприца (очень осторожно). Сеточку с бактериальной взвесью сушили в контейнере 7 суток. После высушивания препарат был готов для просмотра под электронным микроскопом.
Электронный снимок Salmonella abortus-equi представлен на рис. 2.
На рис. 2 представлена бактериальные клетка из одного клона (популяция из одной клетки без предварительной конъюгации). Стационарная фаза. На цельной клетке сальмонелл виден обрывок перитрихиально расположенного жгутика. Также видна трехслойная клеточная мембрана (наружный слой клеточной стенки). В центральной части клетки расположен нуклеоид большой величины. Зона нуклеоида заполнена фибриллярным компонентом. Вблизи нуклеоида локализованы клеточные включения округлой формы. Включения имеют мелкозернистое строение и ограничены от цитоплазмы мембраной. По всей цитоплазме расположены мелкие внутриклеточные включения. Увеличение х 80 000.
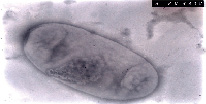
Рис. 2. Электроннограмма штамма Salmonella abortus-equi
Таким образом, выделенная культура сальмонелл была идентифицирована как Salmonella abortus-equi.
Профилактика Патентный поиск показал, что в Америке и в странах Европы не разработаны и не применяются вакцины против сальмонеллезного аборта кобыл. В Якутии применяется инактивированная формолквасцовая инактивированная вакцина против сальмонеллезного аборта кобыл с иммуномодулятором, адаптированная для местной породы лошадей [6, 7]. В Якутии также разработана и применяется ассоциированная убитая вакцина против ринопневмонии и сальмонеллезного аборта кобыл [8, 9]. Для повышения эффективности ассоциированной вакцины и повышения иммунобиологической реактивности организма к вакцине в качестве иммуномодулятора добавляют культуральную жидкость бульонной культуры штамма бактерий Bacillus subtilis ТНП-3 ДЕП, выделенного из мерзлото-переходной почвы [9]. Нами разработана и успешно апробирована на жеребых кобыломатках вакцина сухая живая против сальмонеллезного аборта кобыл из штамма Salmonella abortus – equi Е-841. Вакцинный штамм был получен методом отбора клонов, аттенуированных под влиянием химического мутагена- нитрофуранов с последующей селекцией мутантов. Штамм В-0147 Salmonella abortus – equi Е-841 утратил абортогенные свойства, имеет умеренную остаточную вирулентность (вирулентность штамма снижена в 20 раз по сравнению с природным прототипом), обладает высокой иммуногенностью. Вакцинный аттенуированный штамм обладает типичными для Salmonella abortus – equi культуральными, биохимическими и антигенными свойствами. Существенным отличием штамма В-0147 Salmonella abortus – equi Е-841 от вирулентного прототипа является ауксотрофность в отношении тиамина и никотиновой кислоты; штамм образует аргинин – декарбоксилазу и слабо – лизин–декарбоксилазу.
Вакцинный штамм В-0147 Salmonella abortus – equi Е-841 депонирован нами в Республиканской коллекции микроорганизмов (РКМ) в Национальном референтном центре по ветеринарии (коллекционный номер В-0088), г. Астана. В РКМ депонирован также контрольный (вирулентный) штамм Salmonella abortus – equi коллекционный номер В–0099), выделенный нами из абортированного плода – жеребенка в 2005 году в Алматинской области. Штамм применяется для контроля иммуногенной активности вакцины против сальмонеллезного аборта кобыл.
Вакцинный аттенуированный штамм сохраняет слабую остаточную вирулентность и не реверсирует при пассировании на восприимчивых животных (белые мыши, куриные эмбрионы). Утрата штаммом абортогенных свойств подтверждается опытами вакцинопрофилактики лиофилизированной культурой глубоко жеребых кобыл (за 2-3 месяца до выжеребки) в дозе 1,2–1,5 млрд живых м. к. (микробных клеток). Вакцинация жеребых кобыл в период 4-7 месячной жеребости проводится с профилактической целью однократно. Жеребята и молодняк прививаются по показаниям. Вакцина сообщает привитым животным иммунитет высокого напряжения. Поствакцинальная реакция у лошадей характеризуется образованием агглютининов в высоких титрах (1: 3200) и повышением количества лейкоцитов в крови.
Местная реакция проявляется в виде болезненного отека на месте введения вакцины, который рассасывается в течение 3-5 суток. Общая реакция у части кобыл характеризуется кратковременным повышением температуры и умеренным угнетением в течение первой половины суток. Аппетит у всех животных в период наблюдения сохраняется.
Вакцинальная культура высевается из органов и крови белых мышей в течение 20 суток, из селезенки и лимфатических узлов до 25 суток; от морских свинок в течение двух недель. Подкожная иммунизация морских свинок не вызывает микроскопических изменений. Сухая вакцина соответствует современным отечественным и международным стандартам: малые дозы, умеренная реактогенность, высокая иммунизирующая активность, экономичность, эффективность, удобство при транспортировке.
Отзывы специалистов опытных хозяйств свидетельствуют о безопасности и высокой эффективности вакцинации жеребых кобыл.
Заключение
На основании бактериологических, биохимических, серологических (антигенной структуры) исследований культур, выделенных из абортплодов кобыломаток, установлено, что причиной абортов у кобыл явился сальмонеллезный аборт кобыл, вызванный Salmonella abortus-equi. Систематические прививки живой вакциной из штамма В-0147 Salmonella abortus – equi Е-841 обеспечивают защиту животных от абортов сальмонеллезной этиологии, увеличивают выход жеребят, надои молока, в результате чего хозяйства получат большой экономический эффект. Вакцина в 100 % случаев защищает опытных кобыл от сальмонеллезного аборта. Иммунитет у привитых животных сохраняется в течение года.
Краткое описание: Препарат предназначен для специфической профилактики абортов сальмонеллезной этиологии у жеребых кобыл , обусловленных возбудителем Salmonella abortus - equi. Представляет собой сухую мелкопористую массу белого или серовато-желтого цвета, содержащую аттенуированный вакцинный штамм Salmonella abortus – equi Е-841. В акцина вводится подкожно в среднюю треть шеи, пригодна для применения в течение 12 месяцев со дня изготовления, содержится во флаконах по 5 см 3 и 10 см 3 . Иммунитет у жеребых кобыл наступает через 14 дней и длится до года, что дает возможность предотвратить распространение абортов среди кобыл.
Степень готовности для практической реализации: 100%.
Условия и способ передачи разработки, формы сотрудничества: на договорной основе.
Авторы проекта, адрес, телефон, факс, электронная почта : Султанов А.А., Егорова Н.Н., Мусаева А.К.
НАБОР РЕАГЕНТОВ (ТЕСТ-СИСТЕМА) ДЛЯ ДИАГНОСТИКИ ИНФЕКЦИОННОГО ЭПИДИДИМИТА БАРАНОВ
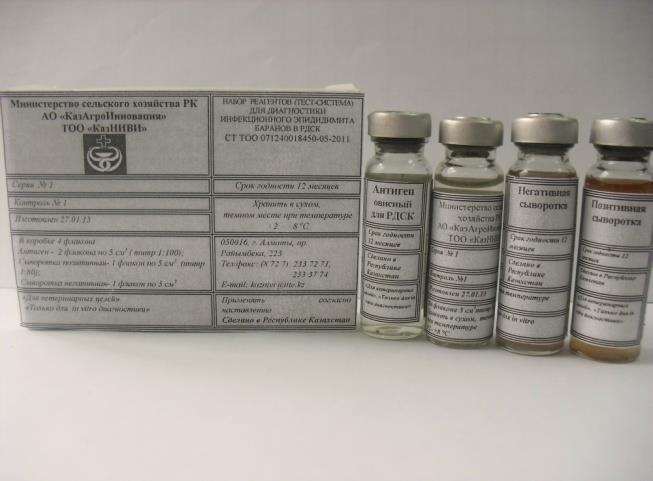
Краткое описание: Препарат предназначен для серологических исследований сывороток крови животных на инфекционный эпидидимит.
Набор состоит из: антигена овисного для РДСК; позитивной (положительной) сыворотки для РДСК; негативной (отрицательной) сыворотки для РДСК. Антиген овисный представляет собой стерильную прозрачную, слегка опалесцирующую жидкость, содержащую активные вещества, извлеченные из штамма B . ovis 6 с помощью ультразвука. Реагенты набора выпускаются во флаконах вместимостью 5,0-20,0 см 3 , один набор рассчитан на 1600 проб. По результатам проведенных серологических реакций сомнительно реагирующих животных исследуют повторно через три недели.
Степень готовности для практической реализации: 100%
Технико – экономические параметры: Обладает высокой диагностической ценностью, чувствительностью и специфичностью, что позволяет получить достоверные результаты при исследовании животных.
Условия и способ передачи разработки, формы сотрудничества: на договорной основе.
Авторы проекта, адрес, телефон, факс, электронная почта : Султанов А.А., Барамова Ш.А., Мырзалиев А.Ж. и др.
АНТИГЕН ЦВЕТНОЙ ДЛЯ КОЛЬЦЕВОЙ РЕАКЦИИ (КР) С МОЛОКОМ
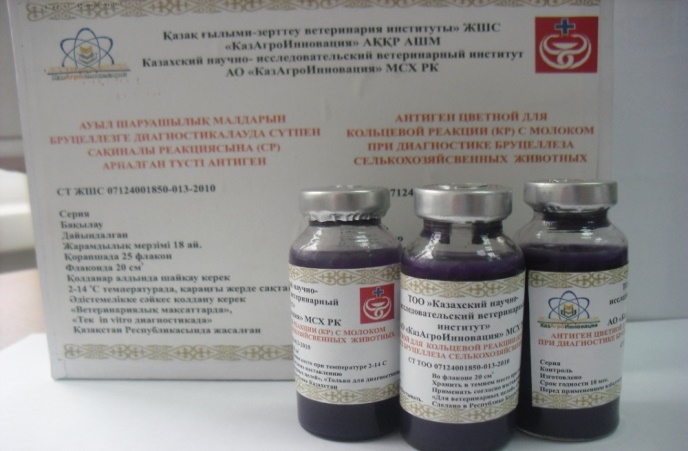
Краткое описание: Представляет собой взвесь убитых бруцелл, полученных из вакцинного штамма Brucella abortus 19, окрашенных в сине-фиолетовый цвет. Предназначен для проверки благополучных по бруцеллезу молочных стад и исследованию рыночного молока на бруцеллез. Образовавшееся четко выраженное сине-фиолетовое кольцо в верхней части (на поверхности) столбика исследуемого молока животных при котором нижняя часть (под кольцом) остается белой свидетельствует о положительном результате КР.
Исследование молока животных на бруцеллез может проводиться как в ветеринарных диагностических лабораториях, так и непосредственно в условиях хозяйств. Постановка КР с предлагаемым антигеном технологически не сложна и не требует использования специального оборудования и приборов.
Степень готовности для практической реализации: 100%
Объем внедрения: Внедрено на 5 000 гол. КРС.
Технико – экономические параметры: Результат реакции получают через 40 мин. Внедрение разработанного диагностического препарата в районные, областные ветеринарные лаборатории позволит поставить диагноз в кратчайшие сроки, что предотвратит дальнейшее распространение инфекции.
Условия и способ передачи разработки, формы сотрудничества: на договорной основе.
Авторы проекта, адрес, телефон, факс, электронная почта : Иванов Н.П., Султанов А.А., Барамова Ш.А., Мырзалиев А.Ж.
НАБОР ДЛЯ СЕРОЛОГИЧЕСКОЙ ДИАГНОСТИКИ ЭПИЗООТИЧЕСКОГО ЛИМФАНГИТА ЛОШАДЕЙ
Краткое описание: В связи с широким распространением эпизоотического лимфангита среди лошадей ветеринарная практика остро нуждается в беспрерывном обеспечении специализированных лабораторий высокоэффективными диагностическим и препаратами. При эпизоотическом лимфангите лошадей, как и при другой инфекции, успех ликвидации болезни, сохранности поголовья и предупреждения распространения возбудителя во многом зависит от того, насколько своевременно ставится диагноз и клинически больные уничтожаются, а сероположительные животные изымаются и отправляются на убой. Набор препаратов для диагностики эпизоотического лимфангита лошадей включает в себя антиген выделенный из штамма гриба Cryptococcus farciminosus , позитивную и отрицательную сыворотки. Препарат предназначен для серологической диагностики эпизоотического лимфангита лошадей в реакции длительного связывания комплемента (РДСК). Набор расфасован в инсулиновые флаконы в количестве 2 ампул по 1 см 3 , одна позитивная и одна отрицательная сыворот ки .
Степень готовности для практической реализации: 100%
Технико – экономические параметры: Возможность диагностировать латентные формы течения заболевания. Предлагаемый серологический набор реагентов инактивирован, экологически чист, безопасен для окружающей среды. При эпизоотическом лимфангите диагноз ставится только по клиническим признакам проявления болезней, а набор КазНИВИ выявляет больных животных в инкубационным периоде заболевания.
Условия и способ передачи разработки, формы сотрудничества: на договорной основе.
Авторы проекта, адрес, телефон, факс, электронная почт а: Кадыров С.О., Шалабаев Б.А.
РОЗ БЕНГАЛ АНТИГЕН ДЛЯ ПЛАСТИНЧАТОЙ РЕАКЦИИ АГГЛЮТИНАЦИИ (РОЗ БЕНГАЛ ПРОБА - РБП) ПРИ ДИАГНОСТИКЕ БРУЦЕЛЛЕЗА ЖИВОТНЫХ
Краткое описание: Антиген цветной представляет собой стерильную микробную суспензию розового цвета, содержащую инактивированную бактериальную массу, полученную из вакцинного штамма B.abortus 19. Предлагается для применения в ветеринарных диагностических лабораториях для постановки пластинчатой реакции агглютинации (ПРА) (роз бенгал проба РБП) при массовых исследованиях сыворотки крови животных на бруцеллез.
Реакцию учитывают невооруженным глазом по истечении четырех минут после смешивания сыворотки с антигеном при слегка наклонном положении пластинки. Агглютинацию, которая происходит позднее четырех минут, не учитывают.
Степень готовности для практической реализации: 100%
Условия и способ передачи разработки, формы сотрудничества: на договорной основе.
Авторы проекта, адрес, телефон, факс, электронная почта : Султанов А.А., Барамова Ш.А., Мырзалиев А.Ж. и др.
Основным действующим веществом является празиквантел. Содержание празиквантела 70 мг в 1 таблетке. В качестве наполнителей использованы вещества, улучшающие поедаемость таблетки. Таблетированная форма препарата имеет точные дозировки основного действующего вещества.
Степень готовности для практической реализации: 100%.
Объем внедрения: Препарат для дегельминтизации собак разработан и внедрен в 34 хозяйствующих субъектах на более 1000 голов собак 11 областей республики. Реализован на сумму 1 700 000 тыс. тенге.
Технико – экономические параметры: Препарат обладает широким спектром лечебного и профилактического действия при тениидозах, в том числе при эхинококкозе плотоядных, действуя на все стадии развития паразита.
Условия и способ передачи разработки, формы сотрудничества: участие в тендерах, госзакупках, аукционах на договорной основе.
Авторы проекта, адрес, телефон, факс, электронная почта : Абдыбекова Аида Макеновна.
А НТГЕЛЬМИНТИК ДЛЯ МАРАЛОВ И ОЛЕНЕЙ
Основным действующим веществом является фенбендазол (панакур) и наполнители: крахмал кукурузный, сахароза, кальция стеарат, карбоксиметилцеллюлоза, и эфирное масло можжевельника, улучшающие качество и поедаемость препарата маралами и оленями.
Степень готовности для практической реализации: 100%.
Технико – экономические параметры: увеличение пантовой продуктивности вследствие лечения маралов при желудочно-кишечных гельминтозах, а также отсутствия каких-либо дополнительных затрат.
Условия и способ передачи разработки, формы сотрудничества: участие в тендерах, госзакупках, аукционах на договорной основе.
Авторы проекта, адрес, телефон, факс, электронная почта : Абдыбекова Аида Макеновна.

In the article it was adduced the results of investigations of pathological material abortus of mare and questions of diagnostics and preventive maintenance salmonelosis abortion of mares are resulted. On the grounds of clinical-and-epizootological data, bacteriological, biochemical investigations from the foal abortus it was defined the Salmonella abortus equi the pathogen of salmonellosis abortion of mares.
В статье рассматриваются вопросы диагностики и профилактики сальмонеллезного аборта кобыл, который часто регистрируется на территории Казахстана. Мониторинговыми исследования установлено, что с 2010 по 2015 годы выход жеребят на 100 голов кобыломаток стабильно снижается. С целью выяснения причины снижения рождаемости жеребят, изучена эпизоотическая ситуация по сальмонеллезному аборту кобыл в хозяйствах Алматинской области. При вспышках болезни проводили выделение возбудителя инфекции от абортплодов кобыл. Приводятся результаты исследований по изучению культурально – морфологических, биохимических и антигенных свойств эпизоотических штаммов сальмонелл, выделенных от абортированных плодов кобыломаток. Авторами описаны биологические свойства аттенуированного вакцинного штамма, на основе которого изготавливается безопасная, высокоиммуногенная вакцина против сальмонеллезного аборта кобыл. Вакцина прививается жеребым кобылам однократно, продолжительность иммунитета – один год.
Цель – выделение культур из абортированных плодов кобыл, их идентификация на основании изучения биологических свойств, разработка методов специфической профилактики сальмонеллезного аборта кобыл.
Сальмонеллезный аборт кобыл – распространенная болезнь жеребых кобыл, сопровождающаяся преждевременными родами (абортами) и рождением нежизнеспособного плода. Возбудитель Salmonella abortus-equi открыт в 1893 году Smith и Kilborne в Америке, в 1901 году Д.В. Поляковым в России. В литературе иногда встречается под названием Salmonella abortiva-equina (синоним) [2]. Аборты могут принимать массовый характер, в табуне абортируют до 80 % кобыл. У больных сальмонеллезом кобыл изредка рождаются больные жеребята, у которых болезнь сопровождается бактериемией, тяжелым токсикозом, истощением, приводящим к гибели. Первые сведения по эпизоотологии болезни в республике были опубликованы в 1940 и 1950 годах, из которых вытекает, что инфекционные аборты среди кобыл в Казахской ССР регистрировались с начала 30-х годов прошлого века. В разные годы аборты кобыл достигали 6 – 30 %, из них свыше 50 % сальмонеллезной этиологии. В 1970 и 1971 годах в хозяйствах республики регистрировались массовые аборты сальмонеллезной этиологии: так в Енбекши-Казахском районе Алма-Атинской области аборты отмечены у 44 % конематок, Нарынколском районе – 20-40 %; Чиликском районе – 30 % конематок абортировало; Аксуском районе Талды-Курганской области – 43 %; Капальском и Каратальском районах отмечались аборты сальмонеллезной этиологии. В 1969 – 1974 годах аборты отмечались в хозяйствах Восточно-Казахстанской (около 40 %), Жамбылской (20 %), Кызылординской (до 25 %) областях. В 1981 году в хозяйствах Мангыстауской области из 1000 кобыл абортировало 384 (38, 4 %). В декабре 1985 года в Атырауской области из 260 жеребых кобыл абортировало 155 (59, 5 %).
В настоящее время в связи с тем, что основное поголовье лошадей от общего числа в республике сосредоточено в личных подворьях граждан и фермерских хозяйствах, возросла актуальность профилактики сальмонеллезного аборта кобыл, а также ведения статистического учета заболеваемости [3]. Мониторинговыми исследования установлено, что с 2010 по 2015 годы выход жеребят стабильно снижается – 59/100; 56/100; 53/100; 50/100; 45/100 голов кобыломаток соответственно. С целью выяснения причины такого снижения рождаемости жеребят нами изучена эпизоотическая ситуация по сальмонеллезному аборту кобыл в хозяйствах Алматинской области. При вспышках болезни проводили выделение возбудителя инфекции от плодов абортировавших кобыл.
В Алматинской области расположены 16 районов, во всех районах области разводятся лошади, в том числе племенные. На 10 июля 2015 г. в области содержатся 288592 головы лошадей. Наибольшее количество животных сосредоточено в частных подворьях населения (641 836 голов). В хозяйствах населения области находятся 150720 голов лошадей, в крестьянских и фермерских хозяйствах находятся 143404 головы, а в сельхозпредприятиях содержится 16 500 голов лошадей. Выход жеребят по области на 100 кобыломаток составляет не более 50. Ситуация осложняется тем, что наибольшее количество лошадей сосредоточено в хозяйствах и частных подворьях населения, где не ведется учет заболеваемости животных. Частные владельцы зачастую скрывают случаи абортов у кобыл.
В 2015 году в Алматинской области получено 64915 жеребят. Наибольшее количество лошадей находится в Кербулакском, Жамбылском и Райымбекском районах. Однако в них выход жеребят в среднем составляет 45 %. Например, в Енбекшиказахском районе в текущем году получено 2281 жеребенок, что составляет всего 34 %, в Кербулакском районе в текущем году получено 3978 жеребят, что составляет всего 41 %, в Жамбылском – 45 %, в Саркандском районе – 43 %, в Балхашском районе – 52 %, в Райымбекском – 56 %. В связи с тем, что основное поголовье лошадей от общего числа в республике сосредоточено в личных подворьях граждан и фермерских хозяйствах, возросла актуальность профилактики сальмонеллезного аборта кобыл, а также ведения статистического учета заболеваемости [4].
Материалы и методы исследования
Отбор проб из паренхиматозных органов абортплода кобылы приведен на рис 1.

Рис. 1. Отбор проб от абортплода кобылы для бактериологических исследований
Результаты исследования и их обсуждение
Диагностика заболевания осуществляется на основании клинико-эпизоотологических, патологоанатомических данных, а также результатов бактериологического и серологических исследований. Посевы из патологического материала делали на МПА, МПБ, среды Клиглера и Эндо, висмут – сульфитный агар из печени, сердца, селезенки, костного мозга из бедренной кости плода. От всех абортированных плодов выделили культуру сальмонелл, которую затем дифференцировали по культурально – морфологическим, биохимическим и антигенным свойствам [4]. На питательных средах отмечался обильный рост сальмонелл. На МПА росли круглые, блестящие, выпуклые влажные колонии с голубоватым оттенком, на среде Клиглера – ярко-желтые круглые колонии, на агаре Эндо – типичные колонии светло-розового цвета, на висмут-сульфитном агаре –бесцветные блестящие колонии. При микроскопии окрашенных по Граму мазков наблюдались полиморфные грамотрицательные мелкие палочки с закругленными концами. Культура агглютинировалась в РА (реакции агглютинации) на стекле с поливалентной и монорецепторными сыворотками производства Краснодарской биофабрики. Все выделенные культуры агглютинировались сыворотками О – IV (++++), ХII (+++), H – enx (++++) [5].
При посеве культур уколом на ПЖА наблюдалась характерная подвижность сальмонелл (подвижные палочки). Выделенные культуры идентифицировали методом изучения биохимических свойств путем культивирования на среде Гисса. Все культуры были идентичны и не изменяли инозит, глицерино – фуксиновый бульон, раффинозу, салицин; сероводород не образовывали (этот признак отличает Salmonella abortus-equi от других сальмонелл) и не продуцировали индола; ферментировали глюкозу, маннит, арабинозу, дульцит, ксилозу, рамнозу, галактозу. Для выявления протеолитической способности испытуемые штаммы засевали на МПЖ. В пробирках, где под действием ферментов бактерий проиcходил протеолиз желатина, среда разжижалась. При постановке биопробы на белых мышах гибель животных наступалв на 3-4 сутки после заражения.
На основании клинико-эпизоотологических данных, изучения культурально – морфологических, тинкториальных, биохимических и антигенных свойств выделенные эпизоотические штаммы сальмонелл отнесены к Salmonella abortus-equi. Во всех случаях возбудителем аборта у кобыл являлась Salmonella abortus-equi. По культурально – морфологическим, биохимическим и антигенным свойствам штаммы были идентичны выделенным эпизоотическим изолятам сальмонелл, выделенным ранее и эталонному коллекционному штамму Salmonella abortus-equi 7/1.
Проводили электронную микроскопию сальмонеллезной культуры, приготовленную из суточной агаровой культуры Salmonella abortus-equi. Бактериальную взвесь (концентрация 500 млн микробных клеток/см3 по оптическому стандарту ГИСК (Государственный институт стандартизации и контроля им. Л.А. Тарасевича) наносили пастеровской пипеткой на парафин в чашке Петри. При нанесении на парафин капля взвеси принимала округлую форму и не растекалась (всего 2–3 капли). Затем методом флотации погружали специальную золотистую сеточку в каплю суспензии сальмонелл на 1 минуту. Чашку Петри с сеточкой, на которой находилась бактериальная взвесь, закрывали на 24 часа и оставляли для высушивания. Через сутки капля микробной суспензии высыхала. Высохшую каплю контрастировали следующим образом: через сутки на парафин в чашке капали каплю контрастера – 2 % раствор фосфорно – вольфрамовой кислоты (ФВК) пастеровской пипеткой, сеточку топили в капле подложкой вверх. Контрастировали 1,5–2 минуты. Затем сеточку пинцетом аккуратно вынимали, удаляли лишнюю жидкость прикосновением фильтровальной бумаги. Сеточку промывали от контрастера дистиллированной водой из шприца (очень осторожно). Сеточку с бактериальной взвесью сушили в контейнере 7 суток. После высушивания препарат был готов для просмотра под электронным микроскопом.
Электронный снимок Salmonella abortus-equi представлен на рис. 2.
На рис. 2 представлена бактериальные клетка из одного клона (популяция из одной клетки без предварительной конъюгации). Стационарная фаза. На цельной клетке сальмонелл виден обрывок перитрихиально расположенного жгутика. Также видна трехслойная клеточная мембрана (наружный слой клеточной стенки). В центральной части клетки расположен нуклеоид большой величины. Зона нуклеоида заполнена фибриллярным компонентом. Вблизи нуклеоида локализованы клеточные включения округлой формы. Включения имеют мелкозернистое строение и ограничены от цитоплазмы мембраной. По всей цитоплазме расположены мелкие внутриклеточные включения. Увеличение х 80 000.

Рис. 2. Электроннограмма штамма Salmonella abortus-equi
Таким образом, выделенная культура сальмонелл была идентифицирована как Salmonella abortus-equi.
Профилактика Патентный поиск показал, что в Америке и в странах Европы не разработаны и не применяются вакцины против сальмонеллезного аборта кобыл. В Якутии применяется инактивированная формолквасцовая инактивированная вакцина против сальмонеллезного аборта кобыл с иммуномодулятором, адаптированная для местной породы лошадей [6, 7]. В Якутии также разработана и применяется ассоциированная убитая вакцина против ринопневмонии и сальмонеллезного аборта кобыл [8, 9]. Для повышения эффективности ассоциированной вакцины и повышения иммунобиологической реактивности организма к вакцине в качестве иммуномодулятора добавляют культуральную жидкость бульонной культуры штамма бактерий Bacillus subtilis ТНП-3 ДЕП, выделенного из мерзлото-переходной почвы [9]. Нами разработана и успешно апробирована на жеребых кобыломатках вакцина сухая живая против сальмонеллезного аборта кобыл из штамма Salmonella abortus – equi Е-841. Вакцинный штамм был получен методом отбора клонов, аттенуированных под влиянием химического мутагена- нитрофуранов с последующей селекцией мутантов. Штамм В-0147 Salmonella abortus – equi Е-841 утратил абортогенные свойства, имеет умеренную остаточную вирулентность (вирулентность штамма снижена в 20 раз по сравнению с природным прототипом), обладает высокой иммуногенностью. Вакцинный аттенуированный штамм обладает типичными для Salmonella abortus – equi культуральными, биохимическими и антигенными свойствами. Существенным отличием штамма В-0147 Salmonella abortus – equi Е-841 от вирулентного прототипа является ауксотрофность в отношении тиамина и никотиновой кислоты; штамм образует аргинин – декарбоксилазу и слабо – лизин–декарбоксилазу.
Вакцинный штамм В-0147 Salmonella abortus – equi Е-841 депонирован нами в Республиканской коллекции микроорганизмов (РКМ) в Национальном референтном центре по ветеринарии (коллекционный номер В-0088), г. Астана. В РКМ депонирован также контрольный (вирулентный) штамм Salmonella abortus – equi коллекционный номер В–0099), выделенный нами из абортированного плода – жеребенка в 2005 году в Алматинской области. Штамм применяется для контроля иммуногенной активности вакцины против сальмонеллезного аборта кобыл.
Вакцинный аттенуированный штамм сохраняет слабую остаточную вирулентность и не реверсирует при пассировании на восприимчивых животных (белые мыши, куриные эмбрионы). Утрата штаммом абортогенных свойств подтверждается опытами вакцинопрофилактики лиофилизированной культурой глубоко жеребых кобыл (за 2-3 месяца до выжеребки) в дозе 1,2–1,5 млрд живых м. к. (микробных клеток). Вакцинация жеребых кобыл в период 4-7 месячной жеребости проводится с профилактической целью однократно. Жеребята и молодняк прививаются по показаниям. Вакцина сообщает привитым животным иммунитет высокого напряжения. Поствакцинальная реакция у лошадей характеризуется образованием агглютининов в высоких титрах (1: 3200) и повышением количества лейкоцитов в крови.
Местная реакция проявляется в виде болезненного отека на месте введения вакцины, который рассасывается в течение 3-5 суток. Общая реакция у части кобыл характеризуется кратковременным повышением температуры и умеренным угнетением в течение первой половины суток. Аппетит у всех животных в период наблюдения сохраняется.
Вакцинальная культура высевается из органов и крови белых мышей в течение 20 суток, из селезенки и лимфатических узлов до 25 суток; от морских свинок в течение двух недель. Подкожная иммунизация морских свинок не вызывает микроскопических изменений. Сухая вакцина соответствует современным отечественным и международным стандартам: малые дозы, умеренная реактогенность, высокая иммунизирующая активность, экономичность, эффективность, удобство при транспортировке.
Отзывы специалистов опытных хозяйств свидетельствуют о безопасности и высокой эффективности вакцинации жеребых кобыл.
Заключение
На основании бактериологических, биохимических, серологических (антигенной структуры) исследований культур, выделенных из абортплодов кобыломаток, установлено, что причиной абортов у кобыл явился сальмонеллезный аборт кобыл, вызванный Salmonella abortus-equi. Систематические прививки живой вакциной из штамма В-0147 Salmonella abortus – equi Е-841 обеспечивают защиту животных от абортов сальмонеллезной этиологии, увеличивают выход жеребят, надои молока, в результате чего хозяйства получат большой экономический эффект. Вакцина в 100 % случаев защищает опытных кобыл от сальмонеллезного аборта. Иммунитет у привитых животных сохраняется в течение года.
Читайте также:

