Вакцина против вируса почему ее трудно изготовить
Обновлено: 25.04.2024
Почему с вирусами нельзя бороться антибиотиками? А чем можно? Почему разработать эффективный противовирусный препарат так сложно? А вакцина — это лекарство? Разбираем популярные вопросы, мифы и сомнения
Вирусы отличаются от бактерий и по строению, и по способу размножения. Одинаковые препараты не применяются для тех и других.
Самым эффективным средством против вирусов остается наш собственный иммунитет, но если он ослаблен — могут быть назначены препараты, подавляющие вирусную нагрузку.
Созданию эффективных препаратов мешают изменчивость вирусов и их способность захватывать наши собственные клетки.
Вакцина — не лекарство, а скорее "обучающий курс" для нашего собственного иммунитета. В идеале вакцина лучше, но для некоторых болезней ее нет — а вот лекарства есть.
Почему вирус нельзя убить антибиотиком?
Антибиотики часто выписывают при инфекционных заболеваниях. Из-за этого может сложиться представление, что их нужно пить при любых инфекциях. На самом деле они действуют только против бактерий. Хотя у бактериальных и вирусных болезней симптомы часто похожи (жар, насморк, кашель, слабость), у их возбудителей разная природа. Они отличаются и по строению, и по способу выживания.
Бактерии — одноклеточные организмы, которые размножаются примерно так же, как и человеческие клетки. Антибиотик может нарушить целостность бактериальной клетки (например, вмешаться в процесс формирования клеточной стенки) или сбить механизм её размножения. Важный момент: препарат должен действовать именно на чужеродные клетки, не затрагивая наши.
Вирусы устроены иначе. У них нет собственной клетки, они живут и размножаются за счет чужих — захватывая их и используя как фабрики по производству своих копий. Созревшие вирусные частицы вырываются наружу, разрушая клетку и заражая ее соседей. Но антибиотик, заточенный под взаимодействие с бактериальной клеткой, не причинит вреда ни отдельной вирусной частице, ни уже зараженной ею человеческой клетке.
Как тогда с ним бороться?
Обычно с этим справляется сам организм, и помощь ему не требуется. Но бывает, что иммунитет ослаблен, и болезнь изначально развивается по тяжелому сценарию — либо вирус умеет обходить защиту (например, поражает сами иммунные клетки, как это делает ВИЧ). Тогда врачи назначают препараты, которые действуют непосредственно на вирусные частицы.
Часть препаратов, попадая в кровь, связываются с белками на поверхности вируса, которые он использует для прикрепления к клетке, и блокируют их. Если вирус уже попал в клетку, можно попытаться нарушить механизм его размножения. В этом случае используют вещества, близкие по структуре к фрагментам вирусного генетического кода (нуклеотидам). Когда они проникают в зараженную клетку, то заменяют собой нормальные части вирусной ДНК, из-за чего ему не удается создавать свои копии.
Как разрабатывают противовирусные препараты?
Чтобы создать работающее лекарство, ученым нужно изучить вирус — его строение, принцип заражения, химические процессы, которые его сопровождают. Препарату всегда нужна мишень, на которую он будет действовать. Например, у вирусов гриппа такими мишенями служат белки гемагглютинин, нейраминидаза (на них указывают буквы H и N в названиях штаммов) и M2. Каждая группа препаратов действует только на один тип белков — точнее, даже на их составные части.
Вещества, которые ученые сочли перспективными, сначала тестируются in vitro — в пробирке, на культуре клеток. Но даже если результаты показали, что концентрация вирусной ДНК снижается, результаты могут не подтвердиться в живых организмах. Вещество может плохо всасываться в кровь или изменять свою структуру, попадая в желудок или кровь. Точно установить причины плохих результатов в клинических испытаниях не всегда удается.
Почему эффективных препаратов так мало?
За 60 лет регулирующие органы разных стран одобрили несколько десятков препаратов, но лишь против 5% всех известных человеческих вирусов. Это вирусы гриппа, ветряной оспы, папилломы человека, герпеса, респираторно-синцитиальный вирус, вирусы гепатита С и B, а также ВИЧ. Но и среди них большинство не способны полностью изгнать вирус из организма, а могут только остановить или затормозить его распространение.
Одна из сложностей в том, что вирусы очень быстро размножаются и мутируют. Фармакологи могут долго подбирать соединение, которое свяжется с вирусным белком определенной структуры, — но в ходе мутации его структура может измениться, и вирус приобретет устойчивость к препарату. Именно это произошло с первыми лекарствами от вируса гриппа, которые были заточены под белок M2. Оказалось, что ген, который кодирует этот белок, склонен к частым мутациям. Сейчас эти препараты не рекомендуют применять без поддержки других.
У некоторых вирусов (например, того же гриппа) отдельные частицы имеют очень разные форму и размеры, с разным числом белков на поверхности. Молекулы препарата могут не закрепиться на мелких или нестандартных частицах, и они все равно найдут способ проникнуть в клетки и заразить их. Эффект от лечения будет, но хуже ожидаемого.
Некоторые вирусы трудно "выкурить" из захваченных ими клеток. Например, ВИЧ проникает в Т-лимфоциты — иммунные клетки, благодаря которым организм защищает себя от инфекций. Вирус встраивается в их геном, и в результате клетки производят уже зараженные копии самих себя. Сегодня антивирусные препараты могут блокировать воспроизведение генома вируса, мешать ему встраиваться в ДНК клеток, предотвращают сборку новых копий — но достать его внутри клеток они не могут.
Чем лекарство отличается от вакцины? Что лучше?
Вакцина стимулирует выработку собственного иммунитета у человека: знакомит иммунную систему с вирусом, а дальше сама вырабатывает защиту — антитела и клетки-киллеры, которые в будущем могут дать отпор настоящему вирусу. При этом вирус в вакцине может быть как живым, но ослабленным, так и мертвым. А в ряде случаев используют только белки этого вируса.
Антитела, в отличие от препаратов, вырабатываются естественным путем. Это белковые молекулы, которые подходят к вирусным белкам, как ключ к замочной скважине. В каком-то смысле можно сказать, что организму виднее, как именно ему бороться с инфекцией. Он сам распознает патоген, сам запускает защитную реакцию — и все это происходит быстрее, чем мы поймем, что заражены.
Но в некоторых случаях вакцину оказывается разработать сложнее, чем лекарство. Например, вакцины от ВИЧ до сих пор нет, а вот существующие препараты (если их начать принимать как можно раньше и делать это регулярно) позволяют вести полноценную жизнь. Также пока нет и вакцины от гепатита С — зато современные препараты позволяют изгнать вирус из организма почти в 100% случаев.
Вакцины — это вообще зачем?

Я не общаюсь с больными, мне можно не прививаться?
по теме

Лечение
Прорыв: ученые создали вакцину против герпеса
От некоторых инфекций действительно нужно прививаться не всем. Например, прививку от желтой лихорадки нужно сделать, если вы собираетесь в Индию, а прививаться от туляремии и бруцеллеза в первую очередь необходимо работникам сельского хозяйства. Однако от большого количества инфекций должны быть привиты все люди, если у них нет индивидуальных медицинских противопоказаний. Это важно для сохранения коллективного иммунитета. Инфекция может распространяться в популяции только при наличии достаточного количества восприимчивых к ней людей.
Если человек привит и не может заболеть, через него инфекция не может распространяться дальше, а если таких людей много — эпидемия затухает вплоть до полного исчезновения болезни. Например, благодаря массовой вакцинации, удалось полностью искоренить натуральную оспу. В середине XX века от оспы привили так много людей по всему миру, что вирусу просто негде было жить, и он исчез. Сейчас оспой никто на планете не болеет, и вакцинация от нее больше не нужна.
Но нельзя вакцинировать все 100% населения — у некоторых есть медицинские противопоказания: аллергия на вакцину или некоторые заболевания. Таких людей может защитить только коллективный иммунитет. Поэтому прививаться нужно не только для сохранения собственного здоровья, но и для сохранения здоровья других людей.
От каких инфекций нужно прививаться всем, а от каких — только в некоторых случаях определено в Национальном календаре профилактических прививок. Он составлен исходя из соотношения потенциальных рисков заболевания инфекциями для разных групп населения и эффективности вакцинации. Также не забывайте проверять рекомендации ВОЗ по вакцинации для отдельных стран перед путешествиями.
В вакцинах же куча всякой химии, а еще и ртуть!
Каждая вакцина проходит многолетние тщательные клинические исследования, доказывающие эффективность и безопасность всех ее компонентов. Содержащий ртуть консервант тиомерсал (он же мертиолят) в современных вакцинах давно не применяют. Кроме того, его концентрация в вакцинах была так мала, что он не мог причинить вред прививаемому человеку. Конечно, каждая вакцина может иметь свои побочные эффекты, но их тяжесть и риск несоизмеримо малы по сравнению с тяжестью самих заболеваний, от которых они защищают.
Да это все не работает, вирусы и бактерии же постоянно мутируют!
Да, возбудители инфекций действительно меняются, как и все живое. Поэтому при разработке вакцины сначала долго изучают и подбирают штаммы возбудителей, чтобы они максимально соответствовали циркулирующим в популяции диким штаммам. Также эффективность вакцины — насколько хорошо она защищает от инфекции — постоянно мониторят на протяжении всего периода ее применения.
по теме

Эпидемия
Как изменит мир вакцина от ВИЧ-инфекции?
Нужно учитывать, что многие возбудители инфекций довольно стабильны. Например, вирус клещевого энцефалита остается неизменным уже десятки тысяч лет, поэтому вакцина от него не требует каких-то доработок, оставаясь эффективной.
Другие возбудители, например, вирус гриппа, меняются очень быстро. В таких случаях используют другую стратегию: перед каждым сезоном Всемирная организация здравоохранения (ВОЗ) строит прогноз, определяя наиболее вероятные штаммы, которые будут вызывать заболевание в грядущем сезоне, и именно эти штаммы используют для производства вакцины. То есть вакцину для профилактики гриппа каждый год делают из новых штаммов возбудителя, поэтому она остается эффективной, несмотря на изменчивость возбудителя.
Я привился от гриппа и все равно заболел.
А почему тогда от простуды до сих пор не сделали вакцину?
Почему нельзя сделать универсальную вакцину от всех инфекций?
Наша иммунная система распознает возбудителя инфекции, реагируя на его отдельные специфические фрагменты — антигены. Как правило, это крупные белковые молекулы, находящиеся на поверхности бактериальной клетки или в оболочке вируса. Именно опознавая эти молекулы, наша иммунная система понимает, с каким возбудителем она столкнулась и как его нейтрализовать.
по теме
Профилактика
В США разработана новая вакцина против туберкулёза
Сейчас существуют комбинированные вакцины, защищающие сразу от нескольких инфекций. В их состав входят характерные молекулы возбудителей разных инфекций, поэтому одна вакцина позволяет познакомить наш иммунитет сразу с пятью — шестью инфекциями и обеспечить защиту от них.
Егор Воронин — нью-йоркский вирусолог, специалист в области вакцинопрофилактики. Более двадцати лет он занимался исследованиями ВИЧ, его эволюцией и репликацией. С 2018 по 2020 год он возглавлял биотехнологическую компанию Worcester HIV Vaccine, занимающуюся разработкой вакцины от ВИЧ. В своем блоге shvarz Егор публикует массу интересных фактов о вакцинах, ВИЧ, о вирусах в целом, а в последние полтора года и о новом коронавирусе: он умеет рассказывать простым языком о сложном.
— Наверное, тот факт, что сейчас все следят за вакцинами, позволит объяснить это проще.
— Это единственная проблема?
— Нет. Вторая проблема: как мы все уже знаем в отношении коронавируса — созданные против него вакцины хорошо предотвращают тяжелое течение болезни и смерть, но гораздо хуже защищают от заражения. Для COVID-19, как все же быстротечной болезни, это нормально: даже если вирус попадет в привитый организм, он не вызовет тяжелую болезнь, организм силами иммунной системы быстро его поборет, и человек скоро выздоровеет, вирус исчезнет.
С ВИЧ же совершенно другая ситуация. Он приспособлен к тому, чтобы жить в организме очень долго и ускользать от иммунной системы годами. Если мы не предотвратили его попадание в организм, то без терапии он будет в нем реплицироваться и в конце концов вызовет СПИД. Будучи привитыми от коронавируса, вы можете все равно им заразиться, но лишь чуть-чуть поболеете или даже не заметите, что вирус был, организм его вычистит, — а с ВИЧ это не работает. На ранних этапах разработки вакцин пытались измерять их эффективность именно по способности предотвращать не заражение ВИЧ, а последующее развитие СПИДа, но сейчас уже ясно, что если ВИЧ попал в организм, то без терапии СПИД неизбежно разовьется. Значит, в отношении ВИЧ нам нужна вакцина, которая будет полностью предотвращать само попадание вируса в организм, а это гораздо более высокая планка.
— Но с точки зрения обывателя все кажется просто: есть вирус ВИЧ, он выделен и хорошо известен. Так возьмите его, убейте, и убитый, обезвреженный вирус введите человеку — пусть организм вырабатывает иммунный ответ. Ведь так делались все классические вакцины. На каком этапе оказалось, что с ВИЧ это не работает?
— Над вакциной от ВИЧ работают уже не первый десяток лет. При этом были сделаны какие-то побочные открытия, которые можно применять в других областях? Например, в нынешней борьбе с коронавирусом?
— Попытки создать вакцины от ВИЧ начались сразу же, как только вирус был впервые выделен. Пытались сделать вакцины на основе убитого вируса, на основе рекомбинантных белков, продолжают активно работать над векторными вакцинами. А когда появился COVID-19, практически все мои коллеги, кто занимался вакцинами от ВИЧ, перекинулись в область коронавируса. Я смотрю на научные статьи о коронавирусе — там все знакомые имена.
Я уже упоминал, что технология стабилизации спайкового белка была разработана для ВИЧ, это был один из главных прорывов в вакцинологии за последние десять лет, и она нашла отличное применение в вакцинах от COVID-19.
Известный вирусолог Барни Грэм, который занимался именно стабилизацией вирусного белка у ВИЧ и у респираторно-синцитиального вируса, сыграл важную роль в разработке одной из самых популярных в мире вакцин от COVID-19 компании Moderna.
Мишель Нуссенцвайг, который выделил нейтрализующие антитела к коронавирусу, разработал технологию выделения этих антител в ходе многолетних исследований антител к ВИЧ и вирусу иммунодефицита обезьян. Памела Бьоркман, ведущий специалист Caltech по структуре вирусных белков, раньше изучала в том числе и ВИЧ.
— Это известные имена, но применяются ли отработанные на ВИЧ методики?
— Сами методы тестирования на нейтрализующие антитела были разработаны для ВИЧ, а теперь применяются для COVID-19. В области тестирования вакцин существует огромная сеть клинических центров и лабораторий и в США, и в Африке, и по миру — она была создана для ВИЧ-инфекции, после начала пандемии ее просто взяли и перепрофилировали под коронавирус, а заведуют ею те же самые ученые.
С другой стороны, технологии, нашедшие применение в вакцинах от COVID-19, сейчас интересуют и исследователей ВИЧ: технология мРНК вакцин разрабатывалась и для ВИЧ, но сейчас работы в этой области существенно активизировались.
— Кто-нибудь из российских ученых занимается разработками вакцины от ВИЧ?
— В России разработки вакцин от ВИЧ ведутся, но их немного. Есть три исследовательские группы: в Москве, Петербурге и в Новосибирске. У них есть определенные наработки, но пока они не прошли дальше первой фазы испытаний.
Вопрос в большей мере этический. Раз уж существуют эффективные методы предотвращения ВИЧ-инфекции, то нельзя не делать их доступными участникам клинических испытаний. Но если мы предоставляем их всем участникам клинических испытаний (и плацебо-группе, и группе, получающей вакцину), то количество новых инфекций будет чрезвычайно мало в обеих группах, и эффективность вакцины будет невозможно измерить. Или придется делать испытания еще обширнее и еще длинней, что еще больше повысит их стоимость.
Перспективы разработки вакцины от ВИЧ тают с каждым днем именно потому, что сложно их тестировать, не подвергая людей риску заразиться в ситуации, когда есть готовые способы избежать этого риска. Но нельзя сказать, что ученые полностью потеряли надежду. Уже ведутся активные обсуждения новых подходов к проведению клинических испытаний ВИЧ-вакцин в будущем.
А для лечения людей с COVID-19 есть только один одобренный препарат, ремдесвир, причем он не спасает жизни, а только ускоряет выздоровление. Очевидно, что было бы неплохо иметь больше противовирусных лекарств — так почему у нас их нет? Оказывается, изобретать эти препараты не так просто.
Но есть шанс, что по мере того как исследователи будут получать новую информацию о жизненном цикле вирусов, ассортимент противовирусных препаратов будет увеличиваться. Ученые также готовятся к следующей возможной пандемии, чтобы иметь к тому времени более обширный список доступных препаратов.
Вот в каком состоянии находится рынок противовирусных средств сегодня и как их ассортимент может вырасти.
Как работают противовирусные препараты?
Противовирусный препарат может действовать на любом из этапов копирования вируса. Проделывая свою грязную работу, вирус должен прикрепиться к клетке хозяина, а затем проникнуть внутрь и обмануть клетку так, чтобы она начала копировать вирусные гены и собирать вирусные белки. После этого новые, размноженные вирусы выходят из клетки и заражают новые клетки-мишени. На каждом этапе этого процесса вирусным генам и белкам приходится взаимодействовать с разными молекулами хозяина. Каждое такое взаимодействие — потенциальная возможность для действия противовирусных препаратов. Эти лекарства часто имитируют какие-либо молекулы человеческой клетки и работают как ловушки, нарушая жизненный цикл вируса и снижая его распространение.
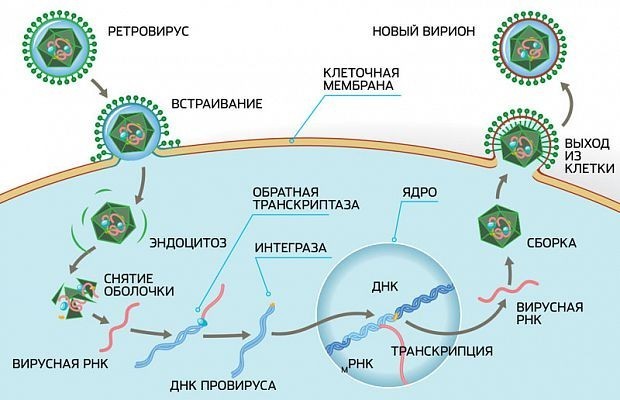
Обычно действие лекарств направлено на копирование вирусных геномов в виде ДНК или РНК. Часто у вирусов есть свои собственные версии белков, выполняющих этот процесс (они называются полимеразами). При копировании генома полимераза по одному добавляет отдельные строительные блоки, нуклеотиды, для достраивания цепочки ДНК или РНК.
Препарат ацикловир, используемый для лечения герпеса, действует именно на этом этапе копирования генома. Вирусная полимераза принимает молекулу ацикловира за еще один строительный блок, хотя это не так. Как только такой ненастоящий блок встраивается в растущую цепочку, копирование вирусного генома прекращается, и игра для вируса окончена.
Другой препарат, осельтамивир (Тамифлю) от гриппа, действует на этапе выхода вируса из зараженной клетки. Вирус использует важный белок, называемый нейраминидазой, для выхода наружу. Осельтамивир связывается с нейраминидазой и не дает ей работать.
Почему существует так мало противовирусных препаратов?
По сравнению с антибактериальными препаратами количество противовирусных лекарств ничтожно мало. Это обусловлено несколькими факторами.
Кроме того, по словам Моники Ганди, врача-инфекциониста Калифорнийского университета в Сан-Франциско, вирусы представляют собой куда более сложную цель, чем бактерии. Бактерии — это целые живые клетки со своими собственными метаболическими путями, необходимыми им для выживания и способными служить мишенью для препаратов. Кроме того, у бактериальных клеток есть уникальные особенности, не свойственные клеткам человека (например, наличие клеточной стенки). Это значит, что антибиотики могут нарушать клеточную стенку или другие структуры клетки и процессы, присущие только бактериям, без риска навредить нашим собственным клеткам. А поскольку в процессе эволюции микробы сами научились вырабатывать антибиотики для борьбы друг с другом, у нас есть огромное множество антибактериальных веществ природного происхождения.
Кроме того, противовирусные препараты могут иметь лишь ограниченное число возможных форм, поскольку они должны подходить в качестве субстрата для вирусных белков.
Самая сложная задача, по словам Селей-Хардтке, заключается в том, чтобы убедиться, что лекарства не повреждают вместе с вирусами и клетки человека. Например, в случае с ацикловиром, имитирующим нуклеотиды, не будет ли риска, что препарат встроится и в человеческую ДНК?
Единственное исключение из всеобщей нехватки противовирусных средств — обширный перечень лекарств против ВИЧ, ставший результатом десятилетних исследований. Ганди говорит, что для лечения ВИЧ-положительных пациентов она может выбирать из примерно 30 наименований препаратов. И еще больше находится в процессе разработки — что очень хорошо, потому что ВИЧ быстро мутирует, вырабатывая устойчивость к любому используемому средству.
Как используют противовирусные препараты для лечения COVID-19?
Препараты, разработанные для борьбы с одним вирусом, часто оказываются эффективны и против других, поскольку у многих вирусов есть схожие белки (например, полимеразы для копирования вирусных геномов). Но нынешняя пандемия требует от создателей противовирусных лекарств чрезвычайной находчивости.
Здесь на сцену выходит ремдесвир, который ранее испытывали на людях с лихорадкой Эбола (хотя он не особенно им помог). Он тоже имитирует нуклеотиды, но у этого препарата есть свои особенности. Встраиваясь в новый вирусный геном (у коронавирусов геном состоит из РНК), ремдесвир не останавливает копирование цепочки. Полимераза продолжает достраивать цепь РНК. Но после добавления нескольких нуклеотидов ремдесвир так крепко связывается с РНК, что полимераза не может продолжать работу. Однако к тому времени редактирующий белок коронавируса уже не работает: ему мешают нормальные нуклеотиды, добавленные после ремдесвира, говорит Селей-Радтке. И полимераза в итоге застревает.
Несмотря на этот изобретательный трюк, эффективность ремдесвира при лечении людей с COVID-19 не особенно впечатляет. Из хороших новостей: в исследовании 1062 человек, госпитализированных с вирусом, было показано, что пациенты, получавшие ремдесвир, выздоравливали быстрее, чем те, кто получал неактивное плацебо. На основании этого и двух похожих исследований FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США) одобрило использование ремдесвира для лечения госпитализированных пациентов.
Производитель ремдесвира, компания Gilead Sciences, работает над версией препарата, которую можно будет принимать в виде ингаляций. В планах есть и другие противовирусные препараты. Например, у Селей-Радтке много надежд на другой аналог нуклеотидов, называемый AT527. Этот препарат, разработанный совместно компаниями Roche и Atea, сейчас находится в процессе исследований с участием людей. Как и ремдесвир, он действует не сразу, так что редактирующий белок не может его вырезать из РНК. Но в отличие от ремдесвира, этот препарат представляет собой таблетки для приема внутрь. В компаниях надеются, что его можно будет применять как до, так и после госпитализации пациентов. И, возможно, его смогут принимать люди, контактировавшие с COVID-19, чтобы избежать развития заболевания.
Пандемия вынудила ученых приложить все усилия к поиску способов лечения. Гейс тестирует действие широкого спектра лекарств — не только стандартные противовирусные препараты — на SARS-CoV-2 в чашках Петри в рамках Инициативы по поиску новых антиретровирусных препаратов (READDI). Идея состоит в том, что поскольку вирус зависит от многих процессов в человеческой клетке, разные препараты, действующие на человеческие белки, могут помочь в лечении, повреждая вирус сильнее, чем пациента. Поэтому есть смысл проверить, не являются ли лекарства, разработанные изначально для лечения рака, психоза, воспалительных и аутоиммунных заболеваний, эффективными также и против COVID-19.
Но участники инициативы READDI, в том числе исследовательские центры, фармацевтические компании и негосударственные организации, нацелены не только на лечение COVID-19. Они надеются найти и протестировать потенциальные лекарства против пока неизвестных инфекций, которые могут появиться в будущем.
С чего все начинается
Вакцины не разрабатываются просто так, по чьему-либо желанию. Процесс инициируется, когда инфекция приобретает угрожающий характер (эпидемии или пандемии), особенно всемирного масштаба. Огромное количество накопленных статистических данных служит толчком к поиску нового препарата.
Изучение свойств патогена происходит как в условиях лаборатории (с привлечением животных или in vitro), так и путем непосредственного наблюдения за инфицированными людьми.
В процессе принимают участие одновременно несколько групп ученых, каждая из которых имеет свои задачи и методы. Таким образом, инфекционного возбудителя исследуют с максимального числа сторон.
Здесь же формируются гипотезы, каким может быть будущий препарат, – живой, инактивированный, синтетический. Важными моментами являются, например:
как будет происходить оценка иммунного ответа;
какие антигены возбудителя нужно взять;
какая питательная среда потребуется для выращивания микроорганизма;
сколько антигена надо, чтобы стимулировать формирование иммунитета у людей разных возрастов;
сколько дозировок нужно и с какой периодичностью введения, и так далее.
НА ЗАМЕТКУ! Антиген – часть инфекционного возбудителя, к которому иммунная система вырабатывает защитные антитела. Для разных антигенов (даже одного микроба) нужны разные антитела.
То есть, на этапе разработки вакцин ученые сталкиваются с огромным количеством вопросов, выдвигают и проверяют десятки и сотни гипотез, при необходимости меняют концепцию. Понятно, что в экстренных случаях такая работа ведется непрерывно, круглосуточно, и в ней задействовано в несколько раз больше исследований, чем в штатном режиме.
Доклинический этап
Когда базовые исследования закончены, и прототип препарата готов, начинается доклинический этап. Испытания проводятся на животных, параллельно отрабатывается технология производства вакцины.
Среди важных моментов доклинических испытаний можно отметить следующие:
- происходит оценка возможности вакцины формировать иммунитет;
- выявляется токсичность препарата для живого организма;
- определяется минимальная, оптимальная и максимально допустимая дозировка;
- исследуется воздействие на плод (вероятность развития аномалий и прочее);
- оценивается способность препарата влиять на образование и/или рост опухолей;
- оцениваются аллергизирующие свойства и так далее.
В процессе тестирования животным вводят вакцину в различных концентрациях и в разных состояниях организма, наблюдая и фиксируя при этом малейшие изменения. Нужно отметить, что большая часть вакцин не проходит доклинические испытания, так как не приводит к цели – иммунный ответ на введение отсутствует.
НА ЗАМЕТКУ! Для проведения доклинических исследований, как правило, берут два вида животных. Чаще всего, это – мыши и приматы. Идеальный вариант – когда в тестировании принимают участие от трех и более видов. Это дает возможность подобрать оптимально подходящую дозировку и обеспечить полную безопасность препарата.
Если доклинические испытания прошли успешно, для дальнейших испытаний нужно получить разрешение в специализированных органах. Авторы подают заявку, в которой подробно описываются проведенные исследования и тесты, обосновывается необходимость применения препарата и другие моменты. В ответ получают либо отказ, либо разрешение. При положительном решении разработка вакцины переходит в клинический этап.
Клинический этап разработки
Этот этап предполагает непосредственное участие в испытаниях людей-добровольцев. Неважно, для какого возраста разрабатывается вакцина, ее действие изучают только на здоровых взрослых людях. Клинические исследования проводятся в три фазы. Процесс разделен на стадии, что позволяет контролировать тестирование препарата, постепенно увеличивая количество людей. Это значительно снижает риски: всё что будет тестироваться массово, уже прошло испытания в узких кругах. И, конечно, такой подход позволяет прекратить тестирование на любом этапе в случае обнаружения нежелательных явлений. Именно поэтому каждая фаза имеет огромную значимость и свои цели.
Первая фаза
Проводится на совсем небольшом количестве людей (десятки людей). Её цель – подтверждение первичной безопасности для людей в принципе. Происходит исследование вакцины в действии. Ученые обращают внимание на следующие моменты:
- переносимость и побочные явления;
- особенность иммунного ответа (скорость, выраженность и другие);
- взаимодействие с другими препаратами;
- безопасность диапазона доз.
В процессе тестирования может изменяться не только дозировка, но и состав препарата. Вакцину вводят не сразу всем участникам, а поочередно, чтобы избежать массовых негативных проявлений в случае, если что-то пойдет не так.
Вторая фаза
Цель этой стадии – оценка эффективности (иммуногенности) вакцины. Во второй фазе испытаний принимает участие несколько сотен добровольцев. На данном этапе происходит еще большая отработка свойств и дозировки препарата. Тщательно фиксируются и анализируются реакции организма, определяется периодичность и сроки вакцинации, особенности транспортировки и прочие моменты.
Третья фаза
Её цель – доказать безопасность и эффективность вакцины при массовом применении в динамике, а также удостовериться, что польза вакцины компенсирует те нежелательные реакции, которые неминуемо будут выявлены (хотим уточнить, что допускаются лишь легкие реакции). Именно на третьей фазе ученые делают выводы, которые невозможны при небольшой численности испытуемых: действие вакцины изучается на тысячах человек. Анализируется частота побочных эффектов (в том числе отдаленных), продолжается определение безопасности.
После того, как все фазы клинического этапа исследований успешно пройдены, данные о них поступают в специализированные структуры. Положительное решение означает, что вакцина может быть запущена в производство; препарат регистрируют, а фирме-изготовителю выдается соответствующая лицензия.
Нужно отметить, что лицензируется не только сама вакцина, но и ее производство. Если в процесс изготовления вносятся какие-либо изменения или он не может в полной мере обеспечить качество, препарат заново проходит испытания. Вакцины выпускаются сотнями тысяч дозировок, и важно, чтобы каждая из них соответствовала ранее заявленным протоколам.
Выдача лицензии и массовый выпуск вакцины не означает, что исследования закончились. Существует еще четвертая фаза клинических исследований. Она проводится уже после того, как препарат становится доступным для людей через розничную сеть медицинский организаций. Это постмаркетинговые испытания или так называемый постклинический мониторинг. Он имеет масштабный характер, позволяют получить еще более подробную информацию о безопасности и эффективности препарата. Также на четвертой фазе оцениваются комбинации с другими препаратами и уточняются вновь открывшиеся данные и гипотезы.
Может быть и такое: вакцину зарегистрировали и начали применять, но внезапно сняли с производства. Дело в том, что даже несколько тысяч человек в некоторых случаях не могут являться абсолютным показателем безопасности. Только внедрение в массы способно в полной степени проявить те или иные качества препарата. Однако такие случаи – редкость.
Примечательно, что даже после того, как все фазы испытаний пройдены, наблюдения за действием препарата продолжают вестись постоянно в течение многих лет: ученые отслеживают влияние на организм в долгосрочном отношении, анализируют данные о динамике заболевания с момента внедрения препарата.
Как же получают сами препараты?
Непосредственное производство вакцины зависит от ее вида. В общих чертах его можно описать следующим образом.
1. Живая вакцина (ослабленная)
- Выбирают штамм возбудителя.
- Ослабляют микроорганизм.
- Размножают (культивируют) в питательной среде.
- Очищают от примесей.
- Стандартизируют (приводят к нужной концентрации, фасуют).
2. Инактивированная вакцина (убитые возбудители).
3. Рекомбинантная вакцина. Используются методы генной инженерии.
- У патогенного возбудителя берут часть генетического материала.
- Встраивают его в геном клеток, которые будут его производить (чаще всего, это – дрожжи).
- Культивируют клетки в питательной среде.
- Выделяют и очищают антиген.
- Готовят вакцину.
НА ЗАМЕТКУ! Одни из последних разработок ученых – создание вакцин на основе растительных вирусов. Их комбинируют с антигеном возбудителя болезни человека. Подобные исследования с использованием вируса табачной мозаики уже проводятся в отношении краснухи, COVID, сибирской язвы.
Сколько времени требуется для создания препарата
Длительность разработки и производства вакцин зависит от многих факторов: штамма возбудителя, антигенных свойств, того, насколько он изучен. В среднем, этапы занимают следующее количество времени:
Суммарно на разработку одной вакцины уходит примерно 10-15 лет (без мониторинга на практике после внедрения в производство).
То же происходит, если свойства, присущие семейству возбудителя, хорошо известны. Например, ежегодные мутации вируса гриппа не являются препятствием для быстрого производства новой вакцины.
Особенности контроля
Каждый этап производства вакцин жестко контролируется. Стандарты и положения, регулирующие нормы качества препаратов, изложены в сборнике – фармакопее. Она имеет юридическую силу и находится под государственным контролем.
Люди-добровольцы, которые участвуют в испытаниях, обязательно должны дать на это свое согласие на основании утвержденного этическим комитетом протокола. Непосредственно на производстве надзору подвергается каждая серия выпущенного препарата. Контролируется не только состав вакцины, но и стерильность, концентрация, требования к фасовке, упаковке и так далее.
На фоне вышесказанного утверждения противников вакцинации выглядят, по меньшей мере, смешными. А если вы запутались в современных вакцинах, раздумываете – делать прививки или нет, наши специалисты всегда придут на помощь: проконсультируют, объяснят, посоветуют.
Читайте также:

