Вакцины при респираторно-синцитиальной инфекции крупного рогатого скота
Обновлено: 13.05.2024
Респираторно-синцитиальная болезнь крупного рогатого скота (Bovine respiratory syncytial disease) – остро протекающая болезнь с выраженной контагиозностью, характеризующаяся поражением респираторных органов с явлениями острого катара верхних дыхательных путей
и лихорадки. Заболевание впервые выявлено в 1956 г у обезьян, а в 1968 г – у крупного рогатого скота. Вспышки инфекции отмечаются преимущественно в осенне-зимний период.
ЭТИОЛОГИЯ. Возбудитель – респираторно-синцитиальный вирус, относящийся к семейству Paramyxoviridae. Размер его 200 нм. Человек и крупный рогатый скот являются природными хозяевами этого вируса. Снаружи он окружен липидно-полисахаридной оболочкой. Особенностью его является отсутствие нейраминидазы и неспособность вызывать гемагглютинацию при наличии чувствительности к эфиру, хлороформу, дезоксихалату и трипсину. Вирус нестойкий. При 5°С он разрушается в течение 30 мин, а в лиофилизированном виде может сохраняться до года.
С другими вирусами и бактериями возникает ассоциированная респираторная инфекция с более тяжелым клиническим проявлением.
Роль этого вируса в возникновении пневмоэнтеритов не выяснена. Установили распространенность серопозитивных животных среди клинически здоровых телят и животных с респираторными симптомами. При отсутствии ассоциаций с другими инфекциями выздоровление наступает быстро. В случае присоединения бактериальной инфекции в частности пастереллеза, течение болезни осложняется. Вирус часто сочетается с герпес-, энтеро-, корона-, ротавирусами и др.
ЭПИЗООТОЛОГИЯ. Источником инфекции является больное животное. Инфекция распространяется воздушно-капельным путем, считается возможным внутриутробное заражение.
Возможность заражения разными путями обуславливает длительную циркуляцию возбудителя в стаде восприимчивого к заболеванию скота.
Восприимчивы к инфекции телята, удается заразить овец и оленей. Отмечена разная чувствительность к инфекции у различных пород скота.
ПАТОГЕНЕЗ. Болезнь развивается по типу респираторной инфекции с поражением клеток эпителиальной выстилки респираторного тракта. Вирус обуславливает слияние клеток и формирование синцитиев. В цитоплазме клеток появляются ацидофильные включения. Вирусная инфекция обуславливает интоксикацию, при остром течении болезни возникают явления лихорадки.
Экспериментально было установлено, что вирус сам по себе у телят-гнотобиотов не в состоянии вызвать клинически выраженное заболевание. Следовательно, тяжелое течение респираторно-синцитиальной болезни может быть обусловлено лишь ассоциацией данного вируса с другими возбудителями. При отсутствии ассоциации с бактериальной инфекцией выздоровление наступает через 5–10 дней.
КЛИНИЧЕСКАЯ КАРТИНА заболевания характеризуется сильно выраженным респираторным синдромом с кашлем, затруднительным дыханием, обильным носовым истечением при повышении температуры до 41,5 °С. Болезнь протекает остро и при отсутствии осложнений заканчивается выздоровлением, примерно, через 3–5 дней у молодняка, а у взрослых животных этот срок удлиняется в два раза.
ПАТОЛОГОАНАТОМИЧЕСКИЕ ИЗМЕНЕНИЯ. При микроскопическом осмотре выявляют некроз и эрозии вокруг носового зеркальца. На вскрытии обнаруживают острый катаральный, а также гнойный и фибринозный ринит, ларингит, трахеит. В легких изменения соответствуют бронхопневмонии с выраженными экссудативно-пролифе-ративными процессами, в некоторых случаях с эмфиземой легких. Отмечается увеличение перибронхиальных лимфоузлов. В бронхиальном дереве изменения преобладают в бронхиолах, где наблюдаются пролиферативные явления, а в просветах скапливается катаральный экссудат. У половозрелых животных возникает папулезно-везикулярный, иногда пустулезный вагинит и баланопостит.
ДИАГНОЗ. При диагностике болезни используют эпизоотологические, клинические, патологоанатомические данные. Однако окончательный диагноз устанавливают по результатам вирусологического и серологического исследований. Вирусологические исследования проводят со смывом из носа и материалом, отобранным из других участков респираторного тракта. Серологическую диагностику проводят с использованием иммунофлуоресценции, РДП. РСК, РИГА, ИФА. Исследуют парные сыворотки.
ДИФФЕРЕНЦИАЛЬНУЮ ДИАГНОСТИКУ проводят в отношении парагриппа-3, аденовирусной инфекции, вирусной диареи, ящура, злокачественной катаральной лихорадки и пастереллеза. Дифференцировать удается по серологическим тестам и идентификации выделенного возбудителя.
Респираторно-синцитиальная инфекция отличается появлением многоядерных клеток в виде синцитиев, симпластов из альвеолярных клеток легкого с наличием пневмонии и эмфиземы при выраженной реакции парабронхиальных лимфоузлов.
ИММУНИТЕТ И ПРОФИЛАКТИКА. Переболевшие животных приобретают иммунитет, который сохраняется 6 – 12 мес. Проводится вакцинация, применяют инактивированную кристаллвиолетом вакцину, которая создает защиту на 1 – 3 мес. Специфических средств лечения нет, антибиотики предотвращают секундарную бактериальную инфекцию, применяют симптоматическое лечение, проводят общие ветеринарно-санитарные мероприятия.
Респираторно-синцитиальная инфекция (PC-инфекция) крупного рогатого скота — контагиозная, остро протекающая болезнь, характеризующаяся повышением температуры, преимущественным поражением органов дыхания. Регистрируется во многих странах мира, в том числе и в России.
В естественных условиях болеет крупный рогатый скот. Заболевание наиболее ярко проявляется у 1—3-месячных телят. PC-инфекция часто осложняется вторичной бактериальной инфекцией, особенно пастереллезом. Многие исследователи считают, что в этиологии массовых пневмоний молочных телят основная роль принадлежит PC-вирусу, который обнаруживали гораздо чаще, чем вирусы ринотрахеита, диареи и парагриппа-3. Отмечено, что особенно чувствителен к PC-вирусу чистокровный крупный рогатый скот герефордской породы. PC-вирус часто участвует в смешанных респираторных инфекциях с другими вирусами и бактериями.
Характеристика возбудителя. Вирус относится к семейству Paramyxoviridae, подсемейству Pneumovirinae, роду Pneumovirus. Вирионы вируса состоят из нуклеокапсида спиральной симметрии и липопротеидной оболочки, содержащей липиды и полисахариды. Вирус имеет единую односпиральную линейную минус-РНК. По размеру и форме вирионы неоднородны, однако многие из них имеют округлую форму.
Устойчивость к физико-химическим воздействиям. Вирус очень нестоек в окружающей среде. Он высокочувствителен к эфиру, хлороформу, дезоксихолату, трипсину, низким значениям pH (pH 3,0) и к замораживанию. При 4 °С он сохраняет активность в течение 7 дней, при минус 70 °С — до 2 мес. Инактивация его наступает при 56 °С за 30 мин. В лиофилизированном виде вирус сохраняет активность до одного года.
Антигенная структура. Изучена недостаточно. Установлено, что вирус не содержит нейраминидазы. Показано, что гликопротеид и F-белок имеют решающее значение для формирования защитного иммунитета.
Антигенная вариабельность. Вирус в иммунологическом отношении однороден. Штаммы PC-вируса крупного рогатого скота родственны человеческим штаммам этого вируса.
Антигенная активность. Вирус вызывает образование вируснейтрализующих, комплементсвязывающих и преципитирующих антител. Отмечена линейная корреляция между титрами комплементсвязывающих и нейтрализующих антител. PC-инфекция может развиваться на фоне циркулирующих антител. Показано, что антитела играют защитную роль при наличии их в титрах не ниже 1 : 128 в сыворотке крови.
Культивирование вируса. PC-вирус культивируется в первичных культурах клеток почки, тестикул, легких и селезенки крупного рогатого скота. При первичном выделении из патологического материала его удается выделить на третьем-четвертом пассажах, в которых на 3—7-й дни проявляются выраженные цитопатические изменения: очаги зернистых сморщенных клеток, синцитии, в большинстве которых имеются ацидофильные цитоплазматические включения. Вирус также культивируется в перевиваемых линиях клеток, полученных из слизистой оболочки носа, легких, почек (Таурус-1) крупного рогатого скота и клеток Vero. Куриные эмбрионы к PC-вирусу нечувствительны.
Гемагглютинирующие свойства. У вируса они не установлены.
Экспериментальная инфекция. Ее можно вызвать при итраназальном и интратрахеальном заражении месячных телят, у которых на 5-й день появляются характерные признаки болезни. У зараженных животных с третьего дня РИФ выявляли вирусный антиген в эпителиальных клетках носовой полости, трахеи, бронхов, бронхиол и альвеолярных макрофагах. Кроме того, выделяли вирус из слизистых носа, бронхов и легких. Удавалось воспроизвести экспериментальную инфекцию на ягнятах, обезьянах, хорьках, норках и морских свинках.
Клинические признаки. Вспышки болезни чаще наблюдают в переходные осенне-зимние и зимне-весенние периоды с охватом большого поголовья животных.
Симптомы болезни обычно проявляются слабо и могут быть незамеченными. Проявление клинических признаков болезни зависит от многих предрасполагающих и осложняющих факторов: условий содержания и кормления животных, их физиологического состояния, вирулентности и дозы вируса, присутствия других инфекционных агентов и др.
Болезнь обычно сопровождается повышением температуры тела до 41 °С, затрудненным дыханием, кашлем, слюноотделением, серозными истечениями из носа и развитием бронхопневмонии разной тяжести. Отмечено, что PC-вирус может вызвать аборт. У молодняка болезнь обычно продолжается не более 3—5, а у взрослых животных — 8—10 дней. Прогноз болезни, как правило, благоприятный, если нет бактериальных осложнений и созданы оптимальные условия содержания животных.
Патологоанатомические изменения. При вскрытии вынужденно убитых животных обнаруживают признаки эмфиземы легких и пневмонии, увеличение бронхиальных лимфатических узлов. При гистологическом исследовании в эпителии альвеол и бронхиол выявляют многоядерные, гигантские клетки.
Локализация вируса. Изучена недостаточно. PC-вирус в течение первой недели после заражения выделяли из носовых и конъюнктивальных смывов. Нередко его изолируют от новорожденных телят. Возможно длительное вирусоносительство.
Из организма больных животных вирус выделяется с носовым экссудатом и выдыхаемым воздухом.
Источник инфекции — больные животные. Инфекция передается воздушно-капельным путем. Считают, что естественная внутриутробная инфекция поддерживает циркуляцию в стаде РС-вируса.
Диагностика. Диагноз на PC-инфекцию ставят на основании эпизоотологических, клинических патологоанатомических данных и лабораторных исследований.
Взятие и подготовка материала. Они идентичны таковым при аденовирусной инфекции. Следует отметить, что PC-вирус очень нестоек, поэтому лучшие результаты выделения вируса получают, проводя заражение культур клеток как можно быстрее после взятия материала и избегая его замораживания до исследования.
Лабораторная диагностика. Диагностику PC-инфекции проводят с использованием набора диагностикума, выпускаемого биопромышленностью. Ее проводят параллельно с исследованием материала на парагрипп-3, аденовирусную инфекцию, инфекционный ринотрахеит и вирусную диарею.
Индикация вируса. В патологическом материале ее проводят путем обнаружения вирусного антигена в мазках, отпечатках из органов или в клетках, полученных после центрифугирования смывов, в РИФ.
Изоляцию вируса патологического материала выполняют в первичной культуре клеток ТБ, ПЭК, ЛЭК или в перевиваемых культурах клеток Таурус 1, ПЛЭК и др. Проводят не менее трех пассажей.
Идентификацию выделенного вируса проводят в PH, РИФ, редко в РДП, РСК.
Обнаруживают антитела в сыворотке крови больных и переболевших животных (ретроспективная диагностика) в РИГА, ИФА, PH, РДП.
Дифференциальный диагноз. Следует исключить парагрипп-3, вирусную диарею, инфекционный ринотрахеит, аденовирусную инфекцию, хламидиоз, так как эпизоотологические, клинические и патологоанатомические данные очень сходны с РС-инфекцией. Необходимо учитывать вероятность смешанного течения этих инфекций.
Иммунитет и специфическая профилактика. Иммунитет при PC-инфекции изучен недостаточно. У крупного рогатого скота, перенесшего болезнь, вырабатываются антитела, однако уровень гуморальных антител не может быть надежным критерием оценки напряженности иммунитета. Для PC-инфекции характерны повторные заболевания даже при наличии в крови антител, что свидетельствует о второстепенной роли сывороточных антител в иммунитете. Важное значение в иммунитете, вероятно, принадлежит секреторным антителам слизистой оболочки респираторного тракта и клеточным факторам.
Материнские антитела слабо предохраняют потомство от инфекции, но частота и тяжесть болезни обратно пропорциональны уровню специфических материнских антител.
В нашей стране вакцины против этой инфекции не разработаны. В зарубежных странах применяют живые вакцины.
Аденовирусная инфекция крупного рогатого скота (аденоинфекция) — остропротекающая болезнь, преимущественно телят. Характеризуется поражением органов дыхания, пищеварения и конъюнктивитами. У взрослых животных протекает обычно латентно.
Болезнь широко распространена во многих странах мира, в том числе и в России. Чаще болеют телята от 2-недельного до 4-месячного возраста. Более взрослые животные поражаются реже.
Характеристика возбудителя. Впервые вирус изолировал Клейн в 1939г. (США).
Вирус относится к семейству Adenoviridae, роду Mastadenovirus. Вирионы вируса представляют собой лишенный суперкапсидной оболочки двадцатигранник кубической симметрии диаметром 70—90 нм. Каждый вирион состоит из 252 капсомеров, из которых 240 являются гексонами (капсомер в окружении шести капсомеров), 12 — пентонами (капсомер в окружении пяти капсомеров) и длинного отростка с утолщением на вершине. Геном аденовирусов содержит одну линейную молекулу двуспиральной ДНК.
Устойчивость к физико-химическим воздействиям. Вирусы во внешней среде (в пределах pH 5,0—9,0) более устойчивы, чем другие вирусы: при 4 °С сохраняют активность в течение 90 дней; при 24 °С — 1—3 мес; при 36 °С — 15—60 дней; при 50 °С — инактивируются за 30—60 мин. Устойчивы к эфиру, хлороформу, трипсину, повторному замораживанию и оттаиванию, длительно сохраняются в лиофилизированном состоянии (более 5 лет). Абсолютный этиловый спирт и формалин в конечной концентрации 0,1—0,3 % инактивируют вирусы. УФ-лучи полностью инактивируют их за 30—60 мин.
Антигенная структура. У аденовирусов различают антигены трех видов: А, В и С.
Антиген А (связан с гексонами) — группоспецифичен, при иммунизации стимулирует образование группоспецифических комплементсвязывающих, преципитирующих антител, антител, реагирующих в реакции РНГА, а также вируснейтрализующих антител против гомологичного вируса.
Антиген В (связан с пентонами) — токсический фактор, ответственный за ранний цитопатический эффект.
Антиген С (связан с нитевидными структурами вирусного капсида) — типоспецифичен, он стимулирует выработку только типоспецифических антител, выявляемых в pH и РТГА.
В культуре клеток, инфицированной онкогенными вирусами, выявляют Т (трансплантационный) антиген. Вирусы первой подгруппы содержат в геноме родоспецифическую детерминанту, общую для вирусов млекопитающих.
Антигенная вариабельность. У крупного рогатого скота установлено 10 серотипов аденовирусов. Все 10 типов аденовирусов крупного рогатого скота на основании общих комплементсвязывающего и преципитирующего антигенов, выявляемых в РСК, РДП и РИФ, делят на две подгруппы. К первой подгруппе относят серотипы 1, 2 и 3, остальные типы — ко второй подгруппе. Вирусы первой подгруппы по антигенным и биологическим свойствам ближе к аденовирусам человека.
Антигенная активность. Вирус индуцирует в организме животных образование вируснейтрализующих, комплементсвязывающих и преципитирующих антител.
Культивирование вирусов. Для культивирования аденовирусов крупного рогатого скота используют культуры клеток из тканей этих животных: почки эмбриона коровы (ПЭК), тестикулы бычка (ТБ), легкие эмбриона коровы (ЛЭК). Вирусы вызывают в клетках характерный цитопатический эффект (округление клеток и образование из них гроздевидных скоплений).
Аденовирусы крупного рогатого скота не размножаются в куриных эмбрионах и непатогенны для лабораторных животных, кроме некоторых онкогенных штаммов (3 серотипа), которые вызывают опухоли у новорожденных хомячков.
Вирусы первой подгруппы хорошо репродуцируются в культуре клеток ПЭК, ЛЭК и ТБ с образованием в них одного ядерного включения неправильной округлой формы.
Для вирусов второй подгруппы используют культуру клеток ТБ или ЛЭК, в которых они продуцируют множественные внутриядерные включения правильной округлой формы.
В последние годы для культивирования аденовирусов первой и второй подгрупп предложена перевиваемая культура клеток почки теленка Т-1 (Таурус-1).
Гемагглютинирующие свойства. Гемагглютинирующая активность установлена у аденовирусов первой подгруппы в отношении эритроцитов белых крыс и в низких титрах — эритроцитов белых мышей. Некоторые штаммы вирусов второй подгруппы приобретали гемагглютинирующие свойства после предварительной их концентрации. Более четкие результаты РТА получают при температуре 4 °С. Спектр гемагглютинирующей активности многих штаммов аденовирусов еще не изучен.
Гемадсорбирукнцие свойства. Не установлены.
Онкогенные свойства. Обнаружены у штамма WBR-1 для новорожденных хомячков.
Экспериментальная инфекция. Воспроизводится только на телятах 15—30-дневного возраста, лучше на безмолозивных. У животных старшего возраста болезнь протекает хронически.
Клинические признаки. Инкубационный период болезни длится 4—7 дней. Течение болезни зависит от условий кормления, содержания, возраста телят. Наиболее остро она протекает у молодняка 5—20-дневного возраста, сопровождается подъемом температуры тела до 41,5 °С, слезотечением, слизистыми, затем слизисто-гнойными истечениями, кашлем, затрудненным дыханием. У телят наблюдают слабость, понос, иногда с примесью крови в фекалиях. Смертность может достигать 60 %. У животных старшего возраста болезнь часто приобретает хроническое течение. Переболевшие телята отстают в росте и долго кашляют. Таким образом, для аденовирусной инфекции характерно преобладание респираторного, конъюнктивального или кишечного синдрома.
Патологоанатомические изменения. При вскрытии обнаруживают признаки катарально-геморрагического гастроэнтерита, изменения в органах дыхания (очаговые уплотнения, ателектаз и эмфизему легких). Регионарные лимфатические узлы увеличены. В клетках легочной ткани, слизистых оболочек трахеи, бронхов, кишечника и паренхиматозных органов находят внутриядерные включения.
Локализация вируса. От клинически больных животных аденовирусы изолируют из проб с конъюнктивы, носовой полости, миндалин, из крови и фекалий, а также из паренхиматозных органов и лимфатических узлов погибших телят. Переболевшие животные длительное время остаются вирусоносителями. Характерное биологическое свойство аденовирусов — тропизм к лимфоидной ткани.
Источники инфекции. Основной источник аденовирусной инфекции — больные животные, которые выделяют вирус в окружающую среду с истечениями из носа и фекалиями, а также вирусоносители. Заражение происходит воздушно-капельным, алиментарным путем и через конъюнктиву. Передача инфекции возможна через корма, подстилку, загрязненные выделениями больных животных.
Диагностика. Диагноз ставят, основываясь на анализе эпизоотологических, клинических данных, патологоанатомических изменений и результатов лабораторных исследований. При этом решающее значение имеют лабораторные исследования, так как сходную патологию могут вызвать вирусы ПГ-3, инфекционного ринотрахеита, диареи, респираторно-синтициальной инфекции, а также хламидии и другие агенты. Поэтому поступивший материал исследуют в лаборатории параллельно на все вышеуказанные инфекции, используя диагностические наборы, выпускаемые биологической промышленностью.
Взятие и подготовка материала. В лабораторию отправляют паралогический материал от больных животных, взятый в первые со дня болезни при выраженной клинической картине или от животных, убитых с диагностической целью в острой стадии заболевания.
От больных животных берут смывы со слизистых оболочек носа, глаз и прямой кишки с помощью стерильного ватно-марлевого или поролонового тампона; кровь в первые 3 дня заболевании (не менее чем от 10 животных) и через 3 нед от тех же животных (дли получения парных сывороток).
От животных, убитых с диагностической целью, берут кусочки легких, селезенки, слизистые оболочки носовой полости, трахеи, кишечника, регионарные лимфатические узлы.
Кусочки органов массой до 20 г помещают в стерильную посуду (пробирки или пенициллиновые флаконы с резиновыми пробками); ватно-марлевые тампоны (смывы) — во флаконы с раствором Хенкса или физиологическим раствором. Материал в термосе с охлаждающей смесью и сопроводительное письмо доставляют в лабоораторию с нарочным.
В лаборатории флаконы с тампонами встряхивают 2—3 мин, отжимают и удаляют, а содержимое флаконов центрифугируют. Надосадочную жидкость используют для выделения вируса, из осадка клеток делают мазки для РИФ.
Из кусочков органов убитого животного готовят мазки-отпечатки для РИФ и 10%-ную суспензию вируса для его выделения.
Лабораторная диагностика. Индикация вируса. В патологичсском материале ее проводят путем обнаружения вирусного антигена в серологических реакциях: РИФ, ИФА, РСК, РДП. Для этой цели в РИФ используют флуоресцирующие антитела (из диагностических наборов) к вирусам ПГ-3, ВД, ИРТ, PC, аденовирусам первой и второй подгрупп. Кроме того, для индикации аденовирусов иногда проводят обнаружение в мазках-отпечатках внутриядерных телец-включений, выявление которых имеет ориентированный характер.
Для обнаружения вирусной нуклеиновой кислоты в смывах и фекалиях используют ДНК-зонд, разрабатывают ПЦР.
Изоляция вируса. Выделение вирусов проводят в первично-трипсинизированных культурах клеток эмбрионов крупного рогатого скота (почки, легкие) и тестикул бычка. В последние годы чаще используют перевиваемые линии клеток (почки, легкие), довольно успешно выделяют вирусы на перевиваемой культуре клеток почки теленка (Т-1), а вирус диареи — на эпителии коронарных сосудов теленка (КСТ). Зараженные и контрольные культуры клеток инкубируют при 37 — 38°С до 7—14 дней, ежедневно просматривая под микроскопом для выявления цитопатического действия. Специфические изменения в клетках, зараженных аденовирусами, начинаются с периферии монослоя, который разрывается, клетки округляются и собираются в конгломераты, похожие на грозди винограда. Цитопатический эффект сопровождается образованием внутриядерных включений.
Изолят считают выделенным, если он вызывает стабильное, однотипичное ЦПД не менее чем в трех последовательных пассажах. В этом случае возможно его последовательное идентифицирование. При отсутствии ЦПД в трех пассажах проводят четвертый пассаж с попыткой выявления вируса в монослойной культуре клеток на покровных стеклышках методом РИФ. При отрицательной реакции выделение вирусов прекращают.
Выделение вирусов на естественно-восприимчивых лабораторных животных и на куриных эмбрионах не применяют.
Идентификация выделенного вируса. Ее проводят в серологических реакциях: РИФ, РСК, РДП, PH, РТГА. Чаще всего используют РИФ с двумя флуоресцирующими сыворотками, соответствующими двум подгруппам (первой и второй). Типирование аденовирусов осуществляют в научно-исследовательских учреждениях, имеющих типоспецифические сыворотки и вирусы 10 типов аденовирусов. Для этой цели используют PH, а если выделенный вирус обладает гемагглютинирующей активностью, ставят РТГА по общепринятым методам.
Ретроспективная диагностика. Ее проводят с целью обнаружения специфических антител в сыворотке крови переболевших животных в РНГА, ИФА, непрямой РИФ. РСК и РДП, используя парные сыворотки крови, взятые в первые 2—3 сут болезни и через 2—4 нед. Диагностическое значение имеют обнаружение 4-кратного и большего нарастания титра антител во второй сыворотке переболевшего животного и увеличение ееропозитивных проб.
Дифференциальная диагностика. На основании эпизоотологических, клинических данных и патологоанатомических изменений точный диагноз на аденовирусную инфекцию поставить трудно из-за сходства ее с парагриипом-3, вирусной диареей, инфекционным ринотрахеитом, респираторно-синтициальной инфекцией, хламидиозом и другими заболеваниями, поражающими респираторно-кишечный тракт животных. Кроме того, аденовирусная инфекция очень часто протекает в ассоциации с вышеназванными заболеваниями. Поэтому только лабораторные исследования, проводимые с использованием диагностических наборов к указанным болезням, помогут правильно поставить диагноз.
Иммунитет и специфическая профилактика. Вопросы иммунитета при аденовирусной инфекции изучены недостаточно. Это, очевидно, связано с множеством типов возбудителя и латентным течением самой инфекции у взрослых животных. Установлено, что переболевшие и вакцинированные телята приобретают иммунитет к заражению вирусом гомологического типа и вирусам, относящимся к аналогичной антигенной подгруппе. Пассивный иммунитет создают антитела молозива в пределах 2—2,5 мес. Высокой эффективностью обладают секреторные антитела слизистой оболочки респираторного тракта.
В нашей стране применяют инактивированную димерэтиленаэросил вакцину из штаммов двух подгрупп аденовирусов крупного рогатого скота, а также бивалентную вакцину, содержащую аденовирусы двух подгрупп и возбудитель пастереллеза. У вакцинированных коров титр антител в крови на достаточно высоком гриппе сохранялся в течение 6 мес после отела, у вакцинированных телят — более 4,5 мес.
Респираторно-синцитиальная инфекция крупного рогатого скота
[Respiratory Syncitial Virus Infectious]
Респираторно-синцитиальная инфекция характеризуется поражением респираторного тракта и кратковременной гиперемией его у КРС. В стадах КРС с респираторными заболеваниями ВНА к респираторно-синцитиальному вирусу (РСВ) выявляли чаще (41 %), чем к ПГ-3 (17 %). Вспышки респираторного заболевания КРС моложе 7 лет, вызванные РСВ, отмечались в хозяйствах Швейцарии, Бельгии, Японии и других странах.
Существует два типа синцитиальных вирусов КРС: 1) синцитиальный вирус, тесно связанный с клетками. Отличается серологически от РСВ КРС (BRSV); 2) BRSV выделен в ряде стран при респираторных вспышках болезни среди КРС. Впервые его выделили в 1969 г. в Бельгии Веллманс и Леннен из смывов верхних дыхательных путей больных телят (шт. V 220/69).
Клинические признаки и патологоанатомические изменения. Инфекцию регистрируют в любое время года, но наивысшая заболеваемость отмечается осенью и ранней зимой. Увеличение числа клинически больных животных наблюдают примерно через 30 дней после прибытия в хозяйство новой партии скота, о чем свидетельствует 4-кратный и более подъем титров AT. Симптомы РСБ проявляются слабо и могут быть не замечены. Если болезнь прогрессирует, наблюдают кашель, повышенное слюноотделение, серозное истечение из носа, учащенное дыхание, инфекция может протекать и как острая респираторная болезнь на фоне высокой температуры тела и диагностируется как эмфизема легких или интерстициальная пневмония. Болезнь длится от 3 до 10 дней и, как правило, заканчивается выздоровлением. В большинстве случаев процесс ограничивается повышением температуры, катаром верхних дыхательных путей и серозным ринитом. Тяжелую бронхопневмонию с высокой температурой (до 41,5 °С) наблюдают крайне редко. У молодняка болезнь, как правило, продолжается не более 3—5, у взрослых животных — 8—10 дней. Помимо того, РСВ вызывает пневмонии и аборты. В Великобритании описан падеж телят при острой пневмонии, вызванной РСВ. При гистологическом исследовании респираторных путей у погибших телят обычно выделяют гигантские синцитиальные клетки в бронхиолах, дегенерацию и некроз эпителиальных клеток бронхиол и легочной ткани, явления клеточной инфильтрации.
Респираторно-синцитиальный вирус крупного рогатого скота (РСВ КРС) наиболее часто связан с тяжелыми эпизоотиями PC-инфекции, особенно у телят первого года жизни. В патологии доминирующую роль играют факторы, связанные с иммунитетом. Возбудитель нарушает защитные механизмы респираторного тракта, что способствует вторичному заражению. Считается, что до 90 % бактериальных пневмоний развивается после первоначальной вирусной инфекции. Болезни наиболее подвержены телята 1—5-месячного возраста.
Классическим методом диагностики PC-инфекции у КРС является выделение возбудителя на культуре клеток. Для обнаружения РСВ КРС и специфических антител разработан метод ELISA. Кроме того, для выявления вируса разработана полиме-разная цепная реакция (ПЦР).
В распространении инфекции, по-видимому, важное место занимает прямой контакт, хотя предполагается и аэрозольный путь заражения. PC-инфекция КРС в большинстве регионов является эндемичной, заболеваемость достигает 80—100 %, а смертность — 5—10 %.
Морфология И Химический состав. Геном РСВ достаточно изучен. Вирус содержит 10 генов, которые транскрибируются с образованием 10 мРНК. Определены нуклео-тидные последовательности семи генов (N-P, P-M, M-SH, SH-G, G-F, F-M2 и М2—Z) РСВ КРС (шт. А 51908). Оказалось, что все стартовые последовательности РСВ человека и РСВ КРС совпадают, кроме гена SH, который отличается заменой одного нуклеотида от гена SH ЧРСВ А2 и гена Z, который у РСВ КРС на один нуклеотид короче, чем у ЧРСВ. С помощью монАТ выделена группа А и В с двумя подгруппами в каждой. Вирус отличается от других парамиксовирусов большим количеством идентифицированных структурных белков, порядком генов, присутствием ГА и N, а также диаметром нуклеокапсида (10-12 нм).
В структуре РСВ КРС идентифицировано 9 или 10 полипептидов, два из которых — G и F — гликозилированы и располагаются на поверхности вириона. Аминокислотная последовательность F-белка РСВ КРС (шт. 51908) оказалась гомологичной аминокислотной последовательности (81-99 %) F-белка РСВ человека. У РСВ белок F содержит основную долю эпитопа, индуцирующего ВНА. Белок F состоит из двух сУбъединиц и исполняет функцию слияния, белок G-прикрепительную функцию (Рецепторную). С помощью монАТ в структуре F-белка идентифицируют не менее 4- АГ детерминант, два из которых причастны к слиянию с клеточной мембраной. В белке слияния F РСВ КРС выявлено два АГ-участка, один из которых ответственен за нейтрализацию. Гликопротеины G и F ответственны за индукцию ВНА и образование протективного иммунитета. Внутренние вирионные АГ выявляются соответствующими монАТ. Изучена нуклеотидная последовательность генов неструктурных белков NS 1 и NS 2 РСВ (шт. А51 908). Оказалось, что ген NS 1 имеет длину 524 н, кодирует белок длиной 136 остатков и гомологичен генам NS 1 овечьего и человеческого вируса (подгрупп А и В) соответственно на 82, 67 и 65 % на нуклеотидном уровне и на 89, 69 и 68 % на аминокислотном уровне. Ген NS 2 имеет длину 489 н, кодирует белок из 124 остатков и гомологичен генам NS 2 овечьего и человеческого РСВ на нуклеотидном уровне и на 87, 84 и 84 % на аминокислотном уровне.
Вирус очень нестоек к замораживанию. Два шт. РСВ КРС (Bov и Bov-x) оказались чувствительны к низким значениям рН. При 4 °С он сохраняет активность в течение недели и при -70 °С до 2 месяцев. Температура 56 °С полностью разрушала его инфекционную активность в течение 30 мин. Вирус чувствителен к эфиру, хлороформу, дезоксихолату, трипсину.
Антигенная структура. РСВ не содержит нейраминидазы. Содержит два растворимых КСА—А и В. АГА, кроме того, индуцирует образование ВНА. Вирус также имеет структурный белок слияния — Fo белок. Определена последовательность аминокислот в белке Fo. Своеобразный ключ к расшифровке структурной организации РСВ — использование монАТ. С их помощью было показано, что гликопротеины F имеют решающее значение для формирования защитного иммунитета. Гены, кодирующие гликопротеины и F, клонированы и расшифрована их нуклеотидная последовательность. Выявлены и описаны полипептиды, нуклеотиды и компоненты РСВ, пригодные для изготовления диагностических реагентов — вакцин/против РСИ КРС. Выделенные полипептиды включают в себя короткие полипептиды, связанные с нейтрализующим эпитопом к эпитопам белка слияния РСВ или с нейтрализующими эпито-пами G-белка.
Благодаря применению монАТ были выявлены два подтипа РСВ, которые в антигенном отношении отличаются от подгрупп РСВ человека. Белки NP, М, Р и F, но не G, у РСВ КРС и РСВ человека имеют общие эпитопы. Среди изолятов РСВ КРС наибольшие варианты в мол. м. обнаружены у Р и F белков. Для типирования штаммов РСВ используют метод белкового профиля, основанный на определении электрофоретической подвижности Р-белка (фосфопротеина). Данным методом 75 штаммов разделены на две группы. У вирусов 1 группы, содержащей в качестве прототипа шт. Ланг, наблюдались минимальные вариации в подвижности Р белков. У вируса II группы, содержащей в качестве прототипа шт. СН 18537, Р белки негомогенны по подвижности. Указанные 1 и II группы белков соответствуют А и В подгруппам. Получено 5 монАТ к РСВ КРС, специфичность которых была изучена с помощью имму-ноблотинга и эпитопного анализа. Эти AT специфичны в отношении белка слияния РСВ, который имеет две антигенных участка, один из которых ответствен за нейтрализацию.
Антигенная вариабельность и родство. Установлено АГ-различие между некоторыми штаммами, выделенными от человека и обезьян. Все штаммы РСВ КРС родственны штаммам РСВЧ. Основные АГ-различия между РСВ человека и КРС выявлены в гликопротеине G. Белки слияния этих вирусов гомологичны на 83—84 %. Сыворотки крови морских свинок, привитых субъединицами РСВ человека и КРС, обладают хорошей перекрестной реактивностью и нейтрализует РСВ как человека, так и КРС. Определена генетическая вариабельность 32 изолятов РСВ подгруппы В, выделенных из одного сообщества в Японии за 20 лет — с 1980 по 1999 гг. Два вариабельных региона гена протеина прикрепления (G) были амплифицированы в RT-PCR, и продукты амплификации были прямо секвенированы. Филогенетический анализ нуклео-тидных последовательностей показал семь отдельных линий родства (ЛР). в которых изолированные в течение близких сезонов штаммы были локализованы: однако, изоляты из одного и того же сезона часто разделялись на множество отдельных ЛР. Для недавних изолятов имелась тенденция располагаться на конце каждой Л Р. Такие линейные эволюционные изменения были типично представлены в ЛР, содержащей 9 штаммов, изолированных в течение шести сезонов с 1980 по 1986 гг. Были подтверждены три типа использования стоп-кодонов, и изоляты, локализованные в каждой ЛР, использовали один и тот же стоп-кодом. Полученные данные позволяют предполагать, что коциркулирует множество линий дифференцировки подгруппы В, и каждый штамм может обладать линейным эволюционным генетическим дрейфом, что приводит к повторяющимся эпидемиям в одной и той популяции.
Локализация вируса изучена недостаточно. На 3—6-й день после инфицирования в мазках-отпечатках со слизистой оболочки носа методом ИФ обнаруживают специфический АГ, а при окраске их — гигантские клетки с включениями. РСВ КРС выделяли из конъюнктивально-назальных смывов, в культуре клеток ПЭК. Данных о локализации вируса, вирусемии и вирусовыделении у естественно больных животных нет. Возможно длительное вирусоносительство. Нередко вирус выделяют от новорожденных телят. Из организма больных животных во внешнюю среду вирус выделяется с носовым экссудатом и выдыхаемым воздухом.
Экспериментальная инфекция. При интраназальном заражении телят РСВ в дозе 7,5-107 БОЕ на 5-й день развивалось слезотечение, истечение из носа, учащенное дыхание, угнетение и лихорадка, а также выраженная ингибиция миграции лейкоцитов периферической крови. Ингибиция достигала максимума к 2—3-му дню после заражения. Мигрирующие клетки представляли собой полиморфноядерные лейкоциты периферической крови, которые чувствительны в реакции задержки миграции. У зараженных интраназально и интратрахеально телят в месячном возрасте через 3—5 дней вирусный АГ выявляли методом ИФ в цитоплазме зараженных клеток трахеи и бронхов, иногда в альвеолярных макрофагах и клетках, а также эпителиальных клетках носовой полости, носоглотки и бронхиол. Развившиеся у зараженных телят бронхиты и трахеиты характеризовались, помимо некроза, гиперплазией эпителиальных клеток, образованием клеточных синцитиев. Значительно реже наблюдали риниты, бронхиолиты и интерстициальную пневмонию. На 30-й день после заражения изменения исчезали. Таким образом, экспериментальная РСИ у телят сопровождается обратимыми изменениями эпителия респираторных путей и усилением фагоцитарной функции макрофагов.
Вирусный АГ выявляли в зараженных клетках бронхиол, вблизи клеточного детрита и просвета протока в эпителии трахеи. При внутрикожном введении появлялась местная реакция гиперчувствительности замедленного типа со второго дня с максимальным утолщением кожи между 2- и 3-м днем после заражения. У зараженных телят РСВ выделяют из слизистой оболочки носа, бронхов и легких. Трудность изоляции его объясняется присутствием секреторных AT. Наиболее чувствительной при изоляции РСВ оказалась культура клеток тестикул бычков. При заражении ягнят референтным шт. Номи и болгарским изолятом Антонова интратрахеально и внутривенно удавалось вызвать клинически выраженное заболевание. Кроме того, экспериментальную инфекцию сравнительно легко воспроизводят на обезьянах (шимпанзе, мартышка), хорьках, норках и морских свинках. Хорошей моделью для изучения РСИ оказались новорожденные хорьки. Вирус можно выделить из трахеи и носовых ходов в течение 7—10 дней. Симптомов болезни не отмечалось, но у хорьков наблюдалось повышение температуры тела. На хорьках удалось провести более 25 пассажей, причем титр вируса достигал 4,7—6,9 lg ИД50. Шт. ММК7, выделенный от коровы при вспышке болезни в Японии в 1968—1969 гг., серийно размножался в мозге однодневных мышей, хотя симптомов болезни у них не наблюдалось. В США выделен вирус (шт. FSJ-1), близкий, но не идентичный РСВ человека. Данный штамм широко распространен среди КРС в США.
Культивирование. РСВ КРС не размножается на КЭ, хорошо репродуцируется в первичных культурах клеток почки, тестикул, легких и селезенки КРС. Вновь изолируемые бычьи штаммы РСВ размножаются только в первичных культурах клеток почки, легких и тестикул эмбриона коров. Вирус обычно выделяют в течение 3—4 пассажей, так как в первых генерациях выраженных ЦПИ Не развивалось. Фибробласты эмбриона человека, обезьян, перевиваемые клетки KB, Hela, BHK-21 не чувствительны к бычьим штаммам РСВ. Последний культивировался в перевиваемых клетках почки КРС, клетках легкого и некоторых органов новорожденных телят. Он также хорошо культивировался в культуре перевиваемых клеток ^слизистой оболочки носа КРС (линия М-57) в однослойной статической культуре и на микроносителях в перевиваемой культуре MDBK, а также диплоидных клеточных культурах щитовидной железы ягненка. Для культивирования РСВ X. Харламбиев и другие использовали перевиваемые линии клеток почек и тестикулов телят, ягнят, хронически инфицированных вирусом лейкоза КРС. Флюоресцирующие клетки впервые становятся заметными в период между 16 и 18 ч и после заражения. Флюоресценция ограничивается цитоплазмой. Максимальный титр вируса 103—104 ТЦД so/мл выявляется на 6—7-й день после заражения. Добавление в питательную среду 2 % сыворотки КРС без специфических AT или 0,1 мг профлавина стимулирует развитие синцитиальных клеток, что способствует обнаружению ЦПД.
Респираторно-синцитиальный вирус не агглютинирует эритроциты КРС, овец, морских свинок, мышей.
Источники и пути передачи инфекции. Источник инфекции — больные животные. Инфекция передается воздушно-капельным путем. Считают, что естественная внутриутробная инфекция поддерживает циркуляцию в стаде РСВ. Нет данных о наличии его в сперме быков-производителей.
Среди КРС клинически болезнь бывает выражена у телят. Особенно чувствителен к нему КРС герефордской породы. В 9 западных штатах США в 42 % случаев с помощью РН обнаружены AT к РСВ у снежных баранов. Для проведения РН использовали шт. Mohanty A 51908, изолированный от КРС. РСВ удается заразить овец и белохвостых оленей. Экспрессированный в бакуловирусной системе очищенный белок нуклеокапсида (N) был использован в непрямом и сэндвич-ELISA для скринирова-ния 499 образцов сывороток КРС на наличие антител к РСВК. Выявленная с помощью непрямого ELISA серопозитивность составляла 46,09 %, в сэндвич-ELISA — 65,33 %. Стада из экзотических животных оказались более чувствительными к инфекции РСВК по сравнению с гибридными. Молодые животные были более уязвимы, чем более старые. Половых различий по этому признаку не обнаружено. Для серомо ниторинга инфекции РСВК предлагается использовать сэндвич-EL1SA как более чувствительный.
Иммунитет и специфическая профилактика. Иммунитет при РСБ не изучен. В нашей стране вакцины против этой инфекции нет. Инфекция у телят в возрасте 1—3 месяцев на фоне материнских AT не стимулирует образование гуморальных AT, хотя в слизистой оболочке дыхательных путей появляются IgA. Инфицирование таких телят сопровождается появлением в респираторном тракте противовирусных IgM, IgA, IgG. Ускоренная их продукция отмечается при повторном заражении. На поверхности эпителиальных клеток верхних дыхательных путей при РСБ идентифицированы AT всех трех типов, но преимущественно IgA. Нижние отделы респираторного тракта содержат большее количество IgG, чем носоглоточная область. Секреторные AT отличаются от сывороточных меньшей специфичностью, поскольку они способны нейтрализовать инфекционную активность гетерогенных штаммов в пределах подтипа. Однако не выявлено корреляции между уровнем вирусоспецифических IgA и приживляемостью вируса в носоглотке. Потенциальное значение специфических антител в защите легких от РСБ продемонстрировано в опытах на мышах. При реинфекции они способствуют более выраженной иммунной реакции. Подавление материнскими AT формирования сывороточных и секреторных AT затрудняет создание вакцины против РСБ. Наибольшей иммуногенностью и протективностью из 10 белковых АГ РСВ обладает белок слияния — гликопротеин А, за которым идет белок G.
В защите от РСБ важную роль играют клеточные механизмы, опосредованные специфическими AT и инфицированные вирусом. Моноциты лизируются свежими лимфоцитами этого же животного в присутствии иммунной сыворотки. Только РСВ и рекомбинантный вирусвакцины, экспрессирующий белок F РСВ, индуцирует образование вирусспецифических Т-лимфоцитов у мышей. Инактивированный РСВ или его гликопротеины F и G таким действием не обладают.
Главным АГ-мишенью для Т-лимфоцитов является F-белок и в меньшей степени белок G РСВ. Поэтому разрабатываемые вакцины для надежной защиты должны индуцировать у привитых животных формирование Т-клеточного иммунитета. Нуклео-протеид РСВ распознается лучше Т-клетками-эффекторами, чем поверхностный G гликопротеин. При РСБ имеет место AT зависимая клеточная цитотоксичность, в которой основной мишенью является А белок вируса, экспрессируемый на поверхности инфицированных клеток. Эта иммунологическая реакция играет важную роль в защите организма и его выздоровлении от РСБ.
В настоящее время клеточный иммунитет — предмет пристального изучения РСБ; разрабатываемые вакцины должны индуцировать у привитых животных формирование Т-клеточного иммунитета. Одним из перспективных направлений в вакцинной профилактике РСБ является создание субъединичной вакцины, содержащей один или оба вирусных гликопротеина. Весьма перспективным считают получение реком-бинантов вируса осповакцины для профилактики РСБ. В Нидерландах применяют живую вакцину из шт. Rispoval — она иммуногенна и безвредна. Разработана также живая комбинированная вакцина Rispoval — RS-BVD против РСБ и ВД-БС КРС. Вакцина безвредна в полевых условиях и сообщает надежный иммунитет против этих инфекций.
Во Франции применяют живую вакцину из шт. КВ94. В ФРГ предложена вакцина из аттенуированного штамма. В Бельгии аттенуированный штамм РСВ был получен путем проведения 94 пассажей в культуре клеток эмбриона КРС. На живую вакцину из шт. RS-52 у привитых телят через месяц образовывались ВНА, сохранявшиеся до 6 месяцев у 70—90 % Животных. Инактивированную вакцину против РСБ КРС удалось приготовить из инфицированных вирусом клеток, обработанных глютаральде-гидом. Продуцентом АГ РСВ являлась персистентно инфицированная культура эпителиальных клеток слизистой оболочки носа КРС. Эта вакцина оказалась более им-муногенной, чем живая из аттенуированного штамма РСВ КРС и TS-мутанта РСВ человека.
Белки Р-слияния,0-прикрепления и М-матрикса РСВ из концентрированного препарата экстрагировали мягкой обработкой детергентом и разделяли их методом хроматографии на колонке из гидроксимилапатита. Они безопасны и высокоимму-ногенны, эффективно защищают животных от заражения РСВ.
ВНА у привитых живой вакциной животных появляются на 5-й день и сохраняются после ревакцинации до 5 месяцев. Наличие AT почти не препятствует возникновению болезни. Видимо, велика роль местного иммунитета. Высокие титры ВНА (1:640) свидетельствовали о тяжести болезни. AT к РСВ, полученные от матерей, не предохраняют телят от инфекции.

Вирусная диарея крупного рогатого скота (болезнь слизистых оболочек, мукозальная болезнь, инфекционная диарея крупного рогатого скота, инфекционный энтерит крупного рогатого скота, диарея новорожденных телят) — контагиозная болезнь преимущественно молодых животных, характеризующаяся эрозивно-язвенным воспалением слизистых оболочек пищеварительного тракта.
Инфекционный ринотрахеит /
инфекционный пустулезный вульвовагинит

Острое контагиозное вирусное заболевание, характеризующаяся лихорадкой, катарально-некротическим воспалением слизистых оболочек верхних дыхательных путей, поражением глаз, половых органов (с признаками пустулёзного вульвовагинита), ЦНС, абортами.
Парагрипп-3

Парагрипп-3 (лат. — Paragrippus bovum; англ. — Parainfluenza-3-virus; транспортная лихорадка крупного рогатого скота, параинфлюэнца-3) — остро протекающая контагиозная болезнь, главным образом телят, характеризующаяся лихорадкой, катаральным воспалением верхних дыхательных путей, а в тяжелых случаях поражением легких.
Респираторно-синцитиальная инфекция
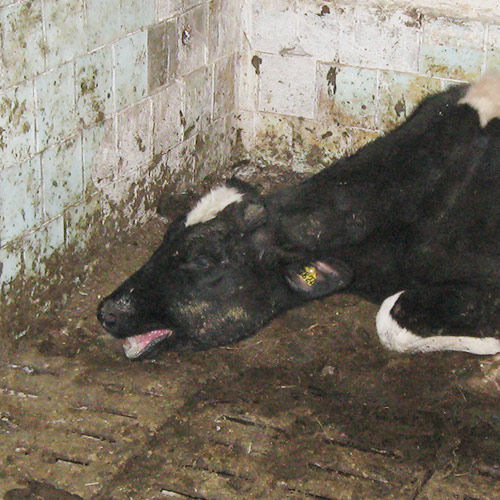
Контагиозная, остро протекающая болезнь, характеризующаяся лихорадкой, преимущественным поражением органов дыхания, потерей аппетита.
Ротавирусная инфекция
Остро протекающая, высококонтагиозная болезнь новорожденных телят, характеризующаяся профузным поносом, дегидратацией организма, развитием катарального или катарально-геморрагического гастроэнтерита и высокой летальностью.
Аденовирусная инфекция
Остро протекающее заболевание молодняка сельскохозяйственных животных, характеризующееся поражением органов дыхания, пищеварения, лимфоидной ткани, конъюнктивитами. Крупный рогатый скот часто является носителем латентных аденовирусов, вызывающих бессимптомные инфекции.
Коронавирусная инфекция
Пастереллёз
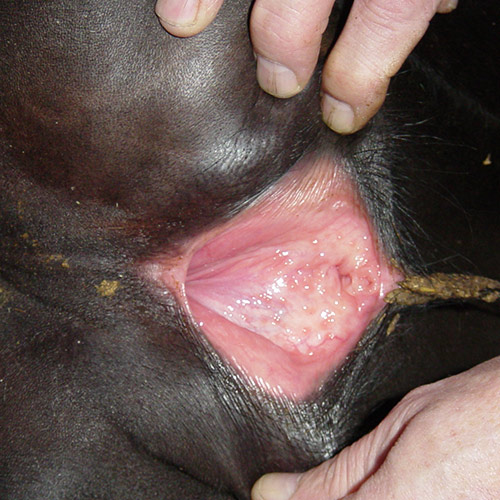
контагиозная инфекционная болезнь животных многих видов, характеризующаяся при остром течении септическими явлениями, крупозным воспалением легких, плевритом, отеками в различных областях тела, а при подостром и хроническом течениях гнойно-некротизирующей пневмонией, поражением глаз, суставов, молочной железы и геморрагическим энтеритом.
Эшерихиоз
Острое инфекционное заболевание с фекально-оральным механизмом передачи; характерно преимущественное поражение ЖКТ с развитием энтерита или энтероколита, в редких случаях - генерализованных форм с внекишечными проявлениями.
| Вирус | Таксономия | Тип НК | ГА св-ва | Основные пути передачи | Восприимчивые животные (резервуар) | Основные клинические формы и признаки | Внутриутробная инфекция |
|---|---|---|---|---|---|---|---|
| ИРТ/ИПВ | Сем. Herpesviridae, подсем. Alphaherpesvirinae, род Varicellovirus | ДНК | - Воздушно-капельно - Перорально - Со спермой - Трансплацентарно | КРС, козы, овцы, буйволы, верблюды, ламы, свиньи | - Ринит, бронхопневмония - Пустулезный вульвовагинит/ баланопостит, эндометрит - Конъюнктивит - Латентная/персистентная инфекция (вследствие инфицирования вирулентным штаммом или вакцинации живым вирусом) | Аборт плода в любой период стельности, чаще в последний триместр. Телята, инфицированные в поздние сроки стельности, рождаются мертвыми или погибают в первые дни жизни с признаками септицемии. | |
| ВД | Сем. Flaviviridae, род Pestivirus | РНК | - Воздушно-капельно - Перорально - Со спермой - Трансплацентарно - Контактно через предметы ухода) | КРС, буйволы, олени, косули | - Диарея - Ринит, бронхопневмония - Болезнь слизистых (вследствие суперинфицирования персистентно инфицированных животных): изъязвление и некроз слизистых, диарея, гибель - Персистентная инфекция | На 1-80 сут. стельности: аборты, мумификация, рассасывание плода На 80-125 сут. стельности: при инфицировании нецитопатогенным штаммом - рождение персистентно-инфицированных животных, цитопатогенным – патология развития или гибель плода После 125 сут. стельности: рождение клинически здоровых телят, наличие антител в сыворотке крови. | |
| ПГ-3 | Сем. Paramyxoviridae, подсем. Paramyxovirinae, род Respirovirus | РНК | - Воздушно-капельно - Перорально - Со спермой - Трансплацентарно | КРС, буйволы, лошади, овцы, козы, верблюды, собаки, крысы | - Ринит, бронхопневмония - Конъюнктивит | Аборты Рождение нежизнеспособных телят | |
| РС | Сем. Paramyxoviridae, подсем. Pneumovirinae, род Pneumovirus | РНК | - Воздушно-капельно - Со спермой - Трансплацентарно | КРС, овцы, козы | - Ринит, бронхопневмония | Аборты | |
| РВ | Сем. Reoviridae, род Rotavirus | РНК | - Перорально - Контактно | КРС, свиньи, овцы, лошади, кошки, собаки, дикие жвачные | - Диарея разной степени тяжести | ||
| КВ | Сем. Coronaviridae, род Betacoronavirus | РНК | - Перорально - Воздушно-капельно - Контактно | КРС, буйволы | - Острая диарея | ||
| АВ | Сем. Adenoviridae род Mastadenovirus | ДНК | - Перорально - Воздушно-капельно - Через конъюнктиву | КРС, чаще телята от 2 мес. до 4 мес. | - Пневмония, энтерит, конъюктивит |

КОМБОВАК-A
Вакцина инактивированная комбинированная против инфекционного ринотрахеита, парагриппа-3, вирусной диареи, респираторно-синцитиальной, рота-, коронавирусной болезней и аденовирусной инфекции крупного рогатого скота

КОМБОВАК
Вакцина инактивированная комбинированная против инфекционного ринотрахеита, парагриппа-3, вирусной диареи, респираторно- синцитиальной, рота- и коронавирусной болезней телят

КОМБОВАК-Р
Вакцина инактивированная комбинированная против инфекционного ринотрахеита, парагриппа-3, респираторно- синцитиальной болезни, вирусной диареи и пастереллеза телят

КОМБОВАК-К
Вакцина инактивированная комбинированная против вирусной диареи, рота-, коронавирусной болезней и эшерихиоза телят
| Антиген | Комбовак | Комбовак-Р | Комбовак-К | Комбовак-А |
|---|
| ИРТ / ИПВ |
| ВД |
| ПГ-3 |
| РС |
| РВ |
| КВ |
| АВ |
| Pasteurella multocida (серовары A, B, D) |
| Mannheimia haemolytica |
| E. coli (протективные антигены эшерихий, термостабильные и термолабильные энтеротоксины) |
- Высоко эффективны
- Полностью безопасны
- Можно применять племенным животным
- Безопасны для стельных
животных - Стабильны при хранении
- Колостральные антитела у телят
не снижают эффективность вакцинации - Изготовлены с использованием
современных адьювантов - Исключена реактивация латентных
вирусов и отсутствует иммуносупрессия
Вакцины КОМБОВАК и КОМБОВАК-А применяют по эпизоотическим показаниям для иммунизации взрослых животных и телят в хозяйствах, неблагополучных по респираторным и желудочно-кишечным,
а вакцину КОМБОВАК-Р преимущественно по респираторным болезням крупного рогатого скота.
Вакцинируют клинически здоровых животных.
В зависимости от принятой в хозяйстве технологии можно использовать наиболее удобную для предприятия схему вакцинации взрослого поголовья.
Коров и телок случного возраста прививают дважды: за 4 и 1 неделю до осеменения, а затем ревакцинируют перед отелом дважды:
- первый раз – за 50-60 суток до отела,
- второй раз – через 14-21 суток (не позднее 30 суток до отела.
Все поголовье животных старше года прививают каждые 6 месяцев двукратно с интервалом 14-21 суток.
Не рекомендуется вакцинировать животных за 3 недели до и после отела.
Независимо от применяемой схемы вакцинации взрослого поголовья телят вакцинируют в возрасте 7-10 суток и старше дважды с интервалом 20-25 суток.
Ревакцинацию проводят однократно в той же дозе в возрасте 6 месяцев.
Вакцину вводят в область шеи.
Вакцину КОМБОВАК-К применяют для иммунизации стельных коров и нетелей в хозяйствах, неблагополучных по желудочно-кишечным болезням новорожденных телят, с целью создания колострального иммунитета. Вакцинируют клинически здоровых животных.
Вакцину вводят в область шеи внутримышечно в дозе 3 см 3 .
Животных вакцинируют дважды: первый раз - за 40-50 суток до отела,
второй раз - через три недели после первой иммунизации.
- Применение вакцин
- Схема №1
- Схема №2
- Вакцинация телят
- Применение КОМБОВАК-К
Производственные испытания по оценке эффективности применения вакцины КОМБОВАК-А проводили в условиях хозяйства неблагополучного по основным вирусным заболеваниям телят, где было вакцинировано 376 стельных коров и 370 телят, полученных от вакцинированных животных, в качестве контроля использовали невакцинированных стельных коров (n=243) и телят (n=238), которых содержали в другом помещении.
Таким образом, применение вакцины КОМБОВАК-А в условиях неблагополучного хозяйства позволило снизить заболеваемость телят в 3 раза, а сохранность поголовья повысить в 3,1 раза, по сравнению с контрольной группой невакцинированных животных.
Читайте также:

