Валт вирус что это
Обновлено: 25.04.2024
Главная задача биологии — это развитие представлений у человека о живых организмах, о многообразии видов, обо всех закономерностях развития живых существ, а также об их взаимодействии с окружающей природой. Предмет основы безопасности жизнедеятельности (ОБЖ) позволяет получить знания и умения, которые помогут сохранить жизнь и здоровье в опасных ситуациях. Эти ситуации всегда возникают неожиданно, но, тем не менее, большинство из них предсказуемы и к ним можно подготовиться заранее. ОБЖ учит нас предвидеть возможные опасности и минимизировать потери от той или иной ситуации. Сегодня мы сталкиваемся с новым видом вирусной опасности COVID-19,о котором поговорим с точки зрения биологии и ОБЖ.
Что такое вирус?
Вирус — это неклеточный инфекционный агент. Сегодня нам известно около 6 тысяч различных вирусов, но их существует несколько миллионов. Вирусы не похожи друг на друга и могут иметь как форму сферы, спирали, так и форму сложного асимметричного сплетения. Размеры вирусов варьируются от 20 нм до 300 нм.
Как устроен вирус?
В центре агента находится генетический материал РНК или ДНК, вокруг которого располагается белковая структура — капсид.
Капсид служит для защиты вируса и помогает при захвате клетки. Некоторые вирусы дополнительно покрыты липидной оболочкой, т.е. жировой структурой, которая защищает их от изменений окружающей среды.
Вирусолог Дэвид Балтимор объединил все вирусы в 8 групп, из которых некоторые группы вирусов содержат 1-2 цепочки ДНК. Другие же содержат 1 цепочку РНК, которая может удваиваться или достраивать на своей матрице ДНК. При этом каждая группа вирусов производит себя в различных органеллах зараженной клетки.
Вирусы имеют определенный диапазон хозяев, т.е. он может быть опасен для одних видов и абсолютно безвреден для других. Например, оспой болеет только человек, а чумкой только некоторые виды плотоядных. Вирус не способен выжить сам по себе, поэтому активируется только в хозяйской клетке, используя ее ресурсы и питательные вещества. Цель вируса — создание множества копий себя, чтобы инфицировать другие клетки!
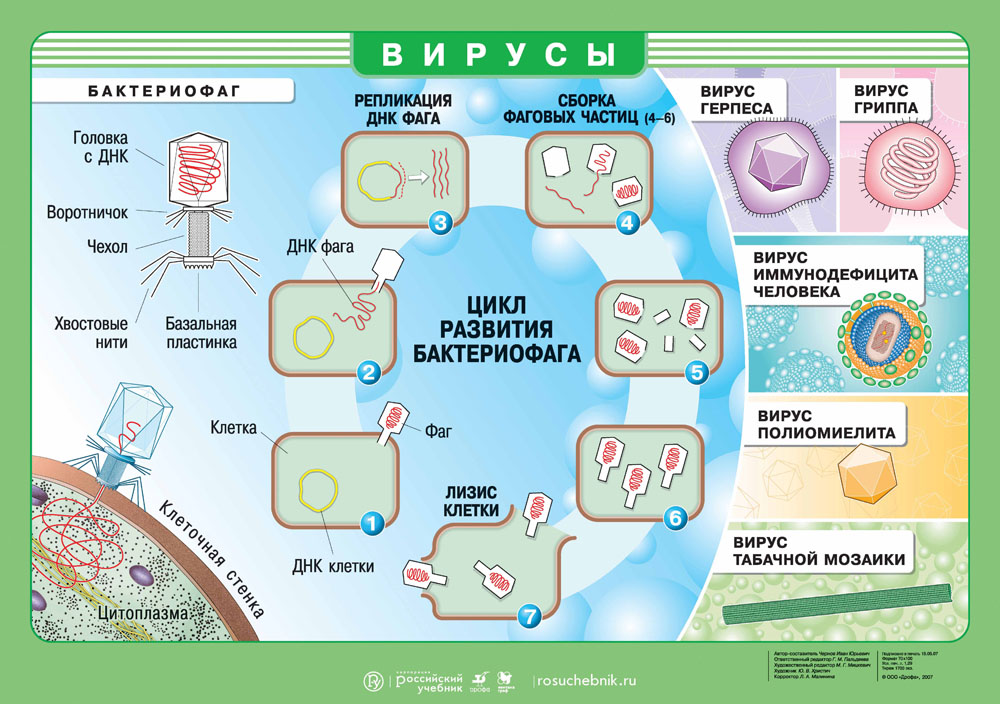
Как вирус попадает в организм?
- через физические повреждения (например, порезы на коже)
- путём направленного впрыскивания (к примеру, укус комара)
- направленного поражения отдельной поверхности (например, при вдыхании вируса через трахею)
- к эпителию слизистых оболочек (это например вирус гриппа)
- к нервной ткани (вирус простого герпеса)
- к иммунным клеткам (вирус иммунодефицита человека)

Геном вируса встраивается в одну из органелл или цитоплазму и превращает клетку в настоящий вирусный завод. Естественные процессы в клетке нарушаются, и она начинает заниматься производством и сбором белка вируса. Этот процесс называется репликацией. И его основная цель — это захват территории. Во время репликации генетический материал вируса смешивается с генами клетки хозяина — это приводит к активной мутации самого вируса, а также повышает его выживаемость. Когда процесс репликации налажен, вирусная частица отпочковывается и заражает уже новые клетки, в то время как инфицированная ранее клетка продолжает производство.
Выход вируса
Вирус создал множество собственных копий, клетка оказывается изнуренной из-за использования ее ресурсов. Больше вирусу клетка не нужна, поэтому клетка часто погибает и новорожденным вирусам приходится искать нового хозяина. Это и есть заключительная стадию жизненного цикла вируса.
Скорость распространения вирусной инфекции
Размножение вирусов протекает с исключительно высокой скоростью: при попадании в верхние дыхательные пути одной вирусной частицы уже через 8 часов количество инфекционного потомства достигает 10³, а концу первых суток − 10²³.
Вирусная латентность
Как вирус распространяется?
- воздушно-капельный (кашель, чихание)
- с кожи на кожу (при прикосновениях и рукопожатиях)
- с кожи на продукты (при прикосновениях к пище грязными руками вирусы могут попасть в пищеварительную и дыхательную системы)
- через жидкие среды организма (кровь, слюну и другие)
Почему с вирусами так тяжело бороться?
Сегодня людям уже удалось победить некоторые вирусы, а некоторые взять под жесткий контроль. Например, Оспа (она же черная оспа). Болезнь вызывается вирусом натуральной оспы, передается от человека к человеку воздушно-капельным путем. Больные покрываются сыпью, переходящей в язвы, как на коже, так и на слизистых внутренних органов. Смертность, в зависимости от штамма вируса, составляет от 10 до 40 (иногда даже 70%), На сегодняшний день вирус полностью истреблен человечеством.
Кроме того, взяты под контроль такие заболевания, как бешенство, корь и полиомиелит. Но помимо этих вирусов существует масса других, которые требуют разработок или открытия новых вакцин.
Коронавирус
Виновником эпидемии, распространяющейся сегодня по миру, стал коронавирус, вирусная частица в 0,1 микрона. Свое название он получил благодаря наростам на своей структуре, своеобразным шипам. Внутри вируса спрятан яд, с помощью которого он подчиняет себе зараженный организм. Этот вирус воздействует не только на человека, но и на птиц, свиней, собак и летучих мышей. В настоящий момент выделяют от 30 до 39 разновидностей коронавирусной инфекции. Но для человека патогенно всего 6. И как любой другой вирус COVID-19 мутирует.

К наиболее распространенным симптомам COVID-19 относятся повышение температуры тела, сухой кашель и утомляемость. К более редким симптомам относятся боли в суставах и мышцах, заложенность носа, головная боль, конъюнктивит, боль в горле, диарея, потеря вкусовых ощущений или обоняния, сыпь и изменение цвета кожи на пальцах рук и ног. Как правило, эти симптомы развиваются постепенно и носят слабо выраженный характер. У некоторых инфицированных лиц болезнь сопровождается очень легкими симптомами.
Сколько же может жить этот вирус вне организма? Все зависит от типа вируса и от той поверхности, на которую вирусы попали. В качестве примера было рассмотрено 3 вируса, по которым велись исследования. Изучали время, на которое может задерживаться вирус на различных поверхностях. Данные приведены в таблице.

Поскольку пока не изобретено вакцины от COVID-19, в целях защиты от инфекции самым важным для нас является соблюдение гигиены.
Гигиена — раздел медицины, изучающий влияние жизни и труда на здоровье человека и разрабатывающая меры (санитарные нормы и правила), направленные на предупреждение заболеваний, обеспечение оптимальных условий существования, укрепление здоровья и продление жизни.
Сегодня следует соблюдать определенные правила гигиены:
- Соблюдение режима труда и отдыха, не допускающего развития утомления и переутомления.
- Выполнение условий, обеспечивающих здоровый и полноценный сон (свежий воздух, отсутствие шума, удобная постель, оптимальная продолжительность).
- Правильное здоровое питание в соответствии с потребностями организма.
- Комфортный микроклимат в жилище (температура, влажность и подвижность воздуха, естественная и искусственная освещенность помещений).
- Содержание в чистоте тела и тщательный уход за зубами.
- Спокойное и корректное поведение в конфликтных ситуациях.

Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Вирус папилломы человека: причины появления, симптомы, диагностика и способы лечения.
Определение
Вирусы папилломы человека (ВПЧ) — это группа чрезвычайно распространенных и генетически разнородных ДНК-содержащих вирусов, поражающих эпителий кожных покровов и слизистых оболочек. Вирус папилломы человека относится к семейству папилломавирусов. Было выявлено и описано более 190 типов ВПЧ. Каждый тип отличается более чем на 10% от ближайшего родственного штамма. Из их числа более 30 типов ВПЧ могут инфицировать эпителиальный слой урогенитального тракта. В зависимости от онкогенного потенциала выделяют вирусы высокого (типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59) и низкого (типы 6, 11, 42, 43, 44) онкогенного риска.
На долю двух высокоонкогенных типов ВПЧ (16 и 18) приходится до 70% случаев рака шейки матки, 80% рака вульвы и влагалища, 92% анального рака, 95% рака ротовой полости, 89% рака ротоглотки, 63% рака полового члена.
При этом 16-й тип имеет самый высокий канцерогенный потенциал. Генотипы ВПЧ 6 и 11 вызывают практически все виды аногенитальных бородавок и большинство случаев рецидивирующего респираторного папилломатоза, который наблюдается в основном у детей младше 5 лет или у лиц 20-30 лет.
Причины появления ВПЧ
Заболевания, вызванные вирусом папилломы человека (ВПЧ), относятся к болезням с латентным началом, хроническим персистирующим течением и проявляются доброкачественными и злокачественными новообразованиями в зоне входных ворот инфекции.
Источником возбудителя инфекции является больной человек или носитель. ВПЧ передается от человека к человеку при оральном, генитальном и анальном половых контактах, а также контактно-бытовым и вертикальным (от матери к ребенку) путями.
Вирус папилломы человека — единственный вирус, который не проникает в кровь, вследствие чего инфекционный процесс протекает без развития воспалительной реакции. В процессе инфицирования вирус папилломы человека поражает незрелые клетки, чаще базального слоя, которые затем становятся постоянным источником инфицирования эпителиальных клеток. Инфицированию способствует наличие микротравм и воспалительных процессов кожи и слизистых оболочек, приводящих к снижению местного иммунитета.
Вирус способен персистировать (хронически присутствовать) в месте проникновения как угодно долго. Инкубационный период заболевания может длиться от нескольких месяцев до нескольких лет. Среднее время между инфицированием ВПЧ и развитием аногенитальных бородавок составляет от 3 месяцев у женщин и до 11 месяцев у мужчин. Инфицирование человека может происходить как одним, так и несколькими типами ВПЧ.
Интервал между инфицированием ВПЧ и прогрессированием до инвазивного рака составляет, как правило, 10 лет или более.
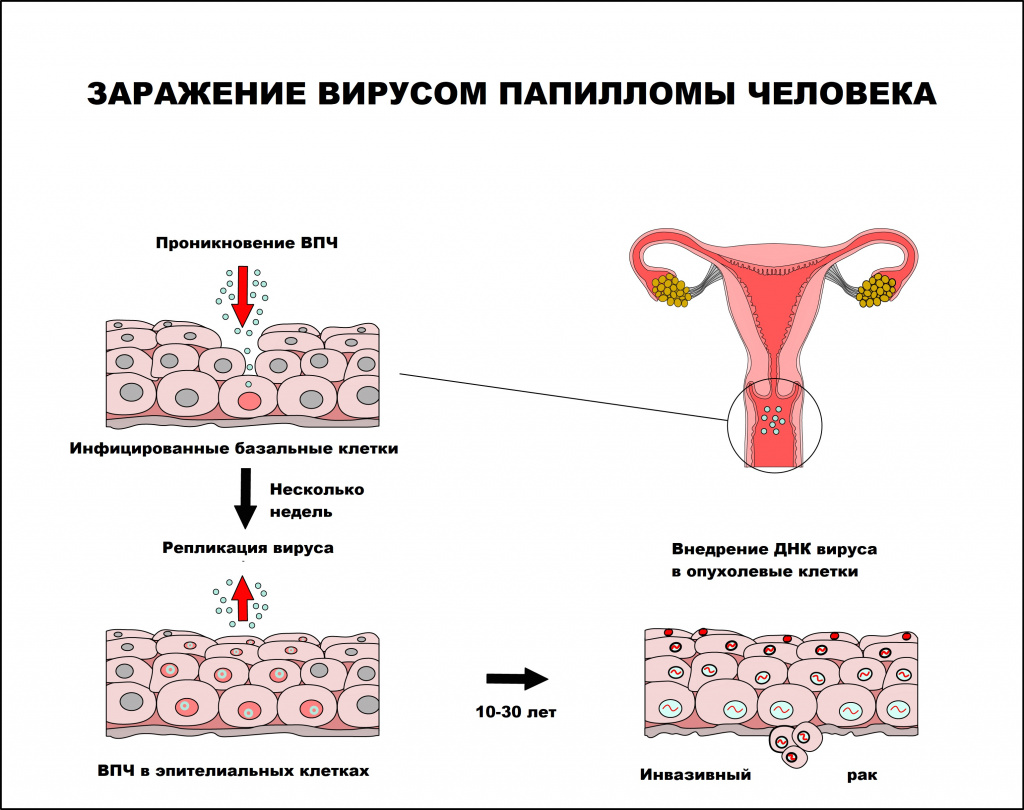
Папилломавирусная инфекция чаще регистрируется у лиц молодого возраста, имеющих большое число половых партнеров. По данным ВОЗ, 50-80% населения инфицировано ВПЧ, но лишь 5-10% инфицированных лиц имеют клинические проявления заболевания.
Классификация заболевания
Общепринятой классификации аногенитальных (венерических) бородавок не существует. Однако выделяют несколько их клинических разновидностей:
- остроконечные кондиломы;
- бородавки в виде папул;
- поражения в виде пятен;
- внутриэпителиальная неоплазия;
- бовеноидный папулез и болезнь Боуэна;
- гигантская кондилома Бушке-Левенштайна (карциномоподобная остроконечная кондилома).
Симптомы ВПЧ
- наличие одиночных или множественных образований в виде папул, папиллом, пятен на кожных покровах и слизистых оболочках половых органов;
- зуд и парестезии (расстройство чувствительности) в области поражения; болезненность во время половых контактов (диспареуния);
- при локализации высыпаний в области уретры наблюдается зуд, жжение, болезненность при мочеиспускании (дизурия); при обширных поражениях в области уретры – затрудненное мочеиспускание;
- болезненные трещины и кровоточивость кожных покровов и слизистых оболочек в местах поражения.
Бородавки в виде папул – папулезные высыпания без пальцеобразных выпячиваний, локализующиеся на кератинизированном эпителии половых органов.
Поражения в виде пятен – серовато-белые, розовато-красные или красновато-коричневые пятна на коже и/или слизистой оболочке половых органов;
Бовеноидный папулез и болезнь Боуэна – папулы и пятна с гладкой или бархатистой поверхностью; цвет элементов в местах поражения слизистой оболочки – бурый или оранжево-красный, а поражений на коже – пепельно-серый или коричневато-черный.
Гигантская кондилома Бушке-Левенштайна – мелкие бородавчатоподобные папилломы, сливающиеся между собой и образующие очаг поражения с широким основанием.
Респираторный папилломатоз – заболевание, при котором папилломы формируются в дыхательных путях, ведущих от носа и полости рта в легкие.
Диагностика ВПЧ
Латентно протекающая инфекция диагностируется только с помощью молекулярно-биологических методов исследования. Субклиническая инфекция диагностируется при молекулярно-биологическом, кольпоскопическом, цитологическом и морфологическом исследовании.
Для улучшения визуализации аногенитальных бородавок может быть проведена проба с 3-5% раствором уксусной кислоты. Тест считается отрицательным, если после обработки уксусной кислотой на поверхности шейки матки нет белых участков. И положительным при выявлении на шейке матки участков белого цвета (ацетобелых участков), отличных от остальной поверхности шейки матки.
Изменения эпителия шейки матки, вызванные ВПЧ, могут быть выявлены цитологическим методом микроскопии слущенных клеток с окраской по Папаниколау (Пап-тест).
Метод окрашивания по Папаниколау - специально разработанный метод, позволяющий с наибольшей степенью достоверности выявить ранние предраковые заболевания шейки матки. Рак шейки матки в структуре злокачественных новообразований репродуктивной системы занимает третье место. До 1992 г. заб.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Вирус Эпштейна–Барр: причины появления, симптомы, диагностика и способы лечения.
Вирус Эпштейна–Барр может инфицировать различные типы клеток, включая B-клетки иммунной системы (разновидность лейкоцитов – белых кровяных телец) и эпителиальные клетки слизистых оболочек.
ВЭБ является представителем ДНК-содержащих вирусов из семейства Herpesviridae (герпесвирусы), подсемейства гамма-герпесвирусов и рода лимфокриптовирусов. В процессе репликации (самокопирования) вируса экспрессируется свыше 70 различных вирусспецифических белков. В настоящее время выделены группы иммуногенных белков, определение антител к которым дает возможность дифференцировать стадию инфекции (ЕА – ранний антиген, ЕВNА-1 — ядерный антиген, VCA — капсидный антиген, LMP — латентный мембранный белок).
Другой способ заражения – контактно-бытовой (вирус передается через зубные щетки, столовые приборы, полотенца и т.д.). ВЭБ также может распространяться через кровь и сперму.
ВЭБ размножается в В-лимфоцитах и эпителиальных клетках, в связи с чем характерно многообразие клинических проявлений данной патологии. Важной отличительной чертой вируса является то, что он не тормозит и не нарушает размножение В-лимфоцитов, а, наоборот, стимулирует его. В этом заключается особенность возбудителя - он размножается в клетках иммунной системы, заставляя их клонировать свою, вирусную, ДНК.
Хронический воспалительный процесс, вызванный ВЭБ, приводит к структурным и метаболическим нарушениям пораженных тканей, что является причиной возникновения разнообразной соматической патологии.
Классификация вируса Эпштейна-Барр
Единой классификации вирусной инфекции Эпштейна-Барр (ВИЭБ) не существует, к использованию в практической медицине предлагается следующая:
- по времени инфицирования – врожденная и приобретенная;
- по форме заболевания – типичная (инфекционный мононуклеоз) и атипичная: стертая, асимптомная, с поражением внутренних органов;
- по тяжести течения – легкая, средней степени и тяжелая;
- по продолжительности течения – острая, затяжная, хроническая;
- по фазе активности – активная и неактивная;
- смешанная инфекция – чаще всего наблюдается в сочетании с цитомегаловирусом.
- Инфекционный мононуклеоз (железистая лихорадка, болезнь Филатова) – распространенное инфекционное заболевание, основными проявлениями которого является подъем температуры до высоких значений, увеличение лимфатических узлов, воспаление слизистой оболочки глотки, увеличение печени и селезенки. ВЭБ в данном случае проникает через эпителий слизистых оболочек верхних дыхательных путей.
- Лимфогранулематоз (болезнь Ходжкина) и некоторые виды неходжкинских лимфом – группа заболеваний, объединенных злокачественной моноклональной пролиферацией лимфоидных клеток в лимфоузлах, костном мозге, селезенке, печени и желудочно-кишечном тракте.
- Синдром хронической усталости – состояние, характеризующееся длительным чувством усталости, которое не проходит после продолжительного отдыха.
- Синдром Алисы в стране чудес – состояние, клиническим проявлением которого является нарушение ощущения своего тела и отдельных его частей. Человек ощущает себя или части своего тела очень большими или очень маленькими по сравнению с действительностью.
- Гепатит, спровоцированный ВЭБ, часто является осложнением инфекционного мононуклеоза. Появляется слабость, тошнота, желтушность кожи и слизистых, увеличивается печень.
- Герпетическая инфекция в виде генитального или лабиального (на губах) поражения. Также возможен стоматит, вызванный ВЭБ. При активации инфекции появляется чувство жжения и боль, а затем множество маленьких пузырьков.
- Посттрансплантационная лимфопролиферативная болезнь – вторичное злокачественное заболевание, развивающееся после трансплантации гемопоэтических стволовых клеток (метод лечения, применяемый при онкологии, заболеваниях крови и др.), ассоциированное с ВЭБ-инфекцией.
- Рассеянный склероз – хроническое аутоиммунное заболевание, при котором поражается миелиновая оболочка нервных волокон головного и спинного мозга. Характеризуется большим количеством симптомов и зависит от уровня поражения: часто снижается мышечная сила, угасают рефлексы, появляются параличи (обездвиженность) различных локализаций.
- Волосатая лейкоплакия – на слизистой оболочке языка по бокам, на спинке либо на его нижней части появляются белые участки с шероховатой поверхностью. Они безболезненны и не причиняют существенного дискомфорта. Основная опасность заключается в возможности озлокачествления измененных клеток слизистой.
- Назофарингеальная карцинома – злокачественное образование глотки. Среди его симптомов часто встречаются заложенность носа, потеря слуха, частые отиты, появление крови в слюне, кровянистые выделения из носа, увеличение лимфоузлов, головные боли.
- Аутоиммунный тиреоидит – хроническое заболевание щитовидной железы, при котором в организме образуются антитела к тканям щитовидной железы. При данном заболевании возможно появление зоба (увеличение щитовидной железы), развитие симптомов гипотиреоза: отеки, повышенная утомляемость, сонливость, запоры, сухость кожи, выпадение волос.
Лабораторное обследование включает:
-
вирус Эпштейна–Барр, определение ДНК в крови (Epstein Barr virus, DNA);
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Цитомегаловирус: причины появления, симптомы, диагностика и способы лечения.
Определение
Цитомегаловирус (ЦМВ, или цитомегаловирусная болезнь) – хроническое инфекционное заболевание вирусной этиологии, характеризующееся многообразием клинических форм и проявлений - от бессимптомного течения до тяжелого поражения внутренних органов и центральной нервной системы. Возбудитель ЦМВ – представитель семейства герпесвирусов (вирус герпеса человека 5-го типа).
Попадая в клетки организма, цитомегаловирус способен оставаться в них пожизненно. У лиц с нормально функционирующей иммунной системой в подавляющем большинстве случаев инфекция протекает по типу вирусоносительства. При угнетении иммунитета вирус активизируется, вызывая клинические симптомы болезни.
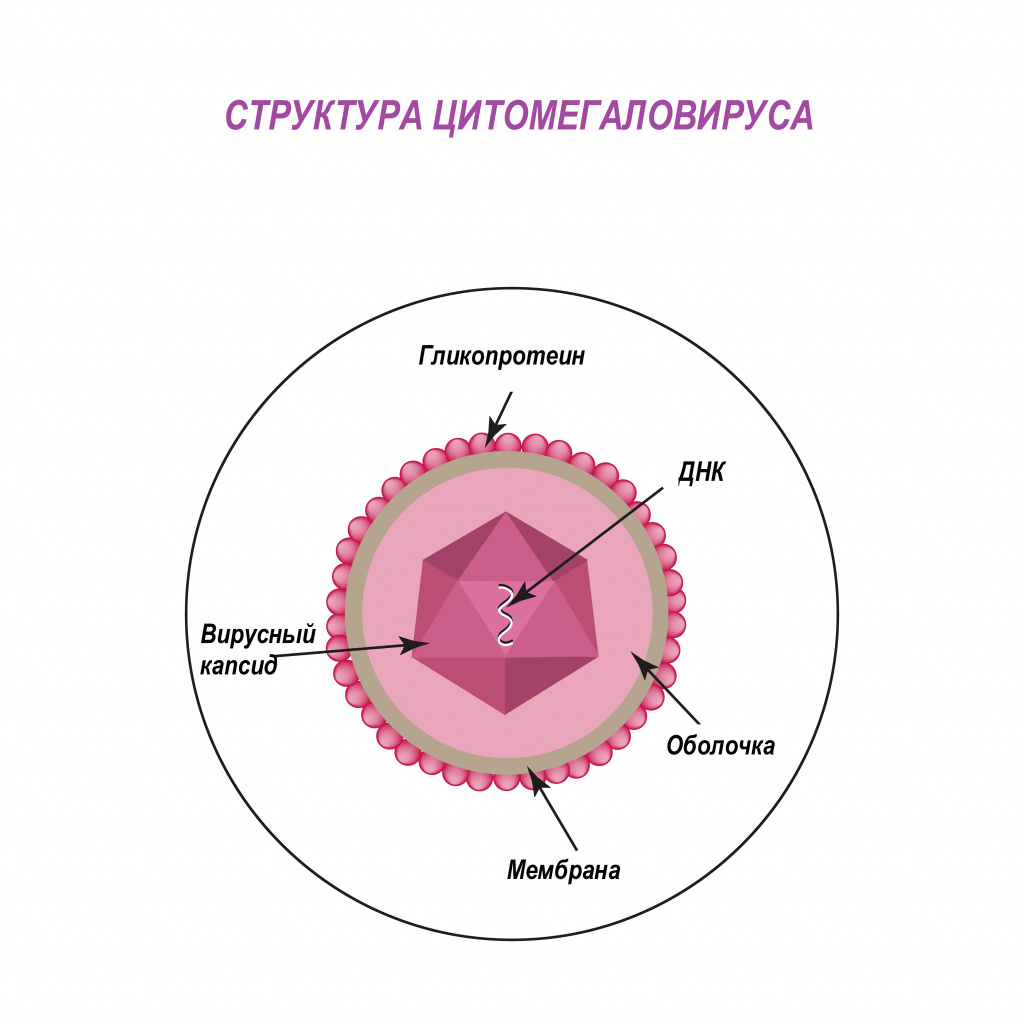
По различным данным доля носителей цитомегаловируса в России составляет порядка 73-90% - то есть именно у такого количества людей выявляются антитела к ЦМВ.
Причины появления цитомегаловирусной болезни
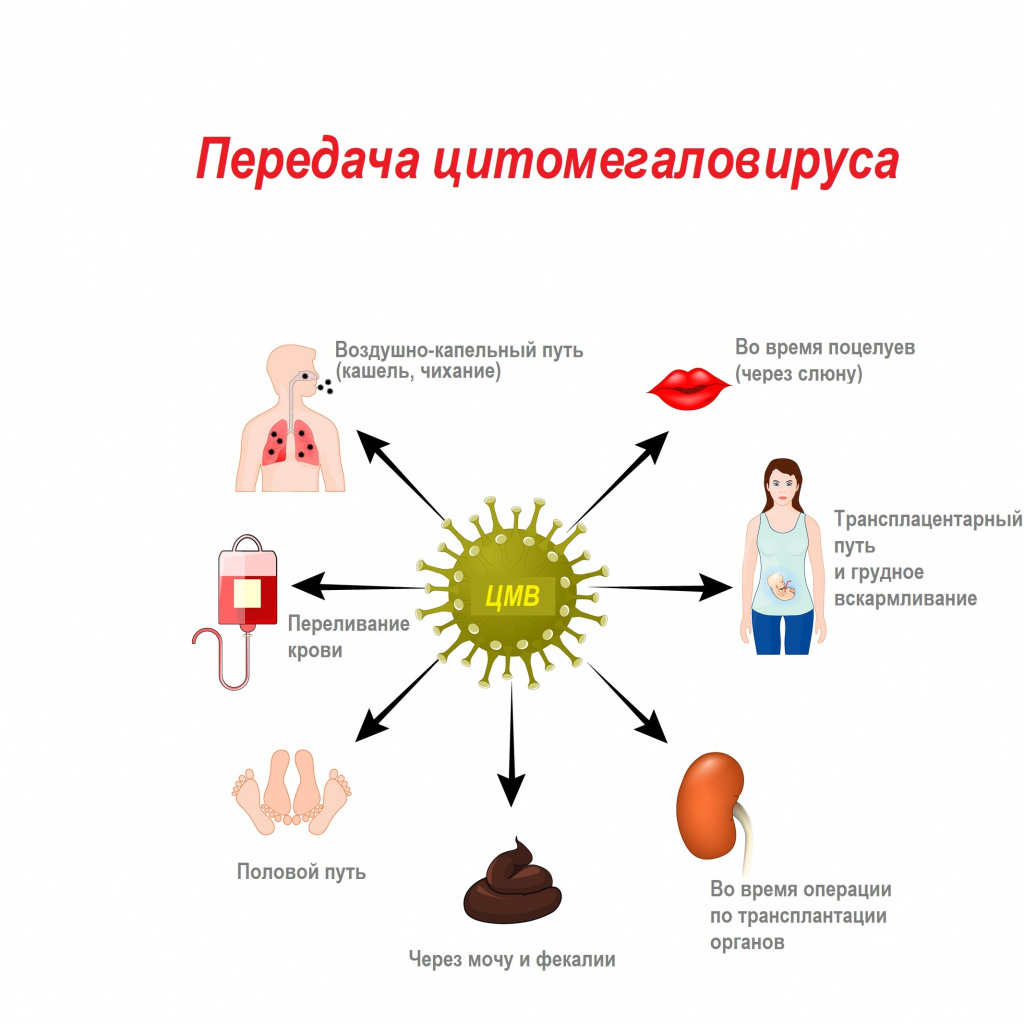
Цитомегаловирус передается через биологические жидкости: слюну, мочу, кровь, вагинальный секрет, слезы, сперму, фекалии, грудное молоко.
Из-за лабильности возбудителя и низкой концентрации вируса в выделениях для передачи инфекции необходим длительный, частый и тесный контакт с носителем.
Механизмы передачи вируса — воздушно-капельный (аэрозольный путь), контактный (контактно-бытовой и половой), гемоконтактный (парентеральный, а также при пересадке органов), вертикальный (от матери к плоду), фекально-оральный (алиментарный — через грудное молоко).
Заражение плода реализуется за счет трансплацентарной передачи от матери к плоду, которая возможна в течение всей беременности. Наибольшую опасность для плода представляет первичная инфекция на ранних сроках беременности, поскольку часто вызывает формирование врожденных пороков развития.
Особое свойство ЦМВ — способность вызывать депрессию практически всех звеньев иммунитета, резко угнетать продукцию интерферонов, в первую очередь ИНФ-α. При острой инфекции вирус поражает преимущественно эпителиальные клетки легких, печени, кишечника, почек, мочевого пузыря, молочных и слюнных желез, генитального тракта. Цитомегаловирус может инфицировать нервные клетки, клетки гладкой мускулатуры, костного мозга.
Классификация заболевания
По характеру инфицирования:
- врожденное (внутриутробное),
- постнатальное (приобретенное).
- латентная инфекция,
- персистирующая инфекция,
- активная (низкой, средней, высокой степени тяжести) инфекция.
- острая инфекция,
- реактивация вируса,
- реинфекция.
Инкубационный период цитомегаловирусной болезни составляет от 15 дней до трех месяцев (при манифестной, выраженной форме заболевания). Однако чаще первичное инфицирование протекает или бессимптомно, или по типу легкой формы ОРЗ – у пациента наблюдаются незначительная слабость, лихорадка (температура 37,1-38,0°С), дискомфорт в мышцах, першение в горле, иногда насморк, увеличение шейных лимфатических узлов, болезненность слюнных желез, головная боль, отсутствие аппетита.
У беременных острая первичная инфекция протекает, как правило, бессимптомно (25–50%) или с неспецифическими проявлениями (с лихорадкой, астенией и головной болью).
В редких случаях развиваются гепато- и спленомегалия, гепатит с минимальной степенью активности цитолитического синдрома, дерматиты, васкулиты, интерстициальный пневмонический процесс, тромбоцитоз или тромбоцитопения, лимфоцитоз.
У больных с иммунодефицитом цитомегаловирусная инфекция протекает тяжело - вирус быстро распространяется по организму и вызывает серьезные осложнения.
Диагностика цитомегаловируса
Диагностические мероприятия начинаются со сбора жалоб и анамнеза, в том числе акушерско-гинекологического анамнеза матери.
Затем врач проводит объективное обследование (физикальное, неврологическое и антропометрическое).
Лабораторные исследования - общие и специфические:
-
общий анализ крови;
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Синонимы: Анализ крови на антитела к цитомегаловирусу; АТ-ЦМВ-IgМ; цитомегаловирусная инфекция; ЦМВ-инфекция; специфические иммуноглобулины класса М к цитомегаловирусу. Cytomegalovirus; CMV Antibody; IgM; CMV infection; CMV-specific IgM. Краткое описание исследования Anti-CMV.
Синонимы: Анализ крови на антитела к цитомегаловирусу; АТ-ЦМВ-IgG; Цитомегаловирусная инфекция; ЦМВ-инфекция; Специфические иммуноглобулины класса G к цитомегаловирусу. Cytomegalovirus; CMV Antibody, IgG; CMV infection; CMV-specific IgG. Краткое описание исследования Anti-CMV-IgG .
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирусная инфекция входит в группу репродуктивно значимых инфекций, обозначаемых как TORCH-комплекс (название образовано начальными буквами в латинских наименованиях - Toxoplasma, Rubella, Cytomegalovirus, Herpes); первичное инфицирование данными возбудителями, либо обострение .
К каким врачам обращаться
С первичными жалобами пациенты обращаются к врачу-терапевту или врачу общей практики (семейному врачу), детей ведет врач-педиатр . Могут потребоваться консультации инфекциониста - для верификации диагноза, стоматолога - при поражениях слизистой оболочки рта, кардиолога - при наличии врожденного порока сердца, нейрохирурга - при пороках центральной нервной системы, невропатолога - для оценки неврологической патологии, гематолога - при выраженных гематологических изменениях и геморрагическом синдроме, окулиста - для исследования глазного дна, отоларинголога - для исследования слухового аппарата.
Лечение цитомегаловирусной болезни
Субклинические формы ЦМВ-инфекции и латентное носительство крайне распространены, поэтому в большинстве случаев не требуют специфической терапии даже при выявлении антител. Их лечение направлено на усиление защитных сил организма при помощи иммуномодуляторов и профилактику факторов риска, которые приводят к обострению заболевания.
Для терапии клинически активных форм инфекции применяют:
- комплекс патогенетической (противовирусной) терапии, который разрабатывается профильными специалистами и включает препараты прямого противовирусного действия для минимизации риска осложнений, сокращения времени течения заболевания, а также профилактики рецидивов;
- иммунотерапию – антицитомегаловирусный иммуноглобулин назначают преимущественно детям при манифестных формах заболевания и беременным;
- дезинтоксикационную терапию, которая направлена на купирование синдрома интоксикации;
- метаболическую терапию - для восстановления обмена веществ в организме;
- симптоматическую терапию - для купирования воспалительных и токсических проявлений заболевания.
Проблема клинически выраженной инфекции актуальна для лиц, имеющих иммуносупрессию иной природы, в частности, онкогематологических пациентов, больных лучевой болезнью, лиц, длительно принимающих кортикостероидную, туберкулостатическую терапию, а также перенесших ожоговую травму.
Острое течение ЦМВ может привести к развитию гепатита с повышением уровня аминотрансфераз и атипичным лимфоцитозом.
Ученые предполагают роль цитомегаловируса как одного из кофакторов в развитии системных васкулитов, хронических диссеминированных заболеваний легких (в частности, фиброзирующего альвеолита), криоглобулинемии, опухолевых процессов (аденокарциномы предстательной железы, аденокарциномы толстой кишки, рака шейки матки), атеросклероза, кардиомиопатии, детского церебрального паралича, эпилепсии, синдрома Гийена-Барре, синдрома хронической усталости, аутизма.
Первичное инфицирование цитомагаловирусом у беременных женщин существенно повышает риск преждевременных родов, самопроизвольного выкидыша, многоводия, замершей беременности, внутриутробного инфицирования и даже гибели плода. Врожденная ЦМВ-инфекция может стать триггерным фактором развития тяжелых генерализованных форм и инвалидизирующих исходов заболевания, таких как потеря слуха, зрения, умственная отсталость, микроцефалия, судорожный синдром и пр. Такие пожизненные проблемы со здоровьем развиваются примерно у каждого пятого ребенка с врожденной цитомегаловирусной инфекцией.
Профилактика цитомегаловирусной болезни
Женщинам, планирующим беременность, необходимо пройти обследование на наличие ЦМВ. При обнаружении вируса важно получить консультацию врача-иммунолога.
Профилактика или превентивное лечение (активный мониторинг пациентов по уровню вирусной нагрузки и назначение противовирусных препаратов пациентам с признаками инфекции) являются эффективными способами предотвращения развития цитомегаловирусной инфекции после трансплантации органов.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Респираторно-синцитиальная вирусная инфекция (РСВИ) занимает важное место в патологии органов дыхания, как у детей, так и у взрослых. Респираторно-синцитиальный вирус (РСВ) - наиболее частая причина поражения Нижних дыхательных путей (НДП) у детей раннего возраста, причем заболевание может привести к летальному исходу. У детей старшего возраста и взрослых РСВ вызывает более легкое поражение респираторного тракта, проявляющееся ринофарингитом, бронхитом, включая обострение хронического бронхита, пневмонией.
Этиология и эпидемиология
РСВ входит в состав семейства Paramyxoviridae, являясь представителем рода Pneumovirus. Свое название вирус получил в результате характерного цитопатического действия в культуре клеток, ведущего к образованию синцития и симпластов. РСВ не содержит гемагглютинина и нейраминидазы.
РСВИ является, по существу, эндемичной, и в отдельные периоды происходит подъем заболеваемости. Вспышки наблюдаются в различное время года, чаще осенью и зимой. Подъем заболеваемости РСВИ нередко совпадает с эпидемией гриппа, и тогда у детей можно диагностировать микст-инфекцию. Как и грипп, РСВИ увеличивает количество осложнений и летальность от гриппа и пневмонии.
Продолжительность эпидемического подъема заболеваемости ограничивается 3-5 месяцами. Такие вспышки, как правило, имеют место ежегодно в одной и той же местности. В это время РСВ вызывает не только бронхиолиты и пневмонии, но также и легкие заболевания верхних дыхательных путей (ВДП) у детей. Вспышки РСВИ могут протекать в виде ограниченных локальных эпидемий в учреждениях для детей раннего возраста.
Источником инфекции являются больные и вирусоносители. Вирусы выделяются вместе с секретом слизистой оболочки ВДП во время разговора, кашля, чихания, и передача возбудителя здоровым осуществляется воздушно-капельным путем. Опасность заражения от больного человека сохраняется в течение 5-7 дней. Восприимчивость к РСВ очень высока, особенно у детей раннего возраста.
О распространении РСВИ среди различных возрастных групп населения позволяют судить серологические исследования. У большинства новорожденных имеются антитела, полученные от матери. Однако врожденный пассивный иммунитет довольно быстро утрачивается, и уже у детей 4-6-месячного возраста антитела не удается обнаружить. В этот период дети становятся высоко восприимчивыми к РСВ, заболеваемость возрастает, в результате чего увеличивается число детей, которые приобрели антитела, а вместе с ними и иммунитет. У детей в возрасте 5-10 лет антитела к РСВ обнаруживаются у 63-68% обследованных. Примерно такой же результат был получен и при обследовании здоровых взрослых (67%). Заболевания, вызванные РСВ, наблюдаются и среди взрослых различного возраста, при этом у большинства из них имеет место реинфекция, так как болезнь возникает несмотря на наличие нейтрализующих и комплементсвязывающих антител.
Клиника и патогенез
Инкубационный период длится не менее 3 дней, чаще 4-5 дней. Начинается заболевание как остро, так и подостро. У детей грудного возраста чаще наблюдается вовлечение в процесс НДП, в то время как у старших детей и у взрослых изменения обычно ограничиваются областью ВДП и протекают в виде ринита, фарингита, ларингита. Ринит отмечается у большинства пациентов, выделения из носа необильные серозно-слизистые. В ротоглотке может наблюдаться умеренная гиперемия слизистой. Наиболее частый симптом РСВИ - кашель, вначале непродуктивный, затем на 3-4 день болезни появляется мокрота.
Через 2-3 дня от начала болезни, а иногда и в более поздние сроки, обнаруживаются признаки поражения НДП с развитием бронхита, бронхиолита или бронхо-бронхиолита, обусловливающие возникновение БОС. Появляется одышка с втяжением уступчивых мест грудной клетки, обычно экспираторного типа. Дыхание шумное, свистящее.
При бронхите у большинства пациентов на фоне жесткого дыхания выслушивается большее или меньшее количество сухих свистящих хрипов, у части больных - средне- и крупнопузырчатые влажные хрипы. Выдох удлинен. Для бронхиолита характерно обилие мелкопузырчатых влажных и крепитирующих хрипов, выслушиваемых по всей поверхности обоих легких, обычно в конце вдоха. Из-за вздутия легких при перкуссии грудной клетки определяется коробочный звук.
Одним из важных признаков, характеризующих БОС, является цианоз. У детей первых месяцев жизни с бронхиолитом отмечается общий цианоз, дети становятся чугунного цвета. Поражение органов дыхания происходит на фоне лихорадки, которая в отдельных случаях может и отсутствовать.
При рентгенологическом обследовании наиболее характерным признаком РСВИ является повышение прозрачности легочных полей, расширение межреберных промежутков, усиление легочного рисунка за счет расширения крупных сосудистых стволов и обогащения его мелкими линейными тенями. Наблюдается перестройка всего легочного рисунка по сетчато-трабекулярному типу.
В крови в первые дни болезни может обнаруживаться лейкоцитоз за счет гранулоцитов, однако чаще имеет место нормоцитоз или, реже, лейкопения. СОЭ обычно повышена.
Общая продолжительность РСВИ составляет от 5-7 дней до 3-х недель.
У новорожденных и детей второго месяца жизни, особенно недоношенных, при РСВИ могут возникать приступы апноэ. Такие приступы, хотя часто повторяются во время острой инфекции, обычно купируются самостоятельно и, как правило, не сопровождаются неврологическими или системными повреждениями, но требуют наблюдения.
У детей старшего возраста и взрослых РСВИ обычно протекает в стертой форме или проявляется только как афебрильное заболевание ВДП, но может иметь и клиническую симптоматику гриппа. Полагают, что РСВ служит причиной 15% обострений хронического бронхита.
Особого внимания заслуживают тяжелые формы РСВИ у детей раннего возраста, проявляющиеся бронхиолитом или бронхо-бронхиолитом с бронхообструктивным синдромом (БОС), требующие неотложной помощи и могущие привести к летальному исходу. Половина больных этой группы приходится на детей первых 3 месяцев жизни, начиная с раннего неонатального периода. Бронхиолиты в изолированном виде обычно наблюдаются у детей первых месяцев жизни, однако в большинстве случаев, наряду с бронхиолитом, имеются клинические признаки поражения и крупных бронхов. Клинически эту группу больных характеризует выраженная дыхательная недостаточность, определяющая тяжесть болезни, в то время как явления интоксикации выражены слабо или в умеренной степени.
Клиническая диагностика РСВИ представляет определенные трудности ввиду сходства с другими респираторными заболеваниями. И все же некоторые клинические особенности отличают РСВИ от других ОРВИ. Для РСВИ в типичных случаях характерно поражение НДП с развитием бронхита или бронхиолита и возникновением БОС. Дифференциальная диагностика у детей первого полугодия жизни должна включать все другие причины острых заболеваний НДП - вирусы парагриппа, особенно 3 типа, аденовирусы, вирусы гриппа, риновирусы, а также Chlamydia trachomatis. Последняя вызывает интерстициальную пневмонию с кашлем, и, в некоторых случаях, затрудненное дыхание, хотя лихорадка обычно отсутствует. У детей с иммунодефицитом должна быть принята во внимание возможность инфекции Pneumocystis carinii. При бактериальной пневмонии шумного выдоха обычно не бывает, а симптомы общей интоксикации более выражены.
Для диагностики РСВИ имеют значение и эпидемиологические данные. Если это семейный очаг, то взрослые и дети старшего возраста переносят обычное, легкое респираторное заболевание, в то время как у детей раннего возраста наблюдается тяжелое течение, и у них часто возникает бронхит или бронхиолит.
Таким образом, имеющихся клинико-эпидемиологических данных нередко бывает достаточно для предположительного диагноза. Для окончательной верификации диагноза РСВИ используются различные лабораторные методы диагностики.
В практической работе в настоящее время наиболее широко используют экспресс-методы, направленные на определение антигена РСВ в материалах от больных. Антиген РСВ можно обнаружить методом иммунофлюоресценции либо ИФА. Оба метода достаточно специфичны и чувствительны и, по существу, имеют равновеликую ценность. Ответ получают через несколько часов.
Образцы для исследования лучше забирать при аспирации, устанавливая катетер над входом в гортань. Материал можно также получить из полости носа, используя сухой ватный тампон на металлическом стержне, реже пользуются носоглоточными смывами. Взятие материала из НДП для рутинного диагноза не является необходимым, хотя это может повысить результативность диагностики.
У умерших детей исследуют ткань легких, трахеи и бронхов на антиген РСВ или они используются для выделения вируса.
Специфический антиген выявляют методом иммунофлуоресценции в цитоплазме эпителиальных клеток носа с первых дней болезни и в последующие 10 дней. Однако при тяжелых формах болезни мы обнаруживали антиген РСВ до 29-49 дней от начала болезни.
При легких формах РСВИ, которые широко распространены, применяются симптоматические средства, и они не требуют каких-либо специфических мер.
При тяжелых формах заболевания, сопровождающихся БОС, необходима госпитализация детей. Лечение тяжелых форм РСВИ с поражением НДП носит неотложный характер. Первоочередными являются следующие мероприятия:
Несомненно, что главной задачей терапии является обеспечение адекватной оксигенации крови, что достигается как прямой ингаляцией кислорода, так и воздействием на различные механизмы БОС. Уже такое простое мероприятие, как своевременное удаление с помощью электроотсоса слизи, накапливающейся в ВДП, может привести к улучшению дыхательной функции.
При БОС показано применение средств, уменьшающих отек слизистой дыхательных путей, гиперсекрецию и бронхоспазм. Применяются бронходилятаторы и муколитики.
В связи с возникновением тяжелых, иногда критических состояний при БОС в качестве неотложной терапии показано применение глюкокортикоидов, которые применяют в сочетании с бронхолитиками. Преднизолон или гидрокортизона гемисукцинат вводят внутривенно, а затем переходят на пероральный прием. Преднизолон назначается из расчета 2-3 мг/кг, а гидрокортизона гемисукцинат 5-6 мг/кг в сутки.
Патогенетически обосновано применение диуретиков быстрого действия (фуросемид) в лечении обструктивного синдрома, если он обусловлен бронхиолитом. Фуросемид вводится в разовой дозе 1 мг/кг внутривенно или внутримышечно. Повторное введение фуросемида следует проводить с осторожностью, и чаще всего в его повторном введении в ближайшие 24 часа нет необходимости. Бикарбонат натрия для коррекции декомпенсированного ацидоза у детей с БОС не применяется.
Оптимальным вариантом поддержания функционального состояния слизистой дыхательных путей является пребывание ребенка в условиях кислородного аэрозоля (тумана) и применение медикаментозных аэрозольных ингаляций. Получение тумана достигается с помощью производителя аэрозолей эжекционного типа. Аэрозоль направляют под тент-палатку ДКП-1 или под колпак кювеза (для детей первых месяцев жизни). В камере создается кислородный аэрозольный туман с 50-60% содержанием кислорода и высокой влажностью (100%). С помощью производителя аэрозолей распыляют обычную воду, 2% раствор бикарбоната натрия, физиологический раствор, которые оказывают муколитическое действие и способствуют отхождению мокроты и снижению потери жидкости.
Постоянная ингаляционная терапия позволяет достичь, прежде всего, удовлетворительной оксигенации крови. При этом улучшаются и другие показатели газового состава крови и кислотно-щелочного состояния, особенно уменьшается метаболический компонент ацидоза.
С целью поддержания гомеостаза почти всем детям проводится инфузионная терапия, тем более, что полноценное энтеральное кормление часто не может быть обеспечено из-за тяжести состояния, однако она осуществляется в небольших объемах (20-25 мл/кг массы) и кратковременно. Обычно вводится 10% раствор глюкозы с электролитами.
В терапии БОС, особенно при выраженном бронхо-спазме, могут быть использованы бронходилятаторы короткого действия из группы b2-агонистов. Например, сальбутамол (0,2 мг/кг в день) при бронхиолите у детей в возрасте 1-9 месяцев.
Из средств этиотропной терапии для лечения РСВИ у детей раннего возраста в настоящее время в мире препаратом выбора является рибавирин, который является синтетическим нуклеозидом и принадлежит к противовирусным препаратам широкого спектра действия. Условием назначения рибавирина является лабораторно подтвержденный диагноз и ранние сроки заболевания. Показаниями для ингаляций рибавирина являются тяжелые формы РСВИ у детей раннего возраста и больные с врожденными пороками сердца. Применяется в виде длительных ингаляций аэрозолей в дозе 10 мг/кг в сутки. Длительность курса лечения 3-5 дней.
Применение рибавирина приводит к уменьшению тяжести клинической картины заболевания, сокращению длительности БОС, быстрой элиминации возбудителя, ускорению выздоровления.
При применении рибавирина следует самым строгим образом учитывать предупреждения о возможных токсических проявлениях.
Создание вакцин против РСВИ имеет долгую и поучительную историю. Более чем за 30 лет были получены инактивированные, живые аттенуированные и субъединичные РСВ-вакцины. Однако все они оказались неэффективными. Более того, после применения инактивированной вакцины естественное заражение РСВ приводило к более тяжелому течению заболевания. Тем не менее, усилия по созданию новых вакцин против РСВИ не ослабевают, и есть надежда, что эффективная вакцина будет разработана.
1. Медицинская микробиология (под ред. В.И. Покровского и О.К. Поздеева). М.: Гэотар Медицина,1998.
2. Simoes E.A. Respiratory syncytial virus infection. Lancet 1999; 354: 847-52.
4. Rodriguez W.J. Management strategies for respiratory syncytial virus infections in infants. J Pediatr 1999; 135: 45-50.
5. Ottolini M.G., Hemming V.G. Prevention and treatment recommendations for respiratory syncytial virus infection. Background and clinical experience 40 years after discovery. Drugs 1997; 54: 867-84.
6. Hussell T.; Openshaw P. Recent developments in the biology of respiratory syncytial virus: are vaccines and new treatments just round the corner? Curr Opin Microbiol 1999; 4: 410-4.
Читайте также:

