Васкулиты ассоциированные с гепатитами
Обновлено: 23.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Васкулиты: причины появления, симптомы, диагностика и способы лечения.
Определение
Причины возникновения васкулитов
Причины развития васкулитов точно пока не известны. Выделяют первичные системные васкулиты, являющиеся самостоятельными заболеваниями, и вторичные, которые развиваются на фоне других болезней.
В основе формирования первичных васкулитов лежат генетические дефекты, а пусковыми факторами становятся латентные (скрыто протекающие) инфекционные процессы (гепатит В, парвовирус, стафилококк, микобактериоз, ОРВИ), иммунная гиперчувствительность к некоторым лекарственным препаратам (антибактериальным, противовирусным, ингибиторам АПФ, аминазину и др.), гиперсенсибилизация к некоторым соединениям, входящим в состав табака, и пр.
Вторичные системные васкулиты возникают как синдром при различных заболеваниях, например, при инфекционном эндокардите, ревматоидном артрите, при некоторых опухолевых процессах, инфекционных поражениях, при лекарственной болезни.
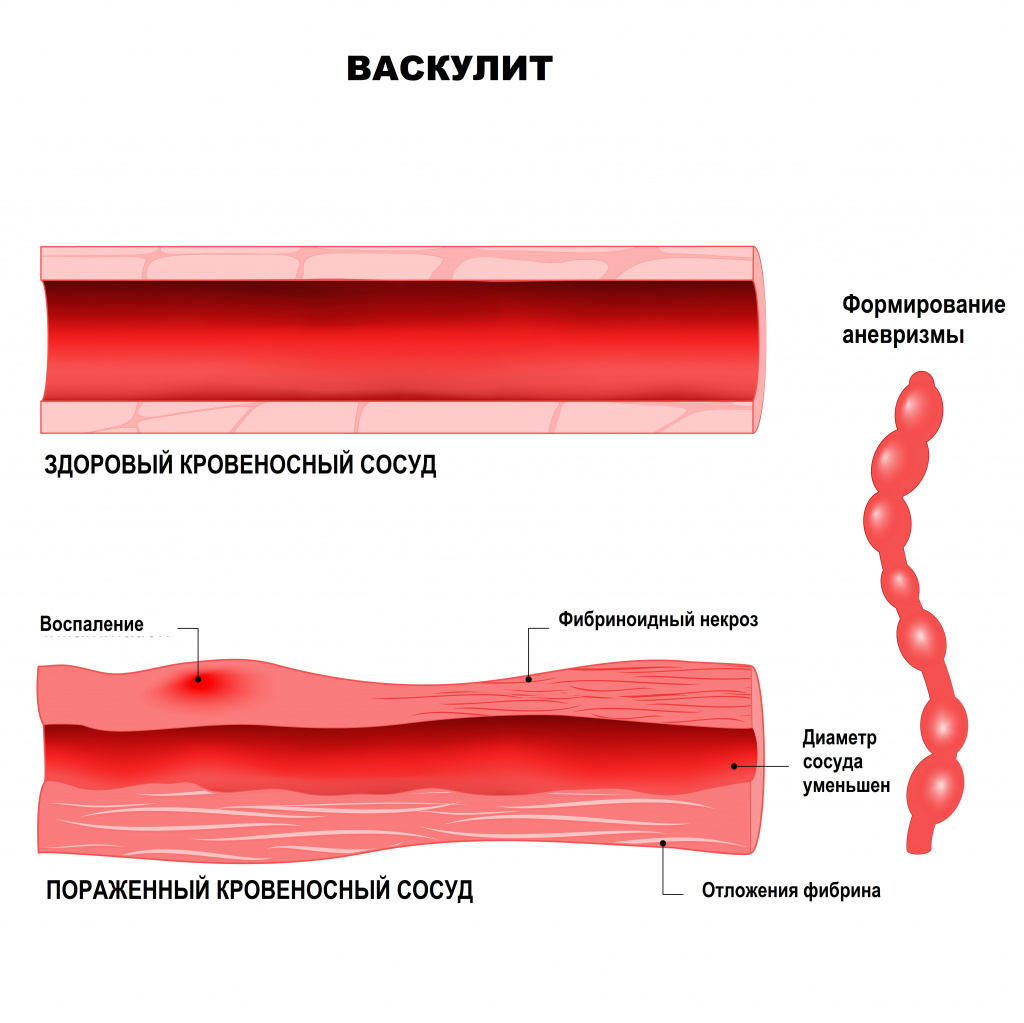
В основе развития системных васкулитов лежат различные патологические механизмы, например, повреждающее действие циркулирующих иммунных комплексов (ЦИК). Иными словами, при попадании в организм антигена (им может быть любой микробный агент, лекарственное вещество, собственный измененный белок) к нему присоединяется соответствующий иммуноглобулин. Вместе они образуют иммунный комплекс. Эти комплексы начинают циркулировать по организму, осаждаются на внутренней стенке сосудов и вызывают воспаление. Чем больше этих комплексов и чем дольше они циркулируют в крови, тем сильнее повреждается сосудистая стенка. Способствует повреждению повышение внутрисосудистого давления, замедление тока крови, нарушения баланса в работе иммунной системы.
Другими патологическими механизмами, лежащими в основе васкулитов, является выработка тромбоцитами и клетками внутренней стенки сосудов (эндотелия) провоспалительных цитокинов и появление в крови аутоантител – белков, которые ведут себя агрессивно по отношению к собственным антигенам организма. Эти аутоантитела могут оказывать прямое повреждающее действие на эндотелий (антиэндотелиальные антитела), на цитоплазму нейтрофилов (АНЦА – антинейтрофильные цитоплазматические антитела), способствовать активации каскада свертывающей системы крови (антифосфолипидные аутоантитела).
Классификация васкулитов
Существует большое количество классификаций системных васкулитов, из которых основной на сегодняшний день является та, в основе которой лежит калибр пораженных сосудов и основные механизмы их поражения:
1. Васкулит с поражением сосудов крупного калибра:
- артериит Такаясу (неспецифический аортоартериит),
- гигантоклеточный артериит (болезнь Хортона) и ревматическая полимиалгия.
- узелковый полиартериит,
- болезнь Кавасаки.
3.1. Васкулиты, ассоциированные с антинейтрофильными цитоплазматическими антителами (АНЦА):
- микроскопический полиангиит,
- гранулематоз с полиангиитом (Вегенера),
- эозинофильный гранулематоз с полиангиитом (Черджа- Строс).
- заболевания, ассоциированные с антителами к базальной мембране клубочка почек (синдром Гудпасчера),
- криоглобулинемический васкулит
- IgA-ассоциированный васкулит (геморрагический васкулит, пурпура Шенлейна-Геноха),
- гипокомплементемический уртикарный васкулит (анти-C1q васкулит).
- кожный лейкоцитокластический ангиит,
- кожный артериит,
- первичный васкулит центральной нервной системы,
- изолированный аортит,
- другие.
- васкулит при системной красной волчанке,
- ревматоидный васкулит,
- саркоидный васкулит,
- другие.
- криоглобулинемический васкулит, ассоциированный с вирусом гепатита С,
- васкулит, ассоциированный с вирусом гепатита В,
- аортит, ассоциированный с сифилисом,
- лекарственный иммунокомплексный васкулит,
- лекарственный АНЦА-ассоциированный васкулит,
- паранеопластический васкулит,
- другие.
Симптомы системного васкулита зависят от того, какие сосуды поражены. При вовлечении сосудов кожи появляются симметричные высыпания (в первую очередь на голенях), склонные к отеку, кровоизлияниям, некрозу. Может развиться гангрена.
На слизистых оболочках также могут появляться геморрагические высыпания, язвы и некрозы.
Ишемический синдром при васкулитах проявляется перемежающейся хромотой – болью в икроножных мышцах, возникающей при ходьбе и вынуждающей человека сделать остановку и подождать, пока боль утихнет (встречается также в других мышцах ног, сопровождается онемением и похолоданием конечностей, может наблюдаться и при поражении верхних конечностей). Кроме того, может развиваться ишемическая полинейропатия, ишемические поражения центральной нервной системы, асимметрия пульсации артерий.
Системные васкулиты характеризуются вовлечением в патологический процесс разных органов и систем. Поражения сосудов сердечно-сосудистой системы могут приводить к недостаточному кровоснабжению сердечной мышцы, миокардитам, поражению внутренней оболочки сердца – эндокарда, и околосердечной сумки – перикарда. Возникают различные нарушения ритма и проводимости, повышается риск развития острого инфаркта миокарда и сердечной недостаточности.
Поражение бронхолегочной системы включает появление в легких уплотнений (инфильтратов), развитие инфарктной пневмонии, бронхоспазма, плеврита.
Почечные васкулиты становятся следствием поражения почечных артерий. Например, при узелковом периартериите в почках возникают множественные безболевые инфаркты (гибель части почки в результате закупорки артерии), что приводит к почечной недостаточности. Поражение почечных артерий может закончиться стойкой злокачественной артериальной гипертензией. Некоторые васкулиты протекают с развитием тяжелого гломерулонефрита – воспалением почечных клубочков.
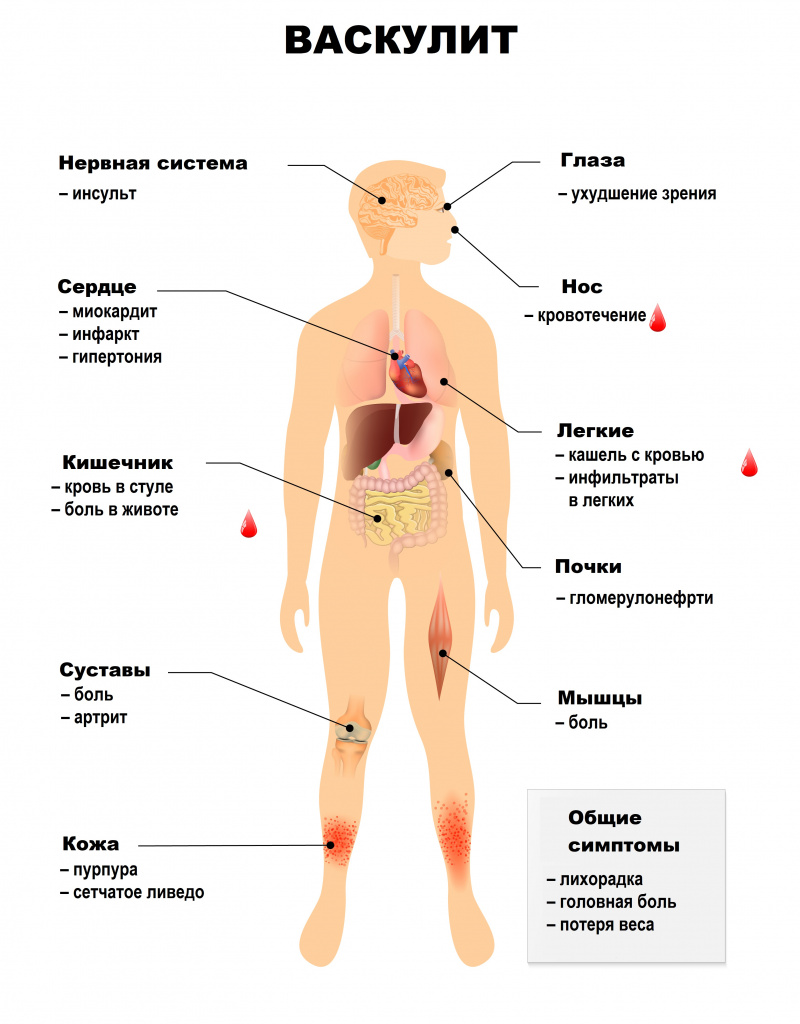
Абдоминальный синдром при васкулитах сопровождается болью в животе в сочетании с диспепсическими расстройствами (чувством распирания, вздутием), тошнотой, рвотой, язвами в желудке и кишечнике, может развиться опасное осложнение – тромбоз брыжеечных артерий, кровоснабжающих кишечник.
Поражение нервной системы проявляется множественными невритами, патологией центральной нервной системы с психозами, зрительными расстройствами, острыми нарушениями мозгового кровообращения.
Для геморрагического васкулита (пурпуры Шенлейна-Геноха) типично поражение кожи, кишечника, почек, суставов. Поражение кожи проявляется геморрагическим синдромом – множественными кровоизлияниями на стопах, голенях, бедрах, ягодицах, плечах, предплечьях, вокруг пораженных суставов. Но особенно они выражены на внутренней поверхности предплечий, бедер, голеней, в местах расположения ремня брюк, ремешка часов. О кровоизлияниях в кишечнике свидетельствуют колики, тошнота, рвота, стул с кровью.
Для криоглобулинемического васкулита характерно поражение кожи и клубочков почек. Появляется мелкоточечная или сливная геморрагическая пурпура чаще в области нижних конечностей, ягодиц, поясницы. Одновременно у больных возникают мигрирующие боли в мелких суставах кистей и в коленных суставах.
Гранулематоз Вегенера проходит с вовлечением дыхательных путей и тяжелым гломерулонефритом, приводящим к декомпенсированной почечной недостаточности и часто является причиной смерти больного.
Эозинофильный гранулематоз с полиангиитом (Черджа-Строс) протекает с поражением респираторного тракта, придаточных пазух носа, аллергией. Характерным признаком является развитие гиперэозинофильной бронхиальной астмы. Почки при этом васкулите, как правило, не страдают.
При узелковом периартериите поражаются в основном артерии среднего калибра – образуются аневризмы, тромбы, кровотечения из-за разрыва аневризм, велик риск инфаркта пораженных органов и тканей. Больные испытывают сильную боль в мышцах (чаще ног), мигрирующие боли в крупных суставах, наблюдается поражение кожи, желудочно-кишечного тракта и сердца.
При микроскопическом полиангиите страдают мелкие сосуды. Для заболевания характерны кожные проявления, полиневрит, воспалительные процессы в дыхательных путях, а также некротизирующий гломерулонефрит.
Болезнь/синдром Кавасаки часто встречается у детей и сопровождается лихорадкой, воспалением слизистых оболочек, кожи, лимфатических узлов и различных систем, прежде всего сердечно-сосудистой, что проявляется тахикардией, аритмией, могут возникать аневризмы и сужения коронарных артерий, миокардит, перикардит, поражение клапанного аппарата.
При болезни Такаясу, или неспецифическом аортоартериите страдают суставы (преимущественно верхних конечностей) и кожа с развитием язв. Характерным является синдром дуги аорты – он включает поражение подключичных артерий, которое проявляется болями, мышечной слабостью, зябкостью рук, резким уменьшением или полным отсутствием пульса на лучевых артериях, и стеноз сонных артерий. Кроме того, возникает симптоматическая артериальная гипертензия (из-за сужения почечных артерий), повышается давление в легочной артерии, сужаются артерии сердца вплоть до развития инфаркта, наблюдается перемежающаяся хромота.
При гигантоклеточном височном артериите страдает аорта и отходящие от нее крупные артерии. Характерным признаком является воспаление височной артерии, вызывающее постоянную, очень интенсивную головную боль, обычно с одной стороны головы.
Диагностика васкулита
Для большинства системных васкулитов нет специфических лабораторных тестов. Внимание уделяется клинической картине заболевания с выявлением характерных для того или иного васкулита симптомов.
Затем врач выясняет системность патологического процесса, на которую могут указывать такие симптомы как повышение температуры, снижение массы тела, боль в мышцах и суставах, анемия, увеличение СОЭ.
Потом определяется, первичный или вторичный характер носит заболевание, после чего требуется клиническое и инструментальное подтверждение поражения сосудов.
Для этой цели применяются методы инструментальной и рентген-диагностики:
Ультразвуковое сканирование артерий верхних конечностей в комплексной диагностике сердечно-сосудистых заболеваний.
Для цитирования: Баранов А.А. Cистемные васкулиты: современные стандарты диагностики и лечения. РМЖ. 2005;24:1577.
Системные васкулиты – группа болезней, при которых ишемия и некроз тканей возникают вследствие воспаления кровеносных сосудов (первичного или вторичного по отношению к основному заболеванию). Клинические проявления васкулитов зависят от типа, размера и локализации пораженных сосудов, а также активности системного воспаления.
Литература
1. Koldingsnes W., Nossent H. Epidemiology of Wegener’s granulomatosis in northern Norway. Arth.Rheum. 2000; 43: 2481–2487.
2. Watts R.A., Lane S.E., Bentham G., Scott D.G.I. Epidemiology of systemic vasculitis: a ten–year study in the United. Arth.Rheum. 2000; 43: 414–419.
3. Mahr A., Guillevin L., Poissonnet M., Ayme S. Prevalemces of polyarteritis nodosa, microscopic poliangiitis, Wegener’s granulomatosis and Churg–Strauss syndrome a French urban population in 2000: a capture–recapture estimate. Arth.Rheum. 2004; 51: 92–99.
4. Jennette J.C., Falk R.J., Andrassy K., et al. Nomenclature of systemic vasculitides: proposed of an international consensus conference. Arthritis Rheum, 1994;37:187–192.
5. Luqmani R.A., Bacon P.A., Moots RJ. et al. Birmingham vasculitis activity score (BVAS) in systemic necrotising vasculitis.Q.J.Med.,1994; 87: 671–678.
6. Jane D. Evidence–based treatment of systemic vasculitis. Rheumatology, 2000; 39:585–595.
7. Ling SM. Polymyalgia rheumatica and giant cell arteritis. Clinical Guidance from ACP. 2003.
8. Thomas–Golbanov C., Sridharan S. Novel therapies in vasculitis. Expert. Opin. Investig. Drugs. 2001; 10:1279–1289.
9. Savage CO., Harper L., Ady D. Primary systemic vasculitis. Lancet, 1997; 349:553–558.
10. Gross W.L. New concept in treatment protocols for severe systemic vasculitis. Curr Opin Rheumatol, 1999; 11: 41–46.
11. Sabbadini M.G., Bozzolo E., Baldissera E. Bellone M. Takayasu’s arteritis: therapeutic strategies. J.Nephrol. 2001; 14:525–531.
12. Groot Kd., Adu D., Savage C.O. The value of pulse cyclophosphamide in ANCA–associated vasculitis: meta–analysis and critical review. Nephrol Dial Transplant 2001; 16:2018–2027.
13. Westman K.W., Bygren P.G., Olsson H. et al. Relapse rate, renal survival, and cancer morbidity in patients with Wegener’s granulomatosis or microscopic polyangiitis with renal involvement. J Am Soc Nephrol 1998; 9:842–852.
14. Jayne D.R., Rasmussen N., Andrassy K. et al. A Randomized Trial of Maintenance Therapy for Vasculitis Associated with Antineutrophil Cytoplasmic Autoantibodies New.Ingl. J.Med. 2003; 349:36–44
15. Stone J.H., Tun W., Hellman D.B. Threatment of non–life threatening Wegener’s granulomatosis with methotrexate and daily prednisolone as the initial therapy of choice. J.Rheumatol. 1999; 26:1134–1139.
16. Sneller M.C., Hoffman G.S., Talar–Williams C. et al. An analysis of 42 Wegener’s granulomatosis patients treated with methotrexate and prednisone. Arthr.Rheum. 1995; 38: 608–613.
17. Langford C.A., Talar–Williams C., Barron K.S., Sneller M.C. Use of a cyclophosphamide–induction methotrexate–maintenance regimen for the treatment of Wegener’s granulomatosis: extended follow–up and rate of relapse. Am. J. Med. 2003; 114: 463–469.
18. Hoffman G.S., Leavitt R.Y., Kerr G.S. et al. Treatment of glucocorticoid–resistant or relapsing Takayasu arteritis with methotrexate // Arthr.Rheum. – 1994. – Vol. 37. – P.578 – 582.
19. Danieli M.G., Cappelli M., Malcangi G. et al. Long term effectiveness of intravenous immunoglobulin in Churg–Strauss syndrome. Ann.Rheum.Dis. 2004; 63: 1649–1654.
20. Cole E., Cattran D., Magil A. et al. A prospective randomized trial of plasma exchange as additive therapy in idiopathic crescentic glomerulonephritis. Am J Kidney Dis. 1992; 20:261–268.
21. Guillevin L., Fain O., Lhote F. et al. Lack of superiority of steroids plus plasma exchange to steroids alone in the treatment of polyarteritis nodosa and Churg – Strauss syndrome. A prospective, randomized trial in 76 patients // Arthr.Rheum. – 1992. – Vol. 35. – P.208 – 215.
22. Nowack R., Gobel U., Klooker P. et al. Mycophenolate mofetil for maintenance therapy of Wegener’s granulomatosis and microscopic polyangiitis: A pilot study in 11 patients with renal involvement. J.Am.Soc. Nephrol. 1999; 10:1965–1971.
23. Langford C.A., Talar–Williams C., Sneller M.C. Mycophenolate mofetil for remission maintenance in the therapy of Wegener’s granulomatosis. Athr.Rheum. 2004; 51:278–283.
24. Diaz–Llopis M., Cervera M., Menezo J.L. Cyclosporin A treatment of Behcet`s disease: a long–term study // Curr.Eye Res. – 1990. – Vol.9 (suppl.). – P.17 – 23.
25. Ozyazgan Y., Yurdakul S., Yazici H. et al. Low dose cyclosporin A versus pulsed cyclophosphamide in Behcet’s syndrome: A single masked trial. Br J Ophthalmol 1992; 76:241–247.
26. Metzler C., Low–Friedrich I., Reinold–Keller E. et al. Leflunomide a new promising agent in maintenance of remission in Wagener’s granulomatosis. Clin.Exp.Immunol. 1998; 112:56.
27. Stegeman C.A., Cohen Tervaert J.W., de Jong P.E., Kallenberg C.G. Trimethoprim–sulfamethoxazole (co–trimoxazole) for the prevention of relapses of Wegener’s granulomatosis. Dutch Co–Trimoxazole Wegener Study Group. N.Engl.J. Med. 1996; 335:16–20.
28. Reinhold–Keller E., De Groot K., Rudert H. et al. Response to trimethoprim/sulfamethoxazole in Wegener’s granulomatosis depends on the phase of disease. Q.J.M. 1996; 89:15–23.
29. Chung J.B., Armstrong K., Schwartz J.S., Albert D. Cost–effectiveness of prophylaxis against Pneumocystis carinii pneumonia in patients with Wegner’s granulomatosis undergoing immunosuppressive therapy. Arthr. Rheum. 2000; 43:1841–1847.
30. Masuda K., Nakajima A., Urayama A. et al. Double–masked trial of cyclosporin versus colchicne and long– term open study of cyclosporin in Behcet`s disease.Lancet. 1989; 1:1093 – 1096.
31. Guillevin L., Cohen P. Management of virus–induced systemic vasculitides. Cur.Rheumatol.Rep. 2002; 4:60–66.
32. Guillevin L., Mahr A., Cohen P. et al. Short–term corticosteroids then lamivudine and plasma exchanges to treat hepatitis B virus–related polyarteritis nodosa. Arthr.Rheum. 2004; 51: 482–487.
33. Tada Y. Surgical treatment of intractable vasculitis syndromes with special reference to Buerger disease, Takayasu arteritis, and so–called inflammatory abdominal aortic aneurysm. Nippon.Rinsho.1994; 52: 2191 – 2202.
34. Hoffman G.S., Thomas–Golbanov C.K., Chan J. et al. Treatment of subglottic stenosis, due to Wegener’s granulomatosis, with intralesional corticosteroids and dilation. J Rheumatol. 2003; 30:1017–1025.
35. Guillevin L., Lhote F., Cohen P. et al. Corticosteroids plus cyclophosphamide and plasma exchange versus corticosteroids plus cyclophosphamide alone in the treatment of polyarteritis nodosa and Churg – Strauss syndrome patients with factors predicting poor prognosis. Arthr.Rheum. – 1995. – Vol.38. – P.1638 – 1645.
36. Blanco R., Martinez–Taboada V.M., Rodriguez–Valverde V. et al. Henoch – Schonlein purpura in adulthood and childhood. Two different expression of the same syndrome. Arthr.Rheum. 1997; 40:859 – 864.
37. Salvarani C., Crowson C.S., O’Fallon W.M. et al. Reappraisal of the epidemiology of giant cell arteritis in Olmsted country, Minnesota, over a fifty–year period. Arth.Rheum. 2004; 51: 264–268.
38. Ishikawa K., Maetani S. Long–term outcome for 120 Japanese patients with Takayasu’s disease. Clinical and statistical analyses of related prognostic factors // Circulation. – 1994. – Vol.90. – Р.855 – 860.
ФГБУ "НИИ ревматологии им. В.А. Насоновой" РАМН, Москва
Современная классификация системных васкулитов
Журнал: Терапевтический архив. 2014;86(5): 94‑98
Бекетова Т.В. Современная классификация системных васкулитов. Терапевтический архив. 2014;86(5):94‑98.
Beketova TV. The current classification of systemic vasculitides. Terapevticheskii Arkhiv. 2014;86(5):94‑98. (In Russ.).
ФГБУ "НИИ ревматологии им. В.А. Насоновой" РАМН, Москва
Аннотация. Системные васкулиты (СВ) представляют собой тяжелые полиорганные заболевания, при которых ранняя диагностика и лечение существенно улучшают прогноз. Значительному снижению вероятности диагностических ошибок может способствовать совершенствование классификации СВ. Представленная статья посвящена итогам прошедшей в 2012 г. Международной согласительной конференции по номенклатуре СВ (Chapel Hill, США). Опираясь на текущие тенденции практического применения терминов, современные представления об особенностях проявлений заболеваний и достижения в изучении патогенеза, пересмотрены номенклатура и определение основных форм СВ, в новую классификацию включены дополнительные категории васкулита.
ФГБУ "НИИ ревматологии им. В.А. Насоновой" РАМН, Москва
Системные васкулиты (СВ) - гетерогенная группа заболеваний, основным морфологическим признаком которых является воспаление сосудистой стенки, а клинические проявления определяются типом, калибром, локализацией пораженных сосудов и тяжестью иммуновоспалительных изменений [1]. В настоящее время изучение СВ можно отнести к одной из наиболее динамично развивающихся областей ревматологии [2]. За последние 2 года произошли существенные изменения, касающиеся номенклатуры отдельных форм СВ, и предложена новая классификация.
Вопросы номенклатуры и классификации СВ традиционно рассматриваются ведущими экспертами мира на проводимых в Чэпел Хилл (Chapel Hill, США) согласительных конференциях (ЧХСК). Классификация, повсеместно использовавшаяся в последние 2 десятилетия, представлена на ЧХСК в 1994 г. [3]. В ее основу положены морфологические особенности наиболее часто встречающихся СВ, в первую очередь калибр преимущественно пораженных сосудов.
В последнее время некоторые ключевые аспекты терминологии и классификации стали восприниматься как устаревшие, и сформировалось единодушное мнение о необходимости пересмотра существующих определений, номенклатуры и разработки новых критериев. На протяжении 2010-2011 гг. ведущими экспертами активно обсуждались вопросы изменения классификации СВ [4] при участии более 50 медицинских центров Европы, Америки, Австралии, Китая и Японии подготовлена платформа для разработки новой классификации [5, 6].
Итогом масштабной подготовительной работы стала состоявшаяся в 2012 г. ЧХСК, на которой утверждена современная классификация СВ [7], заменившая классификацию 1994 г. Сохранился анатомический принцип подразделения заболеваний (см. рисунок), по возможности учтены особенности иммунных механизмов, включены дополнительные категории СВ. Рисунок 1. Основные группы СВ в зависимости от калибра вовлеченных сосудов [7].
Современная классификация системных васкулитов (ЧХСК, 2012 г.) [7]
Васкулит крупных сосудов:
Васкулит средних сосудов:
- узелковый полиартериит (УП)
Васкулит мелких сосудов
Васкулиты ассоциированные с антинейтрофильными цитоплазматическими антителами (АНЦА-СВ):
- гранулематоз с полиангиитом (Вегенера)
- эозинофильный гранулематоз с полиангиитом (Черджа-Строс)
Иммунокомплексные васкулиты мелких сосудов:
- заболевания, ассоциированные с антителами к базальной мембране клубочков (анти-БМК)
- гипокомплементемический уртикарный васкулит (анти-C1q-васкулит)
Вариабельный васкулит:
Васкулит единственного органа:
- кожный лейкоцитокластический ангиит
- первичный васкулит центральной нервной системы (ЦНС)
Васкулит, ассоциированный с системными заболеваниями:
- васкулит, ассоциированный с саркоидозом
Васкулит, ассоциированный с определенной этиологией:
- криоглобулинемический васкулит, ассоциированный с вирусом гепатита С (HCV)
- васкулит, ассоциированный с вирусом гепатита В (HBV)
- аортит, ассоциированный с сифилисом
- лекарственный иммунокомплексный васкулит
- лекарственный АНЦА-ассоциированный васкулит
По-прежнему сохранена нозологическая самостоятельность артериита Такаясу и ГКА. Васкулит крупных сосудов характеризуется преимущественным поражением магистральных артерий (аорты и ее главных ветвей), но, как подчеркивается, может сопровождаться воспалением артерий и другого калибра, что в отдельных случаях определяет тяжесть клинического течения и прогноз. Так, по данным ангиографии, поражение глаз при ГКА может быть обусловлено патологией не только глазной артерии, но и центральной артерии сетчатки, разнообразных цилиарных артерий (артерии среднего калибра) и даже мелких ветвей цилиарных артерий (артерии мелкого калибра) [8]. К такому серьезному осложнению, как слепота, приводит не васкулит крупных артерий, но поражение именно мелких артерий. Как правило, ГКА развивается у пациентов старше 50 лет и часто сочетается с ревматической полимиалгией [9].
Васкулиты средних сосудов, к которым отнесены УП и болезнь Кавасаки, характеризуются преимущественным поражением артерий среднего калибра (главных висцеральных артерий и их ветвей), но возможно вовлечение артерий и другого калибра. Некротизирующее воспаление артерий при васкулите средних сосудов манифестирует более остро и тяжело, чем при васкулите крупных сосудов, типично формирование воспалительных аневризм и стеноза.
При УП некротизирующее поражение артерий среднего и мелкого калибра не сопровождается гиперпродукцией АНЦА, гломерулонефритом (ГН), васкулитом артериол, капилляров или венул.
Свойственная младшему детскому возрасту болезнь Кавасаки проявляется своеобразным поражением кожи, слизистых оболочек, лимфатических узлов и сочетается с артериитом преимущественно средних и мелких артерий (часто коронарных артерий), может сопровождаться поражением аорты и крупных артерий.
При МПА некротизирующий васкулит в отсутствие (или с небольшим количеством) иммунных депозитов преимущественно затрагивает мелкие сосуды (капилляры, венулы, артериолы) и не сопровождается гранулематозным воспалением. Могут поражаться артерии мелкого и среднего калибра. Типично развитие некротизирующего ГН, часто присоединяется геморрагический альвеолит.
ГПА характеризуется некротизирующим гранулематозным воспалением в органах верхних и нижних дыхательных путей, сочетающимся с некротизирующим васкулитом преимущественно сосудов мелкого и среднего калибра (капилляров, венул, артериол, артерий и вен) и частым развитием некротизирующего ГН.
При ЭГПА эозинофильному и гранулематозному воспалению с типичным вовлечением респираторного тракта сопутствует некротизирующий васкулит преимущественно сосудов мелкого и среднего калибра. Заболевание ассоциируется с бронхиальной астмой и эозинофилией. АНЦА определяются не во всех случаях, наиболее часто при ГН.
Группа иммунокомплексных СВ представлена IgA-васкулитом (Шенлейна-Геноха), криоглобулинемическим васкулитом, заболеванием, ассоциированным с анти-БМК и гипокомплементемическим уртикарным васкулитом (анти-C1q). В доказанных случаях иммунокомплексный СВ может быть классифицирован как васкулит, ассоциированный с системными заболеваниями, или васкулит с определенной этиологией.
Пурпура Шенлейна-Геноха объединена с IgA-васкулитом, что обосновано убедительными свидетельствами ключевой патогенетической роли аномальных депозитов IgA в стенках сосудов. Установлено, что у пациентов с системным IgA-васкулитом и изолированной IgA-нефропатией молекулы IgA1 (в депозитах или циркулирующие в сыворотке крови) характеризуются весьма специфичным нарушением О-гликозилирования шарнирной области тяжелых цепей [12]. Такие молекулы IgA1 приобретают способность активировать комплемент по альтернативному пути и проявляют повышенную тропность к мезангиальному матриксу почечных клубочков. Кроме того, в сыворотке крови больных IgA-СВ и IgA-нефропатией имеются антитела класса IgG, направленные против аномально гликозилированных IgA1 и способные образовывать иммунные комплексы IgA1-IgG (анти-IgA1) [13].
Новая классификация дополнена категорией вариабельного васкулита с поражением сосудов любого калибра и типа. В связи с высокой частотой сосудистого повреждения болезнь Бехчета и синдром Когана классифицированы как вариабельные васкулиты, а не вторичные васкулиты при системных заболеваниях.
Болезнь Бехчета проявляется рецидивирующими афтозными изъязвлениями слизистой оболочки рта и/или половых органов, что сопровождается поражением кожи, глаз, суставов, желудочно-кишечного тракта, нервной системы [16]. Характеризуется васкулитом мелких сосудов, артериитом, аневризмами артерий, тромбангиитом, тромбозами.
Для синдрома Когана свойственно воспалительное поражение глаз и органа слуха (нейросенсорная тугоухость и вестибулярные нарушения). Поражение глаз в первую очередь обусловлено васкулитом мелких сосудов переднего отдела глазного яблока: конъюнктивы (конъюнктивит), склеры (эписклерит, склерит), сосудистого тракта (увеит). Распространение воспаления на мелкие сосуды глубоких слоев роговицы вызывает типичный для синдрома Когана интерстициальный кератит. Системный воспалительный процесс также может приводить к развитию артериита (с поражением мелких, средних или крупных артерий), аортита, аневризмы аорты, поражению митрального и аортального клапанов.
Выделена категория васкулита единственного органа, при котором отсутствуют любые признаки, указывающие на возможность ограниченного варианта системного поражения. К этой категории отнесены кожный лейкоцитокластический ангиит, кожный артериит, первичный васкулит ЦНС, изолированный аортит. В то же время отмечено, что возможна трансформация васкулита единственного органа в системную патологию с признаками одной из нозологических форм СВ, что требует пересмотра диагноза в пользу одной из форм СВ. Например, кожный артериит в отдельных случаях может прогрессировать в системный УП. В рамках васкулита единственного органа можно обсуждать такие патологические состояния, как АНЦА-ассоциированный ГН и IgA-нефропатию, которые фактически представляют собой васкулит единственного органа и могут трансформироваться в развернутое системное заболевание. Для разграничения васкулита единственного органа и локального проявления СВ требуется подробное клиническое, лабораторное и инструментальное обследование, но окончательное разрешение этого вопроса может быть затруднено. Так, в клинической практике порой сложно бывает разграничить изолированный васкулит ЦНС и поражение ЦНС при УП, АНЦА-СВ, системной красной волчанке, саркоидозе, особенно в дебюте этих заболеваний.
Перечень СВ расширен включением вторичных васкулитов. В префиксе указывают соответствующее системное заболевание (например, ревматоидный васкулит, люпус-васкулит, васкулит при саркоидозе, рецидивирующем полихондрите и т.д.). Завершает классификацию категория васкулита с определенной этиологией, в которой представлены HCV-криоглобулинемический васкулит, HBV-васкулит, аортит при сифилисе, лекарственный иммунокомплексный васкулит, лекарственный АНЦА-СВ, паранеопластический васкулит.
Обобщение на новом этапе представлений о СВ создает прочный фундамент для последующей разработки современных классификационных и диагностических критериев СВ, необходимых для дальнейшего развития этой области ревматологии.
В-НХЛ — В-клеточная неходжкинская лимфома
ЖКТ — желудочно-кишечный тракт
ИСТ — иммуносупрессивная терапия
КВ — криоглобулинемический васкулит
КВ HСV — КВ, ассоциированный с HСV
ОШ — отношение шансов
ПВТ — противовирусная терапия
ППВД — препараты прямого противовирусного действия
ПЦР — полимеразная цепная реакция
РФ — ревматоидный фактор
СКГ — смешанная криоглобулинемия
СКФ — скорость клубочковой фильтрации
СРБ — С-реактивный белок
УВО — устойчивый вирусологический ответ
ХГС — хронический гепатит С
ЦНС — центральная нервная система
ЦП — цирроз печени
BVAS — индекс активности васкулита
HСV — вирус гепатита С
Криоглобулинемический васкулит (КВ) — системный васкулит с поражением преимущественно мелких сосудов, характеризующийся наличием криоглобулинов (КГ) в сыворотке крови и клиническими проявлениями: триада Мельтцера (сосудистая пурпура, артралгии, слабость), поражение почек, периферической нервной системы, синдром Рейно; реже — поражение сосудов центральной нервной системы (ЦНС), желудочно-кишечного тракта (ЖКТ), легких, сердца [1].
КГ — сывороточные иммуноглобулины (Ig), обладающие способностью к обратимой преципитации при температуре ниже 37 °C. Их разделяют на 3 основных типа. В состав КГ I типа входят только моноклональные Ig одного и того же класса. КГ II и III типов, или смешанные КГ (составляющие почти 90% всех КГ), представлены Ig разных классов, как правило, поликлональным IgG и IgM с активностью ревматоидного фактора (РФ). При этом тип II содержит моноклональный IgM РФ (имеющий легкие цепи каппа), тогда как при III типе все компоненты поликлональные.
После идентификации вируса гепатита С (HСV) доказано, что этот вирус является основным этиологическим фактором СКГ, выявляющимся более чем в 90% случаев СКГ II типа и в 40—70% при СКГ III типа. У больных хроническим гепатитом С (ХГС) установлена высокая частота развития СКГ (30—40%) и внепеченочных проявлений, среди которых преобладает васкулит [1—3]. При СКГ показана значительно более высокая, чем у больных ХГС без СКГ, частота не только проявлений, характерных для васкулита, но и В-клеточной неходжкинской лимфомы (В-НХЛ), ряда аутоиммунных синдромов и заболеваний [4, 5]. Клинические проявления васкулита развиваются чаще и протекают более тяжело при СКГ II типа. Наиболее подробно изучено поражение почек — криоглобулинемический мезангиокапиллярный гломерулонефрит, который, как правило, определяет прогноз КВ [6—8].
В последние годы в ряде зарубежных исследований, включавших от 24 до 231 больного [9—13], и в российском исследовании (21 больной) [14] дана клиническая характеристика КВ, ассоциированного с HСV (КВ HСV). Отмечается значительная вариабельность результатов исследований, касающихся как распространенности КВ среди больных ХГС со СКГ (от 5 до 30%), так и спектра клинических проявлений К.В. Это связано не только с истинными различиями (обусловленными генетическими и средовыми факторами), но и с отсутствием до последнего времени единых критериев диагностики К.В. Лишь в 2011 г. группой европейских экспертов предложены критерии диагностики КВ, которые валидизированы [15].
Установление роли HСV в качестве основного этиологического фактора СКГ радикально изменило подходы к лечению больных КВ, на протяжении многих лет сводившемуся к применению традиционных иммуносупрессоров — глюкокортикостероидов (ГКС) и циклофосфамида. Противовирусная терапия (ПВТ) стала наиболее важной составляющей лечения больных КВ HСV. Установлена также высокая эффективность CD-20 моноклональных антител — ритуксимаба (РТМ). Тем не менее больные КВ HСV представляют одну из наиболее трудных для лечения группу, что обусловлено иммуностимулирующими эффектами интерферона-α (ИФН-α), применяющегося в составе ПВТ, частотой рецидивов и резистентностью ряда проявлений КВ к терапии [16—18]. В отечественной литературе работы, посвященные проблеме лечения больных КВ HСV, ограничены анализом эффективности РТМ у 11 больных [19], а также описанием отдельных клинических наблюдений [20—23].
Цель исследования — дать клиническую характеристику КВ HСV, оценить прогноз заболевания и обобщить опыт многопрофильного терапевтического стационара в его лечении.
Материалы и методы
Работа основана на изучении 72 больных ХГС с КВ, наблюдавшихся в клинике им. Е.М. Тареева с 1995 по 2014 г. Диагноз К.В. устанавливали в соответствии с критериями заболевания, предложенными в 2011 г. [15]. У всех больных исключали другие этиологические факторы поражения печени, ВИЧ-инфекцию. Длительность наблюдения больных в клинике составила от 3 мес до 20 лет, в среднем — 2,8±3,6 года.
Проводили клинико-лабораторное и инструментальное обследование. Определяли содержание КГ методом преципитации, уровни Ig в сыворотке крови, общей гемолитической активности комплемента (СН50), активности РФ, С-реактивного белка (СРБ), антинуклеарных антител, α-фетопротеина, а также поверхностный антиген вируса гепатита В, антитела к ВИЧ и HСV методом иммуноферментного анализа. Выявление РНК HСV в плазме крови проводили методом полимеразной цепной реакции (ПЦР) в ФБУН ЦНИИЭ Роспотребнадзора М.З. РФ.
У 17 больных выполняли морфологическое исследование ткани печени, у 9 — других органов и тканей (почка, кожа, мышца). У 20 (27,8%) пациентов оценку стадии фиброза печени проводили методом ультразвуковой эластометрии на аппарате FibroScan.
У 28 больных выполнено иммунохимическое исследование белков сыворотки крови и мочи для выявления моноклональных белков. В целях диагностики В-НХЛ выполняли гистологическое исследование биоптатов костного мозга, лимфатических узлов, а также ткани селезенки и печени с последующим иммуногистохимическим исследованием (ФГБУ ГНЦ МЗ РФ).
У 60 из 72 больных оценивали эффективность иммуносупрессивной терапии (ИСТ) и/или ПВТ. Для объективной оценки активности васкулита до и после лечения определяли индекс активности BVAS (Birmingham vasculitis activity score) [24]. Активность считали высокой при оценка по BVAS ≥15 баллов.
Для статистической обработки данных использовали пакет программ SPSS. Рассчитывали среднее значение (М) и стандартное отклонение. Для сравнения групп применяли таблицы сопряженности (с расчетом χ 2 и точного критерия Фишера), критерий t, а также непараметрические методы (критерии Манна—Уитни, Вилкоксона). С целью выявления факторов, имеющих независимое значение, применяли многофакторный логистический регрессионный анализ. Для оценки выживаемости и влияющих на нее факторов использовали регрессионную модель Кокса, а также кривые Каплана—Майера. Статистически значимыми считали различия при р

Спектр и частота клинических проявлений КВ HCV у 72 обследованных больных
Результаты и обсуждение
Среди 1352 больных ХГС, госпитализированных с 1995 по 2014 г., СКГ диагностирована у 453 (33,5%), КВ — у 72 (5,3%). Частота развития КВ среди 453 больных ХГС со СКГ составила 15,9%.
Впервые среди отечественных работ дана клиническая характеристика значительной по численности (n=72) группы больных КВ, ассоциированным с HСV. Сравнительный анализ полученных данных проводили с результатами исследований последних лет [9—14], включавших больных КВ HСV и применявших критерии диагноза КВ, предложенные С. Ferri и соавт. [1] и более ранние системы критериев.
В нашей работе, как и в указанных исследованиях, среди больных преобладали женщины (68%). Возраст больных в период установления диагноза варьировал от 24 до 72 лет. Средний возраст, составивший 49,4±10,3 года, был несколько меньше, чем в других работах (от 53 до 60 лет). Средняя длительность инфекции до установления диагноза (19,3±8,6 года) соответствовала данным литературы (15—27 лет). У 33,4% больных при установлении диагноза имелась стадия цирроза печени (ЦП). Преобладал 1-й генотип HСV (65,3%).
Клиническая картина характеризовалась широким спектром проявлений (см. таблицу). Следует отметить более высокую, чем в других исследованиях, частоту поражения почек (61,1 и 30—38% соответственно), отсутствие редко описываемых поражений коронарных сосудов и ЦНС.
Тяжесть отдельных проявлений и течения КВ значительно варьировала — от наличия нераспространенной сосудистой пурпуры до генерализованного васкулита с развитием состояний угрожающих жизни. Оценки по BVAS до лечения колебались от 2 до 36 баллов, составив в среднем 11,9±7,2 балла, тяжелая форма васкулита (BVAS ≥15 баллов) наблюдалась у 30,6% больных. Тяжесть течения заболевания определялась поражением нескольких органов и систем, наличием тяжелого гломерулонефрита с нефротическим синдромом и нарушением функции почек, а также присоединением поражения легких, ЖКТ.
У 19 (26,3%) больных клинические проявления КВ сочетались с наличием ряда аутоиммунных синдромов (синдром Шегрена, иммунная тромбоцитопения, аутоиммунная гемолитическая анемия, фиброзирующий альвеолит, аутоиммунный тиреоидит), а у 7 (9,7%) — с В-НХЛ (селезеночной лимфомой маргинальной зоны, лимфоплазмоцитомой). Эти данные согласуются с современными представлениями об этиологической роли HСV в развитии В-НХЛ и наличии этиологической и патогенетической взаимосвязи между аутоиммунными синдромами и злокачественной В-клеточной лимфопролиферацией [5, 17, 25].
ИСТ и/или ПВТ получали 60 (83,3%) из 72 больных. Так как у отдельных пациентов за время наблюдения последовательно применялись различные виды лечения, эффективность традиционной ИСТ проанализирована в 31, селективной (РТМ) — в 15, а ПВТ — в 25 наблюдениях.
Клинический и иммунологический ответы оценивали через 6 мес после начала ИСТ или через 6 мес после окончания ПВТ. Сохранение авиремии в течение 6 мес после окончания ПВТ расценивали как устойчивый вирусологический ответ (УВО).
Полный клинический ответ (ремиссия) констатировали при снижении оценки по BVAS до 0, частичный — при снижении оценки по BVAS на 50% от исходной. Рецидив у больных с ремиссией регистрировали при возобновлении симптомов и увеличении оценки по BVAS более 0; у больных с частичным ответом — появлении новых симптомов, повышении оценки по BVAS на 50%. Полный иммунологический ответ констатировали при элиминации СКГ и нормализации уровней РФ и СН50, частичный — при снижении криокрита, РФ и повышении СН50.
Аналогичные результаты получены в некоторых зарубежных исследованиях, показавших более высокую частоту достижения ремиссии заболевания при лечении РТМ (58—83%), чем при применении традиционной терапии (8—16%) [12, 26, 27].
Оценка эффективности ПВТ проведена в 25 наблюдениях, в 18 из которых применялась комбинированная ПВТ препаратами пегилированного ИНФ-α и рибавирина, в 7 — монотерапия ИНФ-α. Изолированная ПВТ применялась, как правило, при низкой активности васкулита и в отсутствие других сопутствующих аутоиммунных синдромов. Оценки по BVAS до ПВТ колебались от 0 до 16 баллов, составив в среднем 6,4±4,5 балла.
Отсутствие клинического ответа (у 4 больных) или обострение васкулита, потребовавшие отмены ПВТ (у 4 больных), ассоциировались с исходно более высокой активностью васкулита (средняя оценка по BVAS у этих 8 больных статистически значимо выше, чем у больных, достигших клинического ответа: 10,38±6,5 балла против 4,82±3,7 балла; р=0,037) и/или монотерапии ИФН-α.
Эти данные согласуются с мировым опытом комбинированной терапии ИФН-α и рибавирином у больных КВ HСV, показавшим достижение ремиссии у 44—73% больных, а также зависимость клинического ответа на ПВТ от степени активности васкулита [10, 28, 29]. Хорошо известны иммуностимулирующие эффекты ИФН-α, которые обусловливают риск обострения КВ (чаще поражения почек, невропатии, язвенно-некротического кожного васкулита) и сочетаются с СКГ аутоиммунных синдромов, что ограничивает применение ПВТ, содержащей ИФН-α [10, 16, 17, 28, 29]. У больных с тяжелыми формами васкулита ПВТ, содержащая ИФН-α, может назначаться только после снижения активности васкулита в результате ИСТ [11, 16, 17].
У 6 из 25 больных, имевших до лечения оценки по BVAS 19,0±5,7 балла, ПВТ проводилась после курса лечения РТМ. Снижение оценок по BVAS до 2,6±0,8 балла в результате терапии РТМ позволило провести ПВТ в полном объеме и без развития обострений, а также добиться УВО у 3 (50%) и клинического ответа у 5 (83,3%) больных. У одного них достигнута ремиссия В-НХЛ.
В других работах также показано преимущество сочетанной терапии (РТМ + ПВТ) по сравнению с изолированной ПВТ. Преимущество заключается не только в снижении риска обострения при проведении ПВТ, содержащей ИФН-α, но и в более быстром достижении клинической ремиссии, в том числе поражения почек, В-НХЛ (исходно низкой степени злокачественности) и иммунологического ответа [11, 27, 30, 31].
Внедрение в клиническую практику новых схем ПВТ препаратами прямого противовирусного действия (ППВД) без включения ИФН-α позволит проводить безопасное лечение больных с активными формами васкулита и в случаях сочетания васкулита с другими аутоиммунными синдромами. Обнадеживающие результаты получены в первых работах, оценивающих эффективность терапии ППВД (изолированно и в сочетании с РТМ) [32].
Течение заболевания после ИСТ и/или ПВТ оценено в нашей работе у 37 из 60 больных, длительность наблюдения за которыми составила от 6 мес до 20 лет (в среднем 3,5±4,1 года). Отдаленные результаты лечения после ПВТ были лучше, чем после ИСТ: частота развития рецидива васкулита после ПВТ была более чем в 3 раза ниже, а длительность ремиссии значительно больше (рис. 2).

Рис. 2. Частота развития рецидива после достижения ремиссии васкулита (а) и длительность ремиссии (б) при проведении ПВТ (n=14) и ИСТ (n=23).
Различия по частоте развития рецидива и длительности ремиссии в группах лечения РТМ и ГКС (66,7% против 78,9% и 9,3±4,3 мес против 7,8±9,5 мес соответственно) статистически не значимы. Однако, как и в других исследованиях, при лечении ГКС ремиссия была, как правило, частичной, а рецидивы развивались на фоне продолжающейся терапии. При применении РТМ рецидивы наблюдаются после отмены лечения и достижения ремиссии. При этом повторные курсы терапии РТМ, согласно нашим наблюдениям и результатам зарубежных исследований [26, 27], способны вновь привести к ремиссии или предотвратить рецидив.
Длительное наблюдение за больными КВ HСV после достижения УВО и клинической ремиссии в результате ПВТ показало, что у отдельных больных сохраняется СКГ. У 3 больных мы наблюдали развитие рецидива васкулита и/или В-НХЛ, несмотря на авиремию (2 из этих наблюдений описаны нами ранее [21, 22]). В исследованиях с применением высокочувствительных и высокоспецифичных методов ПЦР не доказано наличие латентной HСV-инфекции в В-лимфоцитах после достижения УВО, в том числе при рецидивах СКГ и васкулита [33, 34]. В качестве причины таких рецидивов рассматривается отсутствие ответа на терапию на молекулярном уровне и сохранение индуцированной HСV олиго/моноклональной пролиферация В-лимфоцитов после элиминации вируса [10, 16]. Важной является информация, что некоторые тяжелые поражения (двигательная невропатия, почечная недостаточность, В-НХЛ) у ряда больных не исчезают полностью даже после успешной ПВТ [35]. Представленные данные обусловливают необходимость как можно более раннего лечения HСV-инфекции, а также пожизненного наблюдения всех больных КВ (независимо от стадии фиброза печени) после достижения элиминации HСV.
Умерли 16 из 60 больных; 5- и 10-летняя выживаемость 60 больных КВ составила 72,8 и 58,7% соответственно. Прогрессирующее поражение печени с развитием кровотечения из вен пищевода и/или печеночно-клеточной недостаточности служило причинной смерти 4 (25%) больных. Более частыми причинами смерти являлись осложнения васкулита (сердечно-сосудистые осложнения у больных с поражением почек, легочный васкулит, поражение ЖКТ) и инфекции, как правило, развившиеся в связи с применением ГКС (пневмония, сепсис) у 6 (37,5%) и 6 (37,5%) больных соответственно.
Оценено влияние ряда клинических факторов, а также вариантов лечения на частоту достижения ремиссии, риск рецидива и прогноз КВ HСV. По данным многофакторного регрессионного анализа, независимым фактором, отрицательно влияющим на достижение клинической ремиссии васкулита, являлось наличие тяжелых форм васкулита (BVAS ≥15 баллов) до лечения (отношение шансов — ОШ 0,090; р=0,005). Независимое положительное влияние на достижение ремиссии имела ПВТ (ОШ 7,173; р=0,003) и лечение РТМ (ОШ 14,014; р=0,004).
Независимыми факторами риска развития рецидива заболевания являются оценка по BVAS ≥15 баллов до лечения (ОШ 2,357; р=0,043) и применение терапии ГКС (ОШ 3,340; р=0,006). К факторам, негативно влияющим на прогноз, относятся возраст старше 55 лет (ОШ 4,485; р=0,01), ЦП (ОШ 3,678; р=0,035), почечная недостаточность (скорость клубочковой фильтрации — СКФ ≤70 мл/мин) (ОШ 4,662; р=0,015) и применение ГКС (ОШ 3,913; р=0,037). В единичных зарубежных работах также установлено независимое влияние данных факторов на прогноз заболевания. Помимо этого, показано повышение выживаемости больных в последнее десятилетие, что связывают с изменением подходов к лечению КВ HСV — с отказом от практики длительного применения ГКС, с применением РТМ и ПВТ, а также с повышением эффективности ПВТ в отношении элиминации HVС [13, 36].
Заключение
КВ-HСV, диагностированный у 5% больных ХГС, характеризуется высокой вариабельностью клинических проявлений и тяжести течения. Тяжесть васкулита (оценки по BVAS ≥15 баллов), а также отдельных его проявлений (язвенно-некротический кожный васкулит, двигательная полиневропатия, поражения почек c нефротическим синдромом и/или снижением СКФ ≤70 мл/мин) определяют эффективность лечения и прогноз.
Выбор адекватной и персонифицированной терапии обусловливает необходимость максимально полного обследования пациентов с целью оценки вовлеченности различных органов и систем, активности КВ, а также наличия В-НХЛ, других аутоиммунных синдромов и заболеваний.
Преимущество ПВТ в отношении отдаленных результатов лечения обосновывают ее применение в качестве терапии выбора у всех больных КВ HСV. Однако ПВТ, содержащая ИФН-α, может назначаться в качестве терапии первого ряда только больным с нетяжелыми формами васкулита (оценка по BVAS
У больных тяжелым васкулитом ПВТ, содержащая ИФН-α, может проводиться только после снижения активности заболевания в результате ИСТ. Наиболее эффективна сочетанная терапия — РТМ с последующей ПВТ. Терапия ГКС (± циклофосфамид) показана при угрожающих жизни состояниях в виде коротких курсов и может сочетаться с применением РТМ. Длительное применение ГКС нецелесообразно в связи с риском развития осложнений и ухудшением прогноза.
Внедрение в клиническую практику высокоэффективной и безопасной терапии ППВД и ее сочетание с РТМ у больных с тяжелыми формами КВ HСV позволит улучшить прогноз заболевания.

Обновлено: 01.11.2021

ЗАПИСАТЬСЯ НА ПРИЁМ
Бесплатная консультация или второе мнение врача-хирурга перед операцией в Клиническом госпитале на Яузе! подробнее
Получите консультацию ревматолога
Обслуживание на двух языках: русский, английский.
Оставьте свой номер телефона, и мы обязательно перезвоним вам.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначить только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Статья проверена терапевтом-ревматологом Бородиным О.О., носит общий информационный характер, не заменяет консультацию специалиста.
Для рекомендаций по диагностике и лечению необходима консультация врача.
- В Клиническом госпитале на Яузе для диагностики геморрагического васкулита (болезни Шенлейна-Геноха, пурпуры) применяются лабораторные (коагулограмма, повышение уровня фермента антистрептолизина-О, IgA) и инструментальные (биопсия) методы исследования.
- По результатам обследования, а также с учетом клинической картины заболевания ревматолог разработает для пациента индивидуальную схему лечения, при необходимости с применением инновационных методов экстракорпоральной гемокоррекции.
- 140 случаев на 1 миллион населения — частота заболеваемости геморрагическим васкулитом
- Более 60% случаев ГВ у взрослых сопровождаются вовлечением в процесс суставов, 50% — почек, 65% — пищеварительного тракта
- В 95% случаев своевременное лечение болезни Шенелейн-Геноха способствует полному выздоровлению пациента
О развитии заболевания
Геморрагическим васкулитом или болезнью Шенелейн-Геноха называют заболевание, при котором происходит аутоиммунное поражение мелких артерий — они становятся хрупкими, повышается их проницаемость, что вызывает нарушение микроциркуляции, микротромбозы, множественные мелкие кровоизлияния (геморрагии) как в коже (геморрагические высыпания на коже и слизистых), так и во внутренних органах (желудочно-кишечном тракте, почках, суставах).
Чаще заболевание развивается в детском возрасте однако может поражать и взрослых. Мальчики болеют в 1,5 раза чаще, чем девочки.
Причины
Точная причина геморрагического васкулита (ГВ) до сих пор не выяснена, однако, большинство ученых склоняется к мультиэтиологической теории развития патологии. Ведущими факторами, провоцирующими развитие болезни, считаются:
- вирусные и бактериальные инфекции,
- хронические инфекции,
- пищевая или медикаментозная аллергия,
- вакцины.
Упомянутые причины провоцируют сбой в работе иммунной системы, которая начинает продуцировать патогенные иммунные комплексы (IgA), поражающие внутреннюю оболочку мелких сосудов и способствующие развитию её воспаления, микротромбозов.
Симптомы геморрагического васкулита
Различают несколько форм ГВ:
- Кожная или простая: характеризуется появлением специфической зудящей сыпи на нижних конечностях и ягодицах (небольшие точечные кровоизлияния, возвышающиеся над кожей и не исчезающие при надавливании). Со временем красная сыпь темнеет и исчезает, оставляя очаги повышенной пигментации.
- Суставная: пациенты жалуются на боли в области крупных суставов (коленных, локтевых, тазобедренных), их отек и дисфункцию.
- Абдоминальная: тошнота и рвота, сильные боли в животе (зачастую схваткообразные), возможны кишечные кровотечения, развитие гангрены кишечника (из-за тромбозов).
- Почечная: моча приобретает розовый или красный цвет из-за примеси эритроцитов, уменьшается ее количество, в анализах появляется белок, что является признаками развития гломерулонефрита и появлением угрозы развития хронической почечной недостаточности.
- Молниеносная: характеризуется развитием ДВС-синдрома и высокой кровопотерей.
Диагностика геморрагического васкулита
В Клиническом госпитале на Яузе пациентам с подозрением на болезни Шенлейн-Геноха назначают следующий комплекс обследований:
- общий анализ крови;
- общий анализ мочи;
- коагулограмму;
- определение уровня антистрептолизина-О, IGA в периферической крови;
- биопсию тканей пораженного органа или части тела с последующим гистологическим исследованием биоптата.
Для постановки диагноза геморрагического васкулита необходимо присутствие у пациента двух и более диагностических критериев:
- специфические высыпания, не связанные с низким уровнем тромбоцитов;
- манифест заболевания в возрасте до 20 лет;
- распространенные боли в животе, которые усиливаются после приема пищи, кишечные кровотечения;
- гранулоцитарная инфильтрация стенок сосудов микроциркуляторного русла, которая подтверждена гистологически.
Терапевтические мероприятия
В Клиническом госпитале на Яузе лечение геморрагического васкулита направлено на достижение следующих целей:
- устранение клинических признаков патологии;
- снижение риска развития осложнений;
- предотвращение поражения жизненно важных органов;
- полное выздоровление пациента или достижение устойчивой длительной ремиссии.
Для этого наш ревматолог разрабатывает для каждого пациента индивидуальную схему терапии, которая включает:
- постельный режим сроком не менее 3 недель;
- исключение контакта с аллергенами;
- диетотерапию;
- назначение энтеросорбентов, антигистаминных препаратов, спазмолитиков, кровоостанавливающих средств и антиаггрегантов;
- в некоторых случаях оправдано использование гормонов и цитостатиков.
Чтобы уменьшить деструктивное влияние циркулирующих иммунных комплексов и усилить эффективность медикаментозной терапии, пациентам с ГВ проводят экстракорпоральную гемокоррекцию.
Преимущества методов ЭГ
ЭГ показана уже в самом начале клинических проявлений. Рано начатое лечение методами гемокоррекции эффективно профилактирует развитие серьезных осложнений и позволяет достигать быстрой и длительной ремиссии заболевания, что благоприятно сказывается на трудоспособности пациента и качестве его жизни.
Данный способ лечения позволяет:
- уменьшить активность или быстро купировать патологический процесс и, тем самым, снизить риск развития осложнений при геморрагическом васкулите со стороны почек, суставов,
- ускорить исчезновение клинических проявлений со стороны кожи, почек, ЖКТ, суставов и т.д.
- улучшить кровоснабжение пораженных органов,
- увеличить восприимчивость организма к лекарствам, включая гормональные препараты, позволяя снизить их дозировку (вплоть до отмены).
Для терапии ГВ показаны следующие методы экстракорпоральной гемокоррекции:
- криоаферез;
- каскадная фильтрация плазмы;
- иммуносорбция;
- высокообъемный плазмообмен;
- экстракорпоральная фармакотерапия;
- фотоферез.
Показаниями к ЭГ считаются: наличие поражения сосудов, подтвержденного биопсией, абдоминальный синдром, неэффективность медикаментозной терапии, побочное действие или осложнения при использовании лекарственных средств.
При подозрении или подтверждённом диагнозе геморрагического васкулита запишитесь на прием к ревматологу Клинического госпиталя на Яузе. Наши ревматологи проводят комплексную диагностику и лечение ГВ с применением самых эффективных инновационных методов, добиваясь лучших результатов.
Цены на услуги Вы можете посмотреть в прайсе или уточнить по телефону, указанному на сайте.
Цены на услуги ревматолога
- Стандартные консультации
- Прием (осмотр, консультация) врача-ревматолога первичный 3 900 руб.
- Прием (осмотр, консультация) врача-ревматолога повторный 3 600 руб.
- Консультации экспертов
- Прием (осмотр, консультация) врача-ревматолога Бородина О.О. 7 000 руб.
- Телеконсультации
- Удаленная консультация врача-ревматолога первичная 2 500 руб.
- Удаленная консультация врача-ревматолога повторная 2 500 руб.
- Помощь на дому
- Прием (осмотр, консультация) врача-терапевта с выездом на дом в пределах МКАД 10 500 руб.
Внимание! Цены на сайте могут отличаться.
Пожалуйста, уточняйте актуальную стоимость у администраторов по телефону.
Наши специалисты:

БородинОлег Олегович Врач-ревматолог
Прием пациентов с 16 лет
Стоимость приема: 7000 ₽
Читайте также:

