Вирус что может поразить в голове
Обновлено: 25.04.2024
Классификация инфекций головного мозга (ЦНС)
а) Классификация. Инфекционные заболевания можно разделить на врожденные/неонатальные и приобретенные. Эти категории, в свою очередь, могут быть подразделены на подгруппы на основании этиологии, например, бактериальные, вирусные, грибковые, паразитические заболевания и риккетсиозы.
Инфекционные болезни могут манифестировать в различных формах в зависимости от остроты процесса. Для некоторых заболеваний, например герпеса и энцефалита, характерно острое и молниеносное течение. Другие протекают в подострой или хронической форме (например, подострый склеротический панэнцефалит (ПСПЭ) и энцефалит Расмуссена).
б) Врожденные/неонатальные инфекционные заболевания:
1. Терминология. Врожденные инфекции головного мозга часто группируют вместе и просто именуют TORCH-инфекциями (сокращение от первых букв англоязычных терминов токсоплазмоза, краснухи, цитомегаловирусной и герпетической инфекций). При включении в эту группу сифилиса ее называютTORCH(S) или (S)TORCH.
Среди других врожденных инфекций выделяют синдром приобретенного иммунодефицита человека (СПИД) и лимфоцитарный хориоменингит (ЛХМ). Примерно 40% беременностей у ВИЧ-лоложительных матерей протекают с вертикальной передачей вируса плоду, но эта цифра значительно снижается при ВААРТ матерей и родоразрешении методом кесарева сечения.
2. Этиология. Большинство врожденных инфекционных заболеваний передается плоду трансплацентарным путем за исключением вируса герпеса, который передается ребенку во время родов. Большинство из них, за исключением двух (токсоплазмоза и сифилиса), имеют вирусную природу. Все они встречаются относительно редко за возможным исключением цитомегаловирусной инфекции (ЦМВИ) и герпетического энцефалита.
3. Патология. Трансплацентарная передача различных патогенов проявляется в виде ряда признаков, которые зависят как от инфекционного агента, так и времени инфицирования. Если инфицирование происходит на ранних этапах эмбрионального развития (например, в первом триместре), то наблюдается тенденция к невынашиванию или формированию врожденных пороков развития.
У выживших младенцев наблюдаются такие пороки развития, как нарушение миграции клеток и шизэнцефалия. При инфицировании на более поздних сроках преобладают энцефалокластические проявления. Встречается микроцефалия с явной деструкцией мозговой ткани и распространенной энцефаломаляцией. Для ЦМВИ, токсоплазмоза, ВИЧ-инфекции и врожденной краснухи характерны дистрофические паренхиматозные кальцификаты.

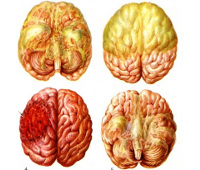
(а) Полученный при аутопсии макропрепарат головного мозга пациента, погибшего от острого бактериального менингита, крупный план: обратите внимание на вязкий гнойный экссудат, который заполняет борозды. Наблюдается отечность и диффузное набухание нижележащих извилин. Мягкая мозговая оболочка воспалена и гиперемирована, хорошо выражены кортикальные сосуды.
(б) При аутопсии определяются множественные пиогенные абсцессы. Разрыв крупного абсцесса, расположенного в глубоком белом веществе головного мозга, в полость желудочков привел к развитию вентрикулита.
в) Приобретенные инфекционные/воспалительные заболевания:
1. Бактериальные инфекции. Бактериальные патогены, которые часто приводят к развитию менингита, включают в себя Streptococcus pneumoniae, Neisseria meningitidis, Haemophilus influenzae, Listeria monocytogenes, Streptococcus В и E. coli.
- Менингит. Гнойный экссудат преимущественно в базальных цистернах является частым патологическим признаком менингита вне зависимости от специфического инфекционного агента. Экссудат может заполнять цистерны и субарахноидальные пространства. Контрастирование мягкой мозговой оболочки и субарахноидального пространства является наиболее частой находкой при диагностической визуализации. Часто развиваются такие осложнения, как гидроцефалия, эмпиема и васкулит с наличием или отсутствием инфаркта ткани головного мозга.
- Абсцесс. Абсцессы проходят четыре общие стадии развития: ранний и поздний церебрит и ранняя и поздняя инкапсуляция. На стадии раннего церебрита присутствует еще не локализованный очаг инфекции. Формируется неинкапсулированное объемное образование, состоящее из воспалительных клеток, отека, очагов некроза и петехиальных кровоизлияний. На стадии позднего церебрита очаги инфекции сливаются. Наблюдается центральный некроз со слабо очерченным ободком из воспалительных клеток, грануляционной ткани и фибробластов. За стадией позднего церебрита следует стадия ранней инкапсуляции.
2. Вирусные инфекции:
- Острые вирусные инфекции. Герпетический энцефалит (ГЭ) является наиболее частым неэпидемическим вирусным энцефалитом. Более 95% из них вызваны ВПГ-1 (оральный вирус герпеса). В настоящее время большинство эпидемических вирусных энцефалитов вызваны вирусом лихорадки западного Нила.
- Подострая и хроническая вирусная инфекция. Для многих вирусов характерен длительный инкубационный период и прогрессирование симптомов на протяжении нескольких месяцев или даже лет. Примером служит подострый склерозирующий панэнцефалит (ПСПЭ). Другим примером является прогрессирующая мультифокальная лейкоэнцефалопатия (ПМЛ), которая наблюдается при инфицировании вирусом JC (убиквитарный полиомавирус).

(а) Макропрепарат голов -ного мозга, полученный при аутопсии: определяются классические признаки острого герпетического энцефалита. Обратите внимание на склонность данной инфекции поражать лимбическую систему, что в данном случае представлено зонами геморрагического некроза в лобной доле и субфронтальной коре.
(б) Макропрепарат головного мозга, полученный при аутопсии: острый геморрагический некротический энцефалит, предположительно вирусной этиологии. Для многих неэпидемических вирусных энцефалитов характерна склонность к поражению базальных ганглиев, таламуса, среднего мозга и моста.
3. Другие инфекционные заболевания:
- Парабиозы. Нейроцистицеркоз (НЦЦ) стал самой распространенной паразитарной инфекцией ЦНС и самой частой причиной эпилепсии во всем мире. Несмотря на то, что большинство паразитов редко вызывают поражение головного мозга, оно рано или поздно возникает у большинства пациентов, инфицированных НЦЦ.
- Грибковые заболевания. Грибы распространены повсеместно и эндемичны для любой области земного шара. Большинство из них, например Aspergillus, инфицируют человека нечасто, в основном при вдыхании или при колотых ранениях. При возникновении грибкового заболевания у иммунокомпетентных лиц легкие поражаются чаще, чем головной мозг. Микозы ЦНС и диссеминированные системные микозы обычно развиваются у иммунокомпрометированных лиц. ВИЧ/СПИД и иммуносупрессивная терапия являются факторами, значительно увеличивающими предрасположенность пациента к оппортунистическим заболеваниям.
- Риккетсиозы, такие как пятнистая лихорадка Скалистых гор и Средиземноморская пятнистая лихорадка, обычно проявляются кожными высыпаниями. Инфицирование ЦНС встречается нечасто. Если же оно происходит, то для риккетсий характерна выраженная тропность к периваскулярным пространствам и возникновение инфарктоподобных поражений в базальных ганглиях.
- Спирохетозы. Спирохеты относятся к грамотрицательному типу бактерий. Среди этой группы патогенов сифилис и болезнь Лайма, вызываемые бактериями Treponema pallidum и Borrelia burgdorferi соответственно, встречаются наиболее часто. В США болезнь Лайма является наиболее частой трансмиссивной (клещевой) инфекцией. Нейроборрелиоз Лайма - вторичное поражение нервной системы на фоне системной инфекции, вызванной Borrelia burgdorferi.

(а) Макропрепарат голов -ною мозга, полученный при аутопсии: наблюдается туберкулезный менингит (ТБМ). ТБМ обычно характеризуется появлением вязких гноеподобных экссудатов, которые склонны располагаться в базальных цистернах. Визуализационная и патологоанатомическая картины при менингите в целом схожи вне зависимости от этиологии процесса.
(б) Макропрепарат головного мозга, полученный при аутопсии: определяются две нейроцистицеркозные кисты, расположенные в поверхностных бороздах. Нейроцистицеркозные кисты церебральной локализации наиболее часто расположены в субарахноидальных пространствах.
Виды инфекций головного мозга
Все многообразие нейроинфекций, поражающих головной мозг можно разделить на пять групп:
- бактериальные;
- паразитарные;
- вирусные;
- прионные;
- грибковые.
Бактериальные инфекции
- повреждении костей черепа, с нарушением целостности оболочек мозга;
- заносе возбудителей во время нейрохирургической операции;
- наличии гнойного очага в организме и ослабленный иммунитет.
Однако с другими возбудителями дело обстоит иначе.
Менингококковая инфекция – традиционная нейроинфекция, которая поражает головной мозг. Пик заболеваемости отмечается в осенне- зимний период, когда иммунная система из-за частых переохлаждений человека и нехватки витаминов снижена.
Если иммунная система в норме, то вы ограничитесь обычным назофарингитом, в обратном случае – вероятность заполучить менингит или менингоэнцефалит возрастает.
Симптомы менингококковой инфекции
- лихорадка,
- повышение температуры тела до 39-40° С.
- озноб,
- головная боль
- слабость
- напряжение мышц шеи
- тошнота,
- рвота,
- Выступающая над поверхностью кожи сыпь красно-фиолетового цвета, элементы которой напоминают по форме звезду
- Заболевание начинается очень остро (часто можно указать конкретное время (час), когда человек заболел)
- В течение 24-х часов, пока человек в сознании должно начаться лечение, в противном случае он может впасть в кому.
Микобактерии туберкулеза кроме в всего прочего могут поражать и головной мозг.
Чаще болеют дети, пожилые люди и лица страдающие иммунодефицитом.
После присоединяются неврологические нарушения – парезы и параличи лицевого нерва, глазодвигательной мускулатуры, головокружения. На фоне неврологических расстройств возникают нарушения психики.
Нейросифилис, сейчас почти не встречается, но до открытия пенициллина составлял основу работы неврологов. Нейросифилис бывает нескольких видов:
Неприятной особенностью заболевания является его трудная диагностика.
Вирусные и прионные инфекции
Существует огромное множество вирусов –возбудителей острых энцефалитов (комариный, клещевой, эпидемический), в общем они отличаются переносчиками и географией распространения.
- парезы
- параличи дыхательной мускулатуры
- параличи конечностей,
- параличи лицевой мускулатуры и пр.
Огромную опасность могут составлять бешенство и медленные инфекции, в связи с чем, им уделяется особое внимание.
Бешенство.
Бешенством могут страдать практически все млекопитающие. Источником появления инфекции обычно служат собаки, волки, лисицы и именно через укус зараженных животных к человеку и передается эта опасная инфекция.
Симптомы:
- гидро и аэрофобия
- судороги
- приступы агрессивного поведения.
Экстренная вакцинопрофилактика после укуса – это единственный способ выздороветь, поэтому дожидаться развития первых симптомов заболевания запрещено, поскольку это может говорить только о том, что человека уже не спасти.
Медленные инфекции – вирусные нейроинфекции, которые имеют способность длительное время бессимптомно находиться в нервной ткани человека, с последующим развитием заболевания.
Учеными были выведены четыре главных признака, отличающих медленные инфекции:
- необычно продолжительный (месяцы и годы) инкубационный период;
- медленно прогрессирующий характер течения;
- необычность поражения органов и тканей;
- неизбежность смертельного исхода.
Возбудители вируса - краснуха и корь. По не до конца ясным причинам эти вирусы после перенесенного заболевания могут остаться в клетках головного мозга и через 4 и более лет вызывать заболевание. Оба вируса вызывают панэнцефалит со сходной симптоматикой:
· изменение личности с развитием деменции
· постепенный паралич всей поперечнополосатой мускулатуры.
К огромному сожалению, даже при лечении, последствия у этих нейроинфекций всегда одинаковы – летальный исход.
Существует четыре вида прионных нейроинфекций, и только с одной из них понятен механизм передачи. В некоторых племенах Папуа-Новая Гвинея часто отмечались случаи куру-куру из-за ранее распространенного ритуального каннибализма – поедания мозга родственников. Прионы вызывают спонгиформную энцефалопатию, то есть мозг превращается в подобие губки.
Паразитарные инфекции
Токсоплазмоз – паразитарное заболевание, характеризуется возможностью внутриутробного заражения, поражения нервной системы, глаз, скелетной мускулатуры и мышцы сердца, а также увеличением лимфоузлов, печени и селезенки.
Для возбудителя этого заболевания человек – промежуточный хозяин, а основной – кошки. При нормальном состоянии иммунитета заболевание никак не проявляется, но если человек страдает иммунодефицитом, то могут быть такие варианты заболевания:
- энцефалопатия, с развитием делирия, спутанности сознания вплоть до комы;
- менингоэнцефалит, со всеми своими классическими проявлениями;
- токсоплазменный абсцесс мозга, который проявляется общеинфекционными симптомами, очаговыми нарушениями, в зависимости от расположения, судорогами, нарушением сознания.
Наиболее тяжелые последствия токсоплазмоза – у беременных, так как он вызывает недоразвитие головного мозга плода.
Диагностика
Для того, чтобы диагностировать нейроинфекцию, в том числе головного мозга, используется комплекс мероприятий:
- общий анализ крови и мочи;
- биохимический анализ крови;
- анализ крови на антитела к вирусным, бактериальным и другим агентам;
- методы визуализации – МРТ;
Лечение
Несмотря на различие возбудителей, некоторые аспекты лечения совпадают во всех случаях.
Больным обязательно назначают постельный режим (при острых инфекциях), противовоспалительные препараты, детоксикационную терапию.
Меры предосторожности
Не употреблять в пищу сырое или недостаточно термически обработанное мясо, тщательно мыть руки после контакта с кошками.
Нейроинфекции – группа инфекционных патологий, которые вызываются бактериями, вирусами, грибками или простейшими, характеризуются преимущественной локализацией возбудителя в ЦНС и признаками поражения ее отделов. Клинические проявления представлены менингеальным, интоксикационным, ликвородинамическим синдромами, вегетососудистыми расстройствами. В процессе диагностики используются анамнестические данные, результаты физикального, общеклинического лабораторного, серологического, бактериологического или вирусологического исследования. В ходе лечения назначаются антибиотики или противовирусные препараты, патогенетические и симптоматические средства.
МКБ-10
Общие сведения
Нейроинфекции – сравнительно распространенная группа патологий. По данным статистики, инфекционные поражения ЦНС достигают 40% в структуре неврологической заболеваемости. Основную часть составляют бактериальные и вирусные менингиты, распространенность которых в различных географических регионах находится в пределах 5-12 случаев на 100 000 населения в год. Для большинства болезней, входящих в данную группу, характерна осенне-зимняя сезонность. Они могут встречаться среди всех возрастных категорий населения, но основную часть пациентов составляют дети до 10-12 лет и лица, не получившие вакцины согласно календарю прививок.

Причины нейроинфекций
Этиология инфекционного поражения структур центральной нервной системы зависит от вида заболевания. В большинстве эпизодов источником заражения становится больной или здоровый человек-носитель. Способствующими факторами являются постоянный контакт с большим количеством людей, ЧМТ, иммунодефицитные состояния, хронические соматические патологии, беспорядочная половая жизнь. Выделяют следующие механизмы инфицирования:
- Воздушно-капельный. Реализуется при кашле, чихании, разговоре. Характерен для возбудителей бактериальных и вирусных менингитов, энцефалитов, полиомиелита, герпетической инфекции.
- Контактно-бытовой. Подразумевает передачу инфекционного агента при прямом контакте с больным, носителем или инфицированными предметами быта. Это один из путей распространения герпес-вирусов, полиомиелита, сифилиса.
- Фекально-оральный. Тип передачи, при котором возбудитель выделяется вместе с испражнениями, проникает в организм с продуктами питаниями или водой. Может реализовываться при герпес-инфекции, вирусах ЕСНО и Коксаки, ботулизме, полиомиелите.
- Половой. При этом варианте заражение происходит во время полового акта через слизистые оболочки половых путей. Таким способом распространяется ВИЧ-инфекция, сифилис, реже – вирусы-возбудители менингитов, энцефалитов.
Патогенез
Для каждой формы нейроинфекции характерны свои патогенетические особенности, но механизмы развития большинства синдромов и симптомов, как правило, аналогичны при всех вариантах этой группы заболеваний. Инфекционный синдром обуславливают комплексы антиген-антитело и токсины возбудителей, которые оказывают деструктивное воздействие на ЦНС, провоцируя нарушения тонуса сосудов, метаболизма и гемодинамики в целом. Менингеальный синдром развивается при воспалительном поражении мозговых оболочек и повышении внутричерепного давления. Вегетативные расстройства вызываются как прямым контактом инфекционных агентов с центрами автономной нервной системы, так и опосредованным воздействием через внутричерепную гипертензию. Ликвородинамические изменения потенцируются усиленной продукцией спинномозговой жидкости на фоне раздражения сосудистых сплетений и блокадой пахионовых грануляций, усложняющей процесс ее резорбции.
Классификация
Использование систематизации обусловлено необходимостью объединить между собой большое количество разнородных инфекционных патологий с вовлечением нервной системы. В зависимости от характера морфологических изменений, клинических особенностей и конкретного возбудителя в неврологии различают несколько групп поражений ЦНС инфекционного происхождения. Основными вариантами нейроинфекций являются:
1. Энцефалиты. Заболевания с воспалением ткани головного мозга. Наиболее распространенными считаются клещевой, герпетический, ветряночный и краснушный энцефалиты. Проявления зависят от типа возбудителя, могут включать общемозговые, очаговые симптомы, системную интоксикацию разной степени выраженности.
2. Менингиты. Болезни, при которых наблюдается поражение мозговых оболочек. Характеризуются наличием менингеального и интоксикационного синдромов, с учетом особенностей воспалительного процесса подразделяются на:
- Гнойные. Провоцируются бактериями, простейшими или грибами, могут быть первичными либо вторичными. К первичным относятся менингиты, вызванные менингококком, пневмококками, гемофильной палочкой. Вторичные поражения являются осложнением гнойных процессов других локализаций – околоносовых пазух, среднего уха и пр.
- Серозные. Сопровождаются преимущественно лимфоцитарным плеоцитозом. В роли возбудителей выступают туберкулёзная палочка, вирус паротита, энтеровирусы Коксаки и ЕСНО.
3. Полиомиелит. Поражение ЦНС, вызванное РНК-содержащим вирусом полиомиелита. Может протекать в двух формах: непаралитической (менингеальной, абортивной, инаппарантной) и паралитической (спинальной, мостовой, бульбарной, энцефалитической).
4. Абсцесс головного мозга. Представляет собой ограниченное капсулой скопление гнойных масс в тканях мозга. Может иметь отогенное, риногенное, метастатическое или посттравматическое происхождение. Проявляется системной интоксикацией, очаговой неврологической симптоматикой, реже – эпилептическим и гипертензивным синдромами.
5. Опоясывающий лишай. Вариант хронической нейроинфекции, обусловленный герпесвирусом человека III типа – Варицелла-Зостер. Наблюдается персистенция возбудителя в спинномозговых ганглиях с активацией при снижении иммунитета или травмах. К основным симптомам относятся острая боль, герпетические высыпания в области 1-2 дерматомов.
6. Нейросифилис. Инфекционная патология, провоцируемая бледной трепонемой. На ранней стадии поражения ЦНС отмечаются общеинфекционные, общемозговые и очаговые симптомы с нарушением функций II, III, VI, VIII пар черепно-мозговых нервов. На поздних стадиях развивается прогрессирующая деменция, выявляются психические расстройства, инсультоподобная симптоматика.
7. Ботулизм. Инфекционное заболевание, вызываемое Clostridium botulinum и сопровождающееся прерыванием передачи нервных импульсов в холинэргических синапсах. Обнаруживаются признаки поражения двигательных ядер ствола мозга, передних рогов.
8. НейроСПИД. Обусловлено инфицированием вирусом иммунодефицита человека. Зачастую представлено первичными поражениями ЦНС: энцефалопатиями, рецидивирующими ВИЧ-менингитами, вакуолярной миелопатией. Проявления разнообразны, включают парезы, афазии, атаксию, мнестические расстройства, психопатологические нарушения.
Симптомы нейроинфекций
Менингальный синдром возникает при вовлечении в патологический процесс мозговых оболочек, состоит из общемозговой симптоматики, мышечно-тонических и корешковых симптомов. В первую группу входит интенсивная диффузная распирающая головная боль; фотофобия, повышенная чувствительность к звукам и свету, рвота без тошноты, не приносящая облегчения. Зачастую наблюдается нарушение сознания по типу галлюцинаций, бреда, оглушения, сопора. У детей возможны фебрильные судороги. Мышечно-тонические и радикулярные проявления включают в себя ригидность затылочных мышц, симптомы Кернига, Брудзинского, Лессажа, Гордона, Менделя, Бехтерева и др.
Вегетативно-сосудистые расстройства при нейроинфекциях могут носить симпатоадреналовый, вагоинсулярный или смешанный характер. В первом случае обнаруживается учащение сердечного ритма, повышение артериального давления, чрезмерная потливость и жажда, во втором – брадикардия, артериальная гипотония, обильное мочеиспускание. При смешанном варианте симптомы из разных групп сочетаются между собой. Нарушение нормальной циркуляции ликвора может протекать по гипертензивному и гипотензивному типу. Более характерной для нейроинфекций является внутричерепная гипертензия, сопровождающаяся угнетением сознания, судорожными и дислокационными синдромами.
Диагностика
Диагностическая программа при инфекциях ЦНС основывается на анамнезе, физикальном исследовании, общеклинических и специфических лабораторных тестах. Лучевые методы диагностики используются редко, зачастую – с целью дифференциации с объемными поражениями нервной системы. Программа обследования больного может включать следующие процедуры:
- Выяснение анамнеза. При общении с пациентом или его родственниками лечащий инфекционист или невролог осуществляет детализацию имеющихся жалоб, выясняет динамику их развития. Важную роль играет эпидемиологический анамнез – контакт с инфекционными больными или выезд за границу на протяжении последних 21 дней.
- Общий и неврологический статус. При осмотре врач определяет уровень сознания, изучает кожу и слизистые оболочки с целью поиска высыпаний, определяет частоту сердечных сокращений и артериальное давление. При установлении неврологического статуса специалист оценивает тонус затылочных мышц, выявляет специфические симптомы, характерные для различных неврологических синдромов.
- Общеклинические лабораторные тесты. В общем анализе крови помимо повышения СОЭ отмечаются следующие изменения: при бактериальной инфекции – высокий нейтрофильный лейкоцитоз, при вирусной – лейкоцитоз со смещением лейкоцитарной формулы вправо, при ВИЧ-инфекции и тяжелых иммунодефицитах – лейкопения. Показатели биохимического анализа крови зависят от сопутствующих поражений внутренних органов.
- Спинномозговая пункция. При нейроинфекциях существует два основных варианта изменений ликвора (белково-клеточных диссоциаций) – по гнойному и серозному типу. При первом типе СПЖ мутная, имеет определенный окрас (белый, желтоватый), наблюдается нейтрофильный плеоцитоз от 1 000, повышение уровня белка от 1,0 г/л. При серозной форме ликвор прозрачный, опалесцирует, при цитологическом исследовании обнаруживается лимфоцитарный плеоцитоз более 100, уровень белка составляет выше 0,4 г/л.
- Серологическое исследование. Заключается в определении повышенного уровня антител в крови при помощи реакций подавления гемагглютинации, связывания комплемента или нейтрализации. Применяется ИФА, в ходе которого выявляется специфический IgM к возбудителю. Проводится ПЦР для уточнения ДНК или РНК инфекционного агента.
- Вирусологическая или бактериологическая диагностика. Предполагает определение возбудителя заболевания в крови или спинномозговой жидкости пациента путем посева образцов на специфические питательные среды. После идентификации патогенного агента целесообразно уточнение чувствительности к основным антибактериальным препаратам.
Лечение нейроинфекций
Все нейроинфекции являются показанием к госпитализации больного в инфекционный или неврологический стационар. При тяжелом состоянии, необходимости непрерывного контроля жизненно важных функций (дыхание, сердцебиение), пациента транспортируют в отделение ОРИТ. Лечебная программа включает следующие мероприятия:
- Этиотропная терапия. Основной целью является элиминация возбудителя из организма больного. Вначале используются препараты широкого спектра действия. После получения результатов серологического и бактериологического исследований медикаменты заменяют антибактериальными или противовирусными средствами, к которым выявленный возбудитель проявил наибольшую чувствительность.
- Патогенетические препараты. Применяются для борьбы с системной интоксикацией, отеком головного мозга и нарушениями гомеостаза, для коррекции водно-электролитного баланса, десенсибилизации и стимуляции иммунитета. Назначаются плазмозаменители, диуретики, глюкокортикостероиды, антигистаминные средства, интерфероны, донорские и искусственные иммуноглобулины, антикоагулянты.
- Симптоматические средства. К этой категории относятся медикаменты, купирующие отдельные симптомы и улучшающие общее состояние больного: анальгетики, жаропонижающие, противорвотные медикаменты, антиконвульсанты, нейролептики.
- Хирургическое лечение. Характер оперативного вмешательства зависит от обнаруженных изменений. Операция может потребоваться в случае абсцесса, туберкуломы головного мозга, компрессии спинного мозга при туберкулезном спондилите, больших областях некроза при опоясывающем лишае.
Прогноз и профилактика
Исход нейроинфекции определяется типом заболевания, общим состоянием больного, своевременностью и полноценностью лечения. В большинстве случаев вовремя поставленный диагноз и адекватная терапия позволяют сохранить жизнь пациента, минимизировать риск развития осложнений. При некоторых формах нейроинфекций, например – энцефалитах, летальность достигает 50-80%. Специфическая профилактика представлена вакцинами против конкретных возбудителей: вирусов герпеса, ботулизма, клещевого энцефалита, кори, полиомиелита, менингококка и т. д. Неспецифические превентивные мероприятия направлены на укрепление иммунитета, своевременное лечение иммунодефицитных состояний и предотвращение контакта с потенциальными носителями инфекционных заболеваний.
1. Инфекционные поражения головного мозга: учебное пособие/ Гладкий П.А., Сергеева И.Г., Тулупов А.А. – 2015.

Инфицирование нейротропными вирусами, а также местные индуцированные иммунные реакции могут необратимо нарушить сложную структурную и функциональную архитектуру ЦНС, часто оставляя пациента с неблагоприятным или фатальным прогнозом. Помимо немедленных и прямых эффектов, существует несколько неврологических расстройств, часто связанных с аутоиммунными механизмами, которые, как предполагается, являются отсроченными вирусными расстройствами: рассеянный склероз, синдром Гийена-Барре, нарколепсия и летаргический энцефалит. Нейротропные патогены могут попадать в головной мозг различными путями, включая ретроградный аксональный транспорт по двигательным и обонятельным нейронам, гематогенное распространение через гематоэнцефалический барьер (ГЭБ), менингеально-спинномозговой барьер, путем прямого инфицирования эндотелиальных клеток или путем распространения инфицированных лейкоцитов через ГЭБ в паренхиму головного мозга. Существует неудовлетворенная потребность в понимании механизмов, которые приводят к нейропатологическим или иммунопатологическим изменениям, возникающим после проникновения вируса в ЦНС или другие части тела, и клинических проявлений, связанных с этими изменениями.
Ниже описан ряд нейротропных вирусов
Альфавирусы
Род Alphavirus группы Togaviridae семейство включает группу оболочечных одноцепочечных РНК-вирусов с положительным смыслом, большинство из которых передаются комарами. Как правило, инфицирование людей альфавирусами , такими как O'nyong-nyong и вирус реки Росс, проявляется лихорадкой, макуло-папулезной сыпью и полиартритом, тогда как заражение вирусами энцефалита лошадей нового мира (EEV) может привести к потенциально летальному энцефалиту. К энцефалитным альфавирусам, вызывающим озабоченность общественного здравоохранения, относятся альфавирусы нового мира, вирус восточного энцефалита лошадей (EEEV), вирус венесуэльского энцефалита лошадей (VEEV) и вирус западного энцефалита лошадей (WEEV). Совсем недавно вирус Чикунгунья Старого Света (CHIKV) также был связан с энцефалитом. Учитывая, что случаи WEEV стали редкими и спорадическими, в этой главе основное внимание уделяется неврологическим проявлениям EEEV.
Герпесвирусы
Герпесвирусы представляет собой древнее семейство оболочечных двухцепочечных ДНК-вирусов, широко распространенных в животном мире. На основании геномных и биологических свойств герпесвирусы делятся на три подсемейства: α-, β- и γ-вирусы. Альфа-герпесвирусы имеют короткий репродуктивный цикл и устанавливают латентный период в нейронах сенсорных ганглиев. Бета- и гамма-герпесвирусы имеют более ограниченный диапазон типов клеток и относительно медленно реплицируются в клеточной культуре. В то время как бета-герпесвирусы могут сохранять латентность во многих типах клеток и органах (например, в секреторных железах, лимфоцитах и почках), гамма-герпесвирусы ограничены определенными субпопуляциями лимфоцитов, включая В- и Т-клетки. Среди восьми вирусов герпеса человека (HHV) подсемейство альфа включает вирусы простого герпеса типа 1 (HSV-1) и -2 (HSV-2) и вирус ветряной оспы (VZV). Цитомегаловирус человека (ЦМВ) и вирусы розеолы HHV-6 и -7 принадлежат к бета-подсемейству, а онкогенное гамма-подсемейство состоит из вирусов Эпштейна-Барр (EBV) и HHV-8. Первичная инфекция HHV, обычно в раннем детстве через орофациальный путь, как правило, протекает бессимптомно или в легкой форме (например, ветряная оспа и детская розеола, вызванная VZV и HHV-6 соответственно) и не требует терапии. Отличительной чертой герпесвирусов является установление пожизненной латентности в определенных типах клеток и прерывистая реактивация, приводящая к бессимптомному выделению вируса или рецидиву заболевания. В то время как врожденный иммунитет предотвращает распространение вируса во время первичной инфекции, адаптивный иммунитет имеет решающее значение для контроля латентного периода. Следовательно, тяжелые HHV-инфекции чаще встречаются у взрослых, ранее не инфицированных HHV, и у пациентов с ослабленным иммунитетом, но также связаны с анатомическим очагом инфекции. Инфицирование HHV иммунно-привилегированных участков, таких как ЦНС и глаза, может привести к потенциальным заболеваниям, угрожающим зрению или даже жизни, соответственно. В то время как HSV и VZV попадают в ЦНС трансаксональным путем, остальные шесть HHV распространяются в мозг гематогенным путем внутри лимфоцитов. Высокая распространенность инфекций HHV во всем мире свидетельствует об их потенциальной этиопатогенной роли в заболеваниях ЦНС, которые могут быть монофазными, рецидивирующими или даже хроническими. представляют интерес клинические и патологические особенности ключевых HHVs, связанных с дисфункцией ЦНС.
Вирус простого герпеса
HSV-инфекция, вызванная первичной или реактивацией латентного вируса, является наиболее частой причиной инфекционного энцефалита у людей . Инкубационный период HSV-1 после первичной инфекции составляет 2–12 дней, тогда как у HSV-2 инкубационный период у восприимчивых лиц составляет 3–7 дней. HSV-1 является причиной до 90% случаев HSV-энцефалита (HSE), в то время как HSV-2 встречается реже и чаще проявляется клинически как менингит. Предрасполагающими факторами являются сахарный диабет, злокачественные новообразования и состояния, нарушающие иммунную систему. Интересно, что дефекты в TLR3-интерфероне (IFN) и интерферон-зависимых путях предрасполагают к ВПГ-энцефалиту, особенно у детей. Таким образом, TLR3-опосредованный иммунный ответ в ЦНС может играть важную роль в борьбе с локальной инфекцией HSV. Клинически у пациентов с HSE наблюдаются головная боль, лихорадка и изменение психического состояния, такое как спутанность сознания, психоз, а также изменение сознания от сонливости до ступора и комы. При предрасположенности HSV к поражению лобных и височных долей у пациентов с HSE также могут быть судороги. У пациентов с ослабленным иммунитетом HSE может быть атипичным, заболевание может быстро развиваться и угрожать жизни. МРТ-сканирование пациентов с HSE часто показывает гиперинтенсивность на флэр- и Т2-взвешенных изображениях, соответствующую цитотоксическому отеку в этих областях
Цитомегаловирус человека (ЦМВ) имеет самый большой геном среди HHV и вызывает множество заболеваний, от самоизлечивающихся до летальных с клиническими симптомами, проявляющимися у некоторых пациентов через 3–12 недель после заражения. Неврологические расстройства, вызванные ЦМВ, в основном у пациентов с иммуносупрессией из-за реактивации ЦМВ, включают пояснично-крестцовый полирадикуломиелит, продольный обширный поперечный миелит и энцефалит . До появления АRТ ЦМВ был наиболее частой оппортунистической инфекцией ЦНС у больных СПИДом. Неврологические заболевания ЦМВ, особенно энцефалит, трудно диагностировать из-за атипичных клинических и нейровизуализационных особенностей. Исследования тканей головного мозга, пораженных HCMV, показывают, что базальные ганглии, промежуточный мозг и ствол головного мозга являются основными местами инфицирования HCMV. Анализ in situ показал, что большинство цитомегалических клеток происходит из инфицированных астроцитов, но HCMV также был обнаружен в нейронах, астроцитах, олигодендроцитах, эпендиме, сосудистом сплетении и эндотелиальных клетках. Нейропатология HCMV может проявляться в виде слабовыраженного энцефалита с распространенными узлами микроглии, часто ассоциированными с небольшим количеством цитомегалических клеток, или в виде некротизирующего вентрикулоэнцефалита с обильными внутриядерными тельцами-включениями. Врожденная инфекция HCMV является серьезной проблемой общественного здравоохранения, вызывая тяжелые неврологические заболевания у младенцев, приводящие к умственной отсталости, церебральному параличу и нейросенсорной тугоухости.
Вирус Эпштейн - Барр
Вирус Эпштейна-Барр является возбудителем инфекционного мононуклеоза (ИМ) у ранее не инфицированных детей и молодых людей с клиническими симптомами, проявляющимися через 4–6 недель после заражения. Менее 5 % первичных EBV-инфекций вызывают поражение ЦНС, которое проявляется в виде менингита, энцефалита, церебеллита, краниальной или периферической невропатии и полирадикуломиелита. Неврологическое вовлечение может возникать незадолго до, во время или после инфекционного мононуклеоза или даже в его отсутствие. Полирадикуломиелит чаще всего является постинфекционным аутоиммунно-опосредованным синдромом, и пациенты хорошо реагируют на стероидную терапию, часто назначаемую в сочетании с противовирусными препаратами . Заболевания ЦНС, связанные с EBV, могут быть вызваны первичной инфекцией или реактивацией, но также могут быть связаны с хронической инфекцией EBV. В отличие от HSV и VZV, в очагах энцефалита человека, вызванного EBV, не обнаруживается присутствие вирусного белка и нуклеиновых кислот, что ставит под сомнение прямое нейропатическое действие вируса. Сообщается, что мозжечок и базальные ганглии в равной степени вовлекаются во время инфекции EBV, наряду с полушариями головного мозга. Сообщалось, что пациенты с изолированным поражением серого или белого вещества полушария достигли хорошего выздоровления, в то время как почти у половины пациентов с поражением таламуса развились осложнения. Самая высокая смертность была среди пациентов с изолированным поражением ствола головного мозга . Нейропатология характеризуется лептоменингеальной мононуклеарной воспалительной инфильтрацией, периваскулярной манжеткой и периодической периваскулярной демиелинизацией. Текущие данные свидетельствуют о том, что EBV-индуцированная патология ЦНС является иммуноопосредованной.
Вирус герпеса 6 типа
Два варианта HHV-6, HHV-6A и -B, недавно были повторно классифицированы как отдельные HHV на основании различий в эпидемиологии, клеточном тропизме и ассоциации с заболеванием . В то время как ни одно заболевание не было четко связано с HHV-6А, HHV-6В может привести к субитумной экзантеме, инкубационный период которой составляет 1-2 недели. По сравнению с другими лимфотропными HHV инфекция HHV6 также проявляет нейротропные характеристики. Неврологические осложнения первичной инфекции HHV6, в основном HHV-6B, в детском возрасте включают судороги, гемиплегию, менингоэнцефалит и остаточную энцефалопатию, исходы которых остаются неопределенными. Плохой прогноз наблюдался у детей с субитум-ассоциированным энцефалитом и фебрильным эпилептическим статусом. Кстати, реактивация HHV-6 у взрослых пациентов после трансплантации, в основном после трансплантации костного мозга с участием HHV-6B, может быть возбудителем миелита, менингита и посттрансплантационного острого лимбического энцефалита . Нейропатология человека состоит из периваскулярных мононуклеарных клеточных манжет, расположенных в гиппокампе (лимбический энцефалит), лобной и островковой коре, связанных с кровоизлияниями. В височной коре была описана заметная потеря нейронов с глиозом и узелками микроглии. Нет ни вирусных включений, ни воспалительной демиелинизации, ни паренхиматозного некроза, ни менингеального воспаления. Иммунохимически антиген HHV-6 находится в ядрах нейронов гиппокампа и в астроцитах.
Ортомиксовирусы
Материнский грипп был связан с шизофренией и биполярным расстройством (BD) у потомства. Ранние исследования пренатального гриппа и шизофрении были экологическими, связывая эпидемии гриппа в популяции с пациентами, которые находились бы внутриутробно во время этих эпидемий. При заражении гриппом в первом триместре риск развития шизофрении увеличивался в семь раз. Однако во второй половине беременности не наблюдалось повышенного риска развития шизофрении при контакте с гриппом, что указывает на специфичность для раннего и среднего периода беременности. Дополнительные исследования показали, что материнский грипп был связан с более чем четырехкратным статистически значимым увеличением риска возникновения биполярного расстройства.

COVID-19 у большинства пациентов протекает с легкой формой гриппоподобного заболевания. Пожилые пациенты с сопутствующими заболеваниями, такими как артериальная гипертензия, диабет, заболевания легких и сердца, более подвержены тяжелым заболеваниям и летальному исходу . COVID-19 может поражать как центральную, так и периферическую нервную систему. Вирус SARS-CoV-2 вызывает заболевание COVID-19 и может проникнуть в мозг.
Неврологические осложнения часто возникают у пациентов в тяжелом или критическом состоянии с сопутствующими заболеваниями. Наиболее тяжелые психические и неврологические расстройства , измененная сенсорная система (возбуждение, делирий и кома), возникают из-за гипоксических и метаболических нарушений. Характерный "цитокиновый шторм" провоцирует серьезные метаболические изменения и полиорганную недостаточность. Острая геморрагическая некротическая энцефалопатия связана именно с "цитокиновым штормом".
Неврологические осложнения стали важной причиной заболеваемости и смертности в условиях продолжающейся пандемии COVID-19. Первоначально считалось, что это заболевание ограничивается респираторной системой, но теперь мы понимаем, что коронавирусная болезнь 2019 (COVID-19) также затрагивает множество других органов, включая центральную и периферическую нервную систему. Из-за своего глобального распространения и многофакторных патогенных механизмов COVID-19 представляет глобальную угрозу для всей нервной системы.
Исследования показывают, что аксональный транспорт SARS-CoV-2 в мозг может происходить через решетчатую пластинку, прилегающую к обонятельной луковице, что может привести к симптоматической аносмии.
Кто пострадает от ковида в большей степени?
Текущие исследования показывают, что плохой прогноз у пациентов с COVID-19 связан с такими факторами, как пол (мужской), возраст (> 60 лет), основные заболевания (гипертония, диабет и сердечно-сосудистые заболевания), вторичный острый респираторный дистресс - синдром и другие соответствующие факторы.
Дыхательная недостаточность и поражение центральной нервной системы
Дыхательная недостаточность - смертельное проявление COVID-19, которое является причиной смертей во всем мире, вероятно, имеет нейрогенное происхождение и может быть результатом вирусной инвазии I черепного нерва , попадающей в дыхательные центры ствола мозга.
Заболевания центральной нервной системы , вызванные ковидом
Первые симптомы ковида
Заболевания периферической нервной системы, вызванные ковидом
В периферической нервной системе COVID-19 связан с дисфункцией обоняния и вкуса, травмой мышц, синдромом Гийена-Барре и его вариантами, синдромом Миллера-Фишера; краниальным полиневритом; и редкими случаямт вирусной миопатии с рабдомиолизом. . В последнее время наблюдается множество случаев синдрома Гийена-Барре у пациентов с COVID-19, и ответственность за это считают обусловлена постинфекционным иммуноопосредованным воспалительным процессом. Напомним читателю, что синдром Гийена-Барре действительно реагирует на внутривенный иммуноглобулин. Миалгия / усталость также распространены после ковида , а повышенный уровень креатинкиназы у больных с ковидом явно указывает на явное поражение мышц и мозга .
Ожидается, что COVID-19 нанесет ущерб нервной системе в долгосрочной перспективе. Представляет интерес оценка возможности нейротропизма и механизмов нейропатогенеза SARS-CoV-2, поскольку они связаны с острыми и хроническими неврологическими последствиями инфекции.
Механизмы повреждения мозга при ковиде
Вирус SARS-CoV-2 попадает в мозг либо гематогенным путем, либо через обонятельную систему. Число признанных неврологических последствий инфекции SARS-CoV-2 быстро увеличивается. Они могут быть результатом различных механизмов, включая индуцированные вирусами гипервоспалительные и гиперкоагуляционные состояния, прямую вирусную инфекцию центральной нервной системы (ЦНС) и постинфекционные иммунно-опосредованные процессы.
Рецепторы ангиотензинпревращающего фермента - "ворота" для острого респираторного синдрома
ACE2 экспрессируется в нескольких тканях, включая альвеолярные клетки легких, ткань желудочно-кишечного тракта и головной мозг. Два рецептора ангиотензинпревращающего фермента, присутствующие на эндотелиальных клетках сосудов головного мозга, являются возможной точкой входа вируса . с моей точки зрения, именно поэтому блокаторы этого фермента ( каптоприл, эналаприл ) например , некоторые препараты , используемые для лечения гипертонии отчасти защищают организм человека от ковида. . Полагают, что механизм антигипертензивного действия связан с конкурентным ингибированием активности ангиотензинпревращающего фермента , которое приводит к снижению скорости превращения ангиотензина I в ангиотензин II (который оказывает выраженное сосудосуживающее действие и стимулирует секрецию альдостерона в коре надпочечников).
Однако , не все так просто, с другой стороны , текущие клинические исследования показали, что ангиотензин-превращающий фермент 2 (ACE2) является рецептором хозяина для тяжелого острого респираторного синдрома - коронавируса 2 (SARS-CoV-2). Кроме того, ACE2 является основным компонентом ренин-ангиотензиновой системы. ACE2 ухудшает ангиотензин II, пептид, ответственный за развитие инсульта. Подавление ACE2 дополнительно активирует иммунологический каскад. Понимание уровеня и характера экспрессии ACE2 человека в различных тканях могут иметь решающее значение для уязвимости по отношению к ковиду , появление специфических симптомов, и, в конце концов результаты лечения инфекции SARS-CoV-2. Поскольку SARS-CoV-2 связывается с ACE2, он препятствует активности ACE2 в обеспечении нейропротекции, особенно в случае пациентов с инсультом. Из-за подавления ACE2 воспалительная реакция активируется в ишемической полутени.
ACE2 экспрессируется эпителиальными клетками легких на высоком уровне, что является основной мишенью заболевания, как видно из посмертной ткани легких пациентов, умерших от COVID-19, что выявляет диффузное альвеолярное повреждение с клеточными фибромиксоидными экссудатами с двух сторон. Для сравнения, ACE2 экспрессируется на низком уровне эндотелиальными клетками сосудов сердца и почек, но также может быть мишенью вируса в тяжелых случаях COVID-19. Интересно, что инфекция SARS-CoV-2 подавляет экспрессию ACE2, что также может играть важную патогенную роль в COVID-19. Важно отметить, что таргетирование на ось ACE2 / Ang 1-7 и блокирование взаимодействия ACE2 с белком S SARS-CoV-2 для сдерживания инфекции SARS-CoV-2 становятся очень привлекательным терапевтическим потенциалом для лечения и профилактики COVID-19.
ACE2 является важным компонентом ренин-ангиотензиновой системы (RAS). Классическая регуляторная ось RAS ACE-Ang II-AT1R и контррегуляторная ось ACE2-Ang 1-7-MasR играют важную роль в поддержании гомеостаза . ACE2 широко распространен в сердце, почках, легких и яичках. ACE2 противодействует активации классической системы RAS и защищает от повреждения органов, защищая от гипертонии, диабета и сердечно-сосудистых заболеваний. Подобно SARS-CoV, SARS-CoV-2 также использует рецептор ACE2 для вторжения в альвеолярные эпителиальные клетки человека. Синдром острого респираторного дистресс-синдрома - клиническое заболевание с высокой смертностью, и ACE2 оказывает защитное действие при этом типе острого повреждения легких.
Инсульт , как последствие ковида
. В настоящее время во всем мире проводится несколько клинических испытаний, а также реализуются многие другие проекты , которые находятся на разных стадиях планирования для того , чтобы облегчить эффективное ведение пациентов с инсультом и инфекцией COVID-19 . Механизмы инсульта у пациентов с COVID-19. SARS-CoV-2 способны подавлять ACE2 и, в свою очередь, сверхактивировать ось классической ренин-ангиотензиновой системы и снижать активацию ее альтернативного пути в головном мозге. Последующий дисбаланс вазодилатации, нейровоспаления, окислительного стресса и тромботической реакции может вносить свой вклад в патогенез инсульта во время инфекции SARS-CoV-2.
Профилактика поражения центральной нервной системы при ковиде
Ввиду существенных положительных функций становится очевидной неоднозначность АСЕ2, в том числе при коронавирусной инфекции. Перспективным терапевтическим направлением при коронавирусной инфекции может оказаться влияние на ренин-ангиотензиновую систему. Предварительные данные о применении ингибиторов АСЕ2 - препаратов, содержащих данный рецептор в циркуляторной форме, и блокаторов ангиотензинового рецептора II свидетельствуют об их эффективности и, как следствие, улучшении состояния и прогнозов для пациентов с коронавирусной инфекцией.
Из-за защитных эффектов ACE2 в отношении хронических основных заболеваний и острого респираторного синдрома разработка вакцины на основе шипового белка и препаратов, повышающих активность ACE2, может стать одним из наиболее многообещающих подходов к лечению COVID-19 в будущем
Читайте также:

