Вирус эбола и вич
Обновлено: 13.05.2024
Вопрос не праздный и интересует многих.
Итак, обо всем по порядку.
Вопрос первый – какова вероятность возникновения в Тюмени вспышки лихорадки Эбола и что это за инфекция?
Виктор Васильевич (а он, к слову, — один из первых российских специалистов, побывавших в эпицентре лихорадки Эбола в Гвинее и один из немногих, кто успел изучить и клиническую картину лихорадки, и повадки считающегося пока неизлечимым вируса) заверил тюменских медиков, что вероятность того, что в Тюмень доберется лихорадка Эбола, от которой в странах Африки уже погибли свыше 1,5 тыс. человек, крайне мала.
Болезнь эта, действительно, чрезвычайно заразная.
Как и всякая контактная инфекция, она передается при контакте (рукопожатии, поцелуе, объятиях и т.п.) с заболевшим, у которого наблюдаются такие симптомы как рвота, диарея и повышение температуры и т.п. Причем контакт подразумевает непосредственное прикосновение к коже больного, его слизистым оболочкам или контакт с его выделениями (слюной, кровью и т.п.)
Воздушно-капельным путем инфекция не передается. Инкубационный период — до 25 дней, большинство погибших от лихорадки скончались на второй неделе течения болезни.
Вирусов, которые вызывают лихорадку Эбола, несколько и лишь некоторые из них обладают поражающим действием и способны привести к летальному исходу. Один из самых опасных – вирус Zaire ebolavirus – обладает поражающей способностью с коэффициентом смертности порядка 80%.
Что касается России, то климат нашей страны достаточно суров для этой инфекции, поэтому вряд ли стоит ждать ее распространения. По мнению ученого возможны лишь единичные случаи заболевания.
Пока в России не зафиксировано случаев заражения лихорадкой Эбола. Между тем, болезнь уже шествует по миру: есть случаи заражения опасным вирусом в Китае, США и Европе.
Стоит заметить, что в регионе проводится серьезная работа и по оказанию помощи ВИЧ-инфицированным. Вакцинопрофилактика позволяет не только продлить жизнь носителей вируса, но и подарить им возможность стать родителями совершенно здоровых детей.
При этом нужно помнить, что в быту заразиться ВИЧ-инфекцией при контакте с больным человеком практически невозможно. Неповрежденная кожа является непреодолимым барьером для вируса, поэтому ВИЧ не передается через рукопожатия и объятия. Содержание вируса в слюне, слезах, поте, моче и кале незначительно, поэтому ВИЧ не передается через поцелуй и контакт с упомянутыми выделениями. ВИЧ не передается при совместном пользовании ванной и туалетом. В пищеварительном тракте вирус ВИЧ погибает, так что, если содержащая вирус жидкость попадает в желудок человека, заражение не наступает. Поэтому ВИЧ не передается при совместном использовании столовых приборов, посуды. Вирус быстро теряет жизнеспособность при высыхании, под воздействием ультрафиолета, высокой температуры и других факторов. Поэтому ВИЧ не передается по воздуху, при совместном пользовании мебелью, телефонной трубкой и т.д. ВИЧ не передается ичерез укусы насекомых. Подробную информацию о ВИЧ-инфекции можно почерпнуть, в частности, на сайте регионального Центра по профилактике и борьбе со СПИД.
По последним данным, рост заболеваемости ВИЧ в регионе обусловлен ростом заболеваемости среди лиц, употребляющих наркотические и психоактивные вещества и лиц, имеющих с этой группой сексуальные контакты. Среди лиц, употребляющих психоактивные вещества (наркоманов), отмечается рост заболеваемости по итогам 9 месяцев текущего года, — на 39,7%; среди лиц, имеющих заболевания передающиеся половым путем, — на 12,5%; среди осужденных и подследственных — на 53,6%; а также по клиническим показаниям — на 21,2%.

Обзор
Распространенность СПИДа в мире на 2009 год.
Автор
Редакторы

Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Иммунная система

Рисунок 1. Упрощенная схема иммунного ответа. Молниями указано, как один тип клеток активирует другие. Мф — макрофаг, Б — бактерия, ТХ — Т-хелпер, ВКл — B-клетка, ПлКл — плазматическая клетка, Ат — антитела, Б+Ат — бактерия, покрытая антителами, привлекающими макрофагов, В — вирус, ЗМф — зараженный макрофаг, ТК — Т-киллер, ЗК — клетка, зараженная вирусом, УК — умирающая (апоптотирующая) клетка, В+Ат — вирус, покрытый антителами.
рисунок автора статьи
Жизненный цикл ВИЧ
Видео. Жизненный цикл ВИЧ.
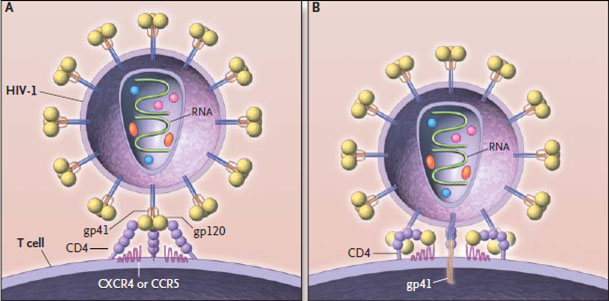
Таким образом, после того как копия вируса в геноме клетки начинает действовать, на её поверхности появляются знакомые нам белки gp41 и gp120, в цитоплазме — остальные вирусные белки и вирусная РНК. И через некоторое время от зараженной клетки начинают отпочковываться всё новые и новые копии ВИЧ.
Способы уничтожения иммунной системы
При отпочковывании вирус использует клеточную мембрану клетки, и со временем это должно вызвать ее разрушение. К тому же, вирусный белок Vpu вызывает увеличение проницаемости мембраны клетки [6]. При активации вируса в клетке появляется неинтегрированная в геном двуцепочечная ДНК [19], наличие которой может рассматриваться клеткой как повреждение ее генетического материала и индуцировать ее смерть через апоптоз (С точки зрения организма такая клетка потенциально может стать раковой). Помимо этого, вирусные белки напрямую нарушают баланс про- и противоапоптотических белков в клетке. К примеру, вирусная протеаза p10 может разрезать противоапоптотический фактор Bcl-2. Белки Nef [26], Env [22] и Tat [24] вовлечены в возрастание количества клеточных белков CD95 и FasL, служащих индукторами апоптоза по т.н. Fas-опосредованному пути. Белок Tat положительно регулирует каспазу 8 [2] — ключевой фактор индукции апоптоза.
Если же клетки не погибли сами, они активно уничтожаются Т-киллерами. (Это стандартный ответ иммунитета на заражение любыми вирусами.)
Помимо этого, при производстве gp120 и Tat часть их выбрасывается зараженной клеткой в кровоток, а это оказывает токсическое действие на организм [4], [28]. gp120 оседает на все СD4 + -клетки (в том числе и здоровые), что имеет три последствия:
- Белок СD4 важен для взаимодействия Т-хелпера с фагоцитом, при слипании же СD4 с gp120 T-хелпер перестает выполнять эту функцию.
- На gp120 как на чужеродный белок образуются антитела; после оседания gp120 на здоровые клетки, последние маркируются антителами, и иммунная система их уничтожает [9].
- После обильного связывания Т-хелпером gp120 клетка умирает сама. Дело в том, что CD4 — это корецептор. Он усиливает сигнал от TCR (T-cell receptor) — главного белка, позволяющего выполнять Т-клеткам функцию иммунитета. В норме эти рецепторы активируются вместе. Если же активируется один тип рецепторов, но не активируется другой, это является сигналом, что что-то пошло не так, и клетка умирает посредством апоптоза.
Антитела, призванные препятствовать инфекции, в случае с ВИЧ часто, наоборот, ее усиливают [28]. Почему так происходит — не совсем понятно. Одну причину мы рассмотрели выше. Возможно, дело в том, что антитела сшивают несколько вирусных частиц вместе, и в клетку попадает не один, а сразу много вирусов. Помимо этого, антитела активируют клетки иммунитета, а в активированной клетке вирусные белки синтезируются быстрее.
Вдобавок, gp120 и gp41 имеют участки, похожие на участки некоторых белков, участвующих в иммунитете (например, MHC-II [25], IgG [23], компонент системы комплемента Clq-A [14]). В результате на эти участки образуются антитела, способные помимо вируса маркировать совершенно здоровые клетки (если на них будут эти белки), с соответствующими для них последствиями.
Так как на поверхности зараженной клетки появляется gp120, то она, как и вирусная частица, будет сливаться с другими СD4-содержащими клетками, образуя огромную многоядерную клетку (синцитий), неспособную выполнять какие-либо функции и обреченную на смерть.
На самом деле, помимо Т-хелперов, СD4 содержатся во множестве других клеток — предшественниках Т-киллеров/Т-хелперов, дендритных клетках, макрофагах/моноцитах, эозинофилах, микроглии (последние четыре — разновидности фагоцитов), нейронах (!), мегакариоцитах, астроцитах, олигодендроцитах (последние две — клетки, питающие нейроны), клетках поперечно-полосатых мышц и хорионаллантоиса (присутствует в плаценте) [29]. Все эти клетки способны заражаться ВИЧ, но сильно токсичен он лишь для Т-хелперов. Это и определяет основное клиническое проявление СПИДа — сильное снижение количества Т-хелперов в крови. Однако для других клеток заражение тоже не проходит бесследно — у больных СПИДом часто снижена свертываемость крови, имеются неврологические и психиатрические отклонения [16], наблюдается общая слабость.
Пути заражения ВИЧ
Внимание! Ввиду того, что СПИД является венерическим заболеванием, информация, приведенная в этом разделе, может вас оскорбить либо вызвать неприятные эмоции при прочтении. Будьте осторожны.
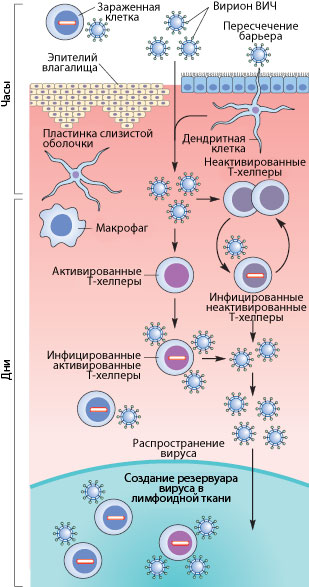
Рисунок 3. Пути проникновения ВИЧ в организм при половом контакте. Слева указано примерные временные рамки каждого этапа.
Как же происходит первичное заражение человека ВИЧ? Думаю, что с переливанием крови или с использованием общего шприца при употреблении наркотиков читателю все понятно — вирус доставляется напрямую из зараженной крови в здоровую. При вертикальном способе передачи инфекции (от матери к ребенку) заражение может произойти во время внутриутробного развития, в момент родов или в период кормления ребенка грудью (т.к. вирус и зараженные вирусом клетки содержатся в молоке матери) [17], [20]. Тем не менее, даже у ребенка, рожденного от ВИЧ-инфицированной матери, есть шанс остаться здоровым, особенно если мать использует ВААРТ (высокоактивную антиретровирусную терапию) [5]. А почему же люди заражаются при половом контакте?
Механизмы передачи вируса при половом акте не до конца ясны. Тем не менее, они понятны в общих чертах. Итак, рассмотрим барьеры, которые необходимо преодолеть вирусу, чтобы добраться до макрофагов и Т-хелперов. К сожалению, рассматривать особо нечего: барьер только один — это слой эпителиальных клеток и вырабатываемая ими слизь, находящиеся во влагалище (а также пенисе, прямой кишке, глотке). Барьер этот тонок — он может быть всего одну клетку в толщину, — но для вируса труднопреодолим, доказательством чего может служить сравнительно небольшой процент заражений — примерно 1–2 случая на 100 половых контактов. Итак, и какими же путями преодолевает вирус это препятствие?
Наиболее очевидный механизм — это микротравмы. При обычном половом контакте, а особенно при анальном сексе, почти неизбежно появляются микротрещины; при наличии же венерических заболеваний часто возникают изъязвления слизистой. Через эти микротравмы вирус, содержащийся в сперме и влагалищном секрете, может проникнуть к иммунокомпетентным клеткам [17], [20].
Помимо дендритных клеток, в кишечнике существует другой тип клеток, предназначенный для ознакомления организма с антигенами внешней среды. Это так называемые М-клетки, пропускающие через себя довольно крупные объекты неповрежденными из просвета кишечника. В т.ч. через них может проходить и вирион ВИЧ.
Свой вклад в заражение вносит и провоспалительный процесс, в норме присутствующий в женских половых путях из-за наличия в них спермы. Благодаря ему Т-клетки подвержены активации, что способствует их восприимчивости к инфекции.
Итак, риск заразиться ВИЧ возрастает в ряду (Классический секс → Анальный секс → переливание крови / использование общих шприцов при принятии наркотиков). Что же касается орального секса, то весьма небольшой шанс заразиться есть только у принимающей стороны — слюна и тем более желудочный сок инактивирует ВИЧ. Теоретически, этим способом может заразиться и мужчина, но для этого необходимы ранки на пенисе.
При поцелуях и обычных бытовых контактах вирус не передается — он очень неустойчив в окружающей среде .
Заключение
. Все эти факты позволяют надеяться, что вскоре ВИЧ, как и оспа, останется в прошлом.

Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.

Обзор
Фотография жизнерадостного молотоголового крылана, потенциального переносчика вируса Эбола.
Автор
Редакторы

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.
Рисунок 1. Информационный плакат о вирусе Эбола.
Геморрагическая лихорадка Эбола — острая вирусная болезнь с высокой заразностью, которая характеризуется развитием тромбогеморрагического синдрома. Он выражается в снижении числа лейкоцитов (белых кровяных тел, частично отвечающих за иммунитет) у больного и, как следствие, — в уменьшении сопротивляемости организма инфекции; а затем и в снижении количества тромбоцитов, что приводит к нарушению свертываемости крови и, нередко, нарушению целостности сосудистой стенки и кровоизлияниям.
Вирус Эболы (рис. 1, 2) вызывает тяжелое заболевание с острым течением, которое обладает близкой к абсолютной летальностью в отсутствие лечения и средней — порядка 60% от всех заболевших — для пациентов, получающих симптоматическое лечение [1]. Распространяясь через физиологические жидкости больных или умерших людей и животных, а также через загрязненные биологическим материалом предметы, болезнь быстро поражает членов одной семьи или деревни после проявления симптомов инфекции. Низкая плотность населения в Африке — один из немногих естественных барьеров для передачи болезни, но представьте только потенциальную активность этого потрясающего патогена в городских условиях развитых стран! Вирус также разносится естественными носителями, обитателями влажных тропических лесов — крыланами (рис. 3), очаровательными летучими мышами, употребляемыми местными жителями в пищу.
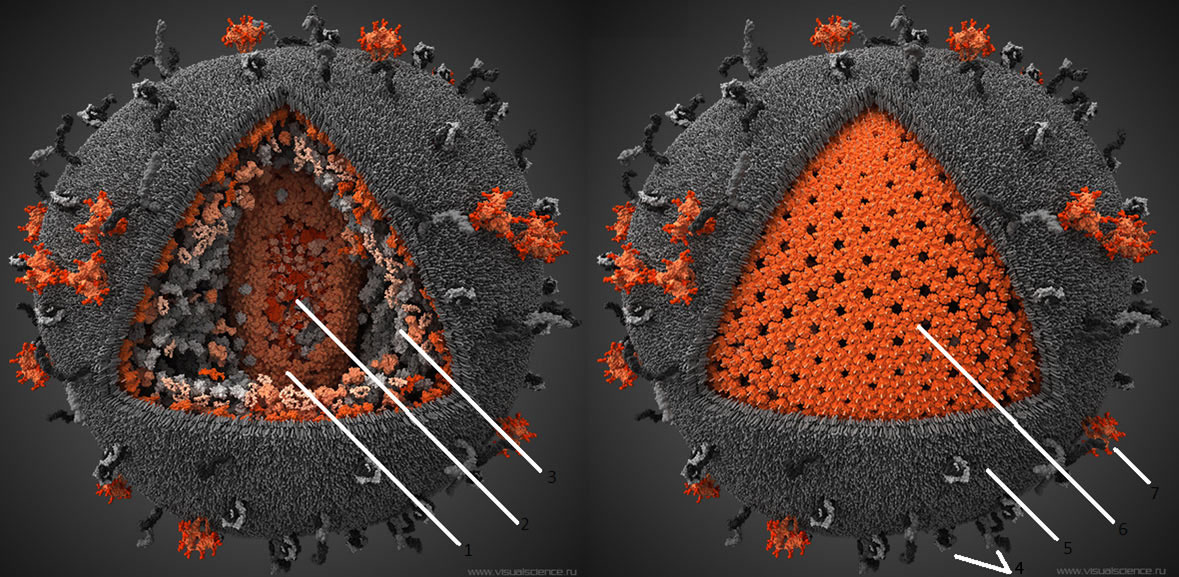
Рисунок 2. Схема структуры вируса Эбола с изображением вирусной РНК и относительным расположением участков, кодирующих его элементы.
Рисунок 3. Крылан молотоголовый, естественный носитель вируса Эболы.
На первом этапе, наступающем через 6–10 дней после контакта с зараженным материалом [2], заболевшие (рис. 4) испытывают симптомы, схожие с другими распространенными в тропических странах заболеваниями, такими как малярия, тифоидная лихорадка (брюшной тиф) и менингит. А именно, у больного наблюдаются повышенная утомляемость, слабость, лихорадка с повышением температуры свыше 38 о С и боли в теле. Спустя еще некоторое время проявляются симптомы обыкновенных кишечных инфекций — тошнота, боли в животе, рвота и диарея.
Рисунок 4. Две медсестры около кровати с больным лихорадкой Эбола. Позднее пациент скончался.
Настоящий ад для заболевших начинается примерно через неделю после проявления первых характерных симптомов. До этого момента, без возможности сделать ПЦР-тест, геморрагическую лихорадку Эбола невозможно обнаружить.
Q-ПЦР (или количественная полимеразная цепная реакция ) — метод молекулярной биологии, позволяющий создать копии определенного фрагмента ДНК из исходного образца, повысив его содержание в пробе на несколько порядков. Он применяется с целью увеличения количества РНК вирусных частиц в пробе и их последующего детектирования посредством взаимодействия с флуоресцентным красителем и регистрации излучения оптическими системами.
Через неделю после проявления первых симптомов лихорадки у больных начинается стадия обильных кровотечений. Вирус Эбола вызывает некоторое снижение свертываемости крови, что в условиях жизни африканских народов в естественном ареале распространения инфекции может провоцировать сильные кровотечения в желудочно-кишечном тракте из-за особенностей слизистых оболочек тонкого и толстого кишечника в десяти процентах случаев, а обильное кровотечение из прочих слизистых — практически в каждом втором. Это приводит к наличию крови в рвоте, кашле и стуле, что многократно повышает заразность заболевания [4].
Как же трактовать частоту появления кровоизлияний? С точки зрения чистой статистики, одна десятая численности — небольшое количество, однако это потенциальные три сотни человек при многотысячной вспышке, подобной той, что была последней в ДРК на текущий момент, которые могут истекать кровью на улице, загрязнять предметы зараженной кровью и разносить инфекцию по округе. Слоняясь в умирающих деревнях, они могут неумышленно распространить вирус на людей, остановившихся с целью помочь и облегчить страдания кажущегося раненным измученного африканца. Инкубационный период болезни вполне может позволить таким туристам покинуть очаг эпидемии.
Именно этот обзор привлек внимание и вызвал оправданное беспокойство нескольких групп эпидемиологов, в том числе американских, к опасности заболевания, возбудитель которого был быстро отнесен к первой группе патогенности.
Рисунок 5. Карта распространения вируса Эбола во время вспышки в 2013–2016 годах.
Текущая обстановка в регионах распространения заболевания остается напряженной: вспышка 2018–2019 годов окончилась при поддержке экспериментальных вакцин как на основе модифицированной ДНК, содержащей гены нуклеопротеинов и гликопротеинов вируса Эболы, так и посредством наиболее свежих на тот момент разработок — векторных вакцин на основе рекомбинантных вирусов .
Параллельно с этим больным оказывалась симптоматическая медицинская помощь в полевых госпиталях и предоставление гуманитарной помощи для находящихся на карантине пострадавших стран. К несчастью, испытания и лечение больных сопровождались вооруженными нападениями на госпитали из-за продолжающейся гражданской войны в ДРК, что неоднократно подрывало миссию медиков и поиск эффективного лечения заболевания и тестирования противовирусных препаратов [8].
Что же такое Инмазеб?
Данный трехкомпонентный препарат состоит из натуральных человеческих специфических антител, которые взаимодействует с гликопротеинами вируса Эбола и блокируют его внедрение в клетки человека, что способствует снижению скорости репликации вирусных частиц и уменьшает тяжесть течения заболевания [10]. В сочетании с имеющимися протоколами лечения болезни, вызываемой вирусом Эбола, это значительно увеличивает эффективность терапии.
Антитела — это крупные глобулярные белки плазмы крови, выделяемые плазматическими клетками иммунной системы и предназначенные для нейтрализации клеток патогенов (бактерий, грибов, многоклеточных паразитов) и вирусов, а также белковых ядов и некоторых других чужеродных веществ. Каждое антитело распознает уникальный элемент патогена, отсутствующий в самом организме, — антиген, а в пределах данного антигена — определенный его участок. Связываясь с антигенами на поверхности патогенов, антитела могут либо непосредственно нейтрализовать их, либо привлекать другие компоненты иммунной системы, чтобы уничтожить чужеродные клетки или вирусные частицы.
Для нейтрализации перечисленных выше патогенов организмом вырабатывается смесь антител, направленных на специфическое связывание с инородными веществами, однако в ряде случаев, а именно — при создании медицинских препаратов узкого спектра действия требуется выделить один компонент из настоящего сонма различных белков, продуцируемых клетками иммунной системы с весьма ограниченным сроком жизни.
Рисунок 6. Строение и типы антител с указанием структурно значимых участков.
О потенциально успешном применении моноклональных антител сообщалось во время ранних клинических препарата ZMapp для лечения лихорадки Эбола [16], и хотя его эффективность не была полностью подтверждена, именно усилия создателей данного лекарственного средства и несколько спасенных жизней показали один из возможных путей борьбы с данной инфекцией. Так начались поиски эффективного типа антител для подавления или ослабления вируса с целью облегчения течения болезни и ее лечения.
Впервые препарат REGN-EB3 был применен в качестве экспериментального лечения во время вспышки заирского эболавируса в 2018 году как на взрослых пациентах, так и на детях параллельно с проведением третьей части клинических испытаний препарата [17]. Согласно данным предварительных исследований, рекомендуемая дозировка для каждого компонента препарата составила 50 мг/кг, однако по завершении вспышки и сбора данных рекомендуемая дозировка была поднята до 100 мг/кг. Препарат разводят перед применением и однократно вводят пациенту внутривенно [18].
Научная сторона исследований
Препарат REGN-EB3, состоящий из антител атолтивимаб (REGN3470), мафтивимаб (REGN3479) и одесивимаб (REGN3471), показал высокое сродство к гликопротеинам вируса Эболы как in silico — при моделировании его активности путем молекулярного докинга, — так и in vivo — при испытании на животных и на людях. Данные электронной микроскопии показали, что при одновременном применении трех типов антител, их связывание с гликопротеином происходит на различных участках, что полностью изменяет свойства белка [18].
Антитела группы атолтивимабов и мафтивимабов успешно нейтрализовали псевдовирусные частицы (клетки, снабженные гликопротеинами вируса Эболы) при сравнительно небольших концентрациях в крови, однако применение одного одесивимаба имело несколько меньший эффект, несмотря на его наибольшее сродство к белковой структуре антигена. Одновременное применение препарата, содержащего все три группы антител, показало полную защиту подопытных животных от летального исхода на пятый, восьмой и одиннадцатый день течения болезни в сравнении с контрольной группой, которой препарат не вводили [18], [19]. Последовательное изучение влияния дозировок препарата на эффективность лечения показало, что минимальная эффективная доза в 100 мг/кг является наименьшей для лучшего контроля за симптомами инфекции [19].
В ходе клинических испытаний препарата, проведенных во время вспышки 2018–2019 годов в ДРК, было обнаружено снижение средней летальности с 50 до 27% и уменьшение общей вирулентности патогена в ходе мутаций в естественной среде обитания, что, несомненно, показывает эффективность препарата в лечении заболевания, однако все еще предполагает комбинированную терапию для достижения наилучшего результата с минимальным количеством летальных исходов.
Обнаруженные во время клинических испытаний побочные эффекты от применения препарата REGN-EB3 включали в себя лихорадку, озноб, тахикардию, учащенное дыхание и другие симптомы (рис. 6), характерные для геморрагической лихорадки Эбола средней тяжести. Полное описание свойств и особенностей представлено на странице 177 опубликованного отчета [9].
Дальнейшие планы
Согласно данным Национальной библиотеки медицины США, протокол клинических испытаний NCT03576690 был одобрен к проведению 14 октября 2020 года, и по настоящее время проводится проверка препарата для лечения болезни, вызываемой заирским эболавирусом, в рамках расширенных клинических испытаний. К исследованиям допускаются люди всех возрастов и полов, которые имеют положительный результат ПЦР-теста и не обладают противопоказаниями к применению представленного протокола лечения геморрагической лихорадки Эбола. Также стоит отметить разрешение от Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США на включение в перечень допущенных до тестирования субъектов беременных женщин, инфицированных вирусом Эбола.
Несмотря на наличие вакцины от болезни, вызываемой вирусом Эбола у многих стран мира, считается, что ей необходимы дополнительные клинические испытания на людях. Параллельно с этим проводятся расширенные клинические исследования препарата моноклональных антител для терапии больных людей. Всё вместе это отражает стремление ученых к созданию не только средств для предотвращения поражения людей этим смертельно опасным вирусом, но и способов лечения для лиц в зоне риска, а именно — жителей Западной Африки, находящихся далеко от пунктов медицинской помощи. Создание единого комплекса мер по противодействию лихорадке Эбола может стать одним из ключей, необходимых жителям африканских республик для дальнейшего развития в неблагоприятных условиях жизни.
ВИРУС (от лат. virus — яд) – простейшая форма жизни, которая паразитирует и размножается в клетках других организмов.
ИММУНОДЕФИЦИТ – снижение способности организма человека сопротивляться различным инфекциям.
ЧЕЛОВЕК – вирус живет ТОЛЬКО в организме человека.
ВИЧ вызывает заболевание, которое называется ВИЧ-инфекция, последняя стадия этого заболевания – СПИД (Синдром Приобретенного Иммунодефицита Человека)
СИНДРОМ – признак определенного заболевания.
ПРИОБРЕТЕННОГО – на является врожденным, а приобретается в результате заражения ВИЧ-инфекцией.
2. Каким образом происходит инфицирование людей этим вирусом?
ВИЧ передается следующими путями:
· Незащищенный половой контакт
· При попадании вируса в кровь в случаях:
- использования нестерильного инструментария при оказании медицинских и косметологических услуг;
- переливания зараженной донорской крови и ее компонентов;
- при внутривенном употреблении наркотиков.
· От ВИЧ-инфицированной матери ребенку (во время беременности, родов, во время грудного вскармливания). В настоящее время применяется комплекс профилактических мер для беременных ВИЧ-инфицированных женщин, снижающий риск инфицирования будущего ребенка до 2% и менее.
Биологические жидкости, в которых вирус содержится в максимальной концентрации (или концентрации, достаточной для заражения):
ВИЧ погибает в течение минуты в крови и других жидкостях организма, если они находятся вне тела человека.
ВИЧ не передается насекомыми (москитами, комарами, блохами, пчелами и осами). ВИЧ не передается при бытовых контактах (объятиях, рукопожатиях, совместном приеме пищи, посещения бассейна).
3. Кто подвержен наибольшему риску?
В наибольшей степени риску инфицирования подвержены: люди, употребляющие наркотические препараты, мужчины, практикующие сексуальные отношения с мужчинами, а также люди, имеющие незащищенные сексуальные контакты.
4. В каких случаях рекомендуется сдать тест на ВИЧ-инфекцию?
ВИЧ-инфекция относится к группе медленных вирусных инфекций с многолетним малосимптомным течением.
Тест на ВИЧ рекомендуется сдать при наличии комплекса симптомов:
· длительное повышение температуры тела неясного происхождения;
· увеличение лимфатических узлов при отсутствии воспалительных заболеваний, в особенности если симптомы не исчезают на протяжении нескольких недель;
· непрекращающаяся диарея на протяжении нескольких недель;
· затяжные и рецидивирующие гнойно-бактериальные, паразитарные и грибковые заболевания;
· герпетические высыпания обширной либо нетипичной локализации;
· резкое снижение массы тела;
· затяжные и рецидивирующие пневмонии или пневмонии, не поддающиеся обычной терапии;
· хронические воспалительные и инфекционные заболевания репродуктивной системы;
· легочный и внелегочный туберкулез.
А также в случаях:
· подготовки к операции;
· частых случайных половых контактов;
· при планировании беременности и во время беременности.
5. Как проходит тестирование на ВИЧ?
Процедура обследования на ВИЧ-инфекцию состоит из нескольких этапов: дотестовой консультации врача, сдачи небольшого количества крови из вены, лабораторного анализа крови, послетестовой консультации врача, на которой разъясняется значение результатов теста.
При наличии положительного результата теста осуществляется повторное обследование. Все ВИЧ-инфицированные граждане Российской Федерации, нуждающиеся в лечении, получают его бесплатно.
Стоит учесть, что существует период "серонегативного окна" (время между заражением ВИЧ и возможностью его выявления, который обычно составляет около 3-х месяцев).
Сдать анализ на ВИЧ можно во всех поликлиниках и больницах на всей территории Российской Федерации, а также в Центрах по профилактике и борьбе со СПИД .
Знание ВИЧ-статуса позволит вам своевременно позаботиться о своем здоровье.
Помните, единственный надежный способ определить ВИЧ-статус человека — это прохождение теста на ВИЧ!
Почтовый адрес:
Вадковский переулок дом 18, строение 5 и 7
г. Москва, 127994
Читайте также:

