Вирус энцефалита леса семлики
Обновлено: 19.04.2024
АРБОВИРУСЫ (английский arboviruses, от arthropod borne viruses вирусы, передаваемые членистоногими) — экологическая группа вирусов, передающихся позвоночным и человеку кровососущими членистоногими переносчиками, в организме которых они активно размножаются, но болезнетворного действия не оказывают. К арбовирусам условно относят группу ареновирусов (см.), трансмиссивная передача которых не установлена.
История изучения арбовирусов началась с установления вирусной природы и трансмиссивной передачи желтой лихорадки (см.).
Арбовирусы внутри группы классифицируют по принципу антигенной структуры и по типу переносчиков (комариные и клещевые вирусы). Арбовирусы в универсальной классификации вирусов не являются единой таксономической группой. Отдельные антигенные группы различаются между собой по фундаментальным характеристикам вирионов и поэтому занимают разное положение. Антигенная классификация арбовирусов построена на объединении в единую группу вирусов, обнаруживающих антигенные связи в реакции торможения гемагглютинации (РТГА) или РСК. Группы обозначены буквами латинского алфавита (А, В. С) или названы по наиболее изученному вирусу (Буньямвера, Бвамба и др.).
К 1 июля 1972 году около 80% арбовирусов были распределены на 41 антигенную группу (табл.).
Число вирусов в каждой группе от 2 до 40, наиболее многочисленны супергруппа Буньямвера, группы А и Б. В антигенной классификации различается определенная иерархия, основанная на степени антигенного родства: группа, комплекс (подгруппа), вирус (серотип), варианты, штаммы. В группе арбовирусов, например, выделены комплексы: а) вируса венесуэльского энцефаломиелита лошадей, б) вируса восточного энцефаломиелита лошадей, в) вируса западного энцефаломиелита лошадей, г) леса Семлики, д) Миддельбург, е) Ндуму. В группе Б различают комплексы: а) вируса клещевого энцефалита, б) японского энцефалита, в) желтой лихорадки. В качестве примера дальнейшей иерархии антигенной структуры можно привести следующий: комплекс Семлики состоит из вирусов леса Семлики, Чикунгунья (подтип О’Ньонг-ньонг и несколько географических вариантов), Гета (подтип Сагияма, Бебару, Росс-Ривер), Майяро (подтип Уна и два варианта).
Вирусы, имеющие сходную антигенную структуру, имеют и другие общие характеристики: тип нуклеиновой к-ты, морфологию, нуклеотидный состав и такие физические параметры, как вес, плавучую плотность, константу седиментации. Эти характеристики относятся к числу основных таксономических признаков (см. Вирусы, классификация). По мере накопления данных отдельные группы арбовирусов или индивидуальные вирусы из числа негруппированных находят место в универсальной классификации вирусов.
Антигенные группы А и В составляют соответственно роды Alpha virus (типовой вид Alphavirus sindbis) и Flavovirus (типовой вид Flavovirus febricis, то есть вирус желтой лихорадки). Они входят в состав семейства Togaviridae. Вирусы этих групп представляют собой сферические частицы с диаметром в среднем 45 нм для флавовирусов и 60 нм для альфа-вирусов. Молекулярный вес вирионов альфа-вирусов 1 X 10 8 дальтон, флавовирусов — 46 X 10 6 дальтон; плавучая плотность — 1,19—1,24 г/мл, константа седиментации — 208—215 S у флавовирусов и 240—280 S у альфа-вирусов. Таким образом, альфа-вирусы отличаются от флавовирусов большими размерами и весом, более высокой константой седиментации.
Вирионы состоят из нуклеоида или нуклеокапсида и тесно прилегающей к нему наружной липопротеиновой оболочки с ворсинками. Толщина оболочки 2—7 нм, диаметр ворсинок около 2 нм, длина 4,5—5 нм (флавовирусы) или 6,5—10 нм (альфа-вирусы). Диаметр нуклеоида альфа-вирусов 30—50 нм, флавовирусов 20—30 нм. Нуклеокапсид состоит из белковых субъединиц кольцевидной формы, число которых точно не установлено. Предположительное число таких субъединиц у альфа-вирусов 32 или 92 с диаметром 7 нм.
Геном представляет однонитчатую линейную РНК в виде одного целого отрезка с мол. весом 4 х 10 6 дальтон. РНК инфекционна и составляет 4—8% веса вириона. У флавовирусов в составе вирионов имеются три структурных белка, у альфа-вирусов — два или три.
Молекулярный вес полипептидов флавовирусов составляет: I — 9000 дальтон, II (нуклеоидный) — 13 500—16 000 дальтон, III (гликопротеин) — 51 000—52 000 дальтон. Мол. вес двух полипептидов альфа-вирусов равен соответственно 30 000 и 53 000 дальтон. Самый тяжелый белок (53 000 дальтон) локализуется в наружной оболочке и несет функции гемагглютинина.
Альфа- и флавовирусы размножаются в цитоплазме клеток. Созревание вирионов происходит на мембранных структурах: проходя через мембраны, нуклеоид покрывается наружной оболочкой и отпочковывается от нее. Почкование альфа-вирусов происходит главным образом через маргинальную мембрану, а флавовирусы в основном формируются на внутренних мембранных структурах.
При репликации в клетках вирусы обеих групп индуцируют образование РНК-зависимой РНК-полимеразы. В процессе размножения вирусов образуется несколько неструктурных белков, число которых у альфа-вирусов от 3 до 15, а у флавовирусов — 4—5.
Вирусы устойчивы при pH = 3,0 благодаря присутствию липидов в составе вириона, чувствительных к действию эфира и дезоксихолата натрия.
Вирусы супергруппы Буньямвера составляют род Bunyamvirus с типовым видом Bunyamvirus bunyamwera. Вирионы изометрические, покрыты оболочкой, имеют размер 90—100 нм в диаметре. Внешняя мембрана состоит из трех слоев, имеет ворсинки, несущие гемагглютинин. Толщина мембраны 15—20 нм, длина ворсинок 5—6 нм.
Геном вируса представлен однонитчатой РНК, возможно, состоящей из 3—6 фрагментов. Экстрагировать инфекционную РНК не удается ни из вирионов, ни из инфицированных клеток. Нуклеокапсид имеет спиральный тип симметрии и представляет собой рибонуклеопротеидный тяж толщиной 2—2,5 нм, свернутый в спираль шириной 9 нм.
Плавучая плотность 1,18—1,20 г/мл, константа седиментации 450 S. Размножаются в цитоплазме инфицированных клеток, созревают почкованием в пузырьки аппарата Гольджи или вблизи него.
Из-за присутствия липидов в составе вирионов вирусы разрушаются под действием жирорастворителей (эфир, хлороформ) и дезоксихолата натрия.
Возможно, на основании общности морфологии и генетической характеристики в состав этого рода войдут антигенные группы Укуниеми, Тюрлок, Маппутта, Кайсоди, Ганджам, КГЛ — Конго, вирусы лихорадки Рифт-Валли и овечьей болезни Найроби.
Род Orbivirus, входящий в состав семейства Reoviridae (см. Вирусы, классификация), состоит из антигенных групп вирусов синего языка овец, африканской болезни лошадей, Коррипарта, Чангинола, Кемерово, Варрего, эпизоотической геморрагической болезни оленей, Пальям, вирусов колорадской лихорадки и Лебомбо.
Основные параметры этого рода даны на основании изучения вируса синего языка овец, который является типовым видом. Другие антигенные группы вирусов объединены в составе этого рода на основе морфологических критериев, поскольку вирусы с идентичной морфологией обладают сходным геномом и другими фундаментальными молекулярнобиологическими свойствами.
Вирусы имеют сферическую форму, не имеют липидной оболочки, хотя иногда бывают покрыты псевдомембраной клеточного происхождения. Диаметр вирионов 65—80 нм, вес 60 X 10 6 дальтон, плавучая плотность 1,36 — 1,38 г/мл, константа седиментации 550 S. Нуклеокапсид двуслойный, общее число белковых субъединиц, из которых он состоит,— 1600. Структура внешнего слоя нуклеокапсида не установлена, внутренний слой состоит из 32 капсомеров. Геном представлен в виде двунитчатой линейной РНК, состоящей из 10—12 фрагментов с общим мол. весом 12 X 10 6 дальтон. РНК составляет 20% , а белок 80% веса вириона. В состав вириона входят 7 белков с молекулярным весом от 32 000 до 155 000 дальтон. Вирионы нестабильны при pH=3,0, относительно резистентны к действию эфира и дезоксихолата натрия, поскольку не содержат липидов.
Вирусы антигенной группы везикулярного стоматита послужили основой создания рода Rhabdovirus (типовой вид — вирус Индиана). Это сложный по составу род, куда входят вирусы позвоночных, беспозвоночных и растений. Кроме упомянутых, в эту группу входят вирусы Чандипур, Пири, летучих мышей Лагос, Кламат, Фландерс, Мокола, Керн-Каньон (см. Рабдовирусы).
Вирусы группы везикулярного стоматита имеют пулевидную форму, покрыты наружной липопротеиновой оболочкой. Размеры — 175 X 68 нм, мол. вес равен 1,2—4,0 X 10 8 дальтон, плавучая плотность — 1,18—1,20 г/мл, константа седиментации — 625 S. Размеры нуклеоида — 155 X 49 нм. Нуклеоид представляет собой цилиндр с плоским с одной стороны и полусферическим с другой стороны концами. Этот цилиндр образован спирально закрученной рибонуклеопротеидной нитью, то есть имеет спиральный тип симметрии. Ворсинки внешней оболочки имеют длину 8—10 нм и диаметр около 3 нм.
Геном представлен линейной однонитчатой РНК в виде цельной нити с молекулярным весом 4 X 10 6 дальтон. РНК составляет 2%, белки —64%, липиды — 20% и углеводы — 13% веса вириона. В составе вируса имеется 5 белков: L-белок (мол. вес 190 000 дальтон), по-видимому, связан с нуклеокапсидом; G-белок (75 000 дальтон) представляет собой гликопротеин и, вероятно, локализуется в ворсинках; N-белок, или нуклеокапсидный белок (57 000 дальтон), связан с РНК и является мажорным структурным белком нуклеокапсида; NS-белок (45 000 дальтон) — минорный нуклеокапсидный белок, возможно, является продуктом деградации N-белка; М-белок (33 000 дальтон) — мембранный белок, который привязывает нуклеокапсид к наружной оболочке. Каждый из белков играет определенную роль в серологических реакциях. Так, например, в реакции нейтрализации интактного вируса участвуют антитела, специфичные для G-белка, в то время как для нейтрализации нуклеокапсида (то есть вируса, лишенного внешней оболочки) нужны антитела к N- и М-белкам.
Вирус везикулярного стоматита и некоторые другие представители обладают гемагглютинирующими свойствами. Вирусы данной группы стабильны при рН=5,0—10,0, чувствительны к эфиру и дезоксихолату натрия.
Отдельные арбовирусы вкраплены в другие таксономические группы. Так, вирус Нодамура относится к роду Enterovirus. Единственный ДНК-содержащий арбовирс африканской лихорадки свиней входит в состав рода Iridovirus (см. Вирусы, классификация). Самый крупный из арбовирусов — Котиа, имеет оспоподобную морфологию.
Несмотря на отмеченные выше различия, арбовирусы обладают многими сходными биологическими свойствами, а для их изучения используют одинаковые методические приемы. Арбовирусы патогенны для многих диких и домашних животных, вызывая у них как клинически выраженную, так и бессимптомную инфекцию. Из лабораторных животных наиболее восприимчивыми являются новорожденные белые мыши при заражении их в мозг. Их используют как для выделения, так и для пассирования вируса в лаборатории. Некоторые арбовирусы патогенны также для взрослых белых мышей. Почти одинаковая с мышами чувствительность к арбовирусам отмечена у сирийских хомяков. Инкубационный период заболевания у новорожденных белых мышей в среднем для вирусов группы А—36—48 часов, группы Б — 60—72 часа, группы Укуниеми—72—96, группы Конго — 96— 120 часов. Длительность инкубационного периода при первичном заражении в процессе выделения вируса обычно более продолжительна. Инфекция у новорожденных белых мышей протекает как летальный энцефалит и в большинстве случаев сопровождается вирусемией (см.). При заражении обезьян вирусемия на фоне лихорадки является одним из постоянных признаков. Большинство арбовирусов размножаются в куриных эмбрионах, наиболее эффективным является заражение в желточный мешок. Для культивирования арбовируов используют также тканевые и клеточные культуры, в том числе и культуры ткани из членистоногих. Способность размножаться в культурах разных видов индивидуальна для каждого вируса, однако наиболее чувствительны к большинству арбовирусов перевиваемые культуры клеток сирийского хомяка (штамм ВНК-21) и почечного эпителия зеленых мартышек (штамм VERO), почки утиных эмбрионов, почки эмбриона свиньи, а из культур членистоногих — линия клеток от комаров Aedes albopictus. В клеточных культурах часто развивается хроническая инфекция. Одним из общих свойств, присущих примерно 60% арбовирусов, является их способность обусловливать агглютинацию эритроцитов гусей. Источником получения гемагглютинирующего антигена является мозг, а для некоторых арбовирусов, например, представителей группы С или вируса леса Сем лики,— сыворотка крови новорожденных белых мышей на высоте заболевания. Для выявления гемагглютинина требуется специальная обработка, направленная на удаление блокирующих гемагглютинин ингибиторов. Для этого применяется метод сахарозо-ацетоновой экстракции, щелочной экстракции, обработка фреоном-113, ацетоном, твином-80 и эфиром. У некоторых вирусов связь гемагглютининов с ингибиторами очень прочная и для освобождения от ингибиторов, кроме указанных методов, дополнительно применяют еще ультразвук и ферментацию трипсином. Гемагглютинины арбовирусов сохраняются только в щелочной среде, но феномен гемагглютинации проявляется при определенных для каждого вируса показателях pH в кислой зоне. В зависимости от наличия внешней липопротеиновой оболочки арбовирусы проявляют разную чувствительность к эфиру и дезоксихолату натрия. Вирусы групп А, Б, супергруппы Буньямвера лишаются инфекционных свойств под действием этих веществ, тогда как эти свойства вирусов антигенных групп Кемерово, синего языка овец, африканской болезни лошадей, эпизоотической геморрагической болезни оленей, Коррипарта снижаются незначительно.
Большинство арбовирусов, кроме крупных палочковидных, проходят через миллипоровые фильтры размером 100 нм. Поскольку все арбовирусы, кроме вируса африканской лихорадки свиней, являются РНК-содержащими, репродукция их не подавляется при добавлении в среду культивирования ингибиторов синтеза ДНК. Все перечисленные выше признаки, а именно: патогенность для мышей-сосунков, гемагглютинирующие свойства, чувствительность к эфиру и дезоксихолату натрия, фильтруемость через миллипоровые фильтры и нечувствительность к ингибиторам синтеза ДНК являются косвенными признаками при изучении новых изолянтов для отнесения их к арбовирусам. Прямым показателем является способность размножаться и передаваться членистоногими в природном цикле или в эксперименте или установление антигенных связей с уже классифицированными арбовирусами.
Для серологической идентификации арбовирусов используют в основном реакцию торможения гемагглютинации (РТГА), реакцию связывания комплемента (РСК), реакцию нейтрализации, которые выявляют как группоспецифические, так и видоспецифические антитела. Специфичность этих реакций для разных антигенных групп варьирует. Так, в группе Б наиболее широкие внутригрупповые связи выявляет РТГА, в меньшей степени РСК. Реакция нейтрализации четко выявляет видовые антигены. Это определяет последовательность использования разных реакций в установлении сначала принадлежности к группе, затем к комплексу и серотипу. Для групповой идентификации используют политиповые сыворотки, полученные иммунизацией несколькими представителями антигенной группы. Наиболее общепринятым методом является иммунизация белых мышей суспензией мозга инфицированных новорожденных белых мышей. В этом случае практически не образуется сопутствующих противотканевых антител, что наблюдается при иммунизации гетерологичным вируссодержащим материалом. В последние годы вместо сыворотки используют асцитную жидкость мышей, индуцированную введением клеток саркомы 180/ТG. Благодаря отсутствию противотканевых антител преимущества иммунных сывороток или асцитных жидкостей, полученных от мышей, особенно выявляются в РСК, иммунофлюоресценции и преципитации.
Около 80 арбовирусов являются патогенными для человека. Арбовирусные болезни (см.) описаны как крупные эпидемические вспышки и как спорадические случаи. Патогенность некоторых арбовирусов установлена только при лабораторных заражениях. Последнее обстоятельство позволяет предположить, что и другие арбовирусы являются потенциально патогенными.
Экологические данные говорят о первичности взаимоотношений большей части арбовирусов с членистоногими. Арбовирусы могут сохраняться в различных органах и тканях на протяжении всей жизни членистоногих, не принося при этом, как правило, вреда. От членистоногих выделено более 80% известных арбовирусов, из них 55% — от комаров. Большинство комариных арбовирусов выделено от представителей рода Culex (47%) и Aedes (37%). Затем по числу выделенных арбовирусов идут роды Anopheles, Mansonia, Sabethes, Psorophora, Haemagogus, Culiseta, Eretmapodites, Trichoprosopon, Wyeomyia, Limatus, Phomiomyia, Aedemyia. В развитии эпидемических вспышек особое место принадлежит синантроп-ному виду Aёdes aegypti. В ряде случаев арбовирусы тесно связаны с одним основным переносчиком, в других случаях набор видов переносчиков широк. Восприимчивость комаров к арбовирусу определяется нижним порогом титра вируса в крови позвоночного, при котором заражается 50% переносчиков, а также числом заразившихся переносчиков, способных передать вирус позвоночному через укус. Количественная оценка этих параметров определяется экспериментально. Кроме того, 7% арбовирусов выделено от мокрецов и 4% — от москитов.
К числу передаваемых комарами относятся арбовирусы групп А, Б (подавляющее большинство), Анофелес А и Б, Бакау, супергруппы Буньямвера, везикулярного стоматита, Коррипарта, Маппутта, Моссурил, Ньяндо, Пальям, Тимбо, Тюрлок, Юбинанги. Комарами передаются также не менее 12 негруппированных арбовирусов, из которых Рифт-Валли (Восточная Африка) имеет значение в патологии человека и домашних животных. Клещами передаются некоторые вирусы из группы Б: комплекса клещевого энцефалита, включающего вирусы клещевого энцефалита, омской геморрагической лихорадки, шотландского энцефаломиелита овец, кьясанурекой лесной болезни, Лангат, Негиси, Повассан и ряд вирусов, входящих в другие антигенные группы. Мокрецы являются переносчиками вирусов синего языка овец, африканской болезни лошадей и некоторых других. Москиты преимущественно участвуют в циркуляции вирусов групп москитной лихорадки и Чангинолы.
Основные представители (вирусы)
Аура, венесуэльского энцефаломиелита лошадей, восточного энцефаломиелита лошадей, Гета, западного энцефаломиелита лошадей, Майяро, Миддельбург, Ндуму, леса Семлики, Синдбис, Урума, Чикунгунья и др.
Антигены тогавирусов. Строение тогавирусов.
В структуре альфавирусов выявлено три антигенных домена, ответственных за видовую специфичность, внутригрупповые и внутриродовые связи. Два из них локализованы в структурных белках оболочки, один — связан с белком нуклеокапсида. Белки оболочки и нуклеокапсида антигенно не связаны между собой. За нейтрализующую активность альфавирусов ответственны гликопротеины Е1 и Е2.
На гликопротеинах Е1 и Е2 идентифицированы соответственно четыре и три эпитопа нейтрализации. Моноклональные антитела к нейтрализующим эпитопам Е2 обладали более выраженным профилактическим действием, чем антитела к нейтрализующим эпитопам Е1.
Нейтрализующие антитела к белку Е2 вируса леса Семлики не реагировали в РТГА и РСК. Установлено участие Е1 вируса Синдбис в клеточном иммунном ответе. Так, антитела к белку Е1 не нейтрализовывали вирус, но оказывали протективное действие в результате зависимого от антител цитолиза инфицированных клеток. Пепломеры вируса леса Семлики, ответственные за сплавление оболочки вириона с клеточной мембраной, состоят из двух трансмембранных белков Е1 и Е2, а также белка Е3, расположенного на поверхности вириона.
В гликопротеинах Е1 и Е2 вируса ВЭЛ идентифицировано по пять сайтов связывания МАТ.

Изучение гомологии нуклеиновых кислот различных альфавирусов показало, что у антигенно тесносвязанных вирусов она составляет 13%, у других вирусов этого рода - не менее 1%. Наличие серологического родства при ограниченной гомологии генома можно объяснить исходя из допущения, что антигенные детерминанты ограничены небольшим количеством аминокислот. Действительно, как показали исследования с моноклональными антителами, большинство альфавирусов сходны по участкам консервативного эпитопа на нуклеокапсидном белке. К немногим исключениям из этого правила относится вирус ВЭЛ.
Между вирусами энцефаломиелита лошадей (ЭМЛ) существует перекрестный иммунитет. Лошади, иммунные к вирусу восточного ЭМЛ, оказались полностью устойчивыми к вирусу ВЭЛ, а иммунные к вирусу западного ЭМЛ — частично защищенными против ВЭЛ [1613]. За антигенный перекрест вирусов ВЭЛ и восточного ЭМЛ ответственны сайты Е1 -1, Е1-3 и Е1-5. Эпитопы гликопротеина Е1 ВЭЛ антигенно сходны с эпитопами белка Е вируса клещевого энцефалита.
Вирус краснухи (рубивирус) антигенно не связан ни с одним из вирусов семейства и классифицируется как тогавирус исключительно на основе структуры.
Сферические частицы диаметром 60—70 нм. Нуклеокапсид 30—35 нм в диаметре окружен оболочкой клетки хозяина. Все штаммы слабо температурочувствительны, урожай вируса при 35°С больше, чем при 37°С. Вирус краснухи размножается более медленно, чем альфавирусы: эклипс фаза длится 10—12 часов, максимальное накопление через 30—48 часов и составляет 10 ИД50 на 1 клетку, тогда как у вируса Синдбис эти показатели соответственно равны 4 и 8 часам и 104ИД50 на 1 клетку.
Структурные белки оболочки вируса краснухи транслируются в виде полипротеина (р 110), в результате расщепления которого образуются капсидный белок (33 кД) и два гликопротеина Е1 (58 кД) и Е2 (42-47 кД).
В гликопротеине Е1 вируса краснухи обнаружено три эпитопа, связанных с ГА-активностью и нейтрализацией вируса антителами. Они расположены в области аминокислот 245—285 белка Е1.
Для краснухи характерен длительный иммунитет после первичной вакцинации.
На Тайване при заболевании людей гепатитом Е изучали возможную причастность свиней к данному заболеванию. Штаммы вируса гепатита Е, выделенные от человека и свиней, относились к одной филогенетической группе и позволили заключить, что свиньи могут служить резервуаром данного вируса.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Тогавирусы. Семейство тогавирусов. Виды тогавирусов.
Род альфавирусов объединяет более 20 антигено связанных между собой видов, передающихся членистоногими. Рубивирусы представлены одним видом — вирусом краснухи, патогенным только для человека.
Прототипным видом рода альфавирусов является вирус Синдбис. В состав рода входят вирусы венесуэльского, восточного и западного американских энцефаломиелитов лошадей. К естественному и экспериментальному заражению чувствительны многие виды позвоночных и беспозвоночных животных. Для альфавирусов характерна пантропность. Основной путь передачи вируса — биологический. При венесуэльском энцефамиелите лошадей (ВЭЛ) в случае массовой вспышки заболевания отмечена транспланцентарная передача вируса и воздушно-капельное заражение.
Тогавирусы — наиболее мелкие оболочечные вирусы животных, представляющие собой мономорфные сферические вирионы, покрытые оболочкой и имеющие диаметр 70 нм. Нуклеокапсид имеет форму икосаэдра диаметром 40 нм и, кроме РНК, содержит один белок С (30—33 кД). Нуклеокапсид окружен двухслойной липидной оболочкой, проходящей из плазматической мембраны клетки хозяина, содержащей вирусспецифические полипептиды. Вирионы покрыты гликопротеиновыми отростками, выступающими над поверхностью на 10 нм. Они представляют собой 80 тримеров, каждый из которых содержит 3 гетеродимера гликопротеинов Е1 и Е2. Нуклеокапсид тогавирусов состоит из 240 копий каждого белка.
Оболочка некоторых вирусов содержит не два, а три белка: Е1 (45—53 кД), Е2 (53—59 кД) и ЕЗ (10 кД). На долю капсидного белка приходится около 20% массы структурных белков.

В зависимости от места нахождения белков вирионе их обозначают так: у альфавирусов С — белок нуклеокапсида, El, E2, ЕЗ - белки оболочки. В суперкапсидной оболочке рубивируса содержится 2 гликозированных белка Е1 (50 кД) иЕ2(65кД).
Геном представлен одной молекулой линейной, одноцепочечной (+)РНК размером от 9,7 (рубивирусы) до 11,8 тн (альфавирусы). На 5'-конце РНК имеется метилированная кэп-структура. З'-конец полиаденилирован. 2/3 5'-конца кодируют неструктурные белки. З'-конец транслируется с геномной РНК как таковой.
В вирусе Семлики, кроме того, содержится еще один гликопротеин ЕЗ с молекулярной массой 10 кД. Два основных гликопротеина (Е1 и Е2), кодируемых альфавирусами (Синдбис и леса Семлики), первоначально синтезируются как полипротеин. В ходе первичного протеолиза образуются Е1 и Е2 (Р62). Белок Е1 состоит из 439 аминокислот с двумя протяженными гидрофобными участками, Р62 — из 487 аминокислот, 64 из которых удаляются при протеолитическом превращении в Е2; Е1 и Е2 и формируют относительно плотный нековалентносвязаный гетеродимер. Три таких гетеродимера собраны в треугольный кластер на поверхности вириона.
Трансмембранные домены альфавирусов состоят из 20—30 гидрофобных аминокислот, лежащих вблизи С-конца полипептида, и имеют основные аминокислоты с цитоплазматической стороны липидного бислоя. Только один альфа-вирусный гликопротеин (Р62/Е2) имеет выраженный цитоплазматический домен, включающий 31 аминокислоту и, вероятно, связывающийся с нуклеокапсидом во время формирования вириона.
Репликация тогавирусов происходит в цитоплазме. Вирусы размножаются с высоким титром в различных клеточных культурах и вызывают отчетливо выраженный ЦПЭ во многих культурах клеток. Они также размножаются в культурах клеток москитов (линия С6/36 клетки Aedes albopictus и др.), но без ЦПЭ. В клетках млекопитающих и птиц инфекция вызывает остановку синтеза белкового и нуклеинового синтеза клетки. В клетках комаров, инфицированных альфа-вирусами, этого не происходит.
При взаимодействии вируса с клеткой хозяина первоначально происходит связывание Е1 с фосфолипидным рецептором поверхности клетки; при вхождении вириона в клетку происходит связывание Е2 с белками клетки. Вхождение вирусного нуклеокапсида в цитоплазму клетки происходит в результате слияния вирусной оболочки с эндосомальной мембраной.
После вхождения в цитоплазму вирионная РНК подвергается двум раундам трансляции. В начале 5'-конец геномной РНК, служащий в качестве мРНК, транслируется с образованием полипротеина, который затем расщепляется на 4 неструктурных белка, два из которых формируют вирусную РНК-зависимую РНК полимеразу Этот фермент транскрибирует полноразмерную негативную копию геномной РНК, которая является матрицей для последующего синтеза геномной (+)РНК. Синтезируется 2 вида (+)РНК:
1) полноразмерная геномная РНК для продолжения инфекции в клетке и для включения в потомство вирионов;
2) 26S субгеномная мРНК с идентичной последовательностью 3'-конца геномной РНК.
В результате трансляции субгеномной РНК образуется большое количество полипротеина, который расщепляется с образованием индивидуальных структурных белков, включая нуклеокапсидный белок С.
Таким образом, геномная РНК вначале служит как месенджер РНК для трансляции неструктурных вирусных белков, а затем как матрица для синтеза комплементарной цепи (—)РНК. Последняя, наоборот, служит матрицей для синтеза двух видов РНК: новой геномной (+)РНК и субгеномных РНК.
Нуклеокапсиды формируются в цитоплазме на эндоплазматических мембранах и продвигаются к плазматической мембране, где они выстраиваются под участки скопившихся вирусных гликопротеиновых пепломеров. Наконец, вирионы формируются почкованием нуклеокапсидов через плазматическую мембрану, нафаршированную включениями пепломерных гликопротеинов. Вирионы не обладают выраженной устойчивостью и легко инактивируются дезинфектантами.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Инфекции с осложнением в виде энцефалита у ребенка
а) Микоплазменный энцефалит. Микоплазма, хотя и не является вирусом, также нуждается в механизме репликации клетки-хозяина. Энцефалит микоплазменной этиологии иногда может иметь острое начало одновременно с респираторными симптомами или чаще в виде вторичного явления с атипичным иммунным ответом на инфекцию в ЦНС (Abramovitz с соавт., 1987). В одном из исследований были представлены плохие продолжительные неврологические последствия у пациентов с микоплазменным энцефалитом (Koskiniemi et al., 1991). Диагноз ставится при выделении ДНК из ликвора и/или серологическим методом определения продукции IgM, IgG и IgA к микоплазме в крови и/или СМЖ (Bencina et al., 2000).
Несмотря на то, что макролидные антибиотики эффективны против микоплазменного агента и должны использоваться при острой системной инфекции, в отдельных случаях трудно установить, является ли энцефалит первичным или иммунной реакцией. Однако проникновение макролидов в ЦНС недостаточно, и эффективность в преодолении гематоэнцефалического барьера не определена.
б) Респираторные вирусные инфекции:
1. Гриппозный энцефалит (грипп А и В). Несмотря на то, что у большинства новорожденных и детей, зараженных вирусом гриппа, развивается легкая респираторная инфекция, могут встречаться более тяжелые проявления болезни, включая неврологические симптомы (Wang et al., 2003; Maricich et al., 2004). Неврологическое поражение часто стойкое с серьезными последствиями или смертельным исходом, и включает острый энцефалит, синдром Рейе, острую некротическую энцефалопатию и миелит, а также аутоиммунные состояния типа синдрома Гийена-Барре. Вирусологическая диагностика основана на выделении вируса или определении антигенов в носоглоточном секрете, а так же на выявлении РНК в ликворе с помощью ПЦР или сероконверсией (Studahl, 2003).
Первоначально о повышенном уровне заболеваемости грипп-ассоциированным энцефалитом/энцефалопатией было заявлено у японских детей. В одном исследовании у 89 детей со средним возрастом 3,8 лет, ни один из которых не получал аспирин, заболевание отмечалось в течение восьми сезонов гриппа (1994-2002 гг.) (Togashi et al., 2004). После короткого респираторного продромального периода у большинства пациентов быстро развилось коматозное состояние с (или без) судорогами; 37% умерли, 19% имели неврологические последствия. В образцах плазмы и ликвора у двоих пациентов, которые умерли от молниеносного течения болезни, отмечалось значительное повышение уровня интерлейкина-6 (ИЛ-6) и фактора некроза опухоли-α (ФНО-α).
При посмертном исследовании одного летального случая выявлен вазогенный отек мозга с генерализованной васкулопатией, подтверждая повреждение эндотелия сосудов, вероятно, за счет высокой активности цитокинов. Другие исследования показали повышенный уровень системных и ликворных цитокинов при гриппозном энцефалите (ИЛ-6 и ФНО-а), так же как увеличение цитохрома С, свидетельствующего о вторичной смерти клеток путем апоптоза в результате гиперцитокинемии (Hosoya et al., 2005, Nunoi et al., 2005). Наиболее высокий уровень отмечен у пациентов с летальным исходом.
2. Энцефалит птичьего гриппа. На сегодняшний день птичий грипп A (H5N1) возникает у небольшой группы лиц, обычно там, где имеется контакт с больными птицами (de Jong et al., 2006). Как и при тяжелой респираторной инфекции, возможно сочетанное поражение многих органов с комой, в большинстве случаев с летальным исходом.
3. Аденовирусный энцефалит. Чаще встречается у детей, обычно проявляясь в виде легкой простудной или гастроинтестинальной болезни. К более тяжелым осложнениям относятся дыхательная недостаточность, энцефалопатия и хронические последствия, включая облитерирующий бронхиолит и продолжительное повреждение ЦНС (Chuang et al., 2003). Аденовирус может быть причиной асептического менингита, однако некоторые штаммы, такие как аденовирус 7 типа, часто вызывают менингоэнцефалит с более тяжелым течением. Другие неврологические синдромы, связанные с аденовирусом — миелит, подострый очаговый аденовирусный энцефалит и Рейе-подобный синдром (Straussberg et al., 2001).
У детей с ослабленным иммунитетом аденовирус может быть причиной полиорганной недостаточности с энцефалитом, печеночной коагулопатией и смертью. Диагноз выставляется на основе изоляции вируса или определения антигенов в носоглоточном секрете или стуле, так же как определение ДНК методом ПЦР в спинномозговой жидкости.
Редкие проявления энцефалопатии возникали при ротавирусных гастроэнтеритах, но, вероятно, это не связано с проникновением вирусов в ткани ЦНС (Nakagomi и Nakagomi, 2005). Энцефалитные проявления с припадками и расстройствами сознания могут быть осложнением других невирусных диарейных заболеваний, включая энтеритные инфекции Shigella (Mulligan et al., 1992) и C. jejuni (Nasralla et al., 1993).
г) Постинфекционные энцефалиты. Постинфекционные энцефалиты, вероятно, самый распространенный тип острых энцефалитов в европейских странах. Поскольку ни в одном из этих случаев не обнаруживают вирус, они скорей всего не являются результатом прямого вирусного вторжения в ЦНС, а вероятно возникают благодаря ответу иммунной системы на инфекционный агент в тканях хозяина посредством механизмов, обсуждаемых в отдельной статье на сайте при остром диссеминированном энцефаломиелите (ADEM).
Большинство случаев постинфекционного энцефалита являются осложнением заболеваний, сопровождающихся экзантематозной сыпью. Однако многие случаи возникают вследствие недиагностированных инфекционных заболеваний. Частота постинфекционных энцефалитов оценивается приблизительно, так как во многих случаях не доступны данные патогенеза и механизма острой энцефалитной картины. Так, при свинке менингит возникает очень часто, но доказательства перивенозного энцефалита представлены лишь в некоторых случаях (Johnson, 1982а). В ряде случаев болезнь, предшествующая началу энцефалита, не диагностируется и не идентифицируется ни один вирус, даже ретроспективно. Диагноз вирусной инфекции основывается на клинических проявлениях и течении продромального периода.
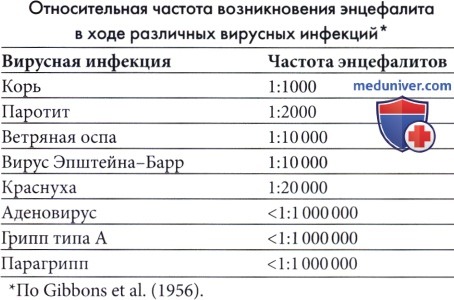
Корь — наиболее частая причина экзантематозной сыпи; таким образом, заболеваемость энцефалитом будет зависеть от заболеваемости корью и уровня иммунизации против кори среди населения. Острый коревой энцефалит начинается через 6-8 дней после первых высыпаний и встречается в 1 из 1000 случаев (Johnson et al, 1984). Несмотря на вариабельность интенсивности, заболевание часто протекает тяжело, со смертельными исходами в 10% случаев и частыми осложнениями, включая припадки, двигательные нарушения и умственную отсталость. Трудности в обучении и поведенческие расстройства характерны для детей с очевидным полным выздоровлением. Описаны редкие случаи постинфекционного энцефалита вследствие вакцинации против кори, но их частота значительно меньше, чем энцефалиты, связанные с диким вирусом кори (Landrigan и Witte, 1973). Постинфекционный энцефалит, ассоциированный с пятой болезнью (парвовирус В19) и внезапной сыпью (HHV-6 и 7) встречается очень редко.
В странах с вакцинацией против кори, свинки и краснухи, rubella (коревая краснуха) в настоящее время является редким заболеванием и случаи острого краснушного энцефаломиелита, следовательно, крайне редки. Постинфекционный краснушный энцефалит — тяжелое заболевание со смертностью примерно в 20% случаев, возникающее в 1 из 5000 острых случаев краснухи. Может развиваться одновременно с сыпью или даже через неделю или позже.
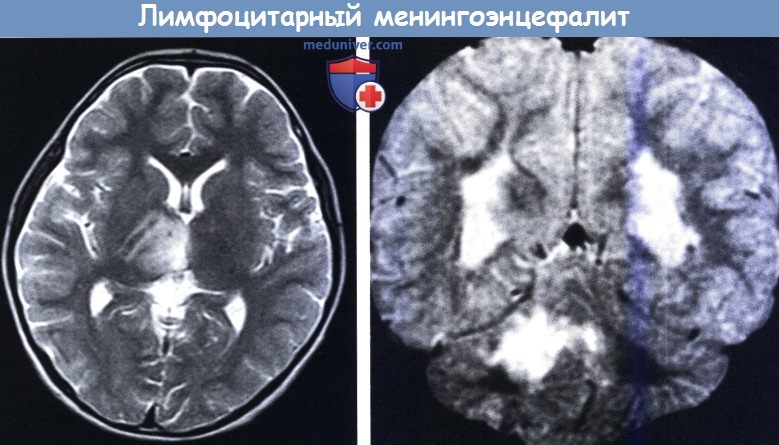
MPT (слева): патологический сигнал от правого таламуса и среднего мозга, вызванный параинфекционным лимфоцитарным менингоэнцефалитом.
12-последовательность (справа): более обширная зона интенсивного сигнала от правого полушария мозжечка и двусторонний интенсивный сигнал от супратенториального белого вещества полушарий (четырехлетняя девочка с мозжечковой атаксией с внезапным началом,
продолжающейся несколько недель, с легким ступором, который исчез через несколько дней).
1. Патология. Патогенез постинфекционного энцефалита имеет отличительные черты. Представлен множественными очагами перивенозной демиелинизации. Осевые цилиндры обычно лучше сохраняются, чем миелин. Определяются лейкоцитарные муфты вокруг вен и венул из мононуклеарных клеток, в демиелинизированных участках видны клетки микроглии и макрофаги.
2. Клинические проявления. Клинические проявления те же, что и при уже описанных типах энцефаломиелита. В большинстве случаев имеется внезапное начало с расстройствами сознания и припадками. Эти симптомы появляются в среднем через шесть дней (до 21 дня) после появления инфекции верхних дыхательных путей или экзантемы, в большинстве случаев у детей в возрасте старше двух лет. Могут быть представлены различные неврологические проявления, включая гемипарез, экстрапирамидные симптомы, атаксию, лицевые параличи, нистагм и поражение черепных нервов (Kennard и Swash, 1981; Marks et al, 1988). Результаты нейровизуализации могут быть отрицательными, а при МРТ обычно выявляются участки повышения сигнала преимущественно в белом веществе полушарий и иногда с вовлечением мозжечка. Характерны вовлечение зрительного бугра и базальных ганглиев. Течение заболевания варьирует от случая к случаю и зависит от причинных факторов. Уровень смертности низкий. Три четверти случаев протекают быстро, с выздоровлением в течение двух недель.
Другим вариантом постинфекционного энцефалита является острый геморрагический лейкоэнцефалит. Это фульминантное заболевание, которое характеризуется быстрой прогрессией очаговых неврологических симптомов и признаков, особенно гемиплегии, сопровождающейся беспокойством, комой и лихорадкой. Ликвор при этом ксантохромный в 20% случаев и показывает полиморфноядерный плеоцитоз. В периферической крови часто представлен выраженный лейкоцитоз. Возможно бифазное течение. Демиелинизирующие повреждения имеют геморрагический характер из-за некротизирующего ангиита венул и капилляров. В постановке диагноза может помочь КТ и МРТ, указывая на наличие больших гиподенсных участках иногда с геморрагическим компонентом (Watson et al., 1984, Huang et al., 1988). При некоторых случаях острого геморрагического лейкоэнцефалита удавалось выделить ДНК и РНК герпесвирусов, но до сих пор неясно, вовлекаются ли эти вирусы в патологический процесс (An et al., 2002).
Лечение постинфекционного энцефалита в основном такое же, как при всех острых энцефалитных заболеваниях. Значение стероидной терапии остается неясным, несмотря на весьма впечатляющее немедленное действие в отдельных случаях (Pasternak et al, 1980). В некоторых случаях применяли внутривенное введение иммуноглобулинов (Kleiman и Brunquell, 1995).
д) Энцефалит ствола мозга и мозжечка. При рентгенографии в случаях острого диссеминированного энцефалита может выявляться вовлечение ствола мозга. Ограниченное вовлечение ствола мозга не характерно и может встречаться при первичных энцефалитах (Kaplan и Koveleski, 1978; North et al., 1993; Duarte et al., 1994) и реже, при постинфекционных типах.
Среди клинических проявлений выделяют лихорадку, системные симптомы и асептический менингит вместе с симптомами и признаками дисфункции ствола головного мозга. Заметно поражение глазодвигательных нервов и нижней лицевой пары, что может сопровождаться заторможенностью и признаками вовлечения длинных нервных путей, что приводит к пирамидальным и мозжечковым проявлениям. Участие черепных нервов и атаксия могут имитировать синдром Миллера-Фишера, который некоторыми авторами рассматривается в качестве формы энцефалита ствола мозга. МРТ может продемонстрировать повышенный сигнал в ножках мозга, в мосте, мозжечке и продолговатом мозге (Ormerod et al., 1986, Hosoda et al., 1987) и энцефалит следует отличать от опухоли ствола мозга, абсцесса или других нейрохирургических проблем. Всегда следует помнить о возможности ромбэнцефалита, вызванного L. monocytogenes, при эффективности антибиотикотерапии (Frith et al., 1987).
е) Острый очаговый энцефалит. Острый очаговый энцефалит, поражающий ограниченный участок при инфекции коксаки-вирусом А9 (Roden et al., 1975) и ЕСНО-вирусом 25 (Peters et al., 1979), может привести к острой гемиплегии или гемихорее. Лакунарные повреждения в центральном сером веществе или внутренней капсуле могут быть результатом сосудистых инфарктов или очаговых церебритов.
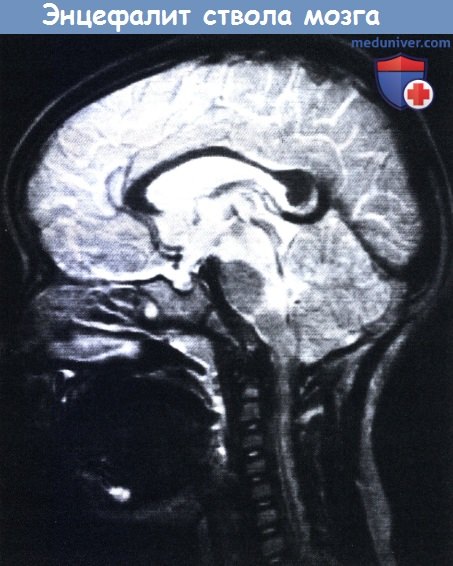
Энцефалит ствола мозга у четырехлетней девочки с клиникой ступора и множественными параличами черепных нервов.
При МРТ выявлено усиление сигнала от ножек мозга и дорсальной части моста.
При повторной МРТ через два месяца патологических изменений не обнаружено.
ТОГАВИРУСЫ (Togaviridae; лат. toga плащ + вирусы) — семейство вирусов с однонитчатой несегментированной инфекционной РНК линейной формы (плюс-нить). Нек-рые Т. вызывают заболевания у человека.
Сем. Togaviridae включает 4 рода: Alphavirus, Flavivirus, Rubivirus и Pestivirus, а также ряд неклассифицированных вирусов (вирусы артериита лошадей, лактатдегидрогеназы мышей, геморрагической лихорадки обезьян и вирус, вызывающий слияние клеток). Все альфа-вирусы (см.) и большинство вирусов рода Flavivirus относятся к арбовирусам (см.), т. к. передаются позвоночным хозяевам (грызунам, птицам и др.) комарами, иксодовыми клещами и другими кровососущими членистоногими переносчиками.
Род Alphavirus (типовой вирус — Синдбис) объединяет 23 передаваемых комарами арбовируса антигенной группы А. Размер вириона 60—65 нм. Нуклеокапсид имеет кубический тип симметрии, окружен липидосодержащей оболочкой. РНК составляет 6% веса (массы) вириона, коэффициент седиментации 42 — 50 S, имеются 3—4 структурных полипептида. Сборка вирионов происходит в цитоплазме путем почкования из плазматической мембраны. Вирусы относятся к 3 антигенным комплексам: восточного (1 вирус), западного (8 вирусов) и венесуэльского (14 вирусов) энцефаломиелита лошадей. По крайней мере 11 вирусов вызывают заболевания человека (см. Арбовирусные болезни), проявляющиеся лихорадкой, артритом, сыпью (вирусы Чикунгунья, Майяро, Мукамбо, О’Ньонг-ньонг, Росс-Ривер, Синдбис) или лихорадкой и синдромом энцефалита, напр, вирусы западного, восточного и венесуэльского энцефаломиелита лошадей (см. Энцефаломиелиты лошадиные). Ветеринарное значение имеют вирусы Эверглейдс и леса Семлики. Альфа-вирусы распространены на всех континентах. В СССР выделены 4 вируса: Гета, Кызылагач, леса Сем-лики и Синдбис, причем вирус Синдбис вызывает заболевание людей.
Род Flavivirus (лат. flavus желтый) включает 56 вирусов антигенной группы В, передаваемых комарами и иксодовыми клещами, а также вирусы с неустановленным путем передачи. В состав рода входят вирусы денге (см.), желтой лихорадки (см.), болезни Кьясанурского леса (см. Кьясанурского леса болезнь), омской геморрагической лихорадки (см.), клещевого энцефалита (см. Энцефалит клещевой), энцефалита долины Муррея, или австралийского энцефалита, японского энцефалита (см. Энцефалиты комариные) и др. Размер вириона 48 — 55 нм, РНК составляет 8% веса вириона, коэффициент седиментации 40—45 S, имеется 3 структурных полипептида. Сборка вириона ассоциирована с цитоплазматической мембраной. По крайней мере 26 вирусов вызывают заболевания человека, характеризующиеся лихорадкой (вирусы Банзи, Буссукуара, Ильеус, Зика, Карши, Кунджин, Сепик, Спондвени, Тюлений), лихорадкой с сыпью и полиартритом (вирусы денге 1—4, Западного Нила), лихорадкой с геморрагическим синдромом (вирусы денге 1—4, болезни Кьясанурского леса, омской геморрагической лихорадки, желтой лихорадки), явлениями энцефалита (вирусы Апои, Ильеус, Лангат, Не-гишп, энцефалита долины Муррея, клещевого энцефалита, Росио, энцефалита Сент-Луис и японского энцефалита, Рио-Браво, Повассан, шотландского энцефаломиелита овец). Эти вирусы распространены на всех континентах. В СССР эндемичны вирусы Западного Нила, клещевого и японского энцефалитов, Карши, омской геморрагической лихорадки, Негиши, Повассан, Сокулук, Тюлений; из них лишь для вируса Сокулук пока не установлено значение в патологии человека.
Род Rubivirus (лат. ruber красный) представлен только вирусом краснухи (см.). Размер вириона 58 + 7 нм. Коэффициент седиментации РНК 40 S. Вирус имеет 3 структурных полипептида. В отличие от других Т. содержит нейрамини-дазу. Вирус реплицируется во многих клеточных культурах, но цитопатическое действие оказывает только на ВНК—21, VERO, SIGR и первичные культуры клеток плода человека после адаптации. Индикатором репликации является интерференция с каким-либо патогенным вирусом. Для се-рол. исследований используют реакции радиального гемолиза и задержки гемолиза. Краснухой болеют преимущественно дети младшего школьного возраста, а также подростки и молодые люди. Она опасна для беременных в связи с тератогенным действием вируса. Пороки развития плода (слепота, глухота, недоразвитие конечностей и др.) возникают при заражении на 1, 2, 3 и 4-м месяце беременности соответственно в 33, 25, 9 и 4% случаев. Поэтому заболевание краснухой в 1-м триместре беременности служит прямым показанием к ее прерыванию. Для профилактики применяют живую вакцину, используемую вне периода беременности.
Род Pestivirus (лат. pestis чума) включает вирусы диареи коров, европейской чумы свиней и антигенно родственный им вирус, поражающий овец. Размер вириона 40—60 нм. Коэффициент седиментации РНК 38—45 S. Имеются 3—4 структурных полипептида. Вирусы вызывают тяжелые эпизоотии среди с.-х. животных, принося большой экономический ущерб.
Библиогр.: Львов Д. К. и Ильичев В. Д. Миграции птиц и перенос возбудителей инфекции, с. 3 7,, М., 19 79; Львов Д. К. и Лебедев А. Д. Экология арбовирусов, М., 1974; Общая и частная вирусология, под ред. В. М. Жданова и С. Я. Гайдамович, т. 2, с. 49, М., 1982; Porterfield J. S. а. о. Togaviridae, Intervirology, v. 9, p. 129, 1978; Togaviruses, biology, structure, replication, ed. by R. W. Schlesinger, N. Y. а. o., 1980.
Читайте также:

