Вирус эпб что это
Обновлено: 18.04.2024
От него не скроешься. Рано или поздно с ним встречается каждый человек. Надо ли его бояться? А может, инфекция совсем безобидна? Паниковать не стоит, но и легкомысленное отношение – ошибка.
— Елена Геннадьевна, что такое вирус Эпштейна-Барр?
— Среди герпес-вирусов насчитывают 8 типов, вызывающих патологии у вида Homo sapiens, то есть у людей. Вирус Эпштейна-Барр – герпес-вирус IV типа. После заражения вирусом Эпштейна-Барр инфекция остаётся в организме навсегда и никогда его не покидает.
Вирус Эпштейна-Барр – один из самых распространённых герпес-вирусов у людей. Восприимчивость к нему человека высока. Многие дети инфицируются до достижения годовалого возраста, а к 40-50 годам инфекция есть в организме практически у каждого.
— Как происходит заражение вирусом Эпштейна-Барр?
Вирус Эпштейна-Барр проникает в организм через верхние дыхательные пути, и уже оттуда распространяется в лимфоидную ткань, вызывая поражения лимфоузлов, миндалин, селезёнки и печени.
При размножении в организме вирус Эпштейна-Барр воздействует на иммунную систему. Механизм воздействия сложен, но в конечном результате за счёт поражения В-лимфоцитов и угнетения Т-клеточного иммунитета происходит подавление выработки интерферона – белка, отвечающего за противовирусную защиту организма.
В современном мире у детей отмечается всплеск заболеваемости, особенно в городах. Наиболее высока вероятность заразиться в местах скопления людей.
— А бессимптомный носитель может быть опасен?
— Чаще всего источником инфекции становится человек в острой стадии болезни. Но передача от бессимптомного носителя не исключена.
— Какую болезнь вызывает вирус Эпштейна-Барр?
— Классическое проявление – инфекционный мононуклеоз. Для него характерны общие интоксикационные симптомы: высокая температура тела, сонливость, вялость, головные боли, боль в горле, увеличение лимфоузлов (или лимфопролиферативный синдром).
Лимфопролиферативный синдром сочетает:
- Поражение рото-, носоглотки: острый фарингит с гипертрофией (увеличением) лимфоидной ткани носоглотки, острые аденоидит и тонзиллит. Это проявляется затруднённым носовым дыханием, храпом во сне.
- Поражение периферических лимфатических узлов (часто поражаются переднешейные, подчелюстные и заднешейные).
Выраженное увеличение шейных лимфоузлов может сопровождаться одутловатостью лица, пастозностью век. - Увеличение печени и селезёнки.
Читайте материалы по теме:
Знать, что ребёнок инфицирован, важно и по другой причине. Вирус Эпштейна-Барр может изменить реакцию на некоторые антибиотики, спровоцировать токсикоаллергическую реакцию. Поэтому следует обязательно своевременно выявлять вирус и сообщать о нём лечащим врачам, они будут подбирать антибиотики с учётом этого факта.
Тяжёлые последствия возникают, если первичное заражение происходит у женщины в период беременности. Вирус Эпштейна-Барр преодолевает плацентарный барьер, это грозит гибелью плода или значительными дефектами развития.
— Есть мнение, что вирус Эпштейна-Барр вызывает гепатит и даже лимфому. Это правда?
— Герпетические вирусы кровотоком разносятся по всему организму, поражают все группы лимфатических узлов. И печень, и селезёнка при остром течении мононуклеоза увеличены. При этом течение болезни обычно благоприятное, здоровье печени полностью восстанавливается.
Утверждать, что вирус Эпштейна-Барр непременно приводит к лимфоме, нельзя. Обнаружить вирус недостаточно: если инфицировано практически всё население планеты, естественно, анализы обнаружат наличие вируса в организме, но ведь лимфомой заболевает далеко не каждый. Конечно, хроническое подавление иммунной системы может приводить к разным нарушениям, в том числе к онкологическим заболеваниям. Но достоверной связи нет. А скомпенсировать иммунные нарушения современная медицина в силах.
Паниковать точно не стоит. Но и надеяться на самостоятельное излечение не надо. Когда ребёнок постоянно болеет, родители зачастую впадают в отчаяние. И хотя избавиться от герпес-вирусов навсегда невозможно, вполне можно облегчить состояние и в разы уменьшить частоту заболеваний. Лечиться можно и нужно.
Подробнее о гепатитах читайте в наших статьях:
— Какими методами можно проверить, присутствует ли в организме вирус Эпштейна-Барр? Какие анализы его выявляют?
Метод ИФА точнее, он в любом случае покажет и наличие инфекции, и выраженность инфекционного процесса. Выводы в данном случае делают по присутствию в крови специфических иммуноглобулинов (антител) к вирусу. Например, если обнаружены иммуноглобулины класса М (IgM), можно говорить об острой фазе инфекции (первичном заражении либо реактивации вируса, когда-то попавшего в организм). Если найдена определённая фракция иммуноглобулина класса G (IgG), это свидетельствует, что организм в прошлом уже сталкивался с инфекцией. Поэтому для определения диагностического метода нужна консультация врача.
— Какими методами лечения вируса Эпштейна-Барр располагает современная медицина?
— Это сложная задача. Если для герпес-вирусов I и II типа (вирусов простого герпеса) есть специфические противовирусные средства, то для вируса Эпштейна-Барр и цитомегаловируса специфической терапии пока не разработали. При лёгком течении болезнь может пройти сама, но при тяжёлом течении с поражением костного мозга медицинская помощь необходима. Лечение направлено на стимуляцию иммунитета, применяются интерфероны. Схему лечения выбирают, исходя из множества факторов, определять её должен только врач.
После излечения вирус продолжает жить в организме. Периодически могут возникать обострения: из-за переохлаждения, длительного пребывания под солнцем, стресса и т. д. Проявления инфекции – всегда повод идти к врачу.
Беседовала Дарья Ушкова
Редакция рекомендует:
Для справки:
Королёва Елена Геннадьевна
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Вирус папилломы человека: причины появления, симптомы, диагностика и способы лечения.
Определение
Вирусы папилломы человека (ВПЧ) — это группа чрезвычайно распространенных и генетически разнородных ДНК-содержащих вирусов, поражающих эпителий кожных покровов и слизистых оболочек. Вирус папилломы человека относится к семейству папилломавирусов. Было выявлено и описано более 190 типов ВПЧ. Каждый тип отличается более чем на 10% от ближайшего родственного штамма. Из их числа более 30 типов ВПЧ могут инфицировать эпителиальный слой урогенитального тракта. В зависимости от онкогенного потенциала выделяют вирусы высокого (типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59) и низкого (типы 6, 11, 42, 43, 44) онкогенного риска.
На долю двух высокоонкогенных типов ВПЧ (16 и 18) приходится до 70% случаев рака шейки матки, 80% рака вульвы и влагалища, 92% анального рака, 95% рака ротовой полости, 89% рака ротоглотки, 63% рака полового члена.
При этом 16-й тип имеет самый высокий канцерогенный потенциал. Генотипы ВПЧ 6 и 11 вызывают практически все виды аногенитальных бородавок и большинство случаев рецидивирующего респираторного папилломатоза, который наблюдается в основном у детей младше 5 лет или у лиц 20-30 лет.
Причины появления ВПЧ
Заболевания, вызванные вирусом папилломы человека (ВПЧ), относятся к болезням с латентным началом, хроническим персистирующим течением и проявляются доброкачественными и злокачественными новообразованиями в зоне входных ворот инфекции.
Источником возбудителя инфекции является больной человек или носитель. ВПЧ передается от человека к человеку при оральном, генитальном и анальном половых контактах, а также контактно-бытовым и вертикальным (от матери к ребенку) путями.
Вирус папилломы человека — единственный вирус, который не проникает в кровь, вследствие чего инфекционный процесс протекает без развития воспалительной реакции. В процессе инфицирования вирус папилломы человека поражает незрелые клетки, чаще базального слоя, которые затем становятся постоянным источником инфицирования эпителиальных клеток. Инфицированию способствует наличие микротравм и воспалительных процессов кожи и слизистых оболочек, приводящих к снижению местного иммунитета.
Вирус способен персистировать (хронически присутствовать) в месте проникновения как угодно долго. Инкубационный период заболевания может длиться от нескольких месяцев до нескольких лет. Среднее время между инфицированием ВПЧ и развитием аногенитальных бородавок составляет от 3 месяцев у женщин и до 11 месяцев у мужчин. Инфицирование человека может происходить как одним, так и несколькими типами ВПЧ.
Интервал между инфицированием ВПЧ и прогрессированием до инвазивного рака составляет, как правило, 10 лет или более.
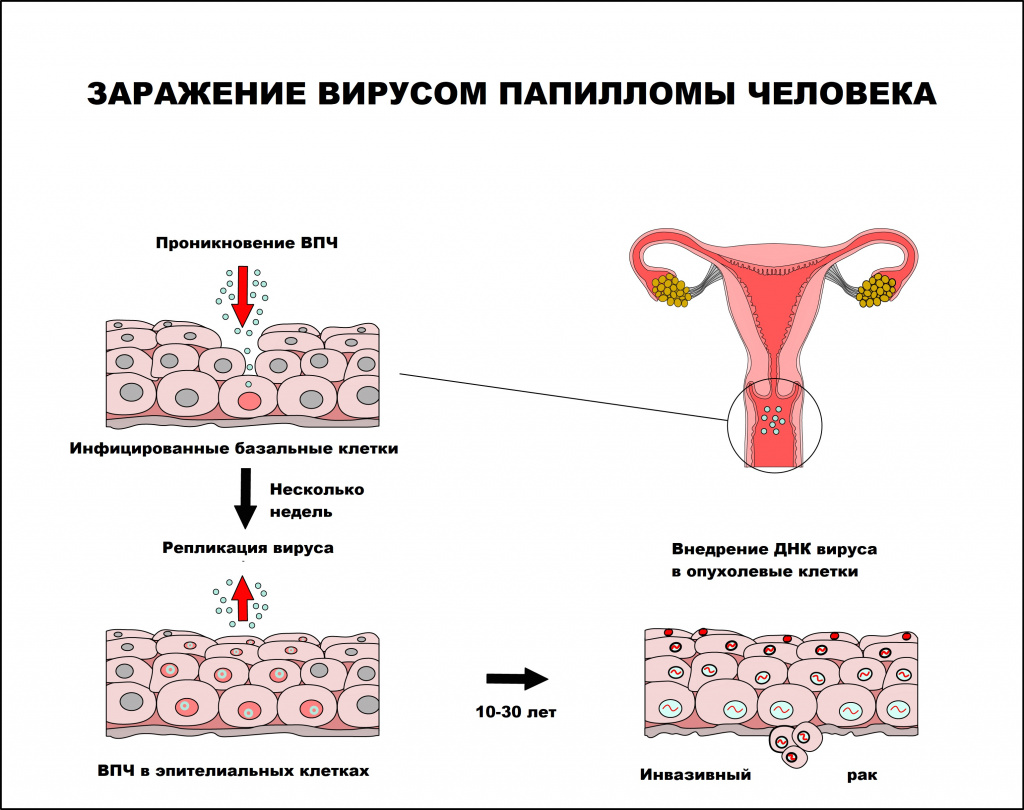
Папилломавирусная инфекция чаще регистрируется у лиц молодого возраста, имеющих большое число половых партнеров. По данным ВОЗ, 50-80% населения инфицировано ВПЧ, но лишь 5-10% инфицированных лиц имеют клинические проявления заболевания.
Классификация заболевания
Общепринятой классификации аногенитальных (венерических) бородавок не существует. Однако выделяют несколько их клинических разновидностей:
- остроконечные кондиломы;
- бородавки в виде папул;
- поражения в виде пятен;
- внутриэпителиальная неоплазия;
- бовеноидный папулез и болезнь Боуэна;
- гигантская кондилома Бушке-Левенштайна (карциномоподобная остроконечная кондилома).
Симптомы ВПЧ
- наличие одиночных или множественных образований в виде папул, папиллом, пятен на кожных покровах и слизистых оболочках половых органов;
- зуд и парестезии (расстройство чувствительности) в области поражения; болезненность во время половых контактов (диспареуния);
- при локализации высыпаний в области уретры наблюдается зуд, жжение, болезненность при мочеиспускании (дизурия); при обширных поражениях в области уретры – затрудненное мочеиспускание;
- болезненные трещины и кровоточивость кожных покровов и слизистых оболочек в местах поражения.
Бородавки в виде папул – папулезные высыпания без пальцеобразных выпячиваний, локализующиеся на кератинизированном эпителии половых органов.
Поражения в виде пятен – серовато-белые, розовато-красные или красновато-коричневые пятна на коже и/или слизистой оболочке половых органов;
Бовеноидный папулез и болезнь Боуэна – папулы и пятна с гладкой или бархатистой поверхностью; цвет элементов в местах поражения слизистой оболочки – бурый или оранжево-красный, а поражений на коже – пепельно-серый или коричневато-черный.
Гигантская кондилома Бушке-Левенштайна – мелкие бородавчатоподобные папилломы, сливающиеся между собой и образующие очаг поражения с широким основанием.
Респираторный папилломатоз – заболевание, при котором папилломы формируются в дыхательных путях, ведущих от носа и полости рта в легкие.
Диагностика ВПЧ
Латентно протекающая инфекция диагностируется только с помощью молекулярно-биологических методов исследования. Субклиническая инфекция диагностируется при молекулярно-биологическом, кольпоскопическом, цитологическом и морфологическом исследовании.
Для улучшения визуализации аногенитальных бородавок может быть проведена проба с 3-5% раствором уксусной кислоты. Тест считается отрицательным, если после обработки уксусной кислотой на поверхности шейки матки нет белых участков. И положительным при выявлении на шейке матки участков белого цвета (ацетобелых участков), отличных от остальной поверхности шейки матки.
Изменения эпителия шейки матки, вызванные ВПЧ, могут быть выявлены цитологическим методом микроскопии слущенных клеток с окраской по Папаниколау (Пап-тест).
Метод окрашивания по Папаниколау - специально разработанный метод, позволяющий с наибольшей степенью достоверности выявить ранние предраковые заболевания шейки матки. Рак шейки матки в структуре злокачественных новообразований репродуктивной системы занимает третье место. До 1992 г. заб.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Определение
Новая коронавирусная инфекция (COVID-19) относится к группе острых респираторных вирусных инфекций (ОРВИ). Она, безусловно, имеет ряд значимых особенностей, отличающих ее от других заболеваний этой группы, но многие признаки, в том числе некоторые способы профилактики, являются общими для всех ОРВИ.
Пути заражения
Ведущим путем передачи нового коронавируса SARS-CoV-2 является воздушно-капельный (при кашле, чихании и разговоре на близком - менее 2 метров - расстоянии). Менее значимый контактный путь передачи реализуется во время рукопожатий и других видах непосредственного контакта с инфицированным человеком, а также через поверхности и предметы, возможно через пищевые продукты, обсемененные вирусом. Аэрозольным путем можно заразиться в помещениях с большим количеством людей и плохой вентиляцией воздуха.
Группы риска
Примерно у 80% заболевших инфекция протекает в легкой форме. Однако с учетом широкой распространенности новой коронавирусной инфекции COVID-19, огромного количества одновременно болеющих людей и 15-20% среднетяжелого и тяжелого течения существует риск неполучения своевременной медицинской помощи, нехватки лекарств и мест в стационарах. От каждого из нас во многом зависит, по какому сценарию будет развиваться эта пандемия.
Кто же входит в группу риска по тяжелому течению COVID-19? Для кого защита от болезни особенно важна?
Пациенты с сахарным диабетом являются группой риска по тяжелому течению новой коронавирусной инфекции, наиболее уязвимы лица пожилого возраста с данным заболеванием, а также люди с ожирением.
Пациенты с сахарным диабетом страдают микро- и макроангиопатиями (повреждением мельчайших сосудов – капилляров и крупных сосудов соответственно), ранним развитием атеросклероза. При коронавирусной инфекции сосудистые осложнения (тромбозы) – одна из основных причин смертности. При исходно измененной сосудистой стенке при сахарном диабете риск возникновения тромбозов возрастает. С другой стороны, тяжелая вирусная инфекция может вызывать резкие колебания уровня глюкозы в крови больных сахарным диабетом, что может вызвать декомпенсацию углеводного обмена.
Ожирение
Существует расчетный показатель – индекс массы тела (ИМТ), позволяющий оценить степень соответствия массы человека его росту. Показатель более 30 свидетельствует об ожирении. При индексе массы тела 30-34 летальность от COVID-19 может достигать 8,9%. Соответственно, при ИМТ 35-39 - 11,5%, свыше 40 - 13,5%.
Возраст старше 65 лет и другие заболевания
Люди старше 65 лет чаще страдают среднетяжелым и тяжелым течением инфекционных болезней. Кроме того, есть данные об умеренном снижении клеточного и гуморального иммунитета в пожилом возрасте.
Наличие иммунодефицитных состояний – ВИЧ, онкологические заболевания в активной фазе болезни или лечения могут стать причиной тяжелого течения новой коронавирусной инфекции.
Люди с хроническими заболеваниями сердца и легких (врожденными пороками сердца, ишемической болезнью сердца, сердечной недостаточностью, бронхиальной астмой, хронической обструктивной болезнью легких) также входят в группу риска.
Медицинские работники и сотрудники общественного транспорта, магазинов, кафе и ресторанов в связи с профессиональной деятельностью имеют длительный тесный контакт с большим количеством людей, и, как следствие, значительную вирусную нагрузку, поэтому у них повышенный риск тяжелого течения коронавирусной инфекции.
Из вышесказанного следует, что люди, относящиеся к данным категориям, должны особенно внимательно относиться к вопросам профилактики новой коронавирусной инфекции. А в случае заболевания максимально быстро обращаться за медицинской помощью для постоянного наблюдения и получения адекватного лечения.
Профилактические мероприятия
Профилактика любых инфекционных заболеваний делится на специфическую (вакцинация) и неспецифическую. Неспецифическая профилактика представляет собой мероприятия, направленные на предотвращение распространения инфекции, и проводится в отношении источника инфекции (инфицированного человека), механизма передачи возбудителя инфекции, а также потенциально восприимчивого контингента (здоровых лиц, находящихся и/или находившихся в контакте с инфицированным человеком).
Основная цель применения вакцины от COVID-19 - не предотвращение самого заболевания, а существенное облегчение его течения и снижение вероятности развития неблагоприятных, тяжелых форм инфекции, особенно у людей из групп риска.
Вопросы безопасности и эффективности вакцин активно изучаются во всем мире. Предполагается, что при охвате вакцинацией большого количества людей, а также с учетом уже переболевших лиц, эпидемия должна пойти на спад.
В идеале вакцина от COVID-19, наряду с доказанной безопасностью, должна:
- приводить к формированию высоких титров нейтрализующих антител (для эффективной борьбы с вирусом);
- сопровождаться формированием низких (в идеале – нулевых) титров ненейтрализующих антител (для снижения вероятности антитело-зависимого усиления инфекции);
- вызывать значительный и устойчивый Th1-клеточный ответ и слабый Th2-клеточный ответ (для физиологической воспалительной реакции без угрозы тяжелого поражения легких и цитокинового шторма/ОРДС);
- поддерживать длительную иммунологическую память (клеточную и гуморальную);
- обеспечивать защиту от возможных мутантных вариантов вируса.
Неспецифическая профилактика
Поговорим подробнее о неспецифической профилактике новой коронавирусной инфекции. Как уже было сказано, возможно воздействие на источник инфекции, механизм передачи вируса и здорового человека, в отношении которого проводится профилактика. Ниже перечислены основные меры по профилактике респираторных вирусных инфекций, в том числе COVID-19.
Мероприятия в отношении источника инфекции:
-
Ранняя диагностика и активное выявление инфицированных лиц, в том числе с бессимптомными формами – мазки из зева и носа для обнаружения вируса (выявление РНК SARS-CoV-2 методом ПЦР или антигена вируса – экспресс-диагностика);
Для проведения исследования в медицинских офисах необходимо предъявить СНИЛС и документ удостоверяющий личность. Запись на исследование В случае получения положительного или сомнительного результата на COVID-19 и при необходимости проведения подтверждающего тестирования обра.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Вирус Эпштейна–Барр: причины появления, симптомы, диагностика и способы лечения.
Вирус Эпштейна–Барр может инфицировать различные типы клеток, включая B-клетки иммунной системы (разновидность лейкоцитов – белых кровяных телец) и эпителиальные клетки слизистых оболочек.
ВЭБ является представителем ДНК-содержащих вирусов из семейства Herpesviridae (герпесвирусы), подсемейства гамма-герпесвирусов и рода лимфокриптовирусов. В процессе репликации (самокопирования) вируса экспрессируется свыше 70 различных вирусспецифических белков. В настоящее время выделены группы иммуногенных белков, определение антител к которым дает возможность дифференцировать стадию инфекции (ЕА – ранний антиген, ЕВNА-1 — ядерный антиген, VCA — капсидный антиген, LMP — латентный мембранный белок).
Другой способ заражения – контактно-бытовой (вирус передается через зубные щетки, столовые приборы, полотенца и т.д.). ВЭБ также может распространяться через кровь и сперму.
ВЭБ размножается в В-лимфоцитах и эпителиальных клетках, в связи с чем характерно многообразие клинических проявлений данной патологии. Важной отличительной чертой вируса является то, что он не тормозит и не нарушает размножение В-лимфоцитов, а, наоборот, стимулирует его. В этом заключается особенность возбудителя - он размножается в клетках иммунной системы, заставляя их клонировать свою, вирусную, ДНК.
Хронический воспалительный процесс, вызванный ВЭБ, приводит к структурным и метаболическим нарушениям пораженных тканей, что является причиной возникновения разнообразной соматической патологии.
Классификация вируса Эпштейна-Барр
Единой классификации вирусной инфекции Эпштейна-Барр (ВИЭБ) не существует, к использованию в практической медицине предлагается следующая:
- по времени инфицирования – врожденная и приобретенная;
- по форме заболевания – типичная (инфекционный мононуклеоз) и атипичная: стертая, асимптомная, с поражением внутренних органов;
- по тяжести течения – легкая, средней степени и тяжелая;
- по продолжительности течения – острая, затяжная, хроническая;
- по фазе активности – активная и неактивная;
- смешанная инфекция – чаще всего наблюдается в сочетании с цитомегаловирусом.
- Инфекционный мононуклеоз (железистая лихорадка, болезнь Филатова) – распространенное инфекционное заболевание, основными проявлениями которого является подъем температуры до высоких значений, увеличение лимфатических узлов, воспаление слизистой оболочки глотки, увеличение печени и селезенки. ВЭБ в данном случае проникает через эпителий слизистых оболочек верхних дыхательных путей.
- Лимфогранулематоз (болезнь Ходжкина) и некоторые виды неходжкинских лимфом – группа заболеваний, объединенных злокачественной моноклональной пролиферацией лимфоидных клеток в лимфоузлах, костном мозге, селезенке, печени и желудочно-кишечном тракте.
- Синдром хронической усталости – состояние, характеризующееся длительным чувством усталости, которое не проходит после продолжительного отдыха.
- Синдром Алисы в стране чудес – состояние, клиническим проявлением которого является нарушение ощущения своего тела и отдельных его частей. Человек ощущает себя или части своего тела очень большими или очень маленькими по сравнению с действительностью.
- Гепатит, спровоцированный ВЭБ, часто является осложнением инфекционного мононуклеоза. Появляется слабость, тошнота, желтушность кожи и слизистых, увеличивается печень.
- Герпетическая инфекция в виде генитального или лабиального (на губах) поражения. Также возможен стоматит, вызванный ВЭБ. При активации инфекции появляется чувство жжения и боль, а затем множество маленьких пузырьков.
- Посттрансплантационная лимфопролиферативная болезнь – вторичное злокачественное заболевание, развивающееся после трансплантации гемопоэтических стволовых клеток (метод лечения, применяемый при онкологии, заболеваниях крови и др.), ассоциированное с ВЭБ-инфекцией.
- Рассеянный склероз – хроническое аутоиммунное заболевание, при котором поражается миелиновая оболочка нервных волокон головного и спинного мозга. Характеризуется большим количеством симптомов и зависит от уровня поражения: часто снижается мышечная сила, угасают рефлексы, появляются параличи (обездвиженность) различных локализаций.
- Волосатая лейкоплакия – на слизистой оболочке языка по бокам, на спинке либо на его нижней части появляются белые участки с шероховатой поверхностью. Они безболезненны и не причиняют существенного дискомфорта. Основная опасность заключается в возможности озлокачествления измененных клеток слизистой.
- Назофарингеальная карцинома – злокачественное образование глотки. Среди его симптомов часто встречаются заложенность носа, потеря слуха, частые отиты, появление крови в слюне, кровянистые выделения из носа, увеличение лимфоузлов, головные боли.
- Аутоиммунный тиреоидит – хроническое заболевание щитовидной железы, при котором в организме образуются антитела к тканям щитовидной железы. При данном заболевании возможно появление зоба (увеличение щитовидной железы), развитие симптомов гипотиреоза: отеки, повышенная утомляемость, сонливость, запоры, сухость кожи, выпадение волос.
Лабораторное обследование включает:
-
вирус Эпштейна–Барр, определение ДНК в крови (Epstein Barr virus, DNA);
Одной из актуальных проблем современной медицины является высокая инфицированность населения одним из представителей оппортунистических возбудителей — вирусом Эпштейна–Барр (ВЭБ).
Одной из актуальных проблем современной медицины является высокая инфицированность населения одним из представителей оппортунистических возбудителей — вирусом Эпштейна–Барр (ВЭБ). Практикующие врачи в своей повседневной практике чаще сталкиваются с клинически манифестными формами первичной Эпштейна–Барр-вирусной инфекции (ЭБВИ) в виде острой, как правило, не верифицированной респираторной инфекцией (более 40% случаев) или инфекционным мононуклеозом (около 18% всех заболеваний) [1, 2]. В большинстве случаев эти заболевания протекают доброкачественно и заканчиваются выздоровлением, но с пожизненной персистенцией ВЭБ в организме переболевшего [1, 3–5].
Однако в 10–25% случаев первичное инфицирование ВЭБ, протекающее бессимптомно, и острая ЭБВИ могут иметь неблагоприятные последствия [6–9] с формированием лимфопролиферативных и онкологических заболеваний, синдрома хронической усталости, ВЭБ-ассоциированного гемофагоцитарного синдрома и др. [7, 9, 11–14].
До настоящего времени нет четких критериев, позволяющих прогнозировать исход первичного инфицирования ВЭБ. Перед врачом, к которому обращается пациент с острой ЭБВИ, всегда встает вопрос: что предпринять в каждом конкретном случае, чтобы максимально снизить риск развития хронической ЭБВИ и ВЭБ-ассоциированных патологических состояний Этот вопрос не праздный, и ответить на него действительно очень трудно, т. к. до сих пор нет четкой патогенетически обоснованной схемы лечения больных, а имеющиеся рекомендации часто противоречат друг другу.
По мнению многих исследователей, лечение ЭБВИ-мононуклеоза (ЭБВИМ) не требует назначения специфической терапии [15–17]. Лечение больных, как правило, проводится в амбулаторных условиях, изоляция пациента не требуется. Показаниями к госпитализации следует считать длительную лихорадку, выраженный синдром тонзиллита и/или синдром ангины, полилимфаденопатию, желтуху, анемию, обструкцию дыхательных путей, боли в животе и развитие осложнений (хирургических, неврологических, гематологических, со стороны сердечно-сосудистой и дыхательной системы, синдром Рейе).
При легком и среднетяжелом течении ЭБВ ИМ больным целесообразно рекомендовать палатный или общий режим с возвращением к обычной деятельности на адекватном для каждого конкретного больного физическом и энергетическом уровне. Проведенное многоцентровое исследование показало, что необоснованно рекомендуемый строгий постельный режим удлиняет период выздоровления и сопровождается длительным астеническим синдромом, требующим нередко медикаментозного лечения [18].
При легком течении ЭБВ ИМ лечение больных ограничивается поддерживающей терапией, включающей адекватную гидратацию, полоскание ротоглотки раствором антисептиков (с добавлением 2% раствора лидокаина (ксилокаина) при выраженном дискомфорте в глотке), нестероидные противовоспалительные препараты, такие как парацетамол (Ацетаминофен, Тайленол). По мнению ряда авторов назначение блокаторов Н2 рецепторов, витаминов, гепатопротекторов и местная обработка миндалин различными антисептиками являются малоэффективными и необоснованными способами лечения [19, 20]. Из экзотических методов лечения следует упомянуть рекомендуемое Ф. Г. Боковым и соавт. (2006) применение мегадоз бифидобактерий при лечении больных острым мононуклеозом [21].
Мнения о целесообразности назначения антибактериальных препаратов при лечении ЭБВИМ весьма противоречивы. По мнению Gershburg E. (2005) тонзиллит при ИМ часто асептический и назначение антибактериальной терапии не оправдано. Также нет смысла в применении антибактериальных средств при катаральной ангине [4]. Показанием для назначения антибактериальных препаратов является присоединение вторичной бактериальной инфекции (развитие у больного лакунарной или некротической ангины, таких осложнений, как пневмония, плеврит и др.), о чем свидетельствуют сохраняющиеся более трех суток выраженные воспалительные изменения показателей крови и фебрильная лихорадка. Выбор препарата зависит от чувствительности микрофлоры на миндалинах больного к антибиотикам и возможных побочных реакций со стороны органов и систем.
По данным H. Fota-Markowcka et al. (2002) у больных чаще выделяют гемофильную палочку, стафилококк и пиогенный стрептококк, реже — грибы рода Candida [22], поэтому следует признать обоснованным назначение этим больным препаратов из группы цефалоспоринов 2–3 поколения, линкосамидов, макролидов и противогрибковых средств (флуконазол) в терапевтических дозах на 5–7 дней (реже — 10 дней) [4]. Некоторые авторы при наличии некротической ангины и гнилостном запахе изо рта, вызванных, вероятно, ассоциированной анаэробной флорой, рекомендуют использовать метронидазол по 0,75 г/сут, разделенных на 3 приема, в течение 7–10 дней.
Противопоказаны препараты из группы аминопенициллинов (ампициллин, амоксициллин (Флемоксин Солютаб, Хиконцил), амоксициллин с клавуланатом (Амоксиклав, Моксиклав, Аугментин)) из-за возможности развития аллергической реакции в виде экзантемы. Появление сыпи на аминопенициллины не является IgE-зависимой реакцией, поэтому применение блокаторов Н1 гистаминовых рецепторов не имеет ни профилактического, ни лечебного эффекта [19].
По мнению ряда авторов до настоящего времени сохраняется эмпирический подход к назначению глюкокортикостероидов больным с ЭБВИ [23]. Глюкокортикостероиды (преднизолон, преднизон (Делтазон, Метикортен, Оразон, Ликвид Пред), Солу Кортеф (гидрокортизон), дексаметазон) рекомендуются больным с тяжелым течением ЭБВИМ, с обструкцией дыхательных путей, неврологическими и гематологическими осложнениями (тяжелая тромбоцитопения, гемолитическая анемия) [4, 24]. Суточная доза преднизолона составляет 60–80 мг в течение 3–5 дней (реже 7 дней) с последующей быстрой отменой препарата. Одинаковой точки зрения на назначение этим больным глюкокортикостероидов при развитии миокардита, перикардита и поражениях ЦНС нет.
При тяжелом течении ЭБВИМ показана внутривенная дезинтоксикационная терапия, при разрыве селезенки — хирургическое лечение.
Наиболее дискуссионным остается вопрос о назначении противовирусной терапии больным с ЭБВИ. В настоящее время известен большой перечень препаратов, являющихся ингибиторами ВЭБ репликации в культуре клеток [4, 25–27].
I. Подавляющие активность ДНК-полимеразы ВЭБ:
- ациклические аналоги нуклеозидов (ацикловир, ганцикловир, пенцикловир, валацикловир, валганцикловир, фамцикловир);
- ациклические аналоги нуклеотидов (цидофовир, адефовир);
- аналоги пирофосфатов (Фоскарнет (фоскавир), фосфоноацетиловая кислота);
- 4 оксо-дигидрохинолины (возможно).
II. Различные соединения, не ингибирующие вирусной ДНК-полимеразы (механизм изучается): марибавир, бета-L-5 урацил йододиоксолан, индолокарбазол.
Однако проведенный метаанализ пяти рандомизированных контролируемых испытаний с участием 339 больных ЭБВИМ, принимавших ацикловир (Зовиракс), показал неэффективность препарата [28, 29].
Одна из возможных причин кроется в цикле развития ВЭБ, в котором ДНК вируса имеет линейную либо циркулярную (эписома) структуру и размножается в ядре клетки хозяина. Активная репликация вируса происходит при продуктивной (литической) стадии инфекционного процесса (ДНК ВЭБ линейной формы). При острой ЭБВИ и активации хронической ЭБВИ происходит цитолитический цикл развития вируса, при котором он запускает экспрессию собственных ранних антигенов и активирует некоторые гены клеток макроорганизма, продукты которых участвуют в репликации ВЭБ. При латентной ЭБВИ ДНК вируса имеет вид эписомы (круговой суперспиральный геном), находящейся в ядре. Циркулярный геном ДНК ВЭБ характерен для CD21+ лимфоцитов, в которых даже при первичном инфицировании вирусом практически не наблюдается литической стадии инфекционного процесса, а ДНК воспроизводится в виде эписомы синхронно с клеточным делением инфицированных клеток. Гибель пораженных ВЭБ В лимфоцитов связана не с опосредованным вирусом цитолизом, а с действием цитотоксических лимфоцитов [4].
При назначении противовирусных препаратов при ЭБВИ врач должен помнить, что их клиническая эффективность зависит от правильной трактовки клинических проявлений болезни, стадии инфекционного процесса и цикла развития вируса на этой стадии. Однако не менее важным является и тот факт, что большинство симптомов ЭБВИ связаны не с прямым цитопатическим действием вируса в инфицированных тканях, а с опосредованным иммунопатологическим ответом ВЭБ-инфицированных В лимфоцитов, циркулирующих в крови и находящихся в клетках пораженных органов. Именно поэтому аналоги нуклеозидов (ацикловир, ганцикловир и др.) и ингибиторы полимеразы (Фоскарнет), подавляющие репликацию ВЭБ и уменьшающие содержание вируса в слюне (но не санирующие ее полностью [4], не оказывают клинического эффекта на тяжесть и продолжительность симптомов ЭБВИМ.
Показаниями для лечения ЭБВИМ противовирусными препаратами являются: тяжелое, осложненное течение болезни, необходимость профилактики ВЭБ-ассоциированной В-клеточной лимфопролиферации у иммунокомпрометированных пациентов, ВЭБ-ассоциированная лейкоплакия. Bannett N. J., Domachowske J. (2010) рекомендуют применять ацикловир (Зовиракс) внутрь в дозе 800 мг внутрь 5 раз в сутки в течение 10 дней (или 10 мг/кг каждые 8 часов в течение 7–10 дней). При поражениях нервной системы предпочтителен внутривенный способ введения препарата в дозе 30 мг/кг/сут 3 раза в сутки в течение 7–10 дней.
По мнению E. Gershburg, J. S. Pagano (2005), если под действием каких-либо факторов (например, иммуномодуляторов, при ВЭБ-ассоциированных злокачественных опухолях — применение лучевой терапии, гемцитабина, доксорубицина, аргинина бутирата и др.) удается перевести ДНК ВЭБ из эписомы в активную репликативную форму, т. е. активировать литический цикл вируса, то в этом случае можно ожидать клинический эффект от противовирусной терапии.
В комплексной терапии рекомендуется внутривенное введение иммуноглобулинов (Гаммар-П, Полигам, Сандоглобулин, Альфаглобин и др.) 400 мг/кг/сут, № 4–5.
В последние годы все чаще для лечения ЭБВИ стали применять рекомбинантные альфа-интерфероны (Интрон А, Роферон-А, Реаферон-ЕС) по 1 млн ME в/м в течение 5–7 дней или через день; при хронической активной ЭБВИ — 3 млн ME в/м 3 раза в неделю, курс 12–36 недель.
Медикаментозная коррекция астенического синдрома при хронической ЭБВИ включает назначение адаптогенов, высоких доз витаминов группы В, ноотропных препаратов, антидепрессантов, психостимуляторов, препаратов с прохолинергическим механизмом действия и корректоров клеточного метаболизма [30–32].
Залогом успешного лечения больного с ЭБВИ являются комплексная терапия и строго индивидуальная тактика ведения как в стационаре, так и во время диспансерного наблюдения.
Литература
И. В. Шестакова, доктор медицинских наук, доцент
Н. Д. Ющук, доктор медицинских наук, профессор, академик РАМН
МГМСУ, Москва
Читайте также:

