Вирус эпштейн барра реферат
Обновлено: 17.04.2024
Поражения вирусом Эпштейна-Барр гематологических больных - диагностика, лечение
Вирусом Эпштейна — Барр (ЭБВ) инфицировано не менее 95 % взрослого населения во всех странах. У большинства людей первичная ЭБВ-инфекция протекает субклинически, а у меньшинства в виде инфекционного мононуклеоза. Случаи летального фульминантного мононуклеоза очень редки и чаще встречаются в группе больных одной из форм врожденного иммунодефицита — Х-сцепленным лимфопролиферативным синдромом (Х-ЛПС, или синдром Пуртильо). Главная особенность при это синдроме — отсутствие способности ограничивать пролиферацию ЭБВ-инфицированных В-лимфоцитов.
Второе по частоте проявление первичной ЭБВ-инфекции у больных с этим синдромом — лимфома Беркитта и, реже, лимфома Ходжкина. Соответственно у всех мальчиков с фульминантным мононуклеозом и семейными случаями лимфом Беркитта и Ходжкина необходимо заподозрить Х-ЛПС.
Резервуаром вируса Эпштейна — Барр (ЭБВ) являются В-лимфоциты и эпителиальные клетки слизистой оболочки носоглотки. Пожизненное латентное состояние вируса поддерживается цитотоксическими ЭБВ-специфическими Т-лимфоцитами, которые составляют около 1 % от всех циркулирующих лимфоцитов крови. При развитии длительного и глубокого дефицита Т-лимфоцитов возможна пролиферация ЭБВ-инфицированных В-лимфоцитов. Это состояние, описанное в конце 70-х годов XX в. у больных реципиентов донорской почки, названо В-клеточным лимфопролиферативным синдромом (В-ЛПС). Любая аллогенная трансплантация (почки, печени, сердца, легких, ГСК) может осложниться В-ЛПС.
Среди гематологических больных наивысший риск развития В-ЛПС отмечается у реципиентов аллогенного костного мозга, хотя отдельные случаи описаны после аутологичных трансплантаций и у реципиентов иммуносупрессивной терапии.
Риск развития В-ЛПС у реципиентов ТГСК оценивается как 1 % в течение 10 лет. В течение 1-го года он составляет 120 случаев на 10 000 пересадок и лишь 5 на 10 000 в последующие годы. Факторами риска развития В-ЛПС являются причины, способствующие возникновению или поддержанию Т-иммунодефицита.
Для клинической картины В-ЛПС характерны увеличение лимфатических узлов, печени, селезенки, высокая лихорадка и инфильтрация нелимфоидных органов. Вовлечение серозных оболочек приводит к развитию полисерозитов с массивными плевральными, перикардиальными выпотами и асцитом. При поражении лимфатических узлов средостения на первый план выступает синдром компрессии: нарушение притока крови к правому предсердию, сдавление трахеи. Нередко, как и при других В-клеточных пролиферациях у больных с Т-клеточным иммунодефицитом, при ЭБВ-ЛПС поражается ЦНС. Известны случаи развития тяжелого гемофагоцитарного синдрома в финальной стадии В-ЛПС.
Для лабораторной картины характерны наличие высокого моноклонального пика иммуноглобулинов класса М или G в сыворотке крови и подъем ЛДГ. Дискордантное восстановление репертуара В-лимфоцитов после аллотрансплантации иногда и в норме приводит к появлению высоких моноклональных пиков иммуноглобулинов, не связанных с В-ЛПС. Другие лабораторные признаки еще менее специфичны.
Патологическим субстратом при В-ЛПС являются ЭБВ-трансформированные В-лимфоциты, которые в подавляющем большинстве случаев имеют донорское происхождение. В связи с этим для профилактики В-ЛПС донорского происхождения на ранних стадиях после трансплантации гемопоэтических стволовых клеток (ТГСК) достаточно высокодозного миелоаблативного кондиционирования перед ТКМ, вызывающего глубокое истощение пула В-клеток донора.
Морфологически в отличие от реципиентов солидных органов, В-ЛПС которых имеют морфологию полиморфных крупноклеточных лимфом, В-ЛПС у реципиентов ТГСК примерно в половине случаев имеют морфологию иммунобластных лимфом. Еще одним отличием является олиго- или моноклональность В-ЛПС у реципиентов аллогенной ТКМ, хотя иногда удается проследить становление истинной моноклональной опухоли через стадии поликлональной и олигоклональной лимфопролиферации.
Интересно, что на стадии полиморфной лимфомы моноклональность обнаруживается менее чем в половине случаев, а при иммунобластных лимфомах — практически в 100 %.
Основными факторами риска развития В-ЛПС являются следующие: Т-деплеция трансплантата, лечение или профилактика РТПХ анти-CD3-моноклональными антителами, лечение или профилактика РТПХ антитимоцитарным глобулином, неродственный или родственный неполностью совместимый донор.
Самый высокий риск развития В-ЛПС, составляющий 64,8 ± 17,7 % через 4 года после трансплантации, присущ детям с тяжелыми комбинированными иммунодефицитными синдромами, получивших Т-деплетированный трансплантат от гаплоидентичного донора, тогда как у больных ТКИН, получивших HLA гено- или феноидентичный трансплантат без Т-деплеции, риск составляет 0,9 ± 0,2 %. Среди реципиентов неродственных трансплантаций с Т-деплецией частота посттрансплантационных В-ЛПС равна 5 %, без Т-деплеции — 1 %. Метод Т-деплеции значительно влияет на вероятность развития В-ЛПС.
В прошлом диагностика В-ЛПС основывалась на характерной патоморфологической картине биоптатов лимфатических узлов и пораженных органов и демонстрации наличия ДНК Эпштейна-Барр вируса (ЭБВ) в клетках опухоли. Важным лабораторным ориентиром служит появление моноклонального пика в глобулиновой фракции. Все эти данные являются, однако, поздними маркерами, которые констатируют заболевание на этапе, когда любая терапия малоэффективна. В настоящее время разработаны полуколичественные и количественные методы мониторинга ДНК Эпштейна-Барр вируса (ЭБВ) в крови, которые позволяют на ранних стадиях оценить риск развития В-ЛПС и назначить упреждающее лечение.
При исследовании частоты реактивации Эпштейна-Барр вируса (ЭБВ) в течение 180 дней после аллогенной ТГСК методом измерения количества копий ДНК Эпштейна-Барр вируса (ЭБВ) в крови выяснилось, что частота реактивации (количество копий генома в 1 мл крови более 50) составляет 39 % после трансплантации нативных ГСК и 65 % после Т-деплетированных трансплантаций. Среди больных, у которых количество копий генома Эпштейна-Барр вируса (ЭБВ) оказалось более 1000 в 1 мл, частота В-ЛПС составила 39 %, в то время как ни у кого из больных с показателем менее 1000 копий в 1 мл не развивался В-ЛПС. Таким образом, количественный мониторинг концентрации вирусной ДНК позволяет выявить популяцию высокого риска развития В-ЛПС. Возможно, что мониторинг вирусной ДНК не в цельной крови, а в плазме является еще более эффективным и специфичным методом ранней диагностики В-ЛПС.
Лечение уже развившегося В-ЛПС представляет сложную задачу. Химиотерапия и а-интерферон не показали воспроизводимой эффективности после ТГСК, хотя после трансплантации солидных органов их эффективность может быть выше, чем после ТГСК. Эпштейна-Барр вирус (ЭБВ) нечувствителен к ингибиторам тимидинкиназы типа ганцикловира и ацикловира, в то время как сидофовир может быть эффективен. Редукция иммуносупрессии, которая может быть предпринята после трансплантации солидных органов, чаще всего невозможна у реципиентов аллогенных ТГСК, поскольку может привести к вспышке РТПХ, которая, помимо того, что сама по себе может вызвать смерть пациента, способствует резкому усугублению иммунодефицита.
Несомненно, что в настоящее время мониторинг реактивации Эпштейна-Барр вируса в популяциях высокого риска и упреждающее лечение ритуксимабом являются методами выбора контроля В-ЛПС. Другой эффективный метод лечения В-ЛПС — клеточная терапия. Инфузии нативных донорских лимфоцитов в дозе более 1 * 106/кг высокоэффективны, однако чреваты высокой частотой развития тяжелой РТПХ. В некоторых самых передовых центрах используется введение ЭБВ-специфических Т-лимфоцитов донора, генерированных in vitro. Эффективность данного метода приближается к 80—90 %. Понятно, что клеточные технологии требуют высокого технологического уровня и доступны далеко не везде.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Инфекция, вызванная онкогенными вирусами, является причиной 15,4% заболеваний раком по всей земле. Первый онкогенный вирус, который был идентифицирован — это куриный вирус саркомы Рауса в 1911 году. Десятилетиями позже были обнаружены серии других онкогенных вирусов, в том числе вирус папилломы Шопа (вирус папилломы кроличьего хвоста), вирус опухоли молочной железы мыши, аденовирус, вирус SV40 (обезьяний вирус sv40). Теория опосредованного вирусом онкогенеза в итоге была экспериментально продемонстрирована в 1976 году Гарольдом Вармусом и Майклом Бишопом путем превращения инфицированных клеток в опухолевые вирусом саркомы (ген v-src вызывает образование опухоли после захвата протоонкогена человеческой клетки в результате трансдукции).
Несмотря на то, что онкогенные вирусы нашли в исследованиях онкогенной активности животных клеток, они были не в состоянии преобразовать человеческие клетки. Теория вирусного онкогенеза в человеческой клетке оставалась спорной до 1965 года, когда вирус Эпштейн-Барр (EBV) был обнаружен в клетках лимфомы Беркитта. В ходе последующих исследований, в том числе выделении Т-лимфотропного вируса человека (HTLV) из клеток Т-клеточной лимфомы и выявлении роли папилломовирусов человека с высокой онкогенной активностью в развитии рака шейки матки, был определен путь для понятия человеческих онкогенных вирусов. Обнаружение связи между герпес-вирусом и саркомой Капоши (KSHV) и лимфомой и между полиомавирусом клеток Меркеля (MCV) и карциномой клеток Меркеля (MCC) подчеркнуло возможность открытия еще большего количества онкогенных вирусов с помощью современных технологий. Далее каждый вирус будет рассмотрен отдельно.
Вирус Эпштейн-Барр
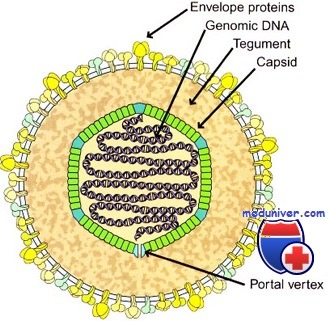
Вирус Эпштейн-Барр (ВЭБ, EBV) — ДНК-содержащий вирус, который преимущественно поражает B-лимфоциты, также является митогеном для них; вызывает лимфопролиферативные болезни (лимфома Беркитта, носоглоточная карцинома, NK-клеточная лейкемия, лимфома Ходжкина и т.д.), а также инфекционный мононуклеоз. Вирионы вируса были обнаружены при электронной микроскопии биоптата лимфомы Беркитта в начале 1964 года Энтони Эпштейном и Ивонной Барр.
Строение. ВЭБ имеет вирусный капсидный антиген (VCA), ядерные антигены-EBNAs 1, 2, 3, 3a, 3b, 3c; латентные мембранные протеины (LMPs) 1, 2 и две маленькие Эпштейна-Барр-кодируемые РНК (EBER) молекулы — EBER1 и EBER2. EBNAs и LMPs являются ДНК-связывающими белками, считающимися необходимыми для развития инфекции и фиксации.
Промотор репликации плазмидного вектора показан оранжевым. Короткие толстые зеленые стрелки представляют экзоны, кодирующие латентные белки: (EBNAs 1, 2, 3A, 3B and 3C, and EBNA‑LP, LMPs 1, 2A and 2B, BHRF1,BARF1). Короткие голубые стрелки сверху представляют наиболее транскрибириуемые полиаденилированные ВЭБ-кодируемые РНК (EBER1, EBER2). Средняя длинная зеленая линия представляет транскрипцию ВЭБ при 3-ем типе латентности, в которой белки EBNA транскрибированы с промотора Ср или Wp. Различные EBNA кодированы индивидуальными мРНК, которые сгенерированы различным сплайсингом одного и того же длинного первичного транскрипта. Внутренняя красная линия представляет транскрипт EBNA1, который берет начало от промотора Qp при 1 и 2 типе латентности.
- необходим для трансформации В-лимфоцитов;
- функционирует как конститутивный активатор рецептора ФНО и имеет сходство с CD-40 рецептором;
- активирует сигнальные пути, которые делают вклад в онкогенный эффект.
В зависимости от набора экспрессируемых вирусных генов в пораженных клетках выделяют три типа латентности (I, II и III тип), характерные для различных видов лимфом: I тип подразумевает избирательную экспрессию EBNA-1 при ВЭБ-положительной лимфоме Беркитта; II тип заключается в экспрессии EBNA-1, LMP-1 и LMP-2 и является отличительным признаком ВЭБ-положительной ходжкинской лимфомы, периферических T/NK-клеточных лимфом; латентность III типа, характеризуемая экспрессией всего набора из девяти латентных белков ВЭБ, наблюдается при лимфопролиферативных поражениях, возникающих у пациентов с тяжелым иммунодефицитом (после трансплантации паренхиматозных органов или стволовых клеток, ВИЧ-инфекции). Тип латентности определяет восприимчивость инфицированных клеток к различным иммунотерапевтическим тактикам. Индуцированные ВЭБ злокачественные новообразования связаны с экспрессией латентных генов. У большинства иммунокомпетентных носителей ВЭБ вирус не индуцирует опухолевый процесс. Новообразования развиваются при комплексном взаимодействии ВЭБ, иммуногенетических факторов, факторов внешней среды (паразитарных инфекций — чаще, малярии, недоедании, потреблении пищи, содержащей канцерогены) и иммунодефицита (ВИЧ-инфекция, трансплантация).
Папилломавирусы человека
Описано около 200 папилломавирусов. Вирусы передаются при контактах через микротравмы кожи и слизистых оболочек, а также половым путем. Папилломавирусы человека вызывают доброкачественные кожные, генитальные, оральные и конъюнктивальные папилломы; индуцируют пролиферацию эпителия, обладают онкогенным потенциалом. С папилломавирусом, особенно ПВЧ-5 и ПВЧ-8, тесно связано развитие немеланомных разновидностей рака кожи. Различают низкоонкогенные папилломавирусы, вызывающие бородавки, которые не малигнизируются, и высокоонкогенные, способные вызвать рак шейки матки, — ПВЧ-16, 18, 31, 33, 35, 45, 51, 52, 58.
Строение. Капсид икосаэдрический, состоит из двух капсидных белков (L1-L2), формирующих 72 пентамера. Геном — двунитевая циркулярная ДНК; имеет в зависимости от вируса восемь ранних генов (E1-E8) и два поздних гена (L1-L2). Гены E6-E7 обладают онкогенной активностью.
Патогенез. В целом, для развития продуктивного поражения ВПЧ (высокого или низкого риска) требуется, чтобы вирус имел доступ к эпителию базального слоя как только эпителиальный барьер был подвержен риску. Папилломавирусы должны инфицировать делящуюся клетку, чтобы стать признанными как малое количество копий ядерной эписомы, и для развития стойкого поражения первичная инфицированная клетка, вероятно, должна быть похожа на долгоживующую эпителиальную стволовую клетку или похожую на нее. Кроме того, связанные с заживлением ран изменения в местном микроокружении, включая увеличение количества факторов роста, могут играть ключевую роль в создании резервуара инфекции в базальном слое. Способность ВПЧ инфицировать, и реплицироваться, и управлять прогрессированием рака зависит от функции вирусного белка, положении в эпителии, где эти белки экспрессируются. Как только инфицированные базальные клетки поделились и в конечном итоге вошли в парабазальный слой, они начинают проходить программу экспрессии генов, которая связана с дифференциацией. Амплификация вирусного генома обычно происходит в срединно-эпителиальных слоях, тогда как сбор и выход вируса происходит вблизи наружной поверхности эпителия.
Несмотря на то, что эффективная амплификация генома требует комбинированного действия множественных продуктов вирусного гена, включая E6, E7, E2 и кодированную вирусом геликазы E1, поддержание репликации в базальном слое эпителия может зависеть от факторов репликации клетки хозяина. Программа, зависящая от дифференциации, которая происходит в надбазальных слоях эпителиальной клетки, включает как временные изменения в активности промотора, так и изменения в шаблонах сплайсинга мРНК, которые облегчают производство различных продуктов вирусных генов на разных стадиях во время программы дифференциации. Функция вирусного белка далее регулируется посттрансляционной модификацией, включая фосфорилирование и протеолитическое деление клетки.

Герпесвирус, ассоциированный с саркомой Капоши
KSHV, или человеческий герпесвирус 8, был обнаружен в 1994 году как член семейства гамма-герпеса человека, присоединившись к ВЭБ. Инфекция иммунокомпрометированных индивидуумов с KSHV была связана с развитием саркомы Капоши, полученной из эндотелиальных клеток, и по меньшей мере двумя B-лимфоцит лимфопролиферативными заболеваниями: первичная выпотная лимфома и многоцентричная болезнь Кастлмана. Однако изучение патогенеза и онкогенеза KSHV затруднено отсутствием значимой модели животных и восприимчивой клеточной культуры.
Онкогенное действие. Две иммортализованные клеточные линии, KS Y-1 и SLK, когда-то использовались для исследований KS и KSHV, но в KS Y-1 были также обнаружены клетки линии рака мочевого пузыря T 24, что затруднило дальнейшую работу. Первичные эмбриональные метанефрические мезенхимальные клетки-предшественники почек крысы восприимчивы к инфекции и трансформации KSHV, но из них распространяются ограниченное количество инфекционных вирионов. Линии B-клеток, полученные из первичной выпотной лимфомы, обычно заражаются KSHV на латентной стадии и могут быть индуцированы для получения малого количества вирионов KSHV, но первичные B-лимфоциты из периферической крови или тонзиллярной ткани являются устойчивыми к инфекции KSHV, и для их инфицирования может потребоваться совместный рост с KSHV-позитивными клетками.
KSHV кодирует несколько важных белков, которые обладают некоторой онкогенной активностью для индуцирования пролиферации клеток, иммортализации, трансформации и передачи сигналов; производства цитокинов; иммунного контроля; антиапоптозной активности; и ангиогенеза. К ним относятся вирусные латентные белки, латентный ассоциированный ядерный антиген (LANA), vFLIP (FADD (Fas-ассоциированный белок с доменом смерти), подобный ферменту, ингибирующему синтез интерферона или ингибирующему белок каспазы 8 (FLICE)), vCyclin и вирусные литические белки G-белкового рецептора (vGPCR), интерферон-регуляторный фактор 1 (vIRF-1) и K1. Хотя истинную онкогенную природу каждого белка еще предстоит определить, накопление доказательств указывает на то, что каждый из них вносит свой вклад в онкогенез KSHV. Таким образом, полный спектр вызванной KSHV злокачественности может потребовать, чтобы несколько онкогенных продуктов работали вместе в присутствии клеток хозяев и экологических факторов. Например, как LANA, так и vIRF-1 нацелены на клеточный опухолевый супрессор p53. LANA также ингибирует pRB и PP2A.vCyclin, активатор CDK4 6,198, подавляет p27kip1, ингибитор CDK199 и вызывает реакцию на задержку старения G1, результаты от гиперактивации NF-κB. vFLIP и K1 активируют путь сигнала NF-κB для предотвращения апоптоза B-клеток. vGPCR и K1 влияют на сигнальные пути AKT и NF-κB и способствуют ангиопролиферативному и воспалительному поражению саркомой Капоши.
Т-лимфотропный вирус человека (HTLV)
T-лимфотропный вирус человека (HTLV) относится к семейству ретровирусов, является возбудителем T-клеточного лимфолейкоза взрослых. Вирус впервые был изолирован в 1980 году от больного Т-лимфомой.
Геном. Gag, Pol и Env являются вирусными структурными белками, другие — вирусными регуляторными/вспомогательными белками. За исключением гена hbz, который кодируется минус-цепью провирусного генома HTLV из 3'-LTR, все остальные гены кодируются плюсовой нитью по направлению 5'-LTR. Следует отметить, что 5'-LTR часто удаляется или метилируется по мере прогрессирования заболевания. Кроме того, на поздних стадиях лейкемиогенеза в гене tax часто возникают нонсенс- или миссенс-мутации. Хотя белок tax и ген HBZ индуцируют опухоли у трансгенных мышей, а p12 проявляет слабую онкогенную активность, ни один из вирусных белков/генов, кроме tax, не требуется для опосредованного HTLV-1 опухолеобразования. Продукт tax гена действует на терминальные повторы LTR, стимулируя синтез вирусной иРНК, а также образование рецепторов IL-2 на поверхности зараженной клетки.

Рисунок 3. Gag, Pol и Env вирусные регуляторные/вспомогательные белки HTLV

Рисунок 4. К леточные пути вирусного онкобелка tax
Патогенез. Проникновение HTLV-1 в клетку человека охарактеризовывает начало выживания и репликации вируса. HTLV-1 связывается с рецептором клеток, имеющих необходимый антиген, что инициирует процесс инвазии. Рецепторный комплекс состоит из транспортера глюкозы (GLUT1), гепаринсульфат протеогликана (HSPG) и рецептора VEGF-165 нейропилина-1 (NRP-1). HTLV-1 взаимодействует с HSPG. Процесс слияния происходит через комбинацию GLUT1 с HSPG/NRP-1, после чего ядро, содержащее вирусную РНК, доставляется в цитоплазму клеток-мишеней. После обратной транскрипции HTLV-1 встраивает свой геном в генома хозяина, чтобы сформировать провирус, окруженный двумя LTR на 5' и 3' концах. Затем провирус транскрибируется и кодирует структурные, регуляторные и вспомогательные белки. Впоследствии вирусные геномные РНК и Gag, Env и Gag-Pol белки переносятся в плазматическую мембрану, чтобы начать собираться в зрелую вирусную частицу.
Вирусы гепатита
Вирус гепатита В (HBV) и вирус гепатита С (HCV) представляют собой несвязанные вирусы, имеющие тропность к гепатоцитам и реплицирующиеся в них. Около 2 миллиардов человек инфицированы HBV, и более 350 миллионов человек становятся хроническими носителями. Только 5-10% взрослых, которые приобретают инфекцию, становятся хроническими носителями, у 30% развиваются прогрессирующие хронические заболевания печени: гепатит, фиброз, цирроз и, наконец, гепатоцеллюлярная карцинома (HCC).
Патогенез. HCC, индуцированная посредством HBV и HCV, развивается в области воспаления и регенерации, что является результатом хронического повреждения печени, а это в свою очередь указывает на то, что патогенез HCC иммунно-опосредован. Эти вирусы постоянно реплицируются в культуре клеток без явных повреждений и смерти клеток, подразумевая, что они являются не цитопатическими. Постоянная репликация вируса является фактором риска для образования HCC, потому что воспаление часто приводит к длительным хроническим заболеваниям печени CLD без выведения вируса. В этом контексте HBV и HCV генерируют белки, подавляющие иммунитет, который должен контролировать хронические инфекции. HBV- и HCV-кодированные белки изменяют экспрессию гена хозяина и клеточный фенотип, что является признаком рака. Эти изменения способствуют независимой от фактора роста пролиферации, сопротивлению к ингибированию роста, инвазии тканей и метастазированию, ангиогенезу, перепрограммированию энергетического метаболизма и устойчивости к апоптозу. Хроническое воспаление также способствует генетической нестабильности в клетках опухоли. Вклад HBV в развитие HCC включает в себя экспрессию гена гепатита Bx (HBx) и, возможно, усеченные пре-S или S-полипептиды карбоксимицина; основной белок и неструктурные (NS) белки NS3 и NS5A HCV способствуют онкогенной трансформации. Изменения в экспрессии гена хозяина, которые способствуют возникновению опухолевого генеза, также, похоже, поддерживают репликацию вируса и/или защиты вирусных гепатоцитов от иммунного опосредованного повреждения и разрушения.

Иммунитет играет важную роль в исходе острых инфекций. Быстрый, сильный и мультиспецифичный ответ против многих белков вирусов гепатита В (HBV) и гепатита C (HCV) приводит к острой инфекции, устраняемой клеткой-хозяином.
Источники
Oncogenes and RNA splicing of human tumor viruses. Masahiko Ajiro & Zhi-Ming Zheng.(September 2014)
Carcinogenic human papillomavirus infection. Mark Schiffman, John Doorbar, Nicolas Wentzensen, Silvia de Sanjosé, Carole Fakhry, Bradley J. Monk, Margaret A. Stanley & Silvia Franceschi.( December 2016)
Human T-cell lymphotropic virus type 1 and its oncogenesis Lan-lan ZHANG, Jing-yun WEI, Long WANG, Shi-le HUANG, Ji-Long CHEN.(2017)
Immunoblastic Lymphoma in Persons with AIDS-Associated Kaposi's Sarcoma: a Role for Kaposi's Sarcoma–Associated Herpesvirus. Eric A Engels M.D., Stefania Pittaluga M.D., Denise Whitby Ph.D., Charles Rabkin M.D., Yoshiyasu Aoki M.D., Elaine S Jaffe M.D. & James J Goedert M.D.(may 2003)
Kaposi’s sarcoma-associated herpesvirus ORF34 is essential for late gene expression and virus production. Mayu Nishimura, Tadashi Watanabe, Syota Yagi, Takahiro Yamanaka & Masahiro Fujimuro( march 2017)
Саркома Капоши: патогенез и основы терапии Н.С. Потекаев, Г.А. Паньшин, Н.П. Теплюк, Н.С. Арсентьев, Е.Ю.,Вертиева,Г.И. Махов, Е.С. Сизова, В.С. Пауков, М.Г. Карташова. (март 2013)
Human T-Cell Lymphotropic Virus: A Model of NF-κB-Associated Tumorigenesis. Zhaoxia Qu and Gutian Xiao(June 2011)
Immune responses and immunopathology in acute and chronic viral hepatitis. Eui-Cheol Shin, Pil Soo Sung & Su-Hyung Park(July 2016)
Pathogenic mechanisms in HBV and HCV-associated hepatocellular carcinoma. Alla Arzumanyan, Helena M. G. P. V. Reis and Mark A. Feitelson(February 2013) Epstein–Barr virus: more than 50 years old and still providing surprises. Lawrence S. Young, Lee Fah Yap & Paul G. Murray( September 2016)
Медицинская микробиология, вирусология и иммунология. В.В. Зверев, А. С. Быков.

Вирус Эпштейна-Барр (ВЭБ) — ДНК-геномный герпесвирус человека из подсемейства Gammaherpesviridae. Он проявляет тропность к В-лимфоцитам (через специфический рецептор CD-21) и эпителиальным клеткам, а также онкогенные свойства.
Источником является больной человек. Пути заражения — воздушно-капельный (в подавляющем большинстве случаев), трансплацентарный, гемотрансфузионный.
Один из самых распространенных вирусов: инфицированность взрослого мирового населения составляет более 90 % и почти не варьируется в зависимости от этноса, условий жизни, доступности медицинской помощи и т. д.
Клинические проявления ВЭБ-инфекции различны. При заражении в раннем детском возрасте клиника может быть стертой, а при заражении в школьном и подростковом возрасте обычно развивается симптомокомплекс инфекционного мононуклеоза (ИМ): фебрильная лихорадка, тонзиллит, лимфаденопатия, гепатоспленомегалия и появление в крови атипичных мононуклеаров.
Этиологическую диагностику Эпштейна-Барр инфекции и оценку ее активности проводят при помощи определения антител к раннему антигену ЕА, к ядерному антигену VCA, EBNA, антител к EBV классов IgG и IgM, серологического профиля (IgMEA-IgG/EBNA-IgG), и, конечно, определения ДНК вируса методом ПЦР в слюне, сыворотке крови и ЦСЖ больного; согласно последним данным, серологические реакции Пауля-Буннеля, Томчика, Ловрика и т. д. показывают до 30 % ложноположительных реакций у лихорадочных больных, а потому их применимость сомнительна.
Если говорить о неврологических проявлениях ВЭБ-инфекции, то и этот список выглядит не менее впечатляющим: энцефалит, энцефаломиелит, поперечный миелит, асептический менингит, острая церебеллярная атаксия, синдром Алисы в стране чудес (аутометаморфопсия), синдром Гийена-Барре. Также доказана роль ВЭБ в развитии острого рассеянного энцефаломиелита, но для его развития могут послужить и другие инфекционные агенты.
Поражение центральной и периферической нервной систем при ВЭБ-инфекции может проявиться как на фоне симптомов мононуклеоза, так и изолированно, и протекать как в острой, так и в хронической форме.
Однако в процентном соотношении поражение ЦНС при мононуклеозе — явление нечастое, и выявляется примерно в 1 % случаев клинически явного ИМ.
Эпштейн-Барр энцефалит у иммунокомпетентных пациентов.
Клиническая картина
Типично развивается на фоне инфекционного мононуклеоза, чаще всего — на 3–7 день болезни. Специфические (исключая симптомы, и так характерные для ИМ) признаки включают в себя фокальные и генерализованные судорожные приступы, вплоть до развития эпилептического статуса, очаговые неврологические дефициты (обычно в виде слабости/спастичности в конечностях, атаксии, асимметрии рефлексов, нарушений слуха и зрения).
Возможно развитие симптоматики энцефалита или энцефаломиелита вне картины инфекционного мононуклеоза, в том числе у людей, перенесших ИМ в прошлом, как проявление реактивации латентной инфекции
Проведя ЭЭГ, можно увидеть диффузное или фокальное замедление ритма, эпилептиформные паттерны, или, в части случаев — нормальную картину.
Лучевые признаки
Радиологические проявления вариабельны (и также могут отсутствовать при наличии клиники). Методом выбора является МРТ.
Сигнальные характеристики энцефалитических очагов те же, что и при энцефалитах другой этиологии:
- одним из лучевых паттернов ВЭБ-энцефалита является симметричное поражение подкорковых структур: таламусов, базальных ядер, островковой доли
- симметричное или асимметричное поражение гиппокампов, коры височных и (реже) теменных областей, ножек мозга, понтинных структур, гемисфер мозжечка
- поражение структур ствола и спинного мозга (иногда в виде поперечного миелита).

Рисунок 1 | A. T1ВИ не выявляет никаких аномалий. B. T2-взвешенное изображение демонстрирует высокую интенсивность сигнала от валика мозолистого тела. С. последовательность FLAIR определила дополнительные области высокого сигнала в задних отделах обоих полушарий. D. все выявленные очаги демонстрировали повышение сигнала на DWI. Е. карта ИКД подтвердила ограничение диффузии в только в валике мозолистого тела. F. на постконтрастном T1ВИ не обнаруживается областей контрастного усиления.
Рисунок 2 | 5-летний мальчик с лихорадкой, судорогами и изменением психического статуса. Аксиальное FLAIR изображение показывает симметричные области гиперинтенсивного сигнала и признаки отека паренхимы мозга в области стриатума с вовлечением наружной капсулы (большие стрелки) и правой поясной извилины (маленькая стрелка).
Рисунок 3 | На аксиальном FLAIR изображении определяется аномально высокий МР-сигнал от тел хвостатых ядер, а также области поражения коры и субкортикального белого вещества головного мозга (стрелки).
Рисунок 4 | Мужчина 43 лет с синдромом приобретенного иммунодефицита, слабостью в нижних конечностях и расстройством мочеиспускания. МР-томограмма поясничного отдела позвоночника после введения контраста определила область гиперинтенсивного в Т2-взвешенных последовательностях сигнала от спинного мозга на уровне Th11–Th12 (миелит).
Инфекции вызванные вирусом Эпштейна—Барр, вирусами герпеса типа 6,7,8: клиника, диагностика
Геном вируса Эпштейна—Барр кодирует характерный для него ядерный антигенный комплекс, латентный мембранный белок, терминальный протеин, мембранный антигенный комплекс, ранний и вирусный капсидный антигены.
Эпидемиология и патогенез инфекции вызванной вирусом Эпштейна—Барра. Как и цитомегаловирус, вирус Эпштейна—Барр широко распространён среди маленьких детей развивающихся стран и среди взрослого населения индустриальных стран. Попадая в организм человека через носоглотку, он поражает В-лимфоциты и распространяется по всему организму.
Вирус способен продлевать жизнь В-лимфоцитам, что приводит к развитию неоплазии, например лимфомы Беркитта (мелкоклеточная лимфома с нерассечёнными ядрами, которую регистрируют в Африке, ниже Сахары, в регионах с высокой заболеваемостью малярией), носоглоточной карциномы (распространена в Китае) и лимфомы (у пациентов со сниженным иммунитетом).
Кроме того, возбудитель может стать причиной лимфопролиферативных заболеваний у пациентов после трансплантации.
Клинические признаки инфекции вызванной вирусом Эпштейна—Барра. Основные признаки инфекции — повышение температуры, общее недомогание, боль в горле, лимфаденопатия и иногда гепатит. Длительность заболевания около 2 нед, но у некоторых пациентов наблюдают симптомы персистирующей инфекции. Эпштейна—Барр инфекция ассоциируется с возникновением опухолей.
Диагностика инфекции вызванной вирусом Эпштейна—Барра. Методы: быстрая реакция агглютинации на предметном стекле. Для подтверждения диагноза применяют ИФА (определение специфического IgM к вирусному капсидному антигену) и молекулярно-генетический метод.

Инфекции вызванные вирусами герпеса человека типа 6 и 7
Впервые выделенные в 1980-х годах, эти бета-герпес-вирусы — единственные представители рода Roseolovirus. Выделяют два подтипа ВГЧ-6, поражающих Т-лимфоциты человека, — А и В. Заражение происходит при контакте со слюной инфицированных лиц.
К концу второго года жизни вирус присутствует в организме практически всех людей. Отмечают внезапное возникновение экзантемы (шестая болезнь), лихорадки (в течение 3—5 дней).
Описано течение болезни без возникновения высыпаний. ВГЧ-6 играет большую роль в развитии фебрильных судорог и энцефалита у детей. Последний, наряду с молниеносным гепатитом, — достаточно редкое осложнение. Диагностические мероприятия включают обнаружение IgG с помощью ИФА и молекулярно-генетический метод.
Практически все дети в возрасте до пяти лет заражены ВГЧ-7. До настоящего времени клинические признаки чётко не описаны, но существуют доказательства связи заболевания с развитием энцефалита.
В основе диагностики — определение специфических антител в ИФА (исследование парных сывороток).
Инфекция вызванная вирусом герпеса человека типа 8 - саркомавирусом Капоши
ВГЧ-8 относят к у-герпес-вирусам. Он имеет много общего с вирусом герпеса обезьян. Механизм передачи — вертикальный и контактный. На начальной стадии заболевание протекает в виде мононуклеозоподобного синдрома. Позже у пациентов со сниженным иммунитетом (особенно у ВИЧ-инфицированных) развивается саркома Капоши.
Диагностика: молекулярно-генетический метод (в образцах поражённых тканей), ИФА, реакция непрямой флюоресценции.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Вирус Эпстайна-Барр выделен английским вирусологом М. Эпстайном и канадским вирусологом И.Барр из биоптатов пациентов с лимфомами Бёркитта (1964). Инфицирование регистрируют повсеместно; специфические AT выявляют у 90% лиц старше 40 лет.
Резервуар инфекции вируса Эпстайн-Барра — человек. Основной путь передачи вируса Эпстайн-Барра — воздушно-капельный, реже трансмиссивный или половой. В раннем возрасте инфекцию сопровождают стёртые проявления, либо она бывает вообще бессимптомной.
Первичное инфицирование вирусом Эпстайна-Барра в подростковом или более старшем возрасте может вызвать заболевание, известное как инфекционный мононуклеоз. Реже наблюдают реактивированную инфекцию, обусловленную хронической персистенцией вируса Эпстайна-Барр.
Клинические проявления вируса Эпстайн-Барра вариабельные, чаще наблюдают синдром хронического мононуклеоза. Хроническая активная инфекция вирусом Эпстайна-Барр, проявляющаяся прогрессирующими лимфопролиферативными заболеваниями или лимфомами ЦНС, обычна для пациентов с иммунодефицитными состояниями.
Развитие злокачественных превращений инфицированных клеток даёт основание предполагать участие вируса Эпстайна-Барр (как коканцерогена) в развитии болезней злокачественного роста, таких как африканские формы лимфомы Бёркитта, карцинома носоглотки у мужчин некоторых этнических групп Южного Китая, а также саркома Капоши у пациентов со СПИДом.

Патогенез поражений вирусом Эпстайна-Барра
При инфекционном мононуклеозе вирус Эпстайн-Барра размножается в верхних отделах дыхательных путей и ассоциированной лимфоидной ткани с развитием местных воспалительных реакций. Возбудитель может гематогенно диссеминировать в периферические лимфатические узлы, селезёнку, печень и другие органы, формируя лимфоидные инфильтраты. Заражение макрофагов и лимфо-идных клеток приводит к появлению крупных мононуклеарных клеток. Латентная инфекция В-лимфоцитов вызывает их поликлональную активацию с образованием низкоспецифичных гетерофильных AT, агглютинирующих эритроциты различных животных. Подобные поражения типичны для большинства лиц. Реже наблюдают развитие злокачественных трансформаций, связанных с нарушениями дифференцирования В-клеток.
Лимфомы Бёркитта характеризуются экспрессией 1-го ядерного Аг (1-ЯАг) вируса Эпстайна-Барр в заражённых клетках, обусловливающего латентное течение процесса посредством длительного персистирования вируса в виде эписом. Хромосомные аномалии обусловлены нарушениями в хромосоме 8 с формированием точечных с-тус мутаций.
Небёркиттовские лимфомы вируса Эпстайн-Барра. При подобных трансформациях в В-лимфоцитах преимущественно экспрессируются 2- и 5-Аг, а также 1 и 2 латентные белки оболочки. 2- и 5-ЯАг активируют G1 циклин, делая клетки практически бессмертными. Трансформацию клеток обусловливают латентные белки оболочки, вызывающие избыточную рецепцию ростовых факторов.
Продолжительность инкубационного периода инфекционного мононуклеоза составляет 30-50 сут у взрослых и 10-40 сут у детей. Заболевание проявляется лихорадкой, общей разбитостью, ангинозными поражениями и лимфангиитами с гепато- и спленомегалией. Очень редко наблюдают поражения в форме гепатита или менингита.
Диагностика вируса Эпстайн-Барра
Читайте также:

