Вирус герпеса и анемия
Обновлено: 17.04.2024
Поражения вирусом герпеса типа 6 гематологических больных - диагностика, лечение
Герпес-вирус человека типа 6 впервые был выделен из мононуклеаров крови больного СПИДом в 1986 г., а в 1988 г. выявлена его связь с одной из сыпных инфекций детского возраста — внезапной экзантемой (roseola infantum), или шестой детской экзантемой. Выделяют два генотипа вируса — А и В, гомология ДНК которых составляет 90 %.
Генотип В выявляется значительно чаще. Первичное инфицирование HHV-6 происходит обычно у детей в первые 2 года жизни через слюну и чаще всего манифестирует высокой лихорадкой неясной этиологии и лимфаденопатией, хотя у части детей наблюдается типичная клиническая картина внезапной экзантемы, когда появление пятнисто-папулезной сыпи на 5—7-й день от начала лихорадки является предвестником выздоровления.
Типично для первичной инфекции развитие фебрильных судорог: примерно у трети больных детей в возрасте до 1,5 года. Это значительно больше, чем у детей с такой же высокой лихорадкой, но не ассоциированной с HHV-6-инфекцией. Возможно, судороги являются следствием специфического вирусного поражения головного мозга, поскольку геном HHV-6 обнаруживается в ткани мозга иммунокомпетентных индивидуумов.
После перенесенной первичной инфекции HHV-6 развивается пожизненная латенция. HHV-6 отличается выраженным лимфотропизмом; его резервуаром являются мононуклеары крови, в частности CD4+-лимфоциты, дендритные клетки, NK-клетки и, возможно, клетки миелоидной линии. Помимо этого, вирус может инфицировать клетки нейроглии и некоторые другие, в частности клетки протоков слюнных желез.

Ганцикловир активен в отношении вируса герпеса типа 6
С последним обстоятельством связана возможность длительной секреции вируса в слюну, которая является основным источником передачи вируса и первичного заражения детей.
Клиническое значение HHV-6 для гематологических больных изучено достаточно слабо. В связи со всеобщей ранней инфицированностью HHV-6 у гамотологических больных первичная инфекция этим вирусом встречается редко, ее клинические признаки неизвестны. Ранняя реактивация HHV-6, выявляемая по виремии, регистрируется у 30—45 % реципиентов аллогенных ТГСК.
Клиническими проявлениями реактивации являются сыпь, лихорадка, замедление становления функции трансплантата и повышение активности печеночных ферментов.
Эти признаки, конечно, крайне неспецифические и могут быть отнесены к проявлениям реактивации HHV-6 только по исключении других причин (CMV-инфекция, РТПХ) и при документации реактивации HHV-6. Данных о влиянии реактивации на исход трансплантации неясен, также неясны подходы к мониторингу и терапии HHV-6.
Ацикловир неактивен в отношении HHV-6, в то время как ганцикловир эффективно ингибирует репликацию вируса.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Г.Р. ФАТКУЛЛИНА, В.А. АНОХИН, Р.И. АЗЮКОВА
Казанский государственный медицинский университет, 420012, г. Казань, ул. Бутлерова, д. 49
Обследовано 154 ребенка с различными нозологическими формами хронических герпесвирусных инфекций. Дана характеристика клинико-лабораторным особенностям анемий, развивающихся уэтих пациентов. Оценены у них показатели феррокинетики, свидетельствующие о доминировании анемии хронического заболевания (АХЗ)в структуре причин снижения уровня гемоглобина. Рассмотрены основные дифференциально-диагностические критерии диагноза. Представлена динамика уровня гемоглобина в ходе проведения противовирусной терапии.
Ключевые слова: дети, герпесвирусные инфекции, анемия хронического заболевания, феррокинетика, противовирусная терапия.
G.R. FATKULLINA, V.A. ANOKHIN, R.I. AZYUKOVA
Kazan State Medical University, 49 Butlerov St., Kazan, Russian Federation, 420012
Anemia of chronic disease and herpetic infections in children
The study included 154 children with different clinical forms of herpetic infections. The article presents the characteristics of clinical and laboratory features of anemia in children with herpes disease. Ferro-kinetic parametersare estimated, which prove the dominance ofchronic diseaseanemia (CDA) over other causes of iron deficiency. The main differential-diagnostic criteria are discussed. The dynamics of the hemoglobin level after antiviral therapy is presented.
Key words: children, herpetic infections, anemia of chronic disease, ferro-kinetics, antiviral therapy.
Во всем мире наиболее распространенной причиной анемии считается дефицит железа в организме [1, 2]. Помимо этого ее развитие традиционно связывают с рядом других причин: с витаминной недостаточностью, длительно протекающими воспалительными процессами, врожденными или приобретенными нарушениями процессов синтеза гемоглобина, дефектами формирования красных кровяных телец и т.п. [1, 3], а распространенность анемии считается интегративным показателем здоровья популяции, традиционно оцениваемым органами практического здравоохранения [1].
С практической точки зрения определение вида анемии, безусловно, важный шаг, поскольку необоснованное назначение препаратов железа (что нередко наблюдается на практике) не только бесполезно, но и, более того, наносит вред больному, приводя к дистрофии слизистой желудочно-кишечного тракта, гемосидерозу, риску развития генерализованных бактериальных процессов и т.д. [6, 7, 9].
Основными отличиями анемии хронического заболевания от уже упомянутой ЖДА считаются:
- повышенный уровень ферритина сыворотки, свидетельствующий о высоком содержании железа в депо;
- умеренно сниженный уровень сывороточного железа;
- нормальный или сниженный уровень общей железосвязывающей способности сыворотки (ОЖСС), что указывает на отсутствии т.н. Fe-голодания сыворотки [8].
Инфекция, вызванная вирусом герпеса человека 6-го типа (англ. — human herpesvirus type 6, HHV-6), занимает особое место. В первую очередь потому, что вызывается одним из наиболее распространенных в человеческой популяции вирусов [10]. Инфицированность ею достигает 60-100% населения различных регионов планеты. Ну и, кроме того, HHV-6 был описан сравнительно недавно, поэтому в настоящее время мы располагаем довольно ограниченной информацией о патогенезе и клинике заболеваний, вызванных этим инфекционным агентом [10].
За последние пять лет значимо увеличилось число детей, умерших от генерализованных инфекционных заболеваний [11]. При этом, как показала статистика, герпетические инфекции, в первую очередь цитомегаловирусная и Эпштейна — Барр вирусная инфекции заняли лидирующие позиции в спектре причин перинатальной патологии [12, 13].
Цель исследования — оценить значимость анемии хронического заболевания у пациентов с хроническими герпетическими инфекциями, вызванными цитомегаловирусом (ЦМВ), вирусом герпеса человека 6-го типа (ВГЧ 6), Эпштейна — Барр вирусом (ЭБВ), герпетическими инфекциями смешанной этиологии.
Материалы и методы исследования
Проведено обследование группы из 154 детей с различными нозологическими формами герпетической инфекций: ЦМВИ — 32 человека, ЭБВИ — 37, ВГЧ-6 инфекция — 41, микст-герпесвирусные инфекции — 44 пациента. Возраст обследованных — от 1,5 до 15 лет (мальчиков — 89, девочек — 65). Пациенты наблюдались амбулаторно и в стационаре инфекционной больницы (РКИБ г. Казани), в период с декабря 2011 по ноябрь 2013 года.
Для верификации диагноза ГВИ использовали иммуноферментный анализ с определением наличия антител к антигенам цитомегаловируса — IgM и G, оценкой индекса авидности; IgG к антигенам вируса герпеса 6-го типа (ВГЧ-6); IgM к капсидному антигену, IgG к раннему и ядерному антигенам ЭБВ в сыворотке крови; полимеразная цепная реакция с определением ДНК ВГЧ-6, ЭБВ и цитомегаловируса в сыворотке крови, ДНК ВГЧ 6 в слюне. Оценивались эритроцитарные индексы: средний объем эритроцита (MCV) и среднее содержание гемоглобина в эритроците (MCH); показатели метаболизма железа: сывороточное железо (СЖ), общая железосвязывающая способность сыворотки (ОЖСС), ферритин, коэффициент насыщения трансферрина железом (КНТ).
Критерии включения в исследование: наличие клинических симптомов хронического инфекционного процесса. Обязательным требованием для включения в группу были маркеры активности одной или нескольких изучаемых вирусных инфекций и повторные эпизоды снижения уровня гемоглобина. При этом, согласно рекомендациям ВОЗ [1], в качестве критерия анемии рассматривались показатели Hb ниже 110 г/л для детей от 6 месяцев до 5 лет; ниже 115 — для детей 5-11 лет и ниже 120 — детям старше 12 лет.
Результаты исследования и обсуждение
Таблица 1.
Клинические варианты герпетической инфекции у обследованных больных (n=154)
| Признак | Абсолютное число | % |
| Хронический мононуклеоз | 117 | 76.0 |
| Хроническая активная герпетическая инфекция с поражением ЦНС | 19 | 12.3 |
| Хронический гепатит | 7 | 4.6 |
| Вирусный пневмонит | 5 | 3.2 |
| Кожная форма без проявлений мононуклеоза | 4 | 2.6 |
| Синдром хронической усталости | 2 | 1.3 |
Обращало внимание снижение уровня гемоглобина у части пациентов, причем достаточно ригидное к ранее проводимым попыткам терапии препаратами железа.
Частота анемии была достаточно высокой и регистрировалась у каждого четвертого (25% — 39 больных). Медиана сроков возникновения анемии с момента появления симптомов инфекционного заболевания составила шесть с половиной месяцев.
У большинства пациентов (71,7%) наблюдалась 1-я степень тяжести анемии; 2-я степень диагностирована у 18,5% детей, а 3-я — у 10,3% обследованных. В последующем для верификации вида анемий была проведена комплексная оценка показателей феррокинетики (табл. 2).
Таблица 2.
Показатели метаболизма железа при анемии у детей с ГВИ (n=39)
| Показатели | Ниже нормы n, абс. (%) | Норма n, абс. (%) | Выше нормы n, абс. (%) |
| MCV (70-100 фл) | 17 (43.6) | 22 (56.4) | 0 (0) |
| MCH(24-33 пг) | 14 (35.9) | 25 (64.1) | 0 (0) |
| СЖ (8,9-21,5 мкмоль/л) | 15 (38.5) | 24 (61.5) | 0 (0) |
| ОЖСС (40,6-62,5 мкмоль/л) | 11 (28.2) | 23 (58.9) | 5 (12.8) |
| КНТ (15-45%) | 31 (79.5) | 8 (20.5) | 0 (0) |
| Ферритин (30-140 нг/мл) | 6 (15.4) | 20 (51.3) | 13 (33.3) |
Первичную информацию о возможной причине анемии можно получить уже при анализе эритроцитарных индексов: среднего объема эритроцитов (MCV) и среднего содержания гемоглобина в эритроците (MCН). Известно, что для ЖДА характерно значимое снижение MCV и MCН [4]. Как видно из таблицы, эритроцитарные индексы у большинства больных (56,4 и 64,1% соответственно) не отличались от условно-нормальных. По данным, приведенным в табл. 3, видно, что показатели СЖ, ОЖСС у большинства больных (61,5 и 58,9% соответственно) находились в диапазоне показателей нормы, что свидетельствует о достаточном количестве железа в организме. Еще один важный фактор, позволяющий дифференцировать истинный и перераспределительный дефицит железа — уровень ферритина сыворотки. Как известно, при АХЗ этот показатель повышается в той или иной мере. В нашем исследовании у 84,6% пациентов ферритин определялся в пределах возрастной нормы или даже превышал условно-нормальные показатели, что говорит о достаточном содержании железа в депо [8]. В пользу АХЗ свидетельствует и тот факт, что уровень ОЖСС был ниже нормы или находился в ее пределах у 28,2% и 58,9% соответственно. При ЖДА же, как известно, данный параметр растет [5, 7].
Наши наблюдения показали, что в структуре анемий у наблюдавшихся больных значительное место занимает АХЗ (33,3%). Поскольку в организме пациентов с АХЗ железо присутствует в достаточном количестве, назначение ферротерапии не имеет смысла и даже опасно возможностью развития разного рода осложнений [4, 6, 9]. Патогенетически оправданно воздействие на первопричину этого явления — хронический воспалительный процесс. В нашем случае это герпетическая инфекция в различных своих формах.
Пациенты с АХЗ и ЖДА (всего 19 детей) получали противовирусную терапию (без использования препаратов железа). В исследовании участвовали пациенты с микросфероцитарной гипохромной анемией, КНТ у которых был менее 15%. При этом к пациентам с ЖДА относили детей с уровнем ферритина менее 30 нг/мл.
У 12 из 13 больных АХЗ уровень гемоглобина достиг нормальных значений после проведения противовирусной терапии. В ситуациях с ЖДА эффект без назначения лечения мы зарегистрировала только у одного больного (возможно, этот пациент имел смешанную природу анемии). Отсутствовал эффект от терапии основного заболевания и у одного больного АХЗ.
У большинства больных анемией при хронической герпетической инфекции в процессе проведения противовирусной терапии был достигнут положительный эффект по целому ряду показателей феррокинетики. Все это еще раз подтвердило мнение о доминировании в спектре причин анемии именно АХЗ.
Вывод
АХЗ является частым видом анемии у детей при хронической герпетической инфекции. Очевидно, что грамотная противоинфекционная терапия позволит в большинстве случаев сгладить или купировать анемический процесс. Безусловно, такого рода тактика не является универсальной, но с учетом распространенности АХЗ подобное врачебное поведение нам кажется оправданным. Дальнейшая диагностическая работа потребует комплексной оценки показателей феррокинетики и окончательного решения вопроса о назначении препаратов железа.
1. WHO/CDC. Assessing the iron status of populations: report of a joint World Health Organization/Centers for Disease Control andPrevention technical consultation on the assessment of iron status at thepopulation level, 2nd ed., Geneva, World Health Organization, 2007.
2. Г.Р. Хасанова. Метаболизм железа у ВИЧ-инфицированных пациентов с анемией // Инфекционные болезни. — 2012. — Т. 9, № 1. — С. 11-13.
3. Cullis J. Anaemia of chronic disease // Clin. Med. — 2013, Apr; 13 (2): 193-6. doi: 10.786 1/clinmedicine. 13-2-193.
5. Белошевский В.А., Минаков Э.В. Анемии при хронических заболеваниях // Воронеж. — 1995. — С. 34-37.
6. Хасанова Г.Р. Анемия хронического заболевания и ВИЧ-инфекция // Практическая медицина. — 2012. — № 1 (56). — С. 49-51.
7. Weiss G., Goodnough L.T. Anemia of chronic disease // New Engl J Med. — 2005. — № 352. — Р. 1011-1023.
9. Weinberg E.D. Iron loading and disease surveillance // Emerg Infect Dis. — 1999. — № 5. — Р. 346-52.
11. Лобзин Ю.В. Проблемы детских инфекций на современном этапе // Инфекционные болезни. — 2009. — № 2. — С. 7-12.
13. Симованьян Э.Н., Денисенко В.Б., Сарычев А.М., Григорян А.В. Хроническая инфекция вируса Эпштейна — Барр у детей: современные аспекты диагностики и лечения // Педиатрия.— 2006. — Т. 8, № 2. — С. 29-35.
1. WHO/CDC. Assessing the iron status of populations: report of a joint World Health Organization/Centers for Disease Control andPrevention technical consultation on the assessment of iron status at thepopulation level, 2nd ed. Geneva, World Health Organization, 2007.
2. Khasanova G.R. Iron metabolism in HIV-infected patients with anemia. Infektsionnye bolezni, 2012, vol. 9, no. 1, pp. 11-13 (in Russ.).
3. Cullis J. Anaemia of chronic disease. Clin. Med., 2013, Apr; 13 (2): 193-6. doi: 10.786 1/clinmedicine. 13-2-193.
4. Solomatina M.A., Al’pidovskiy V.K. Anemia of chronic disease. Vestnik Rossiyskogo universiteta druzhby narodov. Seriya “Meditsina”, 1999, no. 1, pp. 36-38 (in Russ.).
5. Beloshevskiy V.A., Minakov E.V. Anemii pri khronicheskikh zabolevaniyakh [Anemia of chronic disease]. Voronezh, 1995. Pp. 34-37.
6. Khasanova G.R. Anemia of chronic disease and HIV infection. Prakticheskaya meditsina, 2012, no. 1 (56), pp. 49-51 (in Russ.).
7. Weiss G., Goodnough L.T. Anemia of chronic disease. New Engl J Med., 2005, no. 352, rr. 1011-1023.
8. Rykov A.A., Gornostay M.V., Vasil’eva T.V. Laboratory diagnosis of iron deficiency. Meditsinskaya gazeta “Zdorov’e Ukrainy”, 2008, no. 4/1, pp. 52-53 (in Russ.).
9. Weinberg E.D. Iron loading and disease surveillance. Emerg Infect Dis., 1999, no. 5, rr. 346-52.
10. Kazmirchuk V.E., Mal’tsev D.V. Diagnosis and treatment of infection caused by the human herpes virus type 6. Guidelines. Zhurnal “Klinicheskaya immunologiya. Allergologiya. Infektologiya”, 2011, no. 5, pp. 33-40 (in Russ.).
11. Lobzin Yu.V. Problems of childhood infections at the present stage. Infektsionnye bolezni, 2009, no. 2, pp. 7-12 (in Russ.).
12. Vasil’ev V.V., Ushakova G.M., Kopylova A.V. et al. Vrozhdennaya infektsionnaya patologiya: problemy i puti resheniya [Congenital Infectious diseases: problems and solutions]. Sb. dokladov I Vserossiyskoy nauchno-prakticheskoy konferentsii “Infektsionnye aspekty somaticheskoy patologii u detey”. Moscow, 2008. Pp. 12-14.
13. Simovan’yan E.N., Denisenko V.B., Sarychev A.M., Grigoryan A.V. Chronic infection with Epstein — Barr virus in children: current aspects of diagnosis and treatment. Pediatriya, 2006, vol. 8, no. 2, pp. 29-35 (in Russ.).
Герпесвирусы широко распространены в человеческой популяции. После первичного инфицирования вирусы герпесгруппы переходят в латентное состояние и пожизненно персистируют в организме. При неблагоприятных условиях и снижении местного или системного иммунитета может происходить реактивация инфекции, что обусловливает развитие воспаления чаще всего на местном уровне. Разнообразие клинических форм герпесвирусных инфекций постоянно поддерживает научный интерес как в области изучения их патофизиологии, так и в области поиска эффективной противовирусной терапии. Особенно актуально это для β- и γ-герпесвирусов, т. к. группа α-герпесвирусов изучена достаточно хорошо.
Цель исследования: определить эффективность валацикловира в отношении репликации вируса Эпштейна – Барр (ВЭБ), вируса герпеса человека 6 типа (ВГЧ-6), цитомегаловируса (ЦМВ) в ротоглотке у часто болеющих взрослых с хроническими воспалительными заболеваниями верхних дыхательных путей (ВДП).
Материал и методы: нами амбулаторно обследованы 80 пациентов с частыми рецидивами хронических воспалительных заболеваний ВДП. Всем пациентам проводились микробиологическое исследование мазков из ротоглотки и оценка вирусной нагрузки в смешанной слюне и цельной крови вне периода обострения. Пациенты получали терапию валацикловиром по схеме 500 мг 3 р./сут в течение 14 дней. Контроль вирусной нагрузки в биоматериале проводился после окончания лечения.
Результаты и обсуждение: микробный пейзаж ротоглотки часто болеющих взрослых вне периода обострения представлен преимущественно нормальной или условно-патогенной микрофлорой. В смешанной слюне обнаруживалась ДНК ВЭБ, ВГЧ-6, но не ЦМВ. При этом в образцах крови указанных пациентов ДНК вирусов герпесгруппы не выявлялась. Применение валацикловира в дозе 500 мг 3 р./сут достоверно снижает репликацию ВЭБ в ротоглотке у часто болеющих взрослых.
Выводы: целесообразно провести дальнейшие исследования по определению режима дозирования и оценке клинической эффективности ациклических нуклеозидов в лечении ВЭБ-инфекции.
Ключевые слова: герпесвирусы, вирус Эпштейна – Барр, вирус герпеса человека, цитомегаловирус, часто болеющие взрослые, вирусная нагрузка, валацикловир.
Human herpesviruses infections: clinical features and opportunities of therapy
R.V. Shubelko 1 , I.N. Zuykova 2 , A.E. Shulzhenko 2
1 JSC "K+31", Moscow
2 “National Research Center — Institute of Immunology” Federal Medical-Biological Agency of Russia, Moscow
Herpesviruses are widely spread among the human population. After the primary infection, the herpesviruses become latent and persistent in the human body for life. Adverse conditions and a low local or systemic immunity may reactivate the infection, which causes the inflammation, usually at the local level. The variety of clinical forms of herpesviruses infections constantly supports scientific interest both in the field of studying their pathophysiology and in the search for effective antiviral therapy. This is especially important for β- and γ-herpesviruses, since the α-herpesvirus group has been studied rather well.
Aim: to determine the efficacy of valacyclovir for replication of the Epstein-Barr virus (EBV), human herpesvirus type 6 (HHV-6), cytomegalovirus (CMV) in the oropharynx in frequently ill adults with chronic inflammatory diseases of the upper respiratory tract.
Patients and Methods: 80 patients with frequent recurrences of chronic inflammatory diseases of the upper respiratory tract were examined outpatiently. All patients underwent microbiological examination of swabs from the oropharynx and the viral load in mixed saliva and whole blood not in exacerbation period was assessed. Patients received valacyclovir therapy according to the scheme 500 mg x 3 times a day for 14 days. Control of viral load in the biomaterial was carried out after the end of treatment.
Results and Discussion: out of the period of exacerbation the oropharynx microflora in frequently ill adults is represented mainly by a normal or conditionally pathogenic microflora. EBV DNA, HHV-6, but not CMV DNA, were detected in the mixed saliva. The DNA of the herpesvirus was not detected in the blood samples of these patients. The use of valacyclovir in a dose
of 500 mg 3 times a day significantly reduces the replication of EBV in the oropharynx in frequently ill adults.
Conclusions: it is advisable to conduct further studies to determine the dosage regimen and evaluate the clinical efficacy of acyclic nucleosides in the treatment of EBV infection.
В статье рассмотрены клинические особенности и возможности терапии герпесвирусных инфекции человека. Определена эффективность валацикловира в отношении репликации вируса Эпштейна – Барр, вируса герпеса человека 6 типа, цитомегаловируса.
Введение
Герпесвирусы широко распространены в человеческой популяции и обладают большим разнообразием клинических проявлений, поражая различные органы и ткани. В настоящее время известно 8 видов герпесвирусов человека, разделенных на 3 группы: α-герпесвирусы — вирусы простого герпеса 1 и 2 типа (ВПГ-1, -2), вирус ветряной оспы (ВВО), β-герпесвирусы: цитомегаловирус (ЦМВ), вирус герпеса человека 6 типа (ВГЧ-6), ВГЧ-7 и γ-герпесвирусы: вирус Эпштейна – Барр (ВЭБ) и ВГЧ-8 [1, 2].
По данным ВОЗ, около 90% населения земного шара инфицированы одним или несколькими видами герпесвирусов. Первичное инфицирование, как правило, происходит в детском возрасте, после чего вирусы герпесгруппы переходят в латентное состояние, которое характеризуется отсутствием вирусной репликации и экспрессией вирусных белков. Реактивация герпесвирусов из латентной формы происходит на фоне транзиторных (инфекция, неблагоприятные факторы внешней среды, психоэмоциональные перегрузки, эндокринные нарушения и др.) или стойких (первичные или вторичные иммунодефициты, иммуносупрессивная терапия) иммунодефицитных состояний.
Распространенность герпесвирусов в мире и широкий клинический полиморфизм потенцируют проведение большого количества исследований в области изучения патофизиологии и иммунобиологии этой инфекции, а также поиск эффективной противовирусной терапии [1–3].
В своей практической деятельности врачи многих специальностей, в т. ч. и иммунологи, встречаются с заболеваниями, вызванными ВПГ 1 и 2 типа (лабиальный и генитальный герпес), ВВО (ветряная оспа, опоясывающий лишай), для которых разработаны и стандартизированы методы диагностики и терапии. Однако патофизиология и патоморфология хронических герпесвирусных инфекций, обусловленных β- и γ-герпесвирусами, недостаточно изучены, не разработаны четкие методы и стандарты их лечения, что создает определенные трудности в ведении таких пациентов.
Вирус Эпштейна – Барр
Цитомегаловирус
ЦМВ относится к семейству β-герпесвирусов. Для постнатальной цитомегаловирусной инфекции (ЦМВИ) входными воротами служат чаще всего слизистые оболочки ротоглотки и слюнные железы, где и происходит первичная репродукция вируса. Первичное инфицирование ЦМВ иммунокомпетентных лиц обычно протекает бессимптомно, лишь в 5% случаев — в виде мононуклеозоподобного синдрома (цитомегаловирусный мононуклеоз). Отличительными признаками острого процесса являются высокая лихорадка, интоксикационный синдром, сиалоаденит (чаще околоушных слюнных желез), фарингит, гепатомегалия, спленомегалия, выраженный и длительный астенический синдром. При этом для острого процесса поражение миндалин нехарактерно, увеличение регионарных лимфатических узлов отмечается редко. После разрешения первичной ЦМВИ вирус персистирует в латентном состоянии в моноцитах, эпителиальных клетках и клетках слюнных желез, которые являются резервуаром вирусных частиц.
ЦМВИ у взрослых протекает в латентной (локализованной) и генерализованной формах. Латентная форма обычно не проявляется четкими клиническими симптомами. Иногда наблюдаются легкие гриппоподобные состояния, субфебрилитет. У женщин латентно протекающая ЦМВИ может проявляться в виде повторного невынашивания беременности и мертворождения, а также в виде вульвовагинита, кольпита, цервицита, эндометрита, сальпингоофорита.
Генерализованная форма приобретенной ЦМВИ у взрослых наблюдается редко, чаще на фоне иммуносупрессии, и, безусловно, является прерогативой наблюдения инфекционистов. При этом могут поражаться желудочно-кишечный тракт (гепатит, сиалоаденит, эзофагит, гастрит, энтероколит), надпочечники (адреналит), бронхолегочная система (интерстициальная пневмония, бронхит, фиброзирующий бронхиолит, альвеолит), нервная система (энцефаловентрикулит, миелит, полирадикулопатия, полинейропатия), почки, глаза, миокард [1–3].
У иммунокомпетентных взрослых ЦМВ не поражает лимфоидную ткань, а его локальная реактивация проявляется репликацией в клетках эпителия слюнных желез, поэтому, вероятнее всего, он не играет какой-либо роли в развитии хронических воспалительных заболеваний ВДП у взрослых, характеризующихся в первую очередь поражением лимфоидных структур ротоглотки.
Вирус герпеса человека 6 типа
Еще один представитель семейства β-герпесвирусов — ВГЧ-6. Ведущий путь передачи герпесвирусной инфекции, вызванной ВГЧ-6, — воздушно-капельный. В таких случаях первичная репликация происходит в слюнных железах, лимфоидной ткани ротоглотки и шейных лимфатических узлах. Генерализация инфекции может происходить гематогенным или лимфогенным путем. Около 90% инфицированных клеток представлено Т-лимфоцитами (преимущественно CD4+), оставшаяся часть включает В-лимфоциты, моноцитарно-макрофагальные, глиальные клетки и мегакариоциты. Первичная ВГЧ-6-инфекция может протекать бессимптомно, в виде внезапной экзантемы, фебрильных или нефебрильных судорог.
На сегодняшний день считается доказанной роль ВГЧ-6 в формировании инфекционного мононуклеоза (или мононуклеозоподобного синдрома), который характеризуется непродолжительной фебрильной лихорадкой, умеренно выраженными симптомами интоксикации, умеренной лимфоаденопатией, поражением лимфоидной ткани ротоглотки (острый тонзиллит), умеренной гепатомегалией и, в половине случаев, спленомегалией, розеолоподобными высыпаниями (внезапная экзантема). В дальнейшем ВГЧ-6 переходит в латентную или персистирующую форму. Системная реактивация ВГЧ-6 чаще наблюдается у иммунокомпрометированных лиц и может приводить к развитию тяжелых органных поражений (энцефалит, пневмонит, миокардит и др.) и потенциально летальных системных поражений (вирусный сепсис) [1–3, 5].
К числу основных зон персистенции ВГЧ-6 относятся моноциты слюнных желез и лимфоидная ткань ротоглотки [2, 3, 5], поэтому реактивация хронической инфекции у иммунокомпетентных взрослых может происходить по типу мононуклеозоподобного синдрома, с воспалением слизистых оболочек и лимфоидных структур ротоглотки (тонзиллит, фарингиты). Не исключено также, что ВГЧ-6 играет определенную роль в снижении мукозального иммунитета ротоглотки и поддержании хронического воспалительного процесса на местном уровне.
Лечение герпесвирусных инфекций
Материал и методы
Результаты
Первичная герпесвирусная инфекция, обусловленная ВЭБ, ЦМВ, ВГЧ-6, протекает в большинстве случаев в виде инфекционного мононуклеоза. В дальнейшем герпесвирусы пожизненно персистируют в макроорганизме, в т. ч. и в области входных ворот инфекции (лимфоидная ткань ротоглотки). При неблагоприятных условиях и снижении местного или системного иммунитета может происходить локальная реактивация герпесвирусов, провоцируя развитие воспаления на местном уровне.
Микробный пейзаж ротоглотки у часто болеющих взрослых вне периода обострения представлен преимущественно нормальной или условно-патогенной микрофлорой.
В смешанной слюне часто болеющих взрослых вне периода обострения с высокой частотой достоверности обнаруживается ДНК ВЭБ, ВГЧ-6, и не обнаруживается ДНК ЦМВ. При этом в образцах крови указанных пациентов ДНК вирусов герпесгруппы не выявлена, что свидетельствует не о системной, а о преимущественно местной реактивации герпесвирусной инфекции. Учитывая, что титры вирусной нагрузки ВЭБ при микст-инфекции выше (4,47 Lg, копий/10 5 клеток), чем при моноинфекции
(3,99 Lg, копий/105 клеток), можно предположить стимулирующее влияние ВГЧ-6 на активность ВЭБ.
Стандартная антибактериальная терапия без учета вирусной репликации зачастую неэффективна или недостаточно эффективна. Применение противовирусной терапии ациклическими нуклеозидами в комплексном лечении пациентов с частыми рецидивами хронических воспалительных заболеваний ВДП позволяет повысить целенаправленность этиотропной терапии текущего воспалительного процесса.
Из ациклических нуклеозидов наиболее оптимальным и исследованным в лечении герпесвирусов является валацикловир, обладающий высокой биодоступностью и хорошим профилем безопасности. В нашей работе мы применяли дозу валацикловира в 2 раза меньшую, чем та, которая ранее апробировалась разными исследователями, главным образом потому, что мы воздействовали не на острый системный процесс, а на локальную реактивацию герпесвирусной инфекции. Выяснилось, что применение валацикловира в дозе 500 мг 3 р./сут достоверно снижает репликацию ВЭБ в ротоглотке у пациентов с микст-инфекцией (ВЭБ + ВГЧ-6) — на 75%, в большей степени у пациентов с моноинфекцией (ДНК ВЭБ) — на 86%. В отношении инфекции, вызванной ВГЧ-6, не получено достоверных данных о снижении вирусной нагрузки.
Выводы
У часто болеющих взрослых микробный пейзаж вне периода обострения представлен сочетанной бактериально-вирусной микрофлорой: нормальной и/или условно-патогенной бактериальной флорой и представителями герпесгруппы (ВЭБ, ВГЧ-6), что может играть роль в хронизации воспаления в ротоглотке, способствовать снижению местного иммунитета и приводить к частым обострениям патологии ВДП.
Применение валацикловира в дозе 500 мг 3 р./сут в течение 14 дней оказалось эффективным в отношении ВЭБ — на фоне терапии вирусная нагрузка снижалась до нулевых или клинически незначимых титров.
Валацикловир обладает хорошей переносимостью и безопасностью как у молодых пациентов, так и у пациентов старшего возраста.
Дальнейшие исследования должны быть направлены на оценку клинической эффективности валацикловира в лечении реактивации ВЭБ-инфекции у часто болеющих взрослых.
1. Human Herpesviruses: Biology, Therapy, and Immunoprophylaxis / Eds A. Arvin, G. Campadelli-Fiume et al. Cambridge: Cambridge University Press, 2007. 1432 p.
2. Исаков В. А., Архипова Е. И., Исаков Д. В. Герпесвирусные инфекции человека. СПб.: СпецЛит., 2013. 670 с. [Isakov V.A., Arkhipova Ye.I., Isakov D. V. Gerpesvirusnyye infektsii cheloveka. SPb.: SpetsLit., 2013. 670 s. (in Russian)].
3. Иммунотерапия: Руководство для врачей / под ред. Хаитова Р. М., Атауллаханова Р. И., Шульженко А. Е. 2-е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2018. 768 с. [Immunoterapiya: Rukovodstvo dlya vrachey / pod red. Khaitova R. M., Ataullakhanova R. I., Shul’zhenko A. Ye. 2-ye izd., pererab. i dop. M.: GEOTAR-Media, 2018. 768 s. (in Russian)].
4. Lennon P., Crotty M., Fenton J. E. Infectious mononucleosis // British Medical Journal. 2015. Vol. 350. P. 1–7.
5. Agut H., Bonnafous P., Gautheret-Dejean A. Laboratory and Clinical Aspects of Human Herpesvirus 6 Infection // Clinical Microbiology Reviews. 2015. Vol. 28 (2).
P. 313–335. doi: 10.1128/CMR.00122–14.
6. Andersson J., Britton S., Ernberg I. et al. Effect of acyclovir on infectious mononucleosis: a double-blind, placebo-controlled study // J Infect Dis. 1986. Vol. 153. P. 283–290.
7. Andersson J., Sköldenberg B., Henle W. et al. Acyclovir treatment in infectious mononucleosis: a clinical and virological study // Infection. 1987. Vol. 15. P. 14–20.
8. Pagano J. S., Sixbey J. W., Lin J. C. Acyclovir and Epstein-Barr virus infection // J Antimicrob Chemother. 1983. Vol. 12 (Suppl B). P. 113–121.
9. Tynell E., Aurelius E., Brandell A. et al. Acyclovir and prednisolone treatment of acute infectious mononucleosis: a multicenter, double-blind, placebo-controlled study // J Infect Dis. 1996. Vol. 174. P. 324–331.
10. Van der Horst C., Joncas J., Ahronheim G. et al. Lack of effect of peroral acyclovir for the treatment of acute infectious mononucleosis // J Infect Dis. 1991. Vol. 164. P. 788–792.
11. Vouloumanou E. K., Rafailidis P. I., Falagas M. E. Current diagnosis and management of infectious mononucleosis // Current Opinion in Hematology. 2012. Vol. 19 (1). P. 14–20. doi: 10.1097/MOH.0b013e32834daa08.
12. Balfour Jr.H., Hokanson K. M., Schacherer R. M. et al. A virologic pilot study of valacyclovir in infectious mononucleosis // Journal of Clinical Virology. 2007. Vol. 39. P. 16–21.
13. Walling D. M., Flaitz C. M., Nichols C. M. Epstein-Barr Virus Replication in Oral Hairy Leukoplakia: Response, Persistence, and Resistance to Treatment with Valacyclovir // Journal of Infectious Diseases. 2003. Vol. 188. P. 883–890.
14. Cox A. J., Gleeson M., Pyne D. B. et al. Valtrex therapy for Epstein-Barr virus reactivation and upper respiratory symptoms in elite runners // Med. Sci. Sports Exerc. 2004. Vol. 36 (7). P. 1104–1110.
15. Vezina H. E., Balfour Jr. H., Weller D. R. et al. Valacyclovir pharmacokinetics and exploratory pharmacodynamics in young adults with Epstein-Barr virus infectious mononucleosis // J Clin Pharmacol. 2010. Vol. 50. P. 734–742.
16. Hoshino Y., Katano H., Zou P. et al. Long-Term Administration of Valacyclovir Reduces the Number of Epstein-Barr Virus (EBV) -Infected B Cells but Not the Number of EBV DNA Copies per B Cell in Healthy Volunteers // Journal of virology. 2009. Vol. 83 (22). P. 11857–11861.
17. De Paor M., O’Brien K., Fahey T., Smith S. M. Antiviral agents for infectious mononucleosis (glandular fever) // The Cochrane Database of Systematic Reviews. 2016. Issue 12. CD011487. doi: 10.1002/14651858.
Поражения вирусом простого герпеса (ВПГ) гематологических больных - эпидемиология, частота
Вирус простого герпеса (ВПГ) является антропонозным, широко распространенным в человеческой популяции (даже в изолированных от остального человечества племенах он встречается очень часто). Согласно генетическим характеристикам, различают вирусы простого герпеса типов 1 и 2, имеющие неодинаковые эпидемиологические, культуральные характеристики и способные вызывать различные клинические синдромы.
Вирус герпеса типа 1 (ВПГ-1) поражает верхнюю половину туловища (кожа, слизистые оболочки, гораздо реже головной мозг, легкие, печень и кишечник), в то время как вирус герпеса типа 2 (ВПГ-2) обычно вызывает поражение слизистых оболочек половых путей (генитальный, анальный герпес). Механизм передачи герпеса контактный. Главным источником заражения является слюна серопозитивного индивидуума, поэтому неудивительно, что самая высокая частота первичной герпетической инфекции приходится на ранний детский возраст (поцелуи родителей и родственников, общие игрушки и посуда).
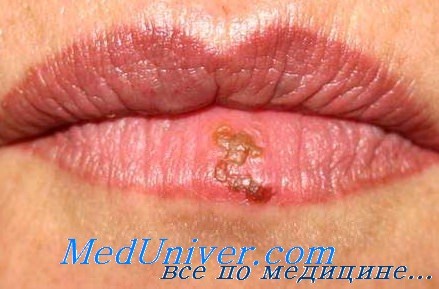
Латентное состояние вируса (непродуктивная инфекция) представляет собой неустойчивое равновесие, легко нарушаемое при неблагоприятных воздействиях (стресс, инсоляция, перегревание, переохлаждение). В этом случае вирус покидает место латенции — периферические ганглии и по нейрональному пути достигает покровов.
Факторами, благоприятно влияющими на реактивацию ВПГ у онкогематологических больных, являются гранулоцитопения и поражение слизистых оболочек, вызванные цитотоксической химиотерапией, гипогаммаглобулинемия, лимфопения, нарушения питания. Следует отметить, что с наибольшей частотой к реактивации ВПГ приводит терапия, вызывающая поражение слизистых оболочек, поэтому, например, при острых лимфоидных лейкозах частота реактивации выше, чем при острых миелоидных лейкозах.
Тяжесть проявлений и длительность герпесвирусной инфекции зависят от степени и продолжительности иммуносупрессии, которая может сильно варьировать в зависимости от основного заболевания (например, при иммунодефицитных синдромах, хронических лимфоидных лейкозах повышен риск развития тяжелых герпесвирусных поражений) и терапии (самые тяжелые поражения отмечаются после аллогенной ТКМ, высок риск тяжелой ВПГ-инфекции у больных, получавших антитимоцитарный глобулин и флударабин).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
На сервисе СпросиВрача доступна консультация инфекциониста по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно и бесплатно. Задайте свой вопрос и получите ответ сразу же!


Здравствуйте. По этим анализам причина неясна. Сдайте ПЦР крови на вэб ЦМВ герпес 6 типа, ИФА крови на Вич, токсоплазм IgM, УЗИ органов брюшной полости.


Здравствуйте! Не увидела ни одного значения IgM. Вам нужно исключить персистирующие (скрытые) инфекции организма путём сдачи анализ крови ИФА на антитела IgM и IgG, к вирусу Эпштейна-Барра (герпес вирусы, инфекционный мононуклеоз), цитомегаловирусу, вирусу простого герпеса, токсоплазме, микоплазме.
Галина, здравствуйте! Подскажите пожалуйста, для полноты картины что лучше сдать антитела IgM или ПЦР этих инфекций?

Здравствуйте! Имеется хроническая персистирующая герпесвирусная инфекция.Данные вирусы попадая в организм поселяются в лимфоузлах,чем провоцируют их увеличение.Так как вирусы сохраняются в организме пожизненно,то ожидать уменьшения размеров лимфоузлов в скором времени не стоит.Необходимо следить за активностью вирусов и при Реактивации проводить лечение.В настоящее время терапия проведена.Сейчас принимайте поливитамины с цинком и селеном
Нина Владиславовна, здравствуйте! Спасибо за консультацию. Подскажите пожалуйста при реактивации ВЭБ и ЦМВ достаточно будет лечения валацикловиром 5дн и нужно ещё с противовирусным препаратом применять интерфероны или все таки лучше не дожидаясь реактивации проводить профилактический приём противовирусного пепарата с каким то интервалрм? И ещё подскажите реактивацию вирусов герпеса лучше отслеживать по анализам ПЦР или Ифа на IgM и IgG.

Отслеживать Реактивации следует в первую очередь по клиническим проявлениям и самочувствию.При наличии симптомов стоит сдавать кровь на антитела к этим вирусам.Лечение противовирусными препаратами малоэффективно.Следует принимать иммуномодуляторы,способствующие активации собственных противовирусных агентов организма
Читайте также:

