Вирус герпеса и глиобластомы
Обновлено: 22.04.2024
Поражения вирусом простого герпеса (ВПГ) гематологических больных - эпидемиология, частота
Вирус простого герпеса (ВПГ) является антропонозным, широко распространенным в человеческой популяции (даже в изолированных от остального человечества племенах он встречается очень часто). Согласно генетическим характеристикам, различают вирусы простого герпеса типов 1 и 2, имеющие неодинаковые эпидемиологические, культуральные характеристики и способные вызывать различные клинические синдромы.
Вирус герпеса типа 1 (ВПГ-1) поражает верхнюю половину туловища (кожа, слизистые оболочки, гораздо реже головной мозг, легкие, печень и кишечник), в то время как вирус герпеса типа 2 (ВПГ-2) обычно вызывает поражение слизистых оболочек половых путей (генитальный, анальный герпес). Механизм передачи герпеса контактный. Главным источником заражения является слюна серопозитивного индивидуума, поэтому неудивительно, что самая высокая частота первичной герпетической инфекции приходится на ранний детский возраст (поцелуи родителей и родственников, общие игрушки и посуда).
Латентное состояние вируса (непродуктивная инфекция) представляет собой неустойчивое равновесие, легко нарушаемое при неблагоприятных воздействиях (стресс, инсоляция, перегревание, переохлаждение). В этом случае вирус покидает место латенции — периферические ганглии и по нейрональному пути достигает покровов.
Факторами, благоприятно влияющими на реактивацию ВПГ у онкогематологических больных, являются гранулоцитопения и поражение слизистых оболочек, вызванные цитотоксической химиотерапией, гипогаммаглобулинемия, лимфопения, нарушения питания. Следует отметить, что с наибольшей частотой к реактивации ВПГ приводит терапия, вызывающая поражение слизистых оболочек, поэтому, например, при острых лимфоидных лейкозах частота реактивации выше, чем при острых миелоидных лейкозах.
Тяжесть проявлений и длительность герпесвирусной инфекции зависят от степени и продолжительности иммуносупрессии, которая может сильно варьировать в зависимости от основного заболевания (например, при иммунодефицитных синдромах, хронических лимфоидных лейкозах повышен риск развития тяжелых герпесвирусных поражений) и терапии (самые тяжелые поражения отмечаются после аллогенной ТКМ, высок риск тяжелой ВПГ-инфекции у больных, получавших антитимоцитарный глобулин и флударабин).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
В последние годы в инфекционной патологии все большее значение приобретают герпес-вирусы (от греч. herpes — ползучий). Внимание, которое вирусологи и клиницисты проявляют в последние 25 лет к герпес-вирусным заболеваниям человека, связано
В последние годы в инфекционной патологии все большее значение приобретают герпес-вирусы (от греч. herpes — ползучий). Внимание, которое вирусологи и клиницисты проявляют в последние 25 лет к герпес-вирусным заболеваниям человека, связано с их значительной эпидемиологической ролью и социальной значимостью в современном мире. Неуклонный рост числа герпетических заболеваний у взрослых и детей обусловливает необходимость всестороннего изучения герпетической инфекции и разработки эффективных методов профилактики и лечения разнообразных форм этой инфекции. Среди вирусных инфекций герпес занимает одно из ведущих мест в силу повсеместного распространения вирусов, многообразия клинических проявлений, как правило, хронического течения, а также различных путей передачи вирусов.
Он входит в число наиболее распространенных и плохо контролируемых инфекций человека. Герпес-вирусы могут циркулировать в организме с нормальной иммунной системой бессимптомно, но у людей с иммуносупрессией вызывают тяжелые заболевания со смертельным исходом. По данным ВОЗ, смертность от герпетической инфекции среди вирусных заболеваний находится на втором месте (15,8%) после гепатита (35,8%).
Герпес-вирусы объединены в обширное семейство Herpesviridae и в настоящее время наиболее четко классифицированы. Семейство Herpesviridae включает в себя более 80 представителей, 8 из которых для человека наиболее патогенны (human herpes virus-HHV). Герпес-вирусы — филогенетически древнее семейство крупных ДНК-вирусов — подразделяются на 3 подсемейства в зависимости от типа клеток, в которых протекает инфекционный процесс, характера репродукции вируса, структуры генома, молекулярно-биологических и иммунологических особенностей: α, β и γ (табл. 1, по данным Н. Г. Перминова, И. В. Тимофеева и др., Государственный научный центр вирусологии и биотехнологий).
α-герпес-вирусы, включающие HSV-1, HSV-2 и VZV, характеризуются быстрой репликацией вируса и цитопатическим действием на культуры инфицированных клеток. Репродукция α-герпес-вирусов протекает в различных типах клеток, вирусы могут сохраняться в латентной форме, преимущественно в ганглиях.
β-герпес-вирусы видоспецифичны, поражают различные виды клеток, которые при этом увеличиваются в размерах (цитомегалия), могут вызывать иммуносупрессивные состояния. Инфекция может принимать генерализованную или латентную форму, в культуре клеток легко возникает персистентная инфекция. К этой группе относятся CMV, HHV-6, HHV-7.
Герпес-вирусы ассоциированы с малигнизацией и способны (по крайней мере, EBV и HVS) трансформировать клетки in vitro. Все герпес-вирусы сходны по морфологическим признакам, размерам, типу нуклеиновой кислоты (двухцепочечная ДНК), икосадельтаэдрическому капсиду, сборка которого происходит в ядре инфицированной клетки, оболочке, типу репродукции, способности вызывать хроническую и латентную инфекцию у человека.
В эпидемиологическом плане наиболее интересны следующие сведения о герпес-вирусах: вирионы чрезвычайно термолабильны — инактивируются при температуре 50–52°С в течение 30 мин, при температуре 37,5°С — в течение 20 ч, устойчивы при температуре 70°С; хорошо переносят лиофилизацию, длительно сохраняются в тканях в 50-процентном растворе глицерина. На металлических поверхностях (монеты, дверные ручки, водопроводные краны) герпес-вирусы выживают в течение 2 ч, на пластике и дереве — до 3 ч, во влажных медицинских вате и марле — до их высыхания при комнатной температуре (до 6 ч).
Уникальными биологическими свойствами всех герпес-вирусов человека является тканевой тропизм, способность к персистенции и латенции в организме инфицированного человека. Персистенция представляет собой способность герпес-вирусов непрерывно или циклично размножаться (реплицироваться) в инфицированных клетках тропных тканей, что создает постоянную угрозу развития инфекционного процесса. Латенция герпес-вирусов — это пожизненное сохранение вирусов в морфологически и иммунохимически видоизмененной форме в нервных клетках регионарных (по отношению к месту внедрения герпес-вируса) ганглиев чувствительных нервов. Штаммы герпес-вирусов обладают неодинаковой способностью к персистенции и латенции и чувствительностью к противогерпетическим препаратам в связи с особенностями их ферментных систем. У каждого герпес-вируса свой темп персистенции и латенции. Среди изучаемых наиболее активны в этом отношении вирусы простого герпеса, наименее — вирус Эпштейна-Барр.
По данным многочисленных исследований, к 18 годам более 90% жителей городов инфицируются одним или несколькими штаммами по меньшей мере 7 клинически значимых герпес-вирусов (простого герпеса 1 и 2 типов, варицелла зостер, цитомегаловирусом, Эпштейна-Барр, герпеса человека 6 и 8 типов). В большинстве случаев первичное и повторное инфицирование происходит воздушно-капельным путем, при прямом контакте или через предметы обихода и гигиены (общие полотенца, носовые платки и т. п.). Доказаны также оральный, генитальный, орогенитальный, трансфузионный, трансплантационный и трансплацентарный пути передачи инфекции.
Герпес-вирусные инфекции широко распространены в мире и имеют тенденцию к неуклонному росту. Особенностью герпес-вирусной инфекции является возможность вовлечения в инфекционный процесс многих органов и систем, чем и обусловлено многообразие вызываемых герпес-вирусами заболеваний, варьирующих от простых кожно-слизистых до угрожающих жизни генерализованных инфекций. Важное свойство герпес-вирусов — это способность после первичного инфицирования в детском возрасте пожизненно персистировать в организме и реактивироваться под влиянием различных экзо- и эндогенных провоцирующих факторов.
Инфицирование человека указанными герпес-вирусами сопровождается клиническими симптомами соответствующего острого инфекционного заболевания в среднем не более чем у 50% людей, в основном у детей: внезапная эритема (вирус герпеса человека 6 типа), афтозный стоматит (вирусы простого герпеса 1 или 2 типов), ветряная оспа (вирус варицелла зостер), инфекционный мононуклеоз (вирус Эпштейна-Барр), мононуклеозоподобный синдром (цитомегаловирус). У остальных пациентов инфекция протекает бессимптомно, что особенно характерно для подростков и взрослых людей. Помимо биологических свойств штамма герпес-вируса, влияние на течение острых и рецидивирующих герпес-вирусных заболеваний оказывают индивидуальные (возрастные, половые, фило- и онкогенетические) особенности иммунного ответа инфицированного человека на многочисленные антигены вируса.
Часто, особенно при снижении иммунореактивности организма, герпес-вирусы выступают в качестве вирусов-оппортунистов, приводя к более тяжелому, с необычными клиническими проявлениями, течению основного заболевания. Вирусы простого герпеса 1 и 2 типов, а также ЦМВ входят в число возбудителей TORCH-инфекций. Они играют важную роль в нарушении репродуктивной функции человека, развитии серьезных заболеваний матери, плода, новорожденного и детей младшего возраста.
Вызываемые вирусами ВПГ, CMV, ВЭБ заболевания рассматриваются как СПИД-индикаторные в связи с их частым обнаружением при данной патологии. В 1988 г. они включены в расширенное определение случаев, подлежащих эпидемиологическому надзору по поводу СПИДа. Результаты исследований последних лет свидетельствуют о роли некоторых герпес-вирусов (ВГЧ-8, ЦМВ, ВЭБ и др.) в развитии ряда злокачественных новообразований: назофарингеальной карциномы, лимфомы Беркитта, В-клеточной лимфомы, рака груди, аденокарциномы кишечника и простаты, карциномы цервикального канала шейки матки, саркомы Капоши, нейробластомы и др.
Наибольшую угрозу для здоровья представляют герпетические нейроинфекции (летальность достигает 20%, а частота инвалидизации — 50%), офтальмогерпес (почти у половины больных приводит к развитию катаракты или глаукомы) и генитальный герпес.
Диагностика герпетической инфекции
Все методы индикации и идентификации вирусов основаны на следующих принципах:
- выявление вируса per se (электронная микроскопия);
- выявление и идентификация вирусов посредством взаимодействующих с ними клеток (накопление вирусов в чувствительных к ним клетках);
- выявление и идентификация вирусов с помощью антител (МФА, ИФА, РАЛ, ИБ, РН, РСК);
- выявление и идентификация нуклеиновых кислот (ПЦР, МГ).
Электронная микроскопия: быстрая диагностика позволяет обнаружить ГВ или их компоненты непосредственно в пробах, взятых от больного, и дать быстрый ответ через несколько часов. Возбудитель выявляют с помощью электронной микроскопии клинического материала при негативном контрастировании.
Серологические методы уступают по информативности и чувствительности другим способам лабораторной диагностики и не позволяют с достаточной степенью достоверности установить этиологию той или иной формы заболевания. Нарастание титров антител происходит
в поздние сроки (через несколько недель) после заражения или реактивации вируса, и в то же время оно может и не наблюдаться у иммунодефицитных лиц. Для установления 4-кратного нарастания титра антител к герпес-вирусной инфекции (показатель первичной инфекции) необходимо исследование парных сывороток. Серологические реакции (РСК, РН) обладают высокой специфичностью, но относительно низкой чувствительностью, а кроме того, сложны в постановке.
Широкое практическое применение получили иммунофлюоресцентный метод, ИФА, РАЛ, ИБ.
Наиболее точным методом диагностики герпес-вирусной инфекции является выделение вируса из различных клеточных культур.
Для обнаружения вируса герпеса используют молекулярно-биологические методы: полимеразную цепную реакцию и реакцию молекулярной гибридизации, которые позволяют выявить наличие вирусной нуклеиновой кислоты в исследуемом материале. ПЦР может считаться самой чувствительной и быстрой реакцией. Чувствительность метода дает возможность определить одну молекулу искомой ДНК в образцах, содержащих 10 клеток.
Лечение герпетической инфекции
Лечение герпетической инфекции до настоящего времени остается сложной задачей. Хроническое течение процесса приводит к иммунной перестройке организма: развитию вторичной иммунной недостаточности, угнетению реакции клеточного иммунитета, снижению неспецифической защиты организма. Несмотря на разнообразие лекарственных препаратов, использующихся для лечения герпетической инфекции, лекарственных средств, обеспечивающих полное излечение от герпеса, не существует. Герпес-вирусная инфекция относится к трудно контролируемым заболеваниям. Это связано, в первую очередь, с разнообразием клинических поражений, развитием резистентности вируса к лекарственным средствам, наличием у герпес-вирусов молекулярной мимикрии. Поэтому для успешного лечения герпетической инфекции необходимо правильно подобрать противовирусный препарат, его дозу и длительность лечения, использовать комбинацию различных лекарств. В схемы терапии для повышения эффективности лечения необходимо также включать иммунобиологические препараты, способствующие коррекции иммунного статуса, а также патогенетические средства, облегчающие состояние пациента.
В настоящее время все антигерпетические средства подразделяются на 3 основные группы антивирусных препаратов (табл. 3).
Механизм действия химиопрепаратов (аномальных нуклеозидов: валтрекса, вектавира, фамвира, цимевена) связан с угнетением синтеза вирусной ДНК и репликации вирусов путем конкурентного ингибирования вирусной ДНК-полимеразы.
В препаратах-иммуномодуляторах (алпизарин, имунофан, ликопид, полиоксидоний) активно действующие вещества обладают иммуностимулирующими свойствами в отношении клеточного и гуморального иммунитетов, окислительно-восстановительных процессов, синтеза цитокинов.
Препараты-индукторы ИФН (амиксин, неовир, циклоферон) сочетают этиотропный и иммуномодулирующий эффекты действия. Препараты индуцируют образование эндогенных ИФН (α, β, γ) Т- и В-лимфоцитами, энтероцитами, гепатоцитами.
Особое место среди средств антигерпес-вирусной терапии занимает герпетическая вакцина для активации клеточного иммунитета, его иммунокоррекции в фазе ремиссии. Вакцинация преследует 2 цели: предупреждение первичной инфекции и возникновения состояния латентности, а также предупреждение или облегчение течения заболевания.
Однако, несмотря на наличие обширного списка антигерпетических препаратов, герпес остается до сих пор плохо контролируемой инфекцией. Это обусловлено и генотипическими особенностями возбудителя, и длительной персистенцией вируса в организме, и формированием штаммов, устойчивых к антивирусным препаратам. Максимальный клинический эффект может быть получен только при рациональной комплексной терапии лекарственных средств с различным механизмом действия.
Санкт-Петербургской группой ученых вирусологов и инфекционистов во главе с В. А. Исаковым предложена программа лечения и профилактики герпетической инфекции (табл. 4).
Преимущества комплексной терапии ГИ.
- Сочетанное применение противогерпетических химиопрепаратов и иммунобиологических средств обеспечивает синергидный эффект.
- Благодаря снижению дозы противовирусного ХПП уменьшается вероятность развития побочных эффектов, сокращается токсическое воздействие на организм больного.
- Снижается вероятность возникновения устойчивых штаммов герпес-вирусов к данному препарату.
- Достигается иммунокорригирующий эффект.
- Сокращается продолжительность острого периода болезни и сроков лечения.
Таким образом, терапия ГИ является сложной и многокомпонентной задачей.
По вопросам литературы обращайтесь в редакцию.
Т. К. Кускова, кандидат медицинских наук
Е. Г. Белова, кандидат медицинских наук
МГМСУ, Москва
Пресс-служба ФИЦ Институт цитологии и генетики СО РАН (Новосибирск) сообщила о новых результатах, полученных по проекту, направленному на создание эффективных средств лечения опухолей головного мозга на основе вирусов. В данном случае речь идет о глиобластоме, а в качестве потенциального терапевтического агента был использован печально известный вирус Зика
Неординарная и, прямо скажем, неочевидная идея лечить рак с помощью вирусов возникла практически сразу после открытия этих мельчайших созданий, и была основана на случайных наблюдениях за онкологическими больными, которые переболели вирусной инфекцией или перенесли вакцинацию. Оказалось, что в некоторых случаях состояние таких пациентов неожиданно значительно улучшалось, иногда отмечалась даже длительная ремиссия. Первые попытки подобного лечения были предприняты еще в первом десятилетии XX в. (для этого использовался ослабленный вакцинный препарат вируса бешенства), а в последующие годы ученые неоднократно возвращались к этой идее, используя для терапии рака непатогенные штаммы вирусов лихорадки Западного Нила, желтой лихорадки, аденовирусов и др.
В России исследования онколитических свойств вирусов связаны с именем М. К. Ворошиловой из Института полиомиелита и вирусных энцефалитов АМН СССР (Московская обл.). В 1960–1970-х гг. в институте были созданы живые энтеровирусные вакцины для профилактики сезонных вирусных заболеваний. В ряде случаев при вакцинации наблюдался положительный эффект в отношении злокачественных новообразований, вплоть до полного исчезновения первичной опухоли и метастазов. В ходе дальнейших исследований вакцинотерапию получили более полутора тысяч больных на поздних стадиях опухолевого процесса.
Тем не менее недостаток знаний о молекулярных механизмах развития опухоли и функционировании самих вирусов, технологические сложности с высококачественной очисткой вирусных препаратов и плохая предсказуемость результатов лечения привели к тому, что в 1980-х гг. работы с онколитическими вирусами были свернуты как в мире, так и в России, и возобновились лишь в конце прошлого века. Этому способствовало открытие механизмов противораковой активности вирусов, связанных с отключением в опухолевых клетках механизма апоптоза (клеточного самоубийства), который включается, чтобы воспрепятствовать заражению инфицированными клетками здоровых окружающих тканей.
Сейчас новосибирские исследователи начали испытания вируса Зика, получившего несколько лет назад широкую известность благодаря вспышке заболевания в Южной Америке. Этот вирус, открытый еще в 1948 г., долгое время считался неопасным. Впервые о лихорадке Зика заговорили в 2007 г., когда на островах Яп в Тихом океане заболело около 5 тыс. человек, которые, впрочем, успешно поправились. В начале 2013 г. еще более масштабная эпидемия охватила Французскую Полинезию, а год спустя случаи заболевания новой болезнью были отмечены на территории Бразилии. В то же время там резко увеличилось число новорожденных с отчетливыми признаками микроцефалии – недоразвитости головного мозга. Оказалось, что виновником этой патологии был вирус Зика, который поражает головной мозг эмбриона во время болезни будущей матери. Из-за выраженного нейротропизма этот вирус и был выбран на роль потенциального оружия для борьбы с опухолью мозга.
Эксперимент проводился на лабораторных мышах из SPF-вивария ИЦиГ СО РАН – уникального объекта научной инфраструктуры Новосибирского научного центра, где в жестко контролируемых условиях согласно международным правилам содержатся животные, свободные от патогенов, что является необходимым условием для проведения современных медико-биологических исследований.
Под кожу мышей были имплантированы клетки человеческой глиобластомы, а затем особям был введен вирус Зика. Результаты оказались обнадеживающими: вирус настолько замедлил рост опухолей, что через два месяца от начала эксперимента их объем был в десять раз меньше, чем у контрольных животных. При этом существенного ущерба здоровым тканям он не принес.
Сами ученые уверены в перспективности такого подхода к лечению онкологических заболеваний, так как современная наука располагает всеми необходимыми инструментами, чтобы использовать онколитические свойства вирусов на благо нашему здоровью. И хотя сегодня применение вирусов в онкотерапии является скорее исключением, чем правилом, в сочетании с традиционными методами лечения они смогут служить дополнительным средством в системе комплексного воздействия на опухоль.
Ученые из Сан-Диего сделали сразу два глобальных открытия, которые помогут остановить вирус Зика и рак мозга.

Алена Герасимова (Dalles) Разработчик сайта, редактор
Разработчик сайтов, журналист, редактор, дизайнер, программист, копирайтер. Стаж работы — 25 лет. Область интересов: новейшие технологии в медицине, медицинский web-контент, профессиональное фото, видео, web-дизайн. Цели: максимально амбициозные.
- Запись опубликована: 17.01.2020
- Reading time: 2 минут чтения
В двух независимых исследованиях, опубликованных Cell Press 16 января 2020 года, сообщается, что механизм, посредством которого вирус Зика проникает в клетки мозга, наконец-то идентифицирован. Более того, ученые использовали его для предотвращения инфекции Зика и для уничтожения раковых клеток.
Что такое вирус Зика?
Вирус Зика вызывает инфекцию, которая может серьезно повлиять на ход беременности, а именно на развитие мозга плода. В 2014-2015 годах эпидемия Зика затронула несколько районов мира, особенно вирус бушевал в Южной Америке. В 2019 году больной Зика впервые был обнаружен и Европе.
Передаваемый через укусы комаров, он также распространяется от беременных матерей к плоду и при половом акте, в результате чего риску заражения подвергается половина людей в мире. От этой инфекции нет лекарства, поэтому ученые, пытались разработать профилактическую и терапевтическую стратегию, изучая, как вирус проникает в клетки мозга.
В рамках исследования, две команды медицинского факультета Калифорнийского университета в Сан-Диего подошли к этому вопросу двумя различными способами, но в итоге пришли к одному и тому же ответу. Они обнаружили, что вирус Зика использует для проникновения в стволовые клетки мозга молекулу αvβ5 интегрин.
Интегрины – что это?
Интегрины – это молекулы, находящиеся внутри клеточных мембран, ограничивающих клетки организма. Они помогают клеткам прилипать друг к другу и к основной фасции или ткани, а также облегчают межклеточную коммуникацию.
Следовательно, эти молекулы также участвуют в потере клеточной адгезии и аномальной клеточной передаче сигналов, которая происходит при распространении рака. При тяжелых формах рака измененные клетки перемещаются из органа-хозяина в отдаленное место, для неконтролируемого размножения и метастатического роста.
Ранее было обнаружено, что многие интегрины имеют слабые участки, через которые в клетки проникают аденовирусы, вирусы ящура и ротавирусы. Новые исследования нашли первое доказательство того, что в инфицировании вирусом Зика участвует интегрин αvβ5.
Первые результаты
В журнале Cell Reports рассказывается, как ученые проводили опыты. Они один за другим они удаляли гены из культивируемых в 3D-культуре клеток глиобластомы человека. Глиобластомы – это особенно тяжелый рак мозга. Каждую из мутантных клеточных культур подвергали воздействию вируса Зика, чтобы увидеть реакцию. Это позволило обнаружить ключевые гены и кодированные белки, необходимые для проникновения вируса в клетку. Вирус, чтобы облегчить его обнаружение после заражения, был помечен зеленым флуоресцентным белком (GFP).
Эксперимент показал, что для проникновения и размножения в клетках мозга, вирусу Зика требуется не менее 92 отдельных человеческих генов, обнаруженных в стволовых клетках рака мозга. Однако, среди них, внимание ученых привлек ген, кодирующий интегрин αvβ5. Это единственный интегрин, который содержится в высоких уровнях в стволовых клетках головного мозга – тех самых клетках, которые наиболее легко заражаются вирусом.
Второй эксперимент
Во втором эксперименте, результаты которого были опубликованы в журнале Cell Stem Cell, ученые, чтобы выяснить, какой ингибитор будет действовать наиболее сильно, использовали против каждого из множества интегринов одно специфическое антитело. Затем они использовали два метода для ингибирования интегрина – использование блокирующего антитела и отключение его кодирующего гена.
Они отметили, что оба метода предотвратили заражение Зика и продлили выживаемость обработанных мышей по сравнению с облученными необработанными мышами. Используя клетки глиобластомы от хирургических пациентов, они также обнаружили, что ингибирование этого интегрина блокировало заражение клетки вирусом Зика.
В этот момент результаты двух исследований сходятся, так как первая группа, чтобы блокировать интегрин αvβ5, также использовала на мышах два экспериментальных препарата против рака – циленгитид и SB273005. Обработанных таким образом мышей затем подвергали воздействию вируса Зика. После 6 дней ежедневного лечения исследователи обнаружили, что в мозге мышей было вдвое меньше вируса, чем в мозге мышей из контрольной группы.
Полученные результаты не только дополняют знания о вирусе, но и открывают новую область возможностей в антивирусных стратегиях – блокирование проникновения других подобных вирусов в конкретные ткани путем ингибирования интегринов.
αvβ5 интегрин и рак мозга
Ученые, помимо прочего, открыли возможный способ уничтожения клеток глиобластомы. К этому привело исследование 2017 года, которое показало, что вирус Зика предпочитает инфицировать и убивать клетки глиобластомы. Это наблюдение было захватывающим, поскольку глиобластомы – это не только очень агрессивные опухоли, которые дают высокий уровень смертности, но также они плохо реагируют на стандартную терапию. Это является основной причиной их плохих результатов, при этом большинство глиобластом, если не все, рецидивируют после лечения.
Текущее исследование объясняет, почему вирусом Зика предпочитаются именно стволовые клетки глиобластомы. Ученые обнаружили, что интегрин αvβ5 состоит из двух частей: αv и β5. Оба экспрессируются глиобластомами в высоких уровнях. Однако первая субъединица обычно экспрессируется стволовыми клетками, а вторая связана с раковыми клетками. Для выживания клеток глиобластомы необходима полная молекула. По этой причине вирус Зика преимущественно инфицирует и убивает стволовые клетки глиобластомы.
Оказывается, то что вирус Зика использует для заражения помогает раковым клеткам становиться агрессивными раковыми клетками.
Ученые проверили свою теорию, пересадив человеческие глиобластомы в трехмерные культуры клеток мозга или органоиды мозга. Оказалось, что вирус Зика избирательно удаляет стволовые клетки глиобластомы из органоидов, просто блокируя интегрин αvβ5.
Таким образом, исследователи могут использовать результаты для блокирования проникновения вируса в клетки мозга и для сокращения раковых клеток в мозге, планируя со временем повысить специфичность разрушения клеток головного мозга путем конструирования вирусных генов.
Будущие исследования будут двоякими: разработка вируса Зика для улучшения профиля безопасности при его использовании при опухолях головного мозга и поиск лекарств, которые блокируют интегрин для предотвращения инфекции Зика.
Новые методы лечения опухоли головного мозга и их эффективность
Неудачи операций в первую очередь связаны с отсутствием границ опухоли головного мозга, а лучевой и химиотерапии —с переменными генетическими аберрациями в клетках опухоли, их неоднородностью, невозможностью адекватной поставки лекарств из-за гематоэнцефалического барьера (ГЭБ) и устойчивостью тканей к диффузии, усиливающейся липофильной основой структуры мозга.
а) Нацеливание и доставка. Концепция нацеливания включает широкий спектр лечебных принципов, основанных на специфических свойствах клеток опухолей головного мозга, отличающих их от окружающих тканей, а также на том, что лекарства могут быть введены непосредственно в опухоль, пострезекционную полость и головной мозг.
Такая терапия включает в себя методы генной терапии и генной инженерии; терапии на основе иммунологических свойств и иммунной системы в целом, лекарственные препараты, распознающие специфические и уникальные рецепторы мембраны опухоли, в том числе использование естественных, а также искусственных лигандов и лигандов, связанных с препаратами; пути внутриклеточного вмешательства, влияние на ангиогенез опухоли, а также воздействие на свойства опухолевых клеток к миграции, которые необходимы для их выживания и распрос гранения.
Разработки в области доставки включают в себя методы, предназначенные для преодоления проблем классических перорального, внутривенного или внутриартериального путей введения лекарственных препаратов. Методы, которые развивались и были разработаны в клинике, основываются на местной доставке путем прямой интрапаренхимальной инъекции вируса во время операции, вектор-продуцирующих клеток или медленного высвобождающихся полимеров с химиотерапевтическими веществами.
Кроме того, были использованы полимерные пластины с устойчивым медленным высвобождением BCNU для внутриполостного размещения. Внутриполостная доставка через катетер, соединенный с подапоневротическим резервуаром, является еще одним вариантом радиоиммунотерапии. Ниже представлены новые методы лечения на основе специфического нацеливания, передовых методов доставки и сочетания обеих технологий.
Также применяются ретровирусы и аденовирусы. Во многих странах мира были выполнены многоцентровые исследования (фазы II и III) ретровирусной системы, однако результаты пока неудовлетворительные. Неэффективная доставка генов приводит к недостаточной скорости трансдукции. Аденовирусное направление трансфекции оказалось более эффективным, но и более рискованным.
Другой метод генной терапии направлен на восстановление одного или нескольких генов, которые удаляются в процессе онкогенеза. Наиболее сложный из них ген ТР53, участвующий в нескольких аспектах управления клеточного цикла, удаляется в значительной группе мультиформных глиобластом. С использованием аденовирусного вектора переноса генов ТР53 была достигнута успешная гибель опухолевых клеток в лабораторных условиях, а также клинических, например, при колоректальном раке. Начаты клинические исследования в отношении глиобластом, и вскоре можно будет оценить результаты.
Третья сфера, в которой генные технологии играют важную роль, охватывает повышение иммунного ответа на опухолевые клетки. Это может быть достигнуто, например, путем устранения иммуносупрессоров. Методы основываются на блокировании генов, отвечающих за формирование инсулиноподобного фактора роста I (IGF I), трансформирующего фактора роста бета (TGFbeta) и другие.
Аналогочно иммунологическим факторам, путем вмешательства в соответствующие гены могут осуществляться и манипуляции с генами, влияющими на ангиогенез опухоли. Глиомы высокой степени злокачественности имеют высокую активность ангиогенеза, необходимую для роста и выживания. Данная методика находится на стадии клинического применения (фаза I).
Вирусы также могут быть использованы для прямого влияния на клетки, вызывая их гибель. При рекомбинантных методах они могут быть безопасны и эффективны. В частности, нейротрофические вирусы, как например, вирус простого герпеса и его аналоги представляются перспективными при мутации в формы, имеющие прямое цитопатическое воздействие на опухолевые клетки, а не на нормальные ткани мозга. Были начаты или уже привели к интересным результатам различные клинические испытания. Кроме того, представляется перспективным применение аденовируса, а также другого типа вируса — реовируса.
2. Иммунотерапия и связанные с ней методы. Ограниченная иммуногенность опухолей головного мозга не только связана с ГЭБ, но также и с иммуносупрессорными факторами. В частности с IGF и TGF бета-2 факторами. Как уже говорилось в отдельной статье на сайте, устранение или минимизация их влияния путем подавления их выработки повышает иммунные реакции. Например, местное (внутриопухолевое) применение TGFbeta 2 уже проведено в клинических условиях в течение нескольких месяцев с представляющим интерес ответом.
Различные другие методы существуют и работают в лабораторных условиях, а некоторые уже достигли клинической стадии. Среди них трансдукции ИЛ-2 и ИЛ-7 в опухолевых клетках с целью повышения Т-клеточной реакции; активация естественных дендритных клеток (пассивная и активная иммунизация с риском аутоиммунных реакций в неопухолевой ЦНС) и различные формы иммунизации аутологичных опухолевых клеток. Последний метод был опробован в клиническом многоцентровом исследовании, при этом опухолевые клетки использовать для повторной вакцинации.
Достижения в сфере антигенного нацеливания специфическими (моноклональными) антителами рассматриваются в следующей статье на сайте.
3. Нацеливание с помощью мембранных рецепторов:
• Как многие другие опухоли, полноценные опухоли головного мозга, такие как мультиформная глиобластома, имеют специфические рецепторы на клеточной мембране. Среди наиболее распространенных рецепторов на поверхности глиом являются EGF-R, PDGF-R, FGF-R, VEGF-R, трансферрин, рецепторы цитокинов, таких KaKTGF-бета, ИЛ-13 или ИЛ-4. При взаимодействии специфических антител с этими рецепторами образуются так называемые иммунотоксины. Некоторые из препаратов и токсинов, способные вызывать такие реакции, были подвергнуты клиническим испытаниям. Наиболее важные из них:
• Трансферрин с дифтерийным токсином (Trans-MID).
• TGF (лиганд для EGF-R) с псевдомонадным экзотоксином (ТР-38).
• ИЛ-4 лиганд с псевдомонадным экзотоксином (NBI-3001).
• ИЛ-13 с псевдомонадным экзотоксином (PRE-CISE)).
Стоит отметить, что опухолевые клетки обладают гиперэкспрессией всех этих рецепторов, а также их лигандов, что приводит к аутокринной петле, стимулирующей и поддерживающей клеточную пролиферацию. К особой группе лигандов и рецепторов следует отнести TNF-связанные апоптоз-индуцирующие лиганды (TRAIL) и TRAIL рецепторы. Многие опухоли, в том числе глиобластомы, обладают экспрессией TRAIL и TRAIL рецепторов. Таким образом, эта составляющая тоже может стать конкретной ориентацией для лекарственного апоптоза.
4. Внутриклеточные пути нацеливания, связанные с мембранными рецепторами. Большинство упомянутых лигандов и рецепторов связаны с их внутриклеточным доменом тирозинкиназы (Т3). Ее активация приводит к каскаду внутриклеточных процессов, многие из которых ведут к дальнейшему распространению клеток и/ или миграции. Прямое вмешательство в эти процессы может прервать подобные явления и в дальнейшем привести к апоптозу клеток. Было разработано множество молекул, АТФ-миметиков подобного действия, которые в настоящее время испытываются при многих видах рака, включая мультиформные глиобластомы. Например, эрлотиниб, гефитиниб (пресса), иматиниб (гливек).
5. Терапия, направленная на ангиогенез и миграцию клеток. Злокачественные опухоли, особенно глиобластомы, вызывают неоангиогенез. Неоваскуляризация необходима для дальнейшего роста, а торможение ангиогенеза может ее предотвратить. Клетками-мишенями при антиангиогенной терапии могут быть опухолевые клетки, вырабатыающие ангиогенные факторы, такие как VEGF и VEGF-R, а также сами эндотелиальные клетки, являющиеся более доступными, так как находятся вне ГЭБ.
С ангиогенной активностью опухолевых клеток тесно связан и их миграционный потенциал. Для пролиферации клетки должны вовлекаться в окружающий матрикс и синтезировать матричные металлопротеиназы (ММП). Ингибирование ММП предотвращает миграцию раковых клеток и косвенно их пролиферацию, в результате чего рост опухоли останавливается. Тесная взаимосвязь между биохимическими ан-гиогенными факторами и ММП приводит к двойному действию антиангиогенных препаратов. Так как эти лекарственные препараты не убивают опухолевые клетки, а только предотвращают их дальнейший рост, их часто называют цитостатиками.
Примеры антиангиогенных препаратов, которые были уже испытаны в клинических исследованиях: талидомид, ангиостатин, эндостатин, ZK222584/PTK787 и ингибиторы ЦОГ-2, такие как целекоксиб и циленгитид. Наиболее перспективными представляются результаты исследований, в которых эти препараты используются в сочетании с лучевой терапией и/или цитотоксической химиотерапией.
б) Доставка. За последние годы были разработаны различные методы для преодоления основных препятствий адекватной доставки лечебных препаратов к клеткам головного мозга.
1. Местные инъекции. При разработке направления лечения с помощью ретровирусов возникла необходимость использования продуцирующих клеток. Эти клетки могут быть размещены только в пределах и вокруг остаточной опухоли или полости путем прямой инъекции в паренхиму. В ряде исследований было показано, что такой способ доставки не причиняет никакого вреда пациентам и в большинстве случаев вызывает только минимальные изменения видимые при МРТ. Однако эффективность доставки даже после 50 инъекций была низкой.
Инъекции клеток или препаратов с помощью резервуара Оммайя и постоянного катетера приводит к созданию пула материала вокруг кончика катетера. Лекарственные препараты могут растворяться в тканях путем диффузии, для этого необходимо, чтобы они были липофильными и имели низкий молекулярный вес.
2. Системы медленного высвобождения. Более перспективной представляется концепция систем медленного высвобождения, хотя и при этом диффузия является движущей силой доставки препаратов с вышеупомянутыми ограничениями, особенно, при отеке мозга и высоком интерстициальном давлении. Накопленный опыт в большинстве своем связан с применением биодеградирующих пластин, содержащих BCNU. Однако он оказал незначительный эффект на показатели выживаемости.
Другими системами медленного высвобождения, проверенными в лаборатории и избирательно на пациентах, являются системы на основе липосом, сфер альгината и полимерных наночастиц.
3. Конвекционный метод доставки. В отличие от диффузии, когда градиент концентрации является движущей силой молекулы/лекарства, конвекция основывается на градиенте давления. Это позволяет поставить даже крупные молекулы на более дальние расстояния. Данная технология особенно эффективна, когда дело касается иммунотоксинов, действительно больших молекул. Этот метод хорошо воспроизводиться у небольших животных, тогда как у людей изменение в устойчивости мозговой ткани и ткани опухоли, вероятно, препятствует прогнозируемому распределению растворителей и препаратов.
После большого опыта, накопленного за последние несколько лет, возможности конвекционных методов доставки доказаны в нескольких исследованиях (например, ТП 38, PRECISE). С помощью максимум четырех катетеров, помещенных в мозг, можно покрыть довольно большую часть одного полушария. Все исследования с препаратами с большой молекулярной массой в настоящее время проходят с помощью этого метода.
в) Перспективные разработки:
- В ближайшее время еще один способ нацеливания может достичь клинической стадии: нервные стволовые клетки и клетки-предшественники, похоже, имеют тропность к клеткам опухоли головного мозга. В лабораторных условиях после трансфекции этих клеток с определенными генами было показано, что они имеют возможность преследовать и убивать клетки опухоли головного мозга, даже находящиеся далеко от места инъекции.
- Хирургические усовершенствования могут привести к реальному и значительному сокращению опухолевой нагрузки: интраоперационная визуализация посредством интраоперационной МРТ или визуализации остаточных опухолевых клеток с помощью окрашивания (ALA) сможет решить эту задачу.
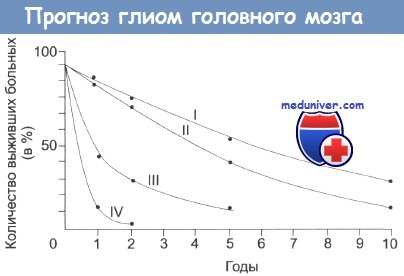
Продолжительность жизни больных со злокачественной глиомой различной степени.
Отметьте, что даже в случаях низкозлокачественной опухоли выживает немного больных.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

