Вирус герпеса на эритроцитах
Обновлено: 24.04.2024
Поражения вирусом герпеса типа 6 гематологических больных - диагностика, лечение
Герпес-вирус человека типа 6 впервые был выделен из мононуклеаров крови больного СПИДом в 1986 г., а в 1988 г. выявлена его связь с одной из сыпных инфекций детского возраста — внезапной экзантемой (roseola infantum), или шестой детской экзантемой. Выделяют два генотипа вируса — А и В, гомология ДНК которых составляет 90 %.
Генотип В выявляется значительно чаще. Первичное инфицирование HHV-6 происходит обычно у детей в первые 2 года жизни через слюну и чаще всего манифестирует высокой лихорадкой неясной этиологии и лимфаденопатией, хотя у части детей наблюдается типичная клиническая картина внезапной экзантемы, когда появление пятнисто-папулезной сыпи на 5—7-й день от начала лихорадки является предвестником выздоровления.
Типично для первичной инфекции развитие фебрильных судорог: примерно у трети больных детей в возрасте до 1,5 года. Это значительно больше, чем у детей с такой же высокой лихорадкой, но не ассоциированной с HHV-6-инфекцией. Возможно, судороги являются следствием специфического вирусного поражения головного мозга, поскольку геном HHV-6 обнаруживается в ткани мозга иммунокомпетентных индивидуумов.
После перенесенной первичной инфекции HHV-6 развивается пожизненная латенция. HHV-6 отличается выраженным лимфотропизмом; его резервуаром являются мононуклеары крови, в частности CD4+-лимфоциты, дендритные клетки, NK-клетки и, возможно, клетки миелоидной линии. Помимо этого, вирус может инфицировать клетки нейроглии и некоторые другие, в частности клетки протоков слюнных желез.

Ганцикловир активен в отношении вируса герпеса типа 6
С последним обстоятельством связана возможность длительной секреции вируса в слюну, которая является основным источником передачи вируса и первичного заражения детей.
Клиническое значение HHV-6 для гематологических больных изучено достаточно слабо. В связи со всеобщей ранней инфицированностью HHV-6 у гамотологических больных первичная инфекция этим вирусом встречается редко, ее клинические признаки неизвестны. Ранняя реактивация HHV-6, выявляемая по виремии, регистрируется у 30—45 % реципиентов аллогенных ТГСК.
Клиническими проявлениями реактивации являются сыпь, лихорадка, замедление становления функции трансплантата и повышение активности печеночных ферментов.
Эти признаки, конечно, крайне неспецифические и могут быть отнесены к проявлениям реактивации HHV-6 только по исключении других причин (CMV-инфекция, РТПХ) и при документации реактивации HHV-6. Данных о влиянии реактивации на исход трансплантации неясен, также неясны подходы к мониторингу и терапии HHV-6.
Ацикловир неактивен в отношении HHV-6, в то время как ганцикловир эффективно ингибирует репликацию вируса.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Г.Р. ФАТКУЛЛИНА, В.А. АНОХИН, Р.И. АЗЮКОВА
Казанский государственный медицинский университет, 420012, г. Казань, ул. Бутлерова, д. 49
Обследовано 154 ребенка с различными нозологическими формами хронических герпесвирусных инфекций. Дана характеристика клинико-лабораторным особенностям анемий, развивающихся уэтих пациентов. Оценены у них показатели феррокинетики, свидетельствующие о доминировании анемии хронического заболевания (АХЗ)в структуре причин снижения уровня гемоглобина. Рассмотрены основные дифференциально-диагностические критерии диагноза. Представлена динамика уровня гемоглобина в ходе проведения противовирусной терапии.
Ключевые слова: дети, герпесвирусные инфекции, анемия хронического заболевания, феррокинетика, противовирусная терапия.
G.R. FATKULLINA, V.A. ANOKHIN, R.I. AZYUKOVA
Kazan State Medical University, 49 Butlerov St., Kazan, Russian Federation, 420012
Anemia of chronic disease and herpetic infections in children
The study included 154 children with different clinical forms of herpetic infections. The article presents the characteristics of clinical and laboratory features of anemia in children with herpes disease. Ferro-kinetic parametersare estimated, which prove the dominance ofchronic diseaseanemia (CDA) over other causes of iron deficiency. The main differential-diagnostic criteria are discussed. The dynamics of the hemoglobin level after antiviral therapy is presented.
Key words: children, herpetic infections, anemia of chronic disease, ferro-kinetics, antiviral therapy.
Во всем мире наиболее распространенной причиной анемии считается дефицит железа в организме [1, 2]. Помимо этого ее развитие традиционно связывают с рядом других причин: с витаминной недостаточностью, длительно протекающими воспалительными процессами, врожденными или приобретенными нарушениями процессов синтеза гемоглобина, дефектами формирования красных кровяных телец и т.п. [1, 3], а распространенность анемии считается интегративным показателем здоровья популяции, традиционно оцениваемым органами практического здравоохранения [1].
С практической точки зрения определение вида анемии, безусловно, важный шаг, поскольку необоснованное назначение препаратов железа (что нередко наблюдается на практике) не только бесполезно, но и, более того, наносит вред больному, приводя к дистрофии слизистой желудочно-кишечного тракта, гемосидерозу, риску развития генерализованных бактериальных процессов и т.д. [6, 7, 9].
Основными отличиями анемии хронического заболевания от уже упомянутой ЖДА считаются:
- повышенный уровень ферритина сыворотки, свидетельствующий о высоком содержании железа в депо;
- умеренно сниженный уровень сывороточного железа;
- нормальный или сниженный уровень общей железосвязывающей способности сыворотки (ОЖСС), что указывает на отсутствии т.н. Fe-голодания сыворотки [8].
Инфекция, вызванная вирусом герпеса человека 6-го типа (англ. — human herpesvirus type 6, HHV-6), занимает особое место. В первую очередь потому, что вызывается одним из наиболее распространенных в человеческой популяции вирусов [10]. Инфицированность ею достигает 60-100% населения различных регионов планеты. Ну и, кроме того, HHV-6 был описан сравнительно недавно, поэтому в настоящее время мы располагаем довольно ограниченной информацией о патогенезе и клинике заболеваний, вызванных этим инфекционным агентом [10].
За последние пять лет значимо увеличилось число детей, умерших от генерализованных инфекционных заболеваний [11]. При этом, как показала статистика, герпетические инфекции, в первую очередь цитомегаловирусная и Эпштейна — Барр вирусная инфекции заняли лидирующие позиции в спектре причин перинатальной патологии [12, 13].
Цель исследования — оценить значимость анемии хронического заболевания у пациентов с хроническими герпетическими инфекциями, вызванными цитомегаловирусом (ЦМВ), вирусом герпеса человека 6-го типа (ВГЧ 6), Эпштейна — Барр вирусом (ЭБВ), герпетическими инфекциями смешанной этиологии.
Материалы и методы исследования
Проведено обследование группы из 154 детей с различными нозологическими формами герпетической инфекций: ЦМВИ — 32 человека, ЭБВИ — 37, ВГЧ-6 инфекция — 41, микст-герпесвирусные инфекции — 44 пациента. Возраст обследованных — от 1,5 до 15 лет (мальчиков — 89, девочек — 65). Пациенты наблюдались амбулаторно и в стационаре инфекционной больницы (РКИБ г. Казани), в период с декабря 2011 по ноябрь 2013 года.
Для верификации диагноза ГВИ использовали иммуноферментный анализ с определением наличия антител к антигенам цитомегаловируса — IgM и G, оценкой индекса авидности; IgG к антигенам вируса герпеса 6-го типа (ВГЧ-6); IgM к капсидному антигену, IgG к раннему и ядерному антигенам ЭБВ в сыворотке крови; полимеразная цепная реакция с определением ДНК ВГЧ-6, ЭБВ и цитомегаловируса в сыворотке крови, ДНК ВГЧ 6 в слюне. Оценивались эритроцитарные индексы: средний объем эритроцита (MCV) и среднее содержание гемоглобина в эритроците (MCH); показатели метаболизма железа: сывороточное железо (СЖ), общая железосвязывающая способность сыворотки (ОЖСС), ферритин, коэффициент насыщения трансферрина железом (КНТ).
Критерии включения в исследование: наличие клинических симптомов хронического инфекционного процесса. Обязательным требованием для включения в группу были маркеры активности одной или нескольких изучаемых вирусных инфекций и повторные эпизоды снижения уровня гемоглобина. При этом, согласно рекомендациям ВОЗ [1], в качестве критерия анемии рассматривались показатели Hb ниже 110 г/л для детей от 6 месяцев до 5 лет; ниже 115 — для детей 5-11 лет и ниже 120 — детям старше 12 лет.
Результаты исследования и обсуждение
Таблица 1.
Клинические варианты герпетической инфекции у обследованных больных (n=154)
| Признак | Абсолютное число | % |
| Хронический мононуклеоз | 117 | 76.0 |
| Хроническая активная герпетическая инфекция с поражением ЦНС | 19 | 12.3 |
| Хронический гепатит | 7 | 4.6 |
| Вирусный пневмонит | 5 | 3.2 |
| Кожная форма без проявлений мононуклеоза | 4 | 2.6 |
| Синдром хронической усталости | 2 | 1.3 |
Обращало внимание снижение уровня гемоглобина у части пациентов, причем достаточно ригидное к ранее проводимым попыткам терапии препаратами железа.
Частота анемии была достаточно высокой и регистрировалась у каждого четвертого (25% — 39 больных). Медиана сроков возникновения анемии с момента появления симптомов инфекционного заболевания составила шесть с половиной месяцев.
У большинства пациентов (71,7%) наблюдалась 1-я степень тяжести анемии; 2-я степень диагностирована у 18,5% детей, а 3-я — у 10,3% обследованных. В последующем для верификации вида анемий была проведена комплексная оценка показателей феррокинетики (табл. 2).
Таблица 2.
Показатели метаболизма железа при анемии у детей с ГВИ (n=39)
| Показатели | Ниже нормы n, абс. (%) | Норма n, абс. (%) | Выше нормы n, абс. (%) |
| MCV (70-100 фл) | 17 (43.6) | 22 (56.4) | 0 (0) |
| MCH(24-33 пг) | 14 (35.9) | 25 (64.1) | 0 (0) |
| СЖ (8,9-21,5 мкмоль/л) | 15 (38.5) | 24 (61.5) | 0 (0) |
| ОЖСС (40,6-62,5 мкмоль/л) | 11 (28.2) | 23 (58.9) | 5 (12.8) |
| КНТ (15-45%) | 31 (79.5) | 8 (20.5) | 0 (0) |
| Ферритин (30-140 нг/мл) | 6 (15.4) | 20 (51.3) | 13 (33.3) |
Первичную информацию о возможной причине анемии можно получить уже при анализе эритроцитарных индексов: среднего объема эритроцитов (MCV) и среднего содержания гемоглобина в эритроците (MCН). Известно, что для ЖДА характерно значимое снижение MCV и MCН [4]. Как видно из таблицы, эритроцитарные индексы у большинства больных (56,4 и 64,1% соответственно) не отличались от условно-нормальных. По данным, приведенным в табл. 3, видно, что показатели СЖ, ОЖСС у большинства больных (61,5 и 58,9% соответственно) находились в диапазоне показателей нормы, что свидетельствует о достаточном количестве железа в организме. Еще один важный фактор, позволяющий дифференцировать истинный и перераспределительный дефицит железа — уровень ферритина сыворотки. Как известно, при АХЗ этот показатель повышается в той или иной мере. В нашем исследовании у 84,6% пациентов ферритин определялся в пределах возрастной нормы или даже превышал условно-нормальные показатели, что говорит о достаточном содержании железа в депо [8]. В пользу АХЗ свидетельствует и тот факт, что уровень ОЖСС был ниже нормы или находился в ее пределах у 28,2% и 58,9% соответственно. При ЖДА же, как известно, данный параметр растет [5, 7].
Наши наблюдения показали, что в структуре анемий у наблюдавшихся больных значительное место занимает АХЗ (33,3%). Поскольку в организме пациентов с АХЗ железо присутствует в достаточном количестве, назначение ферротерапии не имеет смысла и даже опасно возможностью развития разного рода осложнений [4, 6, 9]. Патогенетически оправданно воздействие на первопричину этого явления — хронический воспалительный процесс. В нашем случае это герпетическая инфекция в различных своих формах.
Пациенты с АХЗ и ЖДА (всего 19 детей) получали противовирусную терапию (без использования препаратов железа). В исследовании участвовали пациенты с микросфероцитарной гипохромной анемией, КНТ у которых был менее 15%. При этом к пациентам с ЖДА относили детей с уровнем ферритина менее 30 нг/мл.
У 12 из 13 больных АХЗ уровень гемоглобина достиг нормальных значений после проведения противовирусной терапии. В ситуациях с ЖДА эффект без назначения лечения мы зарегистрировала только у одного больного (возможно, этот пациент имел смешанную природу анемии). Отсутствовал эффект от терапии основного заболевания и у одного больного АХЗ.
У большинства больных анемией при хронической герпетической инфекции в процессе проведения противовирусной терапии был достигнут положительный эффект по целому ряду показателей феррокинетики. Все это еще раз подтвердило мнение о доминировании в спектре причин анемии именно АХЗ.
Вывод
АХЗ является частым видом анемии у детей при хронической герпетической инфекции. Очевидно, что грамотная противоинфекционная терапия позволит в большинстве случаев сгладить или купировать анемический процесс. Безусловно, такого рода тактика не является универсальной, но с учетом распространенности АХЗ подобное врачебное поведение нам кажется оправданным. Дальнейшая диагностическая работа потребует комплексной оценки показателей феррокинетики и окончательного решения вопроса о назначении препаратов железа.
1. WHO/CDC. Assessing the iron status of populations: report of a joint World Health Organization/Centers for Disease Control andPrevention technical consultation on the assessment of iron status at thepopulation level, 2nd ed., Geneva, World Health Organization, 2007.
2. Г.Р. Хасанова. Метаболизм железа у ВИЧ-инфицированных пациентов с анемией // Инфекционные болезни. — 2012. — Т. 9, № 1. — С. 11-13.
3. Cullis J. Anaemia of chronic disease // Clin. Med. — 2013, Apr; 13 (2): 193-6. doi: 10.786 1/clinmedicine. 13-2-193.
5. Белошевский В.А., Минаков Э.В. Анемии при хронических заболеваниях // Воронеж. — 1995. — С. 34-37.
6. Хасанова Г.Р. Анемия хронического заболевания и ВИЧ-инфекция // Практическая медицина. — 2012. — № 1 (56). — С. 49-51.
7. Weiss G., Goodnough L.T. Anemia of chronic disease // New Engl J Med. — 2005. — № 352. — Р. 1011-1023.
9. Weinberg E.D. Iron loading and disease surveillance // Emerg Infect Dis. — 1999. — № 5. — Р. 346-52.
11. Лобзин Ю.В. Проблемы детских инфекций на современном этапе // Инфекционные болезни. — 2009. — № 2. — С. 7-12.
13. Симованьян Э.Н., Денисенко В.Б., Сарычев А.М., Григорян А.В. Хроническая инфекция вируса Эпштейна — Барр у детей: современные аспекты диагностики и лечения // Педиатрия.— 2006. — Т. 8, № 2. — С. 29-35.
1. WHO/CDC. Assessing the iron status of populations: report of a joint World Health Organization/Centers for Disease Control andPrevention technical consultation on the assessment of iron status at thepopulation level, 2nd ed. Geneva, World Health Organization, 2007.
2. Khasanova G.R. Iron metabolism in HIV-infected patients with anemia. Infektsionnye bolezni, 2012, vol. 9, no. 1, pp. 11-13 (in Russ.).
3. Cullis J. Anaemia of chronic disease. Clin. Med., 2013, Apr; 13 (2): 193-6. doi: 10.786 1/clinmedicine. 13-2-193.
4. Solomatina M.A., Al’pidovskiy V.K. Anemia of chronic disease. Vestnik Rossiyskogo universiteta druzhby narodov. Seriya “Meditsina”, 1999, no. 1, pp. 36-38 (in Russ.).
5. Beloshevskiy V.A., Minakov E.V. Anemii pri khronicheskikh zabolevaniyakh [Anemia of chronic disease]. Voronezh, 1995. Pp. 34-37.
6. Khasanova G.R. Anemia of chronic disease and HIV infection. Prakticheskaya meditsina, 2012, no. 1 (56), pp. 49-51 (in Russ.).
7. Weiss G., Goodnough L.T. Anemia of chronic disease. New Engl J Med., 2005, no. 352, rr. 1011-1023.
8. Rykov A.A., Gornostay M.V., Vasil’eva T.V. Laboratory diagnosis of iron deficiency. Meditsinskaya gazeta “Zdorov’e Ukrainy”, 2008, no. 4/1, pp. 52-53 (in Russ.).
9. Weinberg E.D. Iron loading and disease surveillance. Emerg Infect Dis., 1999, no. 5, rr. 346-52.
10. Kazmirchuk V.E., Mal’tsev D.V. Diagnosis and treatment of infection caused by the human herpes virus type 6. Guidelines. Zhurnal “Klinicheskaya immunologiya. Allergologiya. Infektologiya”, 2011, no. 5, pp. 33-40 (in Russ.).
11. Lobzin Yu.V. Problems of childhood infections at the present stage. Infektsionnye bolezni, 2009, no. 2, pp. 7-12 (in Russ.).
12. Vasil’ev V.V., Ushakova G.M., Kopylova A.V. et al. Vrozhdennaya infektsionnaya patologiya: problemy i puti resheniya [Congenital Infectious diseases: problems and solutions]. Sb. dokladov I Vserossiyskoy nauchno-prakticheskoy konferentsii “Infektsionnye aspekty somaticheskoy patologii u detey”. Moscow, 2008. Pp. 12-14.
13. Simovan’yan E.N., Denisenko V.B., Sarychev A.M., Grigoryan A.V. Chronic infection with Epstein — Barr virus in children: current aspects of diagnosis and treatment. Pediatriya, 2006, vol. 8, no. 2, pp. 29-35 (in Russ.).
За последние пять лет увеличилось число детей в возрасте до одного года, умерших от генерализованных вирусных инфекций [4]. Велика роль герпес-вирусных инфекций, особенно цитомегаловирусной, в формировании перинатальной патологии и младенческой смертности. Риск развития внутриутробной инфекции зависит от характера взаимоотношений между организмом беременной женщины и микроорганизмом (первичное заражение во время беременности или реактивация ранее приобретенной инфекции).
Проблема врожденной инфекционной патологии является приоритетной для России [5].
Иммуногенез герпес-вирусной инфекции. Длительное нахождение герпес-вируса в организме человека становится возможным благодаря сложной стратегии противоборства и ускользания от иммунной системы хозяина. В достижении этого состояния можно выделить три пути стратегии возбудителя:
Вирус простого герпеса. В инфицированных клетках вирус простого герпеса образует внутриядерные включения и гигантские клетки, оказывает выраженное цитопатическое действие, проявляющееся округлением и образованием многоядерных клеток. Вирус является слабым индуктором интерферона, в связи с чем инактивация вирусной ДНК внутри клеток не наступает и он сохраняется внутри клеток длительное время, периодически вызывая рецидивы заболевания.
ЦМВ. Сущность проблемы ЦМВ-инфекции в том, что последняя относится к так называемым оппортунистическим инфекциям, клинические проявления которых возможно в условиях первичного или вторичного иммунодефицита.
ЦМВ поражает разнообразные клетки, чаще всего лейкоциты (лимфоциты, моноциты), эпителиальные клетки (дыхательных путей, слюнных желез, почек). С клеток крови ЦМВ с большим постоянством переходит на эндотелий, тропизм к которому у него весьма выражен. Поврежденные эндотелиальные клетки постоянно обнаруживаются в токе крови при активной/реактивированной ЦМВ-инфекции. Повреждение эндотелия сосудов имеет собственное патогенетическое значение в формировании органных поражений, так как вызывает ишемию или кровоизлияния в различные ткани [6].
В раннем неонатальном периоде (0–7 дней) у детей с ЦМВ-инфекцией наблюдались симптомы интоксикации, серый колорит кожи, выраженная мышечная гипотония, большая первоначальная потеря массы тела, синдром рвоты или срыгиваний, признаки угнетения ЦНС. В позднем неонатальном периоде (от 7 дней до одного мессяца) анализ клинических проявлений острой ЦМВ-инфекции выявляет поражение многих органов и систем. Так, у всех детей обнаруживаются гипоксически-ишемическая энцефалопатия с трансформацией синдрома угнетения в синдром гипервозбудимости, проявления анемии, патологическая гипербилирубинемия, увеличение печени и селезенки.
ВЭБ относится к подсемейству бета-герпес-вирусов. Вирусный геном заключен в нуклеокапсид, который покрыт гликопротеидным тегументом gp350, являющимся фактором рецепторного взаимодействия [7]. Проникновение вируса в В-лифоциты осуществляется через рецептор этих клеток CD21-рецептор к C3d-компоненту комплемента. ВЭБ-инфекция широко распространена среди людей, причем первичное инфицирование, как правило, происходит в антенатальном или детском возрасте, но манифестация ВЭБ-инфекции в виде отчетливых клинических проявлений инфекционного мононуклеоза в большинстве случаев происходит в школьном возрасте при различного рода иммунопатологических реакциях. Манифестация инфекции в виде инфекционного мононуклеоза может осложняться поражением печени, слизистой оболочки желудка, ткани почек, лимфоидного аппарата.
Особый характер взаимодействия микро- и макроорганизма при хронических персистирующих инфекциях обусловливают трудности лабораторной диагностики. Обнаружение возбудителя не может быть единственным критерием подтверждения диагноза. Необходима комплексная оценка клинических и лабораторных данных для постановки диагноза.
Цель исследования. Определить клинические особенности течения персистирующих герпес-вирусных инфекций у детей и оценить значимость комплекса лабораторных исследований, в том числе показателей общей иммунологической реактивности у больных при персистирующем у них инфекционном процессе.
Материал и методы исследований. Под наблюдением находилось 63 пациента в возрасте от одного месяца до 7 лет, из них детей до одного года было 25, от одного года до трех лет — 22 и старше трех лет — 15 больных. Среди обследованных детей преобладали пациенты первых двух лет жизни — 47 детей (74,6%) и старше двух лет было 15 больных (25,4%).
Результаты. В клинической диагностике персистирующих инфекций у детей следует отводить первостепенное значение неблагополучию акушерского анамнеза матерей больных детей.
Беременность и роды были осложненными у большинства матерей наблюдаемых детей, чаще всего у них отмечались гестозы и угроза выкидыша, рождение недоношенных, в родах гипоксия плода, преждевременная отслойка плаценты, кесарево сечение и др. У 32 женщин из 63 (50,7%) были различные соматические заболевания (хронический пиелонефрит, кольпит, анемия, аутоиммунный тиреоидит и др.). При обследовании беременных женщин было выявлено как моноинфицирование (у 30 из 63–47,6%), так и сочетания инфекций (у 16 из 63–25,4%). Наиболее часто обнаруживались герпес-вирусы и цитомегаловирусы (суммарно у 27 женщин из 63–43%) и реже другие возбудители — хламидии, микоплазмы (у 11 беременных — 17,4%). Высокая частота вышеуказанных осложнений свидетельствует о несомненной роли инфекции как отягощающего фактора в течение гестационного периода и родов.
Заподозрить внутриутробную или персистирующую инфекцию у детей можно было по высокой степени поражения у детей различных органов и систем: ЦНС (71,4%), органов дыхания (88,8%), желудочно-кишечного тракта (95,2%), поражению глаз (31,7%), лимфатического аппарата (15,9%).
В процессе наблюдения за детьми в недалеком прошлом все дети обследовались на состояние микробиоценоза кишечника.
У всех детей обнаруживались нарушения как в основных компонентах биоценоза, так и в составе условно-патогенной флоры. Следует отметить, что у всех пациентов проводилась коррекция микробиоценоза повторными курсами пре- и пробиотиков, однако восстановления микрофлоры до нормобиоценоза не наблюдалось ни у одного пациента. Следовательно, без выявления и адекватного лечения основного заболевания не удается курировать дисбиотические нарушения в организме ребенка.
Закономерен вопрос о правильности выбора комплекса диагностики внутриутробной и персистирующей инфекции у детей. В зависимости от возраста пользуются разными методами диагностики. Важное значение отводится сбору семейного анамнеза. Диагностика внутриутробных инфекций у детей должна опираться на клинические проявления как общего характера, так и на типоспецифические ее признаки, а также основываться на анализе комплекса лабораторных методов обследования [8].
При оценке клинических анализов крови у наблюдаемых детей обращали на себя внимание значительные отклонения в различных показателях гемограммы: выраженная анемизация (у 31,7% пациентов), нейтропения (у 19%), лимфоцитоз (у 27%), лейкопения с лимфоцитопенией (36,5%), ускорение СОЭ (у 27%), что в совокупности свидетельствовало о наличии воспалительного процесса в организме с выраженным снижением иммунореактивности у детей.
При скрининговом серологическом обследовании методом ИФА на внутриутробные инфекции у детей наиболее часто выявлялись положительные титры типоспецифических антител класса IgM и/или IgG к герпес-вирусам. Диагностические титры антител класса IgM и IgG определялись к ЦМВ (у 9 детей), к HV 1-го, 2-го типа (у 9 детей). Антитела к антигенам ВЭБ обнаруживались у 20 детей, из них у 10 детей были антитела класса IgG к раннему антигену ВЭБ и антитела класса IgM к капсидному антигену ВЭБ, что свидетельствовало об активной фазе ВЭБ-инфекции. Остальные 10 пациентов имели антитела класса IgG к нуклеарному (ядерному) антигену ВЭБ, что расценивалось как поздняя стадия инфекции.
У детей при персистирующем течении с реактивацией инфекции, которое чаще возникало после провоцирующих воздействий (ротавирусные диареи, ОРВИ, профилактические прививки) ПЦР-тесты при исследовании биосубстратов: кровь, осадок мочи, секрет из зева давали положительные результаты с последующим нарастанием титра типоспецифических антител по данным ИФА.
Совокупность проведенных исследований позволила выделить у обследованных больных следующие формы инфекций: моноинфекции были у 21 пациента — 31,8% (ЦМВ — у 5 детей, HV 1-го, 2-го типа — у 6 детей и ВЭБ — у 10), у 42 детей из 63 (68,2%) обнаруживались микст-инфекции. У 23 детей была ассоциация ЦМВ с герпес-вирусами (у 9 детей с HV 1-го, 2-го типа, у 3 детей — с HV 6-го типа и у 11 детей — с C. albicans и хламидиями). Микст-формы герпеса 1-го, 2-го типа были выявлены у 9 больных, у них были ассоциации с микоплазмами и хламидиями. Ассоциации ВЭБ были обнаружены у 10 детей (5 больных имели ассоциацию с ЦМВ, пациента — с HV 6-го типа и 2 больных — с Yersinia pseudotuberculosis).
Из 63 больных у 21 (33,3%) с моноинфекцией течение заболевания расценивалось как латентное (с ЦМВ-инфекцией у 5 и HV 1-го, 2-го типа у 6) и как персистирующее (у 10 детей с ВЭБ-инфекцией). У 14 детей из 42 с микст-инфицированием (у 1/3) было персистирующее течение инфекционного процесса (у 3 детей с ЦМВ-инфекцией в ассоциации с HV 6-го типа и у 11 детей с ЦМВ-инфекцией в ассоциации с C. albicans и хламидиями). У 28 детей из 43 (у 2/3) наблюдалось персистирующее течение с реактивацией инфекции (у 9 детей с ЦМВ-инфекцией в ассоциации с HV 1-го, 2-го типа; у 9 детей с HV 1-го, 2-го типа в ассоциации с хламидиями или микоплазмами и у 10 детей с ВЭБ инфекцией в ассоциации с ЦМВ, HV 6-го типа и ВЭБ в ассоциации с Y. pseudotuberculosis).
Коэффициент фагоцитарной защиты у детей с моноинфицированием и микст-формами герпесвирусной инфекции оказался достоверно сниженным по сравнению со средневозрастной нормой для здоровых детей (0,634 ± 0,05 усл. ед. и 0,540 ± 0,03 усл. ед. соответственно при норме 0,946 ± 0,03, Р1–2 и Р2–3 < 0,001 и < 0,001 соответственно). При микст-инфицировании герпес-вирусами КФЗ имел более низкие значения по сравнению с таковым у детей с -моноинфекцией, однако разница недостоверна (Р1–2 > 0,05). Недостаточность защиты клеточно-фагоцитарного звена иммунитета играет важную роль в патогенезе герпес-вирусных инфекций, что должно учитываться в лечении этих заболеваний.
Отклонение величины показателя ИЛМП имело противоположную направленность, она оказывалась достоверно повышенной как при моноинфекции, так и при микст-формах герпес-вирусных инфекций по сравнению с контролем (Р1–3 и Р2–3 < 0,001 и < 0,001 соответственно). Величины показателя ИЛМП у детей с микст-инфицированием была большей по сравнению с таковой при моноинфекции, однако разница недостоверна Р1–2 > 0,05. Увеличение показателя ИЛМП у детей с герпес-вирусной инфекцией еще раз подтверждает лимфотропность вирусных антигенов.
ЛИИ оказался достоверно повышенным у больных с микст-формами герпес-вирусной инфекции по сравнению со средневозрастной нормой в контроле (Р2–3 < 0,001). Средние значения ЛИИ у детей с моноинфекцией достоверно не отличались от норматива (Р1–3 > 0,05), они имели лишь тенденцию к повышению. Однако при оценке индивидуальных показателей ЛИИ у детей с моноинфицированием герпес-вирусами выявились существенные особенности. У 13 детей из 21 (61,9%) ЛИИ был ниже возрастной нормы, что отражало фазу положительной анергии к совершенно определенному антигену. Это свидетельствует, что организм защищен сейчас только от специфических антигенов, однако он остается уязвимым в отношении других патогенов, то есть низкий индекс интоксикации отнюдь не указывает на полное благополучие организма.
Полученные результаты исследований подтверждают выраженность иммунного дисбаланса как в клеточно-фагоцитарном звене иммунитета, так и в гуморальном, а также свидетельствуют о значимости эндогенной интоксикации у больных с микст-формами герпес-вирусной инфекции и уязвимости иммунной защиты у детей и при моноинфицировании.
Клинический пример. Андрей С., 2 года 5 мес., поступил в стационар с жалобами на высокую температуру — 39 °С, однократную рвоту, сниженный аппетит и жидкий стул 5 раз в сутки. Болен в течение двух недель ОРВИ, получил амбулаторно симптоматическое лечение. К концу второй недели ухудшилось состояние, рецидив лихорадки — 39 °C и дисфункция кишечника. Направлен на госпитализацию.
Анамнез жизни. От первой беременности, протекала с угрозой выкидыша, нефропатией, преэклампсией в родах. Во время беременности перенесла ОPВИ с лимфаденитом. Обследование на пренатальные инфекции, обнаруживались антитела класса IgG к антигенам ЦМВ и вирусу герпеса 1-го, 2-го типа. Лечение не проводилось. Роды в срок, масса при рождении 3500 г, длина 51 см. К груди приложен сразу, сосал активно, грудное вскармливание до года, прикормы вводились в 5 и 6 месяцев. Адаптация к пище нормальная. В массе прибавки достаточные, в 2 г. 5 мес — масса 14 кг 810 г, рост 93 см.
Состояние здоровья в течение первого года жизни неблагополучное. Длительно держалась желтуха, в возрасте 3 недель: общий билирубин — 315,1 мкмоль/л, непрямой — 297,3 мкмоль/л, прямой — 17,8 мкмоль/л. Одновременно с желтухой был неустойчивый стул. В 1-месячном возрасте неврологом установлен диагноз перинатального поражения ЦНС, гипоксическо-ишемического генеза, гипертензионный синдром.
К возрасту 6 мес были обнаружены изменения в гемограмме: гемоглобин — 112 г/л, эритроциты — 4,2 × 10 12 /л, лейкоциты — 7,8 × 10 9 /л, сегментоядерные нейтрофилы — 12%, лимфоциты — 67%, моноциты — 12%, эозинофилы — 8%, базофилы — 1%, СОЭ — 3 мм/час. В повторных анализах крови во 2-м полугодии продолжала выявляться нейтропения. Консультирован гематологом, установлен диагноз доброкачественной нейтропении детского возраста. В 10 мес в анализе крови выявлена анемия (гемоглобин — 107 г/л, эритроциты — 3,81 × 10 12 /л, цветовой показатель — 0,84, тромбоциты — 280 × 10 9 /л, сегментоядерные нейтрофилы — 11%, лимфоциты — 76%, моноциты — 90%, эозинофилы — 3%, базофилы — 1%). Гематологом назначено лечение Сорбифером дурулесом, курс 1 месяц.
Осмотрен ортопедом: отмечено ограниченное отведение бедер. В один год на УЗИ органов брюшной полости определялся перегиб в области шейки желчного пузыря, холестаз. Осмотр генетика: диагностирована недифференцированная дисплазия соединительной ткани с поражением костно-мышечной системы. В 1 г. 5 мес перенес острый энтероколит неуточненной этиологии, госпитализировался в стационар на 10 дней, получал лечение метронидазолом и Энтеролом. В течение 1,5 лет переносит частые ОРВИ с повышением температуры до 38,8 °С в течение 3–4 дней и катаральными явлениями.
Объективные данные. При последней госпитализации отмечались явления назофарингита в течение 5 дней, лихорадка до 39 °С 2 дня, кожные покровы без сыпи. При осмотре — гиперемия зева и увеличение подчелюстных, передних и заднешейных лимфоузлов, стул учащенный до 3 раз в сутки, с 5 дня лечения — оформленный. ЛОР-врачом диагностирован хронический тонзиллит и аденоидит, в фазе обострения.
Обследование. В мазке из зева — высев гемолитического стрептококка. Посевы на патогенную кишечную флору отрицательные. ИФА на ротавирус — отрицательный. Реакция непрямой гемагглютинации (РНГА) с кишечными диагностикумами — отрицательные.
Гемограмма при поступлении: гемоглобин 104 г/л, эритроциты — 3,7 × 10 12 /л, цветовой показатель — 0,85, лейкоциты — 6,4 × 10 9 /л, палочкоядерные нейтрофилы — 4%, сегментоядерные — 72%, лимфоциты — 18%, моноциты — 4%, эозинофилы — 2%, СОЭ — 4 мм/час.
Гемограмма в динамике: гемоглобин — 109 г/л, эритроциты — 3,4 × 10 12 /л, лейкоциты — 7,8 × 10 9 /л, палочкоядерные нейтрофилы — 19%, сегментоядерные — 42%, лимфоциты — 28% (широкоплазменные лимфоциты), моноциты — 8%, плазматические клетки — 1%, эозинофилы — 2%, СОЭ — 13 мм/час. В дальнейшем — красная кровь оставалась без динамики, число лейкоцитов не изменялось, нарастал лимфоцитоз до 43% (широкоплазменные формы), моноцитов до 12%, СОЭ повысилась до 20 мм/час.
Анализ мочи без отклонений от нормы (пятикратно). В биохимическом анализе крови — умеренная гипоальбуминемия, печеночные пробы — в норме. ИФА на специфические антитела к антигенам ЦМВ класса IgM — отрицательный, класса IgG — положительный. Маркеры ДНК-ЦМВ в осадке мочи и в секрете из зева методом ПЦР не найдены. ИФА на специфические антитела к хламидийному антигену (Chlamydia pneumoniae) — положительный в титре 1:80. Маркеры ДНК Ch. pneumoniae в мазке из носоглотки методом ПЦР — положительный. ИФА с микоплазменным антигеном — IgM и IgG — отрицательные, с герпес-вирусами 1-го, 2-го типа — IgM и IgG отрицательные. ИФА на специфические антитела к антигенам ВЭБ: IgM к капсидному антигену — отрицательный, IgG к раннему антигену — положительный и IgG к ядерному антигену (IgGNA) — положительный (> 0,5 ед.). Совокупность данного анализа была индикатором активной фазы мононуклеозной инфекции.
После проведенного обследования ребенку была назначена адекватная комплексная терапия (Cумамед, Ликопид с последующим переходом на Виферон, витамины А, Е, Пиридоксин, пробиотики — курс Примадофилуса). Наблюдение за ним продолжается.
Выводы
- В пользу диагностики персистирующих инфекций у детей свидетельствует отягощенный акушерско-гинекологический и соматический анамнез, а также инфекционный фактор беременных женщин.
- Заподозрить внутриутробное инфицирование у детей раннего возраста можно по высокой степени поражения различных органов и систем: ЦНС, органов дыхания, пищеварения, лимфатического аппарата.
- Диагностика внутриутробных инфекций должна базироваться на клинических проявлениях болезни и основываться на комплексе лабораторных и иммунологических методов исследования с их оценкой в динамике (в 1 мес, 3 мес, 6 мес и в 1 год жизни).
- Правильность выбора комплекса клинических и лабораторных тестов (ИФА в динамике, ПЦР-тесты с различными биосубстратами) приводит к своевременной диагностике внутриутробных инфекций и позволяет выявить моноинфицирование или микст-формы при их длительной персистенции.
- Для суждения о состоянии общей иммунологической реактивности детей с персистирующими герпесвирусными инфекциями может использоваться оценка интегральных показателей (КФЗ и ИЛМП): чем меньше величина КФЗ, тем больше выражен риск прорыва защитного барьера на пути инфекции.
- Наиболее неблагоприятное персистирующее течение имеют микст-формы герпесвирусной инфекции (ЦМВ, герпес, ВЭБ) или их сочетания с внутриклеточными возбудителями.
Литература
Ф. Н. Рябчук, кандидат медицинских наук, доцент
З. И. Пирогова, кандидат медицинских наук, доцент
СПбМАПО, Санкт-Петербург
В последние годы в инфекционной патологии все большее значение приобретают герпес-вирусы (от греч. herpes — ползучий). Внимание, которое вирусологи и клиницисты проявляют в последние 25 лет к герпес-вирусным заболеваниям человека, связано
В последние годы в инфекционной патологии все большее значение приобретают герпес-вирусы (от греч. herpes — ползучий). Внимание, которое вирусологи и клиницисты проявляют в последние 25 лет к герпес-вирусным заболеваниям человека, связано с их значительной эпидемиологической ролью и социальной значимостью в современном мире. Неуклонный рост числа герпетических заболеваний у взрослых и детей обусловливает необходимость всестороннего изучения герпетической инфекции и разработки эффективных методов профилактики и лечения разнообразных форм этой инфекции. Среди вирусных инфекций герпес занимает одно из ведущих мест в силу повсеместного распространения вирусов, многообразия клинических проявлений, как правило, хронического течения, а также различных путей передачи вирусов.
Он входит в число наиболее распространенных и плохо контролируемых инфекций человека. Герпес-вирусы могут циркулировать в организме с нормальной иммунной системой бессимптомно, но у людей с иммуносупрессией вызывают тяжелые заболевания со смертельным исходом. По данным ВОЗ, смертность от герпетической инфекции среди вирусных заболеваний находится на втором месте (15,8%) после гепатита (35,8%).
Герпес-вирусы объединены в обширное семейство Herpesviridae и в настоящее время наиболее четко классифицированы. Семейство Herpesviridae включает в себя более 80 представителей, 8 из которых для человека наиболее патогенны (human herpes virus-HHV). Герпес-вирусы — филогенетически древнее семейство крупных ДНК-вирусов — подразделяются на 3 подсемейства в зависимости от типа клеток, в которых протекает инфекционный процесс, характера репродукции вируса, структуры генома, молекулярно-биологических и иммунологических особенностей: α, β и γ (табл. 1, по данным Н. Г. Перминова, И. В. Тимофеева и др., Государственный научный центр вирусологии и биотехнологий).
α-герпес-вирусы, включающие HSV-1, HSV-2 и VZV, характеризуются быстрой репликацией вируса и цитопатическим действием на культуры инфицированных клеток. Репродукция α-герпес-вирусов протекает в различных типах клеток, вирусы могут сохраняться в латентной форме, преимущественно в ганглиях.
β-герпес-вирусы видоспецифичны, поражают различные виды клеток, которые при этом увеличиваются в размерах (цитомегалия), могут вызывать иммуносупрессивные состояния. Инфекция может принимать генерализованную или латентную форму, в культуре клеток легко возникает персистентная инфекция. К этой группе относятся CMV, HHV-6, HHV-7.
Герпес-вирусы ассоциированы с малигнизацией и способны (по крайней мере, EBV и HVS) трансформировать клетки in vitro. Все герпес-вирусы сходны по морфологическим признакам, размерам, типу нуклеиновой кислоты (двухцепочечная ДНК), икосадельтаэдрическому капсиду, сборка которого происходит в ядре инфицированной клетки, оболочке, типу репродукции, способности вызывать хроническую и латентную инфекцию у человека.
В эпидемиологическом плане наиболее интересны следующие сведения о герпес-вирусах: вирионы чрезвычайно термолабильны — инактивируются при температуре 50–52°С в течение 30 мин, при температуре 37,5°С — в течение 20 ч, устойчивы при температуре 70°С; хорошо переносят лиофилизацию, длительно сохраняются в тканях в 50-процентном растворе глицерина. На металлических поверхностях (монеты, дверные ручки, водопроводные краны) герпес-вирусы выживают в течение 2 ч, на пластике и дереве — до 3 ч, во влажных медицинских вате и марле — до их высыхания при комнатной температуре (до 6 ч).
Уникальными биологическими свойствами всех герпес-вирусов человека является тканевой тропизм, способность к персистенции и латенции в организме инфицированного человека. Персистенция представляет собой способность герпес-вирусов непрерывно или циклично размножаться (реплицироваться) в инфицированных клетках тропных тканей, что создает постоянную угрозу развития инфекционного процесса. Латенция герпес-вирусов — это пожизненное сохранение вирусов в морфологически и иммунохимически видоизмененной форме в нервных клетках регионарных (по отношению к месту внедрения герпес-вируса) ганглиев чувствительных нервов. Штаммы герпес-вирусов обладают неодинаковой способностью к персистенции и латенции и чувствительностью к противогерпетическим препаратам в связи с особенностями их ферментных систем. У каждого герпес-вируса свой темп персистенции и латенции. Среди изучаемых наиболее активны в этом отношении вирусы простого герпеса, наименее — вирус Эпштейна-Барр.
По данным многочисленных исследований, к 18 годам более 90% жителей городов инфицируются одним или несколькими штаммами по меньшей мере 7 клинически значимых герпес-вирусов (простого герпеса 1 и 2 типов, варицелла зостер, цитомегаловирусом, Эпштейна-Барр, герпеса человека 6 и 8 типов). В большинстве случаев первичное и повторное инфицирование происходит воздушно-капельным путем, при прямом контакте или через предметы обихода и гигиены (общие полотенца, носовые платки и т. п.). Доказаны также оральный, генитальный, орогенитальный, трансфузионный, трансплантационный и трансплацентарный пути передачи инфекции.
Герпес-вирусные инфекции широко распространены в мире и имеют тенденцию к неуклонному росту. Особенностью герпес-вирусной инфекции является возможность вовлечения в инфекционный процесс многих органов и систем, чем и обусловлено многообразие вызываемых герпес-вирусами заболеваний, варьирующих от простых кожно-слизистых до угрожающих жизни генерализованных инфекций. Важное свойство герпес-вирусов — это способность после первичного инфицирования в детском возрасте пожизненно персистировать в организме и реактивироваться под влиянием различных экзо- и эндогенных провоцирующих факторов.
Инфицирование человека указанными герпес-вирусами сопровождается клиническими симптомами соответствующего острого инфекционного заболевания в среднем не более чем у 50% людей, в основном у детей: внезапная эритема (вирус герпеса человека 6 типа), афтозный стоматит (вирусы простого герпеса 1 или 2 типов), ветряная оспа (вирус варицелла зостер), инфекционный мононуклеоз (вирус Эпштейна-Барр), мононуклеозоподобный синдром (цитомегаловирус). У остальных пациентов инфекция протекает бессимптомно, что особенно характерно для подростков и взрослых людей. Помимо биологических свойств штамма герпес-вируса, влияние на течение острых и рецидивирующих герпес-вирусных заболеваний оказывают индивидуальные (возрастные, половые, фило- и онкогенетические) особенности иммунного ответа инфицированного человека на многочисленные антигены вируса.
Часто, особенно при снижении иммунореактивности организма, герпес-вирусы выступают в качестве вирусов-оппортунистов, приводя к более тяжелому, с необычными клиническими проявлениями, течению основного заболевания. Вирусы простого герпеса 1 и 2 типов, а также ЦМВ входят в число возбудителей TORCH-инфекций. Они играют важную роль в нарушении репродуктивной функции человека, развитии серьезных заболеваний матери, плода, новорожденного и детей младшего возраста.
Вызываемые вирусами ВПГ, CMV, ВЭБ заболевания рассматриваются как СПИД-индикаторные в связи с их частым обнаружением при данной патологии. В 1988 г. они включены в расширенное определение случаев, подлежащих эпидемиологическому надзору по поводу СПИДа. Результаты исследований последних лет свидетельствуют о роли некоторых герпес-вирусов (ВГЧ-8, ЦМВ, ВЭБ и др.) в развитии ряда злокачественных новообразований: назофарингеальной карциномы, лимфомы Беркитта, В-клеточной лимфомы, рака груди, аденокарциномы кишечника и простаты, карциномы цервикального канала шейки матки, саркомы Капоши, нейробластомы и др.
Наибольшую угрозу для здоровья представляют герпетические нейроинфекции (летальность достигает 20%, а частота инвалидизации — 50%), офтальмогерпес (почти у половины больных приводит к развитию катаракты или глаукомы) и генитальный герпес.
Диагностика герпетической инфекции
Все методы индикации и идентификации вирусов основаны на следующих принципах:
- выявление вируса per se (электронная микроскопия);
- выявление и идентификация вирусов посредством взаимодействующих с ними клеток (накопление вирусов в чувствительных к ним клетках);
- выявление и идентификация вирусов с помощью антител (МФА, ИФА, РАЛ, ИБ, РН, РСК);
- выявление и идентификация нуклеиновых кислот (ПЦР, МГ).
Электронная микроскопия: быстрая диагностика позволяет обнаружить ГВ или их компоненты непосредственно в пробах, взятых от больного, и дать быстрый ответ через несколько часов. Возбудитель выявляют с помощью электронной микроскопии клинического материала при негативном контрастировании.
Серологические методы уступают по информативности и чувствительности другим способам лабораторной диагностики и не позволяют с достаточной степенью достоверности установить этиологию той или иной формы заболевания. Нарастание титров антител происходит
в поздние сроки (через несколько недель) после заражения или реактивации вируса, и в то же время оно может и не наблюдаться у иммунодефицитных лиц. Для установления 4-кратного нарастания титра антител к герпес-вирусной инфекции (показатель первичной инфекции) необходимо исследование парных сывороток. Серологические реакции (РСК, РН) обладают высокой специфичностью, но относительно низкой чувствительностью, а кроме того, сложны в постановке.
Широкое практическое применение получили иммунофлюоресцентный метод, ИФА, РАЛ, ИБ.
Наиболее точным методом диагностики герпес-вирусной инфекции является выделение вируса из различных клеточных культур.
Для обнаружения вируса герпеса используют молекулярно-биологические методы: полимеразную цепную реакцию и реакцию молекулярной гибридизации, которые позволяют выявить наличие вирусной нуклеиновой кислоты в исследуемом материале. ПЦР может считаться самой чувствительной и быстрой реакцией. Чувствительность метода дает возможность определить одну молекулу искомой ДНК в образцах, содержащих 10 клеток.
Лечение герпетической инфекции
Лечение герпетической инфекции до настоящего времени остается сложной задачей. Хроническое течение процесса приводит к иммунной перестройке организма: развитию вторичной иммунной недостаточности, угнетению реакции клеточного иммунитета, снижению неспецифической защиты организма. Несмотря на разнообразие лекарственных препаратов, использующихся для лечения герпетической инфекции, лекарственных средств, обеспечивающих полное излечение от герпеса, не существует. Герпес-вирусная инфекция относится к трудно контролируемым заболеваниям. Это связано, в первую очередь, с разнообразием клинических поражений, развитием резистентности вируса к лекарственным средствам, наличием у герпес-вирусов молекулярной мимикрии. Поэтому для успешного лечения герпетической инфекции необходимо правильно подобрать противовирусный препарат, его дозу и длительность лечения, использовать комбинацию различных лекарств. В схемы терапии для повышения эффективности лечения необходимо также включать иммунобиологические препараты, способствующие коррекции иммунного статуса, а также патогенетические средства, облегчающие состояние пациента.
В настоящее время все антигерпетические средства подразделяются на 3 основные группы антивирусных препаратов (табл. 3).
Механизм действия химиопрепаратов (аномальных нуклеозидов: валтрекса, вектавира, фамвира, цимевена) связан с угнетением синтеза вирусной ДНК и репликации вирусов путем конкурентного ингибирования вирусной ДНК-полимеразы.
В препаратах-иммуномодуляторах (алпизарин, имунофан, ликопид, полиоксидоний) активно действующие вещества обладают иммуностимулирующими свойствами в отношении клеточного и гуморального иммунитетов, окислительно-восстановительных процессов, синтеза цитокинов.
Препараты-индукторы ИФН (амиксин, неовир, циклоферон) сочетают этиотропный и иммуномодулирующий эффекты действия. Препараты индуцируют образование эндогенных ИФН (α, β, γ) Т- и В-лимфоцитами, энтероцитами, гепатоцитами.
Особое место среди средств антигерпес-вирусной терапии занимает герпетическая вакцина для активации клеточного иммунитета, его иммунокоррекции в фазе ремиссии. Вакцинация преследует 2 цели: предупреждение первичной инфекции и возникновения состояния латентности, а также предупреждение или облегчение течения заболевания.
Однако, несмотря на наличие обширного списка антигерпетических препаратов, герпес остается до сих пор плохо контролируемой инфекцией. Это обусловлено и генотипическими особенностями возбудителя, и длительной персистенцией вируса в организме, и формированием штаммов, устойчивых к антивирусным препаратам. Максимальный клинический эффект может быть получен только при рациональной комплексной терапии лекарственных средств с различным механизмом действия.
Санкт-Петербургской группой ученых вирусологов и инфекционистов во главе с В. А. Исаковым предложена программа лечения и профилактики герпетической инфекции (табл. 4).
Преимущества комплексной терапии ГИ.
- Сочетанное применение противогерпетических химиопрепаратов и иммунобиологических средств обеспечивает синергидный эффект.
- Благодаря снижению дозы противовирусного ХПП уменьшается вероятность развития побочных эффектов, сокращается токсическое воздействие на организм больного.
- Снижается вероятность возникновения устойчивых штаммов герпес-вирусов к данному препарату.
- Достигается иммунокорригирующий эффект.
- Сокращается продолжительность острого периода болезни и сроков лечения.
Таким образом, терапия ГИ является сложной и многокомпонентной задачей.
По вопросам литературы обращайтесь в редакцию.
Т. К. Кускова, кандидат медицинских наук
Е. Г. Белова, кандидат медицинских наук
МГМСУ, Москва
Поражения вирусом простого герпеса (ВПГ) гематологических больных - эпидемиология, частота
Вирус простого герпеса (ВПГ) является антропонозным, широко распространенным в человеческой популяции (даже в изолированных от остального человечества племенах он встречается очень часто). Согласно генетическим характеристикам, различают вирусы простого герпеса типов 1 и 2, имеющие неодинаковые эпидемиологические, культуральные характеристики и способные вызывать различные клинические синдромы.
Вирус герпеса типа 1 (ВПГ-1) поражает верхнюю половину туловища (кожа, слизистые оболочки, гораздо реже головной мозг, легкие, печень и кишечник), в то время как вирус герпеса типа 2 (ВПГ-2) обычно вызывает поражение слизистых оболочек половых путей (генитальный, анальный герпес). Механизм передачи герпеса контактный. Главным источником заражения является слюна серопозитивного индивидуума, поэтому неудивительно, что самая высокая частота первичной герпетической инфекции приходится на ранний детский возраст (поцелуи родителей и родственников, общие игрушки и посуда).
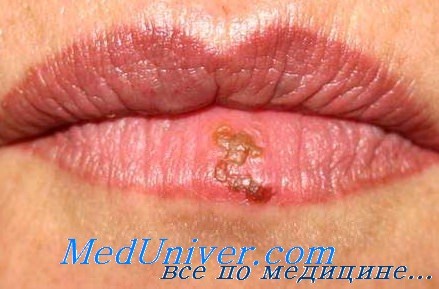
Латентное состояние вируса (непродуктивная инфекция) представляет собой неустойчивое равновесие, легко нарушаемое при неблагоприятных воздействиях (стресс, инсоляция, перегревание, переохлаждение). В этом случае вирус покидает место латенции — периферические ганглии и по нейрональному пути достигает покровов.
Факторами, благоприятно влияющими на реактивацию ВПГ у онкогематологических больных, являются гранулоцитопения и поражение слизистых оболочек, вызванные цитотоксической химиотерапией, гипогаммаглобулинемия, лимфопения, нарушения питания. Следует отметить, что с наибольшей частотой к реактивации ВПГ приводит терапия, вызывающая поражение слизистых оболочек, поэтому, например, при острых лимфоидных лейкозах частота реактивации выше, чем при острых миелоидных лейкозах.
Тяжесть проявлений и длительность герпесвирусной инфекции зависят от степени и продолжительности иммуносупрессии, которая может сильно варьировать в зависимости от основного заболевания (например, при иммунодефицитных синдромах, хронических лимфоидных лейкозах повышен риск развития тяжелых герпесвирусных поражений) и терапии (самые тяжелые поражения отмечаются после аллогенной ТКМ, высок риск тяжелой ВПГ-инфекции у больных, получавших антитимоцитарный глобулин и флударабин).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

