Вирус гриппа и бактериофаги
Обновлено: 19.04.2024
Для цитирования. Костюкевич О.И. Применение бактериофагов в клинической практике: эпоха Возрождения // РМЖ. 2015. № 21. С. 1258–1262.
Предпосылки к применению бактериофагов
На сегодняшний день бактериальные инфекции представляют собой крайне актуальную проблему здравоохранения. И причинами этого являются не только возрастающая антибиотикорезистентность, но и крайне негативные последствия для здоровья нерациональной антибиотикотерапии.
Побочные эффекты антибиотикотерапии
Кроме того, клиницисты в своей практике все чаще сталкиваются с неудовлетворительной переносимостью АБП. Так, частота антибиотико-ассоциированной диареи за последние годы существенно возросла и составляет от 2 до 30% в зависимости от применяемого антибиотика [6]. Все больше пациентов отказываются от приема АБП в связи с развитием побочных эффектов или вследствие боязни (порой вполне обоснованной) кишечных дисбиозов. И все чаще, к сожалению, мы сталкиваемся с нарушением принципов рациональной антибиотикотерапии со стороны самих врачей, что, безусловно, усугубляет ситуацию и с резистентностью к АБП, и с безопасностью антибиотикотерапии.
В этой связи ключевыми задачами являются разработка и внедрение в клиническую практику дополнительных средств борьбы с инфекционными заболеваниями, в качестве которых, несомненно, можно рассматривать бактериофаги.
Бактериофаг (бактерии + греч. phagos – пожирающий; синоним: фаг, бактериальный вирус) – вирус, избирательно поражающий бактерии. Бактериофаги широко распространены в природе, каждый грамм почвы, каждый кубический сантиметр воды и воздуха, продукты питания, растения и животные содержат миллионы фаговых частиц (от 10 до 100 млн). Это древнейшие обитатели планеты, являющиеся естественными ограничителями распространения бактерий.
В 1921 г. Д. Мэйсин и Р. Брайонг впервые описали успешный способ лечения стафилококковых инфекций кожи с помощью стафилококкового фага. До середины ХХ в. на Западе бактериофаги широко изучались и эффективно использовались в качестве лечебного средства против ряда заболеваний, включая дизентерию, тиф, паратиф, холеру и гнойно-септические инфекции.
Однако с момента открытия А. Флемингом в 1928 г. пенициллина началась новая эра борьбы с инфекционными заболеваниями – эра антибиотиков. И бактериофаги, на тот период оказавшиеся менее эффективными, были преданы забвению в западном мире. В СССР же разработки и исследования препаратов бактериофагов не прекращались и активно поддерживались на самом высоком уровне. В 1930-е гг. был создан Институт исследования бактериофагов в Тбилиси, который в 1951 г. вошел в состав группы институтов вакцин и сывороток.
В литературе указывается, что в СССР в 1930–1940 гг. фаготерапия активно использовалась для лечения широкого спектра бактериальных инфекций в области дерматологии (Беридзе, 1938), офтальмологии (Родигина, 1938), урологии (Цулукидзе, 1938), стоматологии (Ручко и Третьяк, 1936), педиатрии (Александрова, 1935; Лурье, 1938), отоларингологии (Ермолиева, 1939) и хирургии (Цулукидзе, 1940, 1941). Эти статьи были опубликованы на русском языке и не были доступны западным ученым. Тем не менее прошлый опыт указывает на высокую эффективность фаготерапии и профилактики.
Клиническое применение препаратов бактериофагов в настоящее время
Фаготерапия с позиций доказательной медицины
За последние 10 лет количество публикаций в ведущих мировых медицинских изданиях, затрагивающих вопросы лечебного и профилактического применения бактериофагов, возросло в несколько раз и превысило уже 3000 (в базе данных PubMed). Количество опубликованных в последнее время работ свидетельствует о возрождении интереса к фаготерапии. Недавно завершившиеся клинические исследования предоставляют убедительные доказательства в отношении безопасности и эффективности фаготерапии у животных и человека [13–15]. Двойная терапия с использованием фагов и антибиотиков приводила к значимо лучшим результатам, чем монотерапия антибиотиками [16]. Показано, что бактериофаги могут быть более эффективными, чем традиционные антибиотики для разрушения бактериальных биопленок [17].
Механизм действия бактериофагов
Антибактериальный эффект бактериофагов обусловлен внедрением генома фага в бактериальную клетку с последующим его размножением и лизисом инфицированной клетки. Вышедшие во внешнюю среду в результате лизиса бактериофаги повторно инфицируют и лизируют уже другие бактериальные клетки, действуя до полного уничтожения патогенных бактерий в очаге воспаления.
Достоинства фаготерапии
Таким образом, на основании накопленных данных можно сформулировать следующие предпосылки к широкому применению препаратов бактериофагов в лечебных и профилактических целях:
1. Эффективность в терапии инфекций, вызванных антибиотикорезистентными бактериями, в т. ч. ИСМП.
2. Возможность применения при аллергических реакциях на АБП.
3. Низкая токсичность, позволяющая считать их самыми безопасными препаратами, что определяет возможность их широкого применения у детей, беременных и кормящих женщин.
4. Высокая специфичность (отсутствие влияния на нормальную микрофлору человека) дает существенное преимущество в лечении любых инфекционных заболеваний у пациентов с различными нарушениями кишечной микрофлоры (в т. ч. с синдромом избыточного бактериального роста (СИБР) и другими дисбиозами), распространенность которых в последние годы значимо возросла.
5. Высокая эффективность в терапии хронических инфекций, особенно ассоциированных с образованием бактериальных биопленок.
6. Возможность применения в виде различных форм: местных аппликаций, жидких и таблетированных; парентеральных.
Ограничения фаготерапии
В то же время бактериофаги в настоящее время в реальной практике применяются намного реже, чем можно было бы ожидать, учитывая большой объем позитивной информации.
Можно выделить следующие причины, ограничивающие применение бактериофагов:
1. Прежде всего это отсутствие нормативно-правовых документов и недостаточная информированность специалистов [21].
2. Есть еще некоторые патогенные для человека бактерии (согласно утвержденному перечню биологических агентов [22]), для которых до сих пор не найдены литические фаги, в т. ч. представители 3-го уровня биобезопасности, такие как Rickettsia, Ehrlichia и Coxiella (возбудители эрлихиоза, эпидемического сыпного тифа, лихорадки Скалистых гор).
3. Выработка антифаговых антител. Проблема иммунного взаимодействия организма человека и фагов пока находится на стадии изучения. Наименьшее количество антител к бактериофагам вырабатывается у новорожденных и грудных детей, что определяет наибольшую эффективность фаготерапии именно в этой группе.
4. Довольно редко, но все же встречаются побочные эффекты употребления фагов, которые обычно связаны с массивным распадом бактериальных клеток с выделением эндотоксина. Справедливости ради надо отметить, что подобные эффекты гораздо более значимы при антибиотикотерапии. Нивелировать данные нежелательные явления в большинстве случаев можно при помощи энтеросорбентов.
Принципы рациональной фаготерапии
Необходимо отметить, что применение бактериофагов, как и любых АБП, должно основываться на рациональных принципах.
1. Предварительное определение чувствительности бактерий к препарату и литической активности бактериофагов в лаборатории.
Все бактериофаги можно разделить на умеренные и вирулентные (или литические).
А. Умеренные бактериофаги включают свой генетический материал в хромосомы бактерий и размножаются синхронно с клеткой хозяина, долгое время не вызывая лизиса. Умеренные бактериофаги играют существенную роль в эволюции бактерий, способствуя приобретению возбудителями дополнительных факторов вирулентности и антибиотикорезистентности. В настоящее время доказано, что множество факторов вирулентности у патогенных бактерий закодировано именно с помощью профаговых генов.
Б. Вирулентные фаги всегда приводят к разрушению бактерий (литический эффект) и высвобождению зрелых фаговых частиц, поражающих новые бактериальные клетки.
В связи с этим бактериофаги, применяемые для лечения инфекционных заболеваний, должны быть исключительно вирулентными, т. е. приводить к гибели бактерий. Литическая активность назначаемых для лечения препаратов бактериофагов обязательно должна быть предварительно проверена в лаборатории.
2. Выбор системы доставки играет ключевую роль в успешной фаготерапии.
Последние достижения в области фаготерапии показывают, что местная (адресная) доставка была более успешной для локализованной инфекции, в то время как для системных инфекций рекомендован парентеральный путь введения [23]. При использовании пероральных форм препаратов необходимо учитывать чувствительность фагов к действию соляной кислоты желудка и в этом случае отдавать предпочтение доставке в кислотоустойчивой оболочке.
Применение бактериофагов при заболеваниях ЖКТ
Лечение бактериофагами инфекций ЖКТ обладает существенным преимуществом по сравнению с антибиотиками в отношении влияния на нормальную кишечную микрофлору. Показана эффективность фаготерапии в отношении таких возбудителей инфекций ЖКТ, как энтеропатогенные E. coli [25], S. sonnae, flexneri, Salmonella E, P.vulgaris, mirabilis, S. aureus, P. aeruginosa, Enterococcus и др.
В практике гастроэнтеролога можно выделить 2 основные группы пациентов, которым может быть показана терапия бактериофагами:
1) с острыми бактериальными инфекциями (острый гастроэнтерит, гастроэнтероколит);
2) с различными нарушениями нормальной кишечной микрофлоры (СИБР в тонкой кишке, дисбиоз толстой кишки), встречающимися в той или иной степени у большинства пациентов с заболеваниями ЖКТ.
Фаготерапия острых бактериальных диарей
Лечение острых бактериальных диарей представляет порой значительные сложности из-за низкой эффективности АБП и развития побочных эффектов. Показано, что вследствие влияния антибиотиков на нормальную кишечную микрофлору угнетается механизм природной колонизационной резистентности. Кроме того, известен прямой механизм иммуносупрессивного действия антибиотиков. Все это может привести к длительной персистенции возбудителя острой кишечной инфекции (ОКИ) на фоне антибиотикотерапии [26, 27]. Так, по данным некоторых исследований, у пациентов, получавших АБП в острую фазу сальмонеллеза, достоверно чаще впоследствии встречалось бактериовыделение сальмонелл в сравнении с лицами, получавшими только патогенетическую терапию [28].
Показания к использованию бактериофагов при ОКИ на сегодняшний день можно сформулировать следующим образом:
– в качестве монотерапии – при легких формах ОКИ;
– в сочетании с антибактериальной терапией или последовательно – при среднетяжелых и тяжелых формах ОКИ;
– при бактериовыделении (у реконвалесцентных или транзиторных бактерионосителей);
– в комплексе терапии энтероколитов условно-патогенной и стафилококковой этиологии;
– для коррекции нарушений микробиоценоза кишечника [29].
Обязательным условием фаготерапии является посев кала с определением фаговой чувствительности. В случае неверифицированного возбудителя предпочтение следует отдавать комплексным препаратам бактериофагов (интести-бактериофаг), обладающим широким спектром действия в отношении возбудителей основных кишечных инфекций.
Перспективы применения бактериофагов
Мы стоим на пороге "Эпохи Возрождения" бактериофаготерапии, которая открывает новые перспективы в лечении антибиотикорезистентной микрофлоры, а также имеет хороший профиль безопасности. В России уже сегодня фаготерапия с успехом применяется при широком спектре заболеваний, и, безусловно, оправдывает себя при различных нарушениях кишечной микрофлоры. Прицельное действие препаратов позволяет сохранить тонкую грань баланса нормофлоры, что крайне важно для наших пациентов.
Человек живет впостоянном контакте исложнейшем взаимодействии снеисчислимым множеством микроорганизмов. Жить без микробов невозможно, ноисмногими изних— тоже. Ежегодно, посамым скромным оценкам, неучитывающим недоступные для статистики ВОЗ данные многих развивающихся стран, погибает отпневмонии 3,9млн человек, отдиареи— 1,6млн, оттуберкулеза— 1,6млн [1].
Человек живет в постоянном контакте и сложнейшем взаимодействии с неисчислимым множеством микроорганизмов. Жить без микробов невозможно, но и с многими из них — тоже. Ежегодно, по самым скромным оценкам, не учитывающим недоступные для статистики ВОЗ данные многих развивающихся стран, погибает от пневмонии 3,9 млн человек, от диареи — 1,6 млн, от туберкулеза — 1,6 млн [1].
С учетом нарастающей резистентности флоры к антибиотикам, вероятности аллергических и токсических реакций возникает проблема: что применять вместо антибиотиков или в комплексе с ними?
Строение и микробиология фага
Бактериофаги — древнейшие вирусы, наиболее распространенный в биосфере биологический объект. Чистая природная вода содержит в 1 мл 2×108 фагов, на каждую бактериальную единицу приходится не менее 10 фаговых [5, 6].
Длительное время фаги изучали на примере фагов , размножающихся на Escherichia (Е.) coli штамма В. Внедрение и совершенствование электронной микроскопии позволили говорить о разнообразии форм фагов. Принципиально фаг вне зависимости от вида построен из белковой или липопротеиновой оболочки, внутри которой заключены ДНК ( чаще, реже), еще реже 1- или РНК и ферменты. Выделяют головку фага (возможны нитчатая, сферическая, полигональная, плеоморфная формы фага), где и заключены генетическая информация и ферменты, и хвост фага, прикрепляющийся за счет специфических рецепторов на поверхности клетки. Фаг является облигатным внутриклеточным паразитом, он растворяет оболочку клетки, впрыскивает в клетку свой геном. Последний полностью за счет транскриптаз переключает метаболизм клетки, и начинается синтез ДНК или, соответственно, РНК фага, и капсида. За 1–24 ч образуется 100–300 новых фагов. Клетка разрушается, выделившиеся в окружающее пространство фаги инфицируют новые клетки. Экспоненциальное размножение фагов завершается только после уничтожения специфических для них клеток. Во внешней среде фаги способны переживать десятилетия [7].
Принципы выбора терапии бактериофагами
В многочисленных отечественных и зарубежных публикациях продемонстрирована эффективность применения бактериофагов, генетически модифицированных, в лечении поверхностной и системной инфекций [8, 9]. Лечение фагами привлекательно по следующим причинам:
2. Бактериофаги — естественные природные средства. Бактериофаг не может длительно циркулировать в макроорганизме — длительность его жизни лимитирована наличием .
При применении бактериофагов следует учитывать, что специфичность фагов может ограничивать их применение в острых случаях.
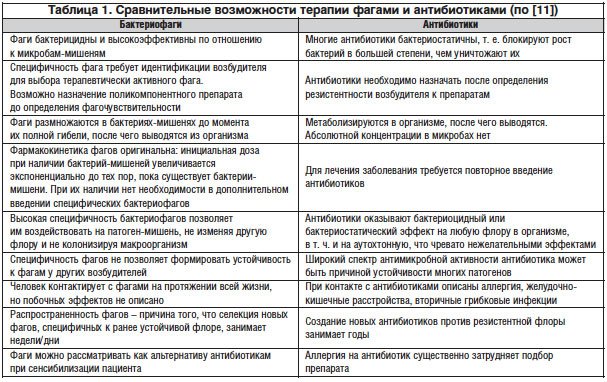
Соотношение бактериофаго- и антибиотикотерапии представлено в таблице 1.
Фаготерапия покровных и барьерных структур тканей
В эксперименте [14, 15] была показана эффективность фагов в лечении кожных инфекций и внутримышечных абсцессов (Pseudomonas (Ps.) aeruginosa, Staphylococcus (S.) aureus). В клинической практике эффективность лечения инфекций ран, инфицированных пострадиационных некрозов была продемонстрирована K. Markoishwili et al. [16] и другими представителями школы грузинского ученого Г. Элиавы.
В нашей стране для наружного применения используют комплексные фаговые препараты. Препарат пиобактериофаг поливалентный (Секстафаг®) для приема внутрь (20 мл 3 р./сут, 7–15 дней), местно или наружно способен лизировать стафило- и стрептококки, патогенные кишечные и синегнойные бактерии (Proteus mirabilis, Proteus vulgaris, Klebsiella pneumoniae). Это позволяет применять его при заболеваниях уха, горла, носа, дыхательных путей, легких и плевры (воспалении пазух носа, среднего уха, ангине, фарингите, ларингите, трахеите, бронхите, пневмонии, плеврите). Секстафаг®, являясь эффективной альтернативой антибиотикам, может также применяться с ними комплексно. Крайне важно, что препарат может применяться при заболеваниях у новорожденных и детей грудного возраста (омфалит, гастроэнтероколит), беременных и рожениц. Все это подчеркивает безопасность препарата.
Гель Отофаг применяют местно в дозировке 1–2 мл: для профилактики рецидивов заболеваний — 2–3 р./сут в течение 7–10 дней, при наличии бактериального воспалительного заболевания — 2–3 р./сут в течение 7–14 дней.
Применение фагов как профилактического, лечебного и противорецидивного средства продемонстрировало свою эффективность в самой частой педиатрической группе: пациенты с инфекционной патологией верхних дыхательных путей (риносинуситы, тонзиллиты, ларингиты, фарингиты). Обычно эти инфекции трактуются как вирусные, хотя достаточно часто причиной бывают и бактерии, или бактериальная флора активируется в процессе манифестации вирусной инфекции.
Подавляющее большинство всех случаев острых заболеваний детей, особенно младшего возраста, вызваны острой респираторной инфекцией (ОРИ). Первичная заболеваемость детей и подростков по г. Москве за колебалась от 1680,2‰ до 1763,6‰3. Заболеваемость болезнями органов дыхания за этот же период составила 1147,4–1188,8‰. Общий экономический ущерб от заболеваний гриппом детей и взрослых в 2008 г. составил 375,2 млрд руб. Заболеваемость ОРВИ детей и подростков до 17 лет в 8,3 раза выше, чем взрослых. Так, при совместных исследованиях с [17] было показано, что на первом году жизни частота эпизодов ОРИ составляет 1535,9:1000, у детей достигает 3796,29:1000. Даже если первоначально заболевание разворачивается как вирусное, то впоследствии часто присоединяется бактериальная флора или активируется собственная, что требует взвешенного решения о выборе препарата или сочетании антибиотиков с иными препаратами, бактериофагами.
Инфекционный ринит дебютирует первоначально, как правило, как вирусный с типичным водянистым или отделяемым. Появление отделяемого, лихорадки, боли в области придаточных пазух говорит о присоединении бактериальной флоры. В качестве профилактики такого развития заболевания можно обсуждать местное применение поливалентного бактериофага.
Присоединение бактериальной инфекции с ее распространением на придаточные пазухи носа приводит к синуситу. Любые нарушения цилиарного клиренса, вентиляции, местного или системного иммунного ответа создают условия для хронизации синусита, вылечить который без воздействия на первоначальные причины невозможно. Признаки синусита:
- сохранение симптомов респираторной инфекции на протяжении 7–10 дней;
- дневной кашель и ринорея;
- заложенность носа;
- нередко низкий субфебрилитет;
- средний отит (у 60–70% больных);
- беспокойство;
- головные боли.
К признакам тяжелого течения синусита или его осложнений относятся гнойная ринорея, лихорадка выше 39ºС и периорбитальный отек. При остром и подостром синусите чаще обнаруживают Streptococcus pneumoniae, реже — Haemophilus (H.) influenzae, Moraxella catarrhalis, Streptococcus pyogenes (β-гемолитический). Хронический синусит чаще полимикробный, вызывается α-гемолитическим стрептококком, S. aureus, коагулазонегативными стафилококками, нетипичными H. influenzae, а также Moraxella catarrhalis и анаэробными бактериями (Peptostreptococcus spp., Prevotella, Bacteroides, Fusobacterium spр.), после многих курсов антибиотиков (или у иммунокомпрометированных пациентов) — Pseudomonads. Эти сведения еще раз заставляют оценить место и роль поливалентных бактериофагов в комплексном лечении синуситов.
При лечении риносинуситов препаратом пиобактериофаг путем его местного введения в пазухи отмечено значительное улучшение, нормализовались показатели завершенности фагоцитоза, что указывало на снижение интенсивности воспаления с восстановлением адекватного иммунного ответа слизистых оболочек носа. Таким образом, препарат пиобактериофаг поливалентный (Секстафаг®) обладает противовоспалительными и иммунорегуляторными свойствами, что проявляется нормализацией показателей местного иммунитета. В то же время применение антибиотиков при лечении больных хроническим гнойным риносинуситом сопровождается сохранением признаков воспаления в виде активации нейтрофильного звена иммунной системы, увеличением внеклеточной пероксидазной активности и угнетением процесса фагоцитоза с нарушением механизмов завершенности в клетках [18]. Пиобактериофаг при местном введении в пазухи улучшает показатели завершенности фагоцитоза, что свидетельствует о снижении интенсивности воспаления с восстановлением адекватного иммунного ответа слизистых оболочек носа [19].
Обострения хронического ларингита сопровождается обсеменением слизистой гортани патогенной микрофлорой. Использование в комплексном лечении таких пациентов специфического бактериофага в виде инстилляций в гортань, а в случае тяжелого обострения — в виде приема внутрь позволяет существенно сократить продолжительность лечения, значительно повышая его качество, достичь более длительной ремиссии болезни и снизить частоту обострений [27].
Эффективность бактериофаготерапии у иммунокомпрометированных пациентов доказана в зарубежных исследованиях [28].
Бактериофаги продемонстрировали эффективность при лечении инфекции, находящейся под биопленкой. Биопленка — плотная колония микроорганизмов на поверхности биологических или небиологических сред, окружающих себя секретируемым экстрацеллюлярным полимером, практически непроницаемым для антибиотиков. Способность бактерий образовывать биопленку — важнейшее условие их выживания на поверхности тканей или медицинских объектов (катетеры, имплантаты). свойства биопленок позволили выдвинуть идею о кооперированных микробных группах как аналогах многоклеточных организмов и социобиологических общностей [29]. Разрушение биопленки возможно при применении фагов [30]. В частности, обработка катетеров перед их постановкой коагулазонегативными фагами резко снижает вероятность образования биопленки Staphylococcus epidermidis [31].
Применение бактериофагов известно также при собственно кишечных инфекциях [32] и при сепсисе, вызванном кишечной инфекцией Ps. aeruginosa [33]. При этом в эксперименте прием бактериофага per os привел к 67% выживаемости в экспериментальной группе животных и к 0% в контрольной.
Особое внимание привлекает возможность бактериофаготерапии при внутренних и системных инфекциях. Большинство таких исследований принадлежит отечественным ученым. Показано, что совместное применение бактериофагов и антибиотиков в лечении детей с осложненной инфекцией мочевыводящих путей значительно эффективней, чем изолированная антибиотикотерапия [34].
[35] пролечено 36 детей в возрасте от 14 дней до 3 лет с тяжелыми заболеваниями бронхолегочной системы с наличием в мокроте синегнойной и кишечной палочек, клебсиеллы, энтерококка, стафилококка, которые, будучи нозокомиальной флорой, в большинстве случаев были нечувствительны к большинству известных антибиотиков. Путем ингаляций вводили моно- или поливалентные бактериофаги, пиобактериофаг. Курс антибактериальной терапии сократился с 13–17 до 8–11 дней. Элиминация возбудителя и уменьшение воспаления в трахеобронхиальном дереве подтверждались контрольным бактериологическим посевом и цитологическим исследованием мокроты: эффективность составила 88,8%. Использование поливалентных фагов явилось более оправданным по сравнению с монофагами на фоне элиминации основного бактериального агента в меньшей мере происходила параллельная контаминация другими, не менее вирулентными, микробами. Таким образом, применение небулайзеротерапии бактериофагами в комплексном лечении острых и хронических обструктивных бронхолегочных заболеваний, включая муковисцидоз, показало высокую клиническую эффективность, позволило сократить сроки лечения дорогостоящими антибиотиками широкого спектра, уменьшить риск развития кандидоза. В эксперименте на животных, моделирующем лечение муковисцидоза, введение бактериофага при тяжелой пневмонии, вызванной Ps. aeruginosa, сопровождалось резким повышением выживаемости в подопытной группе [36].
Есть много нерешенных проблем, которые сводятся к организации многоцентровых исследований по принципам доказательной медицины, соотношению антибиотиков и бактериофагов при лечении.
В любом случае можно утверждать, что это направление перспективно и достаточно обнадеживающе, особенно при инфицировании резистентными штаммами.
Разнообразие лекарственных форм бактериофагов (таблетки, гели, растворы) позволяет применять их как перорально, так и наносить на раневые поверхности, вводить в полости организма. Препараты бактериофагов широко применяются в педиатрии, акушерстве и гинекологии, офтальмологии Например, назначение по поводу кесарева сечения препарата Секстафаг®, предварительно адаптированного к флоре, циркулирующей в конкретном учреждении, приводило к снижению осложнений (18,7%) в большей степени (26,7%), чем в группе женщин, получавших антибиотикопрофилактику.
Заключение
История изучения бактериофагов и анализ их применения в медицине позволяют с уверенностью сказать, что бактериофаги могут оказаться чрезвычайно востребованными в лечении самых разнообразных инфекционных заболеваний человека, особенно при антибиотикорезистентных возбудителях. Каждый препарат, тем более обладающий качествами живого и вводимый в организм человека, имеет свои положительные и вероятностные отрицательные эффекты. В частности, литический эффект фагов, приводящий к разрушению клеточной стенки микроба, сопровождается выбросом в кровь большого количества эндотоксинов, что приводит к эффекту септицемии. Обсуждается необходимость приема активированного угля или иных адсорбентов. Более перспективным направлением кажется генетическая инженерия фага, которая сохраняла бы свой , но фаг был бы . Такой фаг мог бы использоваться в клинической практике как эффективный антимикробный агент, лишенный побочных эффектов [37]. Кроме того, бактериофаги, как и любые другие вирусы, способны переносить гены вирулентности от одной бактерии к другой [38].
В настоящее время в большинстве публикаций указывается на безопасность фаготерапии; хорошо организованные двойные слепые рандомизированные контролируемые исследования позволят определить безопасность и эффективность фагов как альтернативы антибиотикам при инфекциях с полирезистентной флорой [39]. Дальнейшее изучение возможностей бактериофаготерапии будет зависеть от объективной заинтересованности медицинского сообщества, проведения многоцентровых независимых исследований, развития вирусологии с ее возможностями получения новых чистых препаратов фагов.
1 Сборник среднемосковских основных показателей деятельности учреждений Департамента здравоохранения г. Москвы за М., 2009. 87 с.
2 Выбор инфекционного агента для опытов не был случайным: отец был известным микробиологом, написавшим монографию о сибиреязвенной палочке, переведенную и на немецкий язык.
3 Департамент здравоохранения г. Москвы. Доклад о состоянии здоровья населения г. Москвы в 2008 г.
Для цитирования. Костюкевич О.И. Применение бактериофагов в клинической практике: эпоха Возрождения // РМЖ. 2015. № 21. С. 1258–1262.
Предпосылки к применению бактериофагов
На сегодняшний день бактериальные инфекции представляют собой крайне актуальную проблему здравоохранения. И причинами этого являются не только возрастающая антибиотикорезистентность, но и крайне негативные последствия для здоровья нерациональной антибиотикотерапии.
Побочные эффекты антибиотикотерапии
Кроме того, клиницисты в своей практике все чаще сталкиваются с неудовлетворительной переносимостью АБП. Так, частота антибиотико-ассоциированной диареи за последние годы существенно возросла и составляет от 2 до 30% в зависимости от применяемого антибиотика [6]. Все больше пациентов отказываются от приема АБП в связи с развитием побочных эффектов или вследствие боязни (порой вполне обоснованной) кишечных дисбиозов. И все чаще, к сожалению, мы сталкиваемся с нарушением принципов рациональной антибиотикотерапии со стороны самих врачей, что, безусловно, усугубляет ситуацию и с резистентностью к АБП, и с безопасностью антибиотикотерапии.
В этой связи ключевыми задачами являются разработка и внедрение в клиническую практику дополнительных средств борьбы с инфекционными заболеваниями, в качестве которых, несомненно, можно рассматривать бактериофаги.
Бактериофаг (бактерии + греч. phagos – пожирающий; синоним: фаг, бактериальный вирус) – вирус, избирательно поражающий бактерии. Бактериофаги широко распространены в природе, каждый грамм почвы, каждый кубический сантиметр воды и воздуха, продукты питания, растения и животные содержат миллионы фаговых частиц (от 10 до 100 млн). Это древнейшие обитатели планеты, являющиеся естественными ограничителями распространения бактерий.
В 1921 г. Д. Мэйсин и Р. Брайонг впервые описали успешный способ лечения стафилококковых инфекций кожи с помощью стафилококкового фага. До середины ХХ в. на Западе бактериофаги широко изучались и эффективно использовались в качестве лечебного средства против ряда заболеваний, включая дизентерию, тиф, паратиф, холеру и гнойно-септические инфекции.
Однако с момента открытия А. Флемингом в 1928 г. пенициллина началась новая эра борьбы с инфекционными заболеваниями – эра антибиотиков. И бактериофаги, на тот период оказавшиеся менее эффективными, были преданы забвению в западном мире. В СССР же разработки и исследования препаратов бактериофагов не прекращались и активно поддерживались на самом высоком уровне. В 1930-е гг. был создан Институт исследования бактериофагов в Тбилиси, который в 1951 г. вошел в состав группы институтов вакцин и сывороток.
В литературе указывается, что в СССР в 1930–1940 гг. фаготерапия активно использовалась для лечения широкого спектра бактериальных инфекций в области дерматологии (Беридзе, 1938), офтальмологии (Родигина, 1938), урологии (Цулукидзе, 1938), стоматологии (Ручко и Третьяк, 1936), педиатрии (Александрова, 1935; Лурье, 1938), отоларингологии (Ермолиева, 1939) и хирургии (Цулукидзе, 1940, 1941). Эти статьи были опубликованы на русском языке и не были доступны западным ученым. Тем не менее прошлый опыт указывает на высокую эффективность фаготерапии и профилактики.
Клиническое применение препаратов бактериофагов в настоящее время
Фаготерапия с позиций доказательной медицины
За последние 10 лет количество публикаций в ведущих мировых медицинских изданиях, затрагивающих вопросы лечебного и профилактического применения бактериофагов, возросло в несколько раз и превысило уже 3000 (в базе данных PubMed). Количество опубликованных в последнее время работ свидетельствует о возрождении интереса к фаготерапии. Недавно завершившиеся клинические исследования предоставляют убедительные доказательства в отношении безопасности и эффективности фаготерапии у животных и человека [13–15]. Двойная терапия с использованием фагов и антибиотиков приводила к значимо лучшим результатам, чем монотерапия антибиотиками [16]. Показано, что бактериофаги могут быть более эффективными, чем традиционные антибиотики для разрушения бактериальных биопленок [17].
Механизм действия бактериофагов
Антибактериальный эффект бактериофагов обусловлен внедрением генома фага в бактериальную клетку с последующим его размножением и лизисом инфицированной клетки. Вышедшие во внешнюю среду в результате лизиса бактериофаги повторно инфицируют и лизируют уже другие бактериальные клетки, действуя до полного уничтожения патогенных бактерий в очаге воспаления.
Достоинства фаготерапии
Таким образом, на основании накопленных данных можно сформулировать следующие предпосылки к широкому применению препаратов бактериофагов в лечебных и профилактических целях:
1. Эффективность в терапии инфекций, вызванных антибиотикорезистентными бактериями, в т. ч. ИСМП.
2. Возможность применения при аллергических реакциях на АБП.
3. Низкая токсичность, позволяющая считать их самыми безопасными препаратами, что определяет возможность их широкого применения у детей, беременных и кормящих женщин.
4. Высокая специфичность (отсутствие влияния на нормальную микрофлору человека) дает существенное преимущество в лечении любых инфекционных заболеваний у пациентов с различными нарушениями кишечной микрофлоры (в т. ч. с синдромом избыточного бактериального роста (СИБР) и другими дисбиозами), распространенность которых в последние годы значимо возросла.
5. Высокая эффективность в терапии хронических инфекций, особенно ассоциированных с образованием бактериальных биопленок.
6. Возможность применения в виде различных форм: местных аппликаций, жидких и таблетированных; парентеральных.
Ограничения фаготерапии
В то же время бактериофаги в настоящее время в реальной практике применяются намного реже, чем можно было бы ожидать, учитывая большой объем позитивной информации.
Можно выделить следующие причины, ограничивающие применение бактериофагов:
1. Прежде всего это отсутствие нормативно-правовых документов и недостаточная информированность специалистов [21].
2. Есть еще некоторые патогенные для человека бактерии (согласно утвержденному перечню биологических агентов [22]), для которых до сих пор не найдены литические фаги, в т. ч. представители 3-го уровня биобезопасности, такие как Rickettsia, Ehrlichia и Coxiella (возбудители эрлихиоза, эпидемического сыпного тифа, лихорадки Скалистых гор).
3. Выработка антифаговых антител. Проблема иммунного взаимодействия организма человека и фагов пока находится на стадии изучения. Наименьшее количество антител к бактериофагам вырабатывается у новорожденных и грудных детей, что определяет наибольшую эффективность фаготерапии именно в этой группе.
4. Довольно редко, но все же встречаются побочные эффекты употребления фагов, которые обычно связаны с массивным распадом бактериальных клеток с выделением эндотоксина. Справедливости ради надо отметить, что подобные эффекты гораздо более значимы при антибиотикотерапии. Нивелировать данные нежелательные явления в большинстве случаев можно при помощи энтеросорбентов.
Принципы рациональной фаготерапии
Необходимо отметить, что применение бактериофагов, как и любых АБП, должно основываться на рациональных принципах.
1. Предварительное определение чувствительности бактерий к препарату и литической активности бактериофагов в лаборатории.
Все бактериофаги можно разделить на умеренные и вирулентные (или литические).
А. Умеренные бактериофаги включают свой генетический материал в хромосомы бактерий и размножаются синхронно с клеткой хозяина, долгое время не вызывая лизиса. Умеренные бактериофаги играют существенную роль в эволюции бактерий, способствуя приобретению возбудителями дополнительных факторов вирулентности и антибиотикорезистентности. В настоящее время доказано, что множество факторов вирулентности у патогенных бактерий закодировано именно с помощью профаговых генов.
Б. Вирулентные фаги всегда приводят к разрушению бактерий (литический эффект) и высвобождению зрелых фаговых частиц, поражающих новые бактериальные клетки.
В связи с этим бактериофаги, применяемые для лечения инфекционных заболеваний, должны быть исключительно вирулентными, т. е. приводить к гибели бактерий. Литическая активность назначаемых для лечения препаратов бактериофагов обязательно должна быть предварительно проверена в лаборатории.
2. Выбор системы доставки играет ключевую роль в успешной фаготерапии.
Последние достижения в области фаготерапии показывают, что местная (адресная) доставка была более успешной для локализованной инфекции, в то время как для системных инфекций рекомендован парентеральный путь введения [23]. При использовании пероральных форм препаратов необходимо учитывать чувствительность фагов к действию соляной кислоты желудка и в этом случае отдавать предпочтение доставке в кислотоустойчивой оболочке.
Применение бактериофагов при заболеваниях ЖКТ
Лечение бактериофагами инфекций ЖКТ обладает существенным преимуществом по сравнению с антибиотиками в отношении влияния на нормальную кишечную микрофлору. Показана эффективность фаготерапии в отношении таких возбудителей инфекций ЖКТ, как энтеропатогенные E. coli [25], S. sonnae, flexneri, Salmonella E, P.vulgaris, mirabilis, S. aureus, P. aeruginosa, Enterococcus и др.
В практике гастроэнтеролога можно выделить 2 основные группы пациентов, которым может быть показана терапия бактериофагами:
1) с острыми бактериальными инфекциями (острый гастроэнтерит, гастроэнтероколит);
2) с различными нарушениями нормальной кишечной микрофлоры (СИБР в тонкой кишке, дисбиоз толстой кишки), встречающимися в той или иной степени у большинства пациентов с заболеваниями ЖКТ.
Фаготерапия острых бактериальных диарей
Лечение острых бактериальных диарей представляет порой значительные сложности из-за низкой эффективности АБП и развития побочных эффектов. Показано, что вследствие влияния антибиотиков на нормальную кишечную микрофлору угнетается механизм природной колонизационной резистентности. Кроме того, известен прямой механизм иммуносупрессивного действия антибиотиков. Все это может привести к длительной персистенции возбудителя острой кишечной инфекции (ОКИ) на фоне антибиотикотерапии [26, 27]. Так, по данным некоторых исследований, у пациентов, получавших АБП в острую фазу сальмонеллеза, достоверно чаще впоследствии встречалось бактериовыделение сальмонелл в сравнении с лицами, получавшими только патогенетическую терапию [28].
Показания к использованию бактериофагов при ОКИ на сегодняшний день можно сформулировать следующим образом:
– в качестве монотерапии – при легких формах ОКИ;
– в сочетании с антибактериальной терапией или последовательно – при среднетяжелых и тяжелых формах ОКИ;
– при бактериовыделении (у реконвалесцентных или транзиторных бактерионосителей);
– в комплексе терапии энтероколитов условно-патогенной и стафилококковой этиологии;
– для коррекции нарушений микробиоценоза кишечника [29].
Обязательным условием фаготерапии является посев кала с определением фаговой чувствительности. В случае неверифицированного возбудителя предпочтение следует отдавать комплексным препаратам бактериофагов (интести-бактериофаг), обладающим широким спектром действия в отношении возбудителей основных кишечных инфекций.
Перспективы применения бактериофагов
Мы стоим на пороге "Эпохи Возрождения" бактериофаготерапии, которая открывает новые перспективы в лечении антибиотикорезистентной микрофлоры, а также имеет хороший профиль безопасности. В России уже сегодня фаготерапия с успехом применяется при широком спектре заболеваний, и, безусловно, оправдывает себя при различных нарушениях кишечной микрофлоры. Прицельное действие препаратов позволяет сохранить тонкую грань баланса нормофлоры, что крайне важно для наших пациентов.
Валентин Викторович Власов — академик РАН, доктор химических наук, профессор, директор Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Лауреат Государственной премии РФ (1999). Автор и соавтор более 300 научных работ и 20 патентов.
Вера Витальевна Морозова — кандидат биологических наук, старший научный сотрудник лаборатории молекулярной микробиологии Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Автор более 30 научных работ и 6 патентов.
Игорь Викторович Бабкин — кандидат биологических наук, ведущий научный сотрудник лаборатории молекулярной микробиологии Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Автор и соавтор 58 научных работ и 2 патентов.
Нина Викторовна Тикунова — доктор биологических наук, заведующая лабораторией молекулярной микробиологии Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Автор и соавтор 120 научных работ и 21 патента.
Когда в 1930-х гг. группа ученых занялась проблемами функционирования живых систем, то в поиске простейших моделей они обратили внимание на бактериофаги — вирусы бактерий. Ведь среди биологических объектов нет ничего проще, чем бактериофаги, к тому же их можно легко и быстро выращивать и анализировать, а вирусные генетические программы невелики.
Фаг — это минимального размера природная структура, содержащая плотно упакованную генетическую программу (ДНК или РНК), в которой нет ничего лишнего. Эта программа заключена в белковую оболочку, снабженную минимальным набором устройств для ее доставки внутрь бактериальной клетки. Бактериофаги не могут размножаться сами по себе, и в этом смысле их нельзя считать полноценными живыми объектами. Их гены начинают работать только в бактерии, используя имеющиеся в бактериальной клетке биосинтетические системы и запасы молекул, необходимых для синтеза. Однако генетические программы этих вирусов принципиально не отличаются от программ более сложных организмов, поэтому эксперименты с бактериофагами позволили установить основополагающие принципы устройства и работы генома.
В дальнейшем эти знания и разработанные в ходе исследований методы стали фундаментом для развития биологической и медицинской науки, а также широкого спектра биотехнологических приложений.
Бактериофаги — наши друзья, когда речь идет о бактериях, патогенных для человека. Однако есть и другие, дружественные нам бактерии, которые используются в современных биотехнологических производствах, а также в традиционных производствах пищевой промышленности, таких как сыроварение и т. п. В этих случаях фаги могут приносить большой вред, поскольку в больших популяциях микроорганизмов, находящихся в стадии интенсивного роста, создаются благоприятные условия для размножения фагов, что приводит к лизису производственных бактериальных культур. При производстве сыра проблема не столь серьезна, так как при этом обычно применяют закваски, состоящие из многих культур, часть которых выдержит фаговую атаку и продолжит процесс молочнокислого брожения. Серьезные неприятности возникают, если весь процесс основан на применении одного конкретного бактериального штамма, как, например, при производстве антибиотиков или терапевтических белков.
Борцы с патогенами
Первые попытки использовать бактериофаги для лечения инфекционных заболеваний были предприняты практически сразу после их открытия, однако недостаток знаний и несовершенные биотехнологии того времени не позволили достичь полного успеха. Тем не менее дальнейшая клиническая практика показала принципиальную возможность успешного применения бактериофагов при инфекционных заболеваниях желудочно-кишечного тракта, мочеполовой системы, при острых гнойно-септических состояниях больных, для лечения хирургических инфекций и т. д.
По сравнению с антибиотиками бактериофаги имеют ряд преимуществ: они не вызывают побочных эффектов, к тому же строго специфичны для определенных видов бактерий, поэтому при их использовании не нарушается нормальный микробиом человека. Однако такая высокая избирательность создает и проблемы: чтобы успешно лечить пациента, нужно точно знать инфекционный агент и подбирать бактериофаг индивидуально.
Бактериофагами лечат инфекционные болезни не только людей, но и домашних и сельскохозяйственных животных: мастит у коров, колибактериоз и эшерихиоз у телят и свиней, сальмонеллез у кур. Особенно удобно применять фаговые препараты в случае аквакультуры — для лечения промышленно выращиваемых рыб и креветок, так как в воде они долго сохраняются. Бактериофаги помогают защитить и растения, хотя применение фаговых технологий в этом случае затруднено из-за воздействия природных факторов, таких как солнечный свет и дождь, губительных для вирусов.
Фаги могут сыграть большую роль в поддержании микробиологической безопасности продуктов питания, так как применение антибиотиков и химических агентов в пищевой отрасли не решает эту проблему, одновременно снижая уровень экологической чистоты продукции. О серьезности самой проблемы говорят статистические данные: например, в США и России ежегодно регистрируется до 40 тыс. заболевших сальмонеллезом, из которых 1% умирает. Распространение этой инфекции в значительной степени связано с выращиванием, переработкой и потреблением различных видов птицы, и попытки применить для борьбы с ней бактериофаги дали многообещающие результаты.
Так, американская компания Intralytix производит фаговые препараты для борьбы с листериозом, сальмонеллезом и бактериальным загрязнением кишечной палочкой. Они разрешены к применению как добавки, предотвращающие размножение бактерий на продуктах питания — их распыляют на продукты из мяса и домашней птицы, а также на овощи и фрукты. Эксперименты показали, что коктейль из бактериофагов может быть успешно применен и при транспортировке и реализации живой прудовой рыбы для снижения бактериального загрязнения не только воды, но и самой рыбы.
Очевидным применением бактериофагов является дезинфекция, то есть уничтожение бактерий в тех местах, где их не должно быть: в больницах, на пищевых производствах и т. п. Для этой цели британская компания Fixed-Phage разработала метод фиксации фаговых препаратов на поверхностях, обеспечивающий сохранение биологической активности фагов до трех лет.
Эксперимент американских исследователей А. Херши и М. Чейза с использованием бактериофагов, меченных изотопами серы и фосфора, доказали роль ДНК как основного носителя генетической информации
В качестве объектов для своих исследований М. Дельбрюк и его сотрудники использовали мутантные бактериофаги так называемой Т-серии, поражающие кишечную палочку
Семь дней творения
Современные методы синтетической биологии позволяют не только вносить различные модификации в фаговые геномы, но и создавать полностью искусственные активные фаги. Технологически это несложно, нужно только синтезировать фаговый геном и ввести его в бактериальную клетку, а там он уже сам запустит все процессы, необходимые для синтеза белков и сборки новых фаговых частиц. В современных лабораториях на эту работу уйдет всего несколько дней.
Генетические модификации применяют, чтобы изменить специфичность фагов и повысить эффективность их терапевтического действия. Для этого наиболее агрессивные фаги снабжают узнающими структурами, связывающими их с целевыми бактериями. Также в вирусные геномы дополнительно встраивают гены, кодирующие токсические для бактерий белки, нарушающие метаболизм, — такие фаги более смертоносны для бактерий.
Универсальный способ защиты бактерий от всех внешних воздействий — так называемые биофильмы, пленки из ДНК, полисахаридов и белков, которые бактерии создают совместными усилиями и куда не проникают ни антибиотики, ни терапевтические белки. Такие биопленки — головная боль врачей, так как они способствуют разрушению зубной эмали, образуются на поверхности имплантов, катетеров, искусственных суставов, а также в дыхательных путях, на поверхности кожи и т. п. Для борьбы с биофильмами были сконструированы особые бактериофаги, содержащие ген, кодирующий специальный литический фермент, разрушающий бактериальные полимеры.
Большое число ферментов, сегодня широко использующихся в молекулярной биологии и генетической инженерии, были открыты в результате исследований бактериофагов.
Фаговые антибиотики
В терапевтических целях фаги необязательно использовать напрямую. За миллионы лет эволюции бактериофаги разработали арсенал специфических белков — инструментов для распознавания целевых микроорганизмов и манипуляций с биополимерами жертвы, на основе которых можно создавать противобактериальные препараты. Наиболее перспективными белками такого типа являются ферменты эндолизины, которые фаги используют для разрушения клеточной стенки при выходе из бактерии. Сами по себе эти вещества являются мощными антибактериальными средствами, нетоксичными для человека. Эффективность и направленность их действия можно повысить, изменив в них адресующие структуры — белки, специфически связывающиеся с определенными бактериями.
Большинство бактерий делятся по устройству клеточной стенки на грамположительные, мембрана которых покрыта очень толстым слоем пептидогликанов, и грамотрицательные, у которых слой пептидогликана расположен между двумя мембранами. Использование природных эндолизинов особенно эффективно в случае грамположительных бактерий (стафилококков, стрептококков и др.), поскольку пептидогликановый слой у них расположен снаружи. Грамотрицательные бактерии (синегнойная палочка, сальмонеллы, кишечная палочка и др.) являются менее доступной мишенью, поскольку ферменту, чтобы добраться до внутреннего пептидогликанового слоя, необходимо проникнуть сквозь внешнюю бактериальную мембрану.
Для преодоления этой проблемы были созданы так называемые артилизины — модифицированные варианты природных эндолизинов, содержащие поликатионные или амфипатические пептиды, которые дестабилизируют внешнюю мембрану и обеспечивают доставку эндолизина непосредственно к пептидогликановому слою. Артилизины обладают высокой бактерицидной активностью и уже показали свою эффективность при лечении отитов у собак (Briers et al., 2014).
Примером модифицированного эндолизина, избирательно действующего на определенные бактерии, является препарат P128 канадской компании GangaGen Inc. Он представляет собой биологически активный фрагмент эндолизина, соединенный с лизостафином — адресующей белковой молекулой, которая связывается с поверхностью клеток стафилококков. Полученный химерный белок обладает высокой активностью против разных штаммов стафилококка, в том числе обладающих множественной лекарственной устойчивостью.
Анализируя размножение фагов в присутствии целевых бактерий, можно количественно определить численность последних. Так как количество фаговых частиц в растворе возрастет пропорционально числу содержавшихся в нем бактериальных клеток, то для оценки численности бактерий достаточно определить титр бактериофага.
Специфичность и чувствительность такой аналитической реакции достаточно высока, а сами процедуры просты в исполнении и не требуют сложного оборудования. Важно, что диагностические системы, основанные на бактериофагах, сигнализируют о наличии именно живого патогена, тогда как другие методы, такие как ПЦР и иммуноаналитические, свидетельствуют лишь о наличии биополимеров, принадлежащих этой бактерии. Такого типа диагностические методы особенно удобны для использования в экологических исследованиях, а также в пищевой индустрии и сельском хозяйстве.
Вероятно, с помощью модифицированных фагов удастся решить и давнюю задачу глобальной важности — разработать дешевые и быстрые методы детекции возбудителей туберкулеза на ранней стадии заболевания. Задача эта очень сложна, поскольку микобактерии, вызывающие туберкулез, отличаются крайне медленным ростом при культивировании в лабораторных условиях. Поэтому диагностика заболевания традиционными методами может затягиваться на срок до нескольких недель.
Фаговая технология позволяет упростить эту задачу. Суть ее в том, что к образцам анализируемой крови добавляют бактериофаг D29, способный поражать широкий спектр микобактерий. Затем бактериофаги отделяют, и образец перемешивают с быстрорастущей непатогенной культурой микобактерий, также чувствительной к этому бактериофагу. Если в крови первоначально имелись микобактерии, которые были инфицированы фагами, то в новой культуре будет также наблюдаться наработка бактериофага. Таким образом можно выявить единичные клетки микобактерий, а сам процесс диагностики с 2–3 недель сокращается до 2–5 дней (Swift & Rees, 2016).
Фаговый дисплей
Из экспериментов Смита последовало два важных вывода: во-первых, используя технологию рекомбинантных ДНК, можно создавать огромные по разнообразию популяции численностью 10 6 –10 14 фаговых частиц, каждая из которых несет на своей поверхности разные варианты белков. Такие популяции назвали комбинаторные фаговые библиотеки. Во-вторых, выделив из популяции конкретный фаг (например, обладающий способностью связываться с определенным белком или органической молекулой), можно этот фаг размножить в бактериальных клетках и получить неограниченное число потомков с заданными свойствами.
Принципиальная схема процедуры биопеннинга — отбора высокоспецифичных рекомбинантных антител к конкретной мишени-антигену из комбинаторной библиотеки фагового дисплея на основе нитчатых бактериофагов. По: (Тикунова, Морозова, 2009)
На сегодня можно выделить два основных направления применения фагового дисплея. Технология на основе пептидов используется для исследования рецепторов и картирования сайтов связывания антител, создания иммуногенов и нановакцин, а также картирования сайтов связывания субстратов у белков-ферментов. Технология на основе белков и белковых доменов — для отбора антител с заданными свойствами, изучения белок-лигандных взаимодействий, скрининга экспрессируемых фрагментов комплементарной ДНК и направленных модификаций белков.
С помощью фагового дисплея можно вносить узнающие группировки во все виды поверхностных вирусных белков, а также в основной белок, формирующий тело бактериофага. Вводя в поверхностные белки пептиды с заданными свойствами, можно получить целый спектр ценных биотехнологических продуктов. Например, если этот пептид будет имитировать белок опасного вируса или бактерии, узнаваемый иммунной системой, то такой модифицированный бактериофаг представляет собой вакцину, которую можно просто, быстро и безопасно наработать.
Одним из важных применений метода фагового дисплея белков является создание фаговых библиотек рекомбинантных антител, где антигенсвязывающие фрагменты иммуноглобулинов расположены на поверхности фаговых частиц fd или М13. Особый интерес представляют библиотеки антител человека, поскольку такие антитела могут быть использованы в терапии без ограничения. В последние годы только на фармацевтическом рынке США продается около полутора десятка терапевтических антител, сконструированных с использованием этого метода.
Так как вирус представляет собой достаточно жесткую конструкцию с определенным соотношением размерностей, это обстоятельство позволяет использовать его для получения пористых наноструктур с известной площадью поверхности и нужным распределением пор в структуре. Как известно, именно площадь поверхности катализатора является критическим параметром, определяющим его эффективность. А существующие на сегодня технологии формирования на поверхности бактериофагов тончайшего слоя металлов и их оксидов позволяют получать катализаторы с чрезвычайно развитой регулярной поверхностью заданной размерности. (Lee et al., 2012).
Нитчатый бактериофаг М13, размножающийся в обычной кишечной палочке (а), может нести на своей поверхности рекомбинантные чужеродные белки, такие как антитела (б) либо пептиды (в). Он также может служить шаблоном для создания наноустройств и наноматериалов, таких как нанокристаллический катализатор с известной площадью поверхности и нужным распределением пор (г)
Путем покрытия нитчатых фагов золотом и двуокисью индия были получены электрохромные материалы — пористые нанопленки, меняющие цвет при изменении электрического поля, способные реагировать на изменение электрического поля в полтора раза быстрее известных аналогов. Подобного рода материалы перспективны для создания энергосберегающих ультратонких экранных устройств (Nam et al., 2012).
На основе комплексов бактериофага М13, двуокиси титана и одностенных углеродных нанотрубок были также созданы материалы для солнечных батарей (Dang et al., 2011).
Последние годы ознаменовались широкими исследованиями бактериофагов, которые находят себе все новые применения не только в терапии, но и в био- и нанотехнологиях. Их очевидным практическим результатом должно стать возникновение нового мощного направления персонализированной медицины, а также создание целого спектра технологий в пищевой промышленности, ветеринарии, сельском хозяйстве и в производстве современных материалов. Мы ждем, что второе столетие исследований бактериофагов принесет не меньше открытий, чем первое.
Литература
1. Бактериофаги: биология и применение / Ред.: Э. Каттер, А. Сулаквелидзе. М.: Научный мир. 2012.
2. Стент Г., Кэлиндар Р. Молекулярная генетика. М.: Мир. 1974. 614 с.
3. Тикунова Н. В., Морозова В. В. Фаговый дисплей на основе нитчатых бактериофагов: применение для отбора рекомбинантных антител // Acta Naturae. 2009. № 3. C. 6–15.
4. Mc Grath S., van Sinderen D. Bacteriophage: Genetics and Molecular Biology. Horizon Scientific Press, 2007.
Читайте также:

