Вирус гриппа каждый год меняется
Обновлено: 19.04.2024
Георгий Александрович Базыкин — кандидат биологических наук, заведующий сектором молекулярной эволюции в Институте проблем передачи информации им. А. А. Харкевича РАН, ведущий научный сотрудник лаборатории эволюционной геномики факультета биоинженерии и биоинформатики МГУ им. М. В. Ломоносова. Занимается изучением различных вопросов биологической эволюции с использованием методов геномики и биоинформатики.
Юрий Эдуардович Стефанов — кандидат биологических наук, научный сотрудник Института молекулярной биологии РАН им. В. А. Энгельгарта и научный консультант студии научного дизайна Visual Science. Область научных интересов — эволюция мобильных генетических элементов, трехмерное компьютерное моделирование вирусных частиц.
В общественном сознании закрепилось довольно легкомысленное отношение к гриппу. Действительно, зачастую его симптомы не тяжелее простудных, да и беспокоит он нас не дольше недели, причем проходит обычно без всякого лечения. Однако история взаимодействий человека и вируса гриппа требует более серьезного подхода к этому патогену. Достаточно вспомнить, что одни из самых страшных пандемий прошлого века были вызваны этим вирусом * . Да и обычный сезонный грипп далеко не безвреден: по оценкам Всемирной организации здравоохранения, ежегодно от него и связанных с ним осложнений умирают сотни тысяч человек (в первую очередь, пожилые люди, младенцы и страдающие хроническими заболеваниями), а в годы тяжелых пандемий — миллионы. По числу унесенных жизней среди инфекционных заболеваний грипп уступает, пожалуй, только ВИЧ. Основная проблема профилактики и лечения гриппа связана с тем, что вирус очень быстро меняется, и каждый год мы имеем дело с его новыми формами, поведение которых далеко не всегда можно предсказать. Очередным шагом на пути к пониманию изменчивости вируса гриппа стал компьютерный анализ последовательностей аминокислот в белках вируса и нуклеотидов в его геноме.
Первая в мире полная достоверная модель вируса гриппа A/H1N1 с атомным разрешением, созданная в рамках проекта Viral Park компании Visual Science при участии Национального центра биотехнологии в Мадриде. Цель проекта — построение научно достоверных 3D-моделей распространенных вирусов человека с максимальной детализацией. Специалисты Visual Science собирают воедино данные огромного количества работ по молекулярной биологии, вирусологии и кристаллографии вирусов, мнения экспертов ведущих научных центров мира и результаты молекулярного моделирования, полученные научным отделом компании. Модель в значительной степени построена на основе данных, опубликованных исследовательскими коллективами под руководством: Хуана Ортина (Испанский национальный центр биотехнологий, Мадрид, Испания), Такеши Нода (Университет Токио, Япония), Роба Ригро (Отдел взаимодействий вируса и клетки, Гренобль, Франция) и Питера Розенталя (Национальный институт медицинских исследований, Лондон, Великобритания). Точное строение генома вируса гриппа удалось смоделировать благодаря сотрудничеству с Хайме Мартин-Бенито (Испанский национальный центр биотехнологий, Мадрид, Испания), группа которого добилась уникальных результатов в описании упаковки вирусного генетического материала. Создатели модели: Иван Константинов (руководитель проекта), Юрий Стефанов (научный консультант), Анастасия Бакулина (ведущий молекулярный моделлер), Дмитрий Щербинин (молекулярный моделлер), Александр Ковалевский (3D-моделлер)
Сегментированный геном
Общая длина генома вируса гриппа составляет приблизительно 13 500 нуклеотидов [2]. Три самых крупных (примерно по 2300 нуклеотидов) его сегмента (PA, PB1 и PB2) кодируют вирусную полимеразу — белок, копирующий РНК и состоящий из трех крупных субъединиц. Четвертый по длине (около 1750 нуклеотидов) сегмент (HA) отвечает за синтез гемагглютинина. Этот белок заякорен в липидной оболочке вируса и отвечает за его проникновение в клетку, связываясь с рецептором на поверхности клеточной мембраны [3]. В зависимости от того, какой именно вариант гемагглютинина несет вирус, связывание может быть более или менее крепким. После этого клетка поглощает вирус, помещая его в мембранный пузырек внутри цитоплазмы. Большинство макромолекулярных комплексов, поглощаемых таким образом, перевариваются клеткой. Однако вирус избегает этой участи: его мембрана сливается с мембраной пузырька, в результате чего ее содержимое оказывается в цитоплазме. В этом процессе гемагглютинин также играет важную роль. Затем геном вируса проникает в ядро, где с него может начать считываться информация.
Сегмент размером около 1550 нуклеотидов (NP) кодирует нуклеопротеин — белок, необходимый вирусу для упаковки РНК. Множество копий такого белка распределяется по каждому из геномных сегментов, связываясь с молекулой нуклеиновой кислоты. В результате фрагменты генома образуют нуклеопротеидные тяжи, сложенные пополам и закрученные в спираль, к каждому из которых прикрепляется своя копия полимеразного комплекса [4].
Сегмент M1/M2 длиной 1000 нуклеотидов, в соответствии со своим названием, кодирует сразу два белка — М1 и М2. Из молекул первого из них образован слой (матрикс), подстилающий вирусную липидную оболочку. Обычно М1 играет ключевую роль в формировании вирусных частиц, поскольку он взаимодействует одновременно с поверхностными белками вируса и внутренними компонентами вирусной частицы. Задача матриксного белка — собрать все составляющие воедино [6]. Белок М2 выполняет роль ионного канала. Он расположен в липидной оболочке вируса и способствует его распаковке в цитоплазме клетки [7].
Последний, самый короткий (из 865 нуклеотидов) сегмент РНК вируса гриппа отвечает за синтез двух белков, которые не попадают в зрелую вирусную частицу. Эти белки называются NS1 и NEP. Первый необходим вирусу, в частности, для того, чтобы блокировать считывание информации с клеточных молекул РНК [8]. Благодаря ему клетке приходится синтезировать преимущественно вирусные белки, оставляя свои собственные нужды. Второй белок, NEP, обеспечивает транспорт новообразованных геномных комплексов вируса из ядра к клеточной мембране, где происходит сборка вирионов [9].
Новые штаммы и поиск реассортаций
Классификация штаммов вируса гриппа основана прежде всего на том, какие именно варианты гемагглютинина и нейраминидазы входят в его состав. Широко известные комбинации букв H и N в сочетании с порядковыми номерами (например, H3N2) как раз и обозначают подтип вируса: гемагглютинин 3, нейраминидаза 2. Таких подтипов десятки, однако человека заражают лишь немногие — обычно те, у которых не слишком большие номера N и H. Наиболее давние хозяева вируса гриппа — птицы, от которых новые штаммы время от времени передаются домашнему скоту и, прямо или опосредованно, людям [10]. Чем более долгий период коэволюции провели вместе патоген и хозяин, тем менее болезненным становится их совместное существование. Птичьи штаммы вируса зачастую оказываются очень опасными после передачи новым хозяевам [11].
Известно, что именно реассортации сегментов РНК привели к возникновению штаммов, которые вызвали пандемии азиатского и гонконгского гриппа в 1957 и 1968 гг., унесшие около 2,5 млн жизней [12]. Возможно, что и испанский грипп начала прошлого века, число жертв которого шло на десятки миллионов, тоже появился в результате такой эволюционной схемы [13].
Подобное исследование можно провести с использованием геномов вируса гриппа, опубликованных в свободном доступе. Избрав в качестве объекта штаммы H3N2, можно составить выборку из 1376 сегментированных геномов, а затем сравнить между собой филогенетические деревья для этих вирусов, построенные в отдельности по каждому из геномных сегментов [15].
В результате такого сравнения оказалось, что число реассортаций примерно сопоставимо для разных сегментов: в ходе эволюции гриппа в популяции человека каждая пара сегментов в недавнем прошлом реассортировала около 50 раз.
Последствия реассортаций
После того как ветви, в которых произошли реассортации, были обнаружены, стало возможным оценить их влияние на накопление в сегментах вирусного генома точечных замен. Для этого можно сравнить время, прошедшее между каждой такой заменой и ближайшей предшествующей ей реассортацией, с тем, которое бы ожидалось из компьютерной модели, если бы реассортации не влияли на замены. Проведенный анализ показал, что по крайней мере в пяти из восьми сегментов генома мутации ускоренно накапливаются после реассортации. Наиболее ярко эффект проявился для нейраминидазы и белка PB1. Ускорение аминокислотных замен после реассортаций вирусных геномов указывает на то, что в такие периоды эволюции вируса гриппа прежде всего происходит адаптация белков к новому генетическому окружению. Из-за того, что вирусные белки взаимодействуют между собой, молекулы из разошедшихся штаммов вынуждены какое-то время изменяться, приспосабливаясь друг к другу.
Интересно, что у нейраминидаз наблюдалось 30 замен, расстояние от которых до ветви, несущей реассортацию, меньше того эволюционного расстояния, на котором мы бы ожидали встретить одну случайную синонимичную замену в гене данного белка. Такой результат свидетельствует о том, что все эти 30 мутаций произошли и закрепились необычайно быстро, и что необходимость быстрой адаптации возникла именно благодаря тому, что соответствующий сегмент генома попал в новое генетическое окружение.
Реассортация — это резкое эволюционное изменение, которое поначалу может снижать общую приспособленность вируса к условиям окружающей среды и к организму-хозяину. Однако иногда оказывается, что из-за такой перетасовки белков из разных штаммов новая форма патогена оказывается более приспособленной, чем штаммы-предшественники, получая возможность эффективнее распространиться [18]. Похоже, что за коррекцию первичного вредного эффекта от реассортации как раз и отвечают быстро закрепляющиеся адаптивные мутации.
Предсказания, полученные только статистическими методами, — путем анализа последовательностей белков и кодирующих их генов, — конечно, не могут иметь стопроцентную точность. Действительно ли взаимодействуют две определенные аминокислоты, можно проверить экспериментально. Однако каждый белок вируса состоит из сотен аминокислот, так что возможны десятки тысяч разных взаимодействий. Постановка такого числа экспериментов практически неосуществимы. Биоинформатический анализ позволяет расставлять приоритеты: выбирать и анализировать только те аминокислоты, которые участвуют во взаимодействиях, экономя время и силы экспериментаторов. Кроме того, такой подход позволяет понять, насколько взаимодействия, приводящие к вредности реассортаций, распространены на уровне всего генома.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект 13-04-02098) и Министерства образования и науки Российской Федерации (проект 11.G34.31.0008).
Литература
1. Steinhauer D. A., Domingo E., Holland J. J. Lack of evidence for proofreading mechanisms associated with an RNA virus polymerase // Gene. 1992. V. 22. № 2. P. 281–288.
2. Teng Q., Hu T., Li X. et al. Complete genome sequence of an H3N2 avian influenza virus isolated from a live poultry market in Eastern China // J. Virol. 2012. V. 86. № 21. P. 11944. DOI: 10.1128/JVI.02082-12.
3. Carr C. M., Kim P. S. A spring-loaded mechanism for the conformational change of influenza hemagglutinin // Cell. 1993. V. 73. № 4. P. 823–832.
4. Arranz R., Coloma R., Chichуn F. J. et al. The structure of native influenza virion ribonucleoproteins // Science. 2012. V. 338. № 6114. P. 1634–1637. DOI: 10.1126/science.1228172.
5. Kamali A., Holodniy M. Influenza treatment and prophylaxis with neuraminidase inhibitors: a review // Infection and Drug Resistance. 2013. № 6. P. 187–198. DOI: 10.2147/IDR.S36601.
6. Nayak D. P., Hui E. K., Barman S. Assembly and budding of influenza virus // Virus Res. 2004. V. 106. № 2. P. 147–165.
7. Lear J. D. Proton conduction through the M2 protein of the influenza A virus; a quantitative, mechanistic analysis of experimental data // FEBS Lett. 2003. V. 552. № 1. P. 17–22.
8. Hale B. G., Randall R. E., Ortнn J. et al. The multifunctional NS1 protein of influenza A viruses // J. Gen. Virol. 2008. V. 89. № 10. P. 2359–2376. DOI: 10.1099/vir.0.2008/004606-0.
9. Robb N. C, Smith M., Vreede F. T. et al. NS2/NEP protein regulates transcription and replication of the influenza virus RNA genome // J. Gen. Virol. 2009. V. 90. № 6. P. 1398–1407. DOI: 10.1099/vir.0.009639-0.
10. El Zowalaty M. E., Bustin S. A., Husseiny M. I. et al. Avian influenza: virology, diagnosis and surveillance // Future Microbiol. 2013. V. 8. № 9. P. 1209–1227. DOI: 10.2217/fmb.13.81.
11. Kaplan B. S., Webby R. J. The avian and mammalian host range of highly pathogenic avian H5N1 influenza // Virus Res. 2013. V. 178. № 1. P. 3–11. DOI: 10.1016/j.virusres.2013.09.004.
12. Kilbourne E. D. Influenza pandemics of the 20th century // Emerg. Infect. Dis. 2006. V. 12. № 1. P. 9–14.
13. Suzuki Y. A phylogenetic approach to detecting reassortments in viruses with segmented genomes // Gene. 2010. V. 464. № 1–2. P. 11–16. DOI: 10.1016/j.gene.2010.05.002.
14. Nagarajan N., Kingsford C. GiRaF: robust, computational identification of influenza reassortments via graph mining // Nucleic Acids Research. 2011. V. 39. № 6. e34. DOI: 10.1093/nar/gkq1232.
15. Neverov A. D., Lezhnina K. V., Kondrashov A. S., Bazykin G. A. Intrasubtype Reassortments Cause Adaptive Amino Acid Replacements in H3N2 Influenza Genes // PLoS Genet. 2014. V. 10. № 1. e1004037. DOI: 10.1371/journal.pgen.1004037
16. Wolf Y. I., Viboud C., Holmes E. C. et al. Long intervals of stasis punctuated by bursts of positive selection in the seasonal evolution of influenza A virus // Biol. Direct. 2006. V. 1. P. 34.
17. Kryazhimskiy S., Dushoff J., Bazykin G. A. et al. Prevalence of epistasis in the evolution of influenza A surface proteins // PLoS Genet. 2011. V. 7. № 2. e1001301. DOI: 10.1371/journal.pgen.1001301.
18. Li K. S., Guan Y., Wang J. et al. Genesis of a highly pathogenic and potentially pandemic H5N1 influenza virus in eastern Asia // Nature. 2004. V. 430. № 6996. P. 209–213.
19. Ferguson N. M., Fraser C., Donnelly C. A. et al. Public health. Public health risk from the avian H5N1 influenza epidemic // Science. 2004. V. 304. № 5673. P. 968–969.
20. Yong E. Influenza: Five questions on H5N1 // Nature. 2012. V. 486. № 7404. P. 456–458. DOI: 10.1038/486456a.
21. Herfst S., Schrauwen E. J., Linster M. et al. Airborne transmission of influenza A/H5N1 virus between ferrets // Science. 2012. V. 336. № 6088. P. 1534–1541. DOI: 10.1126/science.1213362.
22. Imai M., Watanabe T., Hatta M. et al. Experimental adaptation of an influenza H5 HA confers respiratory droplet transmission to a reassortant H5 HA/H1N1 virus in ferrets // Nature. 2012. V. 486. № 7403. P. 420–428. DOI: 10.1038/nature10831.
23. Russell C. A., Fonville J. M., Brown A. E. et al. The potential for respiratory droplet-transmissible A/H5N1 influenza virus to evolve in a mammalian host // Science. 2012. V. 336. № 6088. P. 1541–1547. DOI: 10.1126/science.1222526.

Каждый год осенью и зимой человечество захлестывает новая волна гриппа. Но грипп гриппу рознь! Об этом поговорим в нашей статье.
Всего в природе циркулирует 4 типа вирусов гриппа – A, B, C и D. Для людей наибольший интерес представляют вирусы гриппа A и B. Именно они вызывают сезонные эпидемии болезни.
Вирус гриппа отличается чрезвычайной изменчивостью генома. Больше всего мутациям подвержен вирус гриппа А.
Каждый сезон появляются новые генетические варианты вируса, отличающиеся по своим антигенным характеристикам от предшественников, и имеющийся у нас иммунитет оказывается бесполезен против них.
Чтобы понять, почему борьба с гриппом продолжается десятилетиями и никак не заканчивается, нужно разобраться в структуре вируса гриппа. В особенности нам интересна внешняя мембрана.
На поверхности вирусной частицы находятся главные мишени иммунной системы — белки гемагглютинин (HA) и нейраминидаза (NA). Первый необходим для проникновения в клетку хозяина, а второй — для успешного высвобождения вирусной частицы. И именно эти белки задействованы в мутациях вируса гриппа.
Вариантов изменчивости вируса гриппа может быть два: антигенный дрейф и антигенный шифт.
Антигенный дрейф — это постепенное накопление мутаций за счет ошибок, которые делает вирусная полимераза во время копирования генома. Из-за постепенных небольших изменений в гемагглютинине и нейраминидазе возникают штаммы вируса, настолько отличающиеся от предыдущих вариантов, что наша иммунная система распознает их как новые. Соответственно каждый сезон циркулирует новый штамм гриппа, именно поэтому состав вакцины ежегодно обновляется.
Второй вариант изменчивости - антигенный шифт, куда более серьезный и опасный. Это обмен вариантами гемагглютинина и нейраминидазы между разными вирусами в процессе сборки вирусной частицы.
Учитывая то, что в природе для вируса гриппа А найдено 18 подтипов гемагглютинина и 11 подтипов нейраминидазы, комбинаций может быть довольно много.
Среди людей обнаружены штаммы с комбинациями H1N1 (гемагглютинин подтипа 1 и нейраминидаза подтипа 1), H2N2 и H3N2.
Как может произойти такая мутация? Если одну и ту же клетку заразят два вируса с разными комбинациями, может произойти реассортация — перетасовка вариантов, в результате которой образуется вирус с новой комбинацией подтипов гемагглютинина и нейраминидазы.
Каждый год вирус гриппа меняется, но одно остается неизменным - необходимость ежегодно прививаться от гриппа и соблюдать меры профилактики.

Грипп, коронавирусная инфекция и другие острые респираторные вирусные инфекции (ОРВИ)
Грипп, коронавирусная инфекция и другие острые респираторные вирусные инфекции (ОРВИ) находятся на первом месте по числу ежегодно заболевающих людей
Несмотря на постоянные усилия, направленные на борьбу с возбудителями гриппа, коронавирусной инфекции и других ОРВИ победить их до сих пор не удается.
Ежегодно от осложнений гриппа погибают тысячи человек.
Это связано с тем, что вирусы, прежде всего вирусы гриппа и коронавирусы обладают способностью менять свою структуру и мутировавший вирус, способен поражать человека вновь. Так, переболевший гриппом человек имеет хороший иммунный барьер, но тем не менее новый измененный вирус, способен легко проникать через него, так как иммунитета против этого вида вируса организм пока не выработал.
Для кого наиболее опасна встреча с вирусом?

Особо тяжело переносят инфекцию дети и пожилые люди, для этих возрастных групп очень опасны осложнения, которые могут развиться во время заболевания. Дети болеют более тяжело в связи с тем, что их иммунная система еще не встречалась с данным вирусом, а для пожилых людей, также, как и для людей с хроническими заболеваниями, вирус опасен по причине ослабленной иммунной системы.
Группы риска
Люди старше 60 лет
Люди с хроническими заболеваниями легких (бронхиальная астма, хроническая обструктивная болезнь легких)
Люди с хроническими заболеваниями сердечно-сосудистой системы (врожденные пороки сердца, ишемическая болезнь сердца, сердечная недостаточность)
Работники общественного транспорта, предприятий общественного питания
Каким образом происходит заражение?
Инфекция передается от больного человека здоровому через мельчайшие капельки слюны или слизи, которые выделяются во время чихания, кашля разговора. Возможна и контактная передача.
Симптомы

В зависимости от конкретного вида возбудителя симптомы могут значительно различаться, как по степени выраженности, так и по вариантам сочетания.
Озноб, общее недомогание, слабость головная боль, боли в мышцах
Снижение аппетита, возможны тошнота и рвота
В среднем, болезнь длится около 5 дней. Если температура держится дольше, возможно, возникли осложнения.
Осложнения
Осложнения беременности, развитие патологии плода
Обострение хронических заболеваний
Лечение заболевания проводится под контролем врача, который только после осмотра пациента назначает схему лечения и дает другие рекомендации. Заболевший должен соблюдать постельный режим, полноценно питаться и пить больше жидкости.
Антибиотики
Заболевший человек должен оставаться дома и не создавать угрозу заражения окружающих.
Профилактика

Самым эффективным способом профилактики гриппа является ежегодная вакцинация. Состав вакцины против гриппа меняется ежегодно. Прежде всего, вакцинироваться рекомендуется тем, кто входит в группу риска. Оптимальное время для вакцинации октябрь-ноябрь. Вакцинация детей против гриппа возможна, начиная с 6-месячного возраста.
Вакцины против большинства возбудителей острых респираторных вирусных инфекций не разработаны.
Универсальные меры профилактики
Часто и тщательно мойте руки
Избегайте контактов с кашляющими людьми
Придерживайтесь здорового образа жизни (сон, здоровая пища, физическая активность)
Пейте больше жидкости
Регулярно проветривайте и увлажняйте воздух в помещении, в котором находитесь
Реже бывайте в людных местах
Используйте маску, когда находитесь в транспорте или в людных местах
Избегайте объятий, поцелуев и рукопожатий при встречах
Не трогайте лицо, глаза, нос немытыми руками
При первых признаках вирусной инфекции – обратитесь к врачу!

Обзор
Такие маски в принудительном порядке носили в 1918—1919-х годах, во время крупнейшей пандемии гриппа, по современным подсчетам унесшей до 50 млн. человеческих жизней
Автор
Редакторы

Грипп
Среди наиболее трагических событий первой половины XX века — наряду с двумя мировыми войнами — выделяется пандемия гриппа 1918 года, ставшая не менее смертоносной, чем крупнейшие конфликты между людьми: в течение 18 месяцев около 50 млн. людей погибли от вирусной инфекции.
Гонки с гриппом
Ежегодно гриппом переболевает 5–15% всей мировой популяции. Наибольшему риску подвергаются дети до двух лет, пожилые люди от 65, а также больные астмой, диабетом или хроническими заболеваниями сердца вне зависимости от возраста. В то же время от болезни не застрахован никто — как показала пандемия 2009-го, когда больше всего пострадали как раз молодые люди с превосходной иммунной системой [4].
Гриппозный зоопарк
Это эстафета, которую ученые и органы здравоохранения уже так долго и с переменным успехом стараются прервать.

Ловец вирусов

— Что является самым главным в экологии вируса гриппа?
— Что еще мы узнали после встречи с птичьим гриппом?
— Болеют ли дикие птицы — природные носители вируса — гриппом?
— Как грипп передается между дикими птицами?
— Это неизвестно. Один из способов это выяснить — исследование природных очагов гриппа. Яркий пример, который наблюдаем мы с коллегами — залив Делавэр на востоке США. Птицы побережья во время сезонной миграции на север в мае останавливаются там, чтобы покормиться яйцами мечехвостов. По-видимому, в этом месте собирается критическая масса птиц, многие из которых еще не являются носителями гриппа, — что и становится определяющим фактором, позволяющим инфекции быстро распространяться. Есть и другие подобные места — в Австралии, Канаде, в других регионах. Потенциально подходит любое место массового скопления и кормления этой водной братии.
— Сколько разновидностей вируса гриппа циркулирует в природе?
— Над чем вы сейчас работаете?
Это исследование, в высшей степени ориентированное на практику. Используя наши диагностические методы, можно будет оперативно объявлять о появлении новых штаммов вируса и проводить грамотные кампании по вакцинации.

Рисунок 3. Во время пандемии поцелуи возможны только с защитой
— До сих пор птичий вирус гриппа H5N1 был не слишком активен, заражая людей. Какова вероятность, что в будущем эта его способность значительно возрастет?
— Вероятность пандемии вируса H5N1 значительно меньше, чем любого из H1, H2 или H3, потому что H5 далеко не так заразен для людей. Но если назвать вирус, который нам хотелось бы видеть пандемичным меньше всего, это будет как раз H5 из-за высокой смертности, причиной которой он становится. Одна из отличительных черт высокопатогенного вируса — молекулярные особенности строения гемагглютинина, позволяющие развиться системной инфекции, а не инфекции только дыхательных путей, как обычно [2]. Такая опасная способность числится только за вирусами H5 и H7.
У H5N1 было десять лет, чтобы переменить хозяина, а значит, это не одна-две и не три-четыре замены, которые должны произойти в нем, чтобы стать патогеном человека, а значительно больше. Есть примеры, когда для перемены хозяина вирусу требуется не одно десятилетие, несмотря на плотный контакт между видами, однако сейчас понятно хотя бы, что H5N1 не может передаться людям легко. Впрочем, совсем исключить эту вероятность нельзя, и если что-то и мешает нам спать спокойно по ночам, — то это вирус H5.
— Что, на ваш взгляд, наиболее удивительно в вирусе гриппа?
— Не устаю удивляться, как мало мы про него знаем, несмотря на то, что так давно и так активно изучаем. Это же сравнительно простые вирусы, — но до сих пор так и не понятно, что позволяет им периодически преодолевать межвидовые барьеры.

Человек
Практически ежегодно, особенно в осенне-зимний период, медики предупреждают о высоком уровне заболеваемости гриппом. Причем с каждым годом названия вирусов меняются. Как появляются новые вирусы гриппа?
Какие бывают вирусы гриппа?
На данный момент специалистами обнаружено 4 типа вирусов гриппа, которые обозначаются буквами A, B, C и D. Каждый тип отличается уникальными особенностями, на основе чего ему и была присвоена отдельная категория.
Вирус гриппа А
Вирус А – наиболее распространенный и чаще остальных вызывает вспышки, эпидемии, пандемии. Для него характерна высокая изменчивость и, соответственно, быстрое распространение. Источником гриппа А считаются водоплавающие птицы, от которых по цепочке заболевание может передаться и человеку. Подразделяется на множество серотипов (подтипов). Среди них наиболее известными являются H1N1 (испанский, свиной грипп), H5N1 (птичий грипп).
Вирусы гриппа B, C и D
Вирус гриппа B тоже изменчив, но не настолько интенсивно. Эпидемии возникают реже – примерно каждые 4-6 лет. Вирус очень похож на А, поэтому иногда их трудно различить. Нередко данные вирусы активизируются одновременно. C и D считаются неопасными для людей. Вирус гриппа С более стабильный, чем предыдущие и может вызывать только легкие инфекции. D и вовсе не вызывает заболеваний у людей.
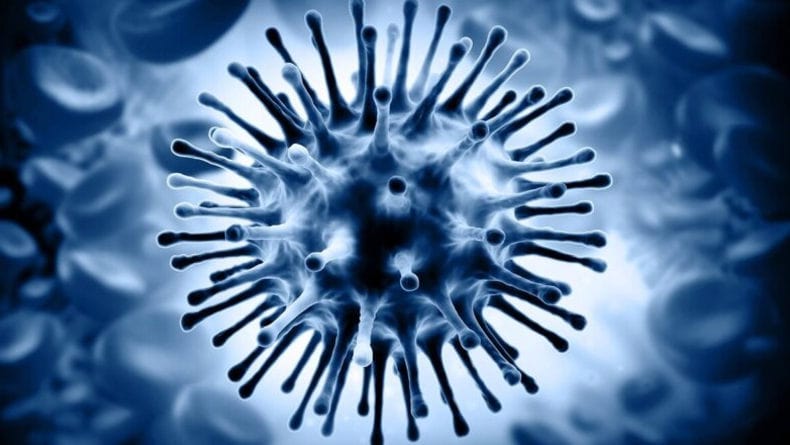
Вирусы гриппа
Все четыре типа вируса гриппа объединяет то, что они относятся к одному семейству – ортомиксовирусов. Это вирусы, которые содержат РНК – рибонуклеиновую кислоту. Она отвечает за гены, их кодирование, прочтение, регуляцию и выражение.
Интересный факт: впервые вирус гриппа обнаружили в 1901 году у кур (Италия). Однако тогда еще не знали о существовании такого заболевания, как грипп, поэтому его отнесли к птичьей чуме. Правильно оценить вирус гриппа ученые смогли только через 50 лет.
Как появляются новые вирусы гриппа?
Ежегодное появление новых типов вируса гриппа обусловлено их высокой изменчивостью. Чтобы понять происхождение данного свойства, нужно иметь представление о структуре вируса и его действии. Инфекционной частью является вирион шарообразной формы. Внутри него содержатся особые белки под названием нейраминидаза и гемагглютинин.

Структура вириона
Эти белки являются основной причиной изменчивости вируса, а также его быстрого распространения. Когда вирус попадает в организм, он начинает атаковать его клетки. При этом он сперва прикрепляется к клетке, а затем проникает внутрь. Гемагглютинин необходим для проникновения внутрь клетки, а нейраминидаза позволяет вирусу покинуть зараженную клетку.
Также внутри вириона располагается геном вируса, который содержит его генетическую информацию в виде РНК. Зачастую заражение одним вирусом может сопровождаться возникновением и другого. Например, А и B часто атакуют организм одновременно. При этом если в клетке организма содержатся два похожих вируса вместе, они способны обмениваться между собой генетической информацией. Так образуются новые подтипы вирусов гриппа. А этот процесс называется антигенным сдвигом или шифтом. Новый подтип вируса заполучает общие для двух исходных вирусов свойства.
Интересный факт: специалисты разделяют два явления – антигенную изменчивость и дрейф антигенов. Если в первом случае образование нового вируса происходит очень быстро, то второй вариант подразумевает медленную и постепенную мутацию. Она неизбежно происходит со всеми вирусами гриппа, поэтому невозможно изобрести эффективную вакцину либо выработать иммунитет.
Специалисты в области медицины стараются предусмотреть возникновение эпидемий гриппа заранее. Для этого они тщательно изучают все случаи заражения каким-либо вирусом гриппа, анализируют собранные материалы и работают над созданием эффективных вакцин. В случае ощущения первых признаков заболевания важно не заниматься самолечением, а обращаться за помощью к квалифицированному врачу.
Регулярное появление новых вирусов гриппа обусловлено их структурой и свойствами. Инфекционная часть вируса – это вирион. Внутри него содержится геном РНК с генетической информацией и белки – гемагглютинин и нейраминидаза. С их помощью вирус проникает в клетки организма, а также выходит из них. Благодаря этому вирус гриппа очень быстро распространяется, а также отличается изменчивостью. Когда в клетке оказываются два похожих вируса, например, А и B, они обретают способность обмениваться генами. Так образуются новые вирусы, и их разнообразие практически не ограничено. Поэтому организм не может выработать стойкий иммунитет.
Если Вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Читайте также:

