Вирус иммунодефицита человека рнк или днк
Обновлено: 22.04.2024
Инфекция вируса иммунодефицита человека (ВИЧ): диагностика, лечение, профилактика
Вирус иммунодефицита человека (ВИЧ) — сферический оболочечный РНК-ретровирус, образующий при помощи обратной транскриптазы ДНК-копию вирусной РНК. Последняя встраивается в ядро клетки хозяина и служит шаблоном для производства последующих вирусных РНК. Для репликации возбудителя необходимы три гена: gag, pol и env. ВИЧ определяют как лентивирус.
Патогенными для человека считают ВИЧ-1 (наиболее распространённый) и ВИЧ-2 (регистрируют в основном на территории Западной Африки), которому свойственна меньшая вирулентность.
Эпидемиология ВИЧ-инфекции. ВИЧ-инфекция распространена во всём мире. Передача вируса осуществляется парентеральным и половым путём. В группу риска входят пациенты, ведущие беспорядочную половую жизнь (особенно при наличии изъязвлений на слизистой оболочке половых органов). В развитых странах чаще всего жертвами ВИЧ становятся мужчины (гомосексуалисты и наркоманы).
Передачу вируса между гетеросексуальными партнёрами встречают реже. В развивающихся странах ВИЧ обычно распространяется при гетеросексуальных связях, переливании неисследованной заражённой крови и использовании инфицированного медицинского инструментария. Возможна передача инфекции от матери к плоду.
Патогенез инфекции вируса иммунодефицита человека. Сначала вирус поражает клетки, обладающие СD4-рецепторами (например, Т-лимфоциты, макрофаги). Затем следует репликация, приводящая к сокращению количества здоровых Т-лимфоцитов и снижению клеточного иммунитета. Различные штаммы вируса имеют разное сродство к клеткам с различными хемокиновыми рецепторами.
При снижении Т-клеточного иммунитета также уменьшается активность В-лимфоцитов. Кроме того, ВИЧ поражает нейроны, стимулирует выделение большого количества цитокинов, способствующих дальнейшему повреждению нервной системы. Большинство клинических признаков при ВИЧ-инфекции связано со вторичными инфекционными заболеваниями, возникающими вследствие снижения иммунитета (уменьшение СD4-клеток).
Клинические признаки инфекции вируса иммунодефицита человека. Через несколько недель после заражения возникает мононуклеозоподобный синдром, сопровождающийся появлением сыпи, лихорадки и лимфаденопатии. Затем следует латентный период, который может продолжаться 10—15 лет.
ВИЧ-инфекция
Диагностика инфекции вируса иммунодефицита человека. Диагноз ВИЧ-инфекции подтверждают двумя серологическими методами: ИФА и постановкой иммуноблоттинга (вестерн-блоттинга), направленных на определение специфических антител. РНК вируса определяют с помощью ПЦР.
При обследовании пациенты с подозрением на ВИЧ должны получать исчерпывающую консультацию врача. Поскольку сероконверсия может продолжаться в течение 3 мес, при первоначальном отрицательном результате необходимо провести повторный анализ.
Лечение необходимо сопровождать регулярным измерением вирусной нагрузки. Вирус может расти в лимфоцитах, но это не используют в диагностических целях.
Лечение инфекции вируса иммунодефицита человека
Для лечения ВИЧ-инфекции применяют:
• нуклеозидные ингибиторы обратной транскриптазы (например, зидовудин);
• ненуклеозидные ингибиторы обратной транскриптазы (например, невирапин);
• ингибиторы протеаз (например, индинавир). Основные три направления лечения:
• торможение вирусной репликации;
• предупреждение появления устойчивых форм;
• повышение иммунитета пациента.
Терапию начинают проводить пациентам с выраженными симптомами, при развитии заболеваний, вызванных условно-патогенной микрофлорой, а также при снижении количества клеток с CD4-рецепторами ниже 0,2x10 9 /л. При показателях выше 0,2x10 9 /л и ниже 0,35x10 9 /л необходимо тщательно продумать тактику лечения (с учётом риска развития побочных эффектов и состояния пациента).
Существуют разнообразные режимы лечения ВИЧ-инфекции. На начальном этапе обычно применяют:
• ненуклеозидный ингибитор обратной транскриптазы + два препарата из группы нуклеозидных ингибиторов обратной транскриптазы;
• ингибитор протеазы + нуклеозидный ингибитор обратной транскриптазы.
При заражении устойчивыми штаммами слудует соблюдать осторожность и применять нестандартные методы, основанные на индивидуальном подходе. В связи с тем что РНК-вирусы не имеют достаточно эффективных генетических механизмов коррекции, мутации, приводящие к образованию устойчивых штаммов, происходят достаточно быстро.
В начале лечения происходит повышение иммунитета, поэтому в связи с усилением иммунного ответа симптомы сопутствующих заболеваний могут усилиться.
Профилактика ВИЧ-инфекции. Для профилактики заражения необходимо избегать половых контактов с лицами, входящими в группу риска, и незащищённых половых связей (без использования барьерной контрацепции). Кроме того, необходимо тщательно исследовать донорскую кровь и уничтожать её образцы, подозрительные на ВИЧ-инфекцию.
Снижению риска заражения среди наркоманов способствуют программы медицинского просвещения и пропаганда использования одноразовых шприцев и игл. К сожалению, разнообразие антигенов вируса делает невозможным создание эффективной вакцины. При случайных проколах кожи медицинскими иглами необходимо проходить профилактический курс антиретровирусной терапии. Риск передачи инфекции от матери к плоду можно снизить с помощью проведения эффективной антиретровирусной терапии, правильно выполненного кесарева сечения и отказа от кормления грудью.
При отсутствии возможности проведения высокоактивной антиретровирусной терапии (в развивающихся странах) лечение проводят коротким курсом для снижения риска передачи инфекции.
У пациентов с ВИЧ-инфекцией развиваются тяжёлые кандидозы кожи и слизистых оболочек, сопровождающиеся изъязвлением слизистой оболочки ротовой полости и поражением пищевода, что приводит к дисфагии и существенной потере массы тела. Для лечения острой инфекции назначают приём внутрь флуконазола, но при длительной терапии часто развивается устойчивость возбудителей. Кроме того, очень серьёзной проблемой считают криптококковый менингит.
Инфекция Toxoplasma gondii у ВИЧ инфицированных. Инфекция персистирует в организме на протяжении длительного времени. Снижение иммунитета приводит к активации возбудителя и развитию различных патологических процессов (объёмные образования головного мозга, сопровождающиеся энцефалитом и др.).
При энцефалите отмечают высокую температуру, головные боли, судороги, неврологические расстройства. Возможно развитие комы. При компьютерной томографии обнаруживают множественные фокальные очаги кольцевидной формы. Исследуемый материал — биоптат мозга. Методы диагностики — культивирование возбудителя, полимеразная цепная реакция. Для лечения энцефалита применяют пириметамин + сульфадиазин. После выздоровления необходимо проведение курса поддерживающей терапии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
ВИЧ. Вирус иммунодефицита человека. СПИД. Эпидемиология вич-инфекции.
Вирус иммунодефицита человека (ВИЧ) — возбудитель своеобразной инфекции, проявляющейся развитием прогрессирующих нарушений иммунного реагирования в результате длительного циркулирования вируса в лимфоцитах, макрофагах и клетках нервной ткани.
Следствие ВИЧ-инфекции — синдром приобретённого иммунодефицита (СПИД). ВИЧ входит в состав подсемейства Lentivirinae семейства Retroviridae. Характерные особенности ретровирусов — уникальное строение генома и наличие обратной транскриптазы (РНК-зависимая ДНК-полимераза). Обратная транскриптаза (или ревертаза) обеспечивает обратную направленность потока генетической информации — не от ДНК к РНК, а наоборот, от РНК к ДНК, в связи с чем семейство и получило своё название 1от англ. retro, обратно].
Геном вич образует две идентичные молекулы однонитевой несегментированной +РНК. Репродуктивный цикл вич уникален, так как при его реализации образуются промежуточные продукты-интермедиаты ДНК.
В настоящее время выделяют два типа вирусов: ВИЧ-1 (HIV-1)— основной возбудитель ВИЧ-инфекции, ВИЧ-2 (HIV-2) — менее вирулентный аналог ВИЧ-I, редко вызывающий типичные проявления СПИДа; его выделяют преимущественно в Западной Африке.
Впервые ВИЧ выделили французский вирусолог Л. Монтаньё (1983) под названием LAV [от англ. tymphoadenopathy associated virus] и американский вирусолог Р. Гэлло (1984) под названием вирус HTLV-III [Т-лимфотропный вирус человека III типа]. После установления идентичности HTLV-III и LAV во избежание путаницы вирусу было присвоено название HIV [англ. human immunedeficiency virus, вирус иммунодефицита человека], или ВИЧ.
Эпидемиология вич-инфекции
ВИЧ-инфекция — типичный антропоноз, у животных воспроизвести заболевание не удаётся. Резервуар вируса вич-инфекции — инфицированный человек. Возбудитель передаётся трансмиссивно.
Основной фактор передачи вич-инфекции — половые контакты (вирус проникает в кровь через повреждения слизистых оболочек). Второй по значимости фактор передачи вируса вич-инфекции — использование одних и тех же игл и шприцев наркоманами.
ВИЧ чувствителен к действию высоких температур (при 56 X инактивируется за 30 мин, при 70-80 °С — через 10 мин), этанола, эфира, ацетона и многих дезинфектантов. В крови и других биологических материалах при комнатной температуре вирус сохраняет жизнеспособность в течение нескольких суток.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Морфология вируса иммунодефицита человека. Антигены вируса иммунодефицита человека.
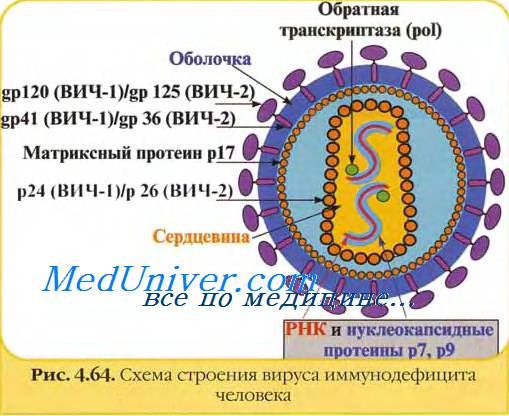
Зрелые вирионы вируса иммунодефицита человека имеют сферическую форму, их размеры не превышают 100-120 им в диаметре. Геном вируса иммунодефицита человека образуют две нити +РНК; их связывают белки рб и р7 (цифра соответствует молекулярному весу в кД).
Капсид вируса иммунодефицита человека образует белок р24. Сердцевина вириона вируса иммунодефицита человека имеет цилиндрическую или конусовидную формы; её формируют белки р18 и р24.
В сердцевине вируса иммунодефицита человека располагаются РНК, внутренние белки (р7 и р9), обратная транскриптаза (димер из белков р66 и p51) и эндонуклсаза (р31). Матричный белок р17 формирует прослойку между сердцевиной вириона и внешней оболочкой.
Суперкапсид вируса иммунодефицита человека образован двойным липидным слоем, который пронизывают гликопротсиновыс шипы. Каждый шип состоит из белков gp41 и gp 120. Гликопротеины gpl20 локализованы в выступающей части шипа и взаимодействуют с молекулами CD4 на мембранах клеток.
Гликопротеины gp41 (белки слияния) вируса иммунодефицита человека располагаются внутри оболочки и обеспечивают её слияние с клеточной мембраной.
Антигенная структура вируса иммунодефицита человека
У вируса иммунодефицита человека главными антигенами выступают группо- и видоспецифичные антигены [сердцевинные (gag-) белки p24; типоспецифичные антигены [оболочечные (env-) белки gp41 и gp120].
В соответствии с их структурой выделяют два типа и более 10 сероваров вируса иммунодефицита человека. Вирус иммунодефицита человека отличается высокой антигенной изменчивостью, и в результате сбоев обратной транскриптазы из организма больного можно выделить серологически различные вирусы.
Главные антигены вируса иммунодефицита человека — поверхностные gp41 и gpl20, a также сердцевинный (ядерный) gp24.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
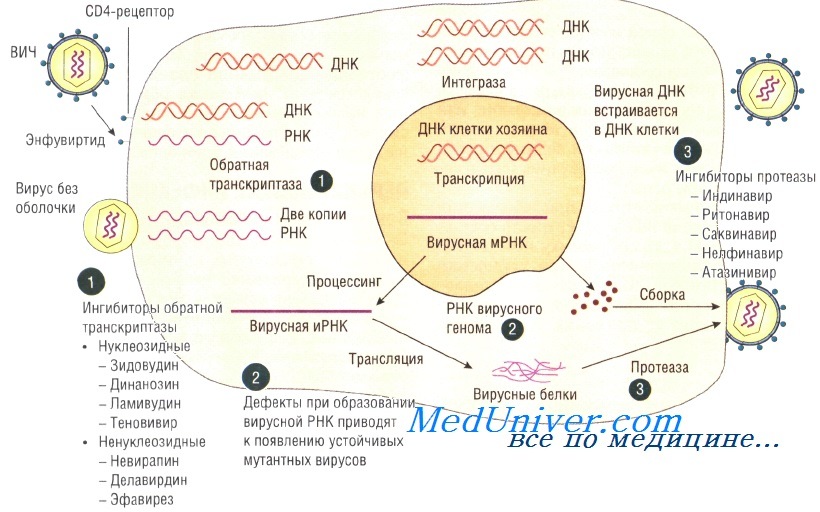
Вирусы могут размножаться только внутри клетки-хозяина, перестраивая ее работу так, что клетка начинает производить новые вирусные частицы. Это серьезно нарушает работу самой клетки и в большинстве случаев ведет к ее гибели. Процесс проникновения и размножения вируса в ней сложный и содержит много стадий, а значит, специальные лекарства могут тормозить его на различных этапах.
В случае с ВИЧ это выглядит так.

по теме

Лечение
Лучшие научпоп-статьи 2018 года
После того как вирусная частица приклеилась к рецепторам CD4 и CCR5/CXCR4 и закрепилась на поверхности клетки, другой специальный белок вируса gp41 соединяет оболочку вируса с мембраной клетки-мишени и помогает вирусу проникнуть внутрь клетки (цифра 2 на схеме). На этом этапе остановить вирус может другая группа препаратов — ингибиторы слияния, например, энфувиртид. Препарат связывается с вирусным белком gp41 и нарушает его работу.

На этом этапе размножение вируса блокирует очень большое количество препаратов из двух классов — нуклеозидные ингибиторы обратной транскриптазы (НИОТ — ламивудин, абакавир, тенофовир) и ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ — эфавиренз, рилпивирин). Принцип действия у веществ из обеих групп похожий: молекула лекарства связывается с обратной транскриптазой вируса, нарушает ее работу и так блокирует перенос генов вируса из РНК в ДНК. Это не позволяет генам вируса встроиться в ДНК клетки-хозяина и начать производство новых вирусных частиц.
На следующем этапе инфицирования (цифра 4 на схеме) готовая вирусная ДНК проникает в ядро и встраивается в ДНК клетки-хозяина с помощью специального вирусного фермента — интегразы. Работу этого фермента блокируют ингибиторы интегразы, например, долутегравир, не позволяя ДНК вируса встроиться в наши гены.
После того как вирусная ДНК встраивается в ДНК клетки-хозяина, клетка получает неправильную программу и начинает производить вирусные белки и РНК, необходимые для сборки новых частиц вируса (цифра 5 на схеме), используя для этого структуры, которые в норме производят собственные белки клетки. Такая перенастройка производства белка сильно нарушает работу клетки и через некоторое время вызывает ее гибель. Лекарств, которые бы влияли на этот этап размножения вируса, нет, так как здесь вирус использует собственные ферментные системы клетки-хозяина и блокирование их работы какими-то веществами навредит здоровым клеткам.
по теме

Лечение
Ошибка системы. Почему в регионах опять не хватает таблеток от ВИЧ
После синтеза вирусных белков клеткой-хозяином в работу вступает еще один фермент вируса — протеаза (цифра 6 на схеме). Дело в том, что белки ВИЧ синтезируются в виде длинных цепочек белков-предшественников, но они неактивные. Протеаза разрезает эти цепочки на более короткие фрагменты, которые становятся активными белками вируса: из одних собирается вирусная оболочка, другие выполняют функции ферментов (обратная транскриптаза, интеграза, протеаза, о которых мы говорили выше). Класс лекарств, нарушающих работу вирусной протеазы, включает большое количество препаратов от достаточно старого лопинавира до современного дарунавира. Основной недостаток препаратов этого класса — высокая степень перекрестной устойчивости: если вирус приобретает устойчивость к одному препарату, скорее всего, на него не подействует ни один другой препарат из этого класса.
На последнем этапе (цифра 7 на схеме) вирусные частицы собираются из готовых компонентов (синтезированных клеткой вирусных белков и РНК), как конструктор, и покидают клетку-хозяина. Лекарств, которые бы тормозили эти процессы, пока не существует.
ВИЧ имеет высокую склонность к мутациям, что позволяет ему быстро приобретать устойчивость к лекарствам. Мутации изменяют форму молекул ферментов вируса. Если при этом форма изменится существенно, то фермент не сможет нормально работать и такой вирус размножаться перестанет — это вредная для вируса мутация. Однако в некоторых случаях — при полезных мутациях — форма молекулы фермента меняется не сильно, а так, что сам фермент продолжает нормально работать, но молекула лекарства уже не может с ним связаться.
Поэтому для эффективного подавления размножения ВИЧ обычно назначают три разных препарата из разных групп, влияющих на разные ферменты вируса, блокируя его воспроизводство на разных этапах. Исключением является группа ингибиторов обратной транскриптазы (НИОТ и ННИОТ) — эти лекарства связываются с разными участками молекулы вирусного фермента, поэтому могут назначаться вместе, несмотря на то, что относятся к одной группе. В условиях такой терапии вирусу очень трудно выработать устойчивость, потому что одновременно должно произойти несколько полезных мутаций в разных генах вируса, а это бывает крайне редко.
Есть несколько перспективных технологий, например, CRISPR/Cas9, которые могут позволить полностью удалить вирусную ДНК из организма человека, но пока ни одна из них не прошла все необходимые исследования для подтверждения эффективности и безопасности. Исследования продолжаются.
Читайте также:

