Вирус монстр что это
Обновлено: 24.04.2024
Они поражают не только невероятными размерами, но и беспрецедентно сложной генетикой. Более того, их происхождение неясно.

Несколько лет назад китайский подводный аппарат опустился в одно из самых таинственных мест на Земле — Бездну Челленджера, это самое дно знаменитой Марианской впадины в Тихом океане. Там на 11-километровой глубине температура близка к нулю, давление примерно 1100 атмосфер, полная темнота и крайняя скудость в смысле питания для живых организмов. И тем не менее это далеко не безжизненное место. Со дна взяли образцы и в них обнаружили множество микроскопических организмов. А некоторые из них весьма странные. Учёные их раньше уже встречали, и накопилось множество вопросов.
В 1976 году в американской Филадельфии была вспышка какой-то необычной пневмонии. Её прозвали "болезнью легионеров", потому что она поразила участников очередного съезда ветеранов боевых действий (Американского легиона). Более двух сотен человек заразились, 34 умерли. Учёные принялись искать возбудителя инфекции. В конце концов нашли: это оказались бактерии, их так и назвали — легионеллами. Но дело в том, что на эти поиски ушло довольно много лет, и в этом долгом процессе исследований однажды — в 1992 году — в числе прочего обнаружили вот такое.
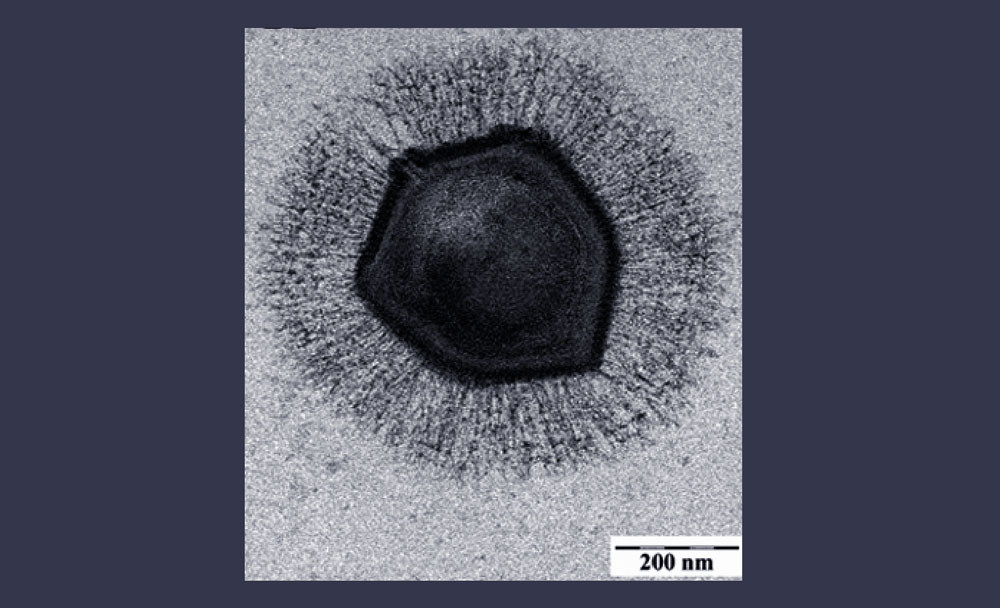
Микробиологи увидели внутри амёбы некий организм в виде многогранника с 20 гранями, такая фигура называется икосаэдром. Покрыт длинными нитями, как волосами. И у него довольно-таки внушительные (в масштабах микромира, конечно) размеры — 500, а то и все 700 нанометров в диаметре. К примеру, у большинства вирусов, для сравнения, диаметр где-то 20, или 50, или 80 нанометров. Поэтому учёные и сказали: это бактерия. Для бактерии такие габариты совершенно нормальны. Даже дали ей название Bradfordcoccus — в честь английского города Брэдфорда, где её и нашли. После этого ещё несколько лет данный образец продержали в холодильнике, а затем его исследовала другая группа учёных. И то, что они обнаружили, если не повергло их в шок, то как минимум изумило: нет, это не бактерия. Бактерии так себя не ведут. У неё жизненный цикл идёт, как у вируса. Это гигантский вирус, который только притворяется микробом. Мимикрирует под микроб. Поэтому он был переименован в мимивирус.
Что о нём удалось выяснить впоследствии. Что это вирус амёб, созданий, которые особым интеллектом не отличаются: они думают, что это бактерия, и проглатывают притворщика. А у него имеется в одном месте небольшая структура, напоминающая звезду. Микробиологи стали называть её звёздными вратами. Так вот, часа через два эти врата открываются и оттуда является вирусная ДНК, то есть молекула-командир, молекула-программа. И ещё спустя пару часов она успешно разворачивает фабрику по производству себе подобных — репликацию. За сутки максимум она собирает штук триста репликантов, и амёба-жертва просто разрывается, это называется лизисом.
И добро бы ещё дело ограничивалось одними амёбами. Но есть исследования о том, что они с таким же успехом могут обитать в человеческих макрофагах, это такие клетки в нашем организме, которые занимаются поеданием в общем-то всего, что нам не нужно: патогенов, остатков разрушенных клеток, токсинов и так далее. Санитары. То есть в нормальной ситуации они съедают нехорошую частицу и просто её переваривают. Но если эта частица способна там обосноваться и организовать производственный процесс, то это уже, знаете ли, интересно получается. И ведь в начале 2000-х в Канаде у нескольких пациентов с воспалением лёгких нашлись антитела против этих мимивирусов. А однажды во Франции лаборант, который их выращивал, подхватил пневмонию. Правда, справедливости ради надо сказать, что совсем не факт, что именно мимивирус к этому причастен. Не установлено.
Далее. Маленький гигант большой репликации производит впечатление не только своими размерами, но и богатым устройством генома: миллион с лишним пар нуклеотидов (строительных блоков ДНК) — примерно в 40 раз больше, чем у того же ковида. Более того, у него много таких белков, которых у других вирусов нет, зато они есть у бактерий, к примеру, или у одноклеточных. А есть такие, которые вообще не похожи ни на один известный белок.
Спрашивается, откуда и зачем столько всего. И это вопрос о, собственно, происхождении мимивирусов. Есть две версии. По одной, это результат "обратной эволюции": сначала он был обыкновенным вирусом, потом развился до уровня бактерии, но через какое-то время передумал и вернулся к вирусному образу жизни. А по другой — он просто насобирал себе этих генов и белков у своих хозяев по мере накопления паразитического опыта. Но, кстати, не исключено, что он не такой уж мерзавец: учёные подозревают, что некоторые из приобретённых способностей он использует в помощь хозяину. То есть это уже по сути симбиоз. Таким образом, оба остаются живы и получают эволюционное преимущество.
Да, вот же что ещё любопытно: на нём самом нашли маленькие вирусы, их назвали Sputnik, то есть это уже его собственный паразит. Вирус вируса!
Наконец, мимивирус снова поднимает давний спор о том, можно ли считать вирусы живыми существами. Появляется новый аргумент в пользу того, что да: на эту мысль наводит происходящее в мимивирусных фабриках. Репликация ДНК, синтез белков — всё это очень напоминает процессы в клеточном ядре.
И ещё один вопрос: почему этим вирусам-гигантам больше нравится на дне Марианской впадины, чем где бы то ни было ещё. Пока в таких количествах, как в жёлобе, их больше нигде не видели.
По словам вирусологов, SARS-Cov-2 сейчас "притирается" к человеческому организму и поэтому будет становиться всё опаснее и опаснее.

Мы уже ознакомились с некоторыми особенностями строения вирусов и механизма их жизнедеятельности, теперь настало время изучать греческий алфавит. В нём 24 буквы. Первые три худо-бедно знают практически все: альфа, бета, гамма. Дальше у большинства людей начинаются проблемы. Четвёртой по счёту идёт дельта. Именно этой буквой обозначили индийский штамм ковида, который в последнее время широко обсуждается и пугает своей способностью уклоняться от антител.
— По всей видимости, клетки, которые заражены дельта-вирусом, не разрушаются, как это происходит со всеми другими штаммами, а он переходит из одной клетки в другую, делает дырку в мембране соседней клетки и образует синцитий (кластер соединённых между собой клеток — Прим. Лайфа), не разрушая саму клетку. Тем самым он защищён от антител клеточной мембраной. То есть образуются громадные клетки под названием синцитий. Из-за этого инфекционный процесс в каждом заражённом укорачивается, и врачи просто не успевают, и иммунная система тоже не успевает защитить своего хозяина за те четыре-пять дней, которые вирус нам отводит, — объяснил в интервью Лайфу глава центра Гамалеи Александр Гинцбург.

Фото © ТАСС / Артем Геодакян
Но дело в том, что на этом наши познания греческого окончательно исчерпываются, а вот эволюция вируса SARS-Cov-2 продолжается. В центре "Вектор" недавно сообщили о появлении гамма-штамма. Это интересно, поскольку согласно алфавиту гамма перед дельтой идёт. И почти одновременно в мире заговорили уже о лямбда-коронавирусе: по данным ВОЗ, он распространился уже в трёх десятках стран. И опять-таки хочется свериться с алфавитом, и, если его внимательно рассмотреть, напрашивается очень простой вывод: значит, коронавирусы "эпсилон", "дзета", "эта", "тета", "йота" и "каппа" уже существуют.
Главный научный сотрудник Института молекулярной биологии имени В.А. Энгельгардта Пётр Чумаков не исключил, что в конце концов 24 букв греческого алфавита для всех будущих штаммов ковида не хватит — и придётся пользоваться каким-то другим. По его словам, разнообразие и скорость появления новых разновидностей CoViD-19 объясняется тем, что коронавирус сейчас обживается в новом для него человеческом организме. Он напомнил, что альфа-коронавирусы уже очень давно циркулируют среди людей и вызывают примерно четверть безобидных простуд, а нынешняя пандемия началась с того, что куда более опасный бета-коронавирус каким-то образом "перепрыгнул" через межвидовой барьер: перешёл от летучих мышей (существ с мощнейшим иммунитетом, кстати) к людям, которым живучесть рукокрылых и не снилась.
— Произошёл первый шаг, "шип" коронавируса приобрёл способность связываться с человеческим АСЕ-2-рецептором. Но слабенько. Он, в принципе, может заразить, но не оптимальным образом. Далее идёт притирание к этому рецептору, накопление мутаций в зоне RBD — в зоне связывания с этим рецептором — и такой вирус начинает ещё сильнее, быстрее проникать в клетку. Одновременно идёт притирание вообще к синтетическому аппарату организма человека, — объясняет известный вирусолог.
По его прогнозу, следующие штаммы будут ещё опаснее.

Фото © ТАСС / Станислав Красильников
— Потом коронавирус достигнет какого-то пика. Когда — трудно предсказать. Может быть, через два или три года. Возникнут такие монстры, которые будут постепенно, понемногу утрачивать свою вирулентность, — предполагает он.
Тревожные прогнозы озвучил и академик Гинцбург. Более того, он подчеркнул, что наука не может заранее знать, как именно этот вирус мутирует в следующий раз и какие новые способности приобретёт.
— В чём он будет становиться "хуже и хуже", в каких именно свойствах, вот это нам предстоит постоянно отслеживать, — сказал он.
Мониторинг новых штаммов CoViD-19 такая же важная часть войны с пандемией, как и вакцинация, отметил Александр Гинцбург.
— Тут как на поле боя: ты, конечно, обладаешь хорошими танками, вооружениями, но, если ты не знаешь, кто против тебя, кто полководец и какие войска где находятся, ты не знаешь 50, а может быть, и 80% информации, которая тебе нужна для победы, — говорит глава центра Гамалеи.
Вирусологи добавили, что, по их твёрдому убеждению, есть только один способ остановить эволюцию SARS-Cov-2.
— Если всё-таки вакцинация пройдёт нормально и привьются если не все, то хотя бы будет иммунная прослойка, которая будет достаточно значимой, то эта инфекция просто затухнет, — уверен главный научный сотрудник Института Энгельгардта Пётр Чумаков.

Вирусы не способны самостоятельно воспроизводиться и не имеют признаков клеточного организма — например, энергетического обмена. Многие исследователи считают, что их нельзя называть живыми организмами. Ведь по сути вирус — это частица, образованная двумя типами биополимеров — нуклеиновыми кислотами и белками. Иногда, правда, присутствуют и липиды.
Большинство вирусов по размеру меньше, чем клетки, и обладают довольно скромным набором генов. Они размножаются, приспосабливая для своих нужд зараженные клетки и используя их ресурсы, а зачастую и убивая. У некоторых вирусов имеются только два гена. Для сравнения: у обычной кишечной палочки Escherichia coli генов более четырех тысяч.

Однако среди вирусов встречаются удивительные создания. Так, в 2003 году в журнале Science была опубликована статья, в которой исследователи сообщили об обнаружении внутри амебы Acanthamoeba polyphaga частиц, напоминающих бактерии, но вместе с тем имеющих вирусную структуру. Они были названы мимивирусами (от англ. mimicking microbe — имитирующие микробы). Это открытие потрясло ученых: мало того что вирусы были гигантскими, они еще и несли в себе больше генов (свыше 2500), чем некоторые микроорганизмы.

Изображение: C.Bickel / Science
Международная группа исследователей, в которую кроме Кунина входили Фредерик Шульц из Объединенного института генома при Министерстве энергетики США и несколько австрийских ученых, проанализировали генетический материал, извлеченный из осадка на станции очистки сточных вод в Клостернойбурге (Австрия), и установили последовательность всей ДНК в образцах, чтобы выяснить, каким организмам принадлежали те или иные фрагменты геномов. Такой метод применяется в тех случаях, когда невозможно изолировать и культивировать в лабораторных условиях сам организм.
Исследователи обнаружили, что некоторые фрагменты ДНК являются вирусными. Когда кусочки были собраны в единый геном, ученые пришли к выводу, что он принадлежит новому гигантскому вирусу, названному Klosneuvirus (KNV). Также были выявлены три родственных ему вируса — Indivirus, Hokovirus и Catovirus. В каждом находился свой набор генов, гомологичных (сходных по нуклеотидной последовательности) генам эукариотических организмов. Это значит, что каждая из четырех найденных разновидностей KNV заражает разных хозяев. Ученые выяснили, что последние относятся к протистам церкозоям (Cercozoa). До этого почти все найденные гигантские вирусы паразитировали на акантамебах.

Геномы гигантских вирусов
Изображение: Frederik Schulz / Department of Energy Joint Genome Institute, Walnut Creek (журнал Science)
Геномный анализ также показал, что KNV занимают промежуточное место между мимивирусами и гигантскими вирусами CroV, которые инфицируют морской жгутиковый организм Cafeteria roenbergensis. Ученые отнесли KNV к семейству Mimiviridae.
Интересно, что у Klosneuvirus имеются гены, осуществляющие процесс трансляции, при котором происходит синтез белков на основе содержащейся в ДНК информации. Так, вирус кодирует 25 различных транспортных РНК (тРНК) и 40 связанных с трансляцией белков. В том числе 19 аминоацил-тРНК-синтетаз (aaRS), которые помогают тРНК встроить правильную аминокислоту в строящуюся последовательность белка. В мимивирусах количество таких ферментов не превышает семи.
Исследователи выяснили происхождение сложного генетического аппарата, связанного с синтезом белков. Оказалось, что большинство aaRS и других белков связано с разнообразными простейшими эукариотами. Это опровергает мнение, что гигантские вирусы могли произойти от таинственных организмов, относящихся к четвертому домену. Более того, они также не происходили от эукариот. Вместо этого вирусы просто постепенно захватывали гены других организмов, становясь такими, какими мы их видим сейчас. Проще говоря, предками гигантских вирусов были более мелкие вирусы.
Тяжелый случай
В 2008 году в педиатрическое отделение при Университете Аристотеля (Греция) поступила десятилетняя девочка с царапиной на локте правой руки. У ребенка в последние три дня держалась высокая температура 40 градусов, и она с трудом могла двигать правой ногой. Врачи диагностировали воспаление правого тазобедренного сустава. Заподозрив бактериальную инфекцию, врачи назначили антибиотик клоксациллин. Тогда они еще не знали, что столкнулись со смертельно опасным противником.
Состояние девочки ухудшалось с каждым часом. Проявились симптомы поражения мозга и серьезные нарушения дыхания из-за проникновения инфекции в легкие. Стало ясно, что клоксациллин не помогает, поэтому было назначено сразу несколько новых антибиотиков. На пятый день рентген показал обширное поражение правой бедренной кости и прилегающей мышечной ткани. Доктора провели дренирование мягких тканей на ноге и выпустили гной, в котором кишели метициллинрезистентные золотистые стафилококки (МРЗС).
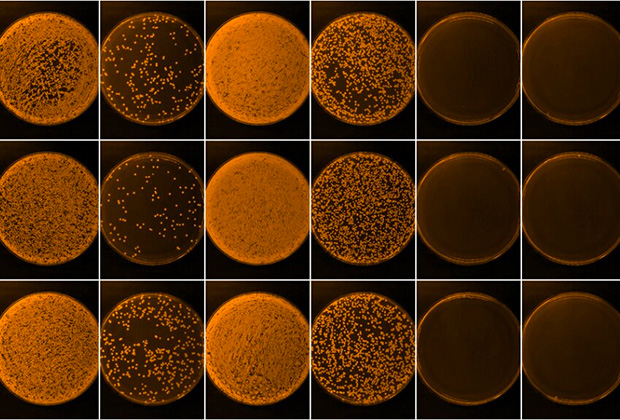
Микробные культуры золотистого стафилококка
Фото: Andrei Papkou
МРЗС обычно связан с внутрибольничными инфекциями. Иными словами, пациенты в больницах, имеющие раны и ослабленный иммунитет, являются основной группой риска. Золотистый стафилококк способен выживать в почти стерильных условиях и распространяется несмотря на дезинфекцию. Но, к сожалению, МРЗС встречается и за пределами больниц, в этом случае он называется бытовым. Именно его подхватила десятилетняя пациентка через обыкновенную царапину. Стафилококк может и не вызвать инфекции, но если организм по какой-то причине ослаблен, последствия могут быть катастрофическими.
Поедающие заживо
Впрочем, некротизирующий фасциит можно предотвратить, если правильно ухаживать за ранами, мыть руки и следить за гигиеной полости рта. При лечении врачи ампутируют пораженные ткани и вводят ударную смесь антибиотиков. Однако даже при правильном и своевременном лечении треть пациентов умирает.
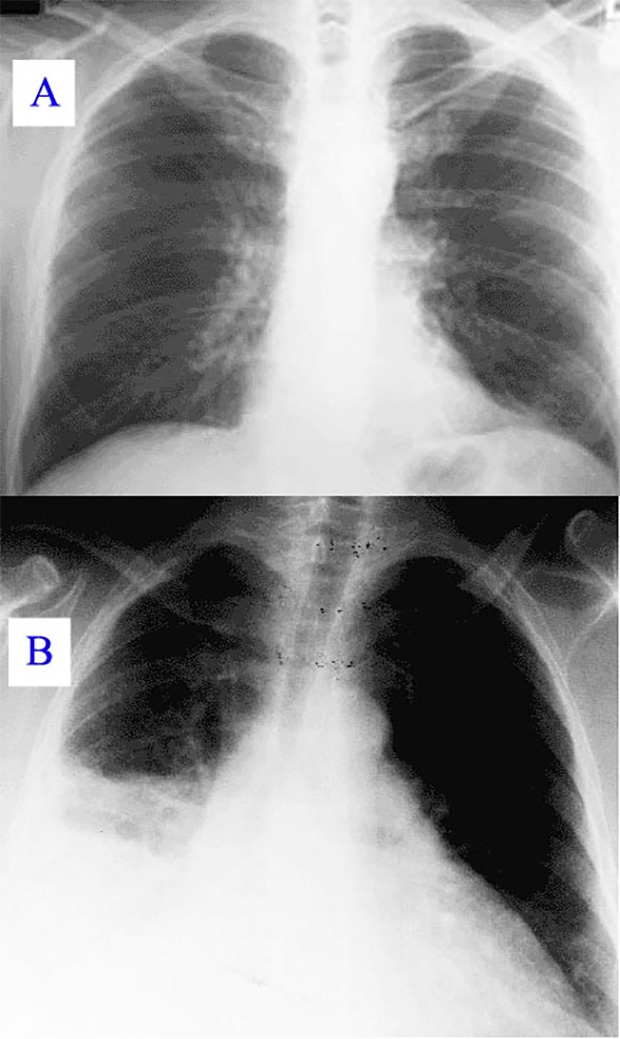
Легкие, пораженные стафилококком
В 2015 году врачи сообщили о крайне необычном случае некротизирующего фасциита, вызванного бытовым стафилококком. Инфекция развивалась молниеносно у пациента с нормальной иммунной системой. Мужчина в возрасте 52 лет поступил в больницу с невыносимой болью в левом бедре и отеком, который держался уже неделю. На коже ноги виднелись гематомы, пузыри, а пораженные участки потеряли чувствительность. Несмотря на агрессивную терапию, хирургическую обработку раны и прием антибиотиков широкого спектра действия больной скончался от сепсиса менее чем через 24 часа после обращения. У мужчины не было никаких травм или предполагаемых контактов с МРЗС, однако он лечился от остеоартроза левого колена периодическими инъекциями стероидов. Последняя инъекция была сделана за три недели до начала симптомов.
МРЗС вызывает не только инфекции мягких тканей. Стафилококк наряду с некротизирующим фасциитом способен провоцировать смертельную некротизирующую пневмонию или внутреннюю гангрену, быстро разрушающую легочные ткани. В большинстве случаев заболевание приводит к летальному исходу, даже несмотря на ударную дозу сильнодействующих антибиотиков, нацеленных против стафилококков. Такая пневмония чаще развивается у детей и молодых взрослых, особенно после вирусной респираторной инфекции, однако поражает и людей старшего возраста.
Опасный вид


Устойчивость к метициллину придает ген mecA, располагающийся в так называемой стафилококковой кассетной хромосоме (SCC, staphylococcal cassette chromosome), которые у разных штаммов имеют разное строение. Бытовые штаммы имеют меньшую и менее сложную версию SCC, специалисты ее обозначают как SCC mecA типа IVa. Она содержит меньше генов, способствующих устойчивости, чем внутрибольничные виды МРЗС, однако включает уникальные гены вирулентности, то есть способности вызывать заболевания или гибель организма. Таким образом бытовые штаммы легче поддаются лечению, но они убивают быстрее, чем те, что атакуют пациентов больниц и клиник. Гены вирулентности производят токсины, представляющие опасность даже для здоровых людей с нормальным иммунитетом. Один из таких токсинов — лейкоцидин Пантона-Валентайна (PVL) — помогает бактерии бороться с клетками иммунитета. Попадание МРЗС, вырабатывающих PVL, в организм человека часто приводит к инфекции мягких тканей, в том числе некротизирующему фасцииту.
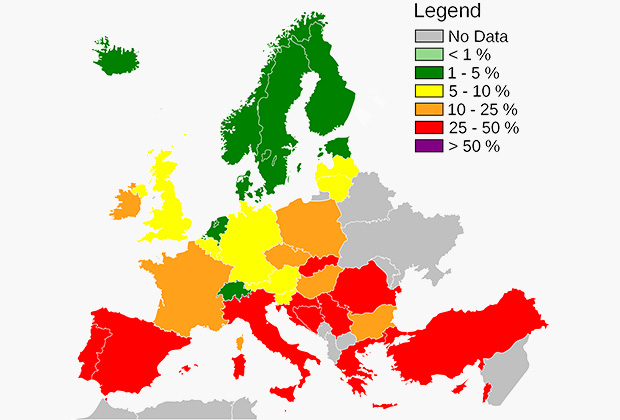
Распространение золотистого стафилококка в Европе
Штамм USA300 прибыл в Северную Америку в первой половине XX века из Европы, где он появился в середине XIX века. Тогда он был менее заразным и не имел многих мутаций, сейчас делающих его смертельно опасным. Роковую роль в создании супермикроба-монстра сыграл заразивший стафилококк вирус — бактериофаг ϕSa2USA, который нес в себе ген, кодирующий PVL. В начале третьего тысячелетия штамм получил широкое распространение в США, а также переселился в Южную Америку, Европу, Африку и Азиатско-Тихоокеанский регион. Считается, что к 2001 году МРЗС колонизировал примерно восемь процентов населения США.
Бой с монстром

Ребенок выздоровел, однако, несмотря на все усилия и гигиенические процедуры, семье не удалось полностью избавиться от МРЗС. Рецидив сначала случился у сына, так как стафилококк поселился у него в организме, иногда проявляясь в виде болезненных нарывов, наполненных гноем. Через некоторое время инфекция перешла и на журналистку. Шах пишет, что хроническая инфекция затихла сама собой, несмотря на всю борьбу с коварными микробами. Тем не менее в запущенных случаях иногда единственным способом остановить заражение остается ампутация конечностей.
Пока МРЗС остается восприимчив к ряду антибиотиков, не принадлежащих бета-лактамам. Однако обнаруживаются новые штаммы, которые проявляют устойчивость и к другим лекарствам. Ситуацию осложняет то, что антибиотики применяют повсеместно и часто неправильно, что только провоцирует размножение бактерий, вызывающих трудноизлечимые или вообще неизлечимые инфекции. При этом антибиотики новых классов изобретаются достаточно редко, а эффективных заменителей, к сожалению, пока не существует.


Прусс: Практически это главное, что мы про него знаем. Недавно вышли очень интересные британские данные про спектр симптомов заболевания, насколько они изменились в сравнении с дельтой. Я должен сказать, что изменились они, по-видимому, не настолько сильно. Да, британцы видят больше больных с больным горлом, их с омикроном около половины, но и с дельтой был каждый третий. Также они видят меньше зараженных с потерей обоняния. Это фиксировалось у трети пациентов с дельтой и осталось у каждого восьмого с омикроном.
То есть для пациентов, которые не испытывают серьезных последствий от ковида, разница симптомов не такая большая.
А вот при тяжелом течении болезни уже есть существенные отличия. Для омикрона больше характерен бронхиолит средних дыхательных путей. А для дельты — более глубинное поражение самих легких, альвеол.
Ясно ли, какая длительность иммунитета после омикрона? Он действует против дельты?
До недавнего времени я рассказывал, что это будет понятно не раньше чем через три месяца. Традиционно считалось, что в первые месяцы после заболевания не всегда просто определить новое это заражение или вспышка старого. Чтобы не ошибиться, отсчитывали 90 дней и только потом выясняли, заразились люди снова или нет.
Сегодня я с большим удовлетворением вижу, что британцы начали смотреть повторное заражение начиная уже с 30-дневного срока. Они, конечно, пока не получили информацию о том, через какое время после омикрона можно заразиться, потому что большинство пациентов еще только-только выздоровели. Но британцы анализируют, насколько у болевших дельтой в осеннюю волну на 30-й день после выздоровления ослабла чувствительность к омикрону.
Теоретически можно предположить, что первые месяц-два, чем бы человек ни переболел, у него сохраняется значительная устойчивость ко всем штаммам, которыми можно заразиться. Иммунная система еще очень активная, в ней много всех активизированных компонентов: и Т-клетки циркулируют, и концентрация антител большая. Реально риски начинаются где-то после третьего месяца после выздоровления, а где-то и больше. Точнее мы об этом узнаем скорее всего в мае.
Омикрон сам по себе менее патогенен или вызывает более легкое течение болезни только у вакцинированных?
И то, и другое — правда. Поначалу это было очень трудно различить, потому что большинство жителей тех стран, по которым омикрон прокатился первым, были или вакцинированы, при этом хорошо, с ревакцинацией, как в Британии, или относительно недавно переболели, как в Южной Африке. По небольшим прослойкам населения, которые все-таки не вакцинированы в Дании и Великобритании
ученые делают вывод, что тяжесть заболевания заметно меньше и для тех, кто ни разу не был вакцинирован. Заметно — это, конечно, не в разы. В зависимости от того, что мы измеряем, — на 30-50 процентов
Хотя статистически установлено, что при омикроне ковид протекает легче, не стоит успокаиваться, это палка о двух концах. Даже уменьшенная в полтора-два раза в группах риска опасность, где она изначально была очень высокой, остается огромной.
В России уровень вакцинации меньше, чем в Европе. Но, мне кажется, найти непереболевших и непривитых уже очень трудно. Многие болели неофициально, поэтому не попали в статистику.
Так случилось в Англии, где трудно было до конца провести анализ, потому что значительная часть населения переболела без официального статуса. В расчетах они пытались применить условные поправочные факторы. Смотрели, у скольких людей нашли антитела к вирусу, больше ли их, чем официально болевших. Но это трудно верно рассчитать.

Фото: Maxim Shemetov / Reuters
Мне все-таки кажется, что именно среди людей пожилых, именно среди тех, кто склонен тяжело переносить ковид, доля болевших, но не имевших подтвержденного диагноза, небольшая. Потому что это гораздо чаще происходит с перенесшими болезнь легко, без дискомфорта, то есть с молодыми.
За счет чего снизились патогенные свойства вируса?
Люди часто думают, что вирусы становятся менее патогенными потому, что они не смогут существовать, убив всех своих носителей. Но никакие штаммы коронавируса не убивали так много людей. С точки зрения общества смертность от ковида очень большая, однако с точки зрения вируса — это не так много, чтобы помешать ему распространяться.
Как вирус изменяет свои свойства? Иммунная система наших организмов учится все лучше и лучше бороться против него. Вирус должен постоянно изменяться, чтобы противостоять давлению иммунитета. Не все изменения проходят вирусу даром. Иногда что-то меняется в белках, это позволяет избежать ему защитной реакции иммунной системы. Но для вируса это тоже вредно, может сделать его менее активным. Именно так произошло с омикроном.
Главное, почему он не проходит в глубину легких, а остается в верхних и средних дыхательных путях, это потому, что в процессе мутирования, чтобы избежать нашей иммунной системы, он утратил один из сайтов расщепления шиповидного белка на поверхности. И в результате больше не может войти в клетки так, как раньше
Но это не сам вирус стал менее патогенен, потому что ему захотелось оставить в живых человечество. Просто наша иммунная система загнала его в такой угол, что у него не осталось другого выхода.
На самом деле и дельта на начальной стадии первых волн резко молодела — гораздо больше заражала людей, которые были младше, чем болевшие до того. К концу волн эта динамика поменялась на противоположную — болело больше пожилых людей. Это связано скорее не с биологией вируса, а с социальными навыками тех, кто первыми или последними подхватывают инфекцию.
Первыми подхватывают вирус те, кто ходит в школу, на всякие гулянки, концерты. Пенсионеры как бы немножко более изолированы, их круг общения уже. А иногда они осторожничают и вообще сокращают его до полного минимума, поэтому к ним поздно приходит инфекция.
Биологический эффект трудно даже оценить, учитывая, что это проявляется на фоне социального аспекта. Перемены наблюдаются в такой стране, как Дания. Там волна омикрона дошла до пика и, возможно, начала спадать. За четыре недели до пика среди зараженных наблюдалось значительное преобладание молодых, особенно 20-24-летних. Но к последней неделе этот эффект начал сходить на нет. Теперь доля омикрона среди пожилых — практически такая же.
Дети стали чаще болеть?
В Дании дети попадали в статистику немного меньше, чем при дельте. Связано ли это с более легким течением болезни, честно говоря, не знаю. Дело в том, что детей тестируют не совсем по тем правилам, по которым тестируют взрослых. Очень многие страны делают программы тестирования в зависимости от уровня инфекции в школах. И получается, что дети охвачены тестированием гораздо шире. Взрослые, чтобы им сделали анализ, должны реально заболеть. А дети — всего лишь находиться в школе, где довольно много заболевших, в этом случае они сразу попадают под обязательное тестирование. Такая программа была и у нас в штате Юта. Сегодня ее отменили по причине того, что болеет столько детей, что тестов уже не хватает на всех.

Фото: Pavel Golovkin / AP
Есть ли вероятность, что омикрон к весне тоже уйдет, как и другие штаммы?
Дельту и омикрон от всех предыдущих штаммов отличает ускоренный жизненный цикл. Это делает более трудным прогноз, исчезнут эти штаммы напрочь или будут возвращаться периодически.
После волн высокой заболеваемости тем или иным штаммом два-три месяца, а то и больше у населения остается нейтрализующий иммунитет. Но постепенно его уровень спадает, и его уже недостаточно, чтобы предохранить людей.
Но буквально за считаные дни после новой инфекции иммунная система вспоминает, что она умеет бороться с этой угрозой, берется за дело и очень быстро останавливает вирус. Однако достаточно ли быстро, чтобы предотвратить новую волну?
Допустим, для альфы или для гаммы реально люди становились заразными на четвертый или на пятый день после инфицирования. К этому сроку иммунная система уже набирала обороты, вирус во внеклеточном пространстве весь инактивировался. И люди, переболевшие даже давно, все равно становились неспособными эффективно распространять эту заразу.
С дельтой было не так. Дельта уже парой волн прокатывалась по России. Хотя организм помнит, как с ней бороться, имеет иммунные клетки памяти, Т-клетки, В-клетки, но те 3-4-5 дней, которые требуются, чтобы на полную скорость раскрутить иммунную реакцию, недостаточны для предотвращения передачи дельты дальше. Жизненный цикл этого вируса быстрее, уже на третьи сутки после инфицирования зараженный человек способен заразить других.
Возможно, то же самое будет характерно и для омикрона. Предполагается, что у него тоже более быстрый жизненный цикл, но точных данных по этому поводу нет.
Пока эпидемия развивается при доминировании какого-то одного штамма. Есть ли опасность, что появятся разные виды вируса, которые будут параллельно ходить в популяции?
В принципе, новой волне подняться на фоне старой волны довольно сложно потому, что у недавно переболевших какое-то время сохраняется иммунитет. Омикрон в какой-то мере является исключением, так как он слишком несхож в иммунологическом плане с другими штаммами, иммунный ответ на него более узок.
Как правило, люди, которые переболели старыми штаммами или вакцинированы, формируют свой иммунный ответ против омикрона из того разнообразия антител, которые у них сформированы. Но в случае омикрона имеющиеся антитела в основном не подходят для решения новой задачи.
Такого биохимического, иммунологического механизма раньше не было. Поэтому есть некоторая вероятность, что будущие варианты вируса смогут изначально избегать нейтрализации. Так что, возможно, прямо на хвосте омикрона придет что-то еще.
Я сейчас внимательно наблюдаю за очень необычной разновидностью омикрона. Формально она считается омикроном, но на практике очень далека от него. Это штамм, который имеет международную номенклатуру ВА.2. Он сейчас очень распространен в Индии, на Филиппинах, в Дании, Швеции
И буквально в ближайшую неделю мы должны узнать, способен ли он распространяться как дополнительная волна на хвосте волны омикрона.

Фото: Kirill Braga / Reuters
Я правильно понимаю, что это преобразованный омикрон?
Месяц или чуть больше назад у них с обычным омикроном (обозначаемым BA.1) были общие предки. Но затем эти две ветки начали развиваться разными эволюционными путями. Штамм ВА.2 отличается от омикрона 20 мутациями. Можно решить, что это омикрон набрал дополнительные 20 мутаций. Но это не так. На самом деле у него нет десяти из мутаций, которые есть у омикрона, зато есть десять других.
Эта новость больше научная или на практике новый омикрон может оказать существенное влияние на пандемию?
Обычный омикрон (BA.1) начал завоевывать целые страны два месяца назад, и постепенно эпидемиологи и иммунологи разобрались в особенностях вызванного им ковида. Массовое распространение BA.2 началось только в последние дни, ясности с этим штаммом меньше.
Однако иммунологи уже предсказывают, что иммунитет у привитых сможет эффективно предотвращать тяжелое течение болезни у зараженных BA.2. И действительно, в Дании, где BA.2 уже преобладает, нагрузка на больницы стабилизировалась. Однако это совсем не означает безоблачную перспективу. Ведь большинство из нас рассчитывают, что волна омикрона закончится спустя считаные недели, и все снова откроется. А BA.2, возможно, удлинит волну, приведет к повторным заболеваниям и существенно замедлит возврат к норме.
С биологической точки зрения возможно ли создать универсальную вакцину от всех штаммов, которая бы обеспечивала длительный иммунитет?
Думаю, что можно. Но опыт показывает, что просто полагаться на широкий иммунитет против шиповидного S-белка вируса, видимо, невозможно. У меня есть своя неподтвержденная гипотеза. Неспроста иммунитет, вызываемый вакцинами или природной заболеваемостью, уходит довольно быстро, количество антител после непродолжительного времени снижается.
Поэтому иммунный ответ, который вызывается одной специфической разновидностью коронавируса, от природы не должен быть слишком долгим. Ведь наш организм ожидает, что придет другая разновидность вируса, против которого предыдущая версия ответа может быть не только неполезна, но даже вредна. Это, конечно, моя гипотеза, и она пока ничем не подтверждена. Но коронавирусы в истории человечества существуют давно, десятки тысяч лет. Ученые находят разнообразные следы эволюции в иммунной системе человека, которые примерно связаны с переселением людей в Восточную Азию, где коронавирусы были эндемичны. Так что не исключено.
Но если для вакцины выбрать другую мишень, не шиповидный белок, то, возможно, удастся найти универсальный ответ. Или выбрать какую-то более узкоспецифическую мишень. То есть такое место в геноме, которое вирус изменить принципиально не может, и оно у всех штаммов единое.
Такие разработки ведутся?
Пока мы идем по линии использования того, что есть. Это, конечно, эффективно, но не идеально. Вряд ли люди будут считать должным ревакцинироваться каждые несколько месяцев. Поэтому на повестке дня будет создание долгосрочных, более универсальных решений. Они точно разрабатываются, но в ближайший год мы этого не увидим.

Фото: Natacha Pisarenko / AP
Частая ревакцинация — с точки зрения биологии, есть ли вред для человека?
Вряд ли это вредно. При очередном столкновении с антигеном у нас не только увеличивается количество антител, но и улучшается их качество, улучшается их сродство, то есть сила связывания с вирусом, которая называется авидностью. Антитела немножко меняются. В Т-клетках, В-клетках происходят небольшие мутации, которые позволяют новым поколениям этих клеток узнавать не только те антигены, которые уже были им знакомы, но даже и родственные.
Определенная польза от этого есть. Но, конечно, эффективность может сходить на нет. Увеличивая количество доз, мы все меньше и меньше будем получать дополнительного эффекта. Особенно это касается векторных вакцин. По мере повторного их применения организм приучается бороться с вектором, на основе которого они сделаны. И тем самым аденовирусу, который используется как вектор, все труднее и труднее будет донести свой груз в виде коронавирусного гена в человеческие клетки, где он будет работать.
До сих пор все самые опасные штаммы коронавируса развивались параллельно — от одного уханьского предка. Почему не было постепенного перехода — от альфы к бете, а потом к дельте? Может быть, постепенная эволюция одного и того же штамма была бы лучше для человечества?
Главный упор в эволюции вируса был сделан на уход от иммунных реакций. Для этого вирусу нужны десятки мутаций. Создать их методом ступенчатой эволюции, одну за другой очень трудно. Поэтому реально оказывалось, что новые важные штаммы, которые вызывали озабоченность ВОЗ, возникали разом из глубинных корней.
Реально не было больших успехов, которые бы опасные штаммы смогли достичь методом постепенной эволюции. Возьмем ту же дельту, которой заболели сотни миллионов людей. В русле дельты постепенно возникли дополнительные, выгодные вирусу мутации, которые, возможно, позволяли ему распространяться быстрее. Но это было очень слабое, инкрементальное, как говорят у нас, изменение степени жизнеспособности вируса. Может быть, это давало пять-десять процентов дополнительной заразности по сравнению с двукратным перевесом, который дельта имела над альфой в самом начале.
Конечно, вирусы эволюционировали, когда было очень много переходов от одного больного к другому, при этом они чуть-чуть продолжали усовершенствоваться.
В свое время я уже был готов поставить точку на коронавирусе. Готов был сказать, что на основе наблюдений за дельтой, за тем, как она приходит круг за кругом, но меняется очень слабо, ступенчато приобретенные мутации дают ей очень копеечный выигрыш, виден конец эволюции вируса
Но с омикроном природа решила поставить нас на место.
Глядя на омикрон, уже нельзя увидеть конец эволюции вируса?
Думаю, что через пару-тройку месяцев мы увидим, насколько у переболевших омикроном сильна остаточная иммунная реакция, насколько долго она тянется, хватит ли ее, чтобы предотвратить новую волну омикрона. Я не берусь судить в долгосрочном плане, но есть надежда, что эффект иммунного обучения нашего организма при встрече с омикроном останется достаточно долгим. Это поможет предотвратить будущие волны, но стопроцентной гарантии нет.
У омикрона есть кое-какие качества, которые заставляют усомниться в таком ответе. Примерно известно, где омикрон выигрывает. Он может входить в клетки некоторых тканей организма через пузырьки эндосом. Считалось, что вирусам трудно так делать. Там очень опасная для вируса среда, там всякие ферменты, которые раскусывают, разгрызают вирусы. Но каким-то образом омикрон научился подавлять эти антивирусные процессы и выходить целехоньким из эндосом. То, что это происходит, достоверно известно, а вот как омикрон это делает — пока непонятно.
От изучения этого специфического процесса будет зависеть наше понимание, что вирусы смогут делать дальше, насколько легко им получить такие необычные изменения, позволяющие эффективно заражать клетки нашего организма. Ведь из-за стремления избежать антител, вся поверхность SARS-CoV-2 уже испорчена. Вирус может себя изменить, чтобы его не узнали, но ему от этого чаще больше вреда, чем пользы. Могу вспомнить русскую пословицу про то, что выбью себе глаз, чтобы у тещи был зять кривой. Наверное, так вирус борется с иммунной системой — что-нибудь портит себе на поверхности, иммунная система из-за этого его не узнает.
Вряд ли вирус умрет, скорее всего станет слабопатогенным. Такое происходит с коронавирусами обычной простуды.
Не может ли на место омикрона прийти еще более опасный новый штамм?
В октябре я бы сказал: да нет, мы уже столько прождали, и ничего опасного не приходило. Но омикрон, конечно, всех удивил, делать прогнозы побаиваюсь. Хотя считаю, что у вируса не должно быть слишком много эффективных решений задачи, как изменить свою поверхность, чтобы она не распознавалась иммунной системой, но при этом хорошо работала.
Читайте также:

