Вирус нестоек к среде
Обновлено: 22.04.2024
Е. Л. Голохваcтова, кандидат медицинских наук Городской центр по профилактике и борьбе со СПИДом, Москва Синдром приобретенного иммунодефицита (СПИД) важнейшая мировая медицинская, социальная и политическая проблема ХХ века. В 1981 г.
Городской центр по профилактике и борьбе со СПИДом, Москва
В настоящее время известны два типа вируса — ВИЧ-1 и ВИЧ-2, различающиеся по своим структурным и антигенным характеристикам. Имеются достоверные различия в течении заболевания, вызываемого этими вирусами. Течение инфекции, вызываемой ВИЧ-2, считается более продолжительным. Среди ВИЧ-1 и ВИЧ-2 выделяют большое число генетически различных групп. Как и все ретровирусы, вирус ВИЧ характеризуется высокой изменчивостью. Считается, что в организме человека по мере прогрессирования инфекции, от бессимптомной до манифестной, происходит эволюция вируса от менее вирулентного к более вирулентному варианту. ВИЧ нестоек во внешней среде, чувствителен к внешним воздействиям, практически полностью инактивируется при нагревании выше 56°С в течение 30 мин, погибает при кипячении через 1-3 мин, а также под воздействием дезинфицирующих средств (3%-ный раствор перекиси водорода, 5%-ный раствор лизола, 70%-ный — этилового спирта). Возможно его сохранение во внешней среде в жидкостях, содержащих вирус в высоких концентрациях, таких как кровь и сперма. Губительны для ВИЧ солнечное и искусственное УФ-излучение, а также все виды ионизирующего излучения. В крови, предназначенной для переливания, вирус живет годы, в замороженной сперме несколько месяцев. Появились данные о том, что ВИЧ теряет активность под воздействием защитных ферментов, содержащихся в слюне и поте. Передачи ВИЧ при укусах кровососущих насекомых не происходит.
ВИЧ-инфекция распространена географически повсеместно. Инфекция ВИЧ-1 — антропоноз. Животные в естественных условиях не заражаются ВИЧ-1. Источником ВИЧ-инфекции является ВИЧ-инфицированный человек на всех стадиях заболевания, как в период бессимптомного вирусоносительства, так и во время развернутых клинических проявлений болезни. Восприимчивость к ВИЧ у людей всеобщая. Причиной невосприимчивости к заражению ВИЧ могут быть специфические иммуноглобулины класса А, обнаруживаемые на слизистых оболочках половых органов.
Пути передачи ВИЧ-инфекции: половой, парентеральный, вертикальный. Половой путь передачи реализуется при гетеросексуальных и гомосексуальных половых контактах. Вероятность заражения повышается при воспалительных заболеваниях половых органов. Парентеральный путь инфицирования встречается в основном среди инъекционных наркоманов. Факторами передачи ВИЧ при этом могут быть общие шприцы и иглы, наркотик, в который добавляется кровь. Инфицирование возможно при переливании зараженной крови, ее препаратов, использовании загрязненных кровью медицинских инструментов, не прошедших соответствующую обработку. Факторами передачи вируса могут быть органы и ткани доноров, используемых для трансплантации. Если женщина заражена ВИЧ, то вероятность инфицирования плода составляет около 50%. Ребенок может инфицироваться до, во время и после родов. Контактно-бытовой и воздушно-капельный пути передачи при ВИЧ-инфекции не встречаются.
ВИЧ-инфекция характеризуется многолетним течением, клинически связанным с прогрессирующим снижением иммунитета и приводящим к развитию тяжелых форм оппортунистических заболеваний. До настоящего времени считалось, что в большинстве случаев ВИЧ-инфекция имеет единственный исход — гибель зараженного ВИЧ организма. Однако теория инфекционного процесса допускает существование как маловирулентных или дефектных штаммов ВИЧ, так и устойчивых к инфекции больных. Среднюю продолжительность жизни инфицированного человека оценивают сейчас в 12 лет, однако продолжительность болезни может быть связана с путями заражения, принадлежностью к различным группам населения, возрастом, расовыми особенностями и доступностью медицинской помощи.
Клиника. После инкубационного периода, продолжительностью от 2 недель до 6 и более месяцев, в 50-70% случаев наступает длящийся от нескольких дней до 2 месяцев период первичных клинических проявлений в виде лихорадочного состояния, которое может сопровождаться увеличением лимфоузлов, стоматитом, пятнистой сыпью, фарингитом, диареей, увеличением селезенки, иногда явлениями энцефалита. Во многих случаях может наблюдаться стертое или малосимптомное начало заболевания, однако у большинства зараженных ВИЧ к 6 месяцам от момента инфицирования появляются антитела к ВИЧ.
Ранние клинические проявления ВИЧ-инфекции, за исключением увеличения лимфоузлов, проходят, и затем в течение нескольких лет у зараженных лиц другие клинические признаки ВИЧ-инфекции не обнаруживаются. В этот период сохраняется активность ВИЧ и происходит медленное снижение количества CD4-клеток. Когда защитные силы организма достаточно ослабевают, у пациента начинают возникать разнообразные оппортунистические заболевания, выраженность которых в дальнейшем нарастает по мере снижения количества CD4-клеток. При значительном снижении количества этих клеток развивающиеся оппортунистические поражения приобретают угрожающий для жизни характер. При отсутствии адекватной терапии больной погибает.
Кроме соматических поражений, у больных ВИЧ-инфекцией развиваются нейропсихические изменения, связанные с известием о заражении вирусом, возникает целая группа стрессов, из-за которых нарушаются или прекращаются социальные и межличностные связи заразившихся, снижается уровень их самооценки, угнетается эмоциональный фон, практически меняется жизнь пациентов. Ни одно инфекционное заболевание до настоящего времени не сопровождалось такой выраженной стигматизацией, как ВИЧ-инфекция. Неблагоприятный прогноз заболевания, особенности передачи возбудителя, молодой возраст заразившихся — все эти факторы усугубляют социально-психологическую ситуацию пациентов. При заражении ВИЧ-2 заболевание прогрессирует несколько медленнее. Своевременно и правильно начатое лечение может на несколько лет увеличить продолжительность жизни инфицированных лиц, а также улучшить качество их жизни.
Течение ВИЧ-инфекции многие исследователи пытались отобразить с помощью клинических классификаций. В нашей стране принята следующая классификация ВИЧ-инфекции (В. И. Покровский, 1989).
I. Стадия инкубации.
II. Стадия первичных проявлений:
А — острая лихорадочная фаза; Б — бессимптомная фаза; В — персистирующая генерализованная лимфоаденопатия.
III. Стадия вторичных заболеваний:
А — потеря массы тела менее 10%, поверхностные грибковые, бактериальные, вирусные поражения кожи и слизистых оболочек, опоясывающий лишай, повторные фарингиты, синуситы;
Б — прогрессирующая потеря массы тела более 10%, необъяснимая диарея или лихорадка более 1 месяца, волосатая лейкоплакия, туберкулез легких, повторные или стойкие бактериальные, грибковые, вирусные, протозойные поражения внутренних органов (без диссеминации) или глубокие поражения кожи и слизистых оболочек, повторный или диссеминированный опоясывающий лишай, локализованная саркома Капоши;
В — генерализованные бактериальные, вирусные, грибковые, протозойные и паразитарные заболевания, пневмоцистная пневмония, кандидоз пищевода, атипичный микобактериоз, внелегочный туберкулез, кахексия, диссеминированная саркома Капоши, поражения ЦНС различной этиологии.
IV. Терминальная стадия.
Выделяют также три иммунологические категории в зависимости от уровня СД4-лимфоцитов:
1) более 0,5 х 109/л СД4-клеток в 1 мм 3 крови; 2) от 0,2 до 0,5 х 109/л в 1 мм 3 ; 3) менее 0,2 х 109/л в 1 мм 3 .
Таким образом, каждый больной может быть отнесен к той или иной категории по клиническим и иммунологическим критериям.
В данной классификации учитываются все проявления болезни от момента заражения до гибели больного, включая и те, которые, возможно, еще неизвестны.
- Нуклеозидные ингибиторы обратной транскриптазы вируса (зидовудин, диданозин, зальцитабин, ставудин, ламивудин, абаковир).
- Ненуклеозидные ингибиторы обратной транскриптазы (ифавиренц, делавирдин, невирапин).
- Ингибиторы протеазы вируса (индинавир, саквинавир, ритонавир, нельфинавир).
Обратная транскриптаза и протеаза — это ферменты вируса, необходимые для его репликации. Соответственно подавление этих ферментов приводит к замедлению размножения ВИЧ. Наиболее эффективной считают комбинацию одного ингибитора протеазы (например, индинавира или ритонавира) и двух нуклеозидных ингибиторов обратной транскриптазы (зидовудина и диданозина, ставудина и диданозина, ставудина и ламивудина, диданозина и ламивудина, зидовудина и зальцитабина, зидовудина и ламивудина). Альтернативой ингибитору протеазы может быть новый ненуклеозидный ингибитор обратной транскриптазы — ифавиренц. Терапия двумя нуклеозидными ингибиторами обратной транскриптазы уступает по эффективности комбинации трех препаратов, а монотерапия любыми антиретровирусными средствами считается неэффективной (за исключением тех случаев, когда альтернативная терапия невозможна, или во время беременности с целью предупреждения перинатальной трансмиссии). Обсуждается возможность одновременного применения трех нуклеозидных ингибиторов обратной транскриптазы, например, абакавира, зидовудина и ламивудина. Однако, по мнению экспертов, в настоящее время все же предпочтительно использование препаратов разных классов. Все антиретровирусные средства следует назначать одновременно в максимальной дозе (исключение составляют ритонавир и невирапин, дозы которых могут быть увеличены). При клинических проявлениях ВИЧ-инфекции антиретровирусная терапия показана всем больным. Необходимо использовать наиболее мощную комбинацию препаратов, обеспечивающих максимальное подавление репликации вируса. Больным СПИД часто приходится назначать не только противовирусные средства, но и препараты для лечения оппортунистических инфекций. В таких случаях необходимо учитывать взаимодействие между ними, а также возможность возникновения сходных нежелательных эффектов. Например, рифампицин, который применяется при лечении активного туберкулеза, снижает уровень ингибиторов протеазы в крови. Последние, в свою очередь, нарушают метаболизм рифампицина. Мощная противовирусная терапия восстанавливает иммунную функцию больного. Усиление иммунологического и/или воспалительного ответа может привести к появлению новых симптомов у больных с субклиническими оппортунистическими инфекциями (например, ЦМВ). Целесообразно продолжить антиретровирусную терапию и провести адекватное лечение оппортунистической инфекции. Иногда по тем или иным причинам приходится прерывать антиретровирусную терапию. Достоверных сведений о том, на сколько дней, недель или месяцев можно без последствий отменить один препарат или всю комбинацию, нет. Если возникает необходимость в прерывании терапии на длительный срок, то теоретически лучше отменить все препараты, чем продолжать терапию одним или двумя антиретровирусными средствами. Такой подход позволяет свести к минимуму риск появления устойчивых штаммов вируса. Зачастую врачи сталкиваются с тем, что выбранная схема терапии не всегда дает достаточный вирусологический и иммунологический эффект, что вынуждает менять лечение. Наиболее важным критерием эффективности терапии является динамика вирусной нагрузки. Подтвержденное клинически значимое повышение концентрации РНК ВИЧ в плазме, которое нельзя объяснить интеркуррентной инфекцией или вакцинацией, указывает на неэффективность лечения (независимо от динамики числа CD4-клеток). При выборе новой схемы лечения необходимо учитывать причины ее изменения. Если терапия давала вирусологический эффект, но вызывала выраженные побочные реакции, то целесообразно отменить препарат, который был причиной нежелательных явлений, и назначить другое средство того же класса, но с иным профилем токсичности и переносимости. Если терапия привела к выраженному подавлению репликации вируса, но является неадекватной с современной точки зрения (например, два нуклеозидных ингибитора обратной транскриптазы или монотерапия), то возникает вопрос: продолжать проводимую терапию или добавить другие средства. Большинство экспертов полагают, что неадекватная терапия в конечном итоге окажется неэффективной, и считают вторую тактику целесообразной. При неэффективности первоначального лечения предпочтительно полностью заменить неадекватную схему. Особое беспокойство вызывает возможность перекрестной устойчивости к различным ингибиторам протеазы. Имеются свидетельства того, что штаммы вируса, которые приобрели резистентность к одному препарату группы, обладают пониженной чувствительностью или устойчивы к большинству или всем ингибиторам протеазы. В связи с этим многие эксперты считают целесообразным включать два ингибитора протеазы в новые схемы лечения. Антиретровирусная терапия у больных острой ВИЧ-инфекцией снижает вирусную нагрузку и благоприятно влияет на иммунную функцию, однако отдаленный клинический эффект подобной терапии изучен недостаточно. Многие эксперты считают целесообразным продолжать лечение неопределенно долгое время, т. к. после прекращения терапии виремия может появиться вновь или возрасти.
В настоящее время существует острая потребность в новых способах лечения, которые были бы эффективны для постоянно растущего числа ВИЧ-инфицированных пациентов, уже леченных вышеупомянутыми препаратами. Получены данные о новом классе противовирусных средств — это ингибитор фузии (препарат Т-20), который применялся в комбинации с традиционными препаратами. В отличие от других препаратов для лечения ВИЧ-инфекции, которые блокируют репликацию однажды попавшего в клетку человека вируса, Т-20 представляет собой пептид, препятствующий проникновению вируса в клетку.

Краснуха - острое вирусное инфекционное заболевание с воздушно-капельным путем передачи.
Возбудитель

РНК - вирус семейства Tagaviridae рода Rubivirus, нестоек во внешней среде.
Источник инфекции
Заболевший краснухой, а также дети с синдромом врожденной краснухи.
Пути передачи
Воздушно-капельный, трансплацентарный (от матери плоду во время беременности).
Группы риска

Особую опасность краснуха представляет для беременных в связи с высоким риском инфицирования плода, влекущее за собой у них множественные пороки развития.
Инкубационный период
Симптомы краснухи появляются спустя 11-21 день с момента инфицирования.
Период заразности
Инфицированный человек становится заразным уже за 4 – 5 дней до появления симптомов. Продолжается период заразности до 5 – 7 дней после появления сыпи (в целом – около двух недель).
У детей с врожденной краснухой вирус может выделяться в течение 8—12 мес и более (до 2 лет) после рождения.
Клиника

- незначительная лихорадка
- мелкая пятнисто-папулезная сыпь, преимущественно на разгибательных поверхностях конечностей, спине и ягодицах
- катаральные явления в горле
- увеличение затылочных лимфоузлов
- боли в суставах (редко).
Инфицирование краснухой во время беременности может привести к развитию внутриутробной инфекции, которая может закончиться потерей беременности или развитием синдрома врожденной краснухи, при котором формируются врожденные дефекты плода, пороки сердца, поражения глаз (катаракта, врожденная глаукома и др.), снижению умственного развития ребёнка, снижению слуха.
Чем опасно заболевание
Инфекция особенно опасна в первом триместре беременности, в связи с вероятностью поражения вирусом эмбриона или плода. Особенно опасно инфицирование в первом триместре беременности.
Диагностика
Диагноз краснухи устанавливается на основании клинической картины, лабораторных данных (определение титра IgM к вирусу краснухи), а также эпидемиологической связи с другими подтвержденными случаями краснухи.
Лечение
Специфического лечения краснухи нет, лечение симптоматическое. Обычно лечение проводится на дому. Исключение - тяжёлое течение заболевания.
Профилактика

Профилактика краснухи - проведение плановой вакцинации в соответствии с Национальным календарем профилактических прививок.
Схема вакцинации детей
Для вакцинации используется как моновакцина, так и трехвалентная (корь, паротит, краснуха).
Вакцинация проводится в 12 месяцев, ревакцинация - в 6 лет.
Вакцинация и ревакцинация против краснухи также проводится детям от 1 года до 18 лет (включительно), женщинам от 18 до 25 лет (включительно), не болевшим, не привитым, привитым однократно против краснухи, не имеющим сведений о прививках против краснухи.
Противопоказания к вакцинации
- тяжелая аллергическая реакция на аминогликозиды
- сильная реакция на предыдущее введение вакцины (температура тела более 40*С, отек и покраснение в месте инъекции более 8 см в диаметре)
- анафилактическая реакция на яичный белок
- иммунодефицитные состояния, злокачественные заболевания крови, новообразования
- беременность
Реакция на введение вакцины
В большинстве случаев прививка против краснухи переносится хорошо, в некоторых случаях спустя 5-12 дней могут появиться незначительные катаральные явления (насморк, кашель), возможно повышение температуры до 38*С. В очень редких случаях возникает немногочисленная сыпь.
Неспецифическая профилактика
Неспецифическая профилактика заключается в исключении контактов с заболевшими краснухой, а также в соблюдении правил личной гигиены.
Корь. Вирус кори. Свойства вируса кори. Эпидемиология кори. Антигены вируса кори.
Корь — острая инфекция, проявляющаяся интоксикацией, катаральными явлениями, своеобразной энантемой и папулёзно-пятнистой сыпью.
Вирус кори — типовой вид рода Morbillivirus [от лат. mоrbilli, корь]. В его состав также включены патогенные для человека вирусы под острого склерозирующего панэнцефалита и рассеянного склероза.
Впервые вирус кори выделили Д. Эндерс и Т. Пиблз (1954). Вирус кори имеет сферическую форму, диаметр— 150-250 нм. Геном вируса кори образован несегментированной однонитевой молекулой -РНК.
С ней ассоциированы нуклеокапсидный белок NP и полимеразные белки Р и L, образующие нуклеокапсид со спиральным типом симметрии вируса кори. Снаружи он окружён матриксным М-белком.
Оболочка вируса кори образована двойным слоем липидов, включающим гликопротеипы Н (гемагглютинин) и F (белок слияния). В культуре клеток вирус кори даёт характерный цитопатический эффект с образованием гигантских клеток и/или синцитиев, либо образует зернистые тельца включений в цитоплазме и ядре.
Эпидемиология кори
Корь распространена повсеместно, а в некоторых странах она эндемична. Резервуар кори — больной человек.
Возбудитель кори передаётся воздушно-капельным путём. Наибольшую эпидемическую опасность больной представляет в продромальный период и период кожных высыпаний. Вирус кори нестоек во внешней среде, чувствителен к инсоляции, высоким температурам и быстро разрушается под действием дезинфектантов и детергентов.
Антигенная структура вируса кори
Основные антигены вируса кори — гемагглютинин, белок F и нуклеокапсидный белок NP. AT к гемагглютинину и F-протеину проявляют цитотоксическое действие, направленное против инфицированных клеток.
Вирус кори имеет общие антигенные детерминанты с прочими морбилливирусами. Антигенная структура вируса кори стабильная. Все известные штаммы принадлежат к одному серологическому варианту.
Видео этиология, патогенез кори
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Диагностика и лечение лихорадки Денге. Лихорадка паппатачи
Распознавание болезни основывается на клинических проявлениях и данных эпиданамнеза. Подтверждение диагноза Денге возможно вирусологическим (выделение вируса из крови в первые 2-3 дня) и серологическим методами (РСК, РТГА, РН).
Этиотропная терапия отсутствует. Интерферон малоэффективен; антибиотики современные в острой стадии болезни неэффективны, но помогают при воспалительных осложнениях Денге. Основными методами лечения являются дезинтоксикационная, антигеморрагическая и симптоматическая терапия. Необходимо назначение анальгетиков (амидопирин, аспирин и др.). При выраженной интоксикации показано внутривенное введение плазмы (свежезамороженной) или плазмозаменителей (20 мл на кг в сутки), преднизолона (100-150 мг в сут). При геморрагиях вводится гепарин (1 мг натриевой соли гепарина на 1 кг массы тела). При выраженном кожном зуде - антигистаминные препараты. Питание больных и питье должны быть адекватными состоянию по объему и составу. Пища должна содержать витамины С и группы В.

Лихорадка паппатачи
Москитная лихорадка, флеботомусная лихорадка, трехдневная лихорадка, солдатская болезнь, легкий грипп, собачья болезнь, болезнь Пика, Phlebotomus fever, Sandely fevor - англ., Phlebotomus Fieber, Pappatasi Fieber - нем., Fievre de trois joures - франц.).
Лихорадка паппатачи - острая арбовирусная болезнь, характеризующаяся кратковременным повышением температуры, сильной головной болью и болью в мышцах, характерной инъекцией склер (с. Пика) и медленным выздоровлением.
Возбудитель - вирус семейства буньявирусов (Bunyaviride), рода Phlebovirus. Из 90 серологических типов вируса 5, а возможно, и более патогенны для человека. К ним относят возбудителей неаполитанской и сицилийской москитных лихорадок, лихорадок Пунта-Торо, Чагрес и Кандиру. Вирус имеет размеры 40-50 нм. Инфицирующая доза для человека 0,001 мл свежей сыворотки больного.
Вирус во внешней среде нестоек, термолабилен, чувствителен к обычным дезинфицирующим средствам. К вирусу восприимчивы многие виды животных: обезьяны, мыши, крысы, собаки, у которых болезнь протекает латентно.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Вирусные тропические лихорадки: диагностика, лечение, профилактика
В роли возбудителей энцефалита и геморрагической лихорадки могут выступать свыше сотни различных вирусов. Практически все они избирают человека в качестве хозяина случайно, при вторжении последнего в их жизненный цикл. Передача осуществляется при прямом контакте с заражённой кровью или физиологическими жидкостями, а также при укусах членистоногих (комаров, клещей и мошек). Некоторые инфекции характеризуются достаточно высокой смертностью пациентов.
Желтая лихорадка. Возбудитель жёлтой лихорадки — оболочечный однонитевой плюс-РНК-вирус. Заражение происходит при укусе комара Aedes aegypti. Жёлтая лихорадка — зоонозная инфекция, при этом человек становится случайным хозяином (джунглевая форма). Вспышки возникают периодически также при проникновении возбудителя в городскую среду (городская форма).
Методы диагностики — культивирование вируса, серологическое исследование. Профилактика — введение живой аттенуированной (ослабленной) вакцины и контроль над распространением переносчиков (комаров).
Лихорадка Денге
Переносчики лихорадки Денге — комары рода Aedes. Возбудитель — флавиви-рус, похожий по своим свойствам на вирус жёлтой лихорадки. Установлено 4 серотипа вируса. Инкубационный период 2—15 дней. При возникновении лихорадки наблюдают виремию, продолжающуюся несколько дней. Вирус лихорадки Денге распространён на территории стран тропической зоны и Ближнего Востока. Эпидемии возникают при появлении нового серотипа либо при массовом попадании неиммунных людей в места обитания вируса; в городах распространяются очень быстро, заболевание протекает тяжело.
После внезапного возникновения жара, головной боли и общего недомогания пациенты начинают жаловаться на боли в суставах и костях. Лихорадка может быть двухволновой. В некоторых случаях отмечают небольшую сыпь. Наиболее тяжёлая и опасная форма заболевания сопровождается геморрагическим синдромом, характеризующимся развитием шока и геморрагического диатеза (геморрагическая форма денге). Смертность 5—10%.
Методы диагностики — серологическое исследование, культивирование вируса, молекулярно-генетические методы. Единственный способ профилактики заболевания — количественный контроль переносчиков. Лечение симптоматическое.
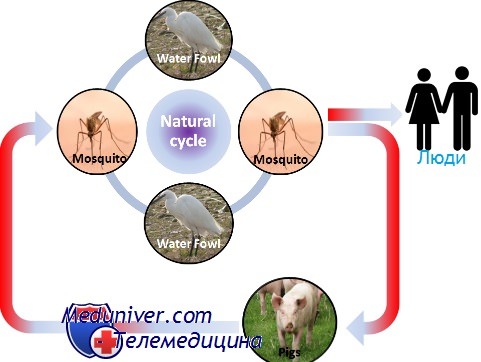
Эпидемиология японского энцефалита
Японский энцефалит В
Возбудитель японского энцефалита В — флавивирус; переносчики — комары. Природным источником вируса являются свиньи. В клинической картине доминируют симптомы тяжёлого энцефалита с высокой летальностью. Болезнь начинается остро с лихорадки, сильной головной боли, тошноты и рвоты.
В некоторых случаях отмечают судороги. При обследовании обнаруживают поражение черепных нервов и пирамидного пути. Для профилактики применяют вакцину.
Вирус лихорадки западного Нила
Заражение вирусом лихорадки западного Нила происходит так же, как при лихорадке Денге и японском энцефалите В. Вирус впервые был обнаружен в Северной Америке в 1999 г. и быстро проник на территорию Канады, Латинской Америки и Карибского бассейна.
Геморрагическая лихорадка Ласса
Ласская лихорадка — тяжёлая геморрагическая лихорадка, вызываемая аренавирусом. Передача инфекции осуществляется посредством контактного механизма от крыс к человеку, а затем и от человека к человеку. Вирус поражает все органы и системы организма. Пациенты жалуются на лихорадку, изъязвления в ротовой полости, мышечную боль и геморрагическую сыпь. Диагноз устанавливают на основании данных клинической картины и анамнеза заражения пациента.
Для его подтверждения применяют молекулярно-генетический метод с использованием обратной транскриптазы или серологические методы. На ранних стадиях заболевания и после контакта с инфицированными людьми назначают рибавирин.
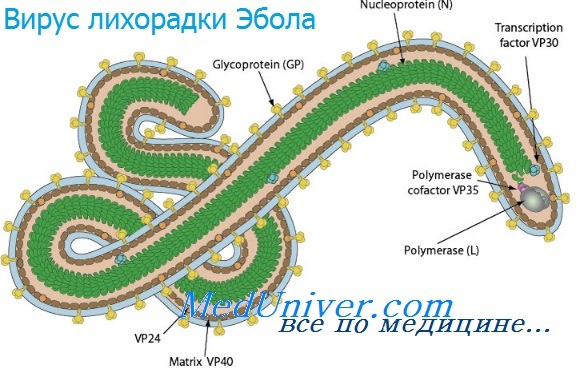
Инфекции вирусов лихорадки Эбола и марбургской болезни
Инфекции вирусов лихорадки Эбола и марбургской болезни - филовирусные инфекции распространены на территории Африки и передаются человеку от приматов и грызунов. Они характеризуются развитием тяжёлой геморрагической лихорадки и высоким уровнем смертности. Инфекция также передаётся при тесном контакте с инфицированными (особенно во внутрибольничной среде). Основной метод лечения — поддерживающая терапия и введение гипериммунной сыворотки.
Профилактику внебольничных инфекций затрудняет отсутствие возможности изоляции источника заболевания. Для предотвращения распространения внутри-больничной инфекции необходимо соблюдать строгие меры предосторожности при контакте с кровью и физиологическими жидкостями больных пациентов. Вакцина на основе вируса везикулярного стоматита, кодирующего антигены вируса лихорадки Марбург, способна защитить приматов даже при введении после заражения.
Хантавирус - хантавирусная лихорадка
Возбудитель передаётся человеку от грызунов, относится к группе буньявирусов. Инфекция, вызванная им, характеризуется геморрагической лихорадкой с почечным синдромом или хантавирусным лёгочным синдромом. Вирус широко распространён во всём мире. Передача от человека к человеку невозможна. По окончании инкубационного периода (2—3 нед) возникают лихорадка, головная боль, боль в спине, поражение конъюнктивы и нёба, а позднее — гипотензия, шок, олигурия, почечная недостаточность. Смертность около 5%.
Методы диагностики — серологическое исследование, молекулярно-генетические с использованием обратной транскриптазы. Предполагают, что рибавирин способен уменьшать вероятность смертельного исхода, но необходимые клинические исследования проведены не были.
Вирус Нипах
Парамиксовирус Нипах — возбудитель тяжёлых инфекций у людей и животных. Впервые выделен в Малайзии; обнаруживают на территории многих азиатских стран. Вызываемое им заболевание сопровождается развитием лихорадки и энцефалита и характеризуется высоким уровнем смертности. Источник инфекции — летучие мыши, питающиеся фруктами. Заражение происходит при контакте с мышами или промежуточными хозяевами (свиньями). Кроме того, возможна передача инфекции от человека к человеку.
Родственный вирусу Нипах вирус Хендра встречают реже. Переносчиками также служат летучие мыши. В клинической картине доминирует гриппоподобный синдром или энцефалит.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

