Вирус оспы это одноклеточное
Обновлено: 24.04.2024
Поражение натуральной оспой. Диагностика, лечение
В 1980 г. Всемирная организация здравоохранения объявила о ликвидации заболевания натуральной оспой. Интерес к натуральной оспе возобновился в связи тем, что оспа потенциально может быть использована в качестве оружия массового поражения; в связи с этим в 2003 г. была начата программа активной вакцинации основного медицинского персонала и военных.
Также они утверждали о попытках советских ученых создать рекомбинантные штаммы вируса, обладающие еще большей вирулентностью. Факт существования и доступности вируса натуральной оспы не может не вызывать серьезной обеспокоенности.
В качестве биологического оружия вирус натуральной оспы должен рассматриваться в первую очередь, и связано это вот с чем: значительная часть населения не обладает иммунитетом к этому заболеванию, запасов вакцины окажется недостаточно, вирус может быть распространен в большом количестве в виде аэрозоля, а его инокуляция в большинстве случаев приведет к развитию заболевания, а передача его от человека к человеку станет неконтролируемой.
Возбудитель натуральной оспы, острого и высококонтагиозного заболевания, принадлежит семейству Poxviridae. Вирус натуральной оспы (вируса Variola) — это ДНК-содержащий вирус. Человеческого резервуара этого вируса, как и его носителей из числа людей, не выявлено. Натуральная оспа может клинически проявляться в двух формах: это variola major, характеризующаяся 20-40% летальностью в группе непривитых лиц, и variola minor, уровень летальности среди непривитых при которой составляет 1%. Существуют и другие вирусы оспы, однако только вирус натуральной оспы способен передаваться от человека человеку.
Вирус натуральной оспы легко передается от человека к человеку воздушно-капельным путем. Во внешней среде вирус способен сохранять жизнеспособность до 7 дней. Первичные симптомы заболевания возникают остро и обычно через 7-17 дней после заражения, они включают лихорадку, ознобы, головную боль, боль в спине и общее недомогание. Это продромальная фаза, которая может продолжаться 2-3 дня. Высыпания обычно появляются через 48 часов после начала заболевания и начинаются с полости рта, языка и ротоглотки, примерно через 24 часа после этого появляются высыпания на коже.
Сыпь быстро распространяется на кистях и предплечьях, после чего она возникает на ногах и туловище; первичными элементами сыпи являются везикулы и пустулы, на месте которых образуются корки и струпья, заканчивающиеся формированием втянутого рубца. Некоторые формы натуральной оспы могут приводить в развитию тяжелых вторичных инфекций и нарушению функции органов и систем: поражению ЖКТ с развитием желудочно-кишечных кровотечений, пневмонии и бронхопневмонии, почечной недостаточности и даже энцефалиту. Смерть наступает обычно к концу первой недели или в начале второй недели заболевания в результате выраженной токсемии, обусловленной неконтролируемой вирусной инфекцией.
Больной натуральной оспой заразен для окружающих в течение всей первой недели заболевания, то есть с тех пор, как появляются первые симптомы. Он продолжает оставаться заразным, пока не заживет последний элемент сыпи. При вспышке заболевания потенциально заразившийся человек во избежание распространения инфекции должен быть изолирован.
В фазу везикулярных высыпаний сыпь может напоминать таковую, встречающуюся при ветряной оспе, однако, существуют два важных отличия. Сыпь при натуральной оспе развивается синхронно, тогда как при ветряной оспе она развивается асинхронно; сыпь при натуральной оспе концентрируется на лице и конечностях, тогда как при ветряной — в основном на туловище. Пустулы при натуральной оспе имеют характерные втяжения (умбиликации) в центральной части. При подозрении на натуральную оспу необходимо немедленно сообщить об этом в органы здравоохранения, поскольку такое событие является ни много ни мало, чрезвычайным происшествием международного масштаба.
Лечение натуральной оспы симптоматическое, каких-либо специфических препаратов, одобренных Управлением по продовольствию и медикаментам (FDA), не существует. В ряде исследований были получены многообещающие результаты применения Цидофовира для профилактики заболеваний, вызываемых ортопоксвирусами. Также в течение первой недели после контакта рекомендуется вакцинация против натуральной оспы. В условиях эпидемии натуральной оспы немедленно должен быть вакцинирован весь медицинский персонал, пациенты должны содержаться в помещениях с отрицательным давлением, персонал должен использовать стандартные меры предосторожности, заключающиеся в ношении перчаток, масок и закрытой одежды.
Ключевым фактором при возникновении эпидемий является изоляция больных и предотвращение дальнейшего распространения инфекции.
Видео урок эпидемий оспы и их значение в истории
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Для терапии таких заболеваний, как астма, атеросклероз, системная красная волчанка, псориаз, ревматоидный артрит, рассеянный склероз и другие, такие как вирус натуральной оспы, используются человеческие антитела, блокирующие белковые факторы воспаления. Оказалось, что для этих целей можно использовать и белки инфекционных микроорганизмов, которые эволюционно адаптированы к преодолению защитных систем организма.
Особый интерес для медицинской биотехнологии представляют высоко патогенные вирусы, для которых человек является единственным хозяином. И сегодня на основе белков вируса натуральной оспы, столетиями являвшегося настоящим бичом цивилизаций, создаются препараты для коррекции тяжелейших патологических состояний неинфекционной, в том числе аутоиммунной, природы
Микроорганизмы обитают везде: в воздухе и в воде, в почве и в наших собственных телах… По сравнению с человеком и животными размножаются они чрезвычайно быстро, и их сообщества неизмеримо многочисленнее. Так, если человечество перевести в масштаб микромира, то все 7 млрд человек легко уместились бы в стандартной микробиологической колбе.
Специфическая защита организма против конкретного инфекционного агента – адаптивный или приобретенный иммунитет, развивается медленнее и представляет собой сложное взаимодействие иммунных клеток разного типа, регулируемое специальными белками.
ИММУННАЯ ОБОРОНА
Задача иммунной системы организма – защищать его от любых внешних и внутренних угроз.
Врожденный иммунитет неспецифичен – он обеспечивает защиту от любых инфицирующих агентов: вирусов, бактерий, а также макромолекул.
Одной из первых (возможно, и одной из самых древних) линий такой неспецифической защиты является апоптоз – программируемое самоубийство клетки. В случае вирусной инфекции апоптоз, индуцируемый в результате молекулярного распознавания специфичных молекул патогена, предотвращает размножение вируса и инфицирование других клеток организма хозяина.
Важную роль в ранней неспецифической защите организма от вирусной инфекции играет воспаление, возникающее в первые часы и дни после инфицирования и направленное на ограничение распространения вируса. Клетки врожденной иммунной системы млекопитающих – макрофаги, дендритные клетки и натуральные киллеры, в ответ на инфекцию продуцируют так называемые провоспалительные цитокины, такие как интерлейкин-1β(IL-1β), интерлейкин-18 (IL-18), фактор некроза опухолей (TNF) и гамма-интерферон (γ-IFN). В развитии воспалительной реакции участвуют белки и другого класса – хемокины, которые регулируют перемещение и функции лейкоцитов.
К дополнительным механизмам врожденного иммунитета можно отнести комплемент – многокомпонентный набор сложных белков сыворотки крови, которые являются протеолитическими ферментами, участвующими в инактивации инфекционных агентов и зараженных ими клеток.
Специфическая защита организма против конкретного инфекционного агента – адаптивный или приобретенный иммунитет, развивается медленнее реакций врожденного иммунитета. Он осуществляется в результате сложного взаимодействия клеток разного типа, контролируемого цитокинами TNF, IL-1β и γ-IFN. Его результат – появление B-лимфоцитов, синтезирующих специфичные противовирусные антитела, и вирусоспецифических цитолитических T-лимфоцитов. Специфичные антитела могут взаимодействовать с вирусными частицами и их компонентами индивидуально либо в комплексе с комплементом, инактивируя их.
Таким образом, интерлейкин-1β, фактор некроза опухолей и гамма-интерферон являются важнейшими цитокинами, которые, наряду с регулированием воспалительных реакций, контролируют развитие адаптивного иммунного ответа организма на инфекцию.
Но что если использовать для этих целей белки патогенных микроорганизмов, таких как вирусы, эволюционно-адаптированных к преодолению защитных систем организма, обернув, образно говоря, зло во благо?
Патогенный и антропонозный
Царство вирусов было открыто более ста лет назад выдающимся русским ученым Д. И. Ивановским, однако изучить эти мельчайшие организмы удалось лишь в последние десятилетия благодаря бурному развитию инструментальных методов исследований.
Разные вирусы млекопитающих отличаются не только по размеру генома и самих вирусных частиц, но и по стратегии своего развития в организме хозяина. Вирусы различных семейств демонстрируют удивительное разнообразие в механизмах преодоления систем врожденного и адаптивного иммунитета млекопитающих. Поэтому изучение этих особенностей вирусов позволяет выявить новые закономерности организации и функционирования защитных систем животных и человека, обеспечивающих выздоровление после инфицирования болезнетворным агентом.
Удивительный пример высокой патогенности для человека и строгой антропонозности представляет собой вирус натуральной оспы. Этот вирус, предположительно, исходно имел широкий круг хозяев, однако в процессе эволюции утратил способность размножаться в организме других млекопитающих, сохраняясь в эндемичном (т. е. свойственном только данной местности) состоянии в течение многих столетий в густонаселенных районах, прежде всего, Индийского субконтинента (Щелкунов, 2012).
Оружие против воспаления
Как уже упоминалось, главной причиной аутоиммунных заболеваний является разбалансировка иммунитета, в том числе сверхсинтез веществ, провоцирующих воспалительные реакции.
Одним из ключевых цитокинов иммунного воспалительного ответа является фактор некроза опухолей (TNF) – именно его повышенная продукция приводит к таким болезням аутоиммунной природы, как псориаз, болезнь Крона, ревматоидный артрит и т. п. Высокий уровень продукции TNF обусловливает и тяжелую патологию, часто завершающуюся летальным исходом – септический или эндотоксический шок.
Воспрепятствовать связыванию TNF с его белковыми рецепторами, зафиксированными на клеточных мембранах, можно с помощью соответствующих моноклональных антител либо так называемых растворимых форм его рецепторов, которые представляют собой внеклеточные домены (участки) рецепторных белков и обычно обнаруживаются в сыворотке и других биологических жидкостях. Присоединение подобных молекул к TNF должно инактивировать этот цитокин и уменьшить вызванный им воспалительный процесс.
Действительно, в модельных лабораторных экспериментах было доказано терапевтическое действие анти-TNF антител при лечении ряда патологий, обусловленных повышенной продукцией TNF. Однако попытки использовать для этих целей напрямую растворимые клеточные TNF-рецепторы не дали положительных результатов. Успеха удалось добиться лишь с помощью методов генетической инженерии, когда были созданы так называемые химерные белки, состоящие из TNF-связывающей части клеточных рецепторов и фрагмента иммуноглобулина человека.
Однако клинические исследования показали, что пациенты, страдающие ревматоидным артритом или другим воспалительным или аутоиммунным заболеванием, оказываются избирательно чувствительны лишь к одному из этих анти-TNF препаратов. Кроме того, поскольку все эти препараты имеют белковую природу, они сами по себе являются мишенью для иммунной системы больных, поэтому при длительной терапии их эффективность может снижаться. Это означает, что при потере чувствительности к одному препарату его требуется заменить на другой.
РЕВМАТОИДНЫЙ АРТРИТ — системное аутоиммунное заболевание соединительной ткани, проявляющееся главным образом хроническим воспалением суставов: голеностопных, лодыжек, коленей и кистей рук.
Сегодня от этой болезни страдает каждый сотый житель Земли, т. е. более 70 млн человек. Женщины болеют в несколько раз чаще, чем мужчины. Болезнь обычно развивается после 30 лет. В 70 % случаев ревматоидный артрит приводит к инвалидности, которая наступает довольно рано.
Причины возникновения этой болезни точно не установлены, но известно, что толчком к ее развитию служит сбой в иммунной системе в результате переохлаждения, стрессов, травм суставов и инфекции, в том числе ОРЗ, ангины и гриппа. При ревматоидном артрите наблюдается избыточный синтез таких провоспалительных цитокинов, как фактор некроза опухолей и гамма-интерферон
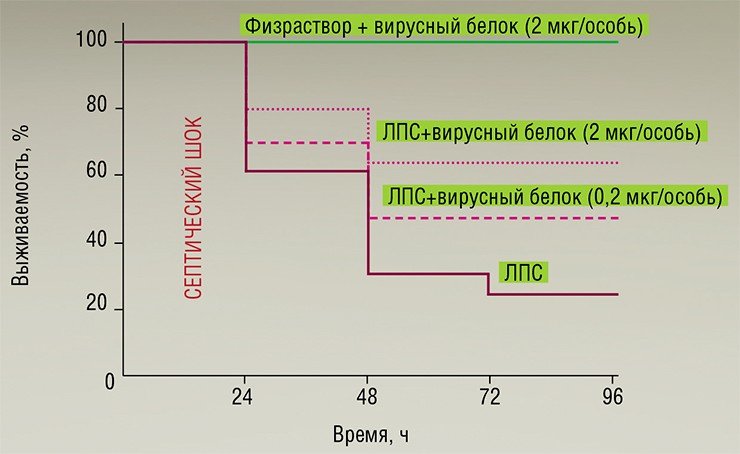
Методами генетической инженерии здесь были созданы рекомбинантные бакуловирусы, способные продуцировать в клеточной культуре TNF-связывающий белок (CrmB), характерный для вирусов оспы коров, оспы обезьян и натуральной оспы. Однако на экспериментальной модели эндотоксического шока было показано, что существенным терапевтическим эффектом обладает лишь белок CrmB вируса натуральной оспы (Gileva et al., 2006). Именно этот белок или его реконструированные варианты могут стать действующим началом новых средств анти-TNF терапии (Гилева и др., 2009).
На сегодня имеется много данных о том, что воспалительный процесс и гистопатологические изменения при ряде воспалительных и аутоиммунных заболеваний нервной системы, артрите, гломерулонефрите, системной красной волчанке и других болезнях во многих случаях обусловлены активацией системы комплемента крови, представляющей собой еще одну из систем неспецифического иммунитета. Комплемент играет важную роль и в реакции отторжения трансплантата.
Поксвирусы кодируют особый белок (КСБ), способный ингибировать активацию комплемента, причем наиболее эффективно с белками комплемента человека взаимодействует белок того же вируса натуральной оспы. Сегодня считается, что именно этот вирусный белок может стать перспективным препаратом для лечения болезни Альцгеймера, синдрома мультиорганной дисфункции и отторжения ксенотрансплантатов (Jha, Kotwal, 2003). Так, на лабораторных животных было показано, что рекомбинантный КСБ способствует восстановлению функций мозга после средней и тяжелой черепно-мозговой травмы. Этот белок оказался эффективен и при травмах спинного мозга: при его применении значительно уменьшались гистопатологические изменения, вызванные воспалительными реакциями.
В патогенезе воспалительных и аутоиммунных заболеваний важную роль играют и хемокины – обширное семейство небольших белков, имеющих очень сходную третичную структуру. Поксвирусы кодируют хемокинсвязывающие белки, по аминокислотной последовательности не имеющие гомологов среди известных белков позвоночных. Их высокий терапевтический потенциал был показан на ряде лабораторных моделей воспалительных и аутоиммунных заболеваний (Непомнящих, Щелкунов, 2008).
Таким образом, предположение ученых, что вирусные белки, являющиеся антагонистами иммунных белков-регуляторов, можно использовать в терапевтических целях, полностью подтвердилось. Сегодня на их основе с помощью методов генетической инженерии уже разрабатываются препараты нового поколения для коррекции патологических состояний человека, связанных с избыточной активацией белков-медиаторов защитных систем организма.
И с этой точки зрения, мы можем по-новому взглянуть на смертельно опасный для человека вирус натуральной оспы: результаты лабораторных исследований и доклинических испытаний свидетельствуют о большой перспективности препаратов для лечения тяжелейших воспалительных и аутоиммунных заболеваний человека, созданных на основе белков этого вируса, на протяжении столетий бывшего настоящим бичом цивилизаций.
Непомнящих Т. С., Щелкунов С. Н. Иммуномодулирующие белки поксвирусов как новые средства иммунокорректирующей терапии // Молекуляр. биология. 2008. Т. 42, №. 5. С. 904–912.
Щелкунов С. Н. Вирус натуральной оспы – источник новых медицинских препаратов // Соросовский образовательный журнал. 1995. № 1. С. 28—31.
Щелкунов С. Н. Генетическая инженерия: Учеб.-справ. пособие. 3-е изд., испр. и доп. Новосибирск: Сиб. универ. изд-во, 2008. 514 с.
Щелкунов С. Н. Преодоление ортопоксвирусами защитных систем организма млекопитающих // Молекуляр. биология. 2011. Т. 45, № 1. С. 30—43.
Щелкунов С. Н. Оспа – дамоклов меч цивилизаций // Наука из первых рук. 2012. № 6 (48). С. 96—109.
Shchelkunov S. N. Orthopoxvirus genes that mediate disease virulence and host tropism // Advances in Virology. 2012. Vol. 2012, Article ID 524743, 17 p. doi:10.1155/2012/524743.
Работа выполнена при финансовой поддержке РФФИ (грант 12-04-00110а)
Натуральная оспа (variola vera) — особо опасная вирусная инфекция, проявляющаяся интоксикацией, лихорадкой и пустулёзно-папулёзной сыпью.
Оспа одна из древнейших инфекционных болезней человека. Первые упоминания об натуральной оспе относятся к 3730-3710 гг. до н.э. (папирус Аменофиса I). В Европу возбудитель проник в VI веке, в Россию был занесён в XV-XVI веках, в Америку — в XVI веке.
До открытия Дженнером метода вакцинации европейские врачи были бессильны перед натуральной оспой. В отдельные годы смертность от оспы достигала 1,5 млн человек.
Возбудитель оспы — самый крупный вирус (220x300 нм), имеет кирпичеобразную форму с закруглёнными углами.
В состав вируса натуральной оспы входят 30 белков, более 10 из них — ферменты, катализирующие синтез нуклеиновых кислот. Вирус натуральной оспы проявляет гемагглютинирующие свойства; гемагглютинин состоит из трёх гликопротеинов.
Важнейшие Аг вируса оспы — нуклеопротеид NP (общий для всего семейства), термостабильный и термолабильный Аг, а также группа растворимых Аг. Размеры вирионов позволяют обнаружить их световой микроскопией в форме телец включений.
Внутриклеточные (точнее околоядерные) включения в клетках роговицы заражённого кролика впервые обнаружил итальянский патолог Д. Гварнери (1892). ЭТ возбудителя натуральной оспы в отделяемом везикул открыл немецкий бактериолог Э. Пашен (1906). Позднее было установлено наличие двух штаммов вируса натуральной оспы.
Первый вызывает классическую оспу (variola major) с летальностью, превышающей 50%, второй — алястрим (variola minor) с более лёгким течением и летальностью, не превышающей 1%. Возбудители идентичны по основным свойствам. Отличительные особенности — способность вируса алястрима размножаться в куриных эмбрионах при более низкой температуре (37,5 °С), образовывать бляшки и проявлять цитопатичес-кий эффект в культуре куриных фибробластов при температуре 37 °С.
К вирусу натуральной оспы чувствителен человек и приматы; экспериментальное внутримозговое заражение новорождённых мышат приводит к развитию генерализованной инфекции. Взрослые мыши нечувствительны к вирусу.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Вирусы оспы. Виды вирусов оспы. Строение вирусов оспы.
Вирусы оспы (ВО) — самые крупные вирусы, содержащие ДНК, молекулярная масса которой больше, чем у любого другого вируса животных. Они широко распространены в природе, вызывают заболевания позвоночных и беспозвоночных с летальным исходом или в виде легко протекающей продолжительной инфекции с образованием доброкачественных опухолей. ВО передаются членистоногими при прямом контакте, аэрозольно или механически. ВО обычно имеют узкий круг хозяев, хотя некоторые из них представляют исключения, в том числе вирусы вакцины и оспы птиц. Вирусы оспы позвоночных включают восемь родов (орто-, пара-, ави-, капри-, лепори-, суи-, моллюсци- и ятапоксвирусы).
Разделение вирусов оспы позвоночных на роды проведено с учетом массы и структуры генома, размера и формы вириона, способности к генетической рекомбинации, антигенной связи и спектра патогенности.
Ортопоксвирусы. Типичный представитель - вирус осповакцины (ВОВ). Спектр естественных хозяев узкий, обычно ограничен одним видом животных: вирусы агглютинируют эритроциты цыплят; варьируют по вирулентности для естественных хозяев и лабораторных животных. Другие виды: вирусы оспы буйволов, верблюдов, крупного рогатого скота, мышей, обезьян и вирус натуральной оспы.
Парапоксвирусы. Типичный представитель — вирус контагиозного пустулёзного дерматита (эктимы) овец и коз (вирус орф). Представители рода серологически связаны между собой, но отличаются от представителей других родов; гемагглютинин не образуют. Другие виды: вирусы пустулёзного стоматита крупного рогатого скота, контагиозной эктимы серн и сыпи доярок.
Авипоксвирусы. Естественные хозяева — птицы; типичный представитель — вирус оспы кур. Члены рода серологически связаны между собой. Другие виды: вирусы оспы канареек, голубей, перепелов, воробьев, скворцов, индеек и оспы Юнко. Передаются членистоногими.
Каприпоксвирусы. Естественные хозяева — парнокопытные; типичный представитель — ВО мелких жвачных (овец и коз). В данный род входит также вирус кожной бугорчатки крупного рогатого скота.
Лепорипоксвирусы. Типичный представитель — вирус миксомы кроликов. Передается механически членистоногими. Другие виды: вирусы фибромы зайцев, кроликов (вирус Шоупа) и белок. Вирус злокачественной фибромы кроликов — летальный туморогенный поксвирус, возникший, по-видимому, вследствие рекомбинации между вирусами фибромы и миксомы кроликов.
Суипоксвирусы. Типичный представитель — вирус оспы свиней. В инфицированных клетках образуются несколько типов цитоплазматических включений и наблюдается вакуолизация ядра. Другие члены рода не определены.
Моллюсципоксвирусы. Типичный представитель — вирус контагиозного моллюска. Возможные члены рода — вирусы однокопытных и обезьян.
Ятапоксвирусы включают вирус опухолей обезьян Яба и вирус оспы Тана.
Вирусы оспы — наиболее крупные из всех вирусов животных. Под электронным микроскопом они выглядят как большие овальные (кирпичеобразные) частицы размером около 250-350x200-270 нм.
Орто-, ави-, лепорипоксвирусы более вытянуты, а вирус оспы свиней шире, чем другие ВО. Парапоксвирусы имеют овальную (коконообразную) форму и размер 260x160 нм.
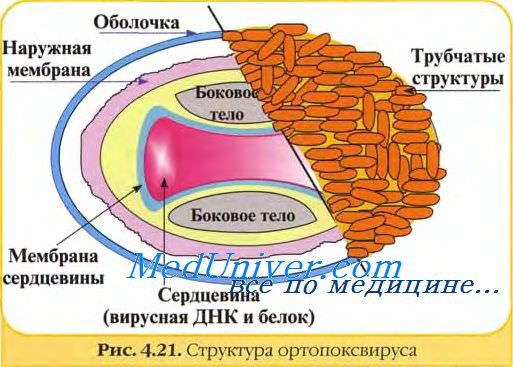
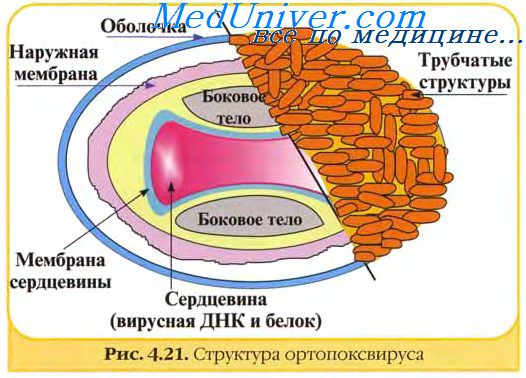
В структуре вирусов оспы различают три основных компонента: двояковогнутую сердцевину, овальные боковые тела и оболочку вириона. Сердцевину вириона составляют ДНК и связанные с нею белки. Сердцевина окружена гладкой мембраной (толщиной около 5 нм), снаружи покрытой слоем вертикально уложенных и плотно прилегающих друг к другу цилиндрических субъединиц (5x10 нм). Вогнутость сердцевины с обеих сторон занята овальными образованиями (неизвестной природы), называемыми боковыми телами. Они как бы сдавливают сердцевину, придавая ей форму двояковогнутого диска, имеющего на разрезе вид гантели.
Вирионы заключены в липопротеиновую супероболочку, которая имеет толщину 20—30 нм и содержит липиды клетки и вирусспецифические белки.
Вирионы большинства вирусов оспы окружены слоем беспорядочно расположенных трубчатых структур, придающих им характерный вид. Эти структуры состоят из сферических субъединиц диаметром около 5 нм. Субъединицы построены из молекул протеина или гликопротеина. В состав ворсинок длиной 20 нм покрывающих поверхность вируса осповакцины (ВОВ), входит белок с молекулярной массой 58 кД, относящийся к главным полипептидам вириона. Поверхность парапоксвирусов покрыта длинными нитеподобными трубочками, уложенными крест-накрест, напоминающими клубок пряжи.
Вирус осповакцины содержит белки, липиды и ДНК, которые соответственно составляют 90, 5 и 3,2% массы вириона (5х10~15 г). В вирусе оспы птиц около 1/3 массы составляют липиды.
Вирион образуется включением ДНК внутрь незрелых вирусоподобных частиц, которые затем созревают, покрываясь дополнительно наружными оболочками. Репликация и сборка вирионов происходят в разных местах цитоплазмы (в виропластах или вирусных фабриках), и вирионы освобождаются почкованием или при лизисе клеток.
Вирионы, освободившиеся из клетки почкованием до ее разрушения, покрыты оболочкой, которая содержит клеточные липиды и несколько вирусспецифических белков.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

