Вирус оспы сообщение по биологии
Обновлено: 24.04.2024
Натуральная оспа представляет собой инфекционное заболевание человека, относящееся к особо опасным инфекциям, вызываемое вирусом Orthopoxvirus variola, характеризующееся лихорадкой, интоксикацией и специфическими высыпаниями на коже и слизистых оболочках. Распространение натуральной оспы происходит аэрозольным путем, при этом возбудитель настолько устойчив в воздушной среде, что может вызывать заражение людей, находящихся не только в одной комнате с больным, но и в соседних помещениях. В середине 70-х годов ХХ века полная ликвидация натуральной оспы в развитых странах привела к отмене профилактической вакцинации против этого заболевания.
Общие сведения
Натуральная оспа представляет собой инфекционное заболевание человека, относящееся к особо опасным инфекциям, вызываемое вирусом Orthopoxvirus variola, характеризующееся лихорадкой, интоксикацией и специфическими высыпаниями на коже и слизистых оболочках.
Характеристика возбудителя
Вирус Orthopoxvirus variola входит в группу вирусов оспы животных и человека, устойчив в окружающей среде, легко переносит понижение температуры и высыхание, может сохранять жизнеспособность при замораживании в течение нескольких лет. При комнатной температуре сохраняется в оспенных корочках до года, в мокроте и слизи – до трех месяцев. При нагревании до 100° С вирус в высушенном виде погибает только через 5-10 минут.
Натуральная оспа передается по аэрозольному механизму преимущественно воздушно-капельным и воздушно-пылевым путями. Аэрозоль с возбудителем способен перемещаться с током воздуха на значительное расстояние, поражая людей, располагающихся в одной комнате с больным, и проникая в соседние помещения. Оспа имеет тенденцию к распространению в многоэтажных многоквартирных помещениях, лечебных учреждениях, скученных коллективах.
Естественная восприимчивость человека – высокая. Неиммунизированные лица заражаются в подавляющем большинстве случаев, процент невосприимчивых лиц составляет не более 12 из 100 непривитых (в среднем 5-7%). После перенесения заболевания формируется стойкий длительный (более 10 лет) иммунитет.
Симптомы натуральной оспы
Инкубационный период натуральной оспы обычно составляет 9-14 дней, может увеличиваться до 22 дней. Выделяют периоды заболевания: продромальный (или период предвестников), высыпаний, нагноения и реконвалесценции. Продромальный период длится от двух до четырех дней, отмечается лихорадка, симптомы интоксикации (головная боль, озноб, слабость, боли в мышцах, пояснице). В это же время на бедрах и груди может обнаруживаться сыпь, напоминающая экзантему при кори или скарлатине.
К концу продромального периода лихорадка, обычно, спадает. На 4-5 сутки появляется оспенная сыпь (период высыпания), первоначально представляющая собой мелкие розеолы, прогрессирующие в папулы, а через 2-3 дня – в везикулы. Везикулы имеют вид многокамерных мелких пузырьков, окруженных гиперемированной кожей и имеющих небольшое пупковидное углубление в центре. Сыпь локализуется на лице, туловище, конечностях, не исключая ладони и подошвы, в отличие от ветряной оспы элементы сыпи в одной зоне мономорфны. С прогрессированием сыпи снова нарастает лихорадка и интоксикация.
К концу первой недели заболевания, в начале второй, начинается период нагноения: температура резко поднимается, состояние ухудшается, сыпные элементы нагнаиваются. Оспины теряют свою многокамерность, сливаясь в единую гнойную пустулу, становятся болезненными. Спустя неделю пустулы вскрываются, образуя черные некротические корочки. Кожа начинает сильно зудеть. На 20-30 сутки наступает период реконвалесценции. Температура тела больного постепенно нормализуется с 4-5 неделе заболевания, оспины заживают, оставляя после себя выраженное шелушение, а в дальнейшем - рубцы, иногда весьма глубокие.
Выделяют тяжелые клинические формы оспы: папулезно-геморрагическую (черная оспа), сливную и оспенную пурпуру. Среднетяжелое течение имеет оспа рассеянная, легкое – оспа без сыпи и температуры: вариолоид. В такой форме оспа протекает обычно у привитых лиц. Характерны редкие высыпания, не оставляющие после себя рубцов, интоксикационные симптомы отсутствуют.
Осложнения натуральной оспы
Чаще всего натуральная оспа осложняется инфекционно-токсическим шоком. Отмечают осложнения воспалительного характера со стороны нервной системы: миелиты, энцефалиты, невриты. Есть вероятность присоединения вторичной инфекции и развития гнойных осложнений: абсцессов, флегмон, лимфаденитов, пневмонии и плеврита, отитов, остеомиелита. Может развиться сепсис. После перенесения оспы могут остаться последствия в виде слепоты или глухоты.
Диагностика и лечение натуральной оспы
Диагностика натуральной оспы производится с помощью вирусоскопического исследования с использованием электронного микроскопа, а так же вирусологическими и серологическими методами: микропреципитация в агаре, ИФА. Исследованию подлежит отделяемое оспенных пустул и корочки. С 5-8 дня заболевание возможно определение специфических антител с помощью РН, РСК, РТГА, ИФА.
Лечение натуральной оспы заключается в назначении противовирусных препаратов (метисазон), введении иммуноглобулинов. Кожу, пораженную оспенной сыпью, обрабатывают антисептическими средствами. Дополнительно (ввиду гнойного характера инфекции) назначается антибиотикотерапия: применяют антибиотики групп полусинтетических пенициллинов, макролидов и цефалоспорины. Симптоматическая терапия заключается в активной дезинтоксикации с помощью внутривенной инфузии растворов глюкозы, водно-солевых растворов. Иногда в терапию включают глюкокортикоиды.
Прогноз и профилактика натуральной оспы
Прогноз зависит от тяжести течения и состояния организма больного. Привитые лица, как правило, переносят оспу в легкой форме. Тяжело протекающая оспа с геморрагическим компонентом может закончиться смертью.
В настоящее время специфическая профилактика оспы производится с целью не допустить ее завоза из эпидемически опасных регионов. Ликвидация оспы в развитых странах достигнута благодаря массовой вакцинации и ревакцинации населения на протяжении нескольких поколений, в настоящее время плановая всеобщая вакцинация нецелесообразна. В случае выявления больного натуральной оспой, осуществляют его изоляцию, а так же производят карантинные мероприятия в отношении всех, имевших контакт с больным. В очаге инфекции производят тщательную дезинфекцию, контактных лиц вакцинируют в течение первых трех дней с момента контакта.

Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.
Натуральная оспа (variola vera) — особо опасная вирусная инфекция, проявляющаяся интоксикацией, лихорадкой и пустулёзно-папулёзной сыпью.
Оспа одна из древнейших инфекционных болезней человека. Первые упоминания об натуральной оспе относятся к 3730-3710 гг. до н.э. (папирус Аменофиса I). В Европу возбудитель проник в VI веке, в Россию был занесён в XV-XVI веках, в Америку — в XVI веке.
До открытия Дженнером метода вакцинации европейские врачи были бессильны перед натуральной оспой. В отдельные годы смертность от оспы достигала 1,5 млн человек.
Возбудитель оспы — самый крупный вирус (220x300 нм), имеет кирпичеобразную форму с закруглёнными углами.
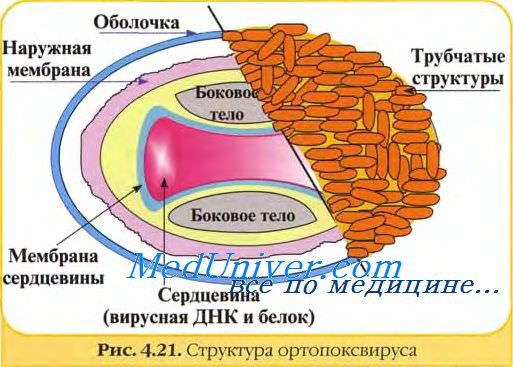
В состав вируса натуральной оспы входят 30 белков, более 10 из них — ферменты, катализирующие синтез нуклеиновых кислот. Вирус натуральной оспы проявляет гемагглютинирующие свойства; гемагглютинин состоит из трёх гликопротеинов.
Важнейшие Аг вируса оспы — нуклеопротеид NP (общий для всего семейства), термостабильный и термолабильный Аг, а также группа растворимых Аг. Размеры вирионов позволяют обнаружить их световой микроскопией в форме телец включений.
Внутриклеточные (точнее околоядерные) включения в клетках роговицы заражённого кролика впервые обнаружил итальянский патолог Д. Гварнери (1892). ЭТ возбудителя натуральной оспы в отделяемом везикул открыл немецкий бактериолог Э. Пашен (1906). Позднее было установлено наличие двух штаммов вируса натуральной оспы.
Первый вызывает классическую оспу (variola major) с летальностью, превышающей 50%, второй — алястрим (variola minor) с более лёгким течением и летальностью, не превышающей 1%. Возбудители идентичны по основным свойствам. Отличительные особенности — способность вируса алястрима размножаться в куриных эмбрионах при более низкой температуре (37,5 °С), образовывать бляшки и проявлять цитопатичес-кий эффект в культуре куриных фибробластов при температуре 37 °С.
К вирусу натуральной оспы чувствителен человек и приматы; экспериментальное внутримозговое заражение новорождённых мышат приводит к развитию генерализованной инфекции. Взрослые мыши нечувствительны к вирусу.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Обзор
Споры сибирской язвы под микроскопом
Автор
Редактор

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Так, в 1915 году в ходе Первой мировой войны Германия и Франция перегоняли зараженный сибирской язвой скот — лошадей и коров — на сторону противника [1].
А в 1940-х годах на британской экспериментальной станции Портон-Даун доктор Пол Филдс определил, что наиболее эффективный способ применения сибирской язвы как биологического боевого агента — распыление частиц при взрыве бомбы. В 1942 году он провел серию экспериментов с бактериологическим оружием на пустынном шотландском острове Грюинард (рис. 1), куда доставили отару овец, после чего туда же сбросили бомбы, начиненные спорами сибирской язвы. Все овцы погибли в течение нескольких дней, а земля острова на протяжении долгих десятилетий оставалась зараженной и непригодной для жизни [2].

Рисунок 1. Остров Грюинард
Военный городок Свердловск-19, 1979 год. Внезапная вспышка сибирской язвы унесла жизни 64 людей — и это только по официальным данным. По неофициальным (со слов врачей и пациентов) — не меньше сотни. Подавляющее большинство инфицированных были мужчинами средних лет. Годы спустя президент Борис Ельцин признал, что причиной эпидемии стали секретные разработки, а именно — случайная утечка бактерий из военной лаборатории [3].
Итак, что же в сибиреязвенных спорах так привлекает биотеррористов, и что делает возбудителя сибирской язвы потенциальным биологическим оружием?
С точки зрения бактериологии

Рисунок 2. Bacillus anthracis. В инфицированной крови или тканях бациллы часто присутствуют в виде коротких цепочек, окруженных полипептидной капсулой.
Грамположительные бактерии — те, что при окраске микроорганизмов по методу Грама приобретают темно-синий цвет и не обесцвечиваются при обработке спиртом. Такая окраска позволяет разделить бактерии по биохимическим свойствам: у грамположительных бактерий спирт вызывает сужение пор в пептидогликане (это полимер в стенках бактериальных клеток), за счет чего краска задерживается в клеточной стенке. Грамотрицательные бактерии, напротив, после воздействия спиртом утрачивают краситель из-за меньшего содержания пептидогликанов [4].
Что касается спор, эти особые формы бактериальных клеток служат для репродукции и/или переживания неблагоприятных условий, то есть хорошо сохраняются во внешней среде (важное свойство для биологического оружия). Они устойчивы к высоким температурам, радиации, высушиванию, действию растворителей и прочих губительных факторов. Более того, споры B. аnthracis могут переносить даже десятиминутное кипячение и сохраняются в почве десятки лет (что демонстрирует случай с островом Грюинард) [2]. В организме животного, которое имело несчастье пастись на такой земле, споры прорастают и вызывают сибирскую язву.
Что насчет патогенеза?
Патогенность B. аnthracis связана со способностью продуцировать токсины — отечный и летальный — и образовывать бактериальную капсулу.
Патогенные свойства B. anthracis кодируются двумя плазмидами: pXO1 отвечает за биосинтез токсинов, а pXO2 кодирует компоненты капсулы. Обе плазмиды необходимы для полной вирулентности (способности к инфицированию), и потеря любой из них приводит к ослаблению штамма.
Небольшая справка
Бактериальные плазмиды — это кольцевые молекулы ДНК, обособленные от хромосом (рис. 3). Они содержат дополнительные гены, необходимые только в специфических условиях для выживания клетки.

Рисунок 3. Генетический аппарат бактерий. Цифрой 1 обозначена бактериальная ДНК, 2 — обособленные от нее плазмиды.
схема автора статьи
Существует несколько основных групп плазмид.
Col-плазмиды отвечают за синтез белков, действующих против других бактерий (такие вещества называются бактериоцинами). Эти белки вызывают гибель бактерий того же вида (или родственных ему), но не действуют на сами клетки, выделяющие данные вещества.
F-плазмиды (факторы фертильности) ответственны за половой процесс у бактерий. Его обусловливает наличие F-пилей — нитей белковой природы — и их способность к конъюгации, то есть переносу части генетического материала от одной бактериальной клетки к другой при их непосредственном контакте.
R-плазмиды (факторы резистентности) отвечают за устойчивость к действию антибиотиков и сульфаниламидных препаратов (бактериостатиков) — лекарств с противомикробным действием [5–7].
D-плазмиды определяют синтез ферментов, обеспечивающих расщепление углеводородов нефти и других трудноусваиваемых соединений [8].
Однако вернемся к сибирской язве. Плазмида pXO1 кодирует три компонента сибиреязвенных токсинов (рис. 4). Фактор отека (EF) вызывает местную воспалительную реакцию — собственно, отек; протективный антиген (PA) обладает иммуногенным действием, то есть способностью вызывать иммунный ответ организма. И третий фактор — летальный (LF) — нарушает внутриклеточный синтез макромолекул, что приводит к некрозу и разрушению клеток, в первую очередь — макрофагов. Каждый из этих факторов по отдельности не обладает патогенным действием, но сочетание протективного и летального факторов образует летальный токсин, а протективного и отечного — отечный токсин [2], [9–11].

Рисунок 4. Плазмиды B. anthracis и продукты их синтеза. Регулятор AtxA, кодируемый плазмидой pXO1, контролирует синтез компонентов токсинов сибирской язвы со своей же плазмиды и компонентов капсулы с pXO2. Компоненты EF (фактор отека), LF (летальный фактор) и PA (протективный антиген) собираются в токсины ETx (отечный токсин) и LTx (летальный токсин), вызывая в целевых клетках-хозяевах отек и смерть соответственно. Компоненты капсулы ABCDE взаимодействуют на мембране бактериальной клетки с образованием поли-гамма-D-глутаматной капсулы, которая защищает клетки B. anthracis от уничтожения фагоцитами во время инфекции. PAI — остров патогенности в составе плазмиды.
Виды сибирской язвы
Сибирская язва существует в четырех формах: кожная, желудочно-кишечная, легочная и инъекционная [2], [12], [13].
Кожная форма является самой распространенной и наименее опасной. Она возникает при проникновении бактерий через поврежденную кожу — порез или царапину — при контакте с больным животным или продуктами животного происхождения. В течение двух-трех дней после заражения на коже развивается папула (вид кожной сыпи), которая затем окружается кольцом из везикул (воспалительных элементов сыпи) и, наконец, высыхает. Обычно к 5–6 дню из нее образуется похожий на уголь черный карбункул: он безболезнен и окружен отеком (рис. 5). Без лечения до 20% людей с кожной сибирской язвой погибает от сепсиса, однако при правильном лечении выживают почти все пациенты.

Рисунок 5. Кожная форма сибирской язвы
Желудочно-кишечная сибирская язва проявляется при употреблении в пищу сырого или недоваренного мяса зараженного животного. Инфекция так же развивается в течение недели. Характерный карбункул чаще всего встречается на стенке терминальной подвздошной или слепой кишки, однако могут быть поражены и ротоглотка, желудок, двенадцатиперстная кишка и верхняя подвздошная кишка. Желудочно-кишечная сибирская язва имеет две клинические формы: брюшную и пищеводную. При брюшной форме начальные симптомы — тошнота, рвота и лихорадка. По мере прогрессирования заболевания возникают сильные боли в животе, кровоизлияние и диарея с кровью, за которыми следуют сепсис и смерть. Все это — результат тяжелого и широко распространяющегося некроза начального отдела кишечника. При пищеводной форме сибирской язвы симптомы включают боль в горле, нарушение глотания, лихорадку, увеличение лимфоузлов в области шеи и отечность. Из-за таких неспецифических проявлений трудно поставить верный диагноз, что приводит к высокой смертности: умирает более половины пациентов. Однако при правильном лечении выживаемость может достигать 60%.
Самая смертоносная форма сибирской язвы — легочная: она возникает при вдыхании спор В. anthracis. Болезнь начинается коварно — с похожих на грипп симптомов: легкой температуры, усталости, недомогания, боли в мышцах и непродуктивного кашля. Начальная стадия длится около 48 часов, после чего резко сменяется развитием острой фазы. Появляются сильная одышка, тахикардия, учащенное свистящее дыхание, влажные хрипы, лихорадка и посинение кожи (цианоз). В конечном итоге пульс становится очень быстрым и слабым, одышка и цианоз прогрессируют, затем быстро наступают кома и смерть. Без лечения выживает только 10–15% пациентов, однако при агрессивном лечении выживаемость может повышаться и до 55%.
Не так давно была обнаружена новая, инъекционная, форма сибирской язвы в среде героиновых наркоманов. Ее симптомы иногда напоминают кожную форму, однако инфекция в этом случае локализуется глубоко под кожей или в мышце — в зависимости от того, куда была сделана инъекция.
Ни одна из форм сибирской язвы не заразна. Это означает, что болезнь не передается от человека к человеку, как простуда или грипп, — инфицирование может происходить только одним из означенных выше способов [13].
Вскрытие покажет
Лечение и профилактика
Для лечения всех форм сибирской язвы ВОЗ рекомендует интенсивную поддерживающую терапию и антибиотикотерапию. В качестве антибиотика, как правило, выступает знаменитый пенициллин. В тяжелых случаях его комбинируют со фторхинолонами (ципрофлоксацином или левофлоксацином) или макролидами (клиндамицином или кларитромицином). Также могут использоваться и другие антибиотики широкого спектра. При заражении самой опасной, легочной, формой сибирской язвы в ход идет тяжелая артиллерия: гемодинамическая поддержка, искусственная вентиляция легких, назначение кортикостероидов. Очень важно начать своевременное лечение, чтобы уничтожить бактерии раньше, чем их токсины попадут в кровоток [15].
Также при лечении сибирской язвы используют человеческие моноклональные (происходящие от одной клетки-предшественницы) антитела: раксибакумаб и обилтоксаксимаб. Оба препарата связывают протективный антиген (PA), в результате чего нейтрализуются оба сибиреязвенных токсина. Это происходит из-за того, что PA играет ключевую роль в сборке токсинов и поражении клеток-мишеней. Препараты рекомендованы для лечения легочной формы сибирской язвы в сочетании с антибактериальной терапией [17], [18].
Лечение сибирской язвы проводится в течение 3–7 дней при неосложненной кожной форме и 10–14 дней — при системной инфекции, которая охватывает весь организм. Если заболевание — результат биотерроризма, длительность лечения, по рекомендациям ВОЗ, может возрастать до 60 дней. В таком случае назначают ципрофлоксацин или доксициклин с тремя дозами вакцины против сибирской язвы (или же без нее) [15].
Почему различаются курсы лечения инфекций, возникших естественным путем и вызванных искусственно? Дело в том, что искусственные инфекционные болезни обладают самостоятельными клиническими аспектами, этиологией и эпидемиологией. Для заражения злоумышленники могут использовать усовершенствованные штаммы микроорганизмов: с повышенной вирулентностью, устойчивостью к отдельным лекарствам и способностью преодолевать иммунитет, возникший в результате вакцинации. О том, что заболевание вызвано воздействием биологического оружия, могут говорить невозможные эпидемиология и клиническая форма болезни. Проще говоря, можно заподозрить биотерроризм, если в природе не существует условий для развития данного эпидемического процесса, либо подобной клинической картины не наблюдается при естественном заражении. Например, существует патология мелкодисперсного аэрозоля: поражение глубоких отделов легких, вызванное проникновением инфекционных агентов размером менее 5 мкм. Эту патологию может вызвать только целенаправленное распыление биологических частиц из аэрозоля с дисперсной фазой 1–5 мкм [19].
Против сибирской язвы существуют и вакцины (см. табл.).
Несмотря на уже существующие вакцины, разрабатывают и новые — с расчетом на то, что они окажутся более безопасными и эффективными [21]. Однако ни одной вакцины нет в свободном доступе, и ВОЗ рекомендует их только для групп риска — людей, чья деятельность связана с высоким риском инфицирования: ветеринарам, некоторым лабораторным работникам и военнослужащим. Например, с 2015 года вакцину получают сотрудники Министерства обороны США и члены их семей [15].
Идеальное биологическое оружие?
Если сравнить, скажем, B. anthracis и Y. pestis — возбудителя чумы — то окажется, что B. anthracis обладает некоторыми преимуществами — разумеется, в качестве биологического оружия. Так, мы уже говорили о том, что возбудитель сибирской язвы крайне устойчив во внешней среде и может храниться в почве десятилетиями. По сравнению с ним, Y. pestis обладает небольшой устойчивостью: при низкой температуре чумная палочка сохраняется в почве до 28 суток, при высокой — быстро погибает. В выделениях больных людей и животных Y. pestis может сохраняться довольно продолжительное время (что, опять же, зависит от температуры и наличия других бактерий), но обычно не больше месяца. В крови больных животных возбудитель чумы сохраняется до 260 суток, а в замороженных человеческих трупах — 4–5 месяцев [23]. В отличие от B. anthracis, Y. pestis не образует споры.
Clostridium botulinum, возбудитель ботулизма, во многом похож на B. anthracis: это тоже грамположительная спорообразующая бактерия, обитающая в почве. В чем-то C. botulinum даже более устойчив: он выдерживает кипячение до 6 часов, тогда как B. anthracis — только 10 минут. Ботулинический токсин — самый сильный из всех биологических ядов, однако для его продуцирования нужны строго анаэробные условия, а возбудитель сибирской язвы может существовать в любой среде [8].
Читайте также:

