Вирус пожирающий клетки бактерий это
Обновлено: 18.04.2024
Бактериофаги - это особый тип вируса, который отличается способностью уничтожать бактериальные клетки. Эти бактериальные вирусы могут уменьшить проблемы, связанные с лечением инфекций с помощью устойчивых к антибиотикам бактерий.
Бактериофаги (фаги) представляют собой исключительно разнообразную группу вирусов, которые особенно используются в медицине. Они используются, среди прочего для лечения бактериальных инфекций, вызванных микробами, устойчивыми к применению антибиотиков. В 1921 году бактериофаги впервые были использованы для лечения больных, инфицированных стафилококком.
Бактериофаги - что это
Мало кто слышал о бактериофагах, хотя их открытие было чрезвычайно ценным для медицины и в будущем может спасти нас от последствий, связанных с чрезмерным использованием антибиотиков. Бактериофаги - это специфические вирусы, атакующие бактерии, которые могут стать альтернативой антибактериальной терапии. Открытие бактериофагов сделали два ученых - в 1915 году в Англии и в 1917 году во Франции. Хотя первооткрыватели бактериальных вирусов не проводили совместных исследований, они в равной степени способствовали прорыву в микробиологии, которым, несомненно, стало открытие фагов.
Бактериофаги - это вирусы с относительно разнообразной структурой, которые могут содержать одноцепочечный или двухцепочечный ДНК или генетический материал РНК, окруженные белково-жировым или белковым капсидом. К настоящему времени открыто и описано 13 семейств бактериофагов. В их разделении учитываются лизогенные и литические бактериофаги, которые различаются вирулентностью. Проще говоря, лизогенные бактериофаги характеризуются умеренной и легкой вирулентностью, а литические бактериофаги классифицируются как вирулентная группа микроорганизмов.
Бактериофаги в медицине
Как уже упоминалось, бактериофаги впервые были использованы в лечении человека в 1921 году для лечения стафилококковых инфекций кожи. Позже эти вирусы много раз использовались для борьбы с бактериями, в том числе с дизентерия. Исследованию бактериофагов препятствовало изобретение антибиотиков, которые эффективно и быстро боролись с бактериальными инфекциями. После изобретения пенициллина в 1928 году исследования бактериофагов постепенно ограничивались.
Бактериофаги – это вирусы, которые поражают только бактерий. В ходе инфекции они влияют на все процессы жизнедеятельности бактериальной клетки, фактически превращая ее в фабрику по производству вирусного потомства. В конце концов клетка разрушается, а вновь образованные вирусные частицы выходят наружу и могут заражать новые бактерии.
Несмотря на огромное число и разнообразие природных фагов, встречаемся мы с ними редко. Однако бывают ситуации, когда деятельность этих вирусов не остается незамеченной. Например, на предприятиях, где производят сыры, йогурты и другие молочно-кислые продукты, часто приходится сталкиваться с вирусной атакой на бактерии, сбраживающие молоко. В большинстве таких случаев фаговая инфекция распространяется молниеносно, и полезные бактерии гибнут, что приводит к значительным экономическим потерям (Neve et al., 1994).
Именно благодаря прикладным исследованиям в интересах молочной промышленности, направленным на получение устойчивых к бактериофагам штаммов молочно-кислых бактерий, был открыт ряд механизмов, с помощью которых бактерии избегают инфекции. Параллельно были изучены способы, с помощью которых вирусы, в свою очередь, преодолевают бактериальные системы защиты (Moineau et al., 1993).
Кто защищен – тот вооружен
На сегодня известно пять основных, весьма хитроумных механизмов защиты, которые бактерии выработали в непрестанной борьбе с вирусами: изменение рецептора на поверхности клетки; исключение суперинфекции; системы абортивной инфекции; системы рестрикции-модификации и, наконец, системы CRISPR-Cas.
К средствам противовирусной защиты бактерий относятся и системы рестрикции-модификации, в которые входят гены, кодирующие два белка-фермента – рестриктазу и метилазу. Рестриктаза узнает определенные последовательности ДНК длиной 4—6 нуклеотидов и вносит в них двуцепочечные разрывы. Метилаза, напротив, ковалентно модифицирует эти последовательности, добавляя к отдельным нуклеотидным основаниям метильные группы, что предотвращает их узнавание рестриктазой.
Врага нужно знать в лицо
Системы CRISPR-Cas являются уникальным примером адаптивного иммунитета бактерий. При проникновении в клетку ДНК фага специальные белки Cas встраивают фрагменты вирусной ДНК длиной 25—40 нуклеотидов в определенный участок генома бактерии (Barrangou et al., 2007). Такие фрагменты называются спейсерами (от англ. spacer – промежуток), участок, где происходит встраивание, – CRISPR-кассета (от англ. Clustered Regularly Interspaced Short Palindromic Repeats), а сам процесс приобретения спейсеров – адаптацией.
Чтобы использовать спейсеры в борьбе с фаговой инфекцией, в клетке должен происходить еще один процесс, управляемый белками Cas, названный интерференцией. Суть его в том, что в ходе транскрипции CRISPR-кассеты образуется длинная молекула РНК, которая разрезается белками Cas на короткие фрагменты – защитные криспрРНК (крРНК), каждая из которых содержит один спейсер. Белки Cas вместе с молекулой крРНК образуют эффекторный комплекс, который сканирует всю ДНК клетки на наличие последовательностей, идентичных спейсеру (протоспейсеров). Найденные протоспейсеры расщепляются белками Cas (Westra et al., 2012; Jinek et al., 2012).
Системы CRISPR-Cas обнаружены у большинства прокариот – бактерий и архей. Хотя общий принцип действия всех известных систем CRISPR-Cas одинаков, механизмы их работы могут существенно отличаться в деталях. Наибольшие различия проявляются в строении и функционировании эффекторного комплекса, в связи с чем системы CRISPR-Cas делят на несколько типов. На сегодняшний день описаны шесть типов таких неродственных друг другу систем (Makarova et al., 2015; Shmakov et al., 2015).

Наиболее изученной является система CRISPR-Cas I типа, которой обладает излюбленный объект молекулярно-биологических исследований – бактерия кишечная палочка (Esсherichia coli). Эффекторный комплекс в этой системе состоит из нескольких небольших белков Cas, каждый из которых отвечает за разные функции: разрезание длинной некодирующей CRISPR РНК, связывание коротких крРНК, поиск, а затем разрезание ДНК-мишени.
Гонка вооружений
Бактериофаги, как факторы среды, вызывают направленные изменения в геноме бактерий, которые наследуются и дают бактериям явное преимущество, спасая от повторных инфекций. Поэтому системы CRISPR-Cas можно считать примером ламарковской эволюции, при которой происходит наследование благоприобретенных признаков (Koonin et al., 2009)
Некоторые бактериофаги реагируют на наличие в бактериальной клетке систем CRISPR-Cas выработкой особых анти CRISPR-белков, способных связываться с белками Cas и блокировать их функции (Bondy-Denomy et al., 2015). Еще одно ухищрение — обмен участков генома вируса, на которые нацелена система CRISPR-Cas, на участки геномов родственных вирусов, отличающихся по составу нуклеотидной последовательности (Paez-Espino et al., 2015).

Благодаря постоянному совершенствованию биоинформатических алгоритмов поиска, а также включению в анализ все большего количества прокариотических геномов, открытие новых типов CRISPR-Cas систем является делом недалекого будущего. Предстоит также выяснить и детальные механизмы работы многих недавно открытых систем. Так, в статье, опубликованной в 2016 г. в журнале Science и посвященной анализу системы CRISPR-Cas VI типа, описан белок С2с2, образующий эффекторный комплекс с крРНК, который нацелен на деградацию не ДНК, а РНК (Abudayyeh et al., 2016). В будущем такое необычное свойство может быть использовано в медицине для регулирования активности генов путем изменения количества кодируемых ими РНК.
Изучение стратегий борьбы бактерий с бактериофагами, несмотря на свою кажущуюся фундаментальность и отвлеченность от задач практической медицины, принесло неоценимую пользу человечеству. Примерами этого могут служить методы молекулярного клонирования и редактирования геномов – направленного внесения или удаления мутаций и изменения уровня транскрипции определенных генов.
Благодаря быстрому развитию методов молекулярной биологии всего лишь через несколько лет после открытия механизма действия систем CRISPR-Cas была создана работающая технология геномного редактирования, способная бороться с болезнями, ранее считавшимися неизлечимыми. Доступность и простота этой технологии позволяют рассматривать ее как основу для медицины, ветеринарии, сельского хозяйства и биотехнологий будущего, которые будут базироваться на направленных и безопасных генных модификациях.
Нет никаких сомнений, что дальнейшее изучение взаимодействия бактерий и их вирусов может открыть перед нами такие возможности, о которых мы сейчас даже не подозреваем.
Abudayyeh O. O., Gootenberg J. S., Konermann S. et al. C 2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector // Science. 2016. V. 353: aaf5573.
Barrangou R., Fremaux C., Deveau H. et al. CRISPR provides acquired resistance against viruses in prokaryotes // Science. 2007. V. 315. P. 1709–1712.
Bikard D., Marraffini L. A. Innate and adaptive immunity in bacteria: mechanisms of programmed genetic variation to fight bacteriophages // Curr. Opin. Immunol. 2012. V. 1 P. 15–20.
Bondy-Denomy J., Garcia B., Strum S. et al. Multiple mechanisms for CRISPR-Cas inhibition by anti-CRISPR proteins // Nature. 2015. V. 526. P. 136–139.
Calendar R., Abedon S. T. The Bacteriophages // 2nd Ed., Oxford University Press. 2006.
Datsenko K. A., Pougach K., Tikhonov A. et al. Molecular memory of prior infections activates the CRISPR/Cas adaptive bacterial immunity system // Nat. Commun. 2012. V. 3. P. 945
Jiang W., Marraffini L. A. CRISPR-Cas: New Tools for Genetic Manipulations from Bacterial Immunity Systems // Annu. Rev. Microbiol. 2015. V. 69. P. 209–28.
Jinek M., Chylinski K., Fonfara I., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity // Science. 2012. V. 337. P. 816–821.
Koonin E. V., Wolf Y. I. Is evolution Darwinian or/and Lamarckian? // Biol. Direct. 2009. V. 4. P. 42.
Lopez-Pascua L., Buckling A. Increasing productivity accelerates host-parasite coevolution // J. Evol. Biol. 2008. V. 3. P. 853–860.
Makarova K. S., Wolf Y. I., et al. An updated evolutionary classification of CRISPR-Cas systems // Nat. Rev. Microbiol. 2015. V. 11. P. 722–736.
Moineau, S., Pandian S., Klaenhammer T. R. Restriction/modification systems and restriction endonucleases are more effective on lactococcal bacteriophages that have emerged recently in the dairy industry // Appl. Envir. Microbiol. 1993. V. 59. P. 197–202.
Neve H., Kemper U., et al. Monitoring and characterization of lactococcal bacteriophage in a dairy plant // Kiel. Milckwirtsch. Forschungsber. 1994. V. 46. P. 167–178.
Nuñez J. K., Harrington L. B., et al. Foreign DNA capture during CRISPR-Cas adaptive immunity // Nature. 2015a. V. 527. P. 535–538.
Nuñez J. K., Kranzusch P. J., et al. Cas1-Cas2 complex formation mediates spacer acquisition during CRISPR-Cas adaptive immunity // Nat. Struct. Mol. Biol. 2014. V. 21. P. 528–534.
Nuñez J. K., Lee A. S., Engelman A., Doudna J. A. Integrase-mediated spacer acquisition during CRISPR-Cas adaptive immunity // Nature. 2015b. V. 519. P. 193–198.
Paez-Espino D., Sharon I., et al. CRISPR Immunity Drives Rapid Phage Genome Evolution in Streptococcus thermophilus // MBio. 2015. V. 6: e00262–15.
Shmakov S., Abudayyeh O. O., Makarova K. S., et al. Discovery and Functional Characterization of Diverse Class 2 CRISPR-Cas Systems. // Mol. Cell. 2015. V. 60. P. 385–397
Tan D., Svenningsen S. L., Middelboe M. Quorum sensing determines the choice of antiphage defense strategy in Vibrio anguillarum. // mBio 2015. V. 6: e00627–15.
Westra E. R., van Erp P. B., Künne T., et al. CRISPR immunity relies on the consecutive binding and degradation of negatively supercoiled invader DNA by Cascade and Cas3 // Mol. Cell. 2012. V. 46. P. 595–605.
БАКТЕРИОФАГИ КАК АЛЬТЕРНАТИВА АНТИБИОТИКАМ В ЛЕЧЕНИИ ИНФЕКЦИЙ
Бактериофаги — вирусы бактерий, естественные микроорганизмы, которые, размножаясь внутри бактериальной клетки, ведут к ее быстрой гибели.
Из истории открытия
Интересный факт: при нанесении бактериофага на влажные слизистые он за 20 минут очищает их от определенного вида бактерий, например от стафилококка. Так быстро не работает ни один антибиотик.
Действие бактериофагов отличается от действия антибиотиков:
- Для определенного вида бактерий существует свой определенный бактериофаг. Но стоит отметить, что не ко всем бактериям есть бактериофаги (это основной недостаток этих препаратов). Для решения вопроса, какую терапию выбрать для лечения инфекции, врач должен сначала взять материал для посева на флору с точным определением вида возбудителя и только после получения анализа на чувствительность микроорганизма к бактериофагам выбрать препарат.
- Бактериофаги не действуют на нормофлору (нормальные бактерии), поэтому лечение бактериофагами экологично и не требует коррекции нормофлоры.
- Бактериофаги не влияют на организм человека, поскольку не способны проникнуть в клетки человека. Поэтому бактериофаги не токсичны и не вызывают побочных эффектов.
- После уничтожения патогена элиминируются (самовыводятся) из организма.
- Бактериофаги просты в применении: большинство их производится в жидком виде. Доступно наружное орошение при местном применении, полоскании, в виде микроклизм при кишечных инфекциях. Но действуют бактериофаги только местно, то есть именно там, где вы их применяете при полоскании, орошении и закапывании. В отличие от антибиотиков, которые при приеме внутрь распределяются по организму и действуют во всех органах и тканях.
- Бактериофаги стимулируют местный иммунитет, так как частицы уничтоженных бактерий побуждают иммунную систему к выработке специфических антител. Из-за этого свойства бактериофаги являются препаратом выбора в лечении бактерионосительства (например, стафилококконосительства) и хронических форм бактериальных инфекций.
- Сочетаются с другими препаратами, в том числе с антибиотиками. Их совместное применение ведет к быстрому выздоровлению от бактериальной инфекции.
- По совокупности описанных свойств бактериофаги применимы как основной препарат для лечения бактериальных инфекций у беременных, детей с рождения и людей пожилого возраста, а также в тех случаях, когда имеется полирезистентность микроорганизма к антибиотикам.
В лаборатории KDL предлагается 2 варианта посевов на флору с определением чувствительности выделенной культуры микроорганизма к препаратам бактериофагов и разным наборам антибиотиков в зависимости от ситуации пациента (выбирает врач), например:
Какие инфекции можно лечить бактериофагами:
- кожные, ожоговые и раневые инфекции;
- инфекции ЛОР органов;
- инфекции урогенитального тракта;
- отдельные инфекции желудочно-кишечного тракта.
Возбудителями этих инфекций могут быть такие бактерии, как золотистый стафилококк, синегнойная палочка, патогенные формы кишечной палочки, сальмонеллы, стрептококки.
В Новосибирском научном центре технологии персонализированного лечения бактериофагами в большой коллекции бактериофагов есть уникальные штаммы, способные бороться с недавно появившимися и уже получившими широкое распространение возбудителями больничных инфекций, такими как грамотрицательные бактерии Acinetobacter baumanii, Stenotrophomonas maltophilia и др.
Последние годы ознаменовались широкими исследованиями бактериофагов из-за нарастающей проблемы антибиотикорезистентности микроорганизмов, которые находят всё новые применения не только в терапии и профилактике, но и в биотехнологиях. Их очевидным практическим результатом должно стать возникновение нового мощного направления персонализированной медицины, а также создание целого спектра технологий в пищевой промышленности, ветеринарии, сельском хозяйстве и в производстве современных материалов. Мы ждем, что второе столетие исследований бактериофагов принесет не меньше открытий, чем первое.
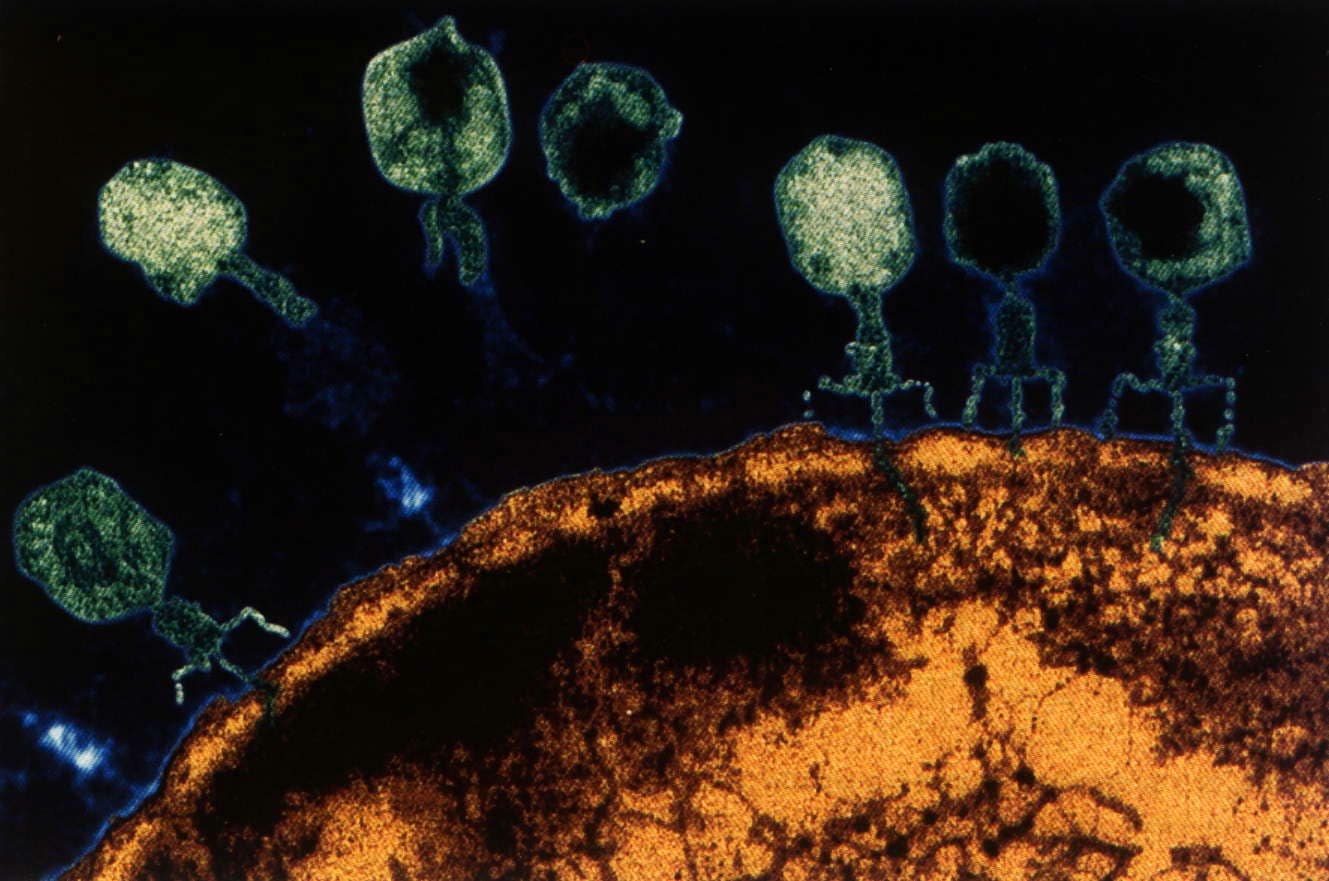
Фотография бактериофага под микроскопом / ©Getty images
С первой статьей цикла о бактериофагах можно ознакомится здесь. Надо сказать, что наша заинтересованность этими крошечными, но полезными вирусами не случайна – в последнее время к ним проявляют все больший интерес не только представители российского, но и мирового медицинского сообщества.
Ведь препараты на их основе могут стать альтернативой антибиотикам в лечении инфекций. Все потому, что бактериофаги способны размножаться только в присутствии определенного вида болезнетворных бактерий, не уничтожая при этом полезные микроорганизмы, что помогает справляться с заболеванием, сохраняя естественную микрофлору организма.
В нашем мире бактериофаги присутствуют повсюду — в океане, почве, глубоководных источниках, питьевой воде, пище и, конечно, в теле человека. И несмотря на то, медицина накопила большую доказательную базу об эффективности и безопасности применения бактериофагов в качестве антибактериальных средств, ученые все равно задаются вопросом: могут ли эти вирусы влиять непосредственно на организм человека?
Сегодня в разных странах мира уже начали проводить такие фундаментальные исследования. Первые их результаты оказались очень интересными: в частности, бактериофаги, возможно, способны оказывать иммуномодулирующий и противовоспалительный эффекты на организм. Но на данном этапе развития этих исследований необходимо признать, что делать выводы о возможности применения этих эффектов в медицине пока рано.
По оценкам ученых, около 30 миллиардов фагов ежедневно мигрируют из кишечника в ткани. И даже в самой защищенной среде нашего организма – спинномозговой жидкости – тоже присутствуют эти вирусы. Что они делают в крови и нервной системе? Ученые осторожно предполагают, что бактериофаги помогают бороться с опасными микроорганизмами, влияют на работу иммунитета и обмен веществ.

Эти соображения отчасти подтверждаются и на практике. Например, в 2007 году были опубликованы результаты исследования, во время которого пациентам с хроническим гнойным воспалением в полости носа и придаточных пазух в пазухи вводили препарат бактериофагов. Выяснилось, что это помогло фагоцитам более успешно пожирать бактерии и доводить этот процесс до конца.
Кроме того, фаги активировали нейтрофилы – одну из разновидностей лейкоцитов. Известно, что эти вирусы помогают предотвращать рецидивы заболеваний ЛОР-органов и не допускать их перехода в хроническую форму. Несмотря на некоторые положительные выводы о влиянии фагов на иммунитет, этот вопрос требует дальнейшего изучения.
Борцы с воспалением
Воспаление – защитная функция организма, и она обеспечивается врожденным иммунитетом. Но иногда воспалительный процесс бывает настолько сильным и длительным, что от него больше вреда. И с этой проблемой, как показывают отдельные исследования, могут помочь бактериофаги.

Зато противовоспалительное действие может быть весьма выражено. В частности, высказываются предположения о том, что фаги могут обладать защитным потенциалом, не только уничтожая патогены, но и подавляя местные иммунные и воспалительные реакции в кишечнике, тем самым способствуя поддержанию иммунного гомеостаза (поддержание иммунной системы в оптимальных физиологических условиях). Это помогает избежать ненужного повреждения тканей и ускорить борьбу с инфекцией.
Ввиду специфического и довольно сложного механизма действия, бактериофаги, конечно, нельзя рассматривать как замену более действенным таблеткам аспирина или ибупрофена. Но об их противовоспалительном потенциале полезно знать.
Вирусы против вирусов
Важно также помнить и о таком явлении, как вторичная бактериальная инфекция. Например, летальные исходы от Covid-19 зачастую происходили от присоединившейся к инфекции бактериальной пневмонии. Для противодействия такому трагическому развитию болезни американское агентство FDA одобрило применение фаготерапии.
Вполне возможно, что полезные свойства бактериофагов не ограничиваются перечисленными в этой статье. Фаготерапия обладает большим перспективами, и чтобы раскрыть его в полной мере, требуется работа вирусологов, биологов, генетиков, врачей, других специалистов.

В Биологическом ресурсном центре объединены в единую функционирующую структуру банк фагов (коллекция охарактеризованных бактериофагов с расшифрованным геномом), молекулярно-генетическая лаборатория и блок селекции. Сегодня ученые могут фотографировать бактериофаги, изучать их биологические свойства и расшифровывать генетический материал, что позволяет быстрее и полнее исследовать природу бактериальных вирусов и ее влияние на организм человека.
Читайте также:

