Вирус простуды от рака
Обновлено: 23.04.2024
Инфекции у больных раком при подавлении иммунитета
Инфекции — главные причины смерти при раке. Они не только часто встречаются, но нередко имеют более тяжелое течение, чем у других пациентов, менее подверженных действию терапии, и иногда вызываются организмами, которые не патогенны для здоровых людей. Такая восприимчивость является следствием подавления защитных механизмов больного, вызванного опухолью и ее лечением.
Кожа и слизистые оболочки служат барьером для инфекции. Опухолевая инфильтрация и местная лучевая радиотерапия могут привести к повреждению лимфатических или венозных сосудов, что приводит к увеличению восприимчивости к локальной инфекции. Воспроизводство эпителиальных клеток в желудочно-кишечном тракте подавляется химиотерапией, из-за чего повреждается и изъязвляется слизистая, что позволяет организмам из кишечника попасть в систему воротной вены.
Кожа повреждается внутривенными иглами и канюлями, особенно туннельными подкожными каналами. Это частые источники инфекции, которые вызываются такими кожными организмами, как Staphylococcus epidermidis. В носоглоточной полости возникают инфекции, вызванные Candida albicans.
Рак при запущенной стадии иногда связан с ухудшением функций и нейтрофилов, и моноцитов. Было описано подавление хемотаксической, фагоцитарной и бактерицидной активностей.
Ослабленная замедленная гиперчувствительность довольно распространена при запущенной болезни Ходжкина, но менее часта в других случаях злокачественных опухолей. Лимфопения неизменно вызывается действием алкилирующих агентов и массивной радиотерапией. Клеточный иммунитет особенно важен при защите организма хозяина от грибов, вирусов, туберкулеза и простейших.
Интенсивная цитотоксическая химиотерапия ведет к ухудшению образования антител к бактериальным и вирусным антигенам.
Циркулирующие бактерии удаляются фагоцитарными клетками, находящимися в синусах ретикулоэндотелиальной системы, особенно в печени и селезенке. Для этой чистки важны антитела и белки системы комплемента. Спленэкто-мия увеличивает риск серьезной бактериальной инфекции, особенно пневмококковый сепсис в детском возрасте и в меньшей степени во взрослом.
Возбудители сепсиса
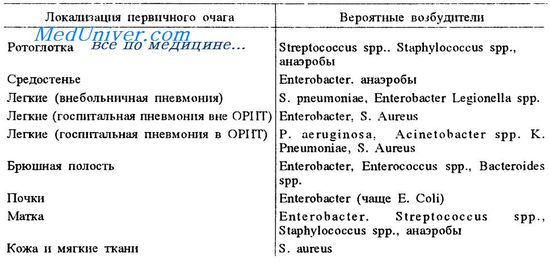
Бактериемия и септицемия у больных раком
Инфекции кровяного русла довольно часты у пациентов с гранулоцитопенией. Патогенами часто являются грамотрицательные бактерии (Escherichia coli, Pseudomonas aeruginosa), стафилококки и стрептококки. Увеличивается частота инфекций, вызванных грамположительными бактериями, особенно Staphylococcus epidermidis. Пациенты с тунельными подкожными каналами особенно подвержены поражениям этим организмом.
Жар у пациента с нейтропенией при раке — показатель присутствия бактерий в крови и под кожей. Если существует очевидный источник инфекции, например инфицированный порт для инфузий, следует взять культуру бактерий и удалить канюлю. Лечение не следует откладываеть для пациента с нейтропенией. Пациенты с лихорадочной нейтропенией с относительно низким риском развития серьезных осложнений относятся к тем, кого лечат короткими циклами химиотерапии для солидных опухолей.
Эти пациенты должны быть госпитализированы. Недавние исследования показали, что пероральный прием амоксициллина-клавуланата комбинированный с пероральным приемом ципрофлоксацина так же эффективен, как и внутривенная химиотерапия в этой группе (70% пациентов). Пациенты с высоким риском (с неконтролируемым раком или на стационарном лечении интенсивной терапией) лечатся внутривенными антибиотиками, в том числе b-лактамом и аминогликозидом или цефтазидимом.
Респираторные инфекции у больных раком
У пациента с серьезным подавлением иммунитета довольно часто возникает жар с легочным инфильтратом. Главные причины этого даны в таблице.
Осложнения в постановке диагноза могут быть значительны, поскольку тесты слюнных и кровеносных культур иногда отрицательны, а более инвазивные процедуры, такие как трансбронхиальная биопсия, невозможны из-за тромбоцитопении или общего состояния пациента.
Существуют некоторые клинические особенности, которые помогают при постановке диагноза. Кавитация наиболее часто сопровождает поражения анаэробными бактериями, стафилококками и микобактериями. Инфекции Pneumocystis вызывают заметную одышку, а на рентгенограмме грудной клетки видны билатеральные инфильтраты, обычно состоящие из хилуса. Болезнь, однако, может протекать вяло и вызвать долевое уплотнение. Цитомегаловирусные инфекции встречаются главным образом у пациентов с серьезным подавлением иммунитета, в частности в течение аллогенной ВМТ. Болезнь может также вызывать миокардит, невропатию или офтальмию.
Легочные инфильтраты обычно билатеральны. Инфекции Candida вызывают широкое разнообразие изменений в рентгенограмме. Инфекции Aspergillus обычно быстро прогрессируют. Тесты культур крови обычно отрицательны, а инфильтраты возможны в одном или двух легких.
При затруднениях в постановке диагноза можно следовать следующей схеме.
У пациентов без нейтропении или тромбоцитопении исследовать посевы крови, слюны, бронхоскопические промывания и трансбронхиальную биопсию там, где это возможно. Если кровяные и слюнные культуры отрицательны, лечить антибиотиками широкого антибактериального спектра действия (обычно в комбинации с аминогликозидом, пенициллином и метронидазолом или аналогичными соединениями). Если возможной причиной инфекции является Pneumocystis, следует давать высокие дозы котримоксазола. Если ответа нет, рассмотрите ацикловир для вируса простого герпеса и противогрибковую терапию с амфотерицином или кетоконазолом. Ацикловир не эффективен против цитомегаловирусов.
Если кровяные или слюнные тесты положительны, лечите соответствующе, но если ответа нет, рассмотрите смешанные инфекции.
Пациентам с нейтропенией или тромбоцитопенией проводят бронхоскопию, но биопсия не всегда возможна, и лечение продолжают без дальнейшего диагностического исследования. До и после бронхоскопии иногда необходимы антибиотики и переливание тромбоцитов.

Инфекции мочевыводящих путей у больных раком
Инфекции часты у пациентов с затрудненным мочеиспусканием. Затруднения могут быть вызваны опухолью или ослаблением мочевого пузыря у пациентов с компрессией спинного мозга и его корешков. Диагноз ставится после исследования уринокультуры, и лечение осуществляется антибиотиками и снятием осложнений, если это возможно.
Желудочно-кишечные инфекции у больных раком
Молочница ротовой полости (инфекция, вызываемая Candida albicans) — частое осложнение химиотерапии. Она особенно распространена у пациентов с подавленным иммунитетом, у пациентов, принимающих стероиды и тех, кого лечат антибиотиками с широким спектром действия. Рот и глотка становятся очень болезненными, а белые пятна грибков видны на эри-темной основе. У плохо питающихся пациентов инфекция может проникать глубже и распространяться по пищеводу, желудку и кишечнику. Обычно эффективен пероральный прием нистатина, амфотерицина или миконазола.
Проявление вируса простого герпеса на губах часто проблематично для пациентов с лейкопенией, и повреждения могут быть довольно обширными. В данном случае необходимо местное применение ацикловира для пациентов с подавленным иммунитетом или систематический прием ацикловира при более серьезных инфекциях.
Инфекции, вызванные Candida в пищеводе, необходимо лечить пероральным приемом суспензии нистатина, но если такое лечение неэффективно, то необходимо применение кетоко-назола или короткий курс амфотерицина. Кишечные инфекции, возникающие при поражении Candida, должны лечиться амфотерицином.
Перианальные инфекции распространены среди пациентов с нейтропенией. Всегда необходимо применять профилактические меры совместно с тщательной гигиеной промежности и смягчителями стула для предотвращения запора и анальных трещин. Распространяющиеся перинеальные (паховые) инфекции могут угрожать жизни пациента, и требуется срочное лечение внутривенными антибиотиками, действующими против грамотрицательных и анаэробных бацилл.
Менингит у больных раком
Инфекции центральной нервной системы (ЦНС) довольно редки, но у пациентов с лимфомой или лейкемией иногда развивается менингит из-за Cryptococcus neoformans. Начало заболевания индивидуально у каждого и сопровождается головной болью. Микроорганизм обнаруживают при окрашивании India ink спинномозговой жидкости (CSF).
Выявление антигенов Cryptococcus в крови и CSF возможно у большинства пациентов. Состояние многих пациентов улучшается при приеме амфотерицина, некоторые вылечиваются.
Кожные инфекции у больных раком
В отличие от инфекции, представленной на портах для вливания, наиболее частое кожное заболевание — опоясывающий лишай (varicella zoster). Возникает из-за реактивации вируса varicella zoster в ганглии дорсального корешка, вызывает кожную пузырчатую сыпь, которая особенно серьезна у людей с подорванным иммунитетом, может распространяться как ветряная оспа и вызывать фатальную пневмонию. Пациентов следует лечить ацикловиром как можно быстрее.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Больные, находящиеся на лечении по поводу злокачественных новообразований, за счет измененного иммунного статуса подвержены простудным заболеваниям, которые в свою очередь еще больше истощают защитные силы организма и затрудняют терапию основного диагноза
ОРВИ при злокачественных новообразованиях: риски и сложности терапии
Острые респираторные вирусные инфекции (ОРВИ), в том числе и грипп, составляющие основную долю инфекционной патологии населения всех возрастов, представляют существенную угрозу пациентам из групп риска: пожилым, беременным, детям младшего возраста и пациентам с хроническими заболеваниями, в том числе онкологическими.
Больные, находящиеся на лечении по поводу злокачественных новообразований, за счет измененного иммунного статуса подвержены простудным заболеваниям, которые в свою очередь еще больше истощают защитные силы организма и затрудняют терапию основного диагноза.
При ОРВИ на фоне онкологического процесса лечащий врач сталкивается со следующими трудностями:
- Длительность ОРВИ у иммунокомпрометированных пациентов может достигать нескольких недель, в течение которых состояние больных значительно ухудшается, и не только по иммунным показателям.
- Инфекционный процесс заставляет откладывать очередной курс химиотерапии, что сильно сказывается на прогнозе.
- Назначение противовирусной терапии может вызвать осложнения, а в частности лекарственную гепатотоксичность, так как ее эффект накладывается на гепатотоксичное действие фармакотерапии злокачественного заболевания 1 .
Таким образом, можно сказать, что необходимость в профилактике и терапии ОРВИ у онкологических пациентов неоспорима, но последнее упомянутое обстоятельство резко ограничивает выбор конкретного средства.
Варианты противовирусной терапии
Вирус-специфические препараты римантадин, занамивир и осельтамивир доказали свою эффективность, которая распространяется однако только на вирус гриппа. Кроме того, эти средства имеют ряд противопоказаний, которые зачастую делают невозможным их применение у онкологических пациентов.
В случае назначения средств, действующих на определенные вирусные белки, следует учитывать также проблему резистентности, которую вырабатывают к ним вирусы 2 . Так, появились данные о повышении до 18% частоты устойчивости вирусов гриппа А (H3N2) к осельтамивиру среди детей, получавших данный препарат для лечения гриппа 3 .
В связи с вышесказанным сегодня как никогда высока потребность в противовирусных препаратах, действующих не на инфекционный агент, а на иммунные защитные механизмы.
Оптимальное противовирусное средство, которое может быть рекомендовано для онкологической практики, должно:
- не вызывать резистентности, вероятно вследствие отличного механизма действия;
- быть безопасным, в частности при длительном применении;
- иметь минимальный риск побочных эффектов при лекарственном взаимодействии.
Перспективы использования иммуномодуляторов
Указанным критериям в полной мере соответствуют иммуномодулирующие средства, благодаря чему интерес к ним клиницистов-онкологов в последние годы резко возрос.
Иммуномодуляторы – это лекарственные средства, которые обладают иммунотропной активностью и в терапевтических дозах восстанавливают эффективную иммунную защиту. Растущая опухоль вызывает существенные изменения в иммунном ответе, а проводимая химио- и лучевая терапия, а также любые оперативные вмешательства вызывают или усугубляют иммунную недостаточность 4 . Поэтому использование иммуномодуляторов, в частности для лечения сопутствующих инфекций, является оправданным.
Эргоферон: элегантное решение непростого вопроса
Главной особенностью релиз-активных препаратов является способность воздействовать на биологически активные молекулы мишени (эндогенные регуляторы), модифицируя их физико-химические свойства. Эффект проявляется не только на молекулярном, но и на клеточном, органном, системном и организменном уровнях.
Так, прием Эргоферона усиливает функциональную активность макрофагов, натуральных киллеров и ИФН при помощи релиз-активных антител к ИФН-γ и CD4+. На этапе цитотоксических клеточных реакций CD8+ и CD4+ Т-лимфоцитов Эргоферон поддерживает противовирусный иммунитет при участии компонента релиз-активных антител к CD4+. На более поздних этапах релиз-активные антитела к CD4+ через стимуляцию рецепторов CD4 Тх2 поддерживают гуморальный противовирусный иммунитет.
Третий компонент Эргоферона – релиз-активные антитела к гистамину – обеспечивает противовоспалительный и антигистаминный эффекты, которые проявляются уменьшением длительности и выраженности катаральных симптомов и аллергических реакций, сопутствующих инфекционному процессу 7 . Это является важным преимуществом Эргоферона перед другими противовирусными препаратами, так как позволяет снизить потребление других средств и нивелировать риск лекарственного взаимодействия при параллельно проводящейся противоопухолевой терапии.
Клинический опыт
Эргоферон применяется в клинической практике с 2011 года, и его эффективность была доказана в ходе рандомизированных клинических исследований. На данный момент завершено 3 клинических исследования и продолжаются еще 4.
Исследований по лечению ОРВИ именно у онкологических больных не проводилось. Однако в клинической практике накоплен опыт назначения Эргоферона госпитализированным больным с солидными опухолями (Шаповалова Ю.С). Учитывая актуальность проблемы отсрочек курсов химиотерапии и продления сроков госпитализации, в 2012 г. был разработан внутрибольничный протокол лечения ОРВИ у госпитализированных пациентов с солидными злокачественными новообразованиями. В него включены следующие противовирусные препараты: для лечения гриппа – ингибиторы нейраминидазы занамивир и осельтамивир, а также римантадин, умифеновир и Эргоферон; для лечения ОРВИ – умифеновир и Эргоферон. Эргоферон применялся в виде монотерапии (37 пациентов) или в комбинации с римантадином (14 пациентов) в течение первых 48 часов от начала проявления симптомов заболевания. Все пациенты выздоровели через 5-9 дней лечения; нежелательных реакций, связанных с изучаемой терапией, отмечено не было. Учитывая благоприятный профиль переносимости Эргоферона и отсутствие гепатотоксичности, его применение может быть востребовано для лечения ОРВИ у пациентов онкологического профиля, в том числе находящихся в процессе химиотерапии.
Следует также отметить, что согласно экспериментам использование релиз-активных антител к ИФН-γ не приводит к гиперпродукции ИФН-γ. Этот факт немаловажен в свете недавних исследований, показавших, что ИФН-γ в больших дозах может приводить к увеличению метастазирования в легкие и резистентности клеток меланомы к терапии 11 .
Учитывая безопасность Эргоферона, доказанную в исследованиях высокого методологического качества, можно сделать вывод, что препарат стоит рекомендовать для лечения ОРВИ у пациентов со злокачественными новообразованиями 12 .
Выводы
Как доказали результаты экспериментальных и клинических исследований Эргоферон является перспективным противовирусным препаратом с принципиально новым механизмом и мишенями воздействия, и он может помочь решить проблему лечения больных в условиях изменчивости антигенных свойств вирусов и исходно скомпрометированного иммунного статуса. Комплексный препарат, сочетающий противовирусное, иммуномодулирующее, противовоспалительное и антигистаминное действие, оказывает выраженный терапевтический эффект при ОРВИ у пациентов с онкологической патологией. Препарат имеет благоприятный профиль безопасности, и его назначение позволяет снизить лекарственную нагрузку и риск лекарственного взаимодействия с противоопухолевыми препаратами.
2 Heaton NS et al. Genome-wide mutagenesis of influenza virus reveals unique plasticity of the hemagglutinin and NS1 proteins. Proc Natl Acad Sci USA 2013; 25.
3 Антимикробная терапия по Джею Сэнфорду. Под ред. Д.Гилберта, Р.Меллеринга мл., Дж.Элиопулоса и др. М.: ГРАНАТ, 2013.
5 Сыроешкин А.В., Никифорова М.В., Колдина А.М., Горнак А.А., Тарабрина И.В. Лекарственные препараты на основе релиз-активных антител. Справочник поликлинического врача. 2018 (3):15-20
6 Эпштейн О.И. Сверхмалые дозы (история одного исследования). М.: Изд-во РАМН, 2008.
7 Жавберт Е.С., Дугина Ю.Л., Эпштейн О.И. Противовоспалительные и противоаллергические свойства антител к гистамину в релиз-активной форме: обзор экспериментальных и клинических исследований. Детские инфекции. 2014; 1: 40-3.
8 Архивъ внутренней медицины. 2013; 14 (6): 46.
9 Шиловский И.П., Корнилаева Г. В., Хаитов М.Р. Новые возможности в терапии респираторно-синцитиальной вирусной инфекции: данные доклинического исследования препарата Эргоферон. Иммунология. 2012; 33 (3): 144-8.
11 Taniguchi K, Petersson M, Höglund P et al. Interferon gamma induces lung colonization by intravenously inoculated B16 melanoma cells in parallel with enhanced expression of class I major histocompatibility complex antigens. Proc Natl Acad Sci USA 1987; 84 (10): 3405-9.
Острые респираторные инфекции (ОРВИ) являются наиболее распространенными среди всех инфекционных заболеваний. На долю ОРВИ, а также гриппа приходится не менее 70% инфекционных заболеваний. В России ежегодно регистрируется около
Острые респираторные инфекции (ОРВИ) являются наиболее распространенными среди всех инфекционных заболеваний. На долю ОРВИ, а также гриппа приходится не менее 70% инфекционных заболеваний. В России ежегодно регистрируется около 50 млн инфекционных заболеваний, из которых до 90% случаев приходится на ОРВИ и грипп.
Почти 90% населения как минимум один раз в году переносят одну из респираторных инфекций вирусной этиологии, что в целом предопределяет высокую заболеваемость и даже влияет на показатель смертности [2].
Столь высокая частота заболеваний респираторного тракта объясняется многообразием этиологических факторов (вирусы гриппа, парагриппа, аденовирусы, риновирусы, реовирусы, респираторно-синцитиальные (РС) вирусы, микоплазмы, хламидии, бактериальные агенты), а также легкостью передачи возбудителя и высокой изменчивостью вирусов.
Дифференциальная диагностика гриппа и ОРВИ затруднена из-за сходства клинической картины этих заболеваний, но вполне возможна. Основными отличиями можно считать начальные признаки заболевания, симптомы интоксикации, характер катаральных явлений и лихорадки, тип развивающихся осложнений и др. Клинический диагноз, подтвержденный данными лабораторных анализов, и определяет выбор терапии.
Клиническая картина ОРВИ и гриппа зависит от вируса-возбудителя (см. таблицу).
Следует отметить, что осложнения при ОРВИ, особенно в период эпидемии, регистрируются в 20–30% случаев. Основными причинами осложнений являются нарушения иммунной защиты, приводящие к длительной недостаточности в работе иммунной системы. Снижение антибактериальной резистентности организма приводит к затяжным периодам реконвалесценции и обусловливает возможность осложнений в течение длительного времени. Особое место среди осложнений занимает так называемый синдром послевирусной астении (СПА), который может развиваться у 65% больных в течение 1 мес от начала заболевания. Ведущими симптомами СПА являются усталость, эмоциональные нарушения и различные психические расстройства.
Круг препаратов, используемых при лечении ОРВИ и гриппа, широк и разнообразен. Он включает живые и инактивированные вакцины, химиопрепараты этиотропного действия, а также средства, применяющиеся для иммунокорригирующей и патогенетической терапии.
Тем не менее течение гриппа и других ОРВИ по-прежнему плохо поддается контролю. Это связано не только с полиэтиологичностью данных заболеваний, но и с уникальной изменчивостью вирусов и глобальным характером эпидемий. Распространение ОРВИ в значительной степени зависит от экологической, социально-экономической ситуации, наличия у пациентов аллергических заболеваний и ряда других факторов.
Противовирусные препараты
Химиопрепараты
Механизм действия этой группы препаратов основан на избирательном подавлении отдельных звеньев репродукции вирусов, без нарушения жизнедеятельности клетки макроорганизма. При респираторных инфекциях используются две группы препаратов — блокаторы М2-каналов и ингибиторы нейроаминидазы, а также рибавирин, активный против РС-вируса.
Блокаторы М2-каналов
В 1961 г. был синтезирован симметричный амин — амантадин, а затем и ряд его производных (римантадин, мидантан, дейтифорин). В нашей стране получил широкое применение римантадин, который используется для лечения и профилактики гриппа, вызванного вирусом типа А. Эффективность этого средства составляет 70–90%.
Противовирусный эффект реализуется путем блокирования особых ионных каналов (М2) вируса, что сопровождается нарушением его способности проникать в клетки и высвобождать рибонуклеопротеид. Тем самым ингибируется важнейшая стадия репликации вирусов. Примерно в 30% случаев может развиваться резистентность к римантадину [6].
Римантадин выпускается в форме ремантадина в таблетках по 50 мг и сиропа для детей от 1 до 7 лет альгирем—2 мг/мл. С лечебной целью препарат назначается с момента регистрации первых симптомов. Длительность терапии не должна превышать 5 дней во избежание появления резистентных форм вируса. Профилактически римантадин необходимо принимать не менее 2 нед.
Ингибиторы нейроаминидазы
Препараты этой группы эффективны не только против вирусов гриппа типа А, но и против вирусов типа В.
Нейроаминидаза (сиалидаза) — один из ключевых ферментов, участвующих в репликации вирусов гриппа. При ингибировании нейроаминидазы нарушается способность вирусов проникать в здоровые клетки, снижается их устойчивость к защитному действию секрета дыхательных путей и таким образом тормозится дальнейшее распространение вируса в организме. Ингибиторы нейроаминидазы способны уменьшать продукцию цитокинов (ИЛ-1 и фактора некроза опухоли), препятствуя развитию местной воспалительной реакции и ослабляя такие системные проявления вирусной инфекции, как лихорадка, боли в мышцах и суставах, потеря аппетита [7].
Предварительные исследования показали, что эффективность такого ингибитора в качестве профилактического средства составляет 70–80%. Прием этих препаратов позволяет сократить длительность болезни на 1–1,5 дней (если препарат начать принимать не позднее, чем через 36–48 ч с момента появления первых симптомов). В начале заболевания и на ранних его стадиях средняя продолжительность репликации вируса сокращается в среднем на 3 дня, а число тяжелых форм ОРВИ и гриппа, характеризующихся повышенной температурой, — на 85%. Препараты не оказывают вредного воздействия на центральную нервную систему. Однако следует отметить, что далеко не всегда представляется возможность их применения в первые 48 ч: из-за сложностей, связанных с дифференциальной диагностикой гриппа и других ОРВИ.
Представителями ингибиторов нейроаминидазы являются озельтамивир и занамивир.
Озельтамивир (тамифлю) назначается по 75–150 мг 2 раза в день в течение 5 дней. Для профилактики — по 75 мг 1 или 2 раза в день в течение 4–6 нед. У пациентов с клиренсом креатинина менее 30 мл/мин доза снижается в 2 раза.
Занамивир (реленца) является структурным аналогом сиаловой кислоты — естественного субстрата нейроаминидазы вирусов гриппа — и, следовательно, обладает способностью конкурировать с ней за связывание с активным центром. Ингалируется с помощью специального устройства — дискхалера. С лечебной целью назначается по 10 мг 2 раза в день (с интервалом 12 ч) в течение 5 дней, для профилактики — по 10 мг 1 раз в день в течение 4–6 нед. Ингаляционный способ введения имеет преимущество, так как обеспечивает достаточно быстрый противовирусный эффект в зоне первичного очага инфекции.
Побочные реакции данной группы препаратов составляют не более 1,5% случаев. Чаще всего это головная боль, головокружение, тошнота, диарея, явления синусита. У пациентов с обструктивными бронхолегочными заболеваниями возможно развитие бронхоспазма.
Препараты, активные против других вирусов
Рибавирин (виразол, ребетол), действующий на многие РНК- и ДНК-содержащие вирусы, в аэрозольной лекарственной форме используется при лечении инфекций, вызванных РС-вирусом. Предполагается, что препарат ингибирует ранние этапы вирусной транскрипции, нарушая синтез рибонуклеопротеидов, информационной РНК, блокируя РНК-полимеразу. Применяется ингаляторно с помощью небулайзера только в условиях стационара.
При приеме рибавирина могут отмечаться бронхоспазм, сыпь, раздражение глаз, причем не только у пациентов, но и у медперсонала. В редких случаях наблюдаются лейкопения, бессонница, раздражительность. Существует риск кристаллизации препарата в дыхательных путях и интубационных трубках. Обладает тератогенным действием.
Перспективным противовирусным препаратом является недавно разработанный в США пленоконарил. В исследованиях in vitro и в экспериментах на животных выявлена его активность против энтеровирусов и риновирусов. Данные первых плацебо-контролируемых исследований свидетельствуют об эффективности препарата при респираторных инфекциях и энтеровирусном менингите [8].
В России применяются оригинальные противовирусные препараты, созданные на основе отечественных разработок. Наиболее широко известный из них — арбидол. Он оказывает ингибирующее действие на вирусы гриппа типа А и В и другие респираторные вирусы, механизм которых до конца не выяснен. Предполагают, что подобное воздействие связано и с интерферониндуцирующими и с иммуномодулирующими свойствами препарата. В частности, арбидол стимулирует активность фагоцитарных клеток. Выпускается в таблетках по 0,1 г. В лечебных целях назначается по 0,2 г 3–4 раза в день в течение 3–5 дней. С профилактической целью применяется по 0,2 г/сут в течение 10–14 дней.
Интерфероны
Интерфероны (ИФН) относятся к числу регуляторов иммуногенеза. Они продуцируются различными клетками и не только реализуют противовирусный ответ, но и регулируют иммунологические реакции. Основные эффекты интерферонов можно подразделить на антивирусные, антимикробные, антипролиферативные, иммуномодулирующие и радиопротективные.
Несмотря на разнообразие генетического материала вирусов, ИФН подавляют их репродукцию на стадии, обязательной для всех вирусов: они блокируют начало трансляции, т. е. синтез вирусспецифических белков. Этим можно объяснить универсальность антивирусного действия интерферона. Под воздействием интерферона в организме усиливается активность естественных киллеров, Т-хелперов, цитотоксических Т-лимфоцитов, фагоцитарная активность, интенсивность дифференцировки В-лимфоцитов, экспрессия антигенов МНС I и II типа [1].
Для лечения вирусных инфекций применяются α- и β-интерфероны. Хороший эффект при лечении дает комбинированное применение химиопрепаратов и препаратов ИФН.
β-интерферон (бетаферон) выпускается в форме порошка, во флаконах, содержащих по 9,5 млн ЕД ИФН. При гриппе его закапывают или распыляют в носовые ходы не менее 4–5 раз в сутки [2].
Человеческий лейкоцитарный интерферон представляет собой смесь интерферонов, синтезируемых лейкоцитами донорской крови в ответ на воздействие вирусного индуктора. Препарат вводят ингаляторно или закапывают в носовые ходы водный раствор, приготавливаемый из сухого вещества в ампуле или флаконе.
Виферон — рекомбинантный интерферон-α 2b — выпускается в форме ректальных свечей и применяется при лечении ОРВИ и гриппа. Повреждение клеточных мембран, наблюдаемое в ходе развития инфекционного процесса, является причиной снижения противовирусной активности интерферона. Токоферола ацетат и аскорбиновая кислота, входящие в состав виферона, являются мембраностабилизирующими компонентами, антиоксидантами, в сочетании с которыми противовирусная активность рекомбинантного интерферона-α 2b возрастает в 10–14 раз [1].
Особенности введения лекарственной формы обеспечивают длительную циркуляцию в крови интерферона-α 2b.
Препарат применяется как у новорожденных детей, так и у взрослых больных при ОРВИ и гриппе в возрастных дозировках. Детям до 7 лет назначается виферон-1, детям старше 7 лет и взрослым — виферон-2.
Индукторы интерферона
Амиксин — низкомолекулярный синтетический индуктор эндогенного интерферона ароматического ряда, относящийся к классу флуоренонов. Основными структурами, продуцирующими интерферон в ответ на введение амиксина, являются клетки эпителия кишечника, гепатоциты, Т-лимфоциты, гранулоциты. В лейкоцитах человека амиксин индуцирует образование интерферона, уровень в крови которого составляет 250 ЕД/мл. После приема амиксина внутрь максимум интерферона у человека определяется последовательно в кишечнике, печени, крови через 4–24 ч [2].
При лечении гриппа и ОРВИ амиксин назначается в первые часы заболевания, на курс достаточно 5–6 таблеток. С целью профилактики назначается 1 раз в неделю в течение 4–6 нед.
Циклоферон является низкомолекулярным индуктором ИФН-α , что определяет широкий спектр его биологической активности. Он быстро проникает в клетки, накапливаясь в ядре и цитоплазме. Циклоферон интеркалирует ДНК клетки, с чем связан механизм его интерферониндуцирующей активности [3].
Циклоферон быстро проникает в кровь. Отмечается низкое связывание его с белками крови и в то же время широкое распространение в различных органах, тканях, биологических жидкостях организма.
Ввиду того что циклоферон является низкомолекулярным препаратом, он легко преодолевает гематоэнцефалический барьер, вызывая образование ИФН в мозге. Циклоферон быстро выводится из организма: 99% введенного препарата элиминируется почками в неизмененном виде в течение 24 ч.
Циклоферон хорошо переносится больными и назначается с первого дня от начала заболевания в виде таблетированной формы или парентерально [4].
Ридостин — высокомолекулярный индуктор ИФН природного происхождения. Ридостин представляет собой двуспиральную РНК, полученную из лизата киллерных дрожжей Saccharamyces cervisiae.
Системное введение ридостина стимулирует продукцию раннего ИФН. Максимальное накопление ИФН в сыворотке отмечается через 6–8 ч после инъекции; через 24 ч в кровотоке не определяется [1].
Препарат проявляет выраженный иммуномодулирующий эффект. Он стимулирует Т-клеточное и гуморальное звенья иммунитета, пролиферацию стволовых клеток костного мозга и фагоцитарную активность макрофагов и нейтрофилов периферической крови. Ридостин повышает уровень кортикостероидных гормонов; применяется для лечения и профилактики гриппа и других ОРВИ.
В настоящее время незаслуженно забывают препарат дибазол, применяемый для лечения и профилактики гриппа и ОРВИ. Дибазол обладает иммуномодулирующей активностью и индуцирует выработку эндогенного интерферона. Для профилактики назначается по 1 таблетке (0,02–0,05 г) 1 раз в день — 3–4 нед, для лечения — по 1 таблетке 3 раза в день — 5 дней.
Незаменимы в лечении гриппа и ОРВИ такие комплексные препараты, как гриппостад, ринза, терафлю, фервекс, а также препараты для наружного и местного применения — мазь от простуды доктор Мом, туссамаг бальзам от простуды.
Несмотря на многообразие препаратов, представленных для лечения ОРВИ и гриппа на современном этапе, выбор лекарственного препарата остается актуальной задачей для практикующего врача. Выбор тактики назначения и ведения больного с ОРВИ или гриппом напрямую связан с тяжестью течения инфекционного процесса, формой заболевания и наличием осложнений. Успех лечения зависит от правильной оценки состояния больного и раннего начала лечения.
Лейкемия и простуда - как не перепутать две болезни? Симптомы рака крови
Лейкемию или рак крови часто в простонародье называют белокровием. При этом онкологическом заболевании происходит нарушение процесса образования клеток крови в костном мозге, что приводит к бесконтрольному росту и мутации лейкоцитов, которые подавляют развитие здоровых кровяных телец.
Лейкемия не знает возрастных ограничений и может поразить людей любого возраста. Болезнь может быстро прогрессировать и привести к летальному исходу в течение 6 месяцев, если носит острый характер. Чаще симптомы лейкемии нарастают постепенно, поэтому больной и его врач не замечают, как начинается заболевание. В этом случае болезнь носит хронический характер и на начальной стадии ее симптомы схожи с проявлениями простуды.
Повышенную температуру, быструю утомляемость и постоянный озноб человек поначалу списывает на обычную простуду, никаких подозрений на онкологию на этом этапе у него не возникают. Лечение инфекции он проводит самостоятельно в домашних условиях или под наблюдением врача, который назначает ему принимать противопростудные средства. Примечательно, что недомогание при лейкемии может действительно пройти после приема лекарств, но уже очень скоро дальнейшее деление патологических клеток крови приводит к ухудшению состояния и повторному проявлению симптомов простуды.
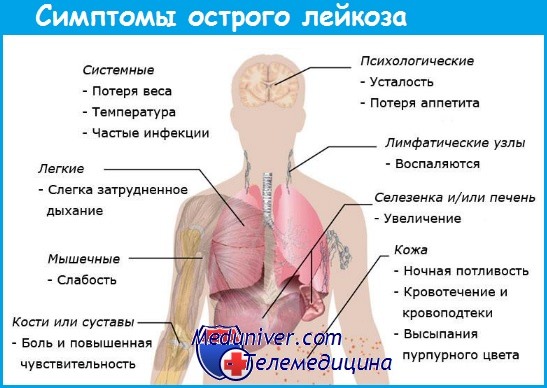
Человек, у которого рак крови, начинает часто болеть. Дело в том, что белые клетки крови - лейкоциты являются главными борцами со всеми инфекциями, а при лейкемии их функции ослабевают и иммунитет становится слабым. Соответственно, организм человека оказывается более уязвимым к любой болячке. Конечно, это не главный отличительный симптом лейкемии от простуды, но если вы часто простужаетесь обязательно надо пройти обследование, чтобы исключить развитие злокачественной болезни.
Для диагностики лейкемии необходимо сдать анализ крови, по результатам которого можно обнаружить заболевание еще до проявления характерных симптомов. Низкий гемоглобин, увеличение количества лейкоцитов и уменьшение количества тромбоцитов требуют более тщательного обследования. Если повторные анализы также указывают на патологическое изменение состава крови, то врач направляет пациента на биопсию костного мозга, чтобы поставить точный диагноз.
Как правило, опытные врачи выявляют хроническую лейкемию уже во время обычного осмотра. Первым делом врач должен проверить, не является ли кожа пациента аномально бледной. Этот симптом при лейкемии неизбежен и является результатом анемии - дефицита красных кровяных телец. Больной чувствуют постоянную усталость и отсутствие сил. Он целые сутки может спать, а проснувшись сказать, что не выспался.
Следующим распространенным симптомом лейкемии является увеличение лимфоузлов, селезенки и печени. Пораженные раком лейкоциты скапливаются в лимфоузлах и развиваются в них дальше, поэтому при лейкемии узлы могут увеличиваться многократно в диаметре, а механическое нажатие на них вызывает боль различной степени интенсивности, что должно насторожить человека. Увеличение лимфоузлов может привести к сдавливанию трахеи и крупных сосудов. Из-за этого нарушается дыхание, появляются кашель и одышка.
Увеличение печени при лейкемии не является критичным. Больших размеров при этом виде онкологии печень не достигает, чего нельзя сказать о селезенке, которая начинает активно расти уже на начальных этапах развития болезни и постепенно становится большой и плотной. Боли и дискомфорта при этом человек может не ощущать, что затрудняет диагностику лейкемии, особенно у пациентов с избыточной массой тела.
Рак крови способствует нарушению процессов выработки тромбоцитов, уменьшение количества которых приводит к плохой свертываемости крови. Поэтому человек больной раком крови часто сталкивается с кровотечениями и синяками. Любое легкое столкновение тела с твердым предметом может привести к появлению синяка, при этом сам человек может и не вспомнить, где и когда он получил этот синяк. Кроме того, при лейкемии на теле появляются мелкие пятнышки синего цвета, похожие на звёздочки.
Больному лейкемией опасны даже неглубокие порезы, царапины, носовые кровотечения и кровотечение десен, так как все они могут привести к серьезным потерям крови. У женщин на фоне заболевания наблюдаются нарушение цикла, обильные менструации и спонтанные маточные кровотечения.
Раньше считалось, что лейкемия - неизлечимая болезнь. Сегодня медицина шагнула далеко вперёд. При своевременной диагностике и начале лечения рак крови можно победить в 90% случаев. Легче всего вылечить лейкемию у детей. Главное вовремя обратиться к врачу, так как чем раньше начать лечение лейкемии, тем больше шансов на полное выздоровление.
Вирусные болезни как причина онкологических заболеваний - рака

Вирусные инфекции ответственны за развитие примерно 10-15% всех онкологических заболеваний у человека. Значимость вирусных инфекций в онкологии значительно возросла с возникновением эпидемии синдрома приобретенного иммунодефицита (СПИД), так как при этом заболевании смертность от рака преобладает в общем числе смертных случаев.
Механизмы вирус-индуцированного канцерогенеза будут обсуждаться в отдельной статье на сайте. Среди вирусов, наиболее часто ассоциируемых с онкологическими заболеваниями, находятся вирус Эпштейна-Барра (ВЭБ), герпесвирус саркомы Капоши ((ГСК) или герпесвирус человека серотипа 8 (ГВЧ8)) и вирус человеческой папилломы. Вирус ВЭБ вызывает лимфому Беркита и рак носоглоточной полости у небольшого процента зараженных им людей.
Лимфома наиболее часто встречается в районах Африки, прилегающих к пустыне Сахара, и в районах с эндемическими очагами малярии. Распространение саркомы Капоши также в основном характерно для близлежащим к Сахаре регионов и в большой степени этому заболеванию подвержены евреи, проживающие в средиземноморском регионе. Известно, что инфицированность ГВЧ8 тесно связана с риском развития саркомы в ходе течения связанных со СПИДом заболеваний.
ГВЧ8 также увеличивает риск развития многоцентровой болезни Каслемана и первичной эффузионной лимфомы. У жителей Италии и Северной Африки отмечается повышенное в сравнении с жителями Великобритании или США содержание антител к вирусу ГВЧ8 (ГСК).
Существенным фактором риска при развитии рака шейки матки являются папилломавирусы. Среди более 100 разновидностей этих вирусов наибольшую опасность представляют серотипы 16, 18, 31 и 33 (несколько менее опасны серотипы 6 и 11).
Рак могут вызывать и представители семейства ретровирусов. Наиболее общеизвестный пример — вирус Т-клеточной лейкемии, серотип 1 (ВТКЛ-1) который является эндемической инфекцией в южной Японии и на Карибском море. У жителей этих регионов опухоли развиваются только у незначительной части инфицированных. Вирус может передаваться от матери к ребенку во время беременности через плаценту, а также с молоком при кормлении. Возможна передача вируса через сперму.
ДНК-Содержащий вирус гепатита В передается через кровь или при половых контактах и вызывает гепатит и цирроз печени. Среди людей, пораженных таким вирусом, печеночно-клеточная карцинома встречается в 100 раз чаще, чем у неинфици-рованных. РНК-Содержащий вирус гепатита С также вызывает хронический гепатит и значительно повышает риск заболеваемости печеночно-клеточной карциномой.
Оба вируса широко распространены по всему миру, но особенно часто встречаются у жителей Китая и Тайваня, а также среди лиц, принимающих наркотики внутривенно. Эти два вируса являются основной причиной смертности от заболеваний раком печени.
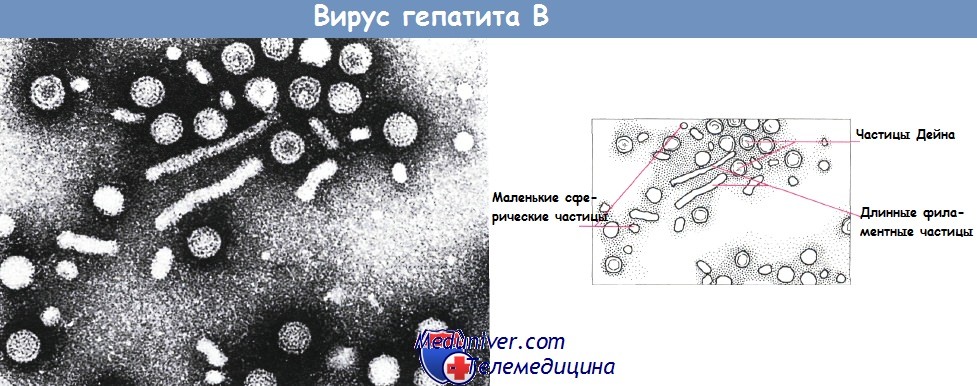
Электронная микрофотография вируса гепатита В.
На срезе видны мелкие сферические частицы с диаметром 28 нм (HBsAg); более крупные сферические двумембранные частицы Дейна (42 нм), продолговатые филаментозные частицы.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

