Вирус рака предстательной железы
Обновлено: 24.04.2024
Существуют разные виды лечения рака предстательной железы (РПЖ) у мужчин, врач выбирает тактику с учетом ряда факторов. В первую очередь ориентируются на стадию опухоли. Если она не выходит за пределы предстательной железы, возможно хирургическое лечение. Если имеются метастазы в лимфатических узлах, костях и других органах, хирургическое лечение не приведет к выздоровлению.
Также необходимо учитывать сопутствующие проблемы со здоровьем, а они, как правило, имеются, потому что злокачественные опухоли предстательной железы чаще диагностируются у мужчин пожилого возраста. Такие пациенты часто страдают артериальной гипертензией, имеют в анамнезе перенесенный инсульт или инфаркт. В таких случаях операция часто бывает противопоказана. [3]
Диагностика рака простаты
Чаще всего на начальных стадиях РПЖ симптоматика отсутствует, т.к. поражаются периферические отделы. По мере прогрессирования заболевания может возникать ослабление или прерывистость струи мочи, учащение мочеиспускания, ощущение неполного опорожнения мочевого пузыря, может возникать примесь крови в моче или сперме, эректильная дисфункция, боль в промежности, костях или пояснице, анемия, отек нижних конечностей и др.
Диагностика рака простаты включает следующие методы: [1]
- Пальцевое ректальное исследование. Это обязательный метод диагностики опухолей предстательной железы, при этом он самый простой, безопасный и дешевый. Его результаты определяются размером опухоли, ее локализацией, а также квалификацией доктора. [9]
- Лабораторная диагностика – определение простатспецифического антигена в крови. При его концентрации 2,5-10 нг/мл чаще выявляется доброкачественная гиперплазия предстательной железы, а при значении выше 10 нг/мл более вероятен РПЖ. Хотя стоит отметить, что это все достаточно условно, его норма зависит от возраста пациента, а также при постановке диагноза учитывается соотношение свободного к общему ПСА (для злокачественного новообразование это значение ниже 0,1), а также исследуется маркер PCA3.
- Инструментальные методы, которые включают трансректальное ультразвуковое исследование, магнитно-резонансную томографию, компьютерную томографию, рентгенографию, остеосцинтиграфию. Подтверждается диагноз только после гистологического исследования биопсийного материала.
Каждый диагностический метод имеет свои показания к проведению. В одних случаях достаточно определения ПСА и пальцевого ректального исследования. В других может дополнительно потребоваться проведение КТ и биопсии. Точный план лечения определяется с учетом состояния пациента и наличия у него тех или иных симптомов. [3]
Современные методы лечения рака простаты
Лечение при онкологии простаты может включать хирургическое вмешательство, лучевую терапию, химиотерапию, гормональную терапию. Кроме того, сегодня набирает популярность абляция предстательной железы с помощью высокоинтенсивного сфокусированного ультразвука – так называемый HIFU (High Intensity Focused Ultrasound). В некоторых случаях врач придерживается тактики активного наблюдения. [1]
Активное наблюдение
У некоторых мужчин в силу возраста или сопутствующих проблем со здоровьем лечение может привести к осложнениям и побочным эффектам, которые бывают более серьезны, чем проблемы, создаваемые самим раком. В таких случаях врач может придерживаться активного наблюдения. Такая тактика возможна в следующих случаях:
- Пациент не испытывает симптомов.
- По прогнозам опухоль будет расти медленно.
- Опухоль имеет небольшие размеры.
- Рак не распространяется за пределы предстательной железы.
Тактика активного наблюдения предполагает осмотры врача и анализы крови на простатспецифический антиген каждые полгода. Раз в год врач может назначить биопсию простаты. [1]
Хирургическое лечение рака предстательной железы
При раке простаты выполняют радикальную простатэктомию — операцию, во время которой удаляют предстательную железу и окружающие ткани, включая семенные пузырьки.
Радикальная простатэктомия может быть выполнена разными способами:
- Позадилобковую простатэктомию выполняют через продольный разрез от пупка до лобка. Обычно пациента выписывают из клиники через несколько дней после операции, восстановительный период продолжается несколько недель.
- При промежностной простатэктомии делают дугообразный разрез между мошонкой и анусом. Эта операция более быстрая по сравнению с позадилобковой простатэктомией, но во время нее затруднен доступ к лимфатическим узлам, и она чаще приводит к проблемам с эрекцией.
- Лапароскопическая простатэктомия выполняется с помощью специальных инструментов через проколы в брюшной стенке. Она сопровождается меньшим кровотечением и меньшей травматизацией тканей по сравнению с открытыми вмешательствами, укорачивается восстановительный период. Но риск осложнений примерно тот же.
- Роботизированная простатэктомия проводится с применением робота да Винчи. По сути это то же лапароскопическое вмешательство, но хирург держит инструменты не сам, а управляет движениями робота через специальный пульт. Благодаря этому движения инструментов более точные. Но нет доказательств того, что это помогает снизить риск осложнений.

Возможные осложнения после радикального удаления простаты: недержание мочи, эректильная дисфункция, небольшое укорочение полового члена, паховая грыжа, бесплодие, лимфедема (отек из-за удаления лимфатических узлов). [1,2]
Виды лучевой терапии при раке простаты
Лучевая терапия РПЖ может быть назначена в качестве альтернативы хирургическому лечению. По эффективности она зачастую не уступает операции. Другие показания:
- В сочетании с гормональной терапией при раке, который распространился за пределы предстательной железы.
- При рецидиве рака.
- В качестве паллиативного лечения на поздних стадиях. Это помогает сдержать рост опухоли и увеличить продолжительность жизни пациента.

При раке простаты применяют два вида лучевой терапии: дистанционную (внешнюю) и внутритканевую лучевую терапию (брахитерапию). [1,5]
Дистанционная лучевая терапия
Внешнее облучение бывает разных видов:
- Трехмерная конформная лучевая терапия использует компьютерные технологии, чтобы определить точное местоположение предстательной железы и опухоли. Это помогает уменьшить повреждение окружающих здоровых тканей.
- Интенсивно-модулированная лучевая терапия — более совершенная разновидность 3D-конформной лучевой терапии. Аппарат не только облучает опухоль под разными углами, но и регулирует интенсивность излучения. Это позволяет подавать на простату еще большую дозу, избегая облучения здоровых тканей.
- Стереотаксическая терапия использует современные технологии, чтобы доставить всю дозу излучения туда, где находится злокачественная опухоль. Она позволяет сократить курс лучевой терапии, в итоге он продолжается дни вместо недель.
К преимуществам дистанционной лучевой терапии рака простаты относится то, что возможно полное излечение заболевания, не требуется госпитализация – лечение может быть проведено амбулаторно, а также оно позволяет избежать хирургического вмешательства. [1]
Брахитерапия
При брахитерапии небольшую гранулу, которая является источником излучения, помещают непосредственно в предстательную железу. Этот метод лечения применяется у мужчин на ранних стадиях, при которых наблюдается медленный рост.
В настоящее время используются 2 разновидности брахитерапии при РПЖ:
- Постоянная (низкодозная). Применяется изотоп йода – 125I или палладия – 103Pd.
- Временная (высокодозная). Применяется изотоп ирридия – 192Ir. Используется при местнораспространенных опухолях в сочетании с дистанционной лучевой терапией.
Как правило, брахитерапия используется на стадиях Т1с-Т2b, при уровне ПСА менее 10 нг/мл, сумме Глисона менее 7 и объеме предстательной железе до 50 см3. Среди ее преимуществ можно отметить то, что это однократная амбулаторная процедура, дает результаты аналогичные хирургическому лечению, сопровождается более низким риском развития недержания мочи, а также дает высокие шансы сохранить потенцию.
На более поздних стадиях брахитерапию иногда применяют в сочетании с дистанционной лучевой терапией. [1]
HIFU для лечения РПЖ
Метод HIFU является достаточно новым в лечении РПЖ, и основан он на применении высокоинтенсивного сфокусированного ультразвука, воздействие которого позволяет разрушать заданный объем предстательной железы, не повреждая при этом окружающие ткани. Метод не увеличивает вероятность метастазирования из первичного очага, а также может использоваться после хирургического вмешательства и после лучевой терапии. [1,7]
На сегодняшний день уже опубликованы исследования, в которых демонстрируется эффективность HIFU-терапии при 3-летнем наблюдении на уровне 91%. При этом в группе с низким риском прогрессии эта цифра превышает 95%, а в группе с высоким риском (при местнораспространенном РПЖ) она составляет 80%. Проведение HIFU-терапии сопровождалось низкой частотой побочных эффектов, а большинство пациентов отмечали улучшение качества жизни. [6,8]
Химиотерапия при раке простаты
Химиотерапия не является основным методом лечения рака предстательной железы, но иногда она может быть полезна. Химиопрепараты назначают в сочетании с гормональными препаратами или в случаях, когда гормональная терапия не работает.
При раке простаты применяют препараты: доцетаксел, кабазитаксел, митоксантрон, эстрамустин. [2,4]
Гормональная терапия при раке простаты
Известно, что мужские половые гормоны — андрогены — стимулируют рост рака предстательной железы. Цель гормональной терапии состоит в том, чтобы снизить уровень андрогенов в организме или не допустить их взаимодействия с раковыми клетками.
Гормональная терапия останавливает рост опухоли на некоторое время. В качестве монотерапии она не способна вылечить. Показания к ее назначению: [4]
- Наличие противопоказаний к хирургическому лечению и лучевой терапии.
- Распространенный рак простаты, когда операция и лучевая терапия неэффективны.
- При агрессивных опухолях, когда высок риск рецидива, гормональную терапию назначают вместе с лучевой терапией.
- Ее могут назначить и до лучевой терапии, чтобы затормозить рост опухоли и улучшить результаты лечения.
Лечение рака простаты 4 стадии
При IV стадии рак простаты распространяется на мочевой пузырь, прямую кишку, лимфоузлы, появляются удаленные метастазы в костях и различных органах. Но даже на этой стадии, в зависимости от распространенности процесса, иногда можно добиться ремиссии. В случаях, когда рак неизлечим, паллиативное лечение поможет на некоторое время сдержать его рост и продлить жизнь больного.
Обычно лечение рака предстательной железы 4 стадии включает следующие мероприятия: [1,2]
- Гормональная терапия, в некоторых случаях — в сочетании с химиотерапией.
- Хирургическое лечение. Если рак не распространился на лимфоузлы, и нет удаленных метастазов, можно провести радикальную простатэктомию. В других случаях для борьбы с симптомами прибегают к паллиативному вмешательству — трансуретральной резекции простаты (ТУРП).
- Если пациенту противопоказаны все виды лечения, и у него нет выраженных симптомов, возможно активное наблюдение.

Лечение метастазов рака простаты в кости
Если обнаружены метастазы в костях, назначают гормональную терапию, лучевую терапию, химиотерапию. Кроме того, в лечении метастаз в кости при раке простаты применяют бисфосфонаты (препараты, которые замедляют разрушение кости), деносумаб (тот же эффект, что у бисфосфонатов, но другой механизм действия), препараты гормонов коры надпочечников (уменьшают боли), обезболивающие средства. [4]
Для цитирования: Локшин К.Л. Внутриклеточные возбудители заболеваний, передающихся половым путем, и рак простаты // Эффективная фармакотерапия. 2019. Т. 15. № 16. С. 34–37.
- Аннотация
- Статья
- Ссылки
- Английский вариант
- КЛЮЧЕВЫЕ СЛОВА: рак простаты, внутриклеточные бактерии, урогенитальные инфекции, заболевания, инфекции
Рак простаты занимает второе место в структуре онкозаболеваемости и шестое место среди причин онкологической смертности у мужчин [1]. Несмотря на множество проводимых исследований, установить сколь-либо значимые модифицируемые факторы риска развития рака простаты пока не удалось. Исключение составляют только курение [2], избыточная масса тела [3] и малоподвижный образ жизни [4]. В то же время известно, что заболевания, передающиеся половым путем, не только сами по себе представляют проблему мирового масштаба, но и ассоциированы с рядом других, в том числе онкологических, заболеваний. К примеру, в настоящее время установлено, что вирус папилломы человека является этиотропным фактором для рака шейки матки, рака полового члена, рака анального канала и опухолей других локализаций [5, 6].
Бактериальные инфекции, передающиеся половым путем (ИППП), приобретают все большее значение в связи с ростом их распространенности в большинстве стран мира [7]. В течение последних 25 лет наблюдается постоянный рост заболеваемости хламидийной инфекцией [8–11]. Заболеваемость гонореей растет в странах, где она традиционно была невысокой [8–13]. При этом многие исследователи отмечают, что, несмотря на более эффективные современные стратегии скрининга и точные методы диагностики в развитых странах, ИППП по-прежнему зачастую не регистрируются или из-за бессимптомного течения не диагностируются.
Обнаружение связи между определенными инфекционными агентами и развитием рака может изменить методы профилактики злокачественных опухолей. Ярким подтверждением этому служит снижение заболеваемости раком шейки матки в результате вакцинации девушек и женщин от вируса папилломы человека. Более того, понимание роли клеточных факторов, на которые оказывают влияние инфекционные агенты, позволяет рассчитывать на создание новых направлений в противораковой терапии.
Известно, что помимо гонококков внутриклеточной локализацией характеризуются такие возбудители ИППП, как хламидии, уреаплазмы и микоплазмы. На сегодняшний день проведен ряд научных исследований возможной роли этих бактерий в развитии рака простаты.
Ряд исследований был посвящен изучению возможной связи рака простаты с внутриклеточной микоплазменной инфекцией. С появлением современных методов диагностики, в том числе полимеразной цепной реакции (ПЦР) и иммуногистохимии, стало очевидно, что у многих здоровых людей имеет место бессимптомная колонизация микоплазмами [20, 21]. Более поздние исследования продемонстрировали возможную корреляцию между различными штаммами микоплазм и онкологическими заболеваниями человека [22–26]. Так, в работе Ю.Г. Аляева и соавт. (2010) при подозрении на рак простаты выполнялась полифокальная трансректальная биопсия, материал которой отправлялся не только на патоморфологическое исследование, но и на ПЦР-диагностику ИППП [25]. Оказалось, что простатическая интраэпителиальная неоплазия высокой степени и рак простаты достоверно чаще обнаруживались у пациентов с выделенной ДНК микоплазм, чем у пациентов без ДНК микоплазм – 80,8 и 63% соответственно (различия достоверны, p = 0,031). Частота развития простатической интраэпителиальной неоплазии высокой степени и рака простаты у больных с выделенной ДНК Mycoplasma hominis составила 84,2%, что достоверно выше, чем у пациентов без нее (p = 0,033). Продолжением этой работы стало исследование Ю.А. Бариковой и соавт. (2011). С помощью метода ПЦР в режиме реального времени установлено, что частота обнаружения Mycoplasma hominis при простатической интраэпителиальной неоплазии высокой степени и/или раке простаты была в три раза выше таковой при доброкачественной гиперплазии предстательной железы (p = 0,002) [26]. В работе J. Hrbacek и соавт. (2011) показано, что при раке простаты, в отличие от доброкачественной гиперплазии предстательной железы, в крови чаще выявляются антитела к Ureaplasma urealyticum [27].
K. Namiki и соавт. (2009) получили свидетельства того, что Mycoplasma hyorhinis (часто встречается при синдроме приобретенного иммунодефицита) и Mycoplasma genitalium индуцируют in vitro злокачественную трансформацию линии клеток доброкачественной гиперплазии предстательной железы человека (линии эпителиальных клеток
BPH-1) [28].
Множество исследований посвящено возможным механизмам воздействия микоплазм на онкогенез в различных тканях. Например, in vitro у микоплазм доказана способность вызывать злокачественную трансформацию линий клеток как грызунов, так и человека [28–31]. Данный проканцерогенный эффект S. Tsai и соавт. (1995) [30], J. Fogh и соавт. (1965) [32] и G.R. Paton и соавт. (1965) [33] объясняют индукцией генетической нестабильности, а K.B. Waites и соавт. (2004, 2005) [20, 21] и C.J. Miller (2003) [34] – нарушением метаболизма клеток и существенными нарушениями экспрессии множества генов.
Особое значение, очевидно, имеют онкогены и гены-супрессоры опухолевых клеток. Так, в исследовании B. Zhang и соавт. (1997) индуцированная микоплазмами малигнизация клеток ассоциировалась с высокой экспрессией онкогенов H-ras и c-myc [35]. А в работе D.Y. Loginov и соавт. (2008) на эмбриональной культуре фибробластов крыс и мышей было показано, что микоплазменная инфекция подавляет экспрессию онкобелка p53 и активирует ядерный фактор NF-κB. Это способствовало возникновению мутаций, генетической нестабильности, пролиферации и в конечном итоге вело к злокачественному перерождению клеток [36].
Сегодня настоящий научный бум переживает протеомика – область молекулярной биологии, посвященная идентификации и количественному анализу белков в клетках. Белковый гомеостаз (или протеостаз) играет огромную роль в определении жизнеспособности и здоровья клеток [37]. Его нарушение связывают с возникновением множества заболеваний, в первую очередь онкологических [38]. М. Zakariah и соавт. (2018) изучали действие белков Mycoplasma hominis на эндоплазматическую ретикулярную сеть клеток простаты как возможный механизм канцерогенеза [39]. Было установлено, что из протеома Mycoplasma hominis 19 белков имеют тропность к эндоплазматическому ретикулуму клеток простаты, таким образом нарушая нормальный процесс фолдинга белков последней. Авторы пришли к выводу, что внутриклеточное инфицирование клеток простаты Mycoplasma hominis – значимый потенциальный фактор онкогенеза рака простаты.
Подводя итог вышесказанному, следует отметить, что внутриклеточные инфекции, передающиеся половым путем, могут как минимум выступать в роли маркера/фактора риска для рака предстательной железы. В то же время предполагаемая связь между раком простаты и внутриклеточными ИППП по крайней мере определяет целесообразность более агрессивной антибиотикотерапии инфицированных мужчин возможно и в тех случаях, когда инфекция протекает малосимптомно или бессимптомно. Однако важно осознавать, что оправданность данного подхода может быть установлена только в ходе продолжительных популяционных исследований, которые бы продемонстрировали снижение заболеваемости раком простаты у пациентов, прошедших курс этиотропной антибиотикотерапии, в сравнении с пациентами, которым такая терапия не проводилась.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Рак простаты: причины появления, симптомы, диагностика и способы лечения.
Определение
Рак простаты – это злокачественное сравнительно медленно прогрессирующее заболевание, возникающее из эпителия желез предстательной железы. Опухоль может располагаться в одной или обеих долях железы, увеличиваться и врастать в прилежащие органы и структуры, а также распространяться в ближайшие к органу лимфатические узлы (регионарные метастазы).
Опухолевые клетки могут переноситься с током крови в другие органы (кости, легкие, печень, и т.д.) и провоцировать рост новых очагов (отдаленные метастазы).
Рак предстательной железы (РПЖ) - одно из наиболее распространенных злокачественных заболеваний у мужчин. Ежегодно в России выявляется более 38 тысяч новых случаев, и все чаще болезнь диагностируется у молодых мужчин. Рак простаты по количеству летальных исходов занимает третье место после рака легкого и рака желудка, поэтому принципиально важна ранняя диагностика опухолевого процесса и своевременное лечение.
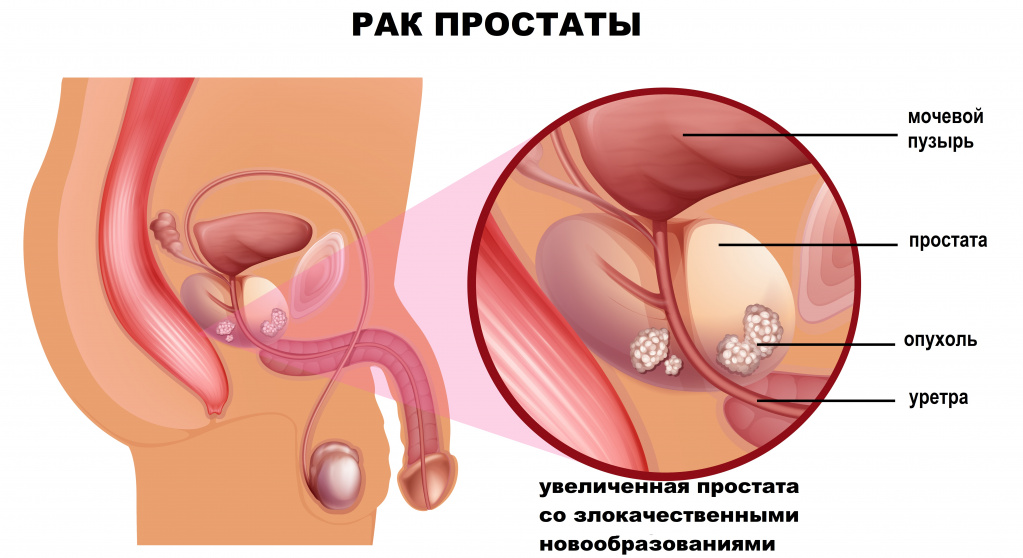
Предстательная железа вырабатывает семенную жидкость, являющуюся питательной средой для сперматозоидов, а также выполняет роль клапана — закрывает выход из мочевого пузыря во время эрекции.
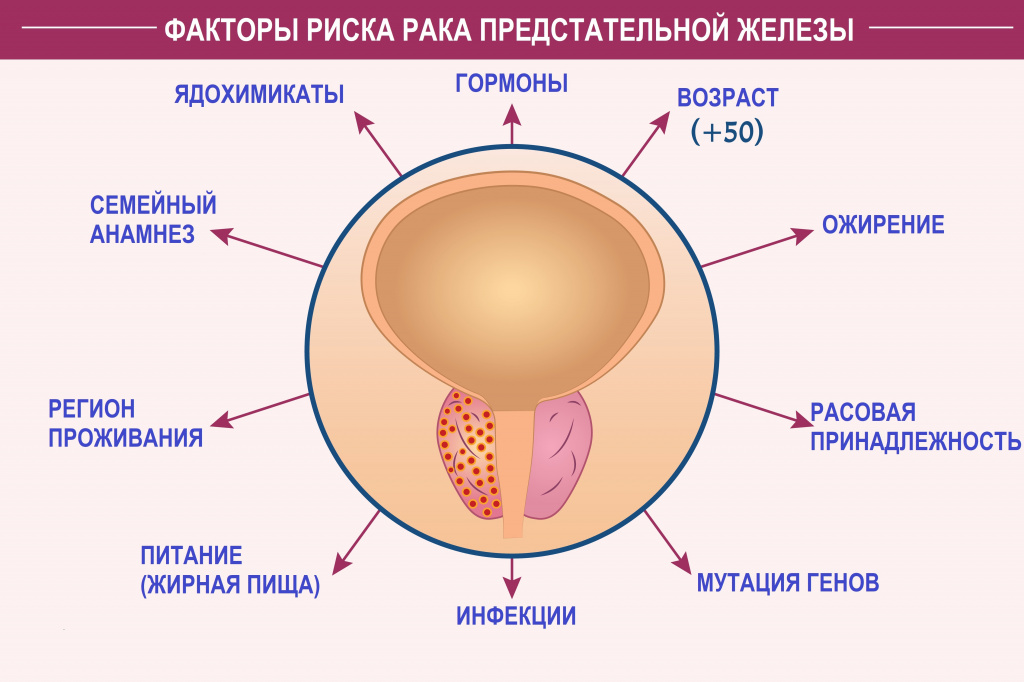
Основными, наиболее изученными факторами риска развития рака простаты являются возраст (старше 50 лет), расовая принадлежность (наиболее подвержены заболеванию афроамериканцы), а также генетическая предрасположенность.
Кроме того, установлено множество других факторов, которые непосредственно или опосредованно могут способствовать возникновению рака предстательной железы.
Классификация заболевания
По Международной классификации болезней 10-го пересмотра (МКБ-10) рак предстательной железы кодируется как С61 – Злокачественное новообразование предстательной железы.
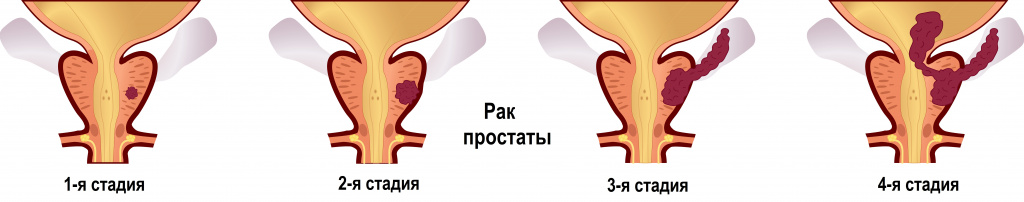
В развитии рака простаты выделяют 4 стадии:
- 1-я стадия – опухоль распространяется лишь в половине одной доли железы;
- 2-я стадия характеризуется наличием локализованной опухоли простаты (без выхода опухоли за капсулу железы), при этом может быть поражена как одна, так и обе доли железы;
- 3-я стадия характеризуется наличием местно-распространенной опухоли простаты (выход опухоли за капсулу железы);
- 4-я стадия определяется при наличии регионарных (метастазы в тазовых лимфоузлах N1) или отдаленных метастазов (М1).
- Т – первичная опухоль:
- Т1-2 – опухоль не выходит за пределы капсулы предстательной железы,
- Т3-4 – опухоль прорастает за пределы капсулы предстательной железы, может врастать в соседние органы (мочевой пузырь, прямую кишку).
- N0 – нет метастазов в лимфоузлах,
- N1 – наличие метастазов в один или несколько лимфоузлов.
- М0 - отдаленные метастазы отсутствуют,
- M1 - отдаленные метастазы в костях или внутренних органах.
- Аденокарцинома:
- мелкоацинарная,
- крупноацинарная,
- криброзная,
- папиллярная,
- солидно-трабекулярная,
- эндометриоидная,
- железисто-кистозная,
- слизеобразующая.
Симптомы рака простаты
Как правило, на ранних стадиях РПЖ симптоматика отсутствует, так как чаще всего поражаются периферические отделы предстательной железы.
Все симптомы, характерные для рака простаты, можно разделить на три группы:
1. Инфравезикальная обструкция:
- ослабление и прерывистость струи мочи,
- ощущение неполного опорожнения мочевого пузыря,
- учащение мочеиспускания,
- императивные позывы к мочеиспусканию,
- стрессовое недержание мочи.
- гемоспермия (примесь крови в сперме),
- гематурия (кровь в моче),
- недержание мочи,
- эректильная дисфункция,
- боль в надлобковой области и промежности.
- боль в костях, пояснице (при обструкции мочеточников),
- отек нижних конечностей (лимфостаз),
- параплегия (компрессия спинного мозга),
- потеря массы тела,
- анемия,
- уремия,
- кахексия.
ПСА общий – белок, специфичный для ткани предстательной железы, используемый в качестве опухолевого маркера. Физиологический экскреторный продукт предстательной железы. Синонимы: Анализ крови на ПСА общий; Простат-специфический антиген общий. Prostate-specific antigen total.
Ультразвуковое сканирование простаты, дающее представление о состоянии предстательной железы и наличии патологии.
Исследование ткани предстательной железы и состояния мочевого пузыря с целью выявления патологий мочеполовой системы.
Согласно требованиям п. 17 Правил проведения патолого-анатомических исследований, утв. Приказом Минздрава России от 24.03.2016 № 179н, в целях уточнения диагноза заболевания (состояния) с учетом требований стандартов медицинской помощи и клинических рекомендаций (протоколов лечения) по вопросам о.
Согласно требованиям п. 17 Правил проведения патолого-анатомических исследований, утв. Приказом Минздрава России от 24.03.2016 № 179н, в целях уточнения диагноза заболевания (состояния) с учетом требований стандартов медицинской помощи и клинических рекомендаций (протоколов лечения) по вопросам о.
Исследование, позволяющее получить данные о состоянии органов малого таза, выявить патологические изменения и опухоли.
Исследование предстательной железы и окружающих тканей для поиска врожденных и приобретенных патологий.
Лечение рака простаты
Тактика лечения рака предстательной железы во многом зависит от стадии и распространенности опухолевого процесса на момент постановки диагноза. Основными вариантами лечения локализованных форм опухоли без отдаленных метастазов являются хирургическое лечение и лучевая терапия в сочетании с гормональной терапией. В случае наличия отдаленных метастазов проводится лекарственная системная терапия.
Хирургическим лечением является радикальная простатэктомия - удаление предстательной железы с семенными пузырьками и окружающей простату клетчаткой. Часто эта операция сопровождается удалением тазовых лимфоузлов, так как лимфатические узлы являются первым барьером на пути распространения опухолевых клеток и есть риск их поражения. Операция направлена на устранение злокачественного процесса с сохранением функции удержания мочи и по возможности потенции.
Лучевая терапия подразумевает применение ионизирующей радиации. При лечении рака предстательной железы она подразделяется на дистанционную и внутритканевую (брахитерапию).
В настоящее время в качестве альтернативных экспериментальных методов лечения локализованного рака предстательной железы применяется криохирургическая деструкция предстательной железы, использование высокоинтенсивного сфокусированного ультразвука и фотодинамическая терапия. Важно, что эти методы используют только в случае выявления рака на ранней стадии.
Орхидэктомия (или хирургическая кастрация) представляет собой оперативное удаление яичек с целью снижения уровня тестостерона в организме для устранения его воздействия на опухоль предстательной железы.
Гормональная терапия позволяет остановить выработку андрогенов или блокировать их действие, что значительно замедляет развитие злокачественного процесса. Монотерапия антиандрогенами показана пациентам с локализованным неметастатическим раком предстательной железы в качестве альтернативы медикаментозной или хирургической кастрации. При проведении гормонотерапии пациентам назначают специальные препараты, называемые аналогами гормонов гипофиза. Через 3–4 недели после их введения содержание тестостерона в крови снижается до минимального уровня, аналогичного таковому после орхидэктомии, т.е. происходит так называемая медикаментозная кастрация. В ряде случаев необходим прием антиандрогенов, которые блокируют способность опухолевых клеток взаимодействовать с половыми гормонами, вызывая совместно с инъекционными препаратами эффект, называемый максимальной андрогенной блокадой.
Химиотерапию назначают в случае рецидива заболевания или рака предстательной железы поздней стадии, который не отвечает на гормональное лечение.
Если патологический процесс обнаружен на 1-2-й стадиях (и нередко даже на 3-й), то при верно подобранном лечении (хирургическом лечении или лучевой терапии в сочетании с гормонотерапией) возможно полное излечение от рака. В случае установления 4-й стадии заболевания при помощи лекарственного лечения можно добиться стойкой ремиссии.
Осложнения
Осложнения рака предстательной железы могут возникнуть как в результате развития опухолевого процесса, так и в ответ на получаемую терапию.К нежелательным эффектам гормонотерапии относят:
Химиотерапия воздействует не только раковые, но и на здоровые клетки организма - мембраны клеток ротовой полости, желудочно-кишечного тракта, волосяные фолликулы и костный мозг. Побочные эффекты химиотерапии обычно исчезают после прекращения лечения. К наиболее распространенным временным побочным эффектам химиотерапии относятся:
- тошнота и рвота;
- утрата аппетита;
- выпадение волос;
- поражение слизистых оболочек;
- диарея;
- бесплодие.
- недержанию мочи;
- задержке мочеиспускания;
- стриктуре (сужению) уретры;
- эректильной дисфункции;
- ректоуретральным свищам.
Профилактика злокачественных новообразований простаты делится на первичную и вторичную.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Напоминаем вам, что самостоятельная интерпретация результатов недопустима, приведенная ниже информация носит исключительно справочный характер
ПСА общий (простатический специфический антиген общий): показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Показания к назначению исследования
Простатический специфический антиген (ПСА) секретируется эпителиальными клетками канальцев предстательной железы. В сыворотке крови он содержится в двух формах – свободной (10%) и связанной с различными антипротеазами (90%). Свободная и связанная фракции составляют общий простатический специфический антиген. Известно, что с возрастом концентрация ПСА увеличивается.
У простатического специфического антигена есть несколько физиологических функций: он разжижает семенной сгусток после эякуляции, выделяет особую субстанцию, которая стимулирует сокращение гладкой мускулатуры семенных пузырьков, обладает ингибирующим (замедляющим) действием на рост клеток, проявляя антиканцерогенный и антиангиогенный эффекты.
Увеличение концентрации сывороточного ПСА при раке простаты происходит из-за роста опухолевых клеток, разрушения пораженного органа и попадания антигена в общий кровоток.
Сывороточный уровень ПСА может повышаться не только при раке предстательной железы, но и при ее доброкачественной гиперплазии (ДГПЖ), и при хроническом простатите, поэтому простатический специфический антиген - это органоспецифический, но не опухолеспецифический маркёр.
Концентрацию ПСА выше 4 нг/мл обнаруживают примерно у 80-90% больных раком предстательной железы и у 10-20% больных аденомой простаты. Повышение уровня ПСА не всегда говорит о злокачественности процесса - значение имеет скорость нарастания концентрации ПСА (при раке это происходит быстрее).
Факторами риска развития рака предстательной железы считают генетическую предрасположенность, возраст мужчины и особенности питания.
Существует связь между уровнем простатического специфического антигена и степенью злокачественности процесса и метастазированием. Так, при значении ПСА выше 50 нг/мл у большинства пациентов может наблюдаться выход онкологического процесса за капсулу органа и поражение регионарных лимфатических узлов.
![Рак простаты.jpg]()
Мониторирование концентрации ПСА помогает специалистам обнаружить рецидив (возвращение проявлений заболевания по причине неполного выздоровления) или метастазирование (процесс образования вторичных очагов опухолевого роста (метастазов) в результате распространения клеток из первичного очага в другие ткани и/или органы). Например, после простатэктомии (удаления предстательной железы) ПСА должен определяться в крови не выше уровня остаточной концентрации от 0,05 до 0,1 нг/мл. Концентрация ПСА выше этого уровня может свидетельствовать об остаточной опухолевой ткани или метастазах. При этом рекомендовано определять ПСА через 60-90 дней после удаления простаты в связи с возможными ложноположительными результатами.Эффективность терапии (например, лучевой, гормональной) определяется значимым снижением концентрации ПСА.
Таким образом, показаниями к проведению исследования уровня простатического специфического антигена являются:
- ранняя диагностика рака предстательной железы;
- решение о целесообразности проведения биопсии простаты;
- мониторинг течения заболевания;
- оценка эффективности проводимой терапии рака простаты;
- диагностика метастазирования.
Подготовка к процедуре
Предпочтительно выдержать 4 часа после последнего приема пищи.
Анализ следует проводить до или не ранее чем через 6-7 дней после массажа или пальцевого ректального обследования простаты, трансректального УЗИ, биопсии, лазерной терапии, эргометрии, цистоскопии, колоноскопии, после любых других механических воздействий на простату.
Срок исполнения
До 1 рабочего дня, указанный срок не включает день взятия биоматериала.
Что может повлиять на результат
В случае несоблюдения правил подготовки полученный результат может оказаться некорректным.
Повышенная концентрация ПСА может наблюдаться в течение 10 дней после пальцевого ректального исследования, цистоскопии, колоноскопии, трансуретральной биопсии, простатэктомии или массажа простаты, лазерной терапии, при задержке мочи, эякуляция накануне исследования.
На уровень общего ПСА могут влиять лекарственные препараты - антагонисты андрогенов, аллопуринол, финастерид, циклофосфамид, метотрексат.
ПСА общий (Простатический специфический антиген общий, Prostate-specific antigen total, PSA total)
ПСА общий – белок, специфичный для ткани предстательной железы, используемый в качестве опухолевого маркера. Физиологический экскреторный продукт предстательной железы. Синонимы: Анализ крови на ПСА общий; Простат-специфический антиген общий. Prostate-specific antigen total.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Напоминаем вам, что самостоятельная интерпретация результатов недопустима, приведенная ниже информация носит исключительно справочный характер
ПСА общий (простатический специфический антиген общий): показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Показания к назначению исследования
Простатический специфический антиген (ПСА) секретируется эпителиальными клетками канальцев предстательной железы. В сыворотке крови он содержится в двух формах – свободной (10%) и связанной с различными антипротеазами (90%). Свободная и связанная фракции составляют общий простатический специфический антиген. Известно, что с возрастом концентрация ПСА увеличивается.
У простатического специфического антигена есть несколько физиологических функций: он разжижает семенной сгусток после эякуляции, выделяет особую субстанцию, которая стимулирует сокращение гладкой мускулатуры семенных пузырьков, обладает ингибирующим (замедляющим) действием на рост клеток, проявляя антиканцерогенный и антиангиогенный эффекты.
Увеличение концентрации сывороточного ПСА при раке простаты происходит из-за роста опухолевых клеток, разрушения пораженного органа и попадания антигена в общий кровоток.
Сывороточный уровень ПСА может повышаться не только при раке предстательной железы, но и при ее доброкачественной гиперплазии (ДГПЖ), и при хроническом простатите, поэтому простатический специфический антиген - это органоспецифический, но не опухолеспецифический маркёр.
Концентрацию ПСА выше 4 нг/мл обнаруживают примерно у 80-90% больных раком предстательной железы и у 10-20% больных аденомой простаты. Повышение уровня ПСА не всегда говорит о злокачественности процесса - значение имеет скорость нарастания концентрации ПСА (при раке это происходит быстрее).
Факторами риска развития рака предстательной железы считают генетическую предрасположенность, возраст мужчины и особенности питания.
Существует связь между уровнем простатического специфического антигена и степенью злокачественности процесса и метастазированием. Так, при значении ПСА выше 50 нг/мл у большинства пациентов может наблюдаться выход онкологического процесса за капсулу органа и поражение регионарных лимфатических узлов.
![Рак простаты.jpg]()
Мониторирование концентрации ПСА помогает специалистам обнаружить рецидив (возвращение проявлений заболевания по причине неполного выздоровления) или метастазирование (процесс образования вторичных очагов опухолевого роста (метастазов) в результате распространения клеток из первичного очага в другие ткани и/или органы). Например, после простатэктомии (удаления предстательной железы) ПСА должен определяться в крови не выше уровня остаточной концентрации от 0,05 до 0,1 нг/мл. Концентрация ПСА выше этого уровня может свидетельствовать об остаточной опухолевой ткани или метастазах. При этом рекомендовано определять ПСА через 60-90 дней после удаления простаты в связи с возможными ложноположительными результатами.Эффективность терапии (например, лучевой, гормональной) определяется значимым снижением концентрации ПСА.
Таким образом, показаниями к проведению исследования уровня простатического специфического антигена являются:
- ранняя диагностика рака предстательной железы;
- решение о целесообразности проведения биопсии простаты;
- мониторинг течения заболевания;
- оценка эффективности проводимой терапии рака простаты;
- диагностика метастазирования.
Подготовка к процедуре
Предпочтительно выдержать 4 часа после последнего приема пищи.
Анализ следует проводить до или не ранее чем через 6-7 дней после массажа или пальцевого ректального обследования простаты, трансректального УЗИ, биопсии, лазерной терапии, эргометрии, цистоскопии, колоноскопии, после любых других механических воздействий на простату.
Срок исполнения
До 1 рабочего дня, указанный срок не включает день взятия биоматериала.
Что может повлиять на результат
В случае несоблюдения правил подготовки полученный результат может оказаться некорректным.
Повышенная концентрация ПСА может наблюдаться в течение 10 дней после пальцевого ректального исследования, цистоскопии, колоноскопии, трансуретральной биопсии, простатэктомии или массажа простаты, лазерной терапии, при задержке мочи, эякуляция накануне исследования.
На уровень общего ПСА могут влиять лекарственные препараты - антагонисты андрогенов, аллопуринол, финастерид, циклофосфамид, метотрексат.
ПСА общий (Простатический специфический антиген общий, Prostate-specific antigen total, PSA total)
ПСА общий – белок, специфичный для ткани предстательной железы, используемый в качестве опухолевого маркера. Физиологический экскреторный продукт предстательной железы. Синонимы: Анализ крови на ПСА общий; Простат-специфический антиген общий. Prostate-specific antigen total.
Читайте также: