Вирус результатов не найдено
Обновлено: 25.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Напоминаем вам, что самостоятельная интерпретация результатов недопустима, приведенная ниже информация носит исключительно справочный характер
Определение ДНК вируса папилломы человека: показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Показание к назначению исследования
Вирусы папилломы человека (ВПЧ) - это группа генетически разнообразных ДНК-содержащих вирусов, относящихся к семейству Papillomaviridae и поражающих эпителий кожных покровов и слизистых оболочек ротовой полости и аногенитальной зоны.
Инфицирование вирусом папилломы человека клинически может проявляться остроконечными кондиломами, папилломами или злокачественной трансформацией клеток. По данным, которые приводит Всемирная организация здравоохранения, 50-80% населения инфицировано ВПЧ, а 5-10% из них имеют клинические проявления заболевания.
Наследственный материал (геном) вируса папилломы человека заключен в белковую оболочку, состоящую из больших (L1) и малых (L2) структурных белков. В зависимости от строения генома L1 были выявлены и описаны различные типы вируса папилломы человека. К настоящему времени выявлено и описано более 200 генотипов вируса папилломы человека, около 45 из них могут инфицировать эпителиальный слой урогенитального тракта.
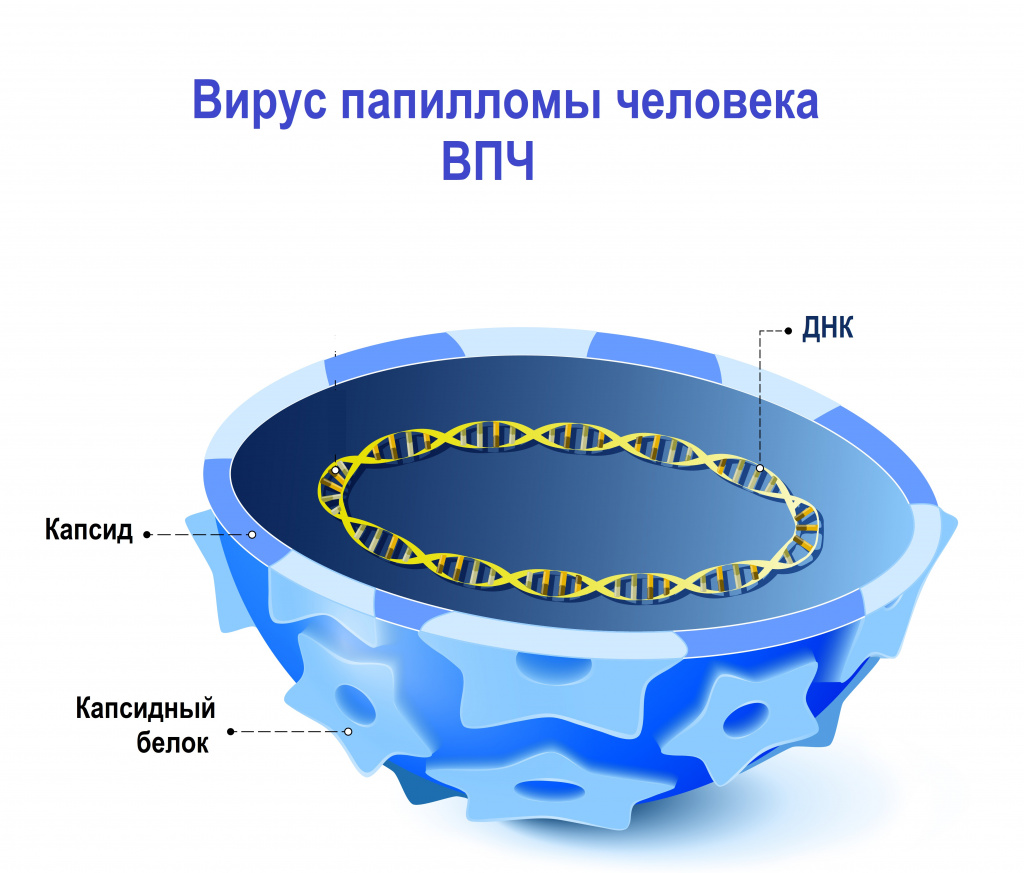
ВПЧ обладает тропностью (свойством поражать определенные органы и/или ткани) к коже и слизистым оболочкам. Источником возбудителя инфекции является больной человек или вирусоноситель.
Основной путь передачи возбудителя - половой (генитально-генитальный, мануально-генитальный, орально-генитальный), однако возможна передача и при соприкосновении (при кожном контакте). Кроме того, ВПЧ может передаваться от матери плоду во время родов.
Риск передачи при однократном половом контакте равен 80% - особенно у девушек, не достигших половой зрелости, из-за особенностей строения эпителия шейки матки в юном возрасте.
Факторы, способствующие инфицированию вирусом папилломы человека и развитию заболевания:
- раннее начало половой жизни;
- частая смена половых партнеров;
- сопутствующая урогенитальная инфекция и нарушение биоценоза влагалища;
- частые роды и аборты;
- иммунодефицитные состояния;
- генетическая предрасположенность и гормональные факторы.
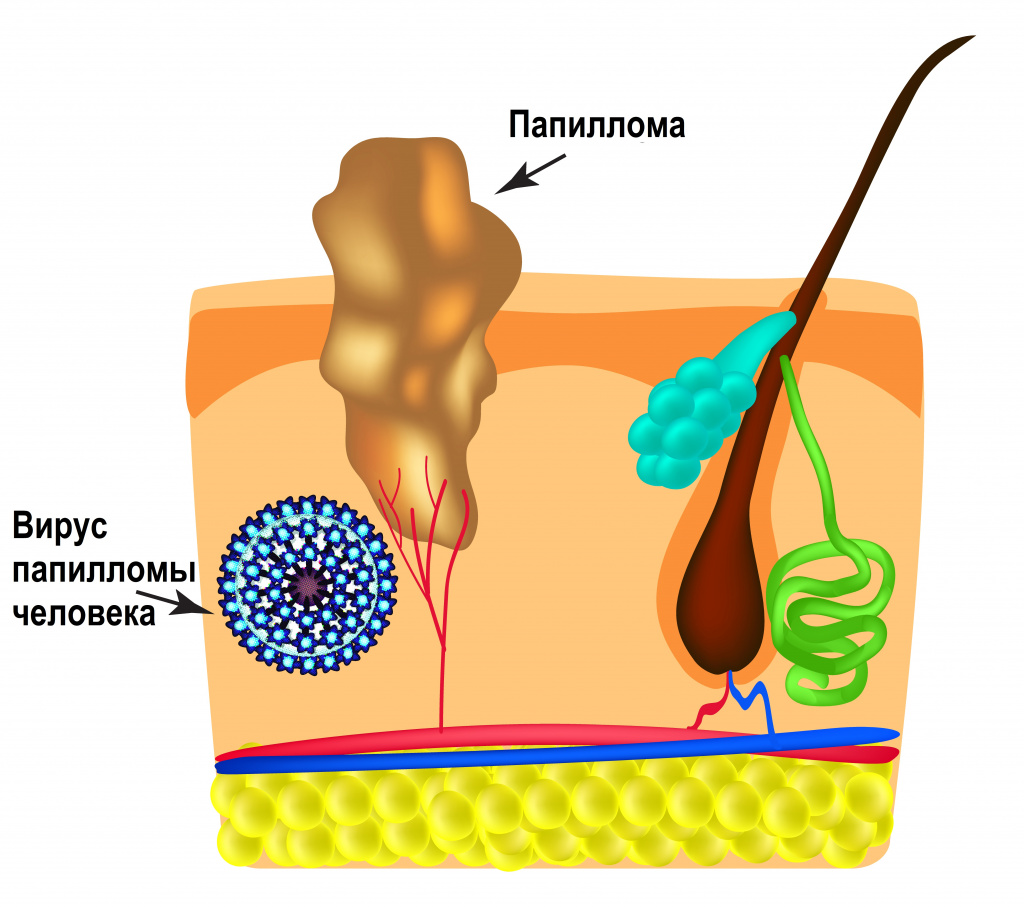
Интервал между инфицированием ВПЧ и инвазивным (проникающим) раком составляет около 10 лет или более.
Инвазивному раку предшествуют предраковые поражения шейки матки, вульвы, влагалища, анального канала, полового члена различной степени тяжести.
Вирус папилломы человека не проникает в кровь, поэтому инфекционный процесс протекает без развития воспалительной реакции.
Выделяют вирусы высокого онкогенного (или канцерогенного) риска (типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59) и низкого онкогенного риска (типы 6, 11, 42, 43, 44).
Типы ВПЧ низкого канцерогенного риска связаны с развитием остроконечных кондилом, папиллом и дисплазиями легкой степени. Типы ВПЧ высокого канцерогенного риска, наряду с остроконечными кондиломами и дисплазиями, также могут вызывать злокачественную трансформацию эпителия, приводя к развитию рака.
Например, высокоонкогенные типы ВПЧ 16 и 18 вызывают в 70% случаев рак шейки матки, в 80% рак вульвы и влагалища, в 92% анальный рак, в 95% рак ротовой полости, в 89% рак ротоглотки, в 63% рак полового члена. Генотипы ВПЧ 6 и 11 обуславливают практически все виды аногенитальных бородавок и большинство случаев рецидивирующего респираторного папилломатоза.
Таким образом, дифференцированное определение ДНК вируса папилломы человека назначают в следующих случаях:
- для подтверждения ВПЧ при наличии папилломатозных разрастаний и изменений на слизистых оболочках половых органов;
- для скрининга (обследования лиц, не считающих себя больными) с целью выявления скрыто протекающего заболевания;
- для контроля эффективности проводимой терапии.
- с 21 года до 29 лет - не реже 1 раза в 3 года;
- с 30 до 69 лет - не реже 1 раза в 5 лет.
Высокая сексуальная активность предполагает проведение скрининга с18 лет.
Подготовка к процедуре
Обследование женщин целесообразно проводить в первую половину менструального цикла, но не ранее 5-го дня. Допустимо обследование во второй половине цикла, но не позднее, чем за 5 дней до предполагаемого начала менструации.
Накануне и в день обследования пациентке не рекомендуется спринцевать влагалище. Забор биоматериала не следует осуществлять ранее 24-48 часов после полового контакта, интравагинального УЗИ и кольпоскопии.
Соскоб из уретры проводят до или через 2-3 часа после мочеиспускания.
Мужчинам необходимо исключить половые контакты за 1–2 суток до взятия мазка (соскоба). Нельзя мочиться в течение 1,5-2 часов до процедуры.
Срок исполнения
До 2 рабочих дней, указанный срок не включает день взятия биоматериала.
Что может повлиять на результат
В случае несоблюдения правил подготовки полученный результат может быть некорректным.
Дифференцированное определение ДНК ВПЧ (вируса папилломы человека, Humanpapillomavirus, HPV) 21 типа (6, 11, 16, 18, 26, 31, 33, 35, 39, 44, 45, 51, 52, 53, 56, 58, 59, 66, 68, 73, 82) + КВМ
Синонимы: Анализ урогенитального соскоба на ВПЧ. HPV DNA, 21 Types, Scrape of Urogenital Epithelial Cells. Краткое описание исследования «Дифференцированное определение ДНК ВПЧ (Вирус папилломы человека, Human papillomavirus, HPV) 21 типа (6, 11, 16, 18, 26, 31, 33, 35, 39.
Исследуемый материал: соскоб эпителиальных клеток урогенитального тракта.
Форма представления результатов: количественный результат по каждому выявляемому показателю.
Единицы измерения: логарифм копий ДНК ВПЧ на 105 эпителиальных клеток (lg копий ДНК/105 эпит. клеток).
До проведения тестов по выявлению ДНК ВПЧ выполняется контроль взятия материала (КВМ). Если в пробе значение КВМ неудовлетворительное (менее 4 lg (10000) копий ДНК человека в пробе), исследование ДНК ВПЧ не проводится и рекомендуется повторное взятие биологического материала.
Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т. д.
Расшифровка показателей
Количественный формат теста позволяет выявить вирус, оценить степень риска и возможное наличие предраковых изменений при высокой вирусной нагрузке.
Интерпретация положительного результата
В анализируемом образце биологического материала обнаруженная ДНК, специфичная для вируса папилломы человека исследуемых типов в выявленной концентрации, свидетельствует о наличии возбудителя.
Если абсолютное содержание ВПЧ превышает клинически значимое, напротив обнаруженного штамма вируса указывается его концентрация. Чем выше значение, тем выше риск развития болезней, вызываемых вирусом папилломы человека.
Рост вирусной нагрузки через 3, 6 и 9 мес. после проведенного лечения свидетельствует о возможности рецидива.
- генотипы низкого онкогенного риска: 6, 11, 44;
- генотипы высокого онкогенного риска: 16, 18, 26, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 73, 82.
Выявление нескольких генотипов вируса предполагает менее благоприятный прогноз течения заболевания и более высокий риск персистенции.
При обнаружении 16 и 18 генотипов рекомендуется проводить кольпоскопическое обследование, не откладывая.
При выявлении других типов высокого риска назначают цитологическое обследование, а при его положительном результате - кольпоскопию.
Дополнительное обследование при отклонении от нормы
Врач интерпретирует результат анализа с учетом данных о пациенте и болезни, заключений осмотра, цитологического и гистологического исследований.
Гинеколог, уролог или проктолог может назначить дополнительные исследования:
-
цитологическое исследование биоматериала соскобов вульвы и влагалища, кроме шейки матки (окрашивание по Папаниколау, Рар-тест);
В цитологическом методе диагностики для окрашивания биологического материала используют несколько способов окраски. Применение определённого метода окрашивания позволяет решить специфические задачи. Каждый метод окрашивания имеет свои особенности, специфику, например, характер окрашивания ядра, ц.

Разработчик сайтов, журналист, редактор, дизайнер, программист, копирайтер. Стаж работы — 25 лет. Область интересов: новейшие технологии в медицине, медицинский web-контент, профессиональное фото, видео, web-дизайн. Цели: максимально амбициозные.
- Запись опубликована: 21.01.2022
- Reading time: 6 минут чтения
С начала пандемии ученые всего мира ищут ответ на вопрос, как долго сохраняется иммунитет у выздоровевших людей. Исследования подтверждают теорию о том, что антитела после COVID-19 сохраняются до нескольких месяцев, а их количество индивидуально и зависит от многих факторов.
Кого можно считать выздоровевшим от КОВИД?
Выздоровевшим считается человек, у которого COVID-19 был диагностирован на основе клинических критериев или подтвержден в лаборатории, и у которого больше нет симптомов этого заболевания и он не заразен.
Как работает иммунитет к COVID-19 у выздоровевших людей?
Чтобы получить ответ на этот вопрос, рассмотрим механизм иммунитета к коронавирусу. Иммунитет, защищающий организм от заражения COVID-19, связан с наличием в организме антител, специфичных к вирусу SARS-CoV-2 и специализированных клеток иммунной системы. Они запрограммированы на уничтожение вируса при новом контакте.
Таблица 1. Классы антител
Специфические физиологические функции связаны с классом антител. Антитела — часть механизма приобретенного, т.е. адаптивного иммунитета.
Для эффективной борьбы с коронавирусом организму необходим именно адаптивный иммунитет, поскольку он позволяет вырабатывать таргетные антитела и Т-лимфоциты, атакующие клетки, инфицированные вирусом. Если адаптивная реакция достаточно сильна, она оставляет постоянную память об инфекции в организме, обеспечивая защиту от вируса в будущем.
Как проверить уровень иммунитета при COVID-19?
Метод мониторинга уровня иммунитета, полученного после COVID-19 или после вакцинации против SARS-COV-2 — измерение концентрации антител против SARS-CoV-2. Известно, что иммунитет пропорционален концентрации антител.
Некоторые тесты адаптированы для измерения антител, особенно важных в механизмах противовирусного гуморального иммунитета – антител, нейтрализующих IgG anti-S. Результат теста выражается в BAU/мл. Измерение концентрации антител дважды позволяет уловить скорость изменения концентрации с течением времени.
Сроки измерений антител жестко не фиксированы, но их однозначно не следует делать в первые 2 недели после вакцинации. Лучше дождаться второй бустерной дозы и сдать анализы через пару недель.
Зная уровень ранних антител – IgM и поздних – IgG можно оценить эффективность иммунной системы, т.е. справилась ли она с коронавирусом SARS CoV-2 после заражения или после вакцинации. Тестирование уровня антител к COVID-19 также позволяет оценить время, прошедшее с момента заражения или последнего контакта с вирусом.
Можно ли отличить антитела после COVID-19 от антител после вакцинации?
Выработка антител стимулирует контакт иммунной системы с частицами (антигенами) вируса. Такой контакт может происходить по-разному. Наиболее распространенные — болезни или вакцинация, стимулирующие организм вырабатывать антитела против COVID-19 — сначала в классе IgM, а затем и в антителах IgG.
Вакцина содержит только модифицированный антиген, полученный из шипа на поверхности вируса, так называемый белок S. Поэтому после вакцинации антитела к COVID образуются только против этого белка. При заболевании COVID, организм контактирует с различными антигенами вируса, а не только с белком S, например, с белком N. Следовательно после болезни образуются различные антитела. На этом основании можно отличить антитела после заболевания (направленные против нуклеокапсидного N-белка) от образовавшихся после вакцинации (направленных только против белка S). Для выявления специфических антител следует проводить только соответствующий тест.
Какой уровень антител защищает от болезни?
Каждый организм по-разному реагирует на болезнь и введение вакцины, поэтому уровень вырабатываемых антител не одинаков. Их количество может варьироваться от нескольких десятков до нескольких тысяч связывающих антител, т.е. BAU (Binding Antibody Units) на миллилитр (/мл).
Пока ученым не удалось определить уровень (титр) антител к COVID, являющихся нормой, защищающей от заболевания. Однако известно, что их уровень отражает реакцию иммунной системы на вакцинацию.
При интерпретации результата на уровне антител необходимо учитывать принимаемые препараты. Некоторые из них, например, глюкокортикостероиды, иммуносупрессивные и противоопухолевые препараты, ухудшают иммунный ответ. У принимающих их людей обычно вырабатывается меньше антител.
С другой стороны, даже очень высокий результат (порядка нескольких тысяч антител/мл) не гарантирует иммунитет от болезни, но безусловно, позволяет избежать тяжелого и опасного для жизни течения заболевания.
Со временем на основании результатов научных исследований и статистических данных, уровень антител, выше которого защита от болезни будет почти стопроцентной, будет установлен.
Виды тестов на уровни антител при COVID-19 – от чего зависит интерпретация результатов анализов
Чтобы диагностировать COVID-19, используются разные виды тестов – генетические и антигенные, требующие мазка из носоглотки и анализы крови на наличие антител.
- Генетическое тестирование . Основано на методах молекулярной биологии, поэтому наиболее чувствительно. То есть COVID-положительные результаты обычно являются истинными (достоверными).
- Антигенные тесты . Это популярные кассетные тесты на SARS-CoV-2. Они менее чувствительны, но просты в использовании и результат получается быстро. Результат теста на COVID может быть положительным (была инфекция), отрицательным (вирус не обнаружен) или неубедительным (тест нужно повторить). . Обнаруживают COVID-специфические антитела IgG и антитела IgM. Это могут быть качественные тесты, т.е. оценка того, существуют ли вообще данные антитела. При интерпретации результатов тестов IgG и IgM результаты интерпретируются с использованием готовых, простых для понимания инструкций. Также доступны количественные тесты. В них уровень антител к COVID определяется числовым значением, выраженным в единице BAU/ml.
Интерпретация результатов на уровне антител IgG
Тесты на IgG SARS-CoV-2 интерпретируются только с точки зрения их наличия и/или уровня в крови. Можно получить отрицательный или положительный результат. Реактивным (положительным) результатом считается >/= 30 БАУ/мл, нереактивным (отрицательным) результатом —
Отрицательный результат теста на антитела IgG свидетельствует об:
- отсутствии контакта с вирусом;
- отсутствии вакцинации;
- неэффективности вакцины;
- серологическом окно — время, необходимое инфицированному организму для выработки антител, направленных против патогена; это также ранний момент заражения, когда антитела еще не обнаруживаются;
- недавнем контакте с возбудителем.
Антитела IgG вырабатываются через некоторое время после заражения и в среднем это период в 2-3 недели, поэтому в начале их может еще не быть.
Положительный результат теста на антитела IgG свидетельствует о том, что:
- в анамнезе была инфекция;
- пациент вакцинирован.
И болезнь, и вакцинация, должны были, имели место некоторое время назад.
Количество антител к COVID-19 следует интерпретировать согласно инструкции производителя теста. У каждого человека может быть разный уровень антител.
Интерпретация результатов на уровне антител IgM
Антитела IgM образуются сначала после контакта с вирусом/вакциной. Они производятся уже через несколько дней.
Положительный результат теста на уровень антител класса IgM (высокий уровень IgM), при отсутствии антител IgG (низкий уровень IgG), указывает на текущую или недавнюю инфекцию или вакцинацию. Титры IgM постепенно снижаются, поэтому они не подходят для оценки иммунного ответа на вакцинацию. Они полезны только при обнаружении недавней инфекции.
Оценка IgG и IgM
Анализ общего результата, как уровня IgG к COVID-19, так и уровня антител IgM, может быть полезен для определения был ли пациент в контакте с вирусом.
- Высокие уровни IgM с низким / нулевым IgG, скорее всего, указывают на недавнюю первую болезнь / вакцинацию.
- Высокий уровень IgG с низким IgM указывает на отдаленное время от первой болезни или вакцинации.
Расшифровывать результаты антител к COVID-19 следует у врача.
Отрицательный тест на антитела
Результат теста на уровень антител к COVID-19, интерпретируемый как отрицательный (нереактивный результат), возможен при достижении концентрации антител ниже уровня, указанного в тесте как реактивного, т.е. положительного. Он необязательно должен быть равен нулю.
Отрицательный результат обычно свидетельствует об отсутствии коронавирусной инфекции или отсутствии или неэффективности вакцинации. Это указывает на то, что организм никогда не вступал в контакт с вирусом или его антигенами и не вырабатывал антитела.
Другая ситуация, когда результат теста может быть нереактивным, — длительный период с момента последнего контакта с вирусом, так как ранее выработанные антитела через некоторое время начинают исчезать. Отсутствие раздражителей в виде антигенов приводит к тому, что организм перестает вырабатывать антитела и их уровень снижается.
Также организм может слабо реагировать на контакт с вирусом или вакциной и не вырабатывать антитела в ситуации иммунодефицита из-за лекарств или болезни.
Какой уровень антител после ковид 19 — норма?
Таблица 2. Результаты тестов на антитела у переболевших
Резюме интерпретации тестов на антитела против SARS-CoV-2 (серологические)
| Тесты | Положительный результат | Отрицательный результат |
| ПОСЛЕ COVID-19 | ||
| P-тело p/SARS-CoV-2 IgM полуколичественно |
* Период, необходимый инфицированному организму для выработки антител, направленных против возбудителя – в этот ранний период инфекции антитела еще не обнаруживаются.
** Можно провести клеточный ответ.
Устойчивость выздоровевших людей к Covid– что показывают исследования?
Первое исследование по определению вероятности повторного заражения после заражения SARS-CoV-2, без предварительного получения вакцины от covid-19, было проведено учеными из Йельской школы общественного здравоохранения и Университета Северной Каролины в Шарлотте.
Результаты дали четкий ответ, что иммунная резистентность после естественного течения covid-19 недолговечна. У людей, которые не вакцинировались, повторное заражение SARS-CoV-2 весьма вероятно вскоре после выздоровления, даже в течение 3-х месяцев. Поэтому авторы исследования рекомендуют вакцинацию, поскольку сама инфекция мало защищает от последующего заражения.
Ученые из Института Ла-Хойя, основываясь на зафиксированных до сих пор реинфектациях, сделали вывод, что если первая инфекция имеет тяжелое течение, то иммунный ответ организма будет сильнее. Благодаря этому шансы на повторное заражение значительно снижаются. В свою очередь, журнал Healthline ссылается на исследование, опубликованное в журнале Immunity, показывающее, что выздоровевшие люди, легко перенесшие болезнь, вырабатывают антитела не менее 5-7 месяцев.
На основании этих исследований можно предположить, что у значительной части выздоровевших людей в течение нескольких месяцев фактически поддерживаются высокие концентрации антител, которые постепенно снижаются с течением времени. При снижении концентрации антител повышается риск повторного заражения и тяжелого течения болезни.
Долгосрочный иммунитет у выздоровевших от COVID-19
Исследование ученых из Вашингтонского университета, опубликованное в журнале Nature, показывает, что клетки, сохраняющие память о прошлом вирусе, остаются в костном мозге, чтобы иметь возможность вырабатывать антитела в любое время. В свою очередь, второе исследование говорит о том, что В-клетки, отвечающие за иммунную память, спустя год после заражения находятся еще на стадии созревания и укрепления.
Перенесенный COVID-19 не дает 100% гарантии от повторного заражения, хотя, как показывают многочисленные исследования, может ограничить его риск на некоторое время. Чтобы обезопасить себя от повторного заражения вирусом, необходимо заботиться об иммунитете. Также нужно вакцинироваться.
Вакцина не полностью защищает от инфекции, но облегчает клиническое течение заболевания и значительно снижает риск летального исхода. Отсрочка принятия решения о вакцинации дает вирусу шанс распространяться и бесконтрольно мутировать.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Определение
Новая коронавирусная инфекция COVID-19 – это острое инфекционное заболевание, относящееся к группе ОРВИ (острых респираторных вирусных инфекций). Его вызывает новый коронавирус SARS-CoV-2.
Основным источником инфекции является больной человек, в том числе находящийся в инкубационном периоде заболевания (между моментом заражения и появлением первых жалоб).
Наибольшую опасность для окружающих человек представляет в последние два дня инкубационного периода (больной еще не знает, что болен, но уже выделяет вирус) и в первые дни болезни (поскольку выделяет максимальное количество вируса).
Пути передачи вируса
Передача инфекции осуществляется воздушно-капельным и контактным путями. Воздушно-капельный путь считается основным и реализуется при кашле, чихании и разговоре на близком (менее 2 метров) расстоянии. Контактным путем можно заразиться через рукопожатия, объятия и поцелуи, а также через поверхности и предметы, пищевые продукты, обсемененные вирусом.
Жалобы при COVID-19 неспецифичны и встречаются при других ОРВИ. В большинстве случаев болезнь протекает нетяжело. Нередко отмечается и вовсе бессимптомное течение: человек чувствует себя хорошо, не предъявляет никаких жалоб, а о перенесенной болезни узнает случайно, сдав анализы.
- Легкое течение (около 80% заболевших).
- Температура тела до 38°C, кашель (чаще сухой, но может быть и с мокротой), общая слабость, боли в горле; возможно, снижение обоняния и вкуса, расстройство стула, различные кожные высыпания.
- Среднетяжелое течение.
- Температура тела выше 38°C.
- Частота дыхания более 22/мин.
- Одышка – ощущение нехватки воздуха, сопровождающееся изменением частоты, глубины и ритма дыхания при обычных физических нагрузках.
- Изменения на КТ (компьютерной томографии) органов грудной клетки, типичные для вирусного поражения (объем поражения минимальный или средний; КТ 1-2).
- Сатурация кислорода (SpO2) – насыщение крови кислородом менее 95%.
- СРБ (С-реактивный белок) сыворотки крови более 10 мг/л.
- Тяжелое течение.
- Частота дыхания более 30/мин.
- SpO2 менее 93%.
- Снижение уровня сознания или возбуждение.
- Нестабильная гемодинамика (снижение артериального давления менее 90/60 мм рт. ст., уменьшение объема выделяемой мочи).
- Изменения в легких на КТ органов грудной клетки, типичные для вирусного поражения (объем поражения значительный или субтотальный; КТ 3-4).
- Изменения ряда лабораторных показателей, определяемых в условиях отделения интенсивной терапии.
- Крайне тяжелое течение – множественные тяжелейшие поражения органов и систем с необходимостью респираторной поддержки (инвазивной вентиляции легких).
- Изменения в легких при КТ, типичные для вирусного поражения критической степени (объем поражения значительный или субтотальный; КТ 4).
Наличие вируса в организме можно выявить путем взятия мазков из носоглотки (носа) и ротоглотки (зева).
- Обнаружение РНК SARS-CoV-2 методом ПЦР;
- Обнаружение вирусных антигенов (экспресс-диагностика).
- Обнаружение антител IgG и IgM к коронавирусу – качественный (есть или нет антитела) и количественный (сколько антител) методы.
- Обнаружение антител IgG и IgM к коронавирусу (экспресс-диагностика).
Их достоинства – быстрое (в течение 20-30 минут) получение результата, возможность использования в домашних условиях. Недостаток – не слишком высокая точность: из-за невысокой чувствительности тесты не всегда могут определить пациентов с новой коронавирусной болезнью (не определяют примерно каждого четвертого). Если тест положительный, то это практически всегда верно. Отрицательный тест не исключает наличие болезни. Экспресс-методы могут использоваться в первичной диагностике для определения дальнейшей тактики обследования.
-
Клинический (общий) анализ крови, С-реактивный белок, прокальцитонин – для исключения присоединения бактериальной инфекции.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
С-реактивный белок – белок острой фазы, чувствительный индикатор повреждения тканей при воспалении, некрозе, травме. Синонимы: Анализ крови на СРБ; С-реактивный белок сыворотки крови. C-reactive Protein (CRP), quantitative; C-reactive protein test; CRP test. Краткое описание опред.
Синонимы: Анализ крови на прокальцитонин; ПКТ. Procalcitonin; PCT. Краткая характеристика определяемого вещества Прокальцитонин Прокальцитонин является прогормоном кальцитонина, состоящим из 116 аминокислот с молекулярной массой 14,5 кDa. Биосинтез прокальцитонина в физиологических условиях прои.
Синонимы: Фрагмент расщепления фибрина. D-dimer, Fragment D-dimer, Fibrin degradation fragment. Краткая характеристика определяемого вещества D-димер D-димер представляет собой растворимый продукт расщепления поперечно-сшитого фибрина. Генерация D-димера требует последовательной активност.
Для проведения исследования в медицинских офисах необходимо предъявить СНИЛС и документ удостоверяющий личность. Запись на исследование В случае получения положительного или сомнительного результата на COVID-19 и при необходимости проведения подтверждающего тестирования обра.
Срок выполнения исследования на выявление РНК SARS-CoV-2 в лабораториях медицинских организаций не должен превышать 48 часов с момента получения биологического материала. Если отбор проводится не в лабораторном центре, необходимо учитывать время доставки проб до лаборатории. Срок выполнения исследований в референтной лаборатории – не более 48 часов с момента доставки образца.
Взятие мазка методом ПЦР для обнаружения РНК SARS-CoV-2 проводится:
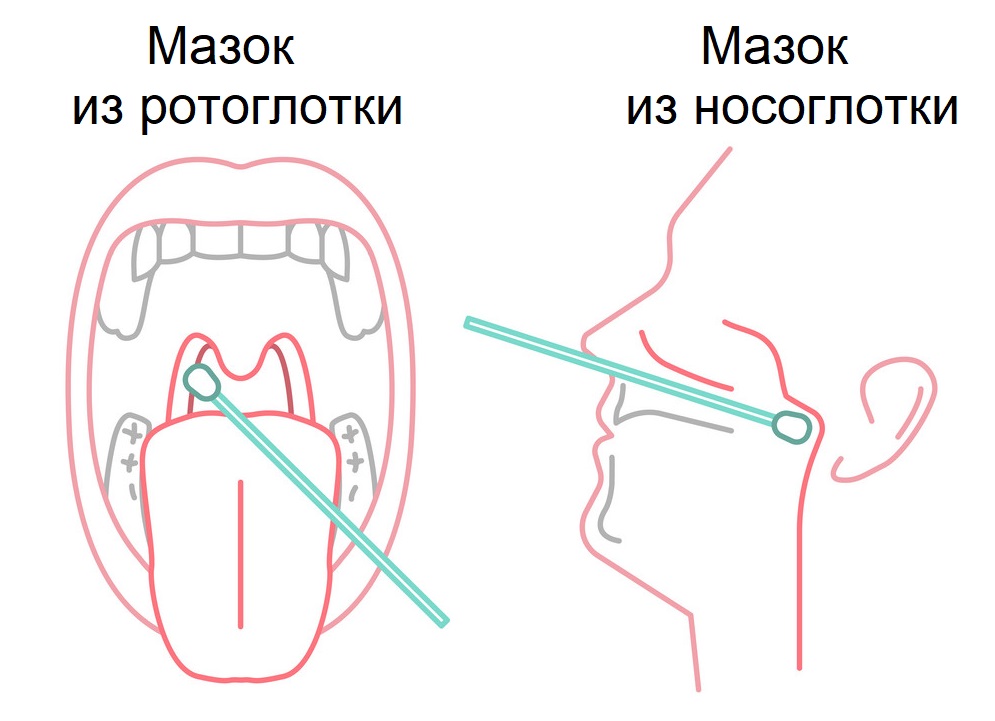
Пациенту за 3-4 часа до взятия мазка нельзя есть, пить, чистить зубы, полоскать рот и горло, использовать спрей-освежитель для ротовой полости, жевать жевательную резинку, курить. Кроме того, нельзя промывать нос, использовать спреи, капли, мази для носа. Это позволит сохранить для исследования максимально возможное число пораженных вирусом клеток эпителия (наружного слоя) верхних дыхательных путей.
Интерпретация результатов
К сожалению, ПЦР-диагностика иногда может давать ошибочные результаты. Причины ложноотрицательных результатов (человек болен COVID-19, а результат теста отрицательный):
- количество вируса в образце меньше порога чувствительности тест-системы из-за некорректной подготовки пациента к исследованию или из-за небольшого количества вируса в организме (низкая вирусная нагрузка), например, при бессимптомном течении или в период выздоровления;
- некорректное взятие мазка – например, только из зева или только из носа, погрешности в технике забора материала;
- нарушение рекомендованного срока хранения взятого образца;
- ненадежная система идентификации образцов, что ведет к получению чужого результата.
Антитела класса М (IgМ) к SARS-CoV-2 появляются, как правило, на 7-10 день болезни. Они могут сохраняться в организме человека до 2-3 месяцев. Поэтому их обнаружение говорит о текущей или недавно перенесенной инфекции.
Антитела класса G (IgG) к SARS-CoV-2 обнаруживают обычно через 10-14 дней после начала болезни. Выявление IgG-антител к возбудителю COVID-19 свидетельствует, что человек выздоравливает или уже переболел коронавирусной инфекцией. Длительность их сохранения в организме на сегодняшний день точно неизвестна.
Тестирование на антитела к вирусу SARS-Cov-2 рекомендуется использовать в следующих случаях:
- в качестве дополнительного метода диагностики острой инфекции (не ранее 7-го дня болезни для IgM, не ранее 10-14-го дня болезни для IgG) или при невозможности по какой-либо причине исследования мазков;
- для выявления лиц с бессимптомной формой инфекции;
- для установления факта перенесенной ранее инфекции при обследовании групп риска и проведении массового обследования населения для оценки уровня популяционного иммунитета;
- для отбора потенциальных доноров иммунокомпетентной (антиковидной) плазмы.
Донорами антиковидной плазмы могут стать лица в возрасте от 18 до 55 лет, с отсутствием противопоказаний к донорству (ряд хронических заболеваний, беременность), которые болели коронавирусной инфекцией и выздоровели, при условии, что с начала болезни прошло не менее 5 недель.
Для оценки иммунитета после вакцинации имеет значение только выявление определенных IgG – антител к спайковому (S) белку SARS-CoV-2 (качественный).
Для проведения исследования в медицинских офисах необходимо предъявить СНИЛС и документ удостоверяющий личность. Синонимы: Выявление IgG к спайковому (S) белку SARS-CoV-2 (качественный анализ) после COVID-19 и для оценки эффективности вакцинации (вакцинным препаратом на основе RBD-домена.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Вирус Эпштейна–Барр: причины появления, симптомы, диагностика и способы лечения.
Вирус Эпштейна–Барр может инфицировать различные типы клеток, включая B-клетки иммунной системы (разновидность лейкоцитов – белых кровяных телец) и эпителиальные клетки слизистых оболочек.
ВЭБ является представителем ДНК-содержащих вирусов из семейства Herpesviridae (герпесвирусы), подсемейства гамма-герпесвирусов и рода лимфокриптовирусов. В процессе репликации (самокопирования) вируса экспрессируется свыше 70 различных вирусспецифических белков. В настоящее время выделены группы иммуногенных белков, определение антител к которым дает возможность дифференцировать стадию инфекции (ЕА – ранний антиген, ЕВNА-1 — ядерный антиген, VCA — капсидный антиген, LMP — латентный мембранный белок).
Другой способ заражения – контактно-бытовой (вирус передается через зубные щетки, столовые приборы, полотенца и т.д.). ВЭБ также может распространяться через кровь и сперму.
ВЭБ размножается в В-лимфоцитах и эпителиальных клетках, в связи с чем характерно многообразие клинических проявлений данной патологии. Важной отличительной чертой вируса является то, что он не тормозит и не нарушает размножение В-лимфоцитов, а, наоборот, стимулирует его. В этом заключается особенность возбудителя - он размножается в клетках иммунной системы, заставляя их клонировать свою, вирусную, ДНК.
Хронический воспалительный процесс, вызванный ВЭБ, приводит к структурным и метаболическим нарушениям пораженных тканей, что является причиной возникновения разнообразной соматической патологии.
Классификация вируса Эпштейна-Барр
Единой классификации вирусной инфекции Эпштейна-Барр (ВИЭБ) не существует, к использованию в практической медицине предлагается следующая:
- по времени инфицирования – врожденная и приобретенная;
- по форме заболевания – типичная (инфекционный мононуклеоз) и атипичная: стертая, асимптомная, с поражением внутренних органов;
- по тяжести течения – легкая, средней степени и тяжелая;
- по продолжительности течения – острая, затяжная, хроническая;
- по фазе активности – активная и неактивная;
- смешанная инфекция – чаще всего наблюдается в сочетании с цитомегаловирусом.
- Инфекционный мононуклеоз (железистая лихорадка, болезнь Филатова) – распространенное инфекционное заболевание, основными проявлениями которого является подъем температуры до высоких значений, увеличение лимфатических узлов, воспаление слизистой оболочки глотки, увеличение печени и селезенки. ВЭБ в данном случае проникает через эпителий слизистых оболочек верхних дыхательных путей.
- Лимфогранулематоз (болезнь Ходжкина) и некоторые виды неходжкинских лимфом – группа заболеваний, объединенных злокачественной моноклональной пролиферацией лимфоидных клеток в лимфоузлах, костном мозге, селезенке, печени и желудочно-кишечном тракте.
- Синдром хронической усталости – состояние, характеризующееся длительным чувством усталости, которое не проходит после продолжительного отдыха.
- Синдром Алисы в стране чудес – состояние, клиническим проявлением которого является нарушение ощущения своего тела и отдельных его частей. Человек ощущает себя или части своего тела очень большими или очень маленькими по сравнению с действительностью.
- Гепатит, спровоцированный ВЭБ, часто является осложнением инфекционного мононуклеоза. Появляется слабость, тошнота, желтушность кожи и слизистых, увеличивается печень.
- Герпетическая инфекция в виде генитального или лабиального (на губах) поражения. Также возможен стоматит, вызванный ВЭБ. При активации инфекции появляется чувство жжения и боль, а затем множество маленьких пузырьков.
- Посттрансплантационная лимфопролиферативная болезнь – вторичное злокачественное заболевание, развивающееся после трансплантации гемопоэтических стволовых клеток (метод лечения, применяемый при онкологии, заболеваниях крови и др.), ассоциированное с ВЭБ-инфекцией.
- Рассеянный склероз – хроническое аутоиммунное заболевание, при котором поражается миелиновая оболочка нервных волокон головного и спинного мозга. Характеризуется большим количеством симптомов и зависит от уровня поражения: часто снижается мышечная сила, угасают рефлексы, появляются параличи (обездвиженность) различных локализаций.
- Волосатая лейкоплакия – на слизистой оболочке языка по бокам, на спинке либо на его нижней части появляются белые участки с шероховатой поверхностью. Они безболезненны и не причиняют существенного дискомфорта. Основная опасность заключается в возможности озлокачествления измененных клеток слизистой.
- Назофарингеальная карцинома – злокачественное образование глотки. Среди его симптомов часто встречаются заложенность носа, потеря слуха, частые отиты, появление крови в слюне, кровянистые выделения из носа, увеличение лимфоузлов, головные боли.
- Аутоиммунный тиреоидит – хроническое заболевание щитовидной железы, при котором в организме образуются антитела к тканям щитовидной железы. При данном заболевании возможно появление зоба (увеличение щитовидной железы), развитие симптомов гипотиреоза: отеки, повышенная утомляемость, сонливость, запоры, сухость кожи, выпадение волос.
Лабораторное обследование включает:
-
вирус Эпштейна–Барр, определение ДНК в крови (Epstein Barr virus, DNA);

Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.
Читайте также:

