Вирус в плаценте человека
Обновлено: 13.05.2024
Рассмотрена проблема внутриутробного инфицирования и внутриутробной инфекции (ВУИ) плода, факторы риска внутриутробных инфекций, патогенетические механизмы возникновения, развития и воздействия ВУИ, подходы к диагностике и лечению.
The issue of fetal intrauterine infecting and intrauterine infection (IUI) was considered, as well as the risk factors of intrauterine infections, pathogenic mechanisms of their occurrence, development and effect of IUI, and approaches to the diagnostics and treatment.
Проблема внутриутробной инфекции особо актуальна в современных условиях в связи с распространенностью и тяжестью воспалительных процессов. Проблема внутриутробного инфицирования и внутриутробной инфекции (ВУИ) плода является одной из ведущих в акушерской практике и в перинатологии в связи с высоким уровнем инфицирования беременных, рожениц и родильниц, опасностью нарушения развития плода и рождения больного ребенка. Наличие инфекции у матери является фактором риска ВУИ плода, но не всегда означает его заболевание [1, 5–7, 13].
Внутриутробная инфекция — группа инфекционно-воспалительных заболеваний плода и детей раннего возраста, которые вызываются различными возбудителями, но характеризуются сходными эпидемиологическими параметрами и нередко имеют однотипные клинические проявления. Заболевания развиваются в результате внутриутробного (анте- и/или интранатального) инфицирования плода. При этом в подавляющем большинстве случаев источником инфекции для плода является мать. Истинная частота врожденных инфекций до настоящего времени не установлена, но, по данным ряда авторов, распространенность данной патологии в человеческой популяции может достигать 10%. В структуре перинатальной смертности ВУИ составляет более 30% [1, 5–7].
Кроме этого, ВУИ относятся к тяжелым заболеваниям и во многом определяют уровень младенческой смертности.
Согласно данным многих авторов, причиной внезапной смерти грудных детей является инфекционное заболевание, протекающее без ясной симптоматики. В числе причин или фоновых состояний скоропостижной смерти могут быть ВУИ [2].
Под внутриутробным инфицированием понимают процесс внутриутробного проникновения микроорганизмов к плоду, при котором отсутствуют признаки инфекционной болезни плода. Как правило, инфекционный процесс затрагивает плаценту, в которой развивается плацентит, хориоамнионит и т. д. Диагноз внутриутробного инфицирования у новорожденного устанавливается на основании выделения возбудителя из клеток крови, ликвора и других источников, выявления IgM и низкоавидных IgG в пуповинной крови, а также при морфологическом исследовании плаценты [1, 5–7].
Внутриутробное инфицирование не означает неизбежного развития инфекционного заболевания. Для выявления ВУИ необходимо наличие данных лабораторного исследования в сочетании с клинической картиной инфекционного заболевания. Под ВУИ подразумевают не только процесс распространения инфекционных агентов в организме плода, но и вызванные ими морфофункциональные нарушения различных органов и систем, характерные для инфекционной болезни (сепсис, пневмония, менингит, гепатит и т. д.), возникшей анте- или интранатально и выявляемой пренатально или после рождения [10, 11].
Инфекционно-воспалительные заболевания во время беременности имеют особенности: инфицирование плода и новорожденного может быть вызвано как острой инфекцией матери, так и активацией хронической, персистирующей инфекции во время беременности; большая часть заболеваний беременных, приводящих к внутриматочной инфекции, протекает в латентной или субклинической форме; активация персистирующей инфекции возможна при любом нарушении гомеостаза в организме беременной (стресс, острые респираторные вирусные инфекции, переохлаждение и др.) [1, 2].
Возможный спектр возбудителей внутриутробной инфекции весьма разнообразен и широк. Это бактерии (грамположительные и грамотрицательные; аэробные и анаэробные), грибы, простейшие, внутриклеточные микроорганизмы (микоплазмы, хламидии), вирусы. Чаще всего наблюдается сочетание возбудителей — бактериально-вирусная смешанная инфекция [3, 4, 10, 11].
Зачастую ВУИ ассоциируются с наличием инфекций TORCH — то есть синдромом комплекса. Данный термин образован первыми буквами латинских названий наиболее часто верифицируемых врожденных инфекций: T — токсоплазмоз (Тoxoplasmоsis), R — краснуха (Rubella), С — цитомегалия (Cytomegalia), Н — герпес (Herpes) и О — другие инфекции (Оther). К последним относят сифилис, листериоз, вирусные гепатиты, хламидиоз, ВИЧ-инфекцию, микоплазмоз и др. [9, 11].
Принимая во внимание, что источником инфекции для плода всегда является его мать, особое значение приобретают следующие факторы риска внутриутробных инфекций:
- хронические очаги инфекции в организме матери (в том числе наличие воспалительных заболеваний органов малого таза, урогенитальные инфекции);
- первичное инфицирование во время беременности, активация инфекционного процесса;
- патологическое снижение общего и местного иммунитета;
- наличие экстрагенитальной патологии (анемия, тромбофилии, аутоиммунные заболевания);
- повышение проницаемости плацентарного барьера во II и III триместрах беременности при невынашивании беременности и плацентарной недостаточности;
- отягощенный акушерско-гинекологический диагноз;
- неблагоприятные социально-бытовые факторы [1, 9, 11].
Патогенетические механизмы возникновения, развития и воздействия ВУИ разнообразны и зависят от многих факторов:
- срока беременности, при котором происходит инфицирование (чем раньше, тем прогноз будет более неблагоприятным);
- вида возбудителя, его вирулентности, массивности обсеменения;
- первичности или вторичности инфекционного процесса у беременной;
- путей проникновения инфекции к плоду (восходящий, нисходящий, гематогенный);
- степени распространенности и интенсивности воспалительного процесса;
- состояния организма матери, его иммунологической толерантности.
Влияние инфекции на эмбрион и плод заключается в воздействии комплекса следующих факторов:
- патологическое воздействие микроорганизмов и их токсинов (инфекционное заболевание, гипоксия плода, задержка развития плода);
- нарушение процесса имплантации и плацентации (низкая плацентация, предлежание плаценты);
- снижение метаболических процессов и иммунологической защиты плода [1, 9, 11].
Таким образом, реализуется ли внутриутробное инфицирование в ВУИ или нет, зависит от ряда факторов, которые мы представили выше.
Учитывая неспецифичность клинических проявлений ВУИ во время беременности, диагностика данной патологии в большинстве случаев затруднена и возможна лишь в результате сочетания клинических и лабораторно-диагностических методов обследования.
Клинический метод исследования позволяет выявить различные осложнения гестационного периода, такие как невынашивание беременности и синдром задержки роста плода (СЗРП). Кроме этого, немаловажное значение имеет наличие проявлений инфекции у матери (отит, гайморит, пиелонефрит, цистит и т. д.).
Методы, позволяющие оценить состояние фетоплацентарной системы:
- эхография (плацентометрия, поведенческая активность плода, его тонус, количество околоплодных вод, степень зрелости плаценты);
- допплерография (МПК, ФПК);
- кардиотокография (КТГ).
Микробиологические и серологические исследования:
- микроскопия влагалищных мазков (повышенное содержание лейкоцитов, кокковая флора, признаки дисбиоза, грибковая флора);
- бактериальный посев (наличие анаэробных и аэробных бактерий, грибковой флоры);
- ПЦР-диагностика (геномы ВПГ-1, ВПГ-2, ЦМВ, микоплазмы, уреаплазмы, хламидии);
- иммуноферментный анализ (ИФА): обнаружение в сыворотке специфических антител к возбудителям (IgM, IgG, IgA) в диагностически значимых титрах.
Исследование хориона (биопсия хориона): бактериологический метод, ПЦР-диагностика.
Исследование околоплодных вод (амниоцентез): бактериологический метод, ПЦР-диагностика.
Исследование пуповинной крови плода (кордоцентез): бактериологический метод, ПЦР-диагностика и специфический иммунный ответ (IgM) плода.
Морфологическое исследование плаценты, данные аутопсии.
Предположительный диагноз внутриутробного инфицирования и ВУИ помогают поставить косвенные методы:
- наличие у матери клиники инфекционного заболевания;
- наличие специфического иммунного ответа;
- результаты УЗИ, допплерометрии, КТГ.
К прямым методам диагностики внутриутробного инфицирования и ВУИ относятся: выявление возбудителя в материале, полученном при биопсии хориона, амниоцентезе (ПЦР, бактериологический метод), кордоцентезе (ПЦР, бактериологический метод и определение уровня специфических IgM).
Характер течения беременности при внутриутробной инфекции зависит от срока воздействия возбудителя.
На ранних этапах зародыша (1–3 недели беременности) из-за отсутствия механизмов взаимодействия инфекционного агента и плодного яйца реализации воспалительной реакции чаще всего не происходит. Контакт с инфекцией может закончиться альтернативным процессом и гибелью плодного яйца. Повреждение эмбриона инфекцией на 4–12 неделях беременности связано с вирусной инфекцией, проникновением микроорганизмов через хорион. Плод еще не имеет защитных механизмов. Нарушение закладки органов и систем вызывает тератогенный и эмбриотоксический эффект [13, 15].
В I триместре беременности специфических клинических признаков наличия ВУИ нет, косвенно о ней свидетельствуют некоторые эхографические признаки:
- повышенный локальный тонус матки;
- отслойка хориона;
- изменение формы плодного яйца (деформация);
- прогрессирование истмико-цервикальной недостаточности (функционального характера);
- гипоплазия хориона;
- увеличение или персистенция желточного мешка;
- несоответствие размеров эмбриона размерам полости плодного яйца (увеличение, уменьшение);
- отсутствие редукции хорионической полости.
Инфекционные фетопатии возникают с 16-й недели, когда происходит генерализация инфекции у плода. Могут возникать такие пороки развития, как фиброэластоз эндокарда, поликистоз легких, микро- и гидроцефалия (ранние фетопатии) [12–15].
В III триместре плод реагирует на внедрение возбудителя локальной реакцией. Могут возникнуть энцефалит, гепатит, пневмония, интерстициальный нефрит. Влияние вирусов чаще всего проявляется признаками незрелости, дисэмбриогенетическими стигмами, затяжным адаптационным периодом, значительной потерей массы тела в раннем постнатальном периоде. Данные эхографии во II и III триместрах беременности, указывающие на развитие инфекции у плода:
- СЗРП;
- гипоксия плода;
- фетоплацентарная недостаточность;
- многоводие или маловодие;
- неиммунная водянка плода;
- увеличение или уменьшение толщины плаценты, наличие патологических включений;
- контрастирование базальной мембраны;
- наличие взвеси в околоплодных водах;
- кальцификаты в печени и селезенке и головном мозге плода;
- поликистоз легких, почек плода;
- эхогенные фиброзные включения на папиллярных мышцах и створках клапанов сердца плода;
- расширение петель кишечника плода (гипоксия, энтерит) [12–15].
После верификации диагноза ВУИ лечебные мероприятии проводят с помощью этиотропной, антимикробной терапии: препараты пенициллинового ряда и макролиды. Целесообразность назначения антимикробных препаратов не вызывает сомнения, если ВУИ обусловлено наличием патогенных возбудителей (бледная спирохета, токсоплазма, хламидии, гонококк и т. д.) [8, 14].
В настоящее время одним из наиболее дискутабельных вопросов в акушерстве является выяснение истинной этиологической роли генитальных микоплазм (Mycoplasma hominis, Mycoplasma genitalis, Ureaplasma urealyticum) в развитии патологии матери и плода. Инфицирование плода генитальными микоплазмами происходит преимущественно интранатально: в 18–55% — у доношенных новорожденных и в 29–55% — у недоношенных [3, 16, 20].
Актуальность проблемы урогенитального микоплазмоза обусловлена не только значительным распространением этой инфекции в популяции, но и неоднозначностью ее оценки как эпидемиологами, так и клиницистами [16].
По данным различных исследователей, микоплазмы являются возможной причиной развития конъюнктивитов, врожденных пневмоний, респираторного дистресс-синдрома, хронических заболеваний легких, менингита и неонатального сепсиса. Вопрос о терапии микоплазменной инфекции до настоящего времени остается открытым. В схемах терапии предусматривается 7–10-дневные курсы макролидов [1, 3, 21, 22].
Во время беременности противовирусная терапия при генитальном герпесе, цитомегаловирусной инфекции, вирусе ветряной оспы проводится с помощью этиотропных препаратов (ацикловир) начиная со II триместра гестационного периода. Целью лечения является профилактика рецидивирования и антенатального инфицирования [14, 17, 19].
Трихомонадная инфекция относится к группе негонококковых воспалительных заболеваний мочеполовых органов. Лечение трихомониаза во время беременности осуществляется с помощью метронидазол-содержащих препаратов начиная со II триместра гестационного периода [8].
Появление новых методов диагностики, разработка и внедрение новых лекарственных средств не изменяют ситуацию с внутриутробными инфекциями, оставляя это по-прежнему актуальной проблемой в акушерстве. Все это обуславливает неуклонный рост инфекции в человеческой популяции, высокий процент рецидивов инфекции даже у пациентов, получавших курс антибиотикотерапии в соответствии с действующими инструкциями и схемами лечения. Проблема осложняется тем, что в настоящее время отсутствует единая концепция механизма рецидивирования, недостаточно изучена роль микст-инфекции в возникновении, течении и персистировании инфекции, не учитываются особенности гормонального и иммунного статуса больного, не сформированы диагностические критерии контроля излеченности патологического процесса. Это все вместе взятое является стимулом для продолжения исследований, направленных на решение данных проблем. Несмотря на то что роль вирусных и бактериальных инфекций в этиологии и патогенезе многих патологических процессов не вызывает сомнений, вопрос о значении инфекций в качестве моновозбудителя на сегодняшний день окончательно не решен. Актуальным по-прежнему остается вопрос разработки алгоритма лабораторной диагностики заболеваний.
Только совершенствование диагностических подходов, разработка оптимальных алгоритмов и методов обследования и предупреждение распространения резистентных штаммов путем адекватного отношения к каждому пациенту индивидуально (обязательное проведение посевов на определение чувствительности к антибиотикам до назначения терапии) может изменить данную ситуацию.
Исследование выполнено за счет гранта Российского научного фонда (проект № 15-15-00109).
Литература
В. Н. Кузьмин 1 , доктор медицинских наук, профессор
К. Н. Арсланян, кандидат медицинских наук
Э. И. Харченко, кандидат медицинских наук
ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
Что такое папилломавирусная инфекция (ВПЧ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Борисова Э. В., гинеколога со стажем в 35 лет.
Над статьей доктора Борисова Э. В. работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Папилломавирусная инфекция — это состояние, развивающееся при заражении какой-либо разновидностью вируса папилломы человека (ВПЧ). Возбудители данной группы могут существовать только в человеческом организме, поражая кожу и слизистые оболочки, приводя к появлению папиллом, бородавок, плоских и остроконечных кондилом. [1] [2] [4]
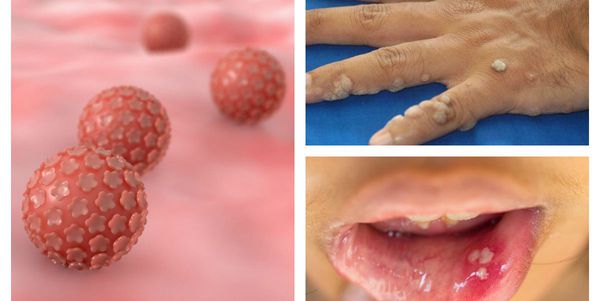
ВПЧ довольно широко распространён в человеческой популяции, особенно среди сексуально активных людей, а это свыше 80% всего населения. До недавнего времени вирусы этой группы считались относительно безобидными, вызывающими лишь косметические дефекты, но последние научные исследования показывают, что проблема гораздо серьёзнее. [9]
На сегодняшний день науке известно несколько сотен штаммов (типов) папилломавирусов . Около 40 из них преимущественно поражают аногенитальную область и передаются половым путём. Особую опасность представляют штаммы высокого онкогенного риска, так как они могут спровоцировать развитие онкологических заболеваний, в том числе рака шейки матки.
Чаще всего заражение происходит в молодом возрасте, как правило, с началом половой жизни, при этом возможно неоднократное инфицирование. Наиболее уязвимой группой в плане вероятности заражения ВПЧ и развития неблагоприятных последствий являются молодые женщины в возрасте 15-30 лет.
Помимо этого ВПЧ может перейти от инфицированной матери к ребёнку, например, при родах. Не исключается и контактно-бытовой способ передачи возбудителя, например, при соприкосновениях и даже при совместном использовании предметов личной гигиены.
К факторам риска, способствующим заражению ВПЧ, развитию хронической папилломавирусной инфекции и её переходу в предраковые состояния с потенциальным перерождением в злокачественную опухоль, относятся:
- иммунодефицит любого происхождения, в том числе вследствие ВИЧ-инфекции, лучевых поражений, применения иммунодепрессантов при трансплантации органов и тканей, лечения цитостатиками и других причин;
- подавленное состояние иммунитета во время беременности;
- раннее начало половой жизни;
- частая смена половых партнёров, незащищённый секс;
- инфицированность высокоонкогенными штаммами ВПЧ;
- заражение одновременно несколькими типами ВПЧ;
- наличие других инфекций, передающихся половым путём, например, герпесвирусной и цитомегаловирусной инфекции, вируса Эпштейна — Барр, гепатитов В и С, гонореи и трихомониаза;
- стресс, истощение, гиповитаминоз, гормональный дисбаланс;
- многократные роды и аборты;
- тяжёлые хронические заболевания, в том числе сахарный диабет;
- вредные привычки (курение, злоупотребление спиртным);
- низкий социальный статус, плохие условия жизни, неудовлетворительная интимная гигиена;
- пренебрежение регулярными профилактическими обследованиями (один из важнейших факторов риска);
- низкий уровень развития медицины в регионе проживания.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы папилломавирусной инфекции
Далеко не всегда человек догадывается о наличии в своём организме папилломавирусной инфекции, оставаясь при этом источником заражения для потенциальных партнёров. [1] [2] Дело в том, что заболевание может долгое время протекать бессимптомно: вирус скрыто существует в организме от нескольких месяцев до нескольких лет, никак себя не проявляя. Кроме того, уже имеющиеся проявления инфекции не всегда доступны для наружного обзора. Например, если папилломы, бородавки и кондиломы на открытых участках тела и поверхности гениталий ещё можно заметить самостоятельно, то патологические изменения, локализующиеся на шейке матки, сможет обнаружить только специалист в ходе осмотра с применением соответствующих инструментов.
И всё же существует несколько симптомов, которые прямо или косвенно могут указывать на наличие папилломавирусной инфекции и её неблагоприятных последствий. [3] К ним относятся:
- появление на коже и/или слизистых оболочках каких-либо разрастаний различных форм (на тонкой ножке или с широким основанием, нитевидной, округлой или плоской конфигурации, в форме цветной капусты или петушиного гребня) и размеров (от образований в несколько миллиметров до разрастаний, занимающих всю промежность);
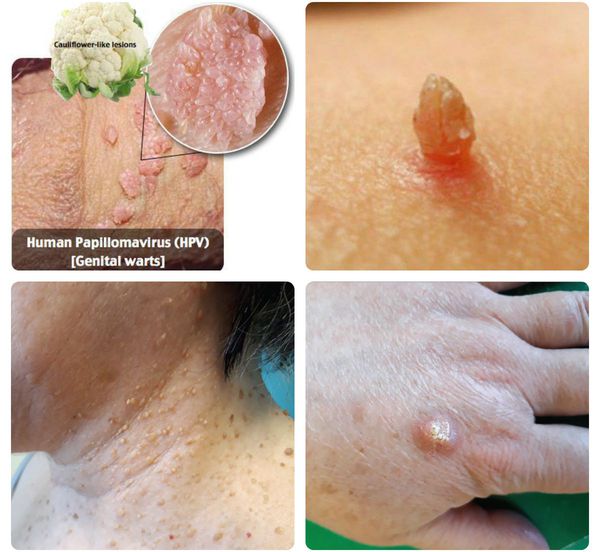
- отёчность и воспалительная инфильтрация папилломатозных разрастаний (остроконечных кондилом), их ранимость и кровоточивость, что приводит к присоединению вторичной инфекции с появлением гнойного отделяемого с неприятным запахом;
- зуд, жжение, мокнутие в области промежности, появление обильных белей, даже при отсутствии видимых патологических образований;
- межменструальные кровянистые выделения, в том числе появляющиеся в результате полового контакта:
- дискомфорт во время полового акта.
Наиболее тревожными признаками заболевания являются:
- постоянные боли в области спины и таза;
- слабость;
- беспричинная потеря веса;
- опухание одной или обеих ног.
Патогенез папилломавирусной инфекции
Заражение папилломавирусной инфекцией происходит при попадании вирусных частиц на кожу или слизистую оболочку. [1] [2] Излюбленная локализация инфекции на теле женщины — промежность, большие и малые половые губы, вульва, влагалище и шейка матки, у мужчин — половой член. Может также произойти поражение слизистой полости рта, пищевода, мочевого пузыря, трахеи, конъюнктивы и других органов и тканей.
Заражению способствуют микротравмы и потёртости. Особенно благоприятные для инфицирования условия создаются при половом акте. В 60–80% случаев достаточно однократного сексуального контакта с больным папилломавирусной инфекцией или бессимптомным носителем ВПЧ. К развитию заболевания может привести попадание в организм буквально единичных вирусных частиц.
При наличии предрасполагающих факторов (микроповреждения, слабого иммунитета и других) возбудитель проникает в эпителиальную ткань до её базального слоя. Там он прикрепляется к оболочке незрелой клетки и внедряется сначала в её цитоплазму, а затем и в ядро, где повреждает генетический аппарат. После этого начинается деление клеток с изменённым геномом, что приводит к появлению в месте внедрения вируса генитальных кондилом (образований, которые постепенно разрастаются), а, например, на шейке матки — к развитию диспластических процессов различной степени тяжести (дисплазия шейки матки).
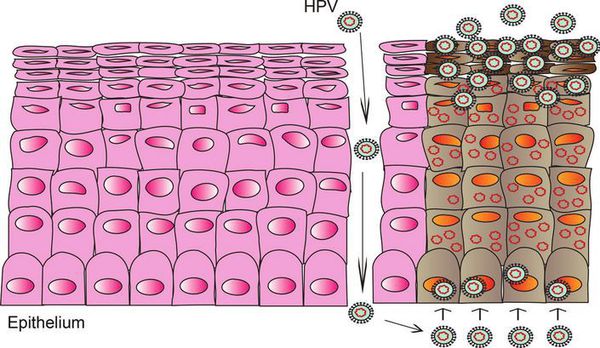
В случае ВПЧ высокого онкогенного риска определённые гены в вирусной ДНК кодируют синтез специфических белков-онкопротеинов (Е6 и Е7), которые подавляют противораковую защиту клеток. Под действием онкопротеинов нарушается стабильность генома клеток, стимулируется их размножение и снижается способность к дифференцировке — всё это со временем может привести к онкопатологии. [12]
Формирование новых полноценных вирусных частиц, способных инфицировать другого человека, происходит уже не в базальном, а в самых поверхностных слоях поражённого эпителия. Возбудитель может содержаться в слущивающихся отмирающих клетках, которые отделаются слизистой оболочкой. Таким образом они переходят к новому хозяину при тесном (сексуальном или бытовом) контакте.
Классификация и стадии развития папилломавирусной инфекции
По способности индуцировать развитие злокачественных новообразований ВПЧ подразделяют на четыре группы: [8]
- неонкогенные штаммы ВПЧ (типы 1-5);
- ВПЧ низкого онкогенного риска (типы 6, 11, 40, 42-44, 54, 61, 70, 72, 81);
- ВПЧ среднего онкогенного риска (типы 26, 31, 33, 35, 51-53, 58, 66);
- ВПЧ высокого онкогенного риска (типы 16, 18, 39, 45, 56, 59, 68, 73, 82).
Клинические формы папилломавирусной инфекции: [5]
- латентная — скрытая форма, не имеющая клинических и морфологических признаков, но обнаруживаемая иммунохимическими и молекулярно-биологическими методами;
- субклиническая — возникает у лиц с нормальным иммунитетом, определяется только специальными диагностическими методами (пробы с растворами-индикаторами, гистологические и цитологические исследования);
- манифестная — появляется у лиц с временным или стойким снижением иммунитета, в случае генитальной папилломавирусной инфекции характеризуется появлением кондилом.
Латентная инфекция может переходить в субклиническую и манифестную форму в случае возникновения предрасполагающих условий (факторов риска), но чаще всего она протекает бессимптомно, не манифестируя.
Клинические проявления папилломавирусной инфекции:
- кожные поражения: подошвенные, плоские и обычные (вульгарные) бородавки, бородавчатая эпидермодисплазия, бородавки Бютчера и небородавчатые поражения кожи;
- поражения слизистых оболочек гениталий: кондиломы, некондиломатозные поражения, карциномы;
- поражения слизистых вне гениталий: папилломатоз гортани, карциномы шеи, языка и другое.
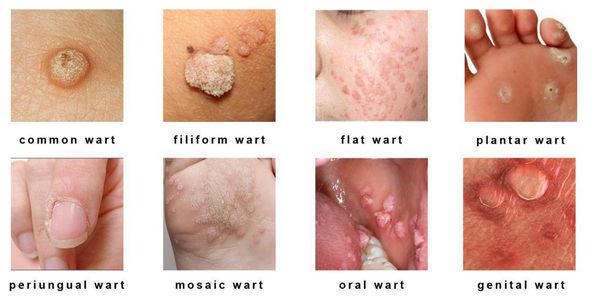
Разновидности поражений:
- экзофитные — видимые разрастания в виде папиллом и бородавок;
- эндофитные — образования, располагающиеся в толще ткани, которые не видны невооружённым глазом.
Осложнения папилломавирусной инфекции
Основными наиболее опасными осложнениями папилломавирусной инфекции являются злокачественные новообразования. Но возможны и другие серьёзные последствия:
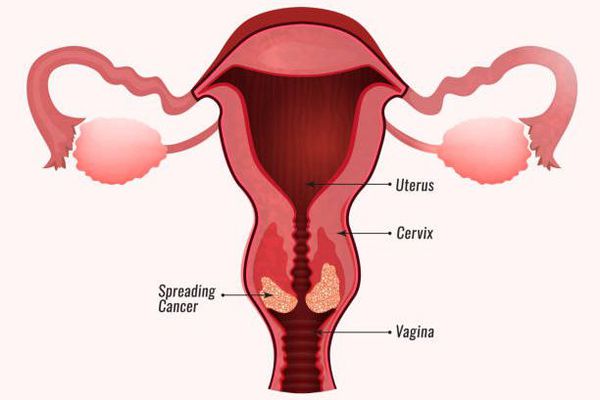
- Злокачественные новообразования заднего прохода, вульвы, полового члена и ротоглотки. Повышение риска их развития также связывают с высокоонкогенными штаммами ВПЧ. [6]
- Остроконечные кондиломы на гениталиях, папилломатоз верхних дыхательных путей (рецидивирующий респираторный папилломатоз, веррукозный ларингит). Причиной возникновения могут стать 6-й и 11-й типы вируса, несмотря на свой низкий онкогенный риск. В случае папилломатоза есть вероятность полной потери голоса, обструкции (перекрытия) гортани с развитием асфиксии. Это довольно редкое заболевание может возникать у детей, рождённых женщинами с папилломавирусной инфекцией. По разным данным, заражение может происходить как во время родов, так и внутриутробно. Как правило, респираторный папилломатоз начинает проявляться в детском и подростковом возрасте, он склонен к неоднократным рецидивам после удаления множественных папиллом, перекрывающих дыхательные пути.
- Гнойно-септические осложнения. Папилломатозные разрастания на слизистых оболочках очень ранимы, легко травмируются, и через участки мокнутия, расчёсов и потёртостей может проникать вторичная инфекция, которая в свою очередь и вызывает нагноение.
Диагностика папилломавирусной инфекции
Основные цели диагностических мероприятий: [3]
- ранняя диагностика папилломавирусной инфекции для динамического наблюдения и лечения;
- своевременное обнаружение и лечение предраковых изменений, что позволяет на 80% предотвратить развитие злокачественных новообразований;
- выявление онкологических новообразований на ранних стадиях, что в большинстве случаев даёт хороший прогноз эффективного излечения;
- решение вопроса о целесообразности вакцинации.
Для выявления папилломавирусной инфекции на сегодняшний день существует целый комплекс диагностических процедур:
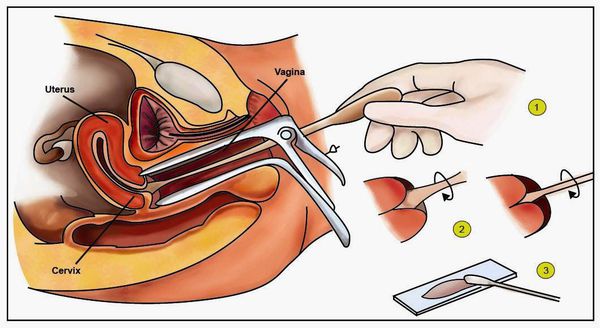
- Гинекологический осмотр в зеркалах — позволяет увидеть папилломатозные разрастания (аногенитальные кондиломы) и другие изменения.
- Классический тест Папаниколау (мазки с поверхности шейки матки и стенок влагалища для цитологического исследования) — обнаруживает ранние признаки дисплазии и злокачественного перерождения.
- Пробы с уксусной кислотой и раствором Люголя — выявляют участки поражения слизистой шейки матки.
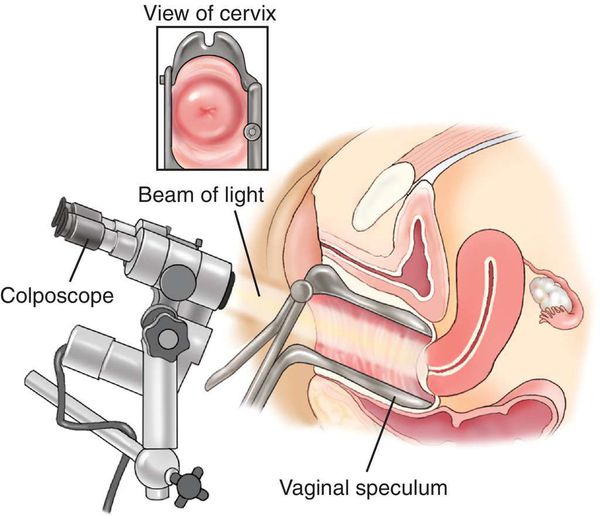
- Кольпоскопия, в том числе с биопсией подозрительных участков и их гистологическим исследованием, — определяет характер имеющегося новообразования.
- Иммунофлюоресцентный анализ (ИФА) обнаруживает в цервикальном соскобе онкопротеины (Е7 и Е6). Этот метод достаточно новый, с его помощью можно различить носительство ВПЧ и первые признаки злокачественного перерождения в клетках, [12] оценить агрессивность данного процесса, сделать предположения относительно прогноза заболевания.
- Полимеразная цепная реакция (ПЦР) находит вирусную ДНК в биологическом материале (соскоб со слизистой), определяет тип ВПЧ, степень его онкогенности, а также количество вирусных частиц, что косвенно позволяет судить о характере течения папилломавирусной инфекции у данного пациента, возможности спонтанного излечения или высокого риска прогрессирования. Обнаружение ВПЧ с помощью этого возможно даже при латентном течении болезни, когда цитологические и гистологические методы не эффективны.
Целесообразно дополнительное обследование пациента на наличие других инфекций, передающихся половым путём, так как папилломавирус в 90% случаев с ними сочетается, и это может осложнять течение заболевания.
Лечение папилломавирусной инфекции
Лечение папилломавирусной инфекции должно быть комплексным и включать следующие составляющие: [3] [5]
- деструкцию (удаление) видимых проявлений (аногенитальных кондилом и др.);
- иммуномодулирующую терапию;
- противовирусную терапию;
- лечение сопутствующих инфекций, передающихся половым путём.
Деструктивные методы делятся на две основные группы:
- химические — с применением трихлоруксусной кислоты, а также таких препаратов, как "Солкодерм", "Колломак", "Ферезол" и др.;
- физические — хирургическое удаление, электрокоагуляция, криодеструкция, радиоволновая и плазменная коагуляция, лазеротерапия.
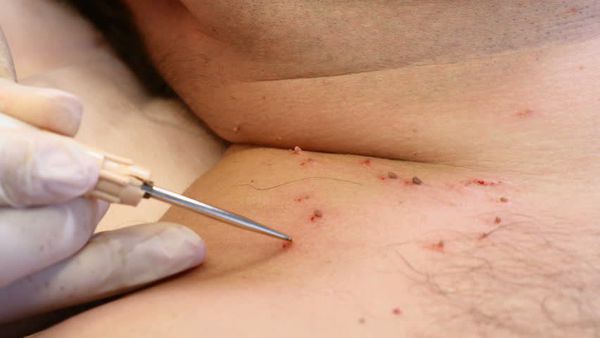
Лечение сопутствующих половых инфекций проводят до начала деструктивной терапии на фоне адекватной иммунокоррекции.
Удаление видимых проявлений папилломавирусной инфекции должно сочетаться с противовирусной терапией — как с общей, так и с применением препаратов местного действия после удаления кондилом.
Следует помнить, что успешно проведённое лечение не исключает развитие рецидивов в дальнейшем, особенно у пациентов с нарушениями иммунитета. Поэтому за ними устанавливается динамическое наблюдение в течение как минимум 1-2 лет.
Прогноз. Профилактика
В 90% случаев здоровая иммунная система человека справляется с папилломавирусной инфекцией самостоятельно за период от полугода до двух лет с момента инфицирования, после чего происходит полное выздоровление с исчезновением вируса из организма. При этом не формируется напряжённого пожизненного иммунитета, то есть человек может заразиться повторно.
В других случаях, при наличии предрасполагающих факторов, заболевание приобретает хроническую форму, склонную к длительному скрытому течению с периодическими рецидивами и возможным развитием тяжёлых осложнений.
От момента попадания вируса в организм до развития предраковых состояний и тем более возникновения рака может пройти достаточно много времени, иногда десятки лет. Поэтому регулярные профилактические обследования, своевременное выявление и лечение предраковых состояний — вполне реальный и эффективный способ избежать самого неблагоприятного варианта развития событий. [13] С этой целью Всемирная организация здравоохранения рекомендует всем женщинам старше 30 лет при первичном скрининге проходить не только “рутинное” цитологическое исследование, но и делать тест на наличие ВПЧ. [10]
Регулярное посещение гинеколога (при отсутствии каких-либо жалоб — раз в год) с проведением теста Папаниколау позволяет своевременно обнаружить начальные признаки дисплазии и предпринять все необходимые меры для предотвращения прогрессирования процесса и его перехода в онкологическое заболевание.
Использование методов барьерной контрацепции хоть и не полностью защищает от инфицирования, но несколько снижает его вероятность.
Главным методом первичной профилактики папилломавирусной инфекции считается вакцинация. [11] Современные вакцины разработаны с целью защиты от наиболее опасных, высокоонкогенных штаммов ВПЧ, ответственных за 70-80% случаев развития рака шейки матки. Стандартный курс, состоящий из трёх прививок, даёт вполне надёжную защиту.

Уже много лет между эволюционистами и креационистами продолжается спор о том, как же все-таки произошел человек — путем эволюции или божественного сотворения? К счастью, древние вирусы на протяжении миллионов лет ведут летопись эволюции и записывают ее в нашу ДНК.
После расшифровки нуклеотидной последовательности ДНК многих животных, в том числе и человека, стало возможным узнать, где именно в геноме находятся эти остатки древних вирусов. И взору ученых предстала строгая упорядоченность расположения эндогенных ретровирусов — выяснилось, что все они находятся в геномах в строго определенных местах. Некоторые из них характерны лишь для человека или для кошки и не встречаются у других животных. Другие же ретровирусы можно обнаружить в одном и том же месте, к примеру, в геномах гориллы, шимпанзе, орангутанга и человека.
Почти половина генома

У разных ретротранспозонов (транспозон — мобильный элемент ДНК) процесс обратной транскрипции имеет свои особенности.
У ретротранспозонов с длинными концевыми повторами (LTR-ретропозоны) обратная транскрипция происходит не в ядре, а в цитоплазме. Так как по своему строению и механизму перемещения LTR-ретропозоны имеют большое сходство с вирусами, данный класс подвижных элементов называют ретровирусоподобными. Их содержание в геноме человека — около 8% всей последовательности нуклеотидов.
Ко второму классу ретротранспозонов, без длинных концевых повторов (non-LTR), относятся элементы LINE (Long Interspersed Elements — длинные перемежающиеся элементы) и SINE (Short Interspersed Elements — короткие перемежающиеся элементы). Перемещение и встраивание ДНК-копии этих элементов происходит не в цитоплазме, а в ядре. Элементы LINE — самые многочисленные из подвижных структур человека: они занимают в ДНК пятую часть (около 20%) от всей последовательности нуклеотидов. И они же единственные из мобильных генов человека, сохранившие до сих пор свою самостоятельную способность к перемещению.
Одомашненные вирусы
Транскрипция — это перенос генетической информации с ДНК на рибонуклеиновую кислоту (РНК), при котором ДНК используется в качестве отправной точки, матрицы. Транскрипцию можно наблюдать всякий раз, когда осуществляется синтез новых белков. До открытия американцами обратной транскрипции считалось, что движение в направлении от РНК к ДНК невозможно. Но, как оказалось, этот генетический метод активно используется в живой природе, в том числе и такими опасными ее представителями, как вирусы (среди которых и самый опасный для человека — ВИЧ).
Жизненный цикл ретровируса

Вирус прикрепляется к строго определенным клеткам хозяина благодаря образованию связей белков капсида и рецепторов на поверхности клетки. После проникновения в клетку собственные ферменты или ферменты клетки хозяина разбирают капсид. Вирусная РНК высвобождается и подвергается обратной транскрипции: обратная транскриптаза формирует по матрице РНК цепочки ДНК, а интеграза инициирует проникновение провирусной ДНК в ядро и включение ее в геном хозяина. В ядре происходит процесс репликации (повторной сборки) вирусной РНК, который уже стал неотъемлемой функцией генома хозяина. В хозяйской цитоплазме вирусная РНК обзаводится капсидом. Отпочковываясь от клетки, обновленный вирус прихватывает с собой часть мембраны хозяина, используя ее в качестве собственной оболочки.
Устройство вириона

РНК ретровируса располагается в белковой оболочке под названием капсид. Наружная липидная оболочка покрыта ворсинками длиной 8−10 нм. Вирион имеет форму икосаэдра (двадцатигранника) и диаметр 80−100 нм.
Двигатель прогресса
Еще в конце 1980-х годов можно было встретить утверждение о том, что ретровирусы не способны вызывать эпидемический процесс. И отсюда — бесплодные попытки ученых создать вакцину против ВИЧ. Ретровирусы и сегодня не утратили своей способности вызвать большую пандемию. Однако ретровирусы, по мнению ученых, могут быть полезными. Предполагается, и не без оснований, что они сослужили нам хорошую службу в процессе эволюции, передав человеку и другим живым организмам свои структурные элементы, ставшие впоследствии нашими генами.

Как мы строим супервирус
Сегодня уже точно известен целый ряд важных генов, берущих свое начало от ретроэлементов. Прежде всего это некоторые гены, участвующие во внутриутробном развитии плода. Несколько лет назад появились данные, что ретровирусы могли сыграть весомую роль в эволюции плацентарных животных. Появление у древних организмов плаценты — важный этап их эволюционного развития в сторону усложнения. Плацента позволила предкам человека продлить внутриутробное развитие. Именно с этим сегодня связывают кардинальные изменения у млекопитающих, живших около 60 млн лет назад, — увеличение размеров мозга и постепенное развитие умственных способностей.
Основной целью российских биологов был поиск ретровирусов hsERV, которые осуществляют функции энхансеров (усилителей). Энхансеры — это нуклеотидная последовательность с регуляторными функциями, которая обычно находится вблизи (или внутри) генов и повышает их экспрессию. Из всех обнаруженных на сегодня hsERV лишь шесть копий находились в районах обычного расположения энхансеров. Изучив эти шесть ретровирусов, исследователи смогли выявить один hsERV, расположенный вблизи важного гена PRODH.
Ген PRODH кодирует фермент пролиндегидрогеназу, связанный с синтезом глутамата, одного из нейромедиаторов, стимулирующего передачу сигналов возбуждения в нервной системе. У шимпанзе аналогичный ген во всех местах его расположения (в гиппокампе, префронтальной коре и хвостатом ядре) не имеет рядом с собой участка ДНК с эндогенными ретровирусами и менее активен по сравнению с человеческим. Есть основания полагать, что внедрение ретровируса вблизи этого гена сыграло весомую роль в развитии умственных способностей человека.
Хозяева Земли
По мнению Супотницкого, именно ретровирусы (и ретроэлементы) — настоящие хозяева Земли. Они возникли раньше нас в процессе эволюции, принимали активное участие в создании сложных организмов и вполне способны ради большего разнообразия видов сгубить все человечество.
Автор выражает большую благодарность
д. б. н. А. А. Буздину (Институт биоорганической химии РАН)
за помощь при написании статьи.
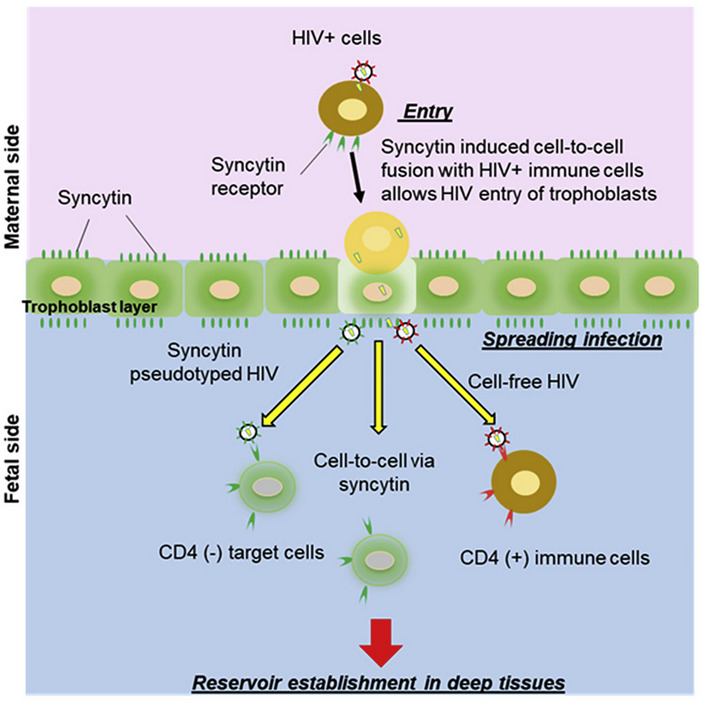
Чаще всего ВИЧ распространяется между клетками классическим путем, как и все вирусы: отпочковывается из одной клетки-жертвы, прикрепляется к поверхности следующей и проникает внутрь. Правда, таким способом ВИЧ может поражать только иммунные клетки, поскольку они несут на себе необходимые для прикрепления вируса рецепторы. Но вирус обнаруживают и в клетках других типов — например, в плаценте. Американские ученые предложили красивое объяснение этому феномену: ВИЧ может пользоваться поверхностными белками других вирусов, чтобы заражать разные клетки. В частности, в плаценте он эксплуатирует белок синцитин, который нужен для слияния ее клеток, а когда-то достался приматам от другого, ныне безвредного ретровируса.
В роли транзитного пассажира в этой истории выступил вирус иммунодефицита человека. Исследователей интересовали механизмы, с помощью которых он путешествует между клетками. Самый известный (его можно назвать классическим) — внеклеточный: вирус производит свои белки за счет клетки, одни выставляет на поверхность клеточной мембраны, другие собирает в вирусную частицу, которая затем отпочковывается наружу, захватывая участок мембраны (с встроенными в него вирусными белками) с собой в качестве оболочки. Дальше поверхностные белки прилипают к белкам на мембране новой клетки-мишени (в случае ВИЧ — это рецепторы CD4 и CCR5), и вирус либо погружается в мембрану, либо сливается с ней, но так или иначе содержимое частицы оказывается внутри.
Однако кроме этого пути ВИЧ освоил множество других (подробнее см. L. Bracq et al., 2018. Mechanisms for cell-to-cell transmission of HIV-1). Для начала он научился пользоваться разнообразными клеточными контактами, которые образуют друг с другом клетки-носители CD4 (это в основном Т-хелперные лимфоциты, но также макрофаги и дендритные клетки). Как правило, это разные отростки, которыми клетки дотягиваются друг до друга или обхватывают друг друга (рис. 2, А, В и С). Вирусные частицы путешествуют по цитоскелету (см. картинку дня Раскрашенный цитоскелет) в дальний конец отростка и только там отпочковываются, сразу же проникая в соседнюю клетку.

Рис. 2. Неклассические способы распространения ВИЧ (зелено-красные шарики) из зараженной клетки (зеленая) в новую клетку-мишень (розовая). A — по нанотрубочкам (мембранным выростам, соединяющим клетки между собой, см. Tunneling nanotube), B — по отросткам клетки-мишени, C — по отросткам зараженной клетки, D и Е — посредством вирусного и инфекционного синапса (разновидности иммунного), F — через фагоцитоз зараженной клетки, G — через слияние клеток. Изображение из статьи L. Bracq et al., 2018. Mechanisms for cell-to-cell transmission of HIV-1
Все перечисленные выше варианты передачи ВИЧ между клетками — это просто разновидности классического внеклеточного пути. Однако этот вирус умеет передвигаться и другими тропами. Например, он может заразить макрофаг, который фагоцитирует инфицированную клетку (рис. 2, F). А может и вовсе заставить клетки слиться друг с другом (рис. 2, G) — и таким образом перейдет из одной цитоплазмы в другую, не пересекая никаких мембран. В случае иммунных клеток это работает так: на поверхности инфицированной клетки появляются белки оболочки ВИЧ, с их помощью клетка прилипает к новой мишени, и их мембраны сливаются.
В качестве образцов авторы работы использовали три плаценты, полученные у ВИЧ-положительных женщин после родов. Все три пациентки принимали антиретровирусную терапию, и вирус в их крови практически не обнаруживался. Тем не менее, во всех трех плацентах исследователи разглядели вирусную РНК: в двух образцах — менее 10 на 1000 клеточных ядер, а в одном — целых 114 меток на 1000 ядер. Примерно в 80% случаев, по их подсчетам, вирус заразил клетки трофобласта, а в оставшихся 20% — другие типы клеток плаценты. Точно так же и ДНК вируса (точнее, ДНК-прообраз вирусной РНК) обнаружился не только в синцитиотрофобласте, но и во внутренних (по отношению к зародышу) слоях трофобласта. Это значит, что ВИЧ все-таки смог преодолеть плацентарный барьер.


Рис. 3. Следы ВИЧ в плаценте. На всех фотографиях вирусная РНК окрашена в красный. Клеточные ядра фиолетовые (сверху) или синие (снизу). Изображение из обсуждаемой статьи в Cell Reports
На следующем этапе нужно было проверить, как вирус мог первый раз попасть в клетки плаценты. Авторы работы предположили, что синцитин позволяет зараженным Т-клеткам сливаться с клетками трофобласта. Они попробовали воспроизвести эти события на модельных клетках. В качестве инфицированного донора они использовали клетки Юркат (см. Jurkat cells) — это культура Т-клеточной лимфомы — и не только заразили их ВИЧ, но и заставили экспрессировать синцитин. Реципиентом вируса стали клетки TANI — это линия HeLa, которая при заражении ВИЧ начинает производить зеленый флуоресцентный белок. Кроме того, на поверхности HeLa много рецепторов к синцитину (ASCT2), что делает их готовой мишенью для слияния. Оказалось, что за несколько дней совместной жизни в культуре клетки Юркат и TANI действительно многократно сливаются и образуют гигантские многоядерные клетки, естественно, ВИЧ-положительные. Если же клетки-доноры были лишены синцитина, то никакого слияния и, следовательно, заражения не происходило.


Рис. 4. В — динамика слияния клеток и распространения ВИЧ. С — зараженные клетки в культуре с Т-лимфоцитами, экспрессирующими синцитин. D — отсутствие заражения в культуре с Т-лимфоцитами без синцитина. Изображение из обсуждаемой статьи в Cell Reports
Вслед за тем авторы работы проверили, может ли заражение происходить более классическим путем, через псевдотипированные вирусные частицы с синцитином на поверхности? Они собрали частицы ВИЧ из среды культивирования клеток Юркат и обработали ими культуру TANI. Заражение действительно произошло, однако далеко не во всех клетках. Из этого исследователи заключили, что такой путь распространения ВИЧ тоже возможен, но слияние клеток встречается чаще.


Рис. 5. Н — заражение клеток ВИЧ в отсутствие (слева) и присутствие (справа) антиретровирусного препарата. I — количество клеток трофобласта, зараженных двумя типами ВИЧ в контроле и под действием антиретровирусной терапии. Изображение из обсуждаемой статьи в Cell Reports
Таким образом, исследователи выстроили цепь распространения ВИЧ в организме беременной женщины. Вначале вирус инфицирует Т-лимфоциты. Они достигают внешних слоев плаценты, а поскольку иммунные клетки экспрессируют белок, с которым связывается синцитин, а на клетках трофобласта много синцитина, происходит слияние. Так ВИЧ попадает внутрь плаценты. Дальше он может распространяться внутри синцития по мере того, как к нему присоединяются новые клетки. Либо может отпочковываться от синцитиотрофобласта, захватывая на свою поверхность синцитин — и благодаря этому может поражать другие клетки плаценты.
Впрочем, особенного успеха ВИЧ не добивается даже с чужой помощью. Как бы он ни прятался от иммунной системы, какие бы резервуары ни образовывал в клетках плаценты, антиретровирусная терапия догоняет его и там. По крайней мере, дети всех трех пациенток, которые участвовали в этом исследовании, родились здоровыми и ВИЧ-отрицательными. А значит, альтернативные способы распространения не увеличивают шансы ВИЧ на передачу по наследству, и их стоит рассматривать скорее как пример взаимопомощи из мира вирусов.
Источник: Y. Tang, B. O. Woodward, L. Pastor, A. M. George, O. Petrechko, F. J. Nouvet, D. W. Haas, G. Jiang, J. E. K. Hildreth. Endogenous retroviral envelope syncytin induces HIV-1 spreading and establishes HIV reservoirs in placenta // Cell Reports. 2020. DOI: 10.1016/j.celrep.2020.03.016.
Читайте также:

