Вирус вакцина из штамма h
Обновлено: 11.05.2024
Живая аттенуированная вакцина против кори. Аттенуированный вирус паротита, ветряной оспы, краснухи.
Первая живая аттенуированная вакцина против кори получена из исходного вирулентного штамма Эдмонстон, выделенного в 1954 г. и прошедшего 7 пассажей в культуре клеток почки человека и 6 пассажей в культуре клеток Vero. После 24 пассажей в культуре клеток почки и 28 пассажей в культуре клеток амниона человека получен штамм Эдмонстон-Эндерс. В дальнейшем его аттенуировали следующим образом:
6 пассажей на куриных эмбрионах (в амниотическую полость); 13 пассажей в культуре клеток куриных эмбрионов; 6 пассажей на куриных эмбрионах (в амниотическую полость); 3 пассажа в культуре клеток куриных эмбрионов; 8 пассажей в культуре клеток куриных эмбрионов (при 36°С); 40 пассажей в культуре клеток куриных эмбрионов (при 32°С).
В результате этих пассажей получен современный аттенуированный вакцинный штамм Moraten. Такой вирус слабо размножался в привитом организме и вызывал слабо выраженные признаки болезни у приматов. Вакцинный штамм имел множественные мутации, часть из которых была связана с изменением прикрепительного белка. Успех вакцинации этим штаммом был обусловлен его слабой репликацией, потомство вирионов часто оставалось на месте репликации, и вакцинация вызывала слабую или инапарантную инфекцию у отдельных пациентов.
В дальнейшем аттенуация этого штамма была продолжена разными авторами, в результате чего получены новые вакцины (Загреб, ALK-C, САМ, Ленинград 16, Шанхай-191). Уровень антител у вакцинированных зависел от возраста пациента и наличия материнских антител. Полиморфизм генов, ответственных за иммунный ответ, также оказывал влияние на сероконверсию. Обычно одна доза (3,0-4,0 lg БОЕ) вакцины вызывала сероконверсию у 80-95% привитых. Когда дозу вакцины для детей 4-6 месячного возраста увеличивали в 10—100 раз, сероконверсия усиливалась. Однако применение высокотитражной вакцины в странах с высокой детской смертностью сопровождалось увеличением смертности девочек в последующие 2—3 года.

Иммунный ответ на живую вакцину подобен иммунному ответу на естественную инфекцию, хотя вакцинальный иммунитет более вариабельный и менее продолжительный. Для предупреждения вспышки кори с учетом ее высокой контагиозности необходимо, чтобы по крайней мере 98% населения было серопозитивными. Роль латентного инфицирования на фоне недостаточного иммунитета в поддержании вируса неизвестна. Корь остается наиболее распространенным заболеванием людей в разных частях света. В центре современной стратегии борьбы с корью остается одновременная массовая вакцинация. Теоретически, корь является идеальным объектом для ликвидации путем иммунизации живой вакциной. Вирус имеет один серотип, большинство случаев болезни легко распознается клинически, не существует животных носителей вируса и существуют эффективные вакцины.
Живые вакцины Jery Lynn, Urabe, Am9 и Ленинград-3 против эпидермического паротита получены путем аттенуации вируса серийным пассированием в куриных эмбрионах (КЭ) и в культуре клеток КЭ. Каждая из этих вакцин представляет собой смесь нескольких аттенуированных штаммов. Например, штамм Jery Lin В аттенуирован пассажами в куриных эмбрионах (17 пассажей) и в культуре клеток куриных эмбрионов. Вакцина из этого штамма представляет собой смесь, по крайней мере, двух аттенуированных штаммов JL5 и JL2 в соотношении 5:1. После однократного парентерального применения живых вакцин ВНА появляются в течение 2 недель у 95% привитых и могут сохраняться более 19 лет. Для профилактики паротита в России применяют живую вакцину Ленинград-3 из аттенуированного штамма (Л-3), размноженного в первичной культуре клеток японских перепелов. Иммунитет развивается примерно у 60% привитых (> 10 000 ТЦД50) и сохраняется не менее 8 лет.
Вирус краснухи аттенуировали серийными пассажами в различных культурах клеток, в результате которых получено несколько вакцинных штаммов. Среди них вакцина HPV77/DE5 из вируса размноженного в культуре клеток эмбриона уток, широко используемая в Северной Америке. Вакцину из штамма Cendehill использовали в Европе. Несколько аттенуированных штаммов получены в Японии.
С целью получения живой безопасной иммуногенной вакцины штамм Н2 вируса гепатита А серийно размножали в культуре клеток почки новорожденных обезьян, а затем в культуре фибробластов человека (КМВ17). Этой вакциной в Китае привито более 20 млн человек, и не было отмечено случаев вакцинального гепатита или выделения вакцинного вируса с фекалиями.
Аттенуированный вакцинный штамм ТС-83 вируса венесуэльского энцефаломиелита лошадей получен в результате 45 пассажей вирулентного штамма в культуре клеток сердца морской свинки. Аналогичный штамм-15 этого вируса получен серийным пассированием вируса в культуре клеток куриного эмбриона.
Испытания, проведенные на добровольцах, показали, что живая вакцина против цитомегаловирусной инфекции человека из штамма Таун была безопасной и защищала от заболевания, но не от инфицирования полевым штаммом вируса. Вакцинный вирус не выделялся из организма привитых пациентов.
Единичные точечные мутации в геноме многих вирусов сопровождаются аминокислотными заменами в поверхностных белках и аттенуацией. Так было с вирусами лихорадки долина Рифт, Синдбис, клещевого и японского энцефалитов и другими вирусами. У аттенуированного штамма ТС-83 вируса венесуэльского энцефаломиелита лошадей выявлены замены одной аминокислоты в Е-1, пяти аминокислот в Е2 и делеция в З'-концевой некодирующей области генома.
Вакцинный штамм 17-D вируса желтой лихорадки содержит мутации в гене, кодирующем протективный гликопротеин VP3. Нуклеотидная дивергенция вакцинного штамма составляла 1%.
Тканевой тропизм и нейровирулентность реовирусов млекопитающих и птиц определяются генными сегментами S-1, кодирующими поверхностный белок Q-1. Вирионный белок Q-1 реовирусов так же, как VP1 пикорнавирусов, ответственен за тропизм к клеткам хозяина и представляет главную мишень для нейтрализующих антител.
Природно аттенуироваиные мутанты реовируса с измененным тропизмом к клеткам центральной нервной системы могут быть изолированы экспериментально селекцией вируса с изменениями в капсидном протеине Q-1. Реовирусные мутанты проявляют пониженный тропизм к специфическим участкам мозга, хотя размножаются нормально во внутренних органах экспериментально инфицированных мышей.
Выявлена интересная зависимость между вирулентностью коронавирусов кошек и клеточным тропизмом. Вирулентные штаммы в основном поражают моноциты авирулентные — реплицируются в эпителии кишечника.
В аттенуации вируса простого герпеса важная роль принадлежит гликопротеинам. Мутанты вируса с делециями в генах гликопротеинов G и Е оказались аттенуированными для мышей. Гликопротеины D и Н также играют существенную роль в тканевом тропизме и инфекционности вируса. Делеция аминокислотных остатков в положении 324-244 гликопротеина D полностью исключает эти функции]. Определенный вклад в инфекционность вируса вносит гликопротеин С. Вирус, лишенный gC, в 10—20 раз имел меньшую инфекционность по сравнению с исходным.
С целью выяснения роли отдельных генов в вирулентности вируса болезни Ауески были получены мутанты с делециями 1-3 генов, кодирующих гликопротеины оболочки вириона. Делеционные мутанты по одному гену gI или gIII обладали пониженной вирулентностью для свиней и однодневных цыплят, тогда как мутанты, дефектные по двум генам, кодирующим гликопротеины gIII и gI или gIII и gp63, оказались полностью авирулентными для указанных животных. Из этого следует, что вирулентность вируса болезни Ауески является синергидной функцией отдельных экспрессируемых генов, а репродукция вируса в культуре не коррелирует с вирулентностью. Полигенный контроль вирулентности обнаружен также у вируса долины Рифт.
Аттенуация для обезьян реассортантов вирусов гриппа птиц и человека детерминирована геном нуклеопротеина.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Ньюкаслская болезнь (НБ) — одно из самых опасных заболеваний в промышленном птицеводстве. Несмотря на открытие возбудителя более 85 лет назад и существование нескольких типов коммерческих вакцин и только одного серотипа птичьего парамиксовируса (APMV-1), болезнь регулярно регистрируется в промышленном птицеводстве во всем мире.
В начальный период развития птицеводства главной целью производителей мяса являлось предотвращение высокой смертности птиц, которую вызывала НБ. В дальнейшем, в связи с развитием научных знаний о болезни, они стали обращать внимание не только на эффективность вакцин, но и на снижение негативного воздействия живых вакцин против НБ на показатели продуктивности птиц.
Мезогенные штаммы
Первые изучения были посвящены профилактике НБ у птиц методом инъекции инактивированной вакцины. Широкому распространению этого метода помешали проблемы, связанные с производством и стандартизацией вакцин. В дальнейшем для создания вакцин в разных странах мира стали применять метод аттенуации вирулентного штамма.
Вакцины из мезогенных штаммов очень хорошо защищали цыплят от полевых вирусов НБ, но обладали рядом недостатков: они все еще вызывали заболевание и высокую смертность у восприимчивых птиц, их следовало применять для иммунизации цыплят старше 4-недельного возраста, пассивный иммунитет у цыплят не защищал от признаков НБ в ранний период выращивания. Поэтому исследователи искали более безопасные вакцины, которые могли бы применяться для цыплят в ранний период выращивания.
Лентогенные вакцины
В США в 40-х гг. прошлого века исследование живых вакцин против Ньюкаслской болезни было главным приоритетом в некоторых научно-исследовательских институтах. В 1947-м, в институте Виржинии, д-р Хитчнер, работая с вирусным штаммом, полученным от д-ра Бодета (патолог из экспериментальной сельскохозяйственной лаборатории в Нью-Джерси), разработал штамм B1, на который были получены права для коммерческого производства вакцины в 1950 г.
Бодет провел повторное исследование 105 изолятов вируса НБ и отобрал некоторые из них с более низкой вирулентностью. Одним из этих изолятов, после нескольких месяцев дополнительных испытаний, сделанных в лаборатории Винеленд, был штамм ЛаСота, изолированный с фермы Адама Ласота.
Апатогенные энтеротропные вакцины
Клонированные лентогенные вакцинные штаммы вызывают меньшую поствакцинальную реакцию, чем исходный вирус, но они все еще способны негативно влиять на клетки респираторного тракта.

15.05.2016
Вариантные штаммы вируса инфекционного бронхита кур
Инфекционный бронхит кур (ИБК) вызывается вирусом семейства коронавирусов, представлен одноцепочечной РНК. Известно, что вирус ИБК легко мутирует, что ведет к изменениям в его антигенном составе. Эти изменения часто приводят к снижению эффективности существующих вакцин, увеличению патогенности вируса, а также к экономическому ущербу. Считается, что разница в 5% или более в нуклеотидной последовательности на гипервариабельном участке S1 спайк-белка вируса ИБК указывает на новый вариант.
Специфическая вирулентность и/или другие характеристики варианта ИБК позволяют ему оставаться долгое время на одной и той же территории, а иногда и распространяться по миру, становясь доминантным штаммом. Таким образом, необходимо вакцинировать против тех вариантных штаммов, присутствие которых на территории приводит к клиническим, субклиническим проявлениям и экономическому ущербу и которые не контролируются другими вакцинами.
Сколько вариантных штаммов существует?
В Университете Джорджии М.У. Джеквуд выделил 82 полевых варианта ИБК, которые были собраны в течение 10 лет (1994–2004 гг.). ИБК распространен повсеместно. Вирус присутствует везде, где существует птицеводство. Популяция домашней птицы во многих странах мира велика и продолжает увеличиваться, что позволяет РНК вируса бесконечно реплицировать, мутировать, изменяя свои антигенные свойства. Именно поэтому мы не знаем, сколько вариантов существует во всем мире, но уверены в том, что их очень много.
На какие вариантные штаммы следует обращать особое внимание
США. Штамм Ark имел высокую вирулентность и причинял большой экономический ущерб. Вакцины Ark используются до сих пор. Штамм Ark имеет некоторые общие антигенные свойства с предыдущими вариантами, включая Хольт, Грей, JMK и Флорида, что, возможно, является причиной исчезновения этих вариантов после вакцинации против Ark. Этот пример служит иллюстрацией того факта, что некоторые варианты долгое время персистируют в промышленном птицеводстве определенного региона, тогда как другие появляются и исчезают.
Хольт, Грей, JMK, Флорида, Айова
Джорджия, Делавэр, Калифорния
GA98, Del 072, CAV
Подтипы Ark, GA 08
Европа. В Европе первые вариантные штаммы (D1466 и D274) были выделены в Голландии в 1980-е гг. В 1990-е гг. в Великобритании и Франции был обнаружен новый вариант (783B, 4/91, CR88), который быстро распространился по ЕС, а позже — по всему миру, за исключением США. В 2005 г. итальянский штамм (IT-02) нанес тяжелый экономический ущерб и распространился в другие европейские страны.
Европейский вариант ИБК
Большая часть ЕС
Китай. В Китае вариант QX стал доминирующим штаммом в 1996 г. К 2001 г. он распространился в Россию и был выделен в Западной Европе в 2003–2004 гг. Штамм QX эволюционировал до А2 в Китае, а позже стал подтипом LX4. Изоляты, родственные китайскому QX, сегодня находят в большинстве стран мира.
Китайская классификация ИБК на 7 генотипов
QXIBV, LX4, CK/CH/LLN/061 (Китай)
793B, 4/91, CR88, Италия 02 (Европа), Var 1 (Израиль)
TW1171/92, TW2575/98 (Тайвань)
Грей, Хольт, Cal99 (USA), T64 (Австралия)
Mass (США), H120, H52, Ma5, 28/26 (ЕС)
Q1, J2, T3, 2992/02, CK/CH/LDL/97I
Латинская Америка. Штаммы Mass. и Conn. были обнаружены в большинстве стран Латинской Америки еще в 1950-х гг. Различные варианты местных генотипов регистрировали в Бразилии, Чили, Мексике и Аргентине. Несмотря на значительный экономический ущерб вследствие инфицирования локальными вариантными штаммами ИБК, единственной лицензированной вакциной в настоящее время является вакцина Mass. + Conn.
Ближний Восток. Вариант 1 (233) был выделен в Израиле и оказался очень близким к штамму 4/91 группы 793В. Вариант 2 был выделен в Израиле в 1996 г., а его модифицированный подтип (206) — в 2006 г. Вариант 2 в настоящее время широко распространен в странах Ближнего Востока (Израиль, Египет, страны Персидского залива, Иран, Турция). В этом случае мы в очередной раз отмечаем, что некоторые штаммы (720, 885) появлялись и исчезали, возможно, вследствие доминирования родственных вариантов (Вариант 1 и Вариант 2-06).
Варианты ИБК Ближнего Востока
Вариант 1 (793B), Израиль
233 (близок к 4/91)
Вариант 1 и Вариант 2, Израиль
близок к Варианту 2
близок к Варианту 1
близок к QX & IT-02?
Вариант 2, sub type
Если новый изолят будет отличаться от предыдущих штаммов, превалирующих в регионе ранее, а клинические и экономические проблемы останутся неразрешенными, вакцинация гомологичным штаммом окажется лучшим или единственным решением проблемы. Очевидно, что разработка новой вакцины — достаточно трудоемкая и долгосрочная задача. Требуется приложить немало усилий для оценки эффективности и безопасности новой вакцины. Именно по этой причине на сегодняшний день разработаны и запущены в серийное производство лишь несколько вакцин для борьбы с новыми вариантными штаммами.
Какие вакцины использовать против каких вариантов? В США текущие программы вакцинации включают один или более вариантов Ark DPI, Del012 и GA98 или GA08. В Европе и большинстве других стран широко используются варианты 793B (4/91, CR88, Var I — Israel). В Китае — группа вариантов QX. На Ближнем Востоке — 793B, а недавно возникла необходимость в использовании Var 2-06 (IS 1494/06).
В августе 2015 г. штамм Вариант 2 был изолирован в Литве, а в ноябре — уже и на Украине. По последним данным, он зафиксирован и в России. В ходе эпидемиологических исследований определили, что в этих регионах Вариант 2 стал доминирующим и подавил распространение других штаммов.
Этот уникальный высокопатогенный вирулентный вирус быстро охватывает обширные территории по всему миру. Учитывая стремительно возрастающее инфекционное давление вируса ИБК типов QX и 793B и новых вариантных штаммов типа Вариант 2 в Европе, на Ближнем Востоке и в России, компания Phibro Animal Health Corporation (США) разработала живую аттенуированную вакцину Tabic IB VAR 206 ® . Ее создали на основе полевого штамма Вариант 2 (IS/1494/06), чтобы контролировать заболеваемость и минимизировать экономический ущерб, причиняемый этим вирусом. Вакцина Tabic IB VAR 206 ® производится по запатентованной и принадлежащей компании Phibro технологии TAbiс — производство живых вакцин в форме стерильных водорастворимых таблеток. Данная технология получила широкое мировое признание и используется другими компаниями для лицензионного производства похожих продуктов.
Резюме. Непрекращающиеся модификации вируса ИБК будут еще долгое время заставать нас врасплох. Перед нами стоит важная и серьезная задача профилактики ИБК, поэтому мы должны быть всегда начеку, имея инструменты для борьбы в условиях нехватки времени. Достоверная и оперативная передача информации между птицефабриками, научно-исследовательскими институтами и лабораториями сократит время реагирования на новые эпидемиологические угрозы.
Ньюкаслская болезнь. Вирус ньюкаслской болезни.
Ньюкаслская болезнь (НБ) — высококонтагиозное заболевавание птиц, которое распространено во всем мире. Болезнь проявляется в виде септицемических, респираторных, желудочно-кишечных симптомов, а также нарушениями функции центральной нервной сиситемы и снижением яйценоскости. Более птица многих видов, но наиболее часто поражается домашняя, в основном куры и в меньшей степени индейки и фазаны. Водоплавающая птица и голуби не заболевают или болеют легко, но могут быть носителями вируса. Инфицированная птица выделяет вирус в секретах и экскретах дыхательных и пищеварительных путей. У кур гибель может достигать 100%.
Штаммы широко варьируют по вирулентности, зависящей от протеолитиче-ской расщепляемости и активации HN-белка и F-белка. Различают высоко, средне- и низковирулентные штаммы (вело-, мезо- и лентогенные).
Вирус не имеет антигенных вариантов, имеющих практическое значение. Однако ряд вспышек в Западной Европе и на Дальнем Востоке были вызваны новым генотипом вируса НБ. Высоковирулентные штаммы вируса НБ вызывают летальную инфекцию у отдельных видов, в том числе уток и другой водоплавающей птицы, которая обычно малочувствительна к вирусу и менее подвержена заболеванию. По-видимому, у водоплавающей птицы имеются сбалансированные механизмы носительства вируса, поскольку систематически выделяли вирус в полевых условиях без признаков вспышек выраженной инфекции. Переболевание обычно сопровождается прочным пожизненным иммунитетом.
Антитела образуются быстро. Например, антитела, подавляющие ГА, можно обнаружить на 4—6 день и в течение 2 лет после заражения. По уровню этих Ат можно судить об иммунитете. Материнские антитела передаются через желток и защищают потомство в течение 3-4 недель. IgG препятствуют циркуляции вируса (виремии), но не прекращают респираторную инфекцию. IgA защищают респираторный и желудочно-кишечный тракт.
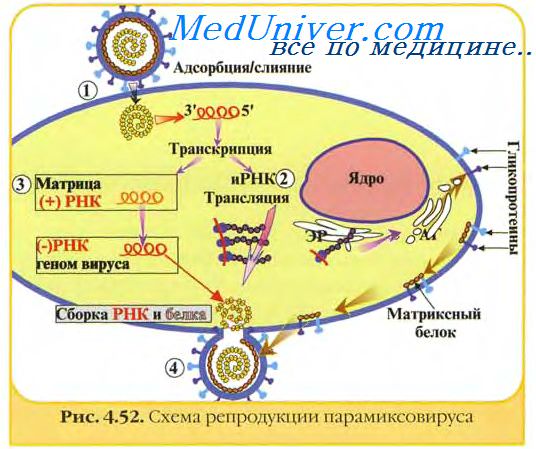
Материнские антитела быстро разрушаются, продолжительность периода их полураспада составляет 4,5 дня. Пассивные антитела могут оказать отрицательное влияние на последующую вакцинацию цыплят, так как они не в состоянии полностью реагировать на живые вакцины, если титр антител в крови выше 1:8 (РТГА). Поэтому цыплят лучше вакцинировать в возрасте не раньше 18 дней.
В инфицированных стадах носительство вирулентного вируса может длиться до 40 дней после начала вакцинации. У выздоровевших птиц вирус вьщеляется с секретами и экскретами не менее 4 недель. Распространению болезни способствует относительная стабильность вируса и широкий круг хозяев.
Обычно используют живые аттенуированные штаммы и инактивированные эмульгированные вакцины. Кур-несушек ревакцинируют через 4 месяца. Защита наступает через 2 недели. Вакцинированная птица экскретирует вакцинный вирус до 15 дней после вакцинации.
Активный иммунитет, приобретаемый после вакцинации, обеспечивает относительно хорошую защиту, но его длительность и напряженность меньшие, чем после естественного переболевания.
Существуют два типа живых вакцин, которые соответственно готовят из природоослабленных авирулентных (лентогенных) или слабовирулентных (мезогенных) вакцинных штаммов.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

