Вирус вызывающий разрушение бактерий
Обновлено: 19.04.2024
Разрушение эффекторных клеток иммунитета и макрофагов вирусами. Устранение действия цитокинов вирусами.
Многие вирусы размножаются продуктивно или абортивно в клетках лимфоидной или ретикуло—эндотелиальнои системы, которые, тем самым, участвуют в создании персистентной инфекции. Лимфоциты и макрофаги являются искушающими мишенями для любых вирусов, они разносят вирусы по организму, а также играют ключевую роль в иммунном ответе. Исключительным примером разрушения иммунной системы является вирус иммунодефицита человека, размножающийся в СД4 Т-лимфоцитах и клетках моноцит-макрофагального ряда и вызывающий глубокую иммунную депрессию и гибель от вторичных инфекций или от неоплазий.
Геном цирковируса анемии цыплят кодирует небольшой белок (13 кД), получивший название апотин, который сам по себе вызывает гибель Т-лимфоцитов и рассматривается как важный фактор патогенеза при данной инфекции у цыплят.
Подавление МНС-регуляции антигенной экспрессии
Т-клетки СД8 и СД4 различают вирусные пептиды во взаимодействии соответственно с МНС I, МНС II, а в присутствии вируса концентрация молекул МНС на клеточной поверхности уменьшается. Аденовирусы кодируют ранний протеин, который связывается с вновь синтезированным антигеном МНС I, препятствуя его нормальному процессингу и, тем самым, уменьшает его экспрессию на поверхности клеток.
Бетагерпесвирусы в дополнение к снижению регулирующей экспрессии МНС I исключают лизис хозяинных клеток Тц-лимфоцитами, синтез молекулподобных МНС I, которые действуют как ловушки, защищая от лизиса NK-клетки, которые сами лизируют клетки, не экспонирующие нормальные комплексы с МНС I.

Устранение действия цитокинов
Интерфероны играют важную роль как антивирусные агенты и как иммуномодуляторы. Однако некоторые вирусы содержат гены, которые блокируют антивирусное действие эффекторных молекул.
Избегание нейтрализации антителами (маскирование эпитопов и иммунные ловушки)
Все еще непонятно, каким образом филовирусы, аренавирусы и асфаровиру-сы устойчивы к нейтрализации сывороткой инфицированных людей и животных. Одной из особенностей вируса Эбола является использование иммунных ловушек для избежания нейтрализации; вирус образует 2 гликопротеина, один из которых формирует пепломеры на поверхности вириона, другой, а может быть, тот же самый, производится в большом количестве и секретируется из клеток. Этот белок, вероятно, связывает антитела и тем самым защищает вирус.
Индукция не нейтрализующих антител
Для многих персистентных инфекций характерно присутствие вирус-специфических антител в низком титре при высоком титре антител против не нейтрализуемых эпитопов вируса. В последнем случае комплекс вирус-антитела и вирусный антиген могут накапливаться на базальных мембранах почечных клубочков или в других местах, вызывая различную иммунную патологию или неопластические заболевания.
Например, при многих ретровирусных инфекциях, в том числе при Алеутской болезни норок, не нейтрализующие антитела часто, соединяясь с вирионами, блокируют присоединение нейтрализующих антител. Поэтому при создании новых вакцин против инфекционного перитонита кошек, PC- болезни, вирусной диареи КРС, инфекционной анемии лошадей, артрита-энцефалита коз и др. необходимо учитывать экспрессию естественных недоминантных нейтрализующих эпитопов.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Вирусы бактерий. Бактериофаги. Классификация бактериофагов. Морфология бактериофагов. Типы бактериофагов.
Бактериофаги [от бактерии, + греч. phagein, поедать] — группа вирусов, паразитирующих в бактериальных клетках. Вирусы, вызывающие гибель инфицированных бактерий, известны как литические бактериофаги. Размножение и выход дочерних популяций вируса из бактерии сопровождается её гибелью и разрушением (лизисом). Бактериофаги широко распространены в природе — их выделяют из воды, почвы, организмов различных животных и человека. Принципы классификации бактериофагов аналогичны подходам к систематике вирусов вообще.
В основу классификации положены антигенная структура, морфология фагов, спектр действия, химический состав и др. Большинство фагов относится к ДНК-содержащим вирусам с нуклео-капсидом, организованным по принципу смешанной симметрии. По спектру действия выделяют типовые фаги (Т-фаги), лизирующие бактерии отдельных типов внутри вида, моновалентные фаги, лизирующие бактерии одного вида, и поливалентные фаги, лизирующие бактерии нескольких видов. Бактериофаги устойчивы к различным физическим и химическим воздействиям. Большинство из них без вреда переносит высокие температуры (50-70 °С), действие дезинфектаитов (за исключением кислот и формалина), прямой солнечный свет и УФ-облучение в низких дозах. Бактериофаги проявляют иммуногенные свойства, вызывая синтез специфических AT.
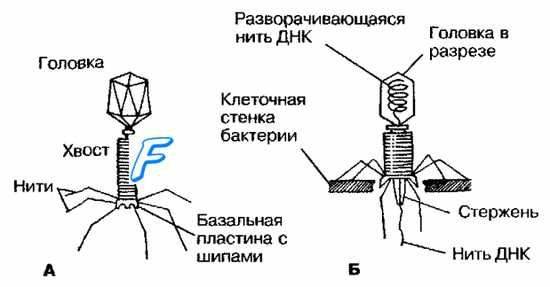
Рис. 5-10. Фаг Т4 кишечной палочки до контакта с бактерией (А) и в момент введения фаговой ДНК (Б).
Морфология бактериофагов. Типы бактериофагов
Строение бактериофагов наиболее полно охарактеризовано на основе изучения Т-фагов кишечной палочки (рис. 5-10). Внешне большинство бактериофагов напоминают сперматозоиды или головастиков, но среди них встречают и другие формы, на основании которых выделяют пять основных типов бактериофагов.
• К типу I бактериофагов относят ДНК-содержащие нитевидные фаги, лизирующие бактерии, содержащие F-плазмиды.
• Фаги типа II представлены головкой и рудиментом хвоста. Геном большинства из них образован молекулой РНК и лишь у фага jc-174 — однонитевой ДНК.
• Бактериофаги типа III имеют короткий хвост (например, Т-фаги 3 и 7).
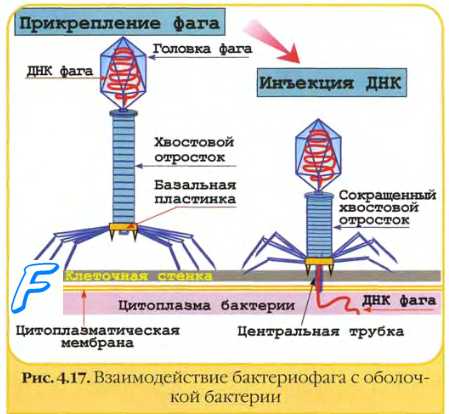
• К типу IV относят фаги с несокращаюшимся хвостом и двухнитевой ДНК (например, Т-фаги 1 и 5).
• Фаги типа V имеют ДНК-геном, сокращающийся чехол хвоста, который заканчивается базаль-ной пластиной (например, Т-фаги 2 или 4).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Сепсис: причины появления, симптомы, диагностика и способы лечения.
Определение
Сепсис – это патологический процесс, в основе которого лежит реакция организма в виде генерализованного воспаления на инфекцию различной природы. При сепсисе бактерии преодолевают иммунную защиту человека и распространяются из очага воспаления по всему организму. Местное воспаление, сепсис, тяжелый сепсис и септический шок – это различные формы выраженности воспалительной реакции организма на инфекционный процесс.

Истинная частота возникновения случаев сепсиса остается неизвестной, однако по оценкам исследователей, во всем мире сепсис является лидирующей причиной летальности у пациентов в критическом состоянии. Согласно результатам большого европейского исследования SOAP, включившего 3147 пациентов из 198 европейских медицинских центров, сепсис развился в 37,4% случаев, а госпитальная летальность от него колебалась от 14% случаев в Швейцарии до 41% в Португалии, в среднем составив 24,1%. Данные другого крупного исследования PROGRES (12 881 больной тяжелым сепсисом в 37 странах) показали, что госпитальная летальность в среднем составила 49,6%.
Причины возникновения сепсиса
Возбудителями сепсиса могут быть бактерии, вирусы или грибы. Но чаще сепсис имеет бактериальную природу - его причиной становятся стафилококки, стрептококки, пневмококки, менингококки, сальмонеллы, синегнойная палочка и др.
В большинстве случаев патологический процесс вызывают условно-патогенные микроорганизмы, которые присутствуют на коже, слизистых оболочках дыхательного и пищеварительного трактов, мочевыводящих путей и половых органов. Иногда при сепсисе выделяют сразу 2-3 микроорганизма.
Причиной сепсиса могут стать гнойно-воспалительные заболевания кожи (абсцессы, фурункулы, флегмоны), обширные травмы, ожоги, инфекционно-воспалительные заболевания мочевыводящей системы (пиелонефрит), живота (например, гнойно-некротический деструктивный панкреатит), тяжелая ангина, гнойный отит, пневмония, инфицирование во время родов или абортов и др.

Возможность возникновения сепсиса зависит не только от свойств возбудителя, но и от состояния иммунной системы человека - нарушения в ее работе предрасполагают к распространению инфекции. Причинами таких нарушений могут быть врожденные дефекты иммунитета, хронические инфекционные болезни (ВИЧ, гнойные процессы), эндокринные заболевания (сахарный диабет), онкологические болезни, хронические интоксикации (алкоголизм, наркомания), проникающая радиация, прием иммуносупрессоров (кортикостероидов, цитостатиков) и др.
В ответ на внедрение возбудителя вырабатываются цитокины – особые белковые молекулы, которые выполняют защитные функции сначала на местном уровне, а затем, попадая в системный кровоток, продолжают работать уже на уровне всего организма. Цитокины бывают провоспалительными и противовоспалительными. В самом начале инфекционного процесса их количество находится в равновесии. Если регулирующие системы организма не способны поддерживать это равновесие, то цитокины накапливаются в кровотоке в сверхвысоких объемах, начинают доминировать их деструктивные, разрушающие эффекты, в результате повреждается сосудистая стенка, запускается синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) и полиорганная дисфункция. Вследствие полиорганной дисфункции печени, почек, кишечника появляются новые повреждающие факторы (лактат, мочевина, билирубин и др.), которые усиливают деструктивные процессы. При ДВС-синдроме в сосудах микроциркуляторного русла образуются множественные тромбы в сочетании с несвёртываемостью крови, приводящей к множественным кровоизлияниям.
Классификация заболевания
В зависимости от локализации входных ворот и первичного очага сепсис подразделяют на:
- перкутанный (чрескожный) – развивается при попадании возбудителя в организм через поврежденный кожный покров (ранки, царапины, фурункулы и др.);
- акушерско-гинекологический – развивается после родов и абортов;
- оральный (одонтогенный и тонзиллогенный) – развивается в результате первичной инфекции в полости рта;
- оториногенный – развивается в результате распространения инфекции из полости уха и/или носа;
- пневмогенный – при наличии инфекционного очага в нижних дыхательных путях;
- хирургический;
- урологический;
- пупочный – развивается у новорожденных вследствие проникновения инфекционных агентов в кровь через пупочную ранку;
- криптогенный (идиопатический, эссенциальный, генуинный) – сепсис неизвестного происхождения: первичный очаг гнойного воспаления неизвестен.
- молниеносный сепсис,
- острый сепсис,
- подострый сепсис,
- хронический сепсис (хрониосепсис).
По клиническим признакам:
1. Синдром системного воспалительного ответа (ССВО) – системная реакция организма на воздействие различных сильных раздражителей (инфекции, травмы, операции и др.) характеризуется двумя или более признаками:
- температура тела ≥ 38°С или ≤ 36°С;
- частота сердечных сокращений (ЧСС) ≥ 90 ударов в минуту;
- частота дыхания (ЧД) > 20 в минуту или гипервентиляция (РаСО2 ≤ 32 мм рт. ст.);
- лейкоциты крови > 12х109 /л или < 4х109 /л, или незрелых форм >10%.
По виду и характеру возбудителя:
- аэробный сепсис,
- анаэробный сепсис,
- смешанный сепсис,
- грибковый сепсис,
- вирусный сепсис.
Клинические проявления сепсиса могут варьировать от незначительных до критических. При молниеносном течении патологическое состояние развивается бурно - за несколько часов или суток. При остром сепсисе симптомы развиваются за несколько дней. Для хрониосепсиса характерно вялое течение и наличие малозаметных изменений, формирующихся месяцами. Рецидивирующий сепсис протекает с эпизодами обострений и затуханий.
Инкубационный период после выявления ворот инфекции или первичного очага составляет от 1 до 3-5 суток. Начало сепсиса, как правило, острое, хотя иногда может быть подострым или постепенным. Интоксикация проявляется резкой слабостью, адинамией, анорексией, нарушением сна, головной болью, расстройством сознания, менингеальным синдромом (поражением оболочек головного и спинного мозга), тахикардией, артериальной гипотензией. Температура тела держится высокой, со скачками утром и вечером. Признаки интоксикации особенно выражены на высоте лихорадки. На коже у трети больных появляется геморрагическая сыпь.
Со стороны дыхательной системы наблюдаются одышка и хрипы в легких. При нарушении функции почек снижается количество выделяемой мочи (олигурия) вплоть до полного прекращения мочеиспускания (анурия), в моче появляются следы крови, гноя. Наблюдается ухудшение функции печени с развитием желтухи и явлениями гепатита, увеличивается селезенка. Повреждение органов ЖКТ проявляется нарушением пищеварения, отсутствием аппетита, язык сухой, обложенный, нередко наблюдаются упорные септические поносы, тошнота и рвота. Метастазирование возбудителя из первичного очага с образованием вторичных очагов инфекции может приводить к инфаркту легкого, гангрене легкого, гнойному плевриту, эндокардиту (поражению внутренней оболочки сердца), воспалению сердечной мышцы (миокардиту), воспалению околосердечной сумки (перикардиту), гнойному циститу, абсцессам мозга и воспалению оболочек мозга (гнойному менингиту), гнойным артритам, флегмонам и абсцессам в мышцах.
Недостаточность функции одного органа длительностью более суток сопровождается летальностью до 35%, при недостаточности двух органов – 55%, при недостаточности функции трех и более органов летальность к четвертому дню возрастает до 85%.
Производят посевы крови, мочи, ликвора, мокроты, гнойного экссудата из элементов сыпи, абсцессов, пунктатов плевры, суставов и других септических очагов. Посевы делают многократно, чтобы определить чувствительность к максимальному количеству антибиотиков. Используется также обнаружение антигенов в крови методом ИФА и определение генома возбудителя методом ПЦР.
Одним из наиболее специфичных и чувствительных маркеров бактериальной инфекции служит прокальцитониновый тест. Прокальцитонин – один из основных маркёров системного воспаления, вызванного бактериями.
Синонимы: Анализ крови на прокальцитонин; ПКТ. Procalcitonin; PCT. Краткая характеристика определяемого вещества Прокальцитонин Прокальцитонин является прогормоном кальцитонина, состоящим из 116 аминокислот с молекулярной массой 14,5 кDa. Биосинтез прокальцитонина в физиологических условиях прои.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Хеликобактериоз: причины появления, симптомы, диагностика и способы лечения.
Определение
Хеликобактериоз – инфекционное заболевание, поражающее пилорический отдел желудка, или привратник, и двенадцатиперстную кишку. Его возбудителем является уникальная патогенная микроаэрофильная грамотрицательная бактерия хеликобактер пилори (H. pylori). Свое название бактерия получила за счет отдела желудка, в котором она обитает – пилорического.
В результате микроорганизм еще сильнее колонизирует слизистую оболочку, формирует ее повышенную восприимчивость к соляной кислоте и провоцирует воспаление, приводящее к развитию язвенных дефектов.
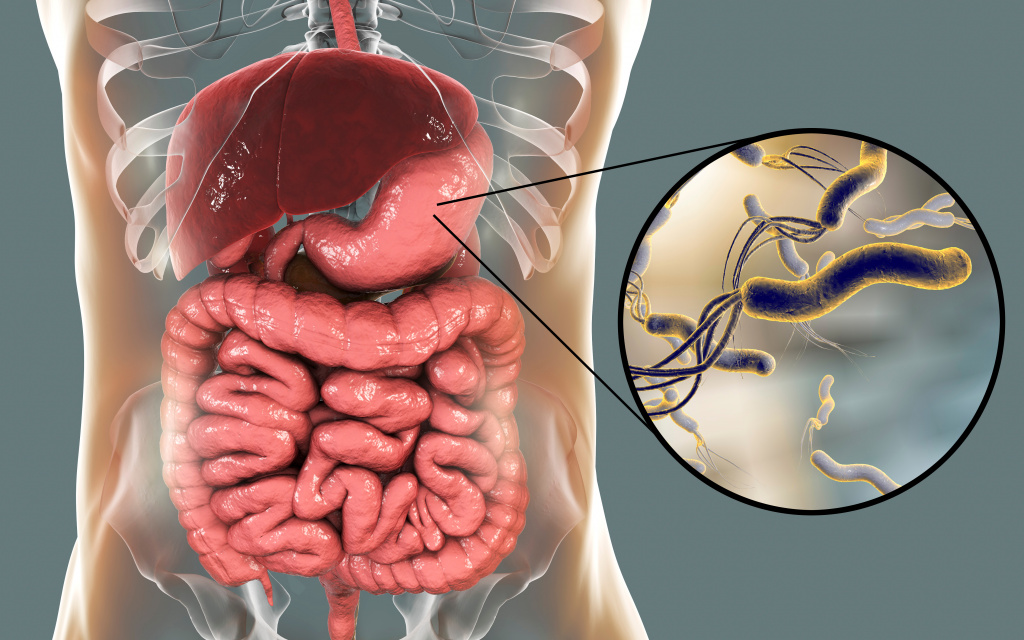
Хеликобактер пилори – спиралевидная бактерия длиной 3,5 и шириной 0,5 микрон. Она имеет жгутики, с помощью которых свободно перемещается по стенке желудка либо надежно на ней закрепляется. Бактерия H. pylori очень изменчива, ее штаммы (разновидности) отличаются друг от друга способностью прикрепляться к слизистой оболочке желудка, вызывать воспалительный процесс и обладают разной степенью патогенности.

Хеликобактер пилори, колонизирующая слизистую оболочку желудка, — частая причина ее воспалительных изменений, она признана этиологическим фактором гастрита, а сам гастрит — инфекционным заболеванием. В зависимости от состояния защитных факторов желудка возникший инфекционный процесс может протекать латентно или с выраженной клинической симптоматикой воспаления. Согласно современным представлениям, H. pylori вызывает хронический гастрит у всех зараженных лиц. Это может привести к язвенной болезни, атрофическому гастриту, аденокарциноме желудка или низкодифференцируемой лимфоме желудка. H. pylori относится к канцерогенам первого порядка.
Результаты многочисленных исследований дают основание предполагать возможную патогенетическую или опосредованную роль инфекции H. pylori в развитии и/или течении заболеваний, не относящихся к пищеварению: кардио-, цереброваскулярных, аутоиммунных заболеваний, заболеваний крови, кожи, нервной системы и многих других.
Патоген отличается относительной устойчивостью к окружающей среде: при кипячении хеликобактерии гибнут практически мгновенно, при обработке дезинфицирующими составами — в течение нескольких минут.
Причины появления хеликобактериоза
Заразиться бактерией можно при контакте с загрязненной водой или продуктами питания. Инфицирование возможно во время проведения эндоскопии и при использовании других плохо стерилизованных медицинских инструментов, которые имели прямой контакт со слизистой желудка пациента.
Бытовой способ передачи (например, через поцелуи, личные вещи и проч.) также возможен, о чем свидетельствует выделение бактерии из слюны и зубного налета.
Распространенность инфекции варьируется в зависимости от географического региона, возраста пациента, его этнической принадлежности и социально-экономического статуса. По данным Департамента здравоохранения г. Москвы (2019), распространенность этой инфекции в Москве составляет 60,7–88%, в Санкт-Петербурге - 63,6%, в Восточной Сибири достигает 90%.
Классификация заболеваний
Заболевания, связанные с H. pylori:
- гастрит,
- дуоденит,
- гастродуоденит,
- эзофагит,
- язвенная болезнь желудка,
- язвенная болезнь двенадцатиперстной кишки,
- железодефицитная анемия неясного генеза,
- рак желудка,
- рак двенадцатиперстной кишки.
Основной жалобой, с которой больные с признаками Helicobacter-инфекции обращаются к врачу, являются желудочные боли. Локализация симптома может меняться и переходить в область расположения двенадцатиперстной кишки.
Боли бывают острыми, ноющими, тупыми, возникают в верхних отделах живота слева и по центру в околопупочной области. Дискомфорт может возникать при длительном голодании, натощак или через определенное время после приема пищи.
Симптоматика хеликобактериоза зависит от клинической формы заболевания и может включать:
- чувство тяжести в животе после еды;
- нарушение аппетита, связанное с внезапными приступами тошноты (если слизистая желудка сильно травмирована);
- беспричинная рвота на фоне нормальной температуры тела;
- изжога (жгучие ощущения в пищеводе и даже гортани) и отрыжка с неприятным кислым или горьким привкусом;
- хронические запоры (отсутствие дефекации в течение трех суток и более);
- разжижение каловых масс, появление пенистой или водянистой консистенции;
- кишечные спазмы и вздутие живота.
- снижение аппетита до полного его отсутствия;
- тошнота может сменяться рвотой со сгустками крови;
- резкое снижение массы тела, не являющееся нормой;
- сухость во рту и привкус металла;
- появление белого налета на языке;
- неприятный запах изо рта при отсутствии кариеса;
- заеды в уголках рта;
- кровоточивость десен.
Диагностика хеликобактериоза
Долгое время хеликобактериоз может никак себя не проявлять, при этом провоцируя развитие язвы, аденокарциномы или мальтомы желудка. В особой зоне риска люди, чьи родственники имеют эти заболевания в анамнезе.
Диагностика может быть инвазивной (эндоскопия с последующей биопсией желудочных тканей) и неинвазивной (лабораторные исследования).
Согласно международным рекомендациям, методами выбора для диагностики бактерии и оценки эффективности лечения H. pylori служат дыхательный̆ тест с мочевиной, меченной 13С и определение специфических антигенов H. pylori в кале иммунохроматографическим методом.
Синонимы: Дыхательный тест с 13С-меченной мочевиной. 13 UBT; 13C-UBT. Краткая характеристика 13С-уреазного дыхательного теста Дыхательный тест в текущей модификации предназначен для лиц старше 12 лет. 13С-уреазный дыхательный тест относится к неинвазивным безопасным методам исследования.
Читайте также:

