Вирусная инфекция при раке легких
Обновлено: 13.05.2024
Рак легкого (бронхогенная карцинома) стал одним из самых грозных заболеваний человека в последние годы. По своей частоте в промышленно развитых странах он уступает только злокачественным заболеваниям желудка.
Рак легкого (бронхогенная карцинома) стал одним из самых грозных заболеваний человека в последние годы. По своей частоте в промышленно развитых странах он уступает только злокачественным заболеваниям желудка. Удельный вес рака легкого среди онкологических заболеваний в России составляет около 15,0%. При этом у мужчин это самая распространенная локализация рака. В 35 индустриальных странах мира бронхогенная карцинома является главной причиной смерти среди онкологических больных.
Наиболее часто рак легкого выявляется на седьмой декаде жизни, при этом мужчины страдают в пять раз чаще.
В соответствии с общепринятой в России клинико-анатомической классификацией рака легкого различают следующие формы рака.
- Центральный: а) эндобронхиальный; б) перибронхиальный узловой; в) разветвленный.
- Периферический: а) круглая тень; б) пневмониеподобный; в) верхушки легкого (Панкоста).
- Атипичные формы: а) медиастинальная; б) милиарный карциноматоз.
В 1981 году была опубликована Международная гистологическая классификация опухолей легкого. Выделяют плоскоклеточный, мелкоклеточный рак, аденокарциному, крупноклеточный, железисто-плоскоклеточный рак, карциноидную опухоль, рак бронхиальных желез и прочие формы.
Наиболее часто встречается плоскоклеточный рак — по результатам различных исследований до 50 — 75%, при этом с возрастом его доля возрастает до 78%. Мужчины болеют плоскоклеточным раком почти в девять раз чаще женщин.
Как и другие виды опухолей, рак легкого все чаще стал выявляться в молодом возрасте. Это происходит прежде всего за счет увеличения доли аденокарциномы.
Среди основных лучевых методов исследования для выявления рака легких используются флюорография, рентгенография органов грудной клетки, рентгеновская компьютерная томография и реже магнитно-резонансная томография. Дополнительно могут применяться рентгеноскопия, бронхография, ангиография, диагностический пневмоторакс.
Широкомасштабное распространение в России получила флюорография органов грудной клетки. Эта методика была оптимальной в период повсеместного внедрения массовой диспансеризации населения страны. Однако необходимо признать главный ее недостаток: невысокий уровень чувствительности и точности. Опыт показывает, что доля ложноположительных и ложноотрицательных заключений достигает 30%. Кроме того, неоправданно высока лучевая нагрузка на пациентов и медицинский персонал. Поглощенная доза при флюорографии составляет более 0,25 мЗв.
Лучшей разрешающей способностью и меньшей лучевой нагрузкой (0,05 мЗв) обладает рентгенография органов грудной клетки. В клиниках стран Западной Европы и Северной Америки происходит агрессивное внедрение цифровых технологий и беспленочного производства. Дигитальная рентгенография еще более снижает лучевую нагрузку на больного. Однако целесообразность ее использования в пульмонологии до сих пор остается спорной. Доводы сторонников аналоговых изображений имеют свою сильную сторону — разрешающая способность последних в исследовании легочного рисунка выше.
Цифровые технологии постоянно развиваются. Появление плоскопанельных детекторов (flat panel detector) обещает произвести революцию в рентгенографии. С одной стороны, их разрешающая способность выше привычных аналоговых изображений, с другой — предполагается уменьшение лучевой нагрузки до 75%. Поэтому дигитальная рентгенография должна стать скрининговым исследованием органов грудной клетки в ближайшие десятилетия.
У 60% больных рак легкого имеет центральную локализацию. Известно, что он развивается из эпителия сегментарных бронхов. Затем опухоль растет проксимально, вплоть до главного бронха. Чаще, поражаются III и VI сегменты правого легкого.
Семиотические признаки центрального рака легкого при рентгенографии включают:
- наличие опухолевых масс в области корня легкого;
- гиповентиляция одного или нескольких сегментов легкого;
- признаки клапанной эмфиземы одного или нескольких сегментов легкого;
- ателектаз одного или нескольких сегментов легкого.
Рентгеновская диагностика периферического рака легкого нередко сложна вследствие схожести его семиотических признаков с другими заболеваниями. Проблема заключается не в выявлении образования, а в интерпретации полученных данных. Типичным является одиночное поражение верхней доли легкого. Структура чаще гомогенна, но на самом деле некроз возникает довольно часто. Однако длительное время дренирование бронхом остается нераспознанным. Время удвоения опухоли зависит от гистологической структуры опухоли. Так, при плоскоклеточном раке оно составляет в среднем 140 дней.
Верхушечный рак сопровождается синдромом Панкоста. Для него характерно наличие округлого образования области верхушки легкого, плевральных изменений, деструкции верхних ребер и соответствующих позвонков. Говорить о раке Панкоста можно лишь в случае, когда он имеет истинное бронхогенное происхождение.
Нередким осложнением периферического рака легких является распад опухолевого узла. При псевдокавернозной форме рака наряду с уже перечисленными семиотическими признаками выявляются дополнительные особенности, помогающие отличить его от абсцесса. Полость распада может занимать значительную часть опухолевых масс. При этом полость имеет неровный, фестончатый характер. Клинически отсутствуют признаки абсцесса легкого.
К сожалению, как и в большинстве случаев, рентгенография не позволяет определить гистологическую природу заболевания. Однако существуют некоторые закономерности, которые следует учитывать при анализе изображений. Так, аденокарцинома чаще имеет периферическую локализацию в верхних долях легких и является солитарной. Структура, как правило, неоднородная, дольковая. Контуры неровные, фестончатые.
Плоскоклеточный рак характеризуется в первую очередь локальным утолщением бронхиальных стенок, прикорневым расположением и, следовательно, возникновением ателектазов. Плоскоклеточная карцинома склонна к внутреннему распаду.
Мелкоклеточный рак также чаще бывает центральным. Первичная опухоль рентгенографически выявляется крайне редко. В то же время характерна медиастенальная лимфоаденопатия.
Крупноклеточная карцинома может иметь любую локализацию. При этом у 70% больных опухолевые массы при первичном выявлении уже превышают 4 см в диаметре.
Карциноидная опухоль является нечастой и первично злокачественной. У 80% пациентов она растет эндобронхиально и солитарно на долевом, сегментарном или субсегментарном уровне. В трети случаев дополнительно визуализируются аномалии развития бронхиального дерева.
Рак бронхиальных желез в 85-90% случаев имеет центральную локализацию. При этом он происходит из трахеи или главных бронхов и приводит к их сужению.
Вторым обязательным этапом обследования больных с подозрением на рак легкого должна быть рентгеновская компьютерная томография (РКТ). Сегодня компьютерная томография прочно и бесспорно заняла свое место среди рутинных обследований таких больных во многих клиниках России. Это объясняется высокой чувствительностью методики. Несмотря на невозможность гистологической верификации опухоли, специфичность РКТ также выше, чем у рентгенографии, и достигает 70%.
Исследование может проводиться в режимах как шаговой, так и спиральной РКТ. Преимуществами второй методики в исследовании легких являются:
- возможность исследования всей зоны интереса при одно-двукратных задержках дыхания;
- исключение фактора различной глубины вдоха при исследовании, что повышает чувствительность метода.
Внутривенное контрастирование йодсодержащими препаратами (омнипак, ультравист) при проведении шаговой томографии используется не часто. Накопление контрастного вещества в ткани опухоли, как правило, не дает дополнительной диагностически значимой информации.
Иначе дело обстоит при спиральной РКТ. Принципиально новая возможность болюсного контрастирования позволяет проводить исследование на 25-30 секундах введения препарата. При этом в кубитальную вену вводится 50-60 мл препарата со скоростью 2 мл/с. Значительно улучшается идентификация сосудистых структур, их топографо-анатомическое взаимоотношение с неопластическими массами. Тем самым определяется вовлеченность в процесс сосудов корня легкого и средостения.
Анализ томограмм производится в двух режимах: средостенном и легочном. В первом случае детально изучаются мягкотканые структуры при ширине окна от 0 до 1000 HU и центре окна 50 HU. Во втором — предметом исследования является воздушная легочная ткань с шириной окна от 1500 до 500 HU и центре окна — 650 HU. В норме денситометрические показатели легочной ткани составляют около 760 HU. При этом в нижних отделах они несколько выше (на 80 — 100 HU), что объясняется гравитационным влиянием на размещение крови в сосудистом русле.
Наиболее радикальным способом лечения рака легкого остается хирургический. Компьютерная томография позволяет уточнить риск и оправданность оперативного вмешательства, оценить возможность осложнений, определить прогноз лечения больного.
При обследовании больного с раком легкого рентгеновская компьютерная томография преследует следующие задачи:
- уточнить наличие и солитарность образования, выявить возможные метастазы;
- изучить размеры, структуру, плотность (количественно в HU) и контуры опухоли;
- определить взаимоотношение неопластических масс с окружающими морфологическими структурами корня легкого и средостения;
- уточнить возможное происхождение опухоли;
- изучить изменения легочной ткани;
- выявить поражение лимфатических узлов средостения.
Обычно центральный рак характеризуется полиморфным строением, гомогенной структурой и плотностью от 40 до 70 HU. Очаги распада, как правило, появляются при значительных размерах опухоли.
Детальный анализ последовательных сканов помогает в определении локализации обструкции бронха.
С точки зрения резектабельности важным является взаимоотношение опухоли с окружающими морфологическими структурами. Велика вероятность вовлечения в неопластический процесс органов средостения, сосудов, плевры, грудной стенки. Хорошим естественным контрастным фоном является жировая клетчатка плотностью от 90 до 80 HU.
Менее информативна компьютерная томография при развитии ателектаза. Только у 20-25 % больных удается четко дифференцировать границы опухоли на фоне плотного ателектаза. Денситометрические показатели участков ателектаза варьируют от -10 до 40 HU.
Осложнением центрального рака легкого может быть выпотной плеврит, выраженность которого зависит от степени поражения плевры. Компьютерная томография выявляет минимальное, 10-15 мл, количество жидкости в полости плевры (рис. 3).
Рентгеновская компьютерная томография более чувствительна в выявлении инфильтративной формы рака, верхушечного рака, а также распада опухоли (рис. 5, 6, 7).
Лихорадка при раке легкого. Анамнез при раке легкого
Лихорадка часто встречается при раке легких. Н. Н. Гринчар отмечает повышенную температуру у 85% своих больных, в том числе 37,6° и выше в 45% случаев. Подобная температура нередко является признаком вторичных воспалительных явлений в легких, иногда на почве застоя бронхиального секрета, абсцедирования и т. д.
Повышение температуры наблюдалось почти у всех наших больных, причем характер кривой был различный. В одних случаях это были вспышки высокой температуры, которые объяснялись как грипп или пневмония, в других случаях отмечалась субфебрильная температура, не превышающая 37,5°. Однако при внимательном опросе у каждого больного можно выявить повторные повышения температуры за последние несколько месяцев, чему, с нашей точки зрения, надо придавать большое значение.
В картине крови обращает на себя внимание высокая РОЭ и дегенеративные изменения ядер нейтрофилов. Эти изменения крови столь же типичны и для гнойных заболеваний легкого.
По нашим данным, выраженный кашель наблюдался у 75% больных, в том числе кашель с гнойной мокротой у 32%, мокрота с запахом — у 10%, кровохаркание — у 15%, боль в груди — у 65%, одышка — у 50%, повышение температуры — у 40% больных.
Анамнез имеет большое значение для правильной постановки диагноза. В анамнезе нередко отмечаются повышение температуры, кашель, боли в боку. Эти явления могут иногда стихать, но потом вновь появляться с возрастающей интенсивностью. При правильно собранном анамнезе можно выявить симптомы нарастающей закупорки бронха. Но анамнез только наводит на мысль о раке легкого. Диагноз же может быть поставлен на основании всестороннего клинического, рентгенологического, лабораторного и бронхоскопического обследования.
В анамнезе надо учитывать длительность заболевания. Доброкачественные опухоли, эхинококки, туберкулезный или хронический нагноительный процесс, приведший к значительным индуративным изменениям, обычно протекают длительное время, исчисляемое годами. Анамнез заболевания больного раком исчисляется обычно месяцами. Так, например, приблизительно у 50% наших больных длительность заболевания до поступления в клинику была менее 6 месяцев. Тем не менее время не является абсолютным критерием для постановки диагноза, ибо встречаются больные раком легкого, у которых анамнез заболевания длится более 2 лет. Таких больных у нас было около 5%.
По длительности заболевания наши больные распределялись следующим образом:
До 3 месяцев . 20%
До 6 месяцев . 29%
До 1 года . 33%
До 2 лет . 13 %
Свыше 2 лет . 5%
Вирусные болезни как причина онкологических заболеваний - рака

Вирусные инфекции ответственны за развитие примерно 10-15% всех онкологических заболеваний у человека. Значимость вирусных инфекций в онкологии значительно возросла с возникновением эпидемии синдрома приобретенного иммунодефицита (СПИД), так как при этом заболевании смертность от рака преобладает в общем числе смертных случаев.
Механизмы вирус-индуцированного канцерогенеза будут обсуждаться в отдельной статье на сайте. Среди вирусов, наиболее часто ассоциируемых с онкологическими заболеваниями, находятся вирус Эпштейна-Барра (ВЭБ), герпесвирус саркомы Капоши ((ГСК) или герпесвирус человека серотипа 8 (ГВЧ8)) и вирус человеческой папилломы. Вирус ВЭБ вызывает лимфому Беркита и рак носоглоточной полости у небольшого процента зараженных им людей.
Лимфома наиболее часто встречается в районах Африки, прилегающих к пустыне Сахара, и в районах с эндемическими очагами малярии. Распространение саркомы Капоши также в основном характерно для близлежащим к Сахаре регионов и в большой степени этому заболеванию подвержены евреи, проживающие в средиземноморском регионе. Известно, что инфицированность ГВЧ8 тесно связана с риском развития саркомы в ходе течения связанных со СПИДом заболеваний.
ГВЧ8 также увеличивает риск развития многоцентровой болезни Каслемана и первичной эффузионной лимфомы. У жителей Италии и Северной Африки отмечается повышенное в сравнении с жителями Великобритании или США содержание антител к вирусу ГВЧ8 (ГСК).
Существенным фактором риска при развитии рака шейки матки являются папилломавирусы. Среди более 100 разновидностей этих вирусов наибольшую опасность представляют серотипы 16, 18, 31 и 33 (несколько менее опасны серотипы 6 и 11).
Рак могут вызывать и представители семейства ретровирусов. Наиболее общеизвестный пример — вирус Т-клеточной лейкемии, серотип 1 (ВТКЛ-1) который является эндемической инфекцией в южной Японии и на Карибском море. У жителей этих регионов опухоли развиваются только у незначительной части инфицированных. Вирус может передаваться от матери к ребенку во время беременности через плаценту, а также с молоком при кормлении. Возможна передача вируса через сперму.
ДНК-Содержащий вирус гепатита В передается через кровь или при половых контактах и вызывает гепатит и цирроз печени. Среди людей, пораженных таким вирусом, печеночно-клеточная карцинома встречается в 100 раз чаще, чем у неинфици-рованных. РНК-Содержащий вирус гепатита С также вызывает хронический гепатит и значительно повышает риск заболеваемости печеночно-клеточной карциномой.
Оба вируса широко распространены по всему миру, но особенно часто встречаются у жителей Китая и Тайваня, а также среди лиц, принимающих наркотики внутривенно. Эти два вируса являются основной причиной смертности от заболеваний раком печени.
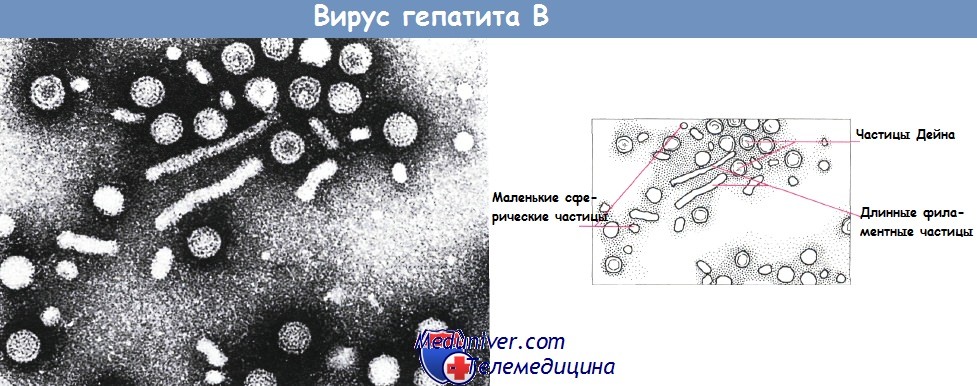
Электронная микрофотография вируса гепатита В.
На срезе видны мелкие сферические частицы с диаметром 28 нм (HBsAg); более крупные сферические двумембранные частицы Дейна (42 нм), продолговатые филаментозные частицы.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Больные, находящиеся на лечении по поводу злокачественных новообразований, за счет измененного иммунного статуса подвержены простудным заболеваниям, которые в свою очередь еще больше истощают защитные силы организма и затрудняют терапию основного диагноза
ОРВИ при злокачественных новообразованиях: риски и сложности терапии
Острые респираторные вирусные инфекции (ОРВИ), в том числе и грипп, составляющие основную долю инфекционной патологии населения всех возрастов, представляют существенную угрозу пациентам из групп риска: пожилым, беременным, детям младшего возраста и пациентам с хроническими заболеваниями, в том числе онкологическими.
Больные, находящиеся на лечении по поводу злокачественных новообразований, за счет измененного иммунного статуса подвержены простудным заболеваниям, которые в свою очередь еще больше истощают защитные силы организма и затрудняют терапию основного диагноза.
При ОРВИ на фоне онкологического процесса лечащий врач сталкивается со следующими трудностями:
- Длительность ОРВИ у иммунокомпрометированных пациентов может достигать нескольких недель, в течение которых состояние больных значительно ухудшается, и не только по иммунным показателям.
- Инфекционный процесс заставляет откладывать очередной курс химиотерапии, что сильно сказывается на прогнозе.
- Назначение противовирусной терапии может вызвать осложнения, а в частности лекарственную гепатотоксичность, так как ее эффект накладывается на гепатотоксичное действие фармакотерапии злокачественного заболевания 1 .
Таким образом, можно сказать, что необходимость в профилактике и терапии ОРВИ у онкологических пациентов неоспорима, но последнее упомянутое обстоятельство резко ограничивает выбор конкретного средства.
Варианты противовирусной терапии
Вирус-специфические препараты римантадин, занамивир и осельтамивир доказали свою эффективность, которая распространяется однако только на вирус гриппа. Кроме того, эти средства имеют ряд противопоказаний, которые зачастую делают невозможным их применение у онкологических пациентов.
В случае назначения средств, действующих на определенные вирусные белки, следует учитывать также проблему резистентности, которую вырабатывают к ним вирусы 2 . Так, появились данные о повышении до 18% частоты устойчивости вирусов гриппа А (H3N2) к осельтамивиру среди детей, получавших данный препарат для лечения гриппа 3 .
В связи с вышесказанным сегодня как никогда высока потребность в противовирусных препаратах, действующих не на инфекционный агент, а на иммунные защитные механизмы.
Оптимальное противовирусное средство, которое может быть рекомендовано для онкологической практики, должно:
- не вызывать резистентности, вероятно вследствие отличного механизма действия;
- быть безопасным, в частности при длительном применении;
- иметь минимальный риск побочных эффектов при лекарственном взаимодействии.
Перспективы использования иммуномодуляторов
Указанным критериям в полной мере соответствуют иммуномодулирующие средства, благодаря чему интерес к ним клиницистов-онкологов в последние годы резко возрос.
Иммуномодуляторы – это лекарственные средства, которые обладают иммунотропной активностью и в терапевтических дозах восстанавливают эффективную иммунную защиту. Растущая опухоль вызывает существенные изменения в иммунном ответе, а проводимая химио- и лучевая терапия, а также любые оперативные вмешательства вызывают или усугубляют иммунную недостаточность 4 . Поэтому использование иммуномодуляторов, в частности для лечения сопутствующих инфекций, является оправданным.
Эргоферон: элегантное решение непростого вопроса
Главной особенностью релиз-активных препаратов является способность воздействовать на биологически активные молекулы мишени (эндогенные регуляторы), модифицируя их физико-химические свойства. Эффект проявляется не только на молекулярном, но и на клеточном, органном, системном и организменном уровнях.
Так, прием Эргоферона усиливает функциональную активность макрофагов, натуральных киллеров и ИФН при помощи релиз-активных антител к ИФН-γ и CD4+. На этапе цитотоксических клеточных реакций CD8+ и CD4+ Т-лимфоцитов Эргоферон поддерживает противовирусный иммунитет при участии компонента релиз-активных антител к CD4+. На более поздних этапах релиз-активные антитела к CD4+ через стимуляцию рецепторов CD4 Тх2 поддерживают гуморальный противовирусный иммунитет.
Третий компонент Эргоферона – релиз-активные антитела к гистамину – обеспечивает противовоспалительный и антигистаминный эффекты, которые проявляются уменьшением длительности и выраженности катаральных симптомов и аллергических реакций, сопутствующих инфекционному процессу 7 . Это является важным преимуществом Эргоферона перед другими противовирусными препаратами, так как позволяет снизить потребление других средств и нивелировать риск лекарственного взаимодействия при параллельно проводящейся противоопухолевой терапии.
Клинический опыт
Эргоферон применяется в клинической практике с 2011 года, и его эффективность была доказана в ходе рандомизированных клинических исследований. На данный момент завершено 3 клинических исследования и продолжаются еще 4.
Исследований по лечению ОРВИ именно у онкологических больных не проводилось. Однако в клинической практике накоплен опыт назначения Эргоферона госпитализированным больным с солидными опухолями (Шаповалова Ю.С). Учитывая актуальность проблемы отсрочек курсов химиотерапии и продления сроков госпитализации, в 2012 г. был разработан внутрибольничный протокол лечения ОРВИ у госпитализированных пациентов с солидными злокачественными новообразованиями. В него включены следующие противовирусные препараты: для лечения гриппа – ингибиторы нейраминидазы занамивир и осельтамивир, а также римантадин, умифеновир и Эргоферон; для лечения ОРВИ – умифеновир и Эргоферон. Эргоферон применялся в виде монотерапии (37 пациентов) или в комбинации с римантадином (14 пациентов) в течение первых 48 часов от начала проявления симптомов заболевания. Все пациенты выздоровели через 5-9 дней лечения; нежелательных реакций, связанных с изучаемой терапией, отмечено не было. Учитывая благоприятный профиль переносимости Эргоферона и отсутствие гепатотоксичности, его применение может быть востребовано для лечения ОРВИ у пациентов онкологического профиля, в том числе находящихся в процессе химиотерапии.
Следует также отметить, что согласно экспериментам использование релиз-активных антител к ИФН-γ не приводит к гиперпродукции ИФН-γ. Этот факт немаловажен в свете недавних исследований, показавших, что ИФН-γ в больших дозах может приводить к увеличению метастазирования в легкие и резистентности клеток меланомы к терапии 11 .
Учитывая безопасность Эргоферона, доказанную в исследованиях высокого методологического качества, можно сделать вывод, что препарат стоит рекомендовать для лечения ОРВИ у пациентов со злокачественными новообразованиями 12 .
Выводы
Как доказали результаты экспериментальных и клинических исследований Эргоферон является перспективным противовирусным препаратом с принципиально новым механизмом и мишенями воздействия, и он может помочь решить проблему лечения больных в условиях изменчивости антигенных свойств вирусов и исходно скомпрометированного иммунного статуса. Комплексный препарат, сочетающий противовирусное, иммуномодулирующее, противовоспалительное и антигистаминное действие, оказывает выраженный терапевтический эффект при ОРВИ у пациентов с онкологической патологией. Препарат имеет благоприятный профиль безопасности, и его назначение позволяет снизить лекарственную нагрузку и риск лекарственного взаимодействия с противоопухолевыми препаратами.
2 Heaton NS et al. Genome-wide mutagenesis of influenza virus reveals unique plasticity of the hemagglutinin and NS1 proteins. Proc Natl Acad Sci USA 2013; 25.
3 Антимикробная терапия по Джею Сэнфорду. Под ред. Д.Гилберта, Р.Меллеринга мл., Дж.Элиопулоса и др. М.: ГРАНАТ, 2013.
5 Сыроешкин А.В., Никифорова М.В., Колдина А.М., Горнак А.А., Тарабрина И.В. Лекарственные препараты на основе релиз-активных антител. Справочник поликлинического врача. 2018 (3):15-20
6 Эпштейн О.И. Сверхмалые дозы (история одного исследования). М.: Изд-во РАМН, 2008.
7 Жавберт Е.С., Дугина Ю.Л., Эпштейн О.И. Противовоспалительные и противоаллергические свойства антител к гистамину в релиз-активной форме: обзор экспериментальных и клинических исследований. Детские инфекции. 2014; 1: 40-3.
8 Архивъ внутренней медицины. 2013; 14 (6): 46.
9 Шиловский И.П., Корнилаева Г. В., Хаитов М.Р. Новые возможности в терапии респираторно-синцитиальной вирусной инфекции: данные доклинического исследования препарата Эргоферон. Иммунология. 2012; 33 (3): 144-8.
11 Taniguchi K, Petersson M, Höglund P et al. Interferon gamma induces lung colonization by intravenously inoculated B16 melanoma cells in parallel with enhanced expression of class I major histocompatibility complex antigens. Proc Natl Acad Sci USA 1987; 84 (10): 3405-9.
Читайте также:

