Вирусная нагрузка впч и онкобелки
Обновлено: 24.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Вирус папилломы человека: причины появления, симптомы, диагностика и способы лечения.
Определение
Вирусы папилломы человека (ВПЧ) — это группа чрезвычайно распространенных и генетически разнородных ДНК-содержащих вирусов, поражающих эпителий кожных покровов и слизистых оболочек. Вирус папилломы человека относится к семейству папилломавирусов. Было выявлено и описано более 190 типов ВПЧ. Каждый тип отличается более чем на 10% от ближайшего родственного штамма. Из их числа более 30 типов ВПЧ могут инфицировать эпителиальный слой урогенитального тракта. В зависимости от онкогенного потенциала выделяют вирусы высокого (типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59) и низкого (типы 6, 11, 42, 43, 44) онкогенного риска.
На долю двух высокоонкогенных типов ВПЧ (16 и 18) приходится до 70% случаев рака шейки матки, 80% рака вульвы и влагалища, 92% анального рака, 95% рака ротовой полости, 89% рака ротоглотки, 63% рака полового члена.
При этом 16-й тип имеет самый высокий канцерогенный потенциал. Генотипы ВПЧ 6 и 11 вызывают практически все виды аногенитальных бородавок и большинство случаев рецидивирующего респираторного папилломатоза, который наблюдается в основном у детей младше 5 лет или у лиц 20-30 лет.
Причины появления ВПЧ
Заболевания, вызванные вирусом папилломы человека (ВПЧ), относятся к болезням с латентным началом, хроническим персистирующим течением и проявляются доброкачественными и злокачественными новообразованиями в зоне входных ворот инфекции.
Источником возбудителя инфекции является больной человек или носитель. ВПЧ передается от человека к человеку при оральном, генитальном и анальном половых контактах, а также контактно-бытовым и вертикальным (от матери к ребенку) путями.
Вирус папилломы человека — единственный вирус, который не проникает в кровь, вследствие чего инфекционный процесс протекает без развития воспалительной реакции. В процессе инфицирования вирус папилломы человека поражает незрелые клетки, чаще базального слоя, которые затем становятся постоянным источником инфицирования эпителиальных клеток. Инфицированию способствует наличие микротравм и воспалительных процессов кожи и слизистых оболочек, приводящих к снижению местного иммунитета.
Вирус способен персистировать (хронически присутствовать) в месте проникновения как угодно долго. Инкубационный период заболевания может длиться от нескольких месяцев до нескольких лет. Среднее время между инфицированием ВПЧ и развитием аногенитальных бородавок составляет от 3 месяцев у женщин и до 11 месяцев у мужчин. Инфицирование человека может происходить как одним, так и несколькими типами ВПЧ.
Интервал между инфицированием ВПЧ и прогрессированием до инвазивного рака составляет, как правило, 10 лет или более.
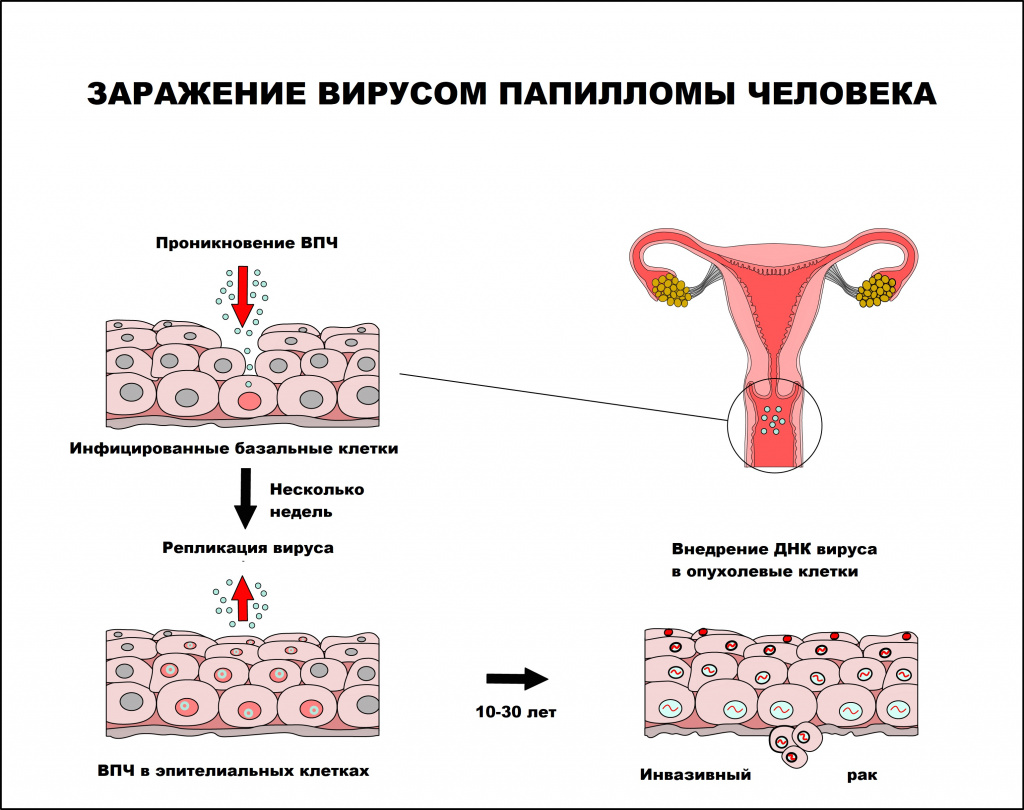
Папилломавирусная инфекция чаще регистрируется у лиц молодого возраста, имеющих большое число половых партнеров. По данным ВОЗ, 50-80% населения инфицировано ВПЧ, но лишь 5-10% инфицированных лиц имеют клинические проявления заболевания.
Классификация заболевания
Общепринятой классификации аногенитальных (венерических) бородавок не существует. Однако выделяют несколько их клинических разновидностей:
- остроконечные кондиломы;
- бородавки в виде папул;
- поражения в виде пятен;
- внутриэпителиальная неоплазия;
- бовеноидный папулез и болезнь Боуэна;
- гигантская кондилома Бушке-Левенштайна (карциномоподобная остроконечная кондилома).
Симптомы ВПЧ
- наличие одиночных или множественных образований в виде папул, папиллом, пятен на кожных покровах и слизистых оболочках половых органов;
- зуд и парестезии (расстройство чувствительности) в области поражения; болезненность во время половых контактов (диспареуния);
- при локализации высыпаний в области уретры наблюдается зуд, жжение, болезненность при мочеиспускании (дизурия); при обширных поражениях в области уретры – затрудненное мочеиспускание;
- болезненные трещины и кровоточивость кожных покровов и слизистых оболочек в местах поражения.
Бородавки в виде папул – папулезные высыпания без пальцеобразных выпячиваний, локализующиеся на кератинизированном эпителии половых органов.
Поражения в виде пятен – серовато-белые, розовато-красные или красновато-коричневые пятна на коже и/или слизистой оболочке половых органов;
Бовеноидный папулез и болезнь Боуэна – папулы и пятна с гладкой или бархатистой поверхностью; цвет элементов в местах поражения слизистой оболочки – бурый или оранжево-красный, а поражений на коже – пепельно-серый или коричневато-черный.
Гигантская кондилома Бушке-Левенштайна – мелкие бородавчатоподобные папилломы, сливающиеся между собой и образующие очаг поражения с широким основанием.
Респираторный папилломатоз – заболевание, при котором папилломы формируются в дыхательных путях, ведущих от носа и полости рта в легкие.
Диагностика ВПЧ
Латентно протекающая инфекция диагностируется только с помощью молекулярно-биологических методов исследования. Субклиническая инфекция диагностируется при молекулярно-биологическом, кольпоскопическом, цитологическом и морфологическом исследовании.
Для улучшения визуализации аногенитальных бородавок может быть проведена проба с 3-5% раствором уксусной кислоты. Тест считается отрицательным, если после обработки уксусной кислотой на поверхности шейки матки нет белых участков. И положительным при выявлении на шейке матки участков белого цвета (ацетобелых участков), отличных от остальной поверхности шейки матки.
Изменения эпителия шейки матки, вызванные ВПЧ, могут быть выявлены цитологическим методом микроскопии слущенных клеток с окраской по Папаниколау (Пап-тест).
Метод окрашивания по Папаниколау - специально разработанный метод, позволяющий с наибольшей степенью достоверности выявить ранние предраковые заболевания шейки матки. Рак шейки матки в структуре злокачественных новообразований репродуктивной системы занимает третье место. До 1992 г. заб.
К.м.н. О.В. Качалина, к.м.н. Л.Д. Андосова, Д.Д. Елисеева, С.В. Засыпкина, Г.А. Микаилова
Кафедра акушерства и гинекологии им. С.С. Добротина (зав. — проф. Т.С. Качалина) Нижегородской государственной медицинской академии
Determination of human papillomavirus types 16 and 18 E7 oncoprotein in reproductiveaged women with cervical pathology
To enhance the efficiency of diagnosing abnormalities of the cervix uteri, the investigators examined 416 patients aged 17 to 46 years with human papillomavirus (HPV)-caused cervical diseases, such as cervicitis and intraepithelial neoplasias. All the patients underwent comprehensive examination: optical coherent tomography with colposcopy; assessment of lower genital tract microbiocenosis by using etiotropic treatment, if needed; HIV testing, typing; viral load determination; liquid-based cytology; immunocytochemical determination of the oncomarker p16ink 4a; determination of HPV types 16 and 18 E7 oncoprotein; biopsy of the cervix uteri; cervical canal curettage if indicated. If the pathogenic, opportunistic, or fungal microfloras were found, treatment with polygynax (Laboratory Innotec International, France) was performed. A diagnostic testing algorithm was proposed for HIV-associated cervical pathology. The importance of HPV types 16 and 18 E7 oncoprotein determination was substantiated in the comprehensive examination of reproductive-aged patients with cervical pathology. In patients with latent and subclinical HIV infection, E7 oncoprotein determination is required to specify the phase of HPV existence in the host cell and to predict the realization of its oncogenic potential in order to draw up an individual patient management plan.
Key words: reproductive-aged women, human papillomavirus, cervical pathology, diagnostic algorithm, HPV types 16 and 18 E7 oncoprotein.
Среди вирусных инфекций, передающихся половым путем, наибольшего внимания заслуживает возрастающая заболеваемость папилломавирусной инфекцией (ПВИ), распространенность которой среди сексуально активного населения планеты составляет 20—60% [4]. Вирус папилломы человека (ВПЧ) является доказанным экзогенным этиопатогенетическим фактором в развитии цервикальной интраэпителиальной неоплазии (ЦИН), в 15—20% инициирует развитие рака шейки матки (РШМ) [2, 3], в связи с чем многие авторы рассматривают ВПЧассоциированный цервицит как ранний показатель предракового состояния [1]. Число случаев прогрессирования ЦИН в более высокую степень или инвазивный рак колеблется в очень широких пределах — от 1,4 до 60% (L. Harlan и соавт., 1991).
Онкогенная стратегия ВПЧ определяется интегративной вирогенией, т.е. включением вирусного генома в состав клеточных хромосом [5]. Тем не менее некоторые исследователи утверждают [10], что ДНК ВПЧ является убиквитарной, т.е. распространенной повсеместно, и вероятность ее обнаружения в женских половых органах достаточно высока.
В настоящее время не существует ни одного метода прогнозирования течения ЦИН у конкретной больной, определяющего возможность стойкой персистенции или прогрессирования ее в более высокую степень или инвазивный РШМ с указанием точной длительности этого процесса [7].
В нашей стране нет единого подхода к диагностике и лечению ВПЧ-ассоциированных заболеваний — воспалений и преинвазивных неоплазий шейки матки у молодых женщин. Так, существующие стандарты оправдывают агрессивный радикализм, который зачастую ведет к нарушению репродуктивной функции, а тактика, основанная на индивидуализации решения вопроса о биопсии и минимизации лечения, удлиняет динамическое наблюдение, что может повлечь за собой осложнения процесса.
Сотрудниками кафедры акушерства и гинекологии Нижегородской государственной медицинской академии был проведен анализ результатов 956 гистологических исследований фрагментов шейки матки, полученных после эксцизий, произведенных пациенткам с цервикальной патологией. Установлено, что 80,29% эксцизий, выполненных в ЦРБ, и 18,53% эксцизий, выполненных в ОКБ им. Н.А. Семашко, не имели данных о патологии ЦИН II+, т.е. оказались неоправданными. На наш взгляд, такая диагностическая агрессия являлась следствием недостаточности скринингового контроля ввиду ограниченных возможностей традиционных методов обследования.
Основная задача при обследовании больных с вирусными поражениями шейки матки заключается в выявлении преинвазивных интраэпителиальных неоплазий, стоимость лечения которых значительно меньше, чем РШМ. Известно, что эффективность затрат — важная составляющая любой диагностической программы, а биопсия шейки матки является не только травматическим вмешательством, но и затратным методом диагностики. Поэтому продолжается поиск новых методов диагностики (оптических, молекулярных) для решения вопроса о необходимости гистологического исследования. Выше изложенное диктует необходимость поиска методов терапии цервикальной патологии, нацеленных на снижение распространенности хронических (персистентных) папилломатозных инфекций, которые служат предшественниками инвазивных раковых опухолей [5].
Решение этих задач также стало возможным вследствие применения в клинической онкогинекологии новейших методов визуализации биотканей: оптической когерентной томографии с кольпоскопией (ОКТкольпоскопия) в новой скоростной модификации и молекулярно-биологического метода — определения онкобелка Е7, который, как известно, является маркером интегративной вирогении, в цервикальных пробах. Известно, что продуктивная репликация ВПЧ возможна лишь в клетках, находящихся в стадии необратимой дифференцировки, в противном случае инфекция принимает абортивный характер. Вирусный геном элиминируется или начинает персистировать, используя механизм интегративной вирогении, когда, оказавшись в клетке, вирусная ДНК транслоцируется в ядро, где и происходят основные события. Вопреки нумерации, репликация ДНК ВПЧ начинается с образования онкопротеинов Е6 и Е7, ответственных за трансформацию клеток, т.е. Е6 и Е7 следует считать вирусными онкогенами [6]. Онкобелок Е7 присутствует во всех клетках, инфицированных ВПЧ и начавших неопластическую трансформацию вплоть до развития РШМ, поэтому его определение очень важно для оценки риска развития РШМ у конкретной пациентки [9]. E6 и Е7 — единственные белки ВПЧ, экспрессия которых устойчиво сохраняется в тканях, пораженных РШМ [1].
Материал и методы
Обследованы 416 пациенток в возрасте от 17 до 46 лет с ВПЧ-ассоциированными заболеваниями шейки матки — цервицитами и интраэпителиальными неоплазиями.
Все пациентки, вошедшие в исследование, по результатам обследования на ВПЧ с типированием и определением вирусной нагрузки были разделены на три группы: ВПЧ высокого канцерогенного риска (ВКР) были выявлены у 221 больной (1-я группа), ВПЧ низкого канцерогенного риска (НКР) — у 134 (2-я группа), у 61 пациентки ДНК ВПЧ не была обнаружена (3-я группа).
При выявлении бактериального и грибкового инфицирования проводилось лечение с применением препарата Полижинакс.
Неомицин (в 1 капсуле содержится 35 000 МЕ), являясь аминогликозидом широкого спектра действия, активен в отношении большинства грамположительных и грамотрицательных кокков, грамположительных палочек, таких, как коринебактерии и Mycobacterium tuberculosis, грамотрицательных бактерий, в частности Еscherichia сoli, Enterobacter aerogenes, Haemophilus influenzae, Klebsiella pneumoniae, Proteus vulgaris.
Полимиксин В (в 1 капсуле содержится 35 000 МЕ) — полипептидный антибиотик, активен в основном в отношении таких грамотрицательных бактерий, как Pseudomonas aeruginosa, исключая Proteus и Neisseria, а также in vitro в отношении Ureaplasma urealyticum. Большинство анаэробных микробов устойчивы к этим двум антибиотикам.
Третий компонент — нистатин (в 1 капсуле содержится 100 000 МЕ) оказывает in vitro и in vivo фунгицидное и фунгистатическое действие на грибы рода Candida, а также на грибы родов Histoplasma, Coccidioides, Cryptococcus. Диметикон, входящий в состав препарата, способствует равномерному распределению основных веществ по всей поверхности влагалища, также оказывает противовоспалительное действие.
В клинической практике при вагините и цервиците очевидно разведение концентрации препаратов вагинальными выделениями, также наблюдается значительное снижение количества лактобацилл в вагинальном биотопе. Эффективность полижинакса подтверждена сохранением чувствительности грамотрицательных и грамположительных микроорганизмов, дрожжеподобных грибов в разведениях изотонического раствора натрия хлорида 1:10, 1:100, 1:1000. Установлено также, что лактобациллы, выделенные из влагалища женщин, в концентрированном растворе и во всех исследуемых разведениях препарата оказались резистентными [8].
Лабораторный контроль эффективности лечения проводился через 3—4 нед после его окончания.
Для цитологического исследования материал забирали из цервикального канала, переходной зоны и экзоцервикса с помощью одноразовой цервикальной щеточки cyto-brush, а при наличии III типа зоны трансформации — с помощью щеточки cervix-brush. Оценку результатов цитологического исследования производили согласно классификационной системе Папаниколау (ПАП) в соотношении с классификациями Бетесда и ЦИН.
Забор материала для морфологической оценки осуществлялся с помощью биопсийной петли для радиоволновой хирургии.
В качестве одного из методов лечения применялась фотодинамическая терапия (ФДТ), в основе которой лежит фотохимическая реакция введенного в организм фотосенсибилизатора, в нашем исследовании фотодитазина, и лазерного излучения определенной длины волны в аэробных условиях. В результате этой реакции выделяются активные формы кислорода, разрушающие пораженные клетки. ФДТ позволяет не только выполнить локальную деструкцию патологических очагов эпителия, где произошла клиническая манифестация ПВИ, но и воздействовать на резервуар ВПЧ в латентном состоянии или недиагностированной субклинической форме, который остается в окружающих тканях и может являться основой для дальнейшего развития онкопатологии.
После процедуры ФДТ всем пациенткам назначался полижинакс с целью профилактики воспалительных осложнений при отхождении некротизированных тканей, что сопровождается значительной транссудацией и, соответственно, разведением препарата.
Результаты и обсуждение
Средний возраст обследованных пациенток составил 29 лет. 69% женщин находились в возрастной группе до 30 лет. Это подтверждает многочисленные данные международных и отечественных исследователей о том, что у женщин молодого возраста ВПЧ-ассоциированная патология встречается чаще, однако и в зрелом возрасте она является актуальной проблемой.
При первом визите всем пациенткам проводилась ОКТ-кольпоскопия. Согласно общим положениям по Международной кольпоскопической классификации, принятой в Рио-де-Жанейро, неадекватная картина отмечалась в 87% случаев из-за проявлений воспаления, контактных кровотечений, рубцовых деформаций, III типа зоны трансформации. При ОКТ-зондировании влагалищной порции шейки матки у 66% пациенток были получены изображения в соответствующей желто-коричневой палитре, где оттенки желтого соответствуют большей, а оттенки коричневого — меньшей оптической плотности. Данные изображения были отнесены к доброкачественным из-за наличия субэпителиальных включений, нормальной скорости угасания сигнала и четкой двуслойности изображения, где верхний слой имеет меньшую оптическую плотность, чем нижний. Кроме доброкачественности, изображения отражали интенсивность воспалительного процесса эктоцервикса: явное усиление, ветвистость сосудистого рисунка, отек стромы, оцениваемый с помощью сниженной скорости угасания оптического сигнала.
У 75% пациенток наблюдалась сопутствующая патология шейки матки, из них у 70% женщин ПВИ протекала на фоне эктопии либо эктропиона, рубцовая деформация цервикса отмечалась в 13% случаев, эндометриоз шейки матки — в 8%, полипы цервикального канала —в 3,5%.
Генитальные кондиломы как клиническая форма течения ПВИ были выявлены у 8,5% пациенток, в 4,5% случаев были диагностированы кондиломы шейки матки, в 5% —вульвы и влагалища. Распространенность данной патологии при беременности составила 62,5%.
Лечение генитальных кондилом являлось обязательным этапом ведения пациенток с ВПЧ-ассоциированными цервицитами. С профилактической целью на 6 дней пациенткам перед лечебными манипуляциями назначался полижинакс, не только обладающий выраженными антибактериальным и фунгицидным свойствами, но и оказывающий противовоспалительный эффект. Выбор метода определялся в зависимости от вида образований, их размера, обширности поражения, необходимости гистологического исследования; осуществлялась криодеструкция либо эксцизия и деструкция с помощью аппарата радиоволновой хирургии Сургитрон.
На втором этапе диагностического исследования выявлялась этиология воспалительного процесса. По нашим данным, ПВИ чаще всего сочеталась с уреаплазмозом (в 35% случаев) и кандидозом (в 10% случаев), в 7,5% случаев у пациенток с ПВИ был обнаружен микоплазмоз, в 5% — гонорея и цитомегалия, в 2,5% — трихомониаз и хламидиоз. В 30% случаев ВПЧ-инфекция протекала на фоне дисбаланса за счет снижения количества лактобактерий, а в 32,5% случаев — на фоне анаэробного дисбиоза.
Все пациентки получали соответствующую этиотропную терапию с последующим восстановлением лактофлоры влагалища и контролем эффективности лечения через 3—4 нед после его окончания. В качестве местного лечения использовался полижинакс.
Нами были обследованы 90 ВПЧ-позитивных пациенток с нарушением влагалищного микробиоценоза. Клиническое и лабораторное обследование пациенток осуществлялось до начала терапии полижинаксом, через 12 дней лечения и 3—4 нед после окончания лечения.
Эффективность терапии препаратом оценивали по 3 критериям: 1) по общему состоянию и самочувствию пациенток; 2) по клиническим данным (по данным анамнеза и гинекологического осмотра); 3) по данным лабораторных бактериоскопических исследований. По результатам обследования и лечения выявлены общее улучшение состояния и купирование симптомов вагинита у 94% пациенток. Отмечено изменение клинической картины и субъективных ощущений: изменение характера белей, уменьшение раздражения, зуда, жжения. По данным гинекологического осмотра также установлено улучшение состояния слизистой оболочки влагалища — уменьшение отечности и гиперемии. У большинства пациенток отмечен положительный бактериологический эффект препарата: подавление патогенной микрофлоры, в том числе грибов рода Candida (по данным бактериоскопии).
На третьем диагностическом этапе проводилось ВПЧ-типирование. У 53,12% обследованных были выявлены ВПЧ высокого канцерогенного риска (16, 18, 31, 33, 35, 39, 45, 48, 51, 52, 56-й типы), 14,57% пациенток были инфицированы ВПЧ низкого канцерогенного риска (6, 11, 42, 43, 44-й типы). В 15,62% случаев встречалось сочетание ВПЧ ВКР и ВПЧ НКР, а у 16,69% пациенток ДНК ВПЧ не было обнаружено.
Следующим важнейшим диагностическим шагом являлось контролируемое ОКТ-кольпоскопией прицельное цитологическое исследование, производимое методом жидкостной цитологии. По результатам нашего исследования, у 87% пациенток цитологический мазок был отнесен к LSIL (low-frade squamous intraepithelial lesions — плоскоклеточное интраэпителиальное поражение низкой степени выраженности) по классификации Бетесда, среди них у 59,7% больных были мазки типа ASCUS (atypical squamous cell of undetermined significance — атипические клетки плоского эпителия неопределенного значения), т.е. II класс мазка по ПАП, что соответствует признакам ПВИ по системе ЦИН, а 27,3% мазков были отнесены к III классу по ПАП или к ЦИН I. У 13% женщин была выявлена нормальная цитологическая картина.
Гистологическое исследование должно являться заключительным седьмым диагностическим этапом, так как этот метод является инвазивным, травматичным и может нарушить репродуктивные планы пациентки. Показаниями к проведению биопсии у пациенток с ВПЧассоциированными цервицитами, по нашему мнению, являются следующие: наличие злокачественных ОКТлокусов в отсутствие данных за HSIL (high-grade squamous intraepithelial lesions — плоскоклеточное интраэпителиальное поражение высокой степени выраженности) по результатам жидкостной цитологии; LSIL без положительной динамики при проведении патогенетической терапии и динамическом наблюдении в течение 18—24 мес; планирование сеанса ФДТ; возраст пациентки старше 35 лет; невозможность дальнейшего наблюдения; при III типе зоны трансформации обязательным является выскабливание слизистой оболочки цервикального канала. Биопсия должна проводится под контролем ОКТ-кольпоскопии и быть максимально щадящей, поэтому в нашем исследовании мы применяли методы радиоволновой хирургии, что позволяло контролировать размер иссекаемого участка, глубину биопсии, получать образцы с минимальными коагуляционными повреждениями.
При выборе тактики дальнейшего ведения пациентки были разделены на 3 группы, в зависимости от конкретной клинической ситуации и согласно совокупности полученных результатов на этапах диагностики.
У 40% пациенток, у которых имело место сочетание доброкачественного типа ОКТ, I степени кольпоскопических изменений, LSIL и р16ink4a-негативной реакции, была определена тактика активного динамического наблюдения после курса противовирусной и иммуномодулирующей терапии при Е7-отрицательной реакции или нескольких таких курсов — при Е7-положительной реакции, в том числе в группе женщин, планирующих беременность.
У 18% пациенток, у которых отмечалось наличие злокачественных локусов, определяемых с помощью ОКТкольпоскопии, I—II степени кольпоскопических изменений, LSIL, р16ink4a-негативной или позитивной реакции, были выполнены прицельное гистологическое исследование, ФДТ и затем проводилось динамическое наблюдение. Всем пациенткам через 10 дней после процедуры ФДТ с профилактической целью назначались капсулы полижинакса. Диметикон, входящий в состав препарата, является активным экципиентом с функцией распространения основных его элементов по всей поверхности влагалища. Он также оказывает успокаивающее, обволакивающее воздействие на воспаленную слизистую оболочку влагалища и улучшает процессы заживления многослойного плоского эпителия эктоцервикса после отхождения некротических масс.
При выявлении цервикальных изменений, соответствующих HSIL, Сancer in situ производилась конизация шейки матки с последующим выскабливанием слизистой оболочки цервикального канала.
Всем небеременным больным с ВПЧассоциированным цервицитом проводились противовирусное и иммуномодулирующее лечение и вакцинация квадривалентной вакциной с целью профилактики повторного инфицирования.
По окончании данного исследования нами предложен следующий алгоритм диагностических мероприятий по выявлению цервикальной патологии, представленный на рисунке.

Алгоритм диагностических мероприятий при ВПЧ-ассоциированной цервикальной патологии.
Примечание. * КС — кольпоскопических; **ВЦК — выскабливание слизистой цервикального канала.
М.А.Гомберг, д.м.н., профессор, А.М.Соловьев, к.м.н., доцент, МГМСУ, Москва
В последнее время папилломавирусная инфекция привлекает особое внимание в связи с ролью этой группы вирусов в развитии рака. В 2008 г. Нобелевской премией по медицине было отмечено доказательство того, что некоторые типы вируса папилломы человека (ВПЧ) способны вызывать рак шейки матки. По Handley J.M., et al. (1994), к ВПЧ-поражениям относят: клинические формы — аногенитальные бородавки (остроконечные кондиломы, вульгарные бородавки), симптоматические внутриэпителиальные неоплазии на ранних стадиях при отсутствии дисплазии (плоские кондиломы); субклинические формы — бессимптомные внутриэпителиальные неоплазии при отсутствии дисплазии; латентные формы (отсутствие морфологических или гистологических изменений на фоне обнаружения ДНК ВПЧ).
Лечение аногенитальных ВПЧ-поражений, согласно существующим принципам по ведению больных с клиническими проявлениями, связанными с ВПЧ, должно быть направлено на разрушение тем или иным методом папилломатозных очагов, возникающих на месте внедрения вируса. Во всех основных рекомендациях по ведению больных с ВПЧ-инфекцией — CDC, Европейских рекомендациях, рекомендациях ВОЗ, и в том числе в рекомендациях РОДВ, приведен именно такой подход.
Роль вирусов папилломы человека (ВПЧ) в развитии множества доброкачественных и злокачественных новообразований кожи и слизистых оболочек не вызывает сомнений. Полагают, что все 500тыс. случаев рака шейки матки, ежегодно диагностируемые в мире, вызваны генитальной ВПЧ-инфекцией (Bulletin Word Health Organization, 2007).
В различных клинических рекомендациях и протоколах подробно описываются методы лечения именно клинических проявлений ВПЧ, но обходится стороной вопрос так называемого вирусоносительства или бессимптомного выделения вируса. Причем вопросу тактики врача при бессимптомном выделении вируса у пациента ВПЧ уделяется мало внимания не только в практических рекомендациях, но и в научно-исследовательской литературе.
Мы предлагаем свой подход к этой проблеме.
Прежде всего мы исходим из того, что наш долг — ставить во главу угла интересы пациента. Если он встревожен наличием ВПЧ и желает избавиться от этой инфекции, мы должны постараться успокоить его и обсудить все имеющиеся в настоящее время возможности лечения. В противном случае нам будет трудно рассчитывать на доверие с его стороны.
Мы считаем, что такое обсуждение должно состоять из 3 частей.
1. Информирование пациента относительно характера течения и последствий инфекции.
2. Методы профилактики рака шейки матки (при выявлении вируса у женщин).
3. Возможности воздействия на ВПЧ с целью его элиминации.
1. ИНФОРМИРОВАНИЕ ПАЦИЕНТА
При первом же визите необходимо рассказать человеку о возможных рисках, связанных с инфицированием ВПЧ. Однако консультирование нужно проводить очень осторожно, чтобы не спровоцировать у человека развитие психоневроза и канцерофобии.
Пациент с выявленным ВПЧ должен знать о своей потенциальной заразности для неинфицированных лиц, поэтому ему надо рекомендовать использовать презерватив при половых контактах и обязательно информировать своего полового партнера о вирусоносительстве.
Следует проинформировать пациентов о том, что возможно самостоятельное исчезновение ВПЧ. Известно, что у лиц более молодого возраста вероятность исчезновения вируса с течением времени выше, чем у лиц старше 25 лет.
2. ПРОФИЛАКТИКА РАКА ШЕЙКИ МАТКИ (ПРИ ВЫЯВЛЕНИИ ВИРУСА ПАПИЛЛОМЫ ЧЕЛОВЕКА У ЖЕНЩИН)
Всем женщинам, инфицированным ВПЧ, следует провести кольпоскопическое исследование, в том числе с окраской раствором Люголя или раствором уксусной кислоты, а также цитологические тесты по Папаниколау. Периодичность обследований обсуждается с гинекологом в зависимости от степени онкогенности выявленных вирусов и результатов кольпоскопии и цитологии. Цитологические исследования следует проводить не реже, чем 1 раз в 6 месяцев. Для женщин старше 26 лет этот подход является практически единственным способом профилактики рака шейки матки.
Имеются публикации об эффективности российского препарата индинол для профилактики рака шейки матки у женщин, инфицированных ВПЧ. Однако контролированных плацебо-исследований не проводилось.
3.ВОЗДЕЙСТВИЕ НА ВПЧ
Наиболее дискуссионным является вопрос о воздействии на выделение вируса, поэтому остановимся на нем подробнее. Врач, безусловно, должен информировать пациента о том, что в настоящее время нет методов, позволяющих достоверно и с высокой степенью вероятности устранить вирус из организма.
Необходимость проведения лечебных мероприятий обсуждается индивидуально с каждым пациентом. Желательно, чтобы врач принимал решение о проведении лечения с целью устранения ВПЧ в отсутствие клинических проявлений только после подписания пациентом информированного согласия, во избежание возможных последующих недоразумений.
Теоретически, учитывая локализацию вируса в эпителиальных клетках и то, что происходит постоянное слущивание эпителия, можно предположить, что ВПЧ может исчезнуть вместе со старыми эпителиальными клетками. Видимо, именно этим объясняются случаи самопроизвольного исчезновения ВПЧ. Между тем очевидно, что элиминации ВПЧ из организма с гораздо большей эффективностью можно добиться при активизации противовирусного иммунитета, ингибирующего размножение ВПЧ и его внедрение в другие клетки. Доказать возможность достижения такого результата на практике можно только путем проведения соответствующих специальных исследований.
Потенциально возможны 3 способа инфицирования: от матери к ребенку (трансплацентарно; во время родов, в том числе путем кесарева сечения; возможно — через слюну или грудное молоко), посредством передачи вируса воздушно-капельным или контактно-бытовым путями. Cчитается, что ВПЧ-инфекция передается в основном половым путем, что объясняет ее широкую распространенность среди сексуально активного населения. В частности, в США ежегодно диагностируют 6,2 млн новых случаев генитальной ВПЧ-инфекции (Steinbrook R., 2006).
Повышение функциональной эффективности противовирусного иммунитета является основным способом, который предположительно может помочь в устранении вируса из организма или уменьшить его активность. Этого можно достичь как неспецифическими, так и специфическими методами.
К неспецифическим относят различные способы укрепления защитных сил организма, так называемый здоровый образ жизни: правильное питание, профилактический прием витаминов, биологически активных добавок.
Отдельный вопрос — проведение гомеопатического лечения. Но поскольку об этих способах часто упоминается в научно-популярной литературе, в рамках данной статьи мы их комментировать не будем.
Установлено, что при применении интерферонов снижается количество вирусной ДНК (по данным ПЦР) у пациентов в очагах поражения [Arany I., et al., 1995].
Интерферон применяют местно и системно (подкожно, внутримышечно, внутривенно или ректально).
В большинстве исследований была показана невысокая эффективность наружного применения интерферона [Keay S., et al, 1988] при наличии клинических проявлений, а при лечении больных с субклиническими очагами ВПЧ-инфекции и цервикальных неоплазиях (ЦИН) были получены обнадеживающие результаты [Gross G., 1996].
По данным различных авторов, при системном применении альфа-интерферона в дозе от 1,5 до 3 млн МЕ внутримышечно или подкожно через день в течение 4 недель в качестве монотерапии у 11—100% пациентов наблюдается полное исчезновение бородавок [Gross G., et al., 1986; Zwiorek L., et al., 1989], что свидетельствует о возможном ингибирующем влиянии препаратов интерферонов на ВПЧ.
При системном применении интерферонов побочными эффектами обычно являются гриппоподобные состояния, выраженность которых зависит от полученной дозы [Handley, et al., 1994]. Эти побочные явления можно ослабить приемом нестероидных противовоспалительных препаратов.
Считается возможным самостоятельное исчезновение ВПЧ. Известно, что у лиц более молодого возраста вероятность исчезновения вируса с течением времени выше, чем у лиц старше 25 лет.
На российском рынке представлен широкий выбор интерферонов различных производителей, как отечественных, так и зарубежных, — генферон, виферон, кипферон, реаферон, роферон-А, интрон А, реальдирон и т.д. Предпочтительнее назначать рекомбинантные, а не человеческие интерфероны.
При назначении интерферонов надо учитывать не только частые побочные реакции, но и то, что их введение может подавлять синтез собственных эндогенных интерферонов. Поэтому в отсутствие клинических проявлений интерфероны применяют только в том случае, когда о целесообразности такого назначения свидетельствуют результы исследования иммунного статуса. Следует также отметить и высокую стоимость качественных препаратов интерферона.
Воздействовать на противовирусный иммунитет можно с помощью индукторов эндогенного интерферона и других активаторов иммунитета. На российском фармацевтическом рынке представлено много иммуноактивных препаратов, которые, согласно инструкции производителя или рекомендациям исследователей, можно применять для комбинированного лечения аногенитальных бородавок (в сочетании с различными деструктивными методами). На основании этого их можно рекомендовать для противовирусной терапии при отсутствии клинических проявлений.
Гепон — синтетический олигопептид, состоящий из 14 аминокислотных остатков, относится к группе иммуномодуляторов. Препарат показан для повышения эффективности иммунной защиты от инфекций, лечения и профилактики оппортунистических инфекций, вызванных бактериями, вирусами или грибами. Гепон оказывает иммунофармакологическое и противовирусное действие:
У больных с ослабленной иммунной системой гепон:
Так, например, после удаления очагов ВПЧ-поражений любым деструктивным методом, аппликации гепона (от 3 до 6 аппликаций через день) позволяют ускорить процесс заживления и снизить уровень рецидивирования. Системно препарат применяют по 2 мг перорально 3 раза в неделю. Курс можно повторять с интервалом в 1 неделю [Соловьев А.М., 2003].
Изопринозин (инозин пранобекс) — противовирусное средство с иммуномодулирующими свойствами. Препарат, индуцируя созревание и дифференцирование Т-лимфоцитов и Т1-хелперов, потенцируя индукцию лимфопролиферативного ответа в митогенных или антиген-активных клетках, нормализует дефицит или дисфункцию клеточного иммунитета. Изопринозин моделирует цитотоксичность Т-лимфоцитов и натуральных киллеров, функцию Т8-супрессоров и Т4-хелперов, а также повышает количество иммуноглобулина G и поверхностных маркеров комплемента. Препарат повышает синтез интерлейкина-1 (ИЛ-1) и интерлейкина-2 (IL-2), регулирует экспрессию рецепторов IL-2, существенно увеличивает секрецию эндогенного γ-интерферона и уменьшает продукцию интерлейкина-4 в организме. Изопринозин усиливает действие нейтрофильных гранулоцитов, хемотаксис и фагоцитоз моноцитов и макрофагов. Кроме этого, он оказывает прямое противовирусное действие, угнетая синтез вирусов путем встраивания инозин-оротовой кислоты в полирибосомы пораженной вирусом клетки и нарушая присоединение адениловой кислоты к вирусной и-РНК. Одним из показаний для применения препарата являются инфекции, вызванные вирусом папилломы человека: остроконечные кондиломы, папилломавирусная инфекция вульвы, вагины и шейки матки (в составе комплексной терапии).
Для женщин старше 26 лет цитологическое исследование слизистой шейки матки, проводимое 2 раза в год, является практически единственным способом профилактики рака шейки матки.
В литературе описаны различные схемы и результаты применения изопринозина.
При инфекциях, вызванных ВПЧ, изопринозин назначают по 3 г/сут (2 таблетки 3 раза в сутки) как дополнение к местной терапии или хирургическому вмешательству на протяжении 14—28 дней для пациентов с низкой степенью риска или 5 дней в неделю последовательно в течение 1—2 недель в месяц в течение 3 мес для пациентов с высокой степенью риска.
Известно о зарубежном опыте применения инозин пранобекса в качестве терапии, дополняющей деструкцию аногенитальных бородавок [Davidson-Parker J., et al., 1988]. Препарат назначали по 1 г 3 раза в сутки в течение 14—28 дней.
В работе Забелева А.В. и соавт. (2005) показано исчезновение атипичного эпителия у женщин с ВПЧ-ассоциированными плоскоклеточными интраэпителиальными поражениями низкой степени после проведения курсов лечения изопринозином. Препарат назначали по 1 грамму 3 раза в сутки в течение 5 дней, 3 курса с интервалом в 1 месяц. В исследовании, проведенном Sun Kuie Tay (1996), показаны аналогичные результаты — улучшение морфологической картины эпителия вульвы. Инозин пранобекс назначали по 1 г 3 раза в сутки в течение 6 недель. Положительный эффект был достигнут у 63,5% больных, тогда как в группе, принимавшей плацебо, только у 16,7%. О прекращении выделения ВПЧ у 65,6% больных после проведения комбинированной терапии (изопринозин + деструкция очагов) ЦИН низкой степени сообщает Прилепская В.Н. (2007). При использовании только деструкции очагов этот результат был достигнут у 46,9% больных. Изопринозин назначали за 7—10 дней до проведения деструкции по 1 г 3 раза в сутки в течение 5 дней. В исследовании Шевниной И.В. (2009) показаны похожие результаты — прекращение выделения ВПЧ у 77% больных при комбинированной терапии женщин с ЦИН и аногенитальными бородавками. Изопринозин назначали по 1 г 3 раза в сутки в течение 10 дней, затем по 0,5 г 3 раза в сутки в течение 20 дней.
Для решения поднятой в этой статье проблемы интересным является факт прекращения обнаружения ВПЧ из очагов поражения в ходе проводимой комбинированной терапии с применением иммуномакса. При проведении вирусологического обследования пациентов до лечения в среднем у 70% выявлялся ВПЧ в очагах поражения. После проведенного комбинированного лечения в ходе контрольного наблюдения у 45% больных было отмечено прекращение выделения ВПЧ [Перламутров Ю.Н. и соавт., 2003]. Полученные результаты свидетельствуют, что проведение терапии иммуномаксом влияет на противовирусный иммунитет и приводит к прекращению не только рецидивов, но и выделения ВПЧ из очагов поражения. В связи с этим в перспективе иммуномакс можно будет использовать не только для лечения остроконечных кондилом, но и для предотвращения вирусовыделения у больных без клинических проявлений инфекции.
ПРОТИВОВИРУСНЫЕ ПРЕПАРАТЫ С ИММУНОМОДУЛИРУЮЩИМ ДЕЙСТВИЕМ
Панавир — растительный полисахарид, полученный из растения Solanum tuberosum, относится к классу высокомолекулярных гексозных гликозидов сложного строения с молекулярной массой 1000 кД. В настоящее время в России он является одним из самых популярных препаратов, использующихся для противовирусной терапии. Причем лечение папилломавирусной инфекции является лишь одним из показаний к его применению.
После однократной инъекции панавира в 2,7—3 раза повышается уровень лейкоцитарного интерферона, что соответствует воздействию терапевтических доз интерферона [Колобухина и соавт., 2005].
Повышение функциональной эффективности противовирусного иммунитета является основным способом, который предположительно может помочь в устранении вируса из организма или уменьшить его активность.
Со степенью распространенности неопластического процесса связывают эффективность препарата в отношении прекращения вирусовыделения [Иванян А.Н. и соавт., 2004]. Так, после проведения комплексного лечения у пациенток с 1-й степенью распространенности процесса вирус не выявлялся в 90,5%, при 2-й степени — в 71,1%, при 3-й степени — в 39,6%, при 4-й степени — в 9,4% случаев. Достоверное снижение вирусной нагрузки с 398,2 RLU до 176,2 RLU (p<0,05) через 1 месяц после окончания монотерапии панавиром ВПЧ-инфекции отмечает Мелехова Н.Ю. (2005).
Продолжаются исследования противовирусной активности панавира с целью установления мишени, объясняющей его высокую противовирусную активность, а также по расширению показаний к его применению. Но уже сейчас можно говорить о том, что он является одним из наиболее перспективных противовирусных агентов с доказанным иммуномодулирующим действием.
В этой статьей мы начали дискуссию о целесообразности попытки устранения папилломавирусной инфекции при отсутствии ее клинических проявлений. Существующие рекомендации по наблюдению таких пациентов могут не удовлетворить тех из них, которые хотели бы получить квалифицированную помощь в устранении этой инфекции. Поэтому мы предлагаем 3-х этапную тактику ведения таких больных: консультирование, цитологический контроль у женщин и использование противовирусных препаратов с иммуномодулирующим действием.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Напоминаем вам, что самостоятельная интерпретация результатов недопустима, приведенная ниже информация носит исключительно справочный характер
Определение ДНК вируса папилломы человека: показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Показание к назначению исследования
Вирусы папилломы человека (ВПЧ) - это группа генетически разнообразных ДНК-содержащих вирусов, относящихся к семейству Papillomaviridae и поражающих эпителий кожных покровов и слизистых оболочек ротовой полости и аногенитальной зоны.
Инфицирование вирусом папилломы человека клинически может проявляться остроконечными кондиломами, папилломами или злокачественной трансформацией клеток. По данным, которые приводит Всемирная организация здравоохранения, 50-80% населения инфицировано ВПЧ, а 5-10% из них имеют клинические проявления заболевания.
Наследственный материал (геном) вируса папилломы человека заключен в белковую оболочку, состоящую из больших (L1) и малых (L2) структурных белков. В зависимости от строения генома L1 были выявлены и описаны различные типы вируса папилломы человека. К настоящему времени выявлено и описано более 200 генотипов вируса папилломы человека, около 45 из них могут инфицировать эпителиальный слой урогенитального тракта.
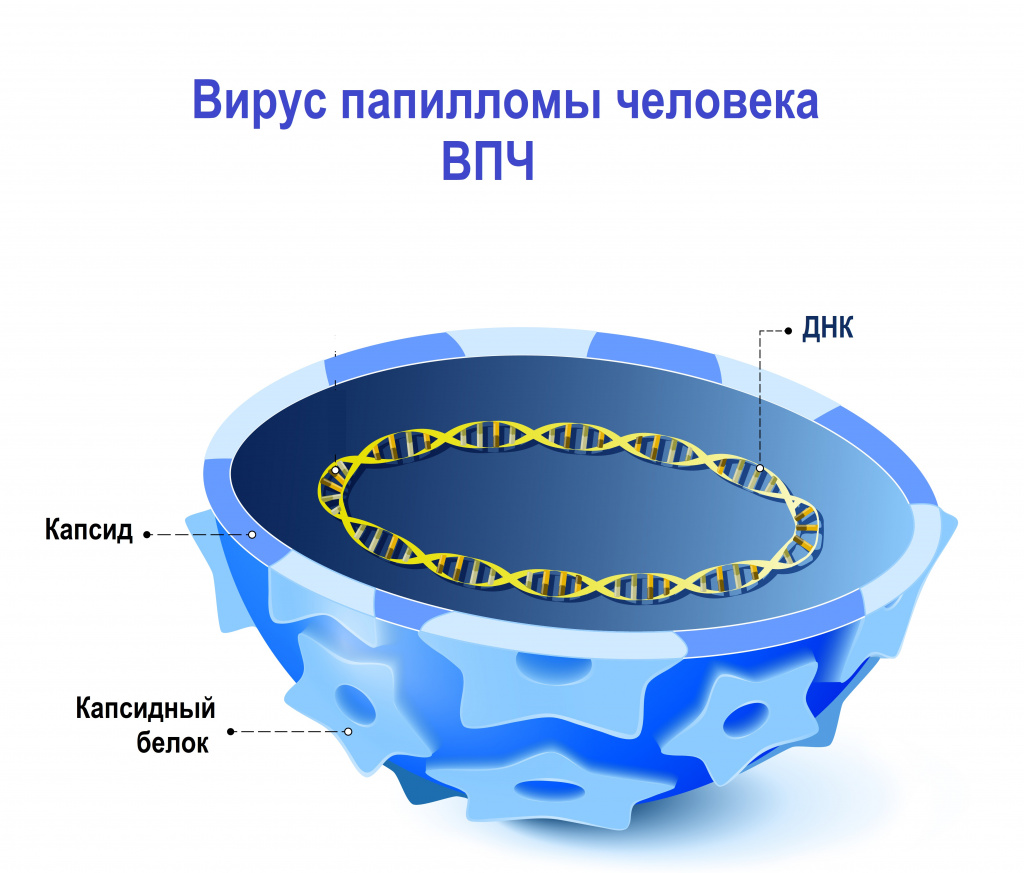
ВПЧ обладает тропностью (свойством поражать определенные органы и/или ткани) к коже и слизистым оболочкам. Источником возбудителя инфекции является больной человек или вирусоноситель.
Основной путь передачи возбудителя - половой (генитально-генитальный, мануально-генитальный, орально-генитальный), однако возможна передача и при соприкосновении (при кожном контакте). Кроме того, ВПЧ может передаваться от матери плоду во время родов.
Риск передачи при однократном половом контакте равен 80% - особенно у девушек, не достигших половой зрелости, из-за особенностей строения эпителия шейки матки в юном возрасте.
Факторы, способствующие инфицированию вирусом папилломы человека и развитию заболевания:
- раннее начало половой жизни;
- частая смена половых партнеров;
- сопутствующая урогенитальная инфекция и нарушение биоценоза влагалища;
- частые роды и аборты;
- иммунодефицитные состояния;
- генетическая предрасположенность и гормональные факторы.
Интервал между инфицированием ВПЧ и инвазивным (проникающим) раком составляет около 10 лет или более.
Инвазивному раку предшествуют предраковые поражения шейки матки, вульвы, влагалища, анального канала, полового члена различной степени тяжести.
Вирус папилломы человека не проникает в кровь, поэтому инфекционный процесс протекает без развития воспалительной реакции.
Выделяют вирусы высокого онкогенного (или канцерогенного) риска (типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59) и низкого онкогенного риска (типы 6, 11, 42, 43, 44).
Типы ВПЧ низкого канцерогенного риска связаны с развитием остроконечных кондилом, папиллом и дисплазиями легкой степени. Типы ВПЧ высокого канцерогенного риска, наряду с остроконечными кондиломами и дисплазиями, также могут вызывать злокачественную трансформацию эпителия, приводя к развитию рака.
Например, высокоонкогенные типы ВПЧ 16 и 18 вызывают в 70% случаев рак шейки матки, в 80% рак вульвы и влагалища, в 92% анальный рак, в 95% рак ротовой полости, в 89% рак ротоглотки, в 63% рак полового члена. Генотипы ВПЧ 6 и 11 обуславливают практически все виды аногенитальных бородавок и большинство случаев рецидивирующего респираторного папилломатоза.
Таким образом, дифференцированное определение ДНК вируса папилломы человека назначают в следующих случаях:
- для подтверждения ВПЧ при наличии папилломатозных разрастаний и изменений на слизистых оболочках половых органов;
- для скрининга (обследования лиц, не считающих себя больными) с целью выявления скрыто протекающего заболевания;
- для контроля эффективности проводимой терапии.
- с 21 года до 29 лет - не реже 1 раза в 3 года;
- с 30 до 69 лет - не реже 1 раза в 5 лет.
Высокая сексуальная активность предполагает проведение скрининга с18 лет.
Подготовка к процедуре
Обследование женщин целесообразно проводить в первую половину менструального цикла, но не ранее 5-го дня. Допустимо обследование во второй половине цикла, но не позднее, чем за 5 дней до предполагаемого начала менструации.
Накануне и в день обследования пациентке не рекомендуется спринцевать влагалище. Забор биоматериала не следует осуществлять ранее 24-48 часов после полового контакта, интравагинального УЗИ и кольпоскопии.
Соскоб из уретры проводят до или через 2-3 часа после мочеиспускания.
Мужчинам необходимо исключить половые контакты за 1–2 суток до взятия мазка (соскоба). Нельзя мочиться в течение 1,5-2 часов до процедуры.
Срок исполнения
До 2 рабочих дней, указанный срок не включает день взятия биоматериала.
Что может повлиять на результат
В случае несоблюдения правил подготовки полученный результат может быть некорректным.
Дифференцированное определение ДНК ВПЧ (вируса папилломы человека, Humanpapillomavirus, HPV) 21 типа (6, 11, 16, 18, 26, 31, 33, 35, 39, 44, 45, 51, 52, 53, 56, 58, 59, 66, 68, 73, 82) + КВМ
Синонимы: Анализ урогенитального соскоба на ВПЧ. HPV DNA, 21 Types, Scrape of Urogenital Epithelial Cells. Краткое описание исследования «Дифференцированное определение ДНК ВПЧ (Вирус папилломы человека, Human papillomavirus, HPV) 21 типа (6, 11, 16, 18, 26, 31, 33, 35, 39.
Исследуемый материал: соскоб эпителиальных клеток урогенитального тракта.
Форма представления результатов: количественный результат по каждому выявляемому показателю.
Единицы измерения: логарифм копий ДНК ВПЧ на 105 эпителиальных клеток (lg копий ДНК/105 эпит. клеток).
До проведения тестов по выявлению ДНК ВПЧ выполняется контроль взятия материала (КВМ). Если в пробе значение КВМ неудовлетворительное (менее 4 lg (10000) копий ДНК человека в пробе), исследование ДНК ВПЧ не проводится и рекомендуется повторное взятие биологического материала.
Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т. д.
Расшифровка показателей
Количественный формат теста позволяет выявить вирус, оценить степень риска и возможное наличие предраковых изменений при высокой вирусной нагрузке.
Интерпретация положительного результата
В анализируемом образце биологического материала обнаруженная ДНК, специфичная для вируса папилломы человека исследуемых типов в выявленной концентрации, свидетельствует о наличии возбудителя.
Если абсолютное содержание ВПЧ превышает клинически значимое, напротив обнаруженного штамма вируса указывается его концентрация. Чем выше значение, тем выше риск развития болезней, вызываемых вирусом папилломы человека.
Рост вирусной нагрузки через 3, 6 и 9 мес. после проведенного лечения свидетельствует о возможности рецидива.
- генотипы низкого онкогенного риска: 6, 11, 44;
- генотипы высокого онкогенного риска: 16, 18, 26, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 73, 82.
Выявление нескольких генотипов вируса предполагает менее благоприятный прогноз течения заболевания и более высокий риск персистенции.
При обнаружении 16 и 18 генотипов рекомендуется проводить кольпоскопическое обследование, не откладывая.
При выявлении других типов высокого риска назначают цитологическое обследование, а при его положительном результате - кольпоскопию.
Дополнительное обследование при отклонении от нормы
Врач интерпретирует результат анализа с учетом данных о пациенте и болезни, заключений осмотра, цитологического и гистологического исследований.
Гинеколог, уролог или проктолог может назначить дополнительные исследования:
-
цитологическое исследование биоматериала соскобов вульвы и влагалища, кроме шейки матки (окрашивание по Папаниколау, Рар-тест);
В цитологическом методе диагностики для окрашивания биологического материала используют несколько способов окраски. Применение определённого метода окрашивания позволяет решить специфические задачи. Каждый метод окрашивания имеет свои особенности, специфику, например, характер окрашивания ядра, ц.
Читайте также:

