Вирусная природа рака молочной железы
Обновлено: 18.04.2024
Прогноз при раке молочной железы давать сложно, потому что пациенты (победившие свою болезнь) есть не только при раннем раке, но и при запущенных формах.
Рак груди сколько
На этой странице представлены результаты самого крупного Скандинавского исследования выживаемости при разных стадиях, подтипах и формах рака молочной железы, а также данные по России, Москве и СПб - по данным канцер-регистра.
"Сколько?" - зависит от того, как правильно будет организовано Ваше обследование и лечение.
| ОБСЛЕДОВАНИЕ перед началом лечения при раке |
Продолжительность жизни рак молочной железы
Если Вас обследовали на несовременном оборудовании, неопытные специалисты по несовременным алгоритмам - стадия Вашей болезни могла быть установлена не верно. Если по факту она больше, чем по результатам такого обследования - то и последующее лечение будет организовано "не на ту опухоль".
Какие прогнозы при раке молочной железы
Данные о выживаемости на этой странице указаны для случаев, когда лечение проводилось по современным правилам.
| ОПЕРАЦИИ при раке молочной железы |
Рак молочной железы сколько
Если Ваш врач умеет выполнять только одну операцию (например, мастэктомию), то он заведомо лишает большинство своих пациенток современного лечения при раке молочной железы.
Если врачу не предоставили современных лекарств для лечения пациентов - то он их лечит "тем что есть", не информируя о таком устаревшем лечении - иначе он спровоцирует жалобы и будет уволен.
Прогнозы лечения рака молочной железы
Прогнозы лечения рака молочной железы зависят от свойств опухоли, стадии онкологического процесса и правильно организованного лечения.
Рак молочной железы выживаемость
На выживаемость при раке молочной железы оказывает влияние в большей степени агрессивность опухоли. Так, например, при неагрессивной опухоли и запущенной стадии выживаемость может быть выше, чем при более ранней стадии, но агрессивном раке.
После того, как выполнено ИГХ-исследование опухоли, полученной при биопсии или операции - можно понять - к какому из 4-х возможных подтипов она относится: Люминальный А, В, хер 2 позитивный или негативный рак молочной железы.
Считается, что эти признаки - самые точные - для определения прогноза рака молочной железы.
На данных графиках показана выживаемость (за 5, 10 и 15 лет) при разных подтипах рака груди с учётом возраста пациенток.
Красная линия - пациентки до 40 лет; синяя - старше 40 лет.
Статистика при раке молочной железы
Подтип опухоли - определяется по её ИГХ (иммуногистохимическим свойствам) - имеет главенствующее значение при прогнозе при раке молочной железы.
Прогноз при люминальном А раке
Самые "лучшие" показатели - при Люминальном А подтипе опухоли (большое значение ER+ и PR+, Her2 отрицательный или 1+, низкий Ki67 - до 15-20%): 15-летняя выживаемость при всех стадиях - около 90%.
Прогноз при Люминальном В раке
При Люминальном В подтипе рака груди (Ki67 - , больше 15-20% в отличии от Люминального А, может быть ниже чувствительность к эстрогенам и прогестинам: er+, pr+) - 15 летние показатели выживаемости "хуже" - до 80% (5-летняя и 10-летняя выживаемость - графики выше).
Her 2 отрицательный рак прогноз
Her 2 neu негативный рак может быть с экспрессией гормональных рецепторов: Люминальный А и В (er+, pr+) - прогноз при них смотрите выше. Также Her2 негативный рак может быть триждынегативный. Прогнозы при таком раке смотрите ниже.
Прогноз при Her2 позитивном раке
При Her2 позитивном раке 15 летняя выживаемость - до 70% у пациенток старше 40 лет и около 60% у заболевших до 40 лет (5-летняя и 10-летняя выживаемость - смотрите графики выше).
Трижды положительный рак
Трижды положительный рак - это Her2 позитивный рак с положительными рецепторами эстрогенов и прогестинов. Прогноз выживаемости при нём такой же, как и при Her2 положительном раке.
Прогноз при трижды негативном раке
Трижды-негативный рак ещё называют триплнегативный. При трипл-негативном раке молочной железы 15 летняя выживаемость - около 70% (5-летняя и 10-летняя выживаемость - смотрите графики выше).
Если не лечить рак молочной железы
Я ни разу не встречал пациентку, которая бы в последствии не пожалела о таком своём решении. Без лечения болезнь переходила в более запущенную стадию, появлялись отдалённые метастазы в лёгкие, печень, кости - нарушая функции этих органов (дыхательная, печёночная недостаточность, переломы костей, зловоние, мокнутие и кровотечение из распадающейся опухоли) - всё это вынуждало пациенток снова обращаться к врачам, в надежде хоть как-то облегчить их страдания.
Поэтому - я рекомендую не отказываться от лечения в любой стадии рака молочной железы , но лечиться надо - у профессионалов.
Выживаемость при раке груди
Выживаемость при раке зависит от стадии болезни: I, IIа, IIб, III стадии.
Стадия рака молочной железы прогноз

Красная линия - пациентки до 40 лет; синяя - старше 40 лет.
Рак молочной железы 1 стадии прогноз
В эту стадию попадают пациенты с T1N0M0.
Самые "лучшие результаты" у тех пациентов, у кого болезнь была выявлена на ранней стадии. Прогноз выживаемости при них смотрите на графиках выше.
Лечение можно начинать с операции, чаще всего - с органосохранной или онкопластики, с биопсией сторожевых узлов. Химиотерапия назначается только при агрессивных опухолях и выявленных метастазах в лимфатические узлы. Лучевая терапия - при органосохраняющей операции.
I или IIа - это ранние стадии рака молочной железы. При них - самые лучшие результаты лечения, потому что болезнь выявили и начали лечить до того, как появились метастазы в лимфатические узлы - стадия IIb.
Рак молочной железы 2 стадия прогноз
При 2 стадии рака абсолютно реально выполнять органосохраняющие операции с последующей лучевой терапией. Шансы на выздоровление при этом аналогичны м астэктомии.
Рак молочной железы 2а стадии прогноз
Стадия 2а включает в себя пациенток с опухолью до 2 см, но с метастазами в лимфатические узлы - T1N1M0, или от 2 до 5 см и без метастазов - T2N0M0.
Иногда (при несовременном обследовании) метастазы в лимфатические узлы могут остаться не выявленными. Стадия получается меньше, чем в действительности, а последующее лечение - не адекватным. Поэтому очень важно при 2 стадии проходить полноценное обследование.
Рак молочной железы 2б стадии прогноз
Стадия 2b подразумевает размер опухоли от 2 до 5 см и метастазы в лимфатические узлы - T2N1M0.
При стадии 2б (при обнаружении метастазов в лимфатические узлы) лечение необходимо начинать не с операции, а с неоадьювантного лечения. Дело в том, что при метастазах в лимфоузлы их стандартно удаляют, тем самым увеличивая риск отёка руки, а потом проводят химиотерапию (уже после операции). Если же при стадии 2б (из-за выявленных метастазов в лимфатические узлы) начать лечение с химиотерапии, то можно добиться исчезновения метастазов и потом сделать операцию с биопсией сторожевых узлов. Тем самым, только за счёт изменения последовательности лечения удаётся при равных шансах на выздоровление минимизировать операцию и добиться лучшего качества жизни.
Рак молочной железы 3 стадии прогноз
T3N0-1M0, T2N2M0, T4bN0-2M0
При 3 стадии рака молочной железы результаты лечения лучше, если лечение было начато с предварительного лечения, а не с операции. Такой подход позволяет более правильно подобрать схему лекарственного лечения и на ней добиться максимального регресса опухоли - это и определяет лучшие показатели выживаемости. Если же операция уже сделана - последующее лечение проводится без контроля его эффективности (не ясно, как это лечение действует на опухолевые клетки).
При 3 стадии рака молочной железы чаще выполняются мастэктомии. Одномоментная реконструкция не ухудшает результаты. Органосохраняющие операции с онкопластикой тоже возможны - при уменьшении размеров опухоли на фоне предоперационного лечения. Результаты таких операций не хуже мастэктомий.
Рак прогноз
В идеале рак молочной железы должен быть выявлен не при пальпации самим пациентом или его врачом, а "по приборам" - при профилактическом обследовании (маммография, МРТ).
Так случилось, что заболевание уже возникло. Теперь важно правильно пройти обследование и лечение.
При раке молочной железы мы рекомендуем обследоваться по данному алгоритму:
Рак молочной железы и прогноз выживаемости
Красная линия - пациентки до 40 лет; синяя - старше 40 лет.
Прогноз при G 1, 2, 3
Grade - так обозначают степень злокачественности опухоли. G1 - низкая степень злокачественности, G2 - промежуточная, а G3 - высокая.
При высокой степени злокачественности опухоли (Grade III) выживаемость хуже, чем при Grade I или G II, особенно у пациенток до 40 лет (графики выживаемости выше).
Степень злокачественности напрямую зависит от Ki 67: чем выше этот показатель - тем хуже.
Рак молочной железы возраст
В целом замечено, что у молодых пациенток рак груди течёт более агрессивно. Это связано с тем, что (чаще всего) в молодом возрасте рак молочных желёз имеет более высокий индекс пролиферации (Ki 67), и чаще бывает более агрессивный: Her 2 3+, триждынегативный. Тогда как в более зрелом возрасте - после менопаузы - чаще встречается Люминальный А рак молочной железы, прогноз при котором лучше (смотрите выше).
Рак груди возраст
На диаграмме показана выживаемость при раке молочной железы у пациенток разного возраста. Этот график указан для всех стадий рака молочной железы. Отражает лишь. общую тенденцию: у молодых болезнь течёт более агрессивно, а у пожилых - более благоприятно.

Никто из врачей не знает где на этих графиках окажетесь именно Вы.
Прогноз после операции по поводу рака груди
Точный пограничный возраст не должен определять минимальный или максимальный риск; женщина пограничного возраста с низким уровнем рецепторов эстрогенов должна быть отнесена в соответствующую группу риска с учетом других индивидуальных прогностических признаков.
Сколько живут с раком молочной железы
Ни один врач точно не знает как поведёт себя болезнь именно у Вас :
- Успела ли опухоль (до операции) прорасти в свои кровеносные или лимфатические сосуды, "оторваться и улететь" с током лимфы или крови в другие органы (дать метастазы)
- Будут ли эффективны назначенные Вам препараты и/или лучевая терапия, или опухоль адаптируется к лечению и станет невосприимчива
- Хватит ли у Вас внутренних резервов перенести лечение
- Владеет ли Ваш врач необходимым ресурсом знаний и опыта для Вашего современного лечения
- Сможет ли Ваш врач предоставить Вам современное лечение (лекарства, препараты поддержки, расходные материалы для операции и хирургические техники)
Рак груди шансы
Размер опухоли (Т)
Состояние регионарных узлов (N)
N+ (1 – 3 лимфоузлов)
Инвазия кровеносных сосудов
Эстрогеновые, прогестиновые рецепторы
Присутствуют все факторы
Присутствие хотя бы одной пары факторов с No
Присутствие хотя бы одной пары с N, либо N + (4 и более лимфоузлов)
Рак молочной железы выздоровление
Мы все объединены одной целью: несмотря на Ваш возраст, Вашу стадию болезни, подтип и степень злокачественности Вашей опухоли сделать так, чтобы потом не упрекать себя в недостаточности мер по борьбе с болезнью.
Сохранять грудь или нет
NB! Ещё в 1980 году было завершено исследование Milan I, которое продемонстрировало, что частота местных рецидивов и выживаемость у пациенток с раком молочной железы в группах кому сделали мастэктомию и кому сохранили грудь и провели лучевую терапию - одинакова!
Врачам в Швеции потребовалось 15 лет, чтобы это осознать и начать использовать в своей работе: с 1995 года у них число органосохранных операций превысило число мастэктомий.
Нашей команде в 2013 году в отдельно взятом стационаре удалось впервые сделать больше органосохраняющих операций чем мастэктомий - за счёт внедрения зарубежных хирургических техник в нашу повседневную работу.
| СМОТРИТЕ ПОДРОБНЕЕ о нашей работе |
Рак молочной железы и имплант
Восстановление молочной железы одновременно с мастэктомией не увеличивает риски при раке. Операция выполняется абсолютно одинаково. Просто при ней либо ставят имплант (экспандер), либо нет.
Технически восстановить грудь одномоментно с мастэктомией проще, и эстетичность такой операции выше. Да, осложнения бывают, но их процент низкий - до 8, а меры профилактики и лечения этих осложнений достаточно хорошо отработаны.
Выживаемость при раке молочной железы в России

На этом графике мы видим, что в России, СПб и Москве 5-летняя выживаемость при раке молочной железы находится в пределах 60-64%. Если сравнить его с данными Скандинавского исследования (представленных выше), то можно заметить, что такой уровень выживаемости "у них" соответствует в основном при 3 стадии рака.
Это означает, что:
- либо у нас рак диагностируется на поздних стадиях (из-за отсутствия финансирования действующих программ профилактических обследований и раннего выявления),
- либо пациентов перед лечением неполноценно обследуют и изначально стадия не соответствует истине (из-за того, что по ОМС это невозможно сделать на надлежащем уровне),
- либо проводимое лечение не соответствует современным стандартам (опять же, из-за недофинансирования).
Рак молочной железы 4
4 стадия рака молочной железы подразумевает наличие отдалённых метастазов - когда удалить всю опухоль и её отсевы технически не возможно. В такой ситуации длительность жизни пациента зависит от того, на сколько успешно удасться добиться сосуществования человека со своей опухолью. Для этого могут применяться различные способы воздействия на опухоль: системное лечение (химиотерапия, гормонотерапия, таргетное лечение), лучевая терапия и операция.

На данном графике показан результат 5-летней выживаемости 12.838 пациентов с 4 стадией рака молочной железы, в зависимости от того лечения, которое они получали (но без учёта данных об иммуногистохимическом подтипе опухоли):
---- Системное лечение и лучевая терапия - 5-летняя выживаемость до 20%
---- Только системное лечение - 5-летняя выживаемость больше 20%
---- Системная терапия и операция - 5 летняя выживаемость - больше 35%
---- Системное лечение, операция и лучевая терапия - 5-летняя выживаемость почти 40%
При 4 стадии рака невозможно достичь полного излечения, но в ряде случаев можно достичь ремиссии - когда болезнь есть, но она никак не мешает жизни человека, и он живёт со своей болезнью достаточно долго.
Это абсолютно реально и при 4 стадии заболевания! Важно получать правильное лечение.
4 стадия рака груди
Прогноз при раке груди 4 стадии зависит и от подтипа опухоли.

На данном графике показана 5-летняя выживаемость в группе из 910 пациентов с Her2-позитивной опухолью при 4 стадии рака груди:
---- Системное лечение и лучевая терапия - 5-летняя выживаемость около 20%
---- Только системное лечение - 5-летняя выживаемость около 30%
---- Системная терапия и операция - 5-летняя выживаемость около 40%
---- Системное лечение, операция и лучевая терапия - 5 летняя выживаемость около 50%
Результаты приведённого исследования демонстрируют, что удаление опухоли в дополнение к системной и лучевой терапии, даже в 4 стадии болезни при гормоножпозитивной и Her2-позитивной опухоли, увеличивает 5-летнюю выживаемость пациентов до 50%!
Рак молочной железы излечение
При обращении к нам - вы можете быть уверены, что мы сделаем всё так, как предписывают современные требования: Ваше обследование, лечение и последующее наблюдение - чтобы добиться Вашего излечения от рака молочной железы.
Мы все прошли стажировки у Европейских и Американских специалистов, изначально организовывали свою работу так, чтобы стать конкурентами зарубежных клиник, чтобы наши соотечественники могли в своей стране получить качественную помощь при этом заболевании.
Рак молочной железы шансы
Да! Предстоит лечение!
Вам нужно выбрать себе врача, который сможет ответственно заниматься вашим лечением, применяя современные знания и методики, чтобы Ваши шансы на выздоровление были не хуже, чем на других графиках этой страницы.
Специалисты Университетского Маммологического Центра регулярно повышают свой профессиональный уровень, посещают отечественные и зарубежные конференции, чтобы быть в курсе всех современных тенденций в онкологии и пластической хирургии.
Рак молочной железы сроки
Сохранение груди
С ОНКОПЛАСТИКОЙ
Рак соска или
РАК ПЕДЖЕТА
Рак молочной железы опасно
Автор: Чиж Игорь Александрович
заведующий, кмн, онколог высшей квалификационной категории,
хирург высшей квалификационной категории, пластический хирург
Протоковый рак молочной железы — самая частая клеточная форма, на его долю приходится семь из десяти злокачественных новообразований в груди. Ежегодно протоковую карциному обнаруживают примерно у 40 тысяч россиянок разного возраста.
Одинаковая по клеточной структуре карцинома не обещает однотипного развития заболевания, потому что может относится к любому из четырёх молекулярно-биологических вариаций, различаться злокачественным потенциалом и чувствительностью к лечебному воздействию.
Общая информация о заболевании
Протоковой карциноме не присущ какой-то один молекулярный тип, она может быть и люминальной — гормонозависимой, и трижды негативной и базальноподобной — любой. В сравнении с другими более редкими морфологическими вариантами, это довольно агрессивный рак молочной железы, но при высокой степени дифференцировки небольшая на момент обнаружения опухоль течет вполне благоприятно и может никогда не откликнуться метастазами.
В каждом клиническом случае протоковый рак молочной железы абсолютно оригинален, но подходы к его лечению стандартизованы и унифицированы до оптимума.

Классификация
Протоковый рак in situ или DCIS начинается с одной или группы злокачественно мутировавших клеток, которые растут в верхних слоях эпителия, не пробивая его базальную мембрану и не внедряясь в глубокие слои. Тем не менее, опухоль может достигать нескольких сантиметров, склонна к развитию локальных рецидивов в зоне операции, в редких случаях даёт метастазы в подмышечные узлы и может привести к смерти от генерализации рака, но в 98% полностью излечивается.
Протоковую неинвазивную карциному разделяют на три типа: чуть более благоприятный по течению некомедо DCIS, несколько более агрессивный комедо DCIS и пограничный. Классификация протокового рака in situ по степени агрессивности — от низкой, через промежуточную до высокой степени злокачественности позволяет рассчитать прогноз и подобрать адекватное лечение.
Излечение протокового рака молочной железы in situ возможно только при использовании хирургии, причём не всегда целесообразна частичная резекция, даже при мизерном протоковом раке клинической необходимостью может стать мастэктомия с последующей профилактической гормонотерапией.
Главная проблема DCIS — высокая частота рецидива после операции, что обусловлено несоответствием размера пальпируемой в железе опухоли реальному раковому поражению тканей, которое максимально точно определяется при рентгенологическом исследовании, а ещё лучше — при МРТ.

Инвазивный протоковый рак имеет все характеристики злокачественного процесса: агрессивность в отношении окружающих тканей, склонность к распространению метастазов и неуклонное стремление к безудержному росту. Инвазивный процесс может быть любой степени злокачественности, с различным набором и концентрацией гормональных рецепторов, индекса пролиферации Ki-67 и гена множественной лекарственной устойчивости HER2.
Стадирование протокового рака стандартно и зависит от размера опухоли в молочной железе, вовлеченности лимфатических лимфоузлов и отдаленного метастазирования.
Факторы риска и причины развития
Причины развития протокового рака молочной железы неизвестны, факторы риска типичны для всех морфологических видов:
- несогласованность гормональной продукции при хронических заболеваниях и аномалиях половой сферы;
- слишком раннее половое созревание, равно как и задержка с завершением менструаций;
- аборты и поздние роды без достаточного по времени грудного вскармливания;
- сахарный диабет, ожирение;
- нездоровый образ жизни с гиподинамией, пристрастием к табаку и алкоголю.
При сочетании нескольких факторов на протяжении десятилетий ко второй половине жизни пятикратно увеличивается риск рака молочной железы.
Болеют ли мужчины протоковым раком груди?
Конечно не все факторы риска рака присутствуют у мужчин, но поведенческие тоже работают во вред. Избыточный вес отражается на продукции тестостерона, что ведет к гиперплазии желез — гинекомастии. Так что неумеренные в еде представители молодых поколений, особенно курящие и выпивающие, со временем могут увеличить популяцию заболевших раком, где точно будет превалировать доля протоковой карциномы.
Симптомы и диагностика
Симптомы протокового рака неотличимы от злокачественного процесса другой морфологической структуры:
- опухолевый узел или инфильтрация молочной железы,
- локальное и специфическое изменение кожи железы,
- увеличение подмышечных лимфоузлов.
- УЗИ при плотной структуре железы, маммография, МРТ для уточнения размеров и в сомнительных случаях.
- Обязательна тонкоигольная биопсия опухоли с ИГХ-исследованием на гормональные рецепторы, ген HER2 и Ki-67.
- При подозрении на отдаленные метастазы проводится дополнительное обследование.

Лечение протокового рака груди
Все протоковые карциномы можно разделить на три группы:
- Операбельные, которым соответствует всё от DCIS до 3 А стадии;
- Сомнительно операбельные — 3 стадия с выходом за границы груди и вколоченными лимфоузлами,
- Неоперабельные — 4 стадия и метастатическая генерализация.
Излечение без хирургии исключается. Хирургическое вмешательство предпочтительно на первом этапе, но может откладываться до завершения курса неоадъювантной химиотерапии. Возможна частичная резекция, во всех случаях дополняемая лучевой терапией, и мастэктомия. Выбор операции зависит от размеров и характера поражения молочной железы и предпочтений пациентки. По результатам выживаемости два оперативных подхода идентичны, но после резекции выше процент рецидивов в рубце. Мастэктомия может быть классической, то есть без реконструкции, современные варианты предполагают одномоментное или отсроченное восстановление молочной железы.
Радиотерапия дополняет операцию или заменяет ее при сомнительной операбельности. Необходима при множественном поражении подмышечных лимфоузлов и неблагоприятных признаках по гистологии: низкая дифференцировка, раковые клетки в сосудистых щелях или около нервных окончаний, высокий индекс пролиферации и обладание геном HER2. После операции облучение возможно только по завершении курса профилактической химиотерапии.
Лекарственная терапия назначается в соответствии с молекулярно-биологическим типом карциномы. Так при люминальном А варианте предпочтительна гормональная терапия, а химиотерапия используется только при наличии факторов неблагоприятного прогноза. Ни одна из схем профилактической химиотерапии не имеет преимуществ по эффективности, поэтому при подборе комбинации цитостатиков ориентировка на ожидаемую токсичность и состояние здоровья женщины. Число циклов химиотерапии зависит от биологического типа и выбранной схемы, лечение начинается при нормализации состояния после операции.
Наличие в клетках рака гена множественной лекарственной резистентности требует регулярных введений таргетного трастузумаба на протяжении года.
Гормональная терапия, а точнее антигормональная, применяется при наличии в опухоли рецепторов эстрогенов. Длительность профилактики от 7 до 10 лет, у менструирующих применяются таблетки тамоксифена или ингибитора ароматазы при подавлении функции яичников. После менопаузы предпочтение отдано ингибитору ароматазы.
Лечение 4 стадии только лекарственное — химиотерапия с антигормонами с учетом молекулярного типа, аналогично проводится лечение генерализации после радикальной операции. Для повышения результативности химиотерапии каждые 3 недели используется таргетная терапия.

Профилактика
Пятилетний прием тамоксифена после удаления протокового рака in situ допускается только при позитивном статусе по рецепторам эстрогена. Антигормон не повышает выживаемости, но снижает частоту рецидивирования при резекции молочной железы и вероятность развития инвазивной карциномы в других участках железы.
Прогноз
Прогноз определяется индивидуальными характеристиками рака на момент его обнаружения: размер опухоли в молочной железы, вовлечение лимфатической системы, клеточные факторы — рецепторный статус и ген устойчивости, а также степень злокачественности.
Естественно, что на дальнейшем течении заболевания отражается выбор лекарственного лечения, который сегодня базируется не только на молекулярно-биологическом типе, но и на персональных генетических характеристиках опухоли.
Список литературы:
4. Romondi E.H., Perez E.Z., Bryant J., et al. /Trastuzumab plus adjuvant chemotherapy for operable HER2 positive breast cancer// N Engl J Med; 2005; 353.
5. Sobin L.H., Gospodarowicz M.K., Wittekind Ch., et al./ International Union Against Cancer (UICC). TNM Classification of Malignant Tumours, 7th ed.// New York: Wiley-Blackwell; 2009.
6. Virnig B.A., Tuttle T.M., Shamliyan T., Kane R.L. /Ductal carcinoma in situ of the breast: a systematic review of incidence, treatment, and outcomes// J Natl Cancer Inst.; 2010 Feb 3; 102 (3).
Рак — это злокачественная опухоль, при которой происходит бесконтрольное размножение клеток, сопровождающееся инвазией в подлежащие ткани и метастазированием в отдаленные органы с током лимфы и/или крови. В народе раком называют любую злокачественную опухоль, но ученые сюда относят только карциномы — опухоли, произрастающие из эпителиальных тканей. Злокачественные новообразования из других тканей называют саркомами, злокачественные новообразования лимфатической системы называют лимфомами, а кроветворной — лейкозами.
Зачастую онкология воспринимается пациентами, как смертный приговор. Однако в реальности далеко не все злокачественные опухоли приводят к гибели человека. Более половины всех пациентов благополучно излечиваются и люди забывают о перенесенном заболевании навсегда.
Несмотря на значительные успехи в лечении онкологии, все же данная патология характеризуется достаточно высоким уровнем летальности и, безусловно, для успешного лечения требует к себе самого пристального внимания со стороны высококвалифицированных докторов.
Механизм возникновения рака
В основе онкологического заболевания лежит нарушение процессов регуляции тканевого роста.
Клетки нашего организма постоянно обновляются. В процессе их деления всегда существует вероятность возникновения ошибок в генах (мутации). Это происходит и в норме, но их частота значительно возрастает при воздействии на организм таких неблагоприятных факторов, как канцерогенные вещества, ионизирующее излучение и др.

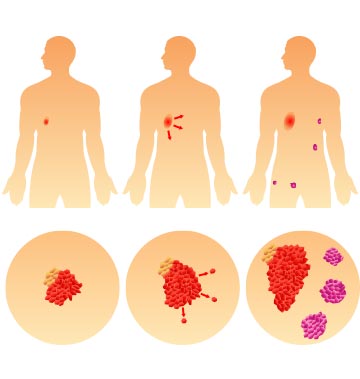
Злокачественные опухоли характеризуются тремя ключевыми отличиями от доброкачественных:
- Неконтролируемый бесконечный рост.
- Прорастание (инвазия) в соседние ткани и органы с нарушением их функционирования.
- Способность к метастазированию — процессу миграции раковых клеток с током крови или лимфы в другие части тела
Именно данные характеристики определяют агрессивность процесса и его злокачественность.
Опухоль может состоять из плотной ткани и тогда говорят о солидном образовании. Однако она может иметь и жидкую консистенцию, как при лейкозах и лимфомах.
Трудности в лечении рака
Онкологическое заболевание может возникнуть у любого живого организма в любом возрасте. Однако данный риск увеличивается с возрастом. Считается, что более 64% случаев заболевания выявляются у людей старше 65 лет. Тем не менее, в настоящее время онкологи говорят об омоложении таких пациентов. Все чаще болезнь диагностируется в возрасте до 40 лет.
Существуют две основные проблемы в лечении данной патологии:
- Распространенность опухолевого процесса, что ограничивает возможности радикального хирургического лечения.
- Гетерогенность клеточного состава опухоли. Можно подобрать препараты, которые убьют 99% опухолевых клеток, но если хотя бы несколько из них уцелеют, то они снова будут делиться, и разовьется рецидив
заболевания.

Причины появления рака
Причины онкологических заболеваний очень разнообразны, но все они приводят
к тому, что в клетках организма возникает мутация, которая приводит к их
бесконтрольному размножению. Спровоцировать образование и размножение
таких клеток могут следующие факторы:
Неправильное питание
Оно является одной из главных причин возникновения рака. И здесь есть несколько аспектов. Во-первых, во многих продуктах, которые люди употребляют ежедневно, содержится определенное количество пищевых канцерогенов. К таким продуктам относят копчености, маринады и другие консервированные и жареные блюда, овощи и фрукты, выращенные с применением химических удобрений и пестицидов и др. Во-вторых, имеет значение сбалансированность питания. Например, есть данные, что избыток мяса в рационе приводит к увеличению риска развития колоректального рака, в то же время большое количество растительных волокон и клетчатки снижает эти риски. Несбалансированное питание может привести к развитию ожирения, которое является фактором риска таких злокачественных новообразований как рак поджелудочной железы.
Старение
В подавляющем большинстве случаев злокачественные опухоли возникают у людей старше 50 лет. Это связывают с накоплением действия факторов риска и ослаблением механизмов защиты и уничтожения мутировавших клеток.
Наследственность
Когда говорят о наследственных причинах онкологии, имеют ввиду два аспекта — генетическую предрасположенность и наследственные формы злокачественных новообразований. В целом вероятность заболеть той или иной формой рака в течение жизни составляет 5-10%. Однако при наличии в семье случаев злокачественных новообразований, эта вероятность увеличивается более, чем в два раза. Это называется генетической предрасположенностью. Помимо этого, есть наследственные формы рака, при которых имеются мутации в определенных генах. В качестве примера можно привести мутации в генах BRCA, при наличии которых вероятность развития рака молочной железы или яичников составляет около 80%.
Вирусы
Вирус папилломы человека высокого онкогенного риска вызывает рак шейки матки. Вирусы гепатитов В и С увеличивают вероятность возникновения рака печени. Инфицирование вирусом Эпштейна-Барр может привести к развитию лимфомы, а Т-лимфотропный вирус может вызвать развитие лейкоза.
Вредные привычки и химическая зависимость
Курение, злоупотребление алкоголем и наркомания также являются серьезными причинами развития рака. Например, каждый пятый случай развития злокачественного новообразования связывают именно с курением. Причем речь идет не только о раке легких. Табачный дым увеличивает риск развития рака ЛОР-органов и органов пищеварительной системы, то же касается и алкоголя. Наркомания приводит к серьезным нарушениям обмена веществ и работы всех систем организма, в том числе и иммунной. На этом фоне развиваются неоплазии, характерные для иммунодефицитов — лимфомы, лейкозы, саркомы.
Ионизирующее излучение
Когда говорят об ионизирующем излучении как о причине развития онкологии на постсоветском пространстве, большинство людей имеет ввиду катастрофу на ЧАЭС. И с этим сложно спорить, поскольку после взрыва отмечалось увеличение случаев развития злокачественных неоплазий, в том числе лейкозов, лимфом и рака щитовидной железы. Однако, помимо этого, нельзя забывать об опасности воздействия солнечного излучения, которое может неблагоприятно воздействовать на кожу и органы зрения. Также увеличивает риск развития вторичных раковых опухолей прохождение лучевой терапии.
Предраковые заболевания
Некоторые виды рака развиваются на фоне имеющейся патологии. Например, колоректальный рак в большинстве случае происходит из аденоматозных кишечных полипов, рак эндометрия может происходить на фоне миом или эндометриоза, раку кожи могут предшествовать пигментный кератоз, лейкоплакия или кожный рог, раку легкого — некоторые профессиональные заболевания легких, раку шейки матки — воспалительные и диспластические процессы. Поэтому важно регулярно проходить скрининговое обследование для своевременного выявления предраковых заболеваний и их лечения.
Неблагоприятная экологическая обстановка и воздействие промышленных и химических канцерогенов
Наиболее агрессивные канцерогены — это асбест, сажа, выхлопные газы автомобилей, некоторые виды продуктов переработки нефти.

Обзор
Автор
Редактор
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Исследования в области происхождения злокачественных опухолей, ежегодно уносящих миллионы человеческих жизней, ведутся с XIX века. Работая в области молекулярной вирусологии, Вармус совместно с Дж. М. Бишопом в исследованиях 1970-х гг. сделали открытие, которое по-новому осветило долго остававшуюся дискуссионной проблему этиологии опухолей у человека и животных. Согласно полученным результатам, неконтролируемый рост клеток, образующих опухоль, вызывается не только проникающим в клетку извне онковирусом, но и внутренними процессами в самой клетке. Вармус доказал, что нормальные гены роста клетки вследствие случайных спонтанных мутаций под воздействием химических канцерогенов или, порой, процесса старения могут изменять свою молекулярную структуру и таким образом превращаться в протовирусы онкогенной природы. За открытие клеточного происхождения онкогенных протовирусов Вармус совместно с Дж. М. Бишопом в 1989 г. были удостоены Нобелевской премии по физиологии и медицине [1].
Один из самых распространённых вирусов в человеческой популяции — вирус Эпштейна-Барр (рис. 1) — был открыт и описан в 1964 году двумя английскими вирусологами: Майклом Эпштейном и Ивонной Барр. Вирус Эпштейна-Барр (ВЭБ) — член семейства герпесвирусов [6, 7]. В инфицированных клетках вирусная ДНК, как правило, не встроена в клеточный геном, а находится в ядре в виде замкнутого кольца (эписомы). Биологическое значение интеграции ВЭБ в геном клетки остается неясным. Высказываются предположения, что эписомная ДНК необходима для реализации полноценной репликации ВЭБ, завершающейся формированием вирусных частиц [8].

В отличие от многих других герпесвирусов, вирус Эпштейна-Барр поражает в первую очередь эпителиальные клетки ротовой полости, глотки, миндалин. Здесь он размножается наиболее активно, и поэтому главным путём заражения вирусом являются поцелуи (вот и приехали). Наибольшее количество вирусных частиц находится в клетках эпителия около слюнных желез, и со слюной выделяется большое количество их. Не удивительно, что инфекционный мононуклеоз — самое распространённое заболевание, вызываемое вирусом Эпштейна-Барр, — называют ещё болезнью поцелуев [9].
После первой встречи человека с ВЭБ вирус в незначительном количестве сохраняется в организме хозяина в течение всей жизни. Однако если любой элемент иммунного ответа нарушен, даже незначительное количество ВЭБ-инфицированных клеток может преумножиться колоссально [12].
Инфицированные В-клетки могут значительное время находиться в миндалинах, что позволяет вирусу выделяться во внешнюю среду со слюной. С зараженными клетками ВЭБ распространяется по другим органам. В пораженных вирусом клетках возможно два вида развития: литический, приводящий к разрушению клетки-хозяина, и латентный (клетка заражена, но ничего не выдает нахождения вируса), когда число вирусных копий небольшое и клетка не разрушается. ВЭБ может длительно находиться в В-лимфоцитах, эпителии носоглотки и слюнных железах. Кроме того, он способен проникать и в другие клетки: Т-лимфоциты, NK-клетки, макрофаги, нейтрофилы, эпителиоциты сосудов (рис. 2а, 2б) [13].

Злокачественные лимфомы (например, увеличение лимфоузлов), согласно данным Международного агентства по изучению рака, составляют 3–4% среди всех регистрируемых в мире злокачественных новообразований [14]. Лимфомы делят на две основные группы: лимфома Ходжкина (20–30 % всех лимфом) и неходжкинские лимфомы (около 70%) [14, 15].
Неходжикинские лимфомы — это совокупность новообразований, в возникновении которых принимают участие различные агенты [18]. Первая группа — это вирусы, трансформирующие лимфоциты и другие клетки (ВЭБ, HHV-8). Вторая группа представлена факторами различной природы, вызывающими иммунодефицитные состояния. К таким факторам в первую очередь относится ВИЧ (вирус иммунодефицита человека), вызывающий у инфицированного лица подавление иммунитета в результате истощения пула Т-лимфоцитов CD4+ и возникновение СПИДа. В третью группу входят некоторые инфекции, (например, H. pylori), которые увеличивают риск возникновения лимфом на фоне вызываемой ими хронической стимуляции иммунной системы и постоянной активации лимфоцитов [17].
Исследования последних лет свидетельствуют о том, что в патогенезе ВЭБ-ассоциированных патологий чрезвычайно важную роль играет вредный LMP1 — латентный мембранный белок 1, кодируемый одноименным геном (LMP1). Он обладает свойствами онкобелка и функционирует как постоянно активный псевдорецептор. Он способен изменять В-лимфоциты человека [19].
Есть предположение, что аминокислотные замены, накапливающиеся в LMP1, по-видимому, также вносят свой вклад в возникновение опухолей. Механизм этого процесса окончательно не установлен, но предполагается, что усиленный трансформирующий эффект мутированных LMP1 может представлять важную составляющую этого процесса. При этом показано, что различия в последовательности гена LMP1 могут определять агрессивный географически локализованный генотип ВЭБ [21].
Из известных механизмов действия LMP-2 (второй из братьев семейства LMP), расположенного на противоположном конце линейного генома, упоминается лишь способность этих белков совместно повышать сигнальную трансдукцию в ВЭБ (+) клетках [19].
По данным Харальда цур Хаузена, связь между вирусом и раковым заболеванием считается установленной при определении следующих критериев:
- эпидемиологические доказательства того, что вирусная инфекция является фактором риска для развития специфической опухоли;
- присутствие и сохранение генома вируса в клетках опухоли;
- стимуляция пролиферации клеток после введения генома (или его части) вируса в ткани культуры клеток;
- демонстрация того, что геном возбудителя индуцирует пролиферацию и злокачественный фенотип опухоли [19].
Однако канцерогенность ВЭБ далеко не однозначна. Несмотря на то, что кодируемые вирусом продукты способны вызывать пролиферацию инфицированных клеток, ведущую к возникновению лимфом у больных с иммунодефицитом, эти клинически агрессивные опухоли довольно часто поликлональны и подвергаются регрессии при восстановлении иммунного ответа на ВЭБ. Такие опухоли как лимфома Беркитта (ЛБ) и лимфома Ходжкина (ЛХ) встречаются не только в ВЭБ-ассоциированных, но и в ВЭБ-неассоциированных вариантах, что говорит о том, что патогенез этих новообразований связан не только с ВЭБ. Кроме того, злокачественные клетки больных ЛБ и ЛХ отличаются фенотипически от клеток ЛКЛ, полученных под воздействием ВЭБ in vitro, и не экспрессируют ряд белков, необходимых для трансформирующего роста. Эти находки позволяют предположить, что опухолевые клетки могут возникать и под воздействием факторов невирусного происхождения, а также зависеть от различных усиливающих рост клеток стимулов [17].
Лабораторная диагностика ВЭБ-инфекции базируется на цитологическом исследовании крови или костного мозга, серологических исследованиях и ПЦР. С помощью метода ПЦР можно определить ДНК вируса в плазме до клинических проявлений болезни, а репликация вируса в организме является показанием к противовирусной терапии и критерием эффективности проведенного лечения. Материалом для исследования служат слюна или рото- и носоглоточная слизь, соскоб эпителиальных клеток урогенитального тракта, кровь, спинномозговая жидкость, ткани опухоли и костный мозг. Как у больных ВЭБ, так и у носителей может быть получен положительный результат в ПЦР. Поэтому для их дифференцировки проводится количественный ПЦР-анализ для определения количества копий вирусного генома. У маленьких детей (до 1–3-х лет) по причине недостаточно сформированного иммунитета диагностика по антителам затруднительна, поэтому в данной группе пациентов в помощь приходит именно ПЦР. Однако в силу того, что ПЦР-анализ информативен только при размножении (репликации) вируса, то существует и определенный процент ложноотрицательных результатов (до 30%), связанный именно с отсутствием репликации в момент исследования. При этом важно сопоставление результатов клинических, серологических и молекулярных обследований в определении ВЭБ-инфекции, как причины имеющегося заболевания [1].
Специфическая профилактика (вакцинация) против ВЭБ не разработана, но проводятся клинические испытания. Основной проблемой при разработке вакцины является большое отличие в белковом составе вируса на разных фазах его существования. Впрочем, в настоящее время разрабатывается вакцина, которая содержит рекомбинантный поверхностный антиген gp350. После вакцинации первичная инфекция протекает субклинически, но собственно инфицирование человека не предупреждается. Кроме того, вырабатывающиеся нейтрализующие антитела не влияют на течение различных форм латентной инфекции, в том числе опухолей. Профилактические меры сводятся к укреплению иммунитета, закаливанию детей, мерам предосторожности при появлении больного в окружении, соблюдение правил личной гигиены.
Заключение
Широкое распространение ВЭБ с выраженным трансформирующим потенциалом среди населения планеты и редкого возникновения в инфицированной популяции связанных с этим вирусом опухолей с преимущественной их локализацией в определенных географических регионах позволяет сделать важный вывод. Подобно большинству опухолей иной вирусной природы, в патогенезе ВЭБ-ассоциированных новообразований важную роль играют дополнительные факторы, и одного ВЭБ недостаточно для возникновения опухоли. ВЭБ лишь инициирует пролиферацию инфицированных им клеток, а последующие события влияют на гистопатологический спектр возникающих неоплазий. Одним из важнейших факторов, в значительной степени определяющих возникновение ВЭБ-ассоциированных опухолей, служит выраженная иммуносупрессия (врожденная, ятрогенная или индуцированная любой вирусной инфекцией, и в первую очередь ВИЧ), приводящая к утрате функции иммунного распознавания клеток, инфицированных ВЭБ.
Таким образом, несмотря на многолетнее изучение связи ВЭБ с опухолями человека, вопрос о роли вируса в их возникновении до конца не изучен. Раскрытие механизма злокачественной трансформации вирусом, персистирующим в латентном состоянии более чем у 90% населения планеты, — задача чрезвычайно сложная. Однако технические достижения последних лет, существенно повысившие специфичность исследований, позволяют надеяться, что детали ВЭБ-ассоциированного канцерогенеза будут выяснены.

Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.
Читайте также:

