Вирусные инфекции и недоношенных детей
Обновлено: 23.04.2024
В отделение патологии недоношенных и новорождённых детей больницы скорой медицинской помощи города Краснодар 12 марта 2018 года из отделения реанимации и интенсивной терапии была переведена девочка на пятые сутки жизни.
Жалобы
Проведение антибактериальной, дегидратационной терапии не влияли на изменение неврологического статуса ребёнка.
Анамнез
В родильном отделении больницы скорой медицинской помощи города Краснодара 7 марта 2018 года родилась девочка на 35 неделе гестации с весом 2100 грамм, 5-6 баллов по Апгар, дыхательная недостаточность II степени по шкале Сильвермана. После рождения ребёнок был переведён в отделение реанимации, проводилась аппаратная поддержка дыхания, коррекция метаболических нарушений, проводилась антибактериальная терапия по поводу врождённой пневмонии.
Мать ребенка 28 лет, роды вторые (I беременность в 2014 году — мальчик, весом 3100 грамм, здоров; II беременность в 2016 году — медицинский аборт; III беременность — настоящая). В анамнезе матери не отмечалось соматической патологии. Беременность в первой половине протекала на фоне токсикоза. Во второй половине — острая респираторная вирусная инфекция на 28 неделе. Роды экстренные, безводный промежуток 10 часов. В анамнезе матери отмечались герпетические высыпания на лице. В области гениталий герпетических высыпаний не отмечалось.
Обследование
Ребёнок находился в позе полуфлексии. На осмотр открывал глаза. Рефлексы орального автоматизма снижены. Отмечалось угнетение спинальных автоматизмов и надсегментарных миелоэнцефальных рефлексов. При проведении осмотра отмечалось диффузное снижение мышечного тонуса в конечностях, мраморность кожных покровов. На момент осмотра судорог не отмечалось. Также регистрировалась лабильность пульса и артериального давления.
В общем анализе крови отмечалось увеличение уровня лейкоцитов. При проведении лабиальной пункции на шестые сутки отмечалось увеличение лейкоцитов до 100*106, смешанный плеоцитоз. Анализ ПЦР крови и ликвора на шестые сутки жизни на герпесвирусные инфекции был отрицательный. Лишь через десять дней (на шестнадцатые сутки жизни) плеоцитоз приобрёл лимфоцитарный характер, пришли положительные результаты ПЦР крови и ликвора на вирус простого герпеса I типа. При проведении нейросонографии регистрировалось повышение эхогенности перивентрикулярных областей.
Диагноз
Лечение
На шестые сутки жизни, после получения общего анализа ликвора, ребёнку были назначены антибиотики в менингитных дозировках и ацикловир (после консультации с инфекционистом и клиническим фармакологом). На шестнадцатые сутки жизни была откорректирована противовирусная терапия с учётом данных ПЦР.
Через три недели после рождения ребёнок начал самостоятельно сосать, мышечный тонус нормализовался, физиологические рефлексы вызывались, но быстро истощались. При осмотре ребёнок открывал глаза, проявлял двигательную активность. Пациентка находилась в позе флексии. Сохранялись редкие срыгивания после еды.
После выписки из отделения выхаживания было рекомендовано наблюдение за ребёнком у невролога на первом году жизни. Какого-либо медикаментозного лечения ребёнку не требовалось.
Заключение
Данный клинический случай подтверждает известные затруднения в дифференциальной диагностики этиологии неонатальных менингитов и энцефалитов. Своевременно начатое лечение позволяет избежать тяжёлых последствий инфекционного поражения нервной системы. Также заражение герпес-вирусной инфекцией возможно интранатально без явной клинической картины герпес-вирусной инфекции у матери.
Все органы человека заселены тысячами бактерий и грибов, выполняющих жизненно важные функции в нашем организме, до конца еще не изученные. Мы постоянно взаимодействуем с окружающей средой, а значит с вирусами, бактериями, грибами, и даже не замечаем этого. Но порой взаимодействие развивается по негативному сценарию, и тогда развиваются заболевания, которые принято называть ОРВИ – острые респираторно-вирусные инфекции.
О заболеваниях дыхательных путей у детей и особенностях их течения у недоношенных рассказывает Галина Анатольевна Асмолова – к.м.н., врач неонатолог, педиатр, доцент кафедры неонатологии факультета дополнительного постдипломного образования Российского национального исследовательского медицинского университета имени Н.И. Пирогова, врач-педиатр высшей категории кабинета катамнестического наблюдения с центром восстановительного лечения для детей от 0 до 3 лет ДГКБ им Н.Ф.Филатова.
Человек не может не болеть ОРВИ. Чаще других болеют дети, особенно раннего возраста, до 3 лет. Заболеваемость ОРВИ у детей в 4-5 раз выше, чем среди взрослых, и составляют более 90% всех регистрируемых в России инфекционных и паразитарных заболеваний. Это связано с анатомо-физиологическими особенностями детского организма, несовершенством их собственной иммунной системы, адаптацией к новым условиям. Особо уязвимую группу составляют недоношенные дети, родившиеся ранее 37 полных недель беременности.
ОРВИ – обширная группа заболеваний, причиной которых являются более 250 различных возбудителей. Более 90% из них – это различные вирусы. Каждый вирус имеет множество разновидностей, в виде разных типов и серотипов, генотипов, в связи с чем, мы можем болеть многократно. Может казаться, что мы болеем одним и тем же вирусом, но на самом деле, с точки зрения нашего организма и иммунного ответа, это не совсем идентичные возбудители.
Наиболее частыми возбудителями ОРВИ являются рино-, адено-, коронавирусы, респираторно-синцитиальный вирус, вирусы гриппа и парагриппа.
Заболевания дыхательных путей
Вирусы, вызывающие инфекции дыхательных путей, повреждают их эпителий и вызывают воспаление слизистой оболочки с повышением продукции вязкой слизи, что сопровождается клинически насморком и/или кашлем. В зависимости от уровня поражения, инфекции дыхательных путей делят на инфекции верхних дыхательных путей и нижних дыхательных путей.
Заболевания органов дыхания носят различные названия в зависимости от того, где именно локализуется очаг воспаления.
Инфекции верхних дыхательных путей
- Ринит – воспаление слизистой оболочки носа
- Фарингит – воспаление слизистой оболочки глотки и миндалин
- Ларингит – воспалительное заболевание, при котором поражается слизистая оболочка гортани
- Трахеит – заболевание, вызванное воспалением слизистой оболочки трахеи
Инфекции нижних дыхательных путей
- Бронхит – воспалительное заболевание дыхательной системы, при котором преимущественно поражены бронхи
- Бронхиолит – это воспаление самых маленьких воздухоносных путей (они называются бронхиолами)
- Пневмония – воспаление легких – являются наибольшей проблемой. Это острое воспалительное заболевание легких, преимущественно бактериальной этиологии, характеризующееся очаговым поражением респираторных отделов легких и наличием альвеолярной экссудации.
Врачи различают внебольничную пневмонию – развившуюся дома, вне стационара или диагносцированную в течение первых 48 часов с момента госпитализации, и нозокомиальную (внутрибольничную) пневмонию, которая развивается у пациента после нахождения в стационаре свыше 48 часов, на фоне основного заболевания. Нозокомиальные пневмонии вызываются внутрибольничными микроорганизмами и с ними тяжелее бороться, т.к. они часто бывают антибиотикорезистентны.
Инфекции нижних дыхательных путей являются наиболее значимой проблемой как с медицинской, так и социальной и экономической точки зрения. Они признаны ВОЗ основной причиной смертности среди детей до 5 лет во всем мире.
Пути заражения
Независимо от этиологии ОРВИ, основной механизм передачи вирусов – воздушно-капельный, при котором человек вдыхает частички аэрозоля, содержащего вирус. Но возможен и контактно-бытовой путь передачи вируса – через поцелуи, рукопожатия, бытовые предметы, общую посуду, поверхности и т.д.
Для детей первого года жизни особую опасность представляют старшие братья и сестры, посещающие детские сады и школы – они часто болеют ОРВИ в легких формах. Среди взрослых членов семьи могут оказаться и бессимптомные носители вируса. Такой человек сам не болеет, т.к. его иммунитет справляется, но для младенца этот вирус может оказаться опасным и вызвать ОРВИ различной степени тяжести.
Сезонность
Заболеваемость ОРВИ не равномерна на протяжении календарного года. Чаще всего дети болеют в холодный период. Вирус гриппа максимально активен в зимне-весенние месяцы. Респираторно-синцитиальный вирус (РСВ) чаще вызывает заболеваемость в осенне-зимний и даже ранний весенний период. Относительно спокойное время – это летние месяцы и начало осени, но и летом можно заболеть ротавирусом или энтеровирусом.
Клинические проявления ОРВИ
Независимо от возбудителя, ОРВИ проявляются, как правило, триадой симптомов:
- лихорадкой (повышением температуры),
- наличием признаков интоксикации,
- поражением самих дыхательных путей, что клинически проявляется насморком, кашлем, болью в горле.
При любом ОРВИ имеют место симптомы интоксикации разной степени выраженности. У взрослых это проявляется ознобом, слабостью, ломотой в теле, головной болью. У детей эти признаки тоже есть, но малыши в силу своего возраста не могут пожаловаться или объяснить, но это косвенно будет проявляться снижением общей активности, вялостью, большей капризностью, повышенной сонливостью, потерей аппетита. Степень выраженности этих симптомов может быть различной в зависимости от тяжести заболевания. Особенно сложно родителям оценить тяжесть состояния у самых маленьких – детей до 1 года.
Симптоматика поражения дыхательных путей у детей может быть не всегда ярко выраженной. Клиническая картина состоит из микросимптомов и их сочетания. Без тщательного осмотра ребенка, сбора анамнеза и анализа данных поставить правильный диагноз и назначить адекватное лечение невозможно!
Позднее обращение к врачу и самолечение приводит к утяжелению течения болезни, с возможным развитием осложнений, отсрочке постановки правильного диагноза и риску неблагоприятного исхода.
Особенности вирусных инфекций у недоношенных детей
Недоношенные новорожденные, родившиеся до 37 полных недель гестации, составляют особо уязвимую группу по заболеваемости и тяжелому течению инфекционных заболеваний дыхательных путей. Чаще других причиной ОРЗ становятся вирусы, причем до 20 % они носят смешанный характер (заражение не одним, а двумя или несколькими вирусами сразу).
Какие вирусы являются наиболее значимыми в структуре заболеваемости ОРВИ детей раннего возраста?
Ведущей причиной заболеваемости ОРВИ как среди всех заболевших (31%), так и потребовавших госпитализации по поводу инфекции нижних дыхательных путей (38%) среди детей раннего возраста, является рино-синцитиальный вирус (РС-вирус).
Чем он так знаменит или опасен? Какие особенности позволяют ему удерживать эту пальму первенства среди вирусов, даже превосходя вирус гриппа?
Возбудитель РС-инфекции имеет выраженную тропность или сродство к поверхностному эпителию слизистой нижних дыхательных путей — бронхов и бронхиол. Он разрушает клетки реснитчатого эпителия, выстилающего дыхательные пути, вызывает отек, гиперпродукцию слизи, закупорку дыхательных путей, что затрудняет прохождение воздуха в мелкие дыхательные пути и может привести к развитию дыхательной недостаточности.
РС вирус опасен тем, что он имеет высокую распространенность среди детского населения. До 60 % всех детей оказываются инфицированными в возрасте до года, почти 100% - в возрасте до 2 лет, а многие успевают перенести его дважды, так как надежный иммунный ответ в ответ на эту инфекцию не формируется.
РС вирус способен вызывать как спорадические случаи заболеваний, так и локальные вспышки, наиболее частые в группах риска.
У большинства детей более старшего возраста и взрослых РС-вирусная инфекция протекает обычно в легкой форме, в виде ринита, фарингита, а вот у малышей на 1-ом году жизни, он, как правило, поражает нижние дыхательные пути, с развитием бронхита, тяжелого бронхиолита, интерстициальной пневмонии, что часто сопровождается дыхательной недостаточностью. Таким образом, чем младше ребенок, тем более он угрожаем по тяжелому течению РС-вирусной инфекции. Пик госпитализаций приходится именно на возраст 2-5 месяцев после рождения.
Бронхиолиты, вызванные РС-вирусом, характеризуются значительно более тяжелым течением, чем бронхиолиты любой другой этиологии.
Что еще более не приятно – это отдаленные последствия после перенесенной тяжелой РСВ инфекции. У детей раннего и более старшего возраста возможно в дальнейшем развитие симптомов рецидивирующего свистящего дыхания, бронхиальной обструкции и астмы.
Есть ли какие-то группы детей, у которых чаще, чем у других, возможно развитие тяжелой РС инфекции, протекающей с осложнениями и госпитализацией?
Недоношенный ребенок
Особую группу риска по тяжелому течению РС- вирусной инфекции составляют, прежде всего, недоношенные дети, родившиеся до 35 недели гестации, младенцы с тяжелыми или гемодинамически значимыми пороками сердца и бронхо-легочной дисплазией. У таких детей еще не до конца сформирована легочная ткань, или она имеет тяжелые повреждения, вследствие перенесенной пневмонии и длительной искусственной вентиляции легких. Для них может потребоваться госпитализация, дополнительная кислородотерапия и даже повторная искусственная вентиляция легких.
Важнейшие факторы профилактики
Можно ли защитить новорожденного, а особенно, недоношенного ребенка из группы риска от тяжелого течения инфекций нижних дыхательных путей? Следует обратить внимание на следующие факторы:
- Грудное вскармливание минимум до 6 месяцев. Несмотря на значительный прогресс в производстве искусственных смесей, мы никогда не сможем повторить тот уникальный состав, который несет в себе материнское молоко.
- Курение – один из самых негативных факторов, влияющий на состояние дыхательной системы. Необходимо исключить как курение беременной женщины, так и пассивное курение кормящей женщины и членов семьи.
- Адекватное питание в целом в соответствии с потребностями ребенка и адекватная витаминизация, прежде всего профилактика и устранение дефицита витамина Д.
- Здоровый кишечник. Кишечник является самым большым иммунным органом в организме человека. Микробиом кишечника опосредованно влияет на все органы и системы, и в том числе частоту заболеваний ОРВИ.
- При заболевании кого-то из членов семьи необходимо разобщение ребенка с больным (особенно в острый период, самое активное распространение вируса – первые 3-4 дня). Соблюдение дома всех санитарно-гигиенических мер.
- Система закаливания, состояние общего иммунитета. На это влияют не только специальные закаливающие процедуры, но и разумная одежда (в которой не жарко и не холодно), регулярное проветривание помещений, по возможности, длительные выезды (от 3 недель) за город, на дачу, на море.
Вакцинация и иммунизация
Возможна ли специфическая профилактика от такого коварного вируса?
Вакцины для профилактики РС вирусной инфекции не существует на сегодняшний день, хотя такие исследования активно ведутся.
Но по назначению врача возможна пассивная иммунизация во время сезонного подъема РС-вирусной инфекции детям из групп высокого риска по тяжелому течению данной инфекции. Такую профилактику проводят после выписки из стационара раз в месяц (всего от 3 до 5 раз).
Еще одним крайне важным фактором защиты для недоношенного ребенка, является активная профилактика инфекций или вакцинация. Существует заблуждение, что недоношенность является противопоказанием к вакцинации. На самом деле все наоборот – недоношенным детям крайне важно проводить все плановые прививки согласно Национальному календарю, принятому в РФ. Именно недоношенных детей, детей со сниженным иммунитетом, необходимо защитить прививками в первую очередь, потому что пневмоккок, гемофильная палочка, коклюш, дифтерия, столбняк, полиомиелит, корь, туберкулез, являются крайне опасными, и могут стоить жизни этим, с таким трудом выхоженным малышам. Но, безусловно, вакцинация должна проходить по индивидуальному графику, по согласованию с врачами, которые наблюдают этого ребенка (педиатр, невролог, окулист и др.).
Сроки проведения вакцинации недоношенного ребенка определяются стабилизацией состояний, связанных с преждевременным рождением, как соматического, так и неврологического. Вакцинация комплексной вакциной против дифтерии, коклюша, столбняка, полиомиелита и гемофильной палочки, предпочтительнее с использованием ацеллюлярной (бесклеточной) вакцины.
Как помочь ребенку, которому внезапно стало трудно дышать?
Это, безусловно, очень непростой вопрос, и ответ на него зависит, от тех условий, когда и где происходи эта ситуация, какой возраст ребенка, и что этому предшествовало. Я расскажу про наиболее часто встречающееся в практике состояние, связанное с вирусом, раз уж мы сегодня говорим про вирусные инфекции.
Обычно все начинается с неспецифических симптомов острой респираторной вирусной инфекции: появляется насморк, першение в горле, кашель. Симптомы обструктивного ларингита развиваются в начале ОРВИ и обычно развиваются остро, вечером, ночью, нередко в предутренние часы (3-4 часа ночи). Ребенок внезапно просыпается, появляется осиплость голоса и/или сухой грубый кашель, очень быстро кашель приобретает лающий грубый характер, появляется шумное дыхание или шумный вдох, нарастает беспокойство ребенка. Может быть видно слабовыраженное втяжение надключичных ямок и межреберных промежутков при дыхании.
Что делать в такой ситуации?
Идеальный способ – использование компрессорного небулайзера, с применением хотя бы физраствора (0,9% NaCl), при неэффективности – проводят ингаляцию суспензии будесонида из расчета 0,5 мг на 2 мл физраствора через компрессорный небулайзер.
Поэтому после рождения ребенка одним из необходимых приобретений является ингалятор (компрессорный небулайзер).
Другая ситуация, которая касается в первую очередь недоношенных детей в первые месяцы жизни, это апноэ. Ребенок замирает на некоторое время, как будто бы забывая вдохнуть. Ребенок при этом, как правило, здоров.
Апноэ - это временная задержка дыхания, длящаяся 10 секунд и более, которая может сопровождаться изменением сердечного ритма и возникает у недоношенных новорожденных, в связи с незрелостью дыхательного центра. При этом отсутствуют движения грудной клетки. Цвет кожных покровов приобретает синюшный оттенок. Пульс становится редким.
Первая помощь при апноэ:
- Выложите ребенка на твердую ровную поверхность.
- Убедитесь, что в ротовой полости отсутствует инородное тело, исключите вероятность аспирации слизью, желудочным содержимым.
- Проводите тактильную активную стимуляцию: ушные раковины, ладони, стопы. Пальцевые нажатия должны быть ощутимыми!
- Поверните ребенка лицом вниз, чтобы кровь прилила к голове. Проведите несколько раз пальцами вдоль позвоночника снизу вверх по околопозвоночным валикам с нажатием.
Будьте осторожны! Слишком глубокий вдох может травмировать легкие малыша. Эффективность вдоха можно оценить по появившимся движениям грудной клетки непосредственно во время проведения искусственного дыхания.
Если эпизоды апноэ повторяются регулярно, это является поводом для быстрого обращения к неврологу и педиатру!
И в заключение: даже если ваш малыш заболел, не паникуйте, обратитесь к врачу, следуйте рекомендациям, и он обязательно поправится!
Внутриутробные инфекции – группа заболеваний плода и новорожденного, развивающихся вследствие заражения в дородовом периоде или в родах. Внутриутробные инфекции могут приводить к гибели плода, самопроизвольному аборту, задержке внутриутробного развития, преждевременным родам, формированию врожденных пороков, поражению внутренних органов и ЦНС. Методы диагностики внутриутробных инфекций включают микроскопические, культуральные, иммуноферментные, молекулярно-биологические исследования. Лечение внутриутробных инфекций проводится с использованием иммуноглобулинов, иммуномодуляторов, противовирусных, антибактериальных препаратов.

Общие сведения
Внутриутробные инфекции – патологические процессы и заболевания, обусловленные антенатальным и интранатальным инфицированием плода. Истинная распространенность внутриутробных инфекций не установлена, однако, согласно обобщенным данным, с врожденными инфекциями рождается не менее 10% новорожденных. Актуальность проблемы внутриутробных инфекций в педиатрии обусловлена высокими репродуктивными потерями, ранней неонатальной заболеваемостью, приводящей к инвалидизации и постнатальной гибели детей. Вопросы профилактики внутриутробных инфекций лежат в плоскости рассмотрения акушерства и гинекологии, неонатологии, педиатрии.

Причины внутриутробных инфекций
Внутриутробные инфекции развиваются в результате инфицирования плода в дородовом периоде или непосредственно во время родов. Обычно источником внутриутробной инфекции для ребенка выступает мать, т. е. имеет место вертикальный механизм передачи, который в антенатальном периоде реализуется трансплацентарным или восходящим (через инфицированные околоплодные воды) путями, а в интранатальном - аспирационным или контактным путями.
Реже происходит ятрогенное инфицирование плода в период беременности при проведении женщине инвазивной пренатальной диагностики (амниоцентеза, кордоцентеза, биопсии ворсин хориона), введении плоду препаратов крови через сосуды пуповины (плазмы, эритроцитарной массы, иммуноглобулинов) и т. д.
В антенатальном периоде инфицирование плода обычно связано с вирусными агентами (вирусами краснухи, герпеса, цитомегалии, гепатита В и С, Коксаки, ВИЧ) и внутриклеточными возбудителями (токсоплазмоза, микоплазмоза).
В интранатальном периоде чаще происходит микробная контаминация, характер и степень которой зависит от микробного пейзажа родовых путей матери. Среди бактериальных агентов наиболее распространены энтеробактерии, стрептококки группы В, гонококки, синегнойная палочки, протей, клебсиелла и др. Плацентарный барьер непроницаем для большинства бактерий и простейших, однако при повреждении плаценты и развитии фетоплацентарной недостаточности, может произойти антенатальное микробное инфицирование (например, возбудителем сифилиса). Кроме этого, не исключается и интранатальное вирусное заражение.
Факторами возникновения внутриутробных инфекций служат отягощенный акушерско-гинекологический анамнез матери (неспецифические кольпиты, эндоцервициты, ЗППП, сальпингофориты), неблагополучное течение беременности (угроза прерывания, гестозы, преждевременная отслойка плаценты) и инфекционная заболеваемость беременной. Риск развития манифестной формы внутриутробной инфекции существенно выше у недоношенных детей и в том случае, когда женщина инфицируется первично во время беременности.
Известно, что тяжесть проявлений инфекционного процесса у беременной и у плода может не совпадать. Бессимптомное или малосимптомное течение инфекции и у матери может вызвать тяжелые поражения плода, вплоть до его гибели. Это связано с повышенным тропизмом вирусных и микробных возбудителей к эмбриональным тканям, преимущественно ЦНС, сердца, органа зрения.
Классификация
Этиологическая структура внутриутробных инфекций предполагает их деление на:
- вирусные (вирусный гепатит, герпес, краснуха, ОРВИ, цитомегалия, эпидемический паротит, энтеровирусная инфекция)
- бактериальные (туберкулез, сифилис, листериоз, сепсис)
- паразитарные и грибковые (микоплазмоз, токсоплазмоз, хламидиоз, кандидоз и др.)
Для обозначения группы наиболее распространенных внутриутробных инфекций используется аббревиатура TORCH-синдром, объединяющий токсоплазмоз (toxoplasmosis), краснуху (rubella), цитомегалию (cytomegalovirus), герпес (herpes simplex). Буквой О (other) обозначаются другие инфекции, в числе которых - вирусные гепатиты, ВИЧ-инфекция, ветряная оспа, листериоз, микоплазмоз, сифилис, хламидиоз и др.).
Симптомы внутриутробных инфекций
Наличие внутриутробной инфекции у новорожденного может быть заподозрено уже во время родов. В пользу внутриутробного инфицирования может свидетельствовать излитие мутных околоплодных вод, загрязненных меконием и имеющих неприятный запах, состояние плаценты (полнокровие, микротробозы, микронекрозы). Дети с внутриутробной инфекцией часто рождаются в состоянии асфиксии, с пренатальной гипотрофией, увеличенной печенью, пороками развития или стигмами дисэмбриогенеза, микроцефалией, гидроцефалией. С первых дней жизни у них отмечается желтуха, элементы пиодермии, розеолезных или везикулезных высыпаний на коже, лихорадка, судорожный синдром, респиратрные и кардиоваскулярные расстройства.
Ранний неонатальный период при внутриутробных инфекциях нередко отягощается интерстициальной пневмонией, омфалитом, миокардитом или кардитом, анемией, кератоконъюнктивитом, хориоретинитом, геморрагическим синдромом и др. При инструментальном обследовании у новорожденных могут обнаруживаться врожденная катаракта, глаукома, врожденные пороки сердца, кисты и кальцификаты мозга.
В перинатальном периоде у ребенка отмечаются частые и обильные срыгивания, мышечная гипотония, синдром угнетения ЦНС, серый цвет кожных покровов. В поздние сроки при длительном инкубационном периоде внутриутробной инфекции возможно развитие поздних менингитов, энцефалитов, остеомиелита.
Рассмотрим проявления основных внутриутробных инфекций, составляющих TORCH-синдром.
Врождённый токсоплазмоз
Внутриутробное инфицирование одноклеточным протозойным паразитом Toxoplasma Gondii приводит к тяжелым поражениям плода – задержке развития, врожденным порокам развития мозга, глаз, сердца, скелета.
После рождения в остром периоде внутриутробная инфекция проявляется лихорадкой, желтухой, отечным синдромом, экзантемой, геморрагиями, диареей, судорогами, гепатоспленомегалией, миокардитом, нефритом, пневмонией. При подостром течении доминирую признаки менингита или энцефалита. При хронической персистенции развивается гидроцефалия с микроцефалией, иридоциклит, косоглазие, атрофия зрительных нервов. Иногда встречаются моносимптомные и латентные формы внутриутробной инфекции.
К числу поздних осложнений врожденного токсоплазмоза относятся олигофрения, эпилепсия, слепота.
Врождённая краснуха
Внутриутробная инфекция возникает из-за заболевания краснухой при беременности. Вероятность и последствия инфицирования плода зависят от гестационного срока: в первые 8 недель риск достигает 80%; последствиями внутриутробной инфекции могут служить самопроизвольное прерывание беременности, эмбрио- и фетопатии. Во II триместре риск внутриутробного инфицирования составляет 10-20%, в III – 3-8%.
Дети с внутриутробной инфекцией обычно рождаются недоношенными или с низкой массой тела. Для периода новорожденности характерна геморрагическая сыпь, длительная желтуха.
Классические проявления врожденной краснухи представлены триадой Грега: поражением глаз (микрофтальмией, катарактой, глаукомой, хориоретинитом), ВПС (открытым артериальным протоком, ДМПП, ДМЖП, стенозом легочной артерии), поражением слухового нерва (сенсоневральной глухотой). В случае развития внутриутробной инфекции во второй половине беременности у ребенка обычно имеется ретинопатия и глухота.
Кроме основных проявлений врожденной краснухи, у ребенка могут выявляться и другие аномалии: микроцефалия, гидроцефалия, расщелины нёба, гепатит, гепатоспленомегалия, пороки развития мочеполовой системы и скелета. В дальнейшем внутриутробная инфекция напоминает о себе отставанием ребенка в физическом развитии, ЗПР или умственной отсталостью.
Врождённая цитомегалия
Внутриутробное заражение цитомегаловирусной инфекцией может приводить к локальному или генерализованному поражению многих органов, иммунодефициту, гнойно-септическим осложнениям. Врожденные дефекты развития обычно включают микроцефалию, микрогирию, микрофтальмию, ретинопатию, катаракту, ВПС и др. Неонатальный период врожденной цитомегалии осложняется желтухой, геморрагическим синдромом, двусторонней пневмонией, интерстициальным нефритом, анемией.
К отдаленным последствиям внутриутробной инфекции относятся слепота, нейросенсорная глухота, энцефалопатия, цирроз печени, пневмосклероз.
Врождённая герпетическая инфекция
Внутриутробная герпес-инфекция может протекать в генерализованной (50%), неврологической (20%), слизисто-кожной форме (20%).
Генерализованная внутриутробная врожденная герпетическая инфекция протекает с выраженным токсикозом, респираторным дистресс-синдромом, гепатомегалией, желтухой, пневмонией, тромбоцитопенией, геморрагическим синдромом. Неврологическая форма врожденного герпеса клинически проявляется энцефалитом и менингоэнцефалитом. Внутриутробная герпес-инфекция с развитием кожного синдрома сопровождается появлением везикулярной сыпи на кожных покровах и слизистых оболочках, в т. ч. внутренних органов. При наслоении бактериальной инфекции развивается сепсис новорожденных.
Внутриутробная герпес-инфекция у ребенка может приводить к формированию пороков развития - микроцефалии, ретинопатии, гипоплазии конечностей (кортикальной карликовости). В числе поздних осложнений врожденного герпеса - энцефалопатия, глухота, слепота, задержка психомоторного развития.
Диагностика
В настоящее время актуальной задачей является пренатальная диагностика внутриутробных инфекций. С этой целью на ранних сроках беременности проводится микроскопия мазка, бактериологический посев из влагалища на флору, ПЦР-исследование соскоба, обследование на TORCH-комплекс. Беременным из группы высокого риска по развитию внутриутробной инфекции показана инвазивная пренатальная диагностика (аспирация ворсин хориона, амниоцентез с исследованием амниотической жидкости, кордоцентез с исследованием пуповинной крови).
Возможно выявление эхографических маркеров внутриутробных инфекций с помощью акушерского УЗИ. К косвенным эхографическим признакам внутриутробного инфицирования относятся маловодие или многоводие; наличие гиперэхогенной взвеси в околоплодных водах или амниотических тяжей; гипоплазия ворсин хориона, плацентит; преждевременное старение плаценты; отечный синдром плода (асцит, перикардит, плеврит), гепатоспленомегалия, кальцификаты и пороки развития внутренних органов и др. В процессе допплерографического исследования кровотока выявляются нарушения плодово-плацентарного кровотока. Кардиотокография обнаруживает признаки гипоксии плода.
После рождения ребенка с целью достоверной верификации этиологии внутриутробной инфекции используются микробиологические (вирусологические, бактериологические), молекулярно-биологические (ДНК-гибридизация, ПЦР), серологические (ИФА) методики обследования. Важное диагностическое значение имеет гистологическое исследование плаценты.
По показаниям новорожденные с внутриутробными инфекциями в первые сутки жизни должны быть осмотрены детским неврологом, детским кардиологом, детским офтальмологом и др. специалистами. Целесообразно провести ЭхоКГ, нейросонографию, офтальмоскопию, исследование слуха методом вызванной отоакустической эмиссии.
Лечение внутриутробных инфекций
Общие принципы лечения внутриутробных инфекций предполагают проведение иммунотерапии, противовирусной, антибактериальной и посиндромной терапии.
Иммунотерапия включает применение поливалентных и специфических иммуноглобулинов, иммуномодуляторов (интерферонов). Противовирусная терапия направленного действия осуществляется, главным образом, ацикловиром. Для противомикробной терапии бактериальных внутриутробных инфекций используются антибиотики широкого спектра действия (цефалоспорины, аминогликозиды, карбапенемы), при микоплазменной и хламидийной инфекциях – макролиды.
Посиндромная терапия внутриутробных инфекций направлена на купирование отдельных проявлений перинатального поражения ЦНС, геморрагического синдрома, гепатита, миокардита, пневмонии и т. д.
Прогноз и профилактика
При генерализованных формах внутриутробных инфекций летальность в неонатальном периоде достигает 80%. При локальных формах возникают серьезные поражения внутренних органов (кардиомиопатии, ХОБЛ, интерстициальный нефрит, хронический гепатит, цирроз и т. д.). Практически во всех случаях внутриутробные инфекции приводят к поражению ЦНС.
Профилактика внутриутробных инфекций заключается в проведении предгравидарной подготовки, лечении ЗППП до наступления беременности, исключении контактов беременной с инфекционными больными, коррекции программы ведения беременности у женщин групп риска. Женщины, ранее не болевшие краснухой и не получавшие прививки против краснухи, должны быть вакцинированы не позднее, чем за 3 месяца до предполагаемой беременности. В ряде случаев внутриутробные инфекции могут являться основанием для искусственного прерывания беременности.
Внутриутробная пневмония – воспаление легочной ткани, возникшее антенатально, сопровождающееся развитием клинических проявлений в первые 72 часа жизни ребенка. Проявляется выраженной дыхательной недостаточностью, явлениями респираторного дистресс-синдрома, интоксикацией, неврологическими нарушениями вследствие отека мозга и др. Внутриутробная пневмония диагностируется рентгенологически, лабораторные исследования позволяют выявить конкретного возбудителя инфекции. Показана этиотропная терапия (антибиотики, противовирусные препараты и др.), кислородотерапия, коррекция симптомов полиорганной недостаточности.
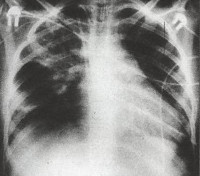
Общие сведения
Внутриутробная пневмония – одна из наиболее часто встречающихся патологий в структуре внутриутробных инфекций. Примерно 30% всех внутриутробных пневмоний протекает в виде локализованных форм, в остальных случаях воспаление легких у новорожденных возникает в рамках генерализованной внутриутробной инфекции. В настоящее время внутриутробные пневмонии продолжают представлять опасность. Средний показатель заболеваемости – около 2 случаев на 1000 новорожденных, также на долю заболевания приходится до 80-90% младенческой смертности. Отдельный акцент делается на внутриутробной пневмонии, вызванной условно-патогенной флорой. Во-первых, оппортунистическим микроорганизмам, как правило, не уделяется должного внимания. Во-вторых, именно они часто остаются резистентными к терапии.
Внутриутробная пневмония остается актуальной проблемой современной педиатрии. Даже будучи успешно вылеченной, болезнь наносит серьезный удар по детскому иммунитету. Впоследствии любая простуда легко может осложняться пневмонией. Если диагностика была запоздалой, высок риск развития осложнений, опасных для жизни (плеврит, сепсис и др.). Часто у детей, перенесших внутриутробную пневмонию, развивается спаечный процесс в плевре, что ведет к хронической дыхательной недостаточности с неизбежной инвалидностью.

Причины внутриутробной пневмонии
Внутриутробная пневмония одинаково часто вызывается бактериями и вирусами, реже – бактериально-вирусными ассоциациями и грибами. Бактерии, наиболее часто являющиеся причинами инфекции, – стрептококк, стафилококк, энтерококк, кишечная палочка, микоплазма и др. Вирусная внутриутробная пневмония развивается, как правило, при участии вирусов TORCH-группы, вирусов гриппа и др. Грибковая этиология связана с грибами рода Candida. Особую роль играют ИППП, которые также могут быть причиной заболевания. Встречается также врожденная сифилитическая пневмония.
Помимо причин заболевания, существует множество факторов риска, способствующих развитию внутриутробной пневмонии. Отдельно выделяют факторы риска со стороны матери и со стороны плода. К акушерско-гинекологическим патологиям, повышающим вероятность развития заболевания, относятся аборты и выкидыши в анамнезе женщины, патологии родов, гестозы и хронические заболевания малого таза, в том числе вследствие широкого применения внутриматочных контрацептивов. К факторам риска со стороны плода относится недоношенность и низкая масса ребенка при рождении, воспалительные процессы в плаценте и фетоплацентарная недостаточность.
Существует два пути заражения плода – восходящий и гематогенный. Первый из них подразумевает наличие у матери инфекции внутренних половых органов, чаще бактериальной природы. Гематогенный путь инфицирования – это трансплацентарное проникновение возбудителя через пупочную вену в кровь плода, характерное в большей степени для внутриутробной пневмонии вирусной этиологии. Независимо от ворот инфекции, микроорганизм попадает в кровь плода и уже оттуда достигает легочной ткани. Поскольку в утробе матери ребенок не дышит воздухом, инфекционный агент остается в тканях бессимптомно до момента родов. С первых вдохом кровоснабжение в легких резко возрастает. Именно этот момент является пусковым, и внутриутробная пневмония начинает проявляться клинически.
Классификация внутриутробных пневмоний
Этиологически выделяют бактериальную, вирусную и грибковую внутриутробную пневмонию, иногда встречаются бактериально-вирусные инфекции. По степени тяжести заболевание делится на легкую, средней тяжести и тяжелую формы. В зависимости от момента заражения внутриутробная пневмония бывает врожденной и интранатальной, когда инфицирование происходит в момент прохождения плода по родовым путям. Течение заболевания может быть острым и затяжным, с осложнениями и без. Различают легочные осложнения в виде пневмоторакса, ателектаза, абсцедирования легкого, а также внелегочные осложнения, основными из которых являются менингит, поражение оболочек сердца и сепсис. Отдельно выделяют 3 степени дыхательной недостаточности.
Симптомы внутриутробной пневмонии
Часто развиваются осложнения со стороны легких, такие как пневмоторакс, ателектаз легкого, респираторный дистресс-синдром, абсцессы легкого, сепсис. Внутриутробная пневмония редко встречается как локализованное заболевание. В связи с этим всегда имеются другие, внелегочные симптомы внутриутробных инфекций: со стороны нервной, сердечно-сосудистой, пищеварительной системы, органов слуха и зрения. У недоношенных детей заболевание протекает тяжелее, вероятность осложнений всегда выше.
Неврологическая симптоматика представлена запрокидыванием головы назад, повышением или снижением мышечного тонуса. Среди осложнений – менингит, который особенно часто встречается при микоплазменной внутриутробной пневмонии. Неврологические расстройства связаны в первую очередь с отеком мозговых оболочек, причиной которого является дыхательная недостаточность. Примерно у половины заболевших детей диагностируются гастроинтестинальные нарушения, в частности, срывания и позывы на рвоту, метеоризм, парез кишечника. Таким образом, при внутриутробной пневмонии речь часто идет о полиорганной недостаточности, основные причины которой – генерализация инфекции и общее нарушение кровообращения.
Диагностика внутриутробной пневмонии
Дыхательная недостаточность легко выявляется при физикальном осмотре ребенка. На рентгенограмме легких заметно усиление легочного рисунка, перибронхиальные изменения, многочисленные очаги инфильтрации легочной ткани. Изменения на рентгенограмме сохраняются до месяца с момента начала острой фазы внутриутробной пневмонии. В тяжелых случаях инфекции возможно отсутствие признаков заболевания по данным рентгенографии легких в течение первых трех дней.
Лабораторная диагностика внутриутробной пневмонии включает общий и биохимический анализ крови, мазок из зева на флору, микробиологическое исследование трахеобронхиального аспирата, анализ отделяемого из полости носа. Анализ крови позволяет выявить признаки воспалительного процесса, анемию разной степени, гипербилирубинемию и др. Обязательно проводятся серологические исследования (ИФА-диагностика) для обнаружения различных классов антител к конкретным возбудителям. В отношении диагностики вирусной этиологии внутриутробной пневмонии эффективен метод ПЦР. Необходимо выявление первичного очага инфекции у матери.
Лечение внутриутробной пневмонии
Лечение проводится в отделении интенсивной терапии или реанимации новорожденных. В зависимости от выраженности дыхательной недостаточности используются различные методы кислородной поддержки: кислородная маска, ИВЛ. Этиотропная терапия внутриутробной пневмонии – антибиотики, противовирусные, противогрибковые препараты – может назначаться эмпирически, либо подбираться исходя из других признаков, патогномоничных для конкретных внутриутробных инфекций (краснуха, токсоплазмоз, хламидиоз и др.). Список антибиотиков ограничен возрастом, противопоказано применение препаратов аминогликозидного ряда.
Недоношенным детям обязательно назначение сурфактантов, способствующих развитию легочной ткани и расправлению спавшихся альвеол. Санация трахеобронхиального дерева проводится практически всем детям, частота регулируется тяжестью состояния. Проводятся дегидратационные мероприятия, детоксикация солевыми растворами, коррекция ацидоза, анемии, нарушений свертываемости крови, симптоматическая терапия. Переливание эритроцитарной массы осуществляется по показаниям. По окончании острой фазы внутриутробной пневмонии показана физиотерапия.
Прогноз и профилактика внутриутробной пневмонии
Прогноз внутриутробной пневмонии определяется конкретной нозологией и тяжестью состояния. Заболевание было и остается одной из основных причин детской смертности. Более благоприятное течение отмечается при внутриутробной пневмонии стафилококковой этиологии (кроме золотистого стафилококка) и вирусного генеза. Частота летального исхода выше в случае инфицирования энтерококками, кишечной палочкой, микоплазмой, золотистым стафилококком; особенно опасны бактериально-вирусные ассоциации. Также уровень смертности повышается в случае развития осложнений, в частности, сепсиса.
Первичная профилактика внутриутробной пневмонии сводится к определению возможных факторов риска заболевания у беременной женщины. Это обеспечит высокую настороженность и готовность медицинского персонала к реанимационным мероприятиям непосредственно в родовом зале. Также необходима своевременная диагностика внутриутробных инфекций, поскольку клиника многих из них включает поражение легких в виде внутриутробной пневмонии. Всем детям, перенесшим заболевание в период новорожденности, проводится профилактика повторной пневмонии: витаминотерапия, массаж, гимнастика и др.
Недоношенные дети – это дети, родившиеся ранее срока родов, функционально незрелые, с массой ниже 2500 г и длиной тела менее 45 см. Клинические признаки недоношенности включают непропорциональное телосложение, открытые швы черепа и малый родничок, невыраженность подкожно-жирового слоя, гиперемию кожных покровов, недоразвитие половых органов, слабость или отсутствие рефлексов, слабый крик, интенсивную и длительную желтуху и др. Выхаживание недоношенных детей подразумевает организацию специального ухода - температурного режима, влажности, уровня оксигенации, вскармливания, при необходимости – проведение интенсивной терапии.

Общие сведения
Недоношенными считаются дети, рожденные в период с 28 по 37 неделю беременности, имеющие массу тела 1000-2500 г и длину тела 35-45 см. Наиболее устойчивым критерием считается срок гестации; антропометрические показатели, в силу их значительной вариабельности, относятся к условным критериям недоношенности. Ежегодно в результате самопроизвольных преждевременных родов или искусственно индуцированного прерывания беременности на поздних сроках недоношенными появляются на свет 5-10% детей от общего числа новорожденных.
По определению ВОЗ (1974 г.), плод считается жизнеспособным при гестационном сроке более 22 недель, массе тела от 500 г, длине тела от 25 см. В отечественной неонатологии и педиатрии рождение плода ранее 28 недели гестации, имеющего массу тела менее 1000 г и длину менее 35 см расценивается как поздний выкидыш. Однако, если такой ребенок родился живым и прожил после рождения не менее 7 суток, он регистрируется как недоношенный. Уровень неонатальной смертности среди недоношенных детей намного выше такового среди доношенных младенцев, и в значительной мере зависит от качества оказания медицинской помощи в первые минуты и дни жизни ребенка.

Причины недоношенности
Все причины, приводящие к рождению недоношенных детей можно объединить в несколько групп. К первой группе относятся социально-биологические факторы, включающие слишком юный или пожилой возраст родителей (моложе 18 и старше 40 лет), вредные привычки беременной, недостаточное питание и неудовлетворительные бытовые условия, профессиональные вредности, неблагоприятный психоэмоциональный фон и др. Риск преждевременного родоразрешения и рождения недоношенных детей выше у женщин, не планировавших беременность и пренебрегающих медицинским сопровождением беременности.
К третьей группе причин, нарушающих нормальное созревание плода и обуславливающих повышенную вероятность рождения недоношенных детей, относятся различные экстрагенитальные заболевания матери: сахарный диабет, гипертоническая болезнь, пороки сердца, пиелонефрит, ревматизм и др. Часто преждевременные роды провоцируются острыми инфекционными заболеваниями, перенесенными женщиной на поздних сроках гестации.
Наконец, рождение недоношенных детей может быть связано с патологией и аномальным развитием самого плода: хромосомными и генетическими болезнями, внутриутробными инфекциями, тяжелыми пороками развития.
Классификация недоношенности
С учетом обозначенных критериев (срока гестации, массы и длины тела) выделяют 4 степени недоношенности:
I степень недоношенности – родоразрешение происходит на сроке 36-37 недель гестации; масса тела ребенка при рождении составляет 2500-2001 г, длина – 45-41 см.
II степень недоношенности - родоразрешение происходит на сроке 32-35 недель гестации; масса тела ребенка при рождении составляет 2001-2500 г, длина – 40-36 см.
III степень недоношенности - родоразрешение происходит на сроке 31-28 недель гестации; масса тела ребенка при рождении составляет 1500-1001 г, длина – 35-30 см.
Внешние признаки недоношенности
Для недоношенных детей характерен ряд клинических признаков, выраженность которых коррелирует со степенью недоношенности.
У глубоко недоношенных детей все роднички и швы черепа открыты, черепные кости податливые, мозговой череп преобладает над лицевым. Характерно недоразвитие ушных раковин, слабое развитие ногтей (ногтевые пластинки не доходят до кончиков пальцев), слабая пигментация сосков и околососковых кружков. Половые органы у недоношенных детей недоразвиты: у девочек отмечается зияние половой щели, у мальчиков – неопущение яичек в мошонку (крипторхизм).
Недоношенные дети, рожденные на сроке 33-34 недели гестации и позже, характеризуются большей зрелостью. Их внешний облик отличается розовым цветом кожных покровов, отсутствием пушка на лице и туловище, более пропорциональным телосложением (меньшей головой, более высоким расположением пупка и пр.). У недоношенных детей I-II степени сформированы изгибы ушных раковин, выражена пигментация сосков и околососковых кружков. У девочек большие половые губы практически полностью прикрывают половую щель; у мальчиков яички расположены у входа в мошонку.
Анатомо-физиологические особенности недоношенных детей
Недоношенность определяется не столько антропометрическими показателями, сколько морфофункциональной незрелостью жизненно важных органов и систем организма.
Характерными особенностями органов дыхания у недоношенных детей являются узость верхних дыхательных путей, высокое стояние диафрагмы, податливость грудной клетки, перпендикулярное расположение ребер относительно грудины. Данные морфологические особенности недоношенных детей обусловливают поверхностное, частое, ослабленное дыхание (40-70 в мин.), склонность к апноэ длительностью 5-10 секунд (апноэ недоношенных). Вследствие недоразвития эластической ткани легких, незрелости альвеол, сниженного содержания сурфактанта у недоношенных детей легко возникает синдром дыхательных расстройств (застойные пневмонии, респираторный дистресс-синдром).
Незрелость сердечно-сосудистой системы характеризуется лабильностью пульса, тахикардией 120-180 в мин., приглушенностью сердечных тонов, артериальной гипотонией (55-65/20-30 мм рт. ст.). При наличии врожденных пороков сердца (открытого Боталлова протока, открытого овального окна) могут выслушиваться шумы. Вследствие повышенной ломкости и проницаемости сосудистых стенок легко возникают кровоизлияния (подкожные, во внутренние органы, в мозг).
Морфологическими признаками незрелости ЦНС у недоношенных детей служат слабая дифференцировка серого и белого вещества, сглаженность борозд мозга, неполная миелинизация нервных волокон, обедненная васкуляризация подкорковых зон. Мышечный тонус у недоношенных детей слабый, физиологические рефлексы и двигательная активность снижены, реакция на раздражители замедлена, терморегуляция нарушена, имеется склонность как к гипо-, так и гипертермии. В первые 2-3 недели у недоношенного ребенка могут возникать преходящий нистагм и косоглазие, тремор, вздрагивания, клонус стоп.
У недоношенных детей отмечается функциональная незрелость всех отделов желудочно-кишечного тракта и низкая ферментовыделительная активность. В связи с этим недоношенные дети предрасположены к срыгиваниям, развитию метеоризма, дисбактериоза. Желтуха у недоношенных детей выражена интенсивнее и сохраняется дольше, чем у доношенных новорожденных. Вследствие незрелости ферментных систем печени, повышенной проницаемости гематоэнцефалического барьера и бурного распада эритроцитов у недоношенных детей может легко развиваться билирубиновая энцефалопатия.
Функциональная незрелость почек у недоношенных детей приводит к изменению электролитного баланса (гипокальциемии, гипомагниемии, гипернатриемии, гиперкалиемии), декомпенсированному метаболическому ацидозу, склонности к возникновению отеков и быстрому обезвоживанию при неадекватном уходе.
Деятельность эндокринной системы характеризуется задержкой становления циркадного ритма выделения гормонов, быстрым истощением желез. У недоношенных детей отмечается низкий синтез катехоламинов, часто развивается транзиторный гипотиреоз, в первые дни жизни редко проявляется половой криз (физиологический мастит, физиологический вульвовагинит у девочек).
У недоношенных детей более быстрыми темпами, чем у доношенных, развивается ранняя анемия, имеется повышенный риск развития септицемии (сепсиса) и септикопиемии (гнойного менингита, остеомиелита, язвенно-некротического энтероколита).
В течение первого года жизни нарастание массы и длины тела у недоношенных детей происходит очень интенсивно. Однако по антропометрическим показателям недоношенные дети догоняют рожденных в срок сверстников только к 2-3 годам (иногда к 5-6 годам). Отставание в психомоторном и речевом развитии у недоношенных детей зависит от степени недоношенности и сопутствующей патологии. При благоприятном сценарии развития недоношенного ребенка выравнивание происходит на 2-ом году жизни.
Дальнейшее физическое и психомоторное развитие недоношенных детей может идти наравне со сверстниками или запаздывать.
Среди недоношенных детей чаще, чем среди доношенных сверстников встречаются неврологические нарушения: астено-вегетативный синдром, гидроцефалия, судорожный синдром, вегето-сосудистая дистония, детский церебральный паралич, гиперактивность, функциональная дислалия либо дизартрия. Почти у трети недоношенных детей обнаруживается патология органа зрения – близорукость и астигматизм различной степени выраженности, глаукома, косоглазие, отслойка сетчатки, атрофия зрительного нерва. Недоношенные дети склонны к частым повторным ОРВИ, отитам, на фоне чего может развиваться тугоухость.
Женщины, родившиеся недоношенными, во взрослой жизни часто страдают нарушениями менструального цикла, признаками полового инфантилизма; у них может отмечаться угроза самопроизвольного прерывания беременности и преждевременных родов.
Особенности ухода за недоношенными детьми
Дети, рожденные недоношенными, нуждаются в организации особого ухода. Их поэтапное выхаживание осуществляется специалистами неонатологами и педиатрами сначала в родильном доме, затем в детской больнице и поликлинике. Основными составляющими ухода за недоношенными детьми являются: обеспечение оптимального температурно-влажностного режима, рациональной кислородотерапии и дозированного вскармливания. У недоношенных детей осуществляется постоянный контроль электролитного состава и КОС крови, мониторирование газового состава крови, пульса и АД.
Глубоко недоношенные дети сразу после рождения помещаются в кувезы, где с учетом состояния ребенка поддерживается постоянная температура (32-35°С), влажность (в первые дни около 90%, затем 60-50%), уровень оксигенации (около 30%). Недоношенные дети I-II степени обычно размещаются в кроватках с обогревом или в обычных кроватках в специальных боксах, где поддерживается температура воздуха 24-25°С.
Недоношенные дети, способные самостоятельно поддерживать нормальную температуру тела, достигшие массы тела 2000 г, имеющие хорошую эпителизацию пупочной ранки, могут быть выписаны домой. Второй этап выхаживания в специализированных отделениях детских стационаров показан недоношенным, не достигшим в первые 2 недели массы тела 2000 г, и детям с перинатальной патологией.
Кормление недоношенных детей следует начинать уже в первые часы жизни. Дети с отсутствующим сосательным и глотательным рефлексами получают питание через желудочный зонд; если сосательный рефлекс выражен достаточно, но масса тела менее 1800 г – ребенка вскармливают через соску; дети с массой тела свыше 1800 г могут быть приложены к груди. Кратность кормлений недоношенных детей I-II степени 7-8 раз в сутки; III и IV степени - 10 раз в сутки. Расчет питания производится по специальным формулам.
Диспансеризация недоношенных детей
После выписки дети, рожденные недоношенными, нуждаются в постоянном наблюдении педиатра в течение первого года жизни. Осмотры и антропометрия проводятся еженедельно в первый месяц, 1 раз в две недели – в первом полугодии, 1 раз в месяц - во втором полугодии. На первом месяце жизни недоношенные дети должны быть осмотрены детским хирургом, детским неврологом, детским травматологом-ортопедом, детским кардиологом, детским офтальмологом. В возрасте 1 года детям необходима консультация логопеда и детского психиатра.
С 2-недельного возраста недоношенные дети нуждаются в профилактике железодефицитной анемии и рахита. Профилактические прививки недоношенным детям выполняются по индивидуальному графику. На первом году жизни рекомендуются повторные курсы детского массажа, гимнастики, индивидуальных оздоровительных и закаливающих процедур.
Читайте также:

