Вирусные инфекции в онкогематологии
Обновлено: 01.05.2024
Показания для ПЦР (полимеразной цепной реакции) в гематологии
1. Вирусные инфекции как показание для ПЦР (полимеразной цепной реакции). Вирусы являются важными этиологическими факторами оппортунистических инфекций, возникающих у гематологических больных на фоне вторичного иммунодефицита и агранулоцитоза. Индикация этих вирусов (Herpes simplex, Herpes zoster, Cytomegalovirus и др.) затруднена в связи со сложностями их культивирования.
Внедрение ПЦР позволяет:
1) улучшить диагностику вирусных инфекций;
2) оценивать интенсивность репродукции вирусов в организме, что особенно актуально при лечении герпесвирусных инфекций у больных с вторичным иммунодефицитом (пациенты с острым лейкозом, пациенты после трансплантации костного мозга);
3) изучать роль вирусов как возможных этиологических факторов онкогематологических заболеваний;
4) проводить мониторинг посттрансплантационных лимфопролиферативных заболеваний, вызываемых вирусом Эпштейна-Барр.
Благодаря внедрению ПЦР значительно улучшилось качество HLA-типирования при трансплантации аллогенных гемопоэтических клеток от неродственных доноров: выживаемость пациентов в течение года после миелотрансплантации увеличилась с 10-20% (при традиционном исследовании) до 70-80%. При аутологичной миелотрансплантации ПЦР позволяет выявлять контаминацию трансплантатов опухолевыми клетками и контролировать их очистку.
3. Генетически обусловленные заболевания системы крови как показание для ПЦР (полимеразной цепной реакции). При наследственных заболеваниях системы крови (гемоглобинопатии, врожденные нарушения гемостаза и др.) имеются генетические нарушения, которые могут быть выявлены с помощью ПЦР.
4. Онкогематологические заболевания как показание для ПЦР (полимеразной цепной реакции).

Онкогематология — приоритетная сфера применения ПЦР. Основными задачами в этой области являются:
1) выявление молекулярно-генетических маркеров онкогематологических заболеваний;
2) диагностика множественной лекарственной резистентности;
3) выявление минимальной резидуальной болезни после курса лечения, мониторинг и ранняя диагностика рецидивов заболевания.
Выявление маркеров онкогематологических заболеваний. Изменения в геноме выявляются при большинстве гемобластозов, причем многие нозологические формы характеризуются наличием специфических хромосомных транслокаций. Например, при различных вариантах неходжкинских лимфом закономерно выявляются: транслокации между хромосомами 14 и 18 (В-клеточные фолликулярные лимфомы), между хромосомами 8 и 14 (лимфома Беркитта), между хромосомами 11 и 14 (лимфомы из клеток мантийной зоны), между хромосомами 2 и 5 (анапластические крупноклеточные лимфомы); транслокации с участием хромосомы 3 (диффузные крупноклеточные лимфомы), хромосомы 9 (лимфоплазмоцитарные лимфомы), хромосомы 10 (кожные Т-клеточные лимфомы); трисомия хромосомы 3 (MALT-лимфомы).
Общей закономерностью для онкогенных транслокаций является проксимальное по отношению к точке транслокации расположение онкогена. Различные транслокации сопровождаются активацией определенных онкогенов, которые являются специфичными маркерами конкретных онкогематологических заболеваний. Так, молекулярно-генетической основой онкогенного потенциала транслокации t(14;18), выявляемой у большинства больных В-клеточными лимфомами, является сопоставление гена тяжелой цепи иммуноглобулина в хромосоме 14 с онкогеном bcl-2 в хромосоме 18.
При этом онкоген bcl-2 остается функционально активным, его усиленная экспрессия обнаруживается при ПЦР и является маркером этой группы неходжкинских лимфом.
Из онкогенов, активирующихся при онкогематологических заболеваниях, представляют интерес гены семейств myc и ras, контролирующие клеточный цикл. В частности, одним из признаков опухолевой прогрессии является появление дополнительных хромосомных транслокаций с участием онкогена с-тус.
Важным фактором, способствующим прогрессированию гемобластозов, является изменение экспрессии антионкогена р53. Нарушения структуры и/или экспрессии р53 выявляются практически у всех пациентов с признаками прогрессирования заболевания. В связи с этим ПЦР — метод выбора по сравнению с гистологическими исследованиями, при которых изменения обнаруживаются не более чем у 50% пациентов.
Диагностика множественной лекарственной резистентности. При лечении онкогематологических заболеваний большое значение имеет приобретение злокачественными клетками множественной лекарственной резистентности. До начала химиотерапии данный феномен выявляется у 2-3% больных, при повторных курсах лечения его частота достигает 60-70%. Основную роль в развитии множественной лекарственной резистентности играет ген mdr (multidrug resistance), меньшее значение имеют гены bcl-2 и р53. Изучение экспрессии генов mdr, bcl-2 и р53 с помощью ПЦР позволяет своевременно выявлять пациентов с резистентными к лечению формами онкогематологических заболеваний и корректировать программу лечения.
Выявление минимальной резидуальной болезни, мониторинг и ранняя диагностика рецидивов заболевания. При достижении полной ремиссии лейкозов и лимфом при стандартном обследовании (общий анализ крови, исследование миелограммы, компьютерная томография и т. д.) признаки заболевания отсутствуют, однако в организме остаются опухолевые клетки, количество которых достигает 107-108.
Рутинное цитогенетическое исследование во многих случаях недостаточно чувствительно. Основным методом, позволяющим выявить опухолевые клетки и диагностировать минимальную резидуальную болезнь, является ПЦР, чувствительность которой дает возможность обнаружить одну опухолевую клетку среди 105-106 нормальных. Оценка количества опухолевых клеток при выявлении минимальной резидуальной болезни с помощью ПЦР позволяет проводить мониторинг и прогнозировать рецидив заболевания задолго до появления его клинических признаков и данных лабораторных и инструментальных исследований.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Обзор
Автор
Редактор
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Исследования в области происхождения злокачественных опухолей, ежегодно уносящих миллионы человеческих жизней, ведутся с XIX века. Работая в области молекулярной вирусологии, Вармус совместно с Дж. М. Бишопом в исследованиях 1970-х гг. сделали открытие, которое по-новому осветило долго остававшуюся дискуссионной проблему этиологии опухолей у человека и животных. Согласно полученным результатам, неконтролируемый рост клеток, образующих опухоль, вызывается не только проникающим в клетку извне онковирусом, но и внутренними процессами в самой клетке. Вармус доказал, что нормальные гены роста клетки вследствие случайных спонтанных мутаций под воздействием химических канцерогенов или, порой, процесса старения могут изменять свою молекулярную структуру и таким образом превращаться в протовирусы онкогенной природы. За открытие клеточного происхождения онкогенных протовирусов Вармус совместно с Дж. М. Бишопом в 1989 г. были удостоены Нобелевской премии по физиологии и медицине [1].
Один из самых распространённых вирусов в человеческой популяции — вирус Эпштейна-Барр (рис. 1) — был открыт и описан в 1964 году двумя английскими вирусологами: Майклом Эпштейном и Ивонной Барр. Вирус Эпштейна-Барр (ВЭБ) — член семейства герпесвирусов [6, 7]. В инфицированных клетках вирусная ДНК, как правило, не встроена в клеточный геном, а находится в ядре в виде замкнутого кольца (эписомы). Биологическое значение интеграции ВЭБ в геном клетки остается неясным. Высказываются предположения, что эписомная ДНК необходима для реализации полноценной репликации ВЭБ, завершающейся формированием вирусных частиц [8].

В отличие от многих других герпесвирусов, вирус Эпштейна-Барр поражает в первую очередь эпителиальные клетки ротовой полости, глотки, миндалин. Здесь он размножается наиболее активно, и поэтому главным путём заражения вирусом являются поцелуи (вот и приехали). Наибольшее количество вирусных частиц находится в клетках эпителия около слюнных желез, и со слюной выделяется большое количество их. Не удивительно, что инфекционный мононуклеоз — самое распространённое заболевание, вызываемое вирусом Эпштейна-Барр, — называют ещё болезнью поцелуев [9].
После первой встречи человека с ВЭБ вирус в незначительном количестве сохраняется в организме хозяина в течение всей жизни. Однако если любой элемент иммунного ответа нарушен, даже незначительное количество ВЭБ-инфицированных клеток может преумножиться колоссально [12].
Инфицированные В-клетки могут значительное время находиться в миндалинах, что позволяет вирусу выделяться во внешнюю среду со слюной. С зараженными клетками ВЭБ распространяется по другим органам. В пораженных вирусом клетках возможно два вида развития: литический, приводящий к разрушению клетки-хозяина, и латентный (клетка заражена, но ничего не выдает нахождения вируса), когда число вирусных копий небольшое и клетка не разрушается. ВЭБ может длительно находиться в В-лимфоцитах, эпителии носоглотки и слюнных железах. Кроме того, он способен проникать и в другие клетки: Т-лимфоциты, NK-клетки, макрофаги, нейтрофилы, эпителиоциты сосудов (рис. 2а, 2б) [13].

Злокачественные лимфомы (например, увеличение лимфоузлов), согласно данным Международного агентства по изучению рака, составляют 3–4% среди всех регистрируемых в мире злокачественных новообразований [14]. Лимфомы делят на две основные группы: лимфома Ходжкина (20–30 % всех лимфом) и неходжкинские лимфомы (около 70%) [14, 15].
Неходжикинские лимфомы — это совокупность новообразований, в возникновении которых принимают участие различные агенты [18]. Первая группа — это вирусы, трансформирующие лимфоциты и другие клетки (ВЭБ, HHV-8). Вторая группа представлена факторами различной природы, вызывающими иммунодефицитные состояния. К таким факторам в первую очередь относится ВИЧ (вирус иммунодефицита человека), вызывающий у инфицированного лица подавление иммунитета в результате истощения пула Т-лимфоцитов CD4+ и возникновение СПИДа. В третью группу входят некоторые инфекции, (например, H. pylori), которые увеличивают риск возникновения лимфом на фоне вызываемой ими хронической стимуляции иммунной системы и постоянной активации лимфоцитов [17].
Исследования последних лет свидетельствуют о том, что в патогенезе ВЭБ-ассоциированных патологий чрезвычайно важную роль играет вредный LMP1 — латентный мембранный белок 1, кодируемый одноименным геном (LMP1). Он обладает свойствами онкобелка и функционирует как постоянно активный псевдорецептор. Он способен изменять В-лимфоциты человека [19].
Есть предположение, что аминокислотные замены, накапливающиеся в LMP1, по-видимому, также вносят свой вклад в возникновение опухолей. Механизм этого процесса окончательно не установлен, но предполагается, что усиленный трансформирующий эффект мутированных LMP1 может представлять важную составляющую этого процесса. При этом показано, что различия в последовательности гена LMP1 могут определять агрессивный географически локализованный генотип ВЭБ [21].
Из известных механизмов действия LMP-2 (второй из братьев семейства LMP), расположенного на противоположном конце линейного генома, упоминается лишь способность этих белков совместно повышать сигнальную трансдукцию в ВЭБ (+) клетках [19].
По данным Харальда цур Хаузена, связь между вирусом и раковым заболеванием считается установленной при определении следующих критериев:
- эпидемиологические доказательства того, что вирусная инфекция является фактором риска для развития специфической опухоли;
- присутствие и сохранение генома вируса в клетках опухоли;
- стимуляция пролиферации клеток после введения генома (или его части) вируса в ткани культуры клеток;
- демонстрация того, что геном возбудителя индуцирует пролиферацию и злокачественный фенотип опухоли [19].
Однако канцерогенность ВЭБ далеко не однозначна. Несмотря на то, что кодируемые вирусом продукты способны вызывать пролиферацию инфицированных клеток, ведущую к возникновению лимфом у больных с иммунодефицитом, эти клинически агрессивные опухоли довольно часто поликлональны и подвергаются регрессии при восстановлении иммунного ответа на ВЭБ. Такие опухоли как лимфома Беркитта (ЛБ) и лимфома Ходжкина (ЛХ) встречаются не только в ВЭБ-ассоциированных, но и в ВЭБ-неассоциированных вариантах, что говорит о том, что патогенез этих новообразований связан не только с ВЭБ. Кроме того, злокачественные клетки больных ЛБ и ЛХ отличаются фенотипически от клеток ЛКЛ, полученных под воздействием ВЭБ in vitro, и не экспрессируют ряд белков, необходимых для трансформирующего роста. Эти находки позволяют предположить, что опухолевые клетки могут возникать и под воздействием факторов невирусного происхождения, а также зависеть от различных усиливающих рост клеток стимулов [17].
Лабораторная диагностика ВЭБ-инфекции базируется на цитологическом исследовании крови или костного мозга, серологических исследованиях и ПЦР. С помощью метода ПЦР можно определить ДНК вируса в плазме до клинических проявлений болезни, а репликация вируса в организме является показанием к противовирусной терапии и критерием эффективности проведенного лечения. Материалом для исследования служат слюна или рото- и носоглоточная слизь, соскоб эпителиальных клеток урогенитального тракта, кровь, спинномозговая жидкость, ткани опухоли и костный мозг. Как у больных ВЭБ, так и у носителей может быть получен положительный результат в ПЦР. Поэтому для их дифференцировки проводится количественный ПЦР-анализ для определения количества копий вирусного генома. У маленьких детей (до 1–3-х лет) по причине недостаточно сформированного иммунитета диагностика по антителам затруднительна, поэтому в данной группе пациентов в помощь приходит именно ПЦР. Однако в силу того, что ПЦР-анализ информативен только при размножении (репликации) вируса, то существует и определенный процент ложноотрицательных результатов (до 30%), связанный именно с отсутствием репликации в момент исследования. При этом важно сопоставление результатов клинических, серологических и молекулярных обследований в определении ВЭБ-инфекции, как причины имеющегося заболевания [1].
Специфическая профилактика (вакцинация) против ВЭБ не разработана, но проводятся клинические испытания. Основной проблемой при разработке вакцины является большое отличие в белковом составе вируса на разных фазах его существования. Впрочем, в настоящее время разрабатывается вакцина, которая содержит рекомбинантный поверхностный антиген gp350. После вакцинации первичная инфекция протекает субклинически, но собственно инфицирование человека не предупреждается. Кроме того, вырабатывающиеся нейтрализующие антитела не влияют на течение различных форм латентной инфекции, в том числе опухолей. Профилактические меры сводятся к укреплению иммунитета, закаливанию детей, мерам предосторожности при появлении больного в окружении, соблюдение правил личной гигиены.
Заключение
Широкое распространение ВЭБ с выраженным трансформирующим потенциалом среди населения планеты и редкого возникновения в инфицированной популяции связанных с этим вирусом опухолей с преимущественной их локализацией в определенных географических регионах позволяет сделать важный вывод. Подобно большинству опухолей иной вирусной природы, в патогенезе ВЭБ-ассоциированных новообразований важную роль играют дополнительные факторы, и одного ВЭБ недостаточно для возникновения опухоли. ВЭБ лишь инициирует пролиферацию инфицированных им клеток, а последующие события влияют на гистопатологический спектр возникающих неоплазий. Одним из важнейших факторов, в значительной степени определяющих возникновение ВЭБ-ассоциированных опухолей, служит выраженная иммуносупрессия (врожденная, ятрогенная или индуцированная любой вирусной инфекцией, и в первую очередь ВИЧ), приводящая к утрате функции иммунного распознавания клеток, инфицированных ВЭБ.
Таким образом, несмотря на многолетнее изучение связи ВЭБ с опухолями человека, вопрос о роли вируса в их возникновении до конца не изучен. Раскрытие механизма злокачественной трансформации вирусом, персистирующим в латентном состоянии более чем у 90% населения планеты, — задача чрезвычайно сложная. Однако технические достижения последних лет, существенно повысившие специфичность исследований, позволяют надеяться, что детали ВЭБ-ассоциированного канцерогенеза будут выяснены.

Обзор
Онколитические вирусы — новая стратегия лечения рака
рисунок автора статьи
Автор
Редакторы

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Во благо, не во вред

рисунок автора статьи

Рисунок 2. Схема действия онколитического вируса. Онколитический вирус инфицирует опухолевую клетку, а затем размножается в ней. В итоге это приводит к уничтожению опухолевой клетки, что привлекает внимание иммунных клеток. При этом онколитический вирус не трогает здоровую клетку.
рисунок автора статьи
Случайное не случайно
Немалое количество научных открытий, изменивших мир, произошло по счастливой неслучайности. Падение яблока около Ньютона подарило миру понятие о гравитации, а открытое окно в лаборатории Флеминга — антибиотики. Так, еще в 1897 году врач в Мичигане отметил, что одна из пациенток с лейкемией вышла в долгую ремиссию после того, как переболела гриппом. А в 1971 году в Уганде ребенок, больной лимфомой, излечился от рака, когда заболел корью. С конца 1990-х ученые уже в лабораторных экспериментах стали наблюдать, что обычные вирусы способны уничтожать раковые клетки. С тех пор начались попытки приручить дикие вирусы и заставить их работать для лечения рака.
Первый онколитический препарат на основе вируса герпеса, талимоген лагерпарепвек (T-VEC), был одобрен уже в 2015 году для неоперабельных пациентов с поздней стадией меланомы. Этот препарат представляет собой генетически модифицированный вирус простого герпеса I типа. Для безопасного использования препарата с помощью генной инженерии из вируса убрали белки, мешающие иммунитету распознавать инфекцию. За 49 месяцев наблюдения 17% пациентов полностью ответили на терапию [13], то есть у них не осталось никакого следа от опухоли. Для клинического испытания в онкологии это впечатляющий результат. Что еще важнее, среди полностью ответивших на терапию был очень высокий процент выживаемости — по расчетам, 88,5% остались живы спустя 5 лет после терапии (рис. 3).

Рисунок 3. График Каплана—Мейера показывает общую выживаемость пациентов с меланомой, которые полностью ответили (красный) или ответили не полностью (синий) на терапию онколитическим вирусом после девяти месяцев от начала исследования. Вертикальная координата показывает процент пациентов, оставшихся в живых. Горизонтальная — месяцы спустя терапии. Из графика ясно видно, что две кривые, красная и синяя, расходятся. При этом красная кривая даже спустя 55 месяцев остается на высоком уровне, что говорит о высокой выживаемость пациентов, которые ответили на терапию онколитическим вирусом.
Как это работает?
Праздновать победу рано
На протяжении прошлого века оценка вирусотерапии напоминала американские горки: от неистового восторга надежды до полного разочарования. Изначально эксперименты с дикими вирусами на людях в 1950-х годах были довольно опасными и почти убили интерес к вирусной терапии. Из-за невозможности тогда контролировать способность вирусов избегать иммунного ответа и размножаться, начальные эксперименты приводили к серьезным нежелательным инфекциям. К счастью, изобретение полимеразной цепной реакции (ПЦР) [18] и открытие генной рекомбинации в 1980-х позволило сделать использование вирусов более безопасным для людей. Генная рекомбинация позволила создавать онколитические вирусы, более избирательно поражающие опухолевые клетки и способные лучше вызывать иммунный ответ.
К сожалению, эффект онколитических вирусов может быть временным из-за роста раковых клеткой, которые вирус изначально не инфицировал. Клинические испытания показывают, что лишь небольшой процент пациентов полностью отвечают на терапию существующими онколитическими вирусами.
Уже ясно, что не все виды опухолей отвечают на онколитическую вирусную терапию. Наибольшего успеха удалось добиться в лечении меланомы и опухолей желудочно-кишечного тракта [9]. Ученым еще предстоит научиться персонализировать вирусную онколитическую терапию — подбирать вирусы для конкретного пациента и его опухоли с индивидуальным набором молекулярных черт.
Будущее онколитической вирусной терапии
Современная противоопухолевая медикаментозная терапия стоит на трех китах: химиотерапия, таргетная и иммунотерапия. Главная цель любой из них — убить раковые клетки, но не трогать здоровые. Каждая разновидность лечения справляется с этой задачей с разной долей успеха. Препараты, которые, в отличие от химиотерапии, избегают угнетения иммунитета и, наоборот, усиливают собственный противоопухолевый иммунитет человека, стали новой надеждой терапии рака. Оказалось, что вирусы способны вызывать такой противоопухолевый ответ. В отличие от таргетной терапии, мишень которой — определенная генетическая мутация, вирусная терапия эффективна против раковых клеток с разным набором генетических изменений. Эти качества однозначно делают онколитическую терапию привлекательной. Более того, доклинические исследования показывают, что лучевая и химиотерапия могут синергично работать вместе с вирусной терапией, улучшая результаты одиночной работы [19], [20].
Пожалуй, самой перспективной комбинацией с точки зрения эффективности станет комбинация онколитических вирусов и ингибиторов контрольных точек иммунного ответа или других новых иммуномодулирующих препаратов. Ингибиторы контрольных точек иммунного ответа — это препараты, которые убирают тормоза иммунного ответа, заставляя их вновь уничтожать врага. Комбинация таких препаратов с вирусной терапией может значительно повысить эффективность иммунного надзора: полицейские будут знать все фотороботы врагов и без всяких тормозов будут отлавливать и уничтожать их.
Так, посмотрев на обе стороны медали, можно перестать видеть в вирусах исключительно врагов и разглядеть в них возможного союзника в борьбе против рака.
Вирусные болезни как причина онкологических заболеваний - рака

Вирусные инфекции ответственны за развитие примерно 10-15% всех онкологических заболеваний у человека. Значимость вирусных инфекций в онкологии значительно возросла с возникновением эпидемии синдрома приобретенного иммунодефицита (СПИД), так как при этом заболевании смертность от рака преобладает в общем числе смертных случаев.
Механизмы вирус-индуцированного канцерогенеза будут обсуждаться в отдельной статье на сайте. Среди вирусов, наиболее часто ассоциируемых с онкологическими заболеваниями, находятся вирус Эпштейна-Барра (ВЭБ), герпесвирус саркомы Капоши ((ГСК) или герпесвирус человека серотипа 8 (ГВЧ8)) и вирус человеческой папилломы. Вирус ВЭБ вызывает лимфому Беркита и рак носоглоточной полости у небольшого процента зараженных им людей.
Лимфома наиболее часто встречается в районах Африки, прилегающих к пустыне Сахара, и в районах с эндемическими очагами малярии. Распространение саркомы Капоши также в основном характерно для близлежащим к Сахаре регионов и в большой степени этому заболеванию подвержены евреи, проживающие в средиземноморском регионе. Известно, что инфицированность ГВЧ8 тесно связана с риском развития саркомы в ходе течения связанных со СПИДом заболеваний.
ГВЧ8 также увеличивает риск развития многоцентровой болезни Каслемана и первичной эффузионной лимфомы. У жителей Италии и Северной Африки отмечается повышенное в сравнении с жителями Великобритании или США содержание антител к вирусу ГВЧ8 (ГСК).
Существенным фактором риска при развитии рака шейки матки являются папилломавирусы. Среди более 100 разновидностей этих вирусов наибольшую опасность представляют серотипы 16, 18, 31 и 33 (несколько менее опасны серотипы 6 и 11).
Рак могут вызывать и представители семейства ретровирусов. Наиболее общеизвестный пример — вирус Т-клеточной лейкемии, серотип 1 (ВТКЛ-1) который является эндемической инфекцией в южной Японии и на Карибском море. У жителей этих регионов опухоли развиваются только у незначительной части инфицированных. Вирус может передаваться от матери к ребенку во время беременности через плаценту, а также с молоком при кормлении. Возможна передача вируса через сперму.
ДНК-Содержащий вирус гепатита В передается через кровь или при половых контактах и вызывает гепатит и цирроз печени. Среди людей, пораженных таким вирусом, печеночно-клеточная карцинома встречается в 100 раз чаще, чем у неинфици-рованных. РНК-Содержащий вирус гепатита С также вызывает хронический гепатит и значительно повышает риск заболеваемости печеночно-клеточной карциномой.
Оба вируса широко распространены по всему миру, но особенно часто встречаются у жителей Китая и Тайваня, а также среди лиц, принимающих наркотики внутривенно. Эти два вируса являются основной причиной смертности от заболеваний раком печени.
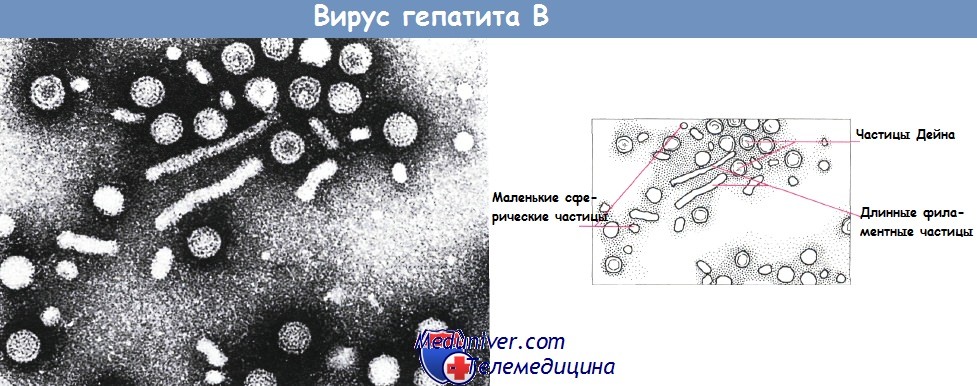
Электронная микрофотография вируса гепатита В.
На срезе видны мелкие сферические частицы с диаметром 28 нм (HBsAg); более крупные сферические двумембранные частицы Дейна (42 нм), продолговатые филаментозные частицы.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Гематологи ГКБ №52 первыми в России начали лечить онкогематологических больных с COVID-19. О том, как помогают таким пациентам в 52-й больнице, рассказывает руководитель гематологической службы Мисюрина Елена Николаевна.
Когда вы приняли первых пациентов с коронавирусом?
- В марте 2020 года появились первые пациенты, страдающие онкогематологическими заболеваниями и к тому же заразившиеся коронавирусной инфекцией. Все онкогематологические пациенты Москвы с COVID-19 были направлены на госпитализацию в ГКБ №52. На конец мая у нас было пролечено более 300 онкогематологических пациенов с COVID-19.
Каковы особенности течения коронавирусной инфекции у этой группы пациентов?
- Пациенты с онкогематологическими заболеваниями являются самыми уязвимыми для COVID-19. Вирусная инфекция COVID-19 является серьезной угрозой здоровью человека, а для пациентов онкогематологического профиля риски увеличиваются в десятки раз. Все наши пациенты находятся на разных этапах циклического лечения (после высокодозных курсов химиотерапии, до начала химиотерапии, пациенты с хроническими заболеваниями, которые находятся на постоянной химиотерапии), и это состояние отнюдь не прибавляет им сил сопротивляться инфекции.
Так, мы столкнулись с очень серьезной проблемой для пациентов с первые выявленными гемобластозами, когда на фоне COVID-19 по витальным показаниям нужно начинать химиотерапию. Например, поступила молодая пациентка с впервые выявленным острым миелоидным лейкозом с лейкоцитами 300 *109, а у нее еще к тому же выявлен COVID-19. Или молодой пациент с COVID-19 и впервые выявленным острым промиелоцитарным лейкозом, который нужно срочно лечить. Или переводят пациента после высокодозной химиотерапии в агранулоцитозе и COVID-19 пневмонией. Отдельная группа пациентов – это пациенты после проведенной трансплантации костного мозга. И как в этих ситуациях поступать? Никаких рекомендаций и алгоритмов для онкогематологических больных ни международных, ни российских нет! В общем, мы оказались на передовой.
- Нам очень помогли наши внутрибольничные протоколы для лечения обычных пациентов с COVID-19, доступность в больнице всех необходимых лекарственных препаратов. Все это позволило адаптировать существующие методики лечения коронавирусной пневмонии для онкогематологических пациентов с COVID-19. Конечно, к каждому пациенту вырабатывался инивидуальный подход, каждый пациент обсуждался коллегиально, принималось решение о необходимости, целесообразности назначения противовирусной терапии, терапии для подавления цитокинового шторма на фоне глубокого агранулоцитоза. Можно сказать, мы стали первопроходцами в вопросах лечения онкогематологических больных с COVID-19. Все решения были и будут очень непростыми. На сегодняшний день уже появились свои первые наработки, понимание, “ощущение” того, как протекает COVID-19 у пациентов с разными гематологическими заболеваниями (лейкозами, злокачественными лимфомами, миеломами, миелодиспластическим синдромом, хроническими миелопролиферативными заболеваниями, хроническим лимфолейкозом и анемиями).
А как ведет себя иммунитет у таких пациентов? Как они сопротивляются вирусу?
Читайте также:

