Вирусные супрессоры рнк интерференции
Обновлено: 19.04.2024

Механизм РНК-интерференции очень древний. Скорее всего, биологическая эволюция создала его более миллиарда лет назад. С его помощью они получили возможность защищаться от нападений вирусов. Позже эту способность у них переняли далекие потомки, грибки и растения, а потом и животные. Многоклеточные организмы также научились прицельно отключать с помощью РНК-интерференции свои собственные гены, прерывая процесс синтеза кодируемых ими белков.
Малые РНК, состоящие всего из нескольких десятков нуклеотидов, могли показаться просто мусором, остатками от своих "больших братьев". И даже несмотря на то, что роль отдельных малых молекул РНК в процессах превращения информационных РНК (сплайсинге), а также при упаковке нитей нуклеиновых кислот, была доказана ранее, истинным "хитом" в биологии малые РНК стали только лишь с открытием своей способности подавлять экспрессию генов у животных [1].
Ключевые этапы РНК интерференций. В нормально работающей клетке каждый ген выполняет собственную, строго определенную функцию, например, отвечает за выработку белка, мРНК, или за взаимодействие с другими регуляторными белками. При этом говорят о нормальной экспрессии (от лат. expressus - выразительный, явный) гена в клетке. Если же количество продукта данного гена (например, белка) снижается, то говорят о снижении экспрессии данного гена. Эффект "гашения" экспрессии определенных генов малыми РНК и получил название РНК-интерференции, а молекулы, вызывающие его, назвали siRNA (small interfering RiboNucleic Acids - малые интерферирующие рибонуклеиновые кислоты) [3]
Bernstein с соавторами изучили потенциальную возможность участия нескольких белков дрозофилы, содержащих домены РНКазыIII и dsRBD, в процессинге двухцепочечной РНК на siRNA ( Bernstein et al. 2001 ). Оказалось, что очищенный после экспрессии в E.coli белок, содержащий кроме доменов РНКазыIII и dsRBD еще и РНК-хеликазный- и PAZ-домены, способен к расщеплению двухцепочечной РНК на короткие 21-22 нуклеотидные РНК, в то время как другие белки не обладают такой активностью. Соответствующий ген был назван Dicer (от английского резать на мелкие кусочки). Введение в бесклеточную систему антител, полученных против DICER , ингибирует активность, необходимую для процессинга двухцепочечной РНК. Сейчас известно, что белок Dicer одним из своих доменов может “заякорить” конец молекулы дцРНК, при этом другой домен, находящийся на расстоянии в 20-25 пар нуклеотидов, производит разрывы в обеих цепях дцРНК. Таким образом, Dicer действует как “молекулярная линейка”, безошибочно отмеряющая и штампующая короткие дцРНК с заданным размером и определенными структурными особенностями. Затем Dicer передает короткие РНК другим комплексам, содержащим белки семейства Argonaute *. На следующем этапе происходит расплетание дуплекса коротких РНК, одна из цепей которого обнаруживает в клетке комплементарные ей молекулы РНК (мишени), в результате чего белок Argonaute катализирует подавление их экспрессии. На данный момент известно несколько молекулярных механизмов, с помощью которых может подавляться экспрессия мишеней при РНК-интерференции: белок Argonaute обладает способностью разрезать РНК-мишень, а также блокировать трансляцию матричной РНК. Кроме того, в некоторых случаях комплексы коротких РНК с белками Argonaute могут подавлять непосредственно транскрипцию (синтез РНК) гена-мишени в клеточном ядре.
Белки Argonaute также участвуют в образовании и регуляции активности микроРНК. Ago2 разрезает пре-микроРНК и образует дополнительный предшественник (ac-pre-miRNA); [4] 2) Ago2 также входит в RISC и опосредует связывание микроРНК с 3'НТР, соответствующей мРНК и ингибирует трансляцию (в некоторых случаях - вызывает деаденилирование и деградацию мРНК). Ago2 взаимодействует с TRBP и Dicer (который процессирует пре-миРНК в миРНК) и образует вместе с ними тройной комплекс, который также связывает миРНК, на базе которого происходит дальнейшая сборка RISC путём присоединения других белков [4]
Семейство белков Argonaute представлено среди эукариот, некоторых архей и даже бактерий, например, Aquifex aeolicus. На основании сравнения геномов, семейство Argonaute, по-видимому, произошло от ферментов инициации трансляции.
Итак, суть РНК-интерференции заключается в ингибировании одноцепочечных молекул РНК, несущих информацию о структуре гена, после присоединения к ним siRNA - малых двухцепочечных РНК, циркулирующих в цитоплазме клетки.
1. Fire, A., Xu, S., Montgomery, M. K., Kostas, S. A., Driver, S. E., and Mello, C. C. (1998) Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature 391, 806-811.
3. Ding, S. W., and Voinnet, O. (2007) Antiviral immunity directed by small RNAs. Cell 130, 413-426.

Обзор
Автор
Редакторы
Ещё двадцать лет назад молекулярная биология не знала такого удивительного феномена, как РНК-интерференция. Сегодня же у учёных не вызывает сомнения, что это явление принимает участие в широчайшем спектре физиологических процессов у всех живых существ, а её молекулярные посредники — короткие РНК — по разнообразию и специфичности не уступают антителам крови. У простейших РНК-интерференция обеспечивает иммунитет, в частности — защиту от вирусов. У более развитых организмов этот механизм включается в борьбу не только (и не столько) с внешними, но и с внутригеномными паразитами, а также становится важнейшим регулятором активности генов. На сегодняшний день идентифицированы уже тысячи коротких регуляторных РНК, а механизм РНК-интерференции изучен очень подробно, однако бесспорно и то, что мы наблюдаем пока только верхушку этого айсберга.
Принцип РНК-интерференции
Основы РНК-интерференции

Рисунок 1. РНК-интерференция
Игрок № 1 — короткие интерферирующие РНК
Короткие интерферирующие РНК
| Мишень (мРНК) | -AТCGUACGCGG*AAUACUUCGAUU- |
| Смысловая киРНК | CGUACGCGG AAUACUUCGAUU-3′ |
| Анти-смысловая киРНК | 3′-UUGCAUGCGCC*UUAUGAAGCU-5′ |
Игрок № 2 — микроРНК
По мере усложнения генома микроРНК и пиРНК принимали всё большее участие в регуляции транскрипции и трансляции. Со временем, они превратились в дополнительную, точную и тонкую систему регуляции генома. В отличие от киРНК, микроРНК и пиРНК (открыты в 2001 году, см. врезку 3) не производятся из чужеродных двуцепочечных молекул РНК, а изначально закодированы в геноме организма-хозяина [8].
Встречайте: микроРНК


Рисунок 4. Общий механизм процессинга микроРНК и реализации её активности.
Механизм действия многих микроРНК аналогичен действию киРНК: короткая (21–25 нуклеотидов) одноцепочечная РНК в составе белкового комплекса RISC с высокой специфичностью связывается с комплементарным участком в 3′-нетранслируемой области мРНК-мишени. Связывание приводит к расщеплению мРНК белком Ago. Однако активность микроРНК (по сравнению с киРНК) уже более дифференцирована — если комплементарность не абсолютная, целевая мРНК может не деградировать, а только обратимо блокироваться (трансляции не будет). Тот же RISC-комплекс может использовать и искусственно введённые киРНК. Это объясняет, почему киРНК, сделанные по аналогии с простейшими, активны и у млекопитающих.
Таким образом, мы можем дополнить иллюстрацию механизма действия РНК-интерференции у высших (билатерально-симметричных) организмов, объединив на одном рисунке схему действия микроРНК и биотехнологически введённых киРНК (рис. 5).
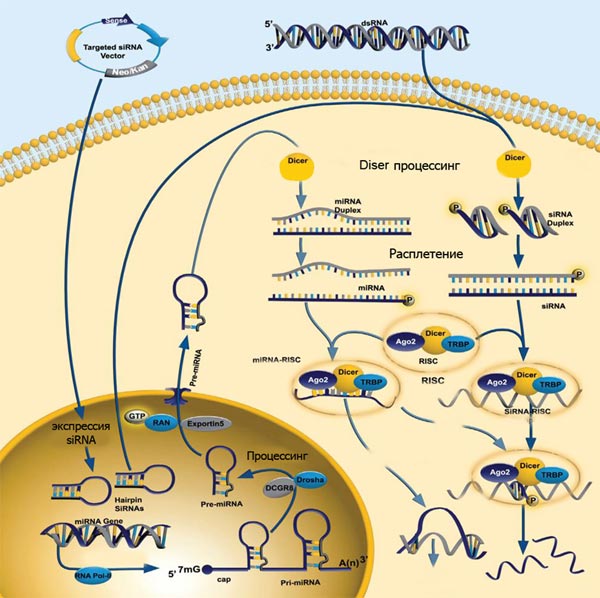
Рисунок 5. Обобщённая схема действия искусственных микроРНК и киРНК (искусственные киРНК вводятся в клетку с помощью специализированных плазмид — targeting siRNA vector).
Функции микроРНК
До недавнего времени считалось, что микроРНК только подавляют — полностью или частично — работу генов. Однако недавно оказалось: действие микроРНК может кардинально отличаться в зависимости от состояния клетки! В активно делящейся клетке микроРНК, связавшись с комплементарной последовательностью в 3′-участке мРНК, ингибирует синтез белка (трансляцию). Однако в состоянии покоя или стресса (например, при росте на бедной среде) то же самое событие приводит к прямо противоположному эффекту — усилению синтеза целевого белка [11]!
Эволюция микроРНК
Количество разновидностей микроРНК у высших организмов ещё до конца не установлено — по некоторым данным, оно превосходит 1% от числа белок-кодирующих генов (у человека, например, говорят о 700 микроРНК, и это число постоянно растет). микроРНК регулируют активность около 30% всех генов (мишени для многих из них пока не известны), причём существуют как повсеместно распространённые, так и тканеспецифичные молекулы — например, один такой важный пул микроРНК регулирует созревание стволовых клеток крови.
Широкий профиль экспрессии в разных тканях разных организмов и биологическая распространённость микроРНК говорит об эволюционно древнем происхождении. Впервые микроРНК обнаружили у нематод, и долгое время потом считали, что эти молекулы появляются лишь у губок и кишечнополостных; однако позже их открыли и в одноклеточных водорослях [11]. Интересно, что по мере усложнения организмов увеличивается также количество и гетерогенность пула микроРНК. Это косвенно свидетельствует о том, что сложность этих организмов обеспечивается, в частности, функционированием микроРНК [12]. Возможная эволюция микроРНК показана на рисунке 6.

Рисунок 6. Многообразие микроРНК у разных организмов. Чем выше организация организма, тем больше у него обнаруживается микроРНК (число в скобках). Красным выделены виды, у которых обнаружены единичные микроРНК.
Между киРНК и микроРНК можно провести чёткую эволюционную связь, опираясь на следующие факты:
Чем дальше, тем запутанней. Игрок № 3 — пиРНК
Однако в процессе эволюции природа создала ещё одну, эволюционно самую позднюю и узкоспециализированную систему на основе всё того же удачного принципа РНК-интерференции. Речь идет пиРНК (piRNA, от Piwi-interaction RNA).
Количество МГЭ нелинейно увеличивается с размером генома, и их активность необходимо сдерживать. Для этого животные, уже начиная с кишечнополостных, используют всё тот же феномен РНК-интерференции. Эту функцию также выполняют короткие РНК, однако не те, о которых речь уже шла, а третий их тип — пиРНК.
пиРНК — короткие молекулы длиной в 24–30 нуклеотидов, закодированные в центромерных и теломерных областях хромосомы. Последовательности многих из них комплементарны известным мобильным генетическим элементам, однако есть множество других пиРНК, совпадающих с участками рабочих генов или с фрагментами генома, функции которых неизвестны.
пиРНК (также как и микроРНК) закодированы в обеих цепях геномной ДНК; они весьма изменчивы и разнообразны (до 500 000 (!) видов в одном организме). В отличие от киРНК и микроРНК, они образуются одной цепью с характерной особенностью — урацилом (U) на 5′-конце и метилированным 3′-концом. Есть и другие отличия:
- В отличие от киРНК и микроРНК, они не требуют процессинга Dicer’ом.
- Гены пиРНК активны только в зародышевых клетках (во время эмбриогенеза) и окружающих их эндотелиальных клетках.
- Белковый состав системы пиРНК иной — это эндонуклеазы класса Piwi (Piwi и Aub) и отдельная разновидность Argonaute — Ago3.
Процессинг и активность пиРНК пока достаточно плохо изучены, но уже ясно, что механизм действия совершенно отличается от других коротких РНК — сегодня предложена пинг-понг модель их работы (рис. 7 и 8).

Рисунок 7. Цитоплазматическая часть процессинга пиРНК. Биогенез и активность пиРНК опосредуется семейством эндонуклеаз Piwi (Ago3, Aub, Piwi). Активность пиРНК обеспечивается обеими одноцепочечными молекулами пиРНК — смысловой и анти-смысловой, — каждая из которых ассоциирует со специфической эндонуклеазой Piwi. пиРНК узнает комплементарный участок мРНК транспозона (синяя цепь) и вырезает его. Это не только инактивирует транспозон, но и создает новую пиРНК (связанную с Ago3 с помощью метилирования метилазой Hen1 3′-конца). Такая пиРНК, в свою очередь, узнаёт мРНК с транскриптами кластера предшественников пиРНК (красная цепь) — таким способом цикл замыкается и снова вырабатывается нужная пиРНК.

Рисунок 8. пиРНК в ядре. Кроме эндонуклеазы Aub, антисмысловую пиРНК может связывать и эндонуклеаза Piwi. После связывания комплекс мигрирует в ядро, где вызывает деградацию комплементарных транскриптов и перестройку хроматина, вызывающую подавление активности транспозонов.
Функции пиРНК
Главная функция пиРНК — подавление активности МГЭ на уровне транскрипции и трансляции. Считается, что пиРНК активны только во время эмбриогенеза, когда непредсказуемые перетасовки генома особенно опасны и могут привести к гибели зародыша. Это логично — когда иммунная система ещё не заработала, клетки эмбриона нуждаются в какой-нибудь простой, но действенной защите. От внешних патогенов эмбрион надежно защищен плацентой (или оболочкой яйца). Но кроме этого необходима оборона и от эндогенных (внутренних) вирусов, — в первую очередь МГЭ.
Распространение и эволюция пиРНК
У высших животных — в том числе и человека — система пиРНК развита очень хорошо, но встретить её можно только в эмбриональных клетках и в околоплодном эндотелии. Почему распространение пиРНК в организме столь ограничено — ещё предстоит узнать. Можно предположить, что, как и любое мощное оружие, пиРНК приносит пользу только в очень специфических условиях (во время развития плода), а во взрослом организме их активность нанесёт больше вреда, чем пользы. Все-таки, число пиРНК на порядок превосходит количество известных белков — и неспецифические эффекты пиРНК в зрелых клетках сложно предсказать.
| киРНК | микроРНК | пиРНК | |
|---|---|---|---|
| Распространение | Растения, Drosophila, C. elegans. Не найдено у позвоночных | Эукариоты | Эмбриональные клетки животных (начиная с кишечнополостных). Нет у простейших и растений |
| Длина | 21–22 нуклеотидов | 19–25 нуклеотидов | 24–30 нуклеотидов |
| Структура | Двуцепочечная, по 19 комплементарных нуклеотидов и два неспаренных нуклеотида на 3′-конце | Одноцепочечная сложная структура | Одноцепочечная сложная структура. U на 5′-конце, 2’-O-метилированный 3′-конец |
| Процессинг | Dicer-зависимый | Dicer-зависимый | Dicer-независимый |
| Эндонуклеазы | Ago2 | Ago1, Ago2 | Ago3, Piwi, Aub |
| Активность | Деградация комплементарных мРНК, ацетилирование геномной ДНК | Деградация или ингибирование трансляции целевой мРНК | Деградация мРНК, кодирующих МГЭ, регуляция транскрипции МГЭ |
| Биологическая роль | Антивирусная иммунная защита, подавление активности собственных генов | Регуляция активности генов | Подавление активности МГЭ во время эмбриогенеза |
Заключение
В заключение хочется привести таблицу, иллюстрирующую эволюцию белкового аппарата, участвующего в РНК-интерференции (рис. 9). Видно, что у простейших наиболее развита система киРНК (белковые семейства Ago, Dicer), а с усложнением организмов акцент переносится на более специализированные системы — увеличивается число изоформ белков для микроРНК (Drosha, Pasha) и пиРНК (Piwi, Hen1). При этом разнообразие ферментов, опосредующих действие киРНК, уменьшается.

Рисунок 9. Многообразие белков, участвующих в РНК-интерференции (цифры обозначают количество белков каждой группы). Синим цветом подсвечены элементы, характерные для киРНК и микроРНК, а красным — белки, связанные с пиРНК.

Новость
Подавление экспрессии мутантного гена TTR, вызывающего семейную амилоидную полинейропатию: РНК-индуцируемый комплекс выключения гена (RISC) совместно с интерферирующей РНК (siRNA) бесстрашно летит навстречу злобной патогенной мРНК-мишени, предвкушая расправу.
иллюстрация авторов статьи
Авторы
Редакторы

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
Семейная амилоидная полинейропатия (FAP), или наследственный транстиретиновый амилоидоз (hATTR), связана с различными точечными мутациями в гене, кодирующем транстиретин (TTR). В норме он вырабатывается гепатоцитами и осуществляет транспорт витамина А вместе с тиреоидными гормонами к периферическим тканям. Определенные мутации способствуют тому, что мономеры этого белка неправильно сворачиваются и образуют аморфные олигомеры, которые сливаются в фибриллы (рис. 1). По некоторым данным, именно небольшие олигомеры обладают наибольшей токсичностью в клетках [2].

Рисунок 1. Синтез мутантного варианта транстиретина и влияние на этот процесс патисирана. Без лечения мРНК TTR транслируется в белок, который в норме состоит из четырех субъединиц. Мутантные мономеры белка сворачиваются неправильным образом и образуют аморфные олигомеры, кластеры нефиксированного размера, сливающиеся в фибриллы. Образование фибрилл может привести к развитию нейродегенеративных заболеваний и проблемам с сердечно-сосудистой системой.
На начальных стадиях заболевания фибриллы накапливаются в периферической нервной системе, вызывая прогрессирующую полинейропатию. Пациент чувствует мышечную слабость, онемение, боль, позднее происходит иммобилизация. На терминальных стадиях амилоиды препятствуют работе почек и сердца. Насчитывается более 120 амилоидогенных мутаций, определяющих различный характер проявлений наследственного транстиретинового амилоидоза (рис. 2). Заболевание проявляется в среднем возрасте, неумолимо прогрессирует и вызывает смерть через 5–10 лет [3]. К счастью, в мире им страдают лишь около 50 000 человек [4]. По данным Комитета по лекарственным средствам для орфанных заболеваний (COMP), в Европейском союзе частота встречаемости транстиретинового амилоидоза составляет 0,2 на 10 000 человек.

Рисунок 2. Связь генотипа с клиническими проявлениями при транстиретиновом амилоидозе (hATTR). До появления патисирана спасением для таких пациентов являлась трансплантация печени. В Европе также используют препарат тафамидис, который стабилизирует транстиретин. Он связывается с тетрамером и не дает ему диссоциировать на мономеры. Однако в США он так и не смог получить одобрение [5].
А вот один из молекулярных механизмов эукариот уже подарил нам первое лекарство и надежду на лечение огромного спектра заболеваний. Попробуем разобраться в тернистом двадцатилетнем пути с момента открытия РНК-интерференции до первого официально одобренного FDA (Food and Drug Administration, Управление США по контролю за лекарствами и пищевыми продуктами) препарата.
Воздействовать на белок мы можем принципиально тремя способами. Можно придумать молекулу, которая будет связываться с уже синтезированным белком, препятствуя его работе, или, напротив, побуждая его к действию. Так работает большинство лекарств, например, известный анальгетик и жаропонижающее средство ибупрофен ингибирует фермент циклооксигеназу (ЦОГ), уменьшая выработку простагландинов — веществ, ответственных за воспаление [20].
Но ученые мечтают о новых возможностях: о выключении таргетного гена, вызывающего генетическое заболевание, на уровне ДНК (нокаут) и о выключении без затрагивания самой последовательности ДНК на уровне РНК (нокдаун).

Рисунок 3. Центральная догма молекулярной биологии. Генетическая информация, закодированная в ДНК, переходит в мРНК, и уже с нее синтезируется полипептидная последовательность. Нуклеотиды одной цепочки нуклеиновой кислоты могут быть соединены с нуклеотидами другой по правилу комплементарности. В процессе транскрипции синтезируется смысловая цепь мРНК, и, зная ее последовательность, мы можем синтезировать комплементарную ей цепочку, или антисмысловую цепь.
Pearson Education, Inc., publishing as Benjamin Cummings
Процесс начинается с того, что поступившая в клетку экзогенная двухцепочечная РНК связывается с рибонуклеазой Dicer (да-да, как та самая овощерезка), которая нарезает ее на небольшие фрагменты длиной 20–25 пар нуклеотидов, с двумя неспаренными основаниями на каждом конце. Такая длина, видимо, оказалась оптимальной для специфического связывания с мишенью. Эти фрагменты взаимодействуют с белковым комплексом RISC, который отщепляет одну из цепей РНК, оставляя вторую на съедение нуклеазам (ферментам, расщепляющим нуклеиновые кислоты), и путешествует с ней по клетке в поисках таргетной мРНК. Обнаружив ее, белок Аргонавт из комплекса RISC разрезает свою мишень (рис. 1 и 4).

Рисунок 4. РНК-интерференция. Сверху представлена схема строения малой интерферирующей РНК (siRNA). Экзогенная двухцепочечная РНК разрезается ферментом Dicer и встраивается, расплетаясь, в белковый комплекс RISC. Готовый к работе, совместно с siRNA, он путешествует по клетке. При встрече с комплементарной мРНК комплекс индуцирует ее деградацию. Таким образом, клетка уничтожает потенциально вирусную РНК, препятствуя синтезу вирусных белков, а также борется с транспозонами.
Этот механизм выполняет защитную функцию против вирусов, которые стремятся заполучить контроль над клеткой, предоставляя ее белковой машинерии инструкции по производству вирусных агентов. Также интерферирующие РНК могут быть полезны клетке в борьбе с мобильными генетическими элементами, которые активируются при делении клетки и нарушают нормальную работу ее генетического аппарата.
Также стоит отметить, что РНК-интерференция является не единственным механизмом регуляции экспрессии генов. Для трансляции необходимо, чтобы мРНК была одноцепочечной, поэтому при попадании одноцепочечной антисмысловой РНК в клетку блокируется процесс синтеза белка, а также активируется РНКаза H, разрушающая транскрипт.
В каких случаях мы можем использовать этот изящный механизм?
Проблема с применением большинства таких методов для лечения человека заключается в низкой селективности редактирования, что может вносить дополнительные мутации в геном. Клетки могут перерождаться в раковые, уходить в апоптоз. Данные побочные действия затрудняют применение описанных подходов для лечения генетических заболеваний человека.
Всего этого можно избежать, выключая гены с помощью РНК-интерференции. Очень перспективна разработка антивирусных лекарств, препятствующих связыванию вирусных белков с таргетной клеткой, а также противоопухолевых препаратов.
Так что же останавливало ученых в реализации этой простой идеи?
Все, кто работал в лаборатории с РНК, знают ее коварство: она быстро деградирует под действием РНКаз, находящихся на поверхности кожи, в слюне, и в большом количестве в кровяном русле. Получается, что препарат просто не успевает добраться до нужных клеток, гены которых необходимо выключить с помощью RNAi.
После долгих и дорогостоящих попыток фармкомпании практически потеряли надежду на терапевтическое применение этого механизма. Однако решение было найдено [13]. Сегодня у одной только компании Alnylam известно семь препаратов на основе РНК-интерференции, находящихся на разных стадиях клинических испытаний (табл. 1).
| Лекарство | Заболевание | Стадия клинических испытаний |
|---|---|---|
| Patisiran | Наследственный АТТР амилоидоз | Одобрен |
| Givosiran | Острые печеночные порфирии | Поздняя стадия (фаза 2–3) |
| Fitusiran | Гемофилия и редкие кровотечения | Поздняя стадия (фаза 2–3) |
| Inclisiran | Гиперхолестеринемия | Поздняя стадия (фаза 2–3) |
| ALNTTRsc02 | АТТR амилоидоз | Ранняя стадия (фаза 1–2) |
| Lumasiran | Первичная гипероксалурия типа 1 | Ранняя стадия (фаза 1–2) |
| Cemdisiran | Болезни, связанные с системой комплемента | Ранняя стадия (фаза 1–2) |
| * Интересно, что некоторые препараты несут в себе название siRNA, например, Givosiran, Inclisiran; а некоторые препараты, являющиеся антисмысловыми цепочками РНК — Alicaforsen, Inotersen. | ||
Патисиран — первый олигонуклеотидный препарат на основе РНК-интерференции
Как вообще можно увеличить стабильность РНК?

Рисунок 5. Нуклеотидная составляющая патисирана представляет собой короткую 21-буквенную двуцепочечную РНК из смысловой и антисмысловой цепей, которая комплементарна таргетному гену транстиретина (TTR). Для бóльшей устойчивости, некоторые из нуклеотидов О-метилированы (Um, Cm), а на 3′ концах пришиты два тимидина (dT). Молекулярная формула лекарства — C412H480N148Na40O290P40. Молекулярный вес составляет 14 304 Да.
Впервые система доставки малых двухцепочных РНК была предложена в 2010 году и после развивалась вплоть до первого успешного клинического испытания в 2016, которое показало возможность применения РНК-интерференции для лечения генетических заболеваний человека [13].
Липидные наночастицы, защищающие РНК, состоят из внешнего слоя, образованного липидами с полиэтиленгликолем и холестерином, и внутренней полости, заполненной буфером, в которой находятся окруженные катионными частицами интерферирующие агенты (рис. 6).

Рисунок 6. Строение липидных наночастиц. Для создания липидных наночастиц эмпирически был разработан специальный протокол, сочетающий различные буферы и типы липидов: смешиваются ионизированные катионные липиды с siRNA в буфере с низкой ионной силой, за счет чего РНК сближаются с липидами и собираются в наночастицы (разноименные заряды катионных липидов и РНК притягиваются). Далее собранные структуры покрываются вспомогательными липидами, холестерином и липидами с полиэтиленгликолем (ПЭГ).
Таким образом, препарат таргетно доставляется в гепатоциты — клетки, продуцирующие амилоидный транстиретин.
Клинические испытания
Во время клинических испытаний возникли побочные эффекты: у 10% пациентов, принимавших лекарство, и 3%, принимавших плацебо, выявили инфекции верхних дыхательных путей. У всех пациентов наблюдали падение концентрации витамина А в крови (вспомним функции транстиретина).
FDA одобрило лекарство для всех стадий заболевания 10 августа 2018 года — так, патисиран стал не только первым одобренным препаратом для лечения наследственного транстиретинового амилоидоза, но и первым одобренным средством, в механизме работы которого лежит РНК-интерференция [17].
Комитет по лекарственным средствам для человека (CHMP), входящий в Европейское агентство лекарственных средств (EMA), рекомендовал предоставить разрешение на применение патисирана для лечения наследственного транстиретин-опосредованного амилоидоза у взрослых пациентов с полинейропатией 1 или 2 стадий. Значимого улучшения состояния пациентов с 3 стадией заболевания, по результатам клинических тестов и судя по комментариям представителя компании, достичь не удалось.
Лекарство будет доступно в виде раствора для внутривенного введения с концентрацией активного компонента 2 мг/мл. Примечательна периодичность инъекций: один раз в три недели.
На данный момент стоимость годового курса составляет $450 000, в ближайшее время предполагается снижение стоимости до $350 000. Назначение патисирана, к сожалению, не покрывается всеми страховыми планами.
Компания Alnylam предоставляет несколько типов финансовых тарифов для пациентов разных категорий. Рассмотрим два из них:
- У пациента есть коммерческая страховка.Компания предоставляет программу быстрого старта, обеспечивающую до трех доз лекарства в ожидании подтверждения страхового покрытия без каких-либо затрат. После подтверждения лечение полностью оплачивается страховой фирмой.
- У пациента нет страховки или его заболевание не подпадает под страховой случай.Компания может предоставить лекарство бесплатно, если у пациента есть Medicare, Medicaid (национальные системы страхования в США) или любое другое спонсируемое правительством страхование. Также покрытие полной стоимости или ее части возможно за счет нескольких частных фондов и благотворительных организаций. В данном случае пациенту приходится ждать соблюдения всех формальностей, он не получает лечение сразу.
Нам удалось узнать подробнее о планах компании Alnylam на расширение рынка препарата. На данный момент патисиран доступен на территории США, о продаже на территории России речи пока не идет. Авторы надеются, что с течением времени терапия станет ближе для бóльшего числа больных.
Кто нас ждет теперь?
Как мы смогли убедиться, создание RNAi-препаратов сопряжено с огромными трудностями, связанными с доставкой хрупких РНК к клеткам. Сегодня остается еще много вопросов касательно дизайна и применения липидных наночастиц.

Вредители и патогены, в том числе и вирусы, ограничивают биологический потенциал сельскохозяйственных растений, что представляет огромную угрозу продовольственной безопасности. На современном этапе разрабатываются методы защиты растений, основанные на естественном системном и клеточном фитоиммунитете, где особое место занимает уникальный механизм, описываемый термином РНК-интерференция (РНКи). Он формирует один из “эшелонов” одновременно эволюционно консервативного и высоко видоспецифичного фитоиммунитета. В обзоре обсуждается роль малых некодирующих РНК и белков DCL, AGO и RDR, вовлеченных в механизм РНКи, в инфицировании фитопатогенами, вирусами, вредителями и перспективы использования этого феномена при создании препаратов для защиты растений от болезней и вредителей, в том числе с применением метода искусственного отключения генов, описываемого как спрей-индуцированный генный сайленсинг (СИГС, spray induced gene silencing, SIGS).
Discover the world's research
- 20+ million members
- 135+ million publications
- 700k+ research projects
a Институт биохимии и генетики – обособленное структ урное подразделение Федерального государственного
Argonautes (AGOs) associate with non-coding RNAs to regulate gene expression during development and stress adaptation. Their role in plant immunity against hemibiotrophic fungal infection remains poorly understood. Here, we explore the function of AGOs in Nicotiana attenuata's (wild tobacco) interaction with a naturally-occurring hemibiotrphic pathogen, Fusarium brachygibbosum. Amongst all AGOs, only transcripts of AGO4 elicited after fungal infection. The disease progressed more rapidly in AGO4-silenced (irAGO4) plants than in WT, and small RNA (smRNA) profiling revealed that 24-nucleotide smRNA accumulation was severely abrogated in irAGO4 plants. Unique microRNAs (miRNAs: 130 conserved and 208 novel, including 11 isomiRs) were identified in infected plants; silencing of AGO4 strongly changed miRNA accumulation dynamics. Time-course studies revealed that infection increased accumulation of ABA, jasmonates and salicylic acid in WT; irAGO4 plants accumulated lower jasmonate levels and lower transcripts of jasmonic acid (JA) biosynthesis genes. Treating irAGO4 plants with JA, methyl jasmonate or cis-(+)-12-oxo-phytodienoic acid restored WT levels of susceptibility. Silencing expression of RNA-directed RNA polymerases- RdR1, RdR2 (not RdR3) and Dicer-like- DCL3 (not DCL2/4) increased susceptibility to F. brachygibbosum. The relevance of AGO4, RdR1, RdR2 and DCL3 in a natural setting was revealed when plants individually silenced in their expression (and their binary combinations) were planted in a diseased field plot in the Great Basin Desert. These plants were more susceptible to infection and accumulated lower JA levels than WT. We infer that AGO4-dependent smRNAs play a central role in modulating JA biogenesis and signaling during hemibiotrophic fungal infections.

Новость
РНК-препараты способны избирательно проникать в печень и воздействовать на мишень на уровне трансляции
Автор
Редакторы

Современные лекарства
Спецпроект о современных лекарствах, истории их создания, методах разработки и тенденциях развития.
Партнер спецпроекта — компания Cytiva — образовалась в результате продажи подразделения GE Healthcare Biopharma корпорации Danaher Corporation. Cytiva — глобальный поставщик технологий и услуг, которые продвигают и ускоряют разработку и производство терапевтических средств. У компании богатое наследие, насчитывающее сотни лет. Клиенты Cytiva проводят мероприятия по спасению жизни, начиная от фундаментальных биологических исследований и заканчивая разработкой инновационных вакцин, биологических препаратов и новейших клеточных и генных терапий. Задача компании — предоставить инструменты и услуги, которые им необходимы, чтобы они работали лучше, быстрее и безопаснее, что приведет к лучшим результатам для пациентов.
Вместо оглавления
Что такое порфирия?
Рисунок 1. Простейший порфирин — порфин
Порфирии — это семейство заболеваний, связанных с дефектами ферментов, которые отвечают за синтез гема. Результатом их дисфункции становится накопление в различных органах и тканях порфиринов — макроциклических соединений с четырьмя атомами азота (рис. 1) [5].
В случае печеночных порфирий у пациента повреждены ферменты печени, отвечающие за путь синтеза гема. Как правило, острая печеночная порфирия имеет генетическую природу и наследуется аутосомно-доминантным способом (рис. 2).
Рисунок 2. Аутосомно-доминантное наследование. При этом типе наследования генетический дефект находится не на половой хромосоме, и мальчики и девочки болеют с одинаковой частотой.
По идее, женщин и мужчин с порфирией должно быть поровну, однако на деле примерно 80% больных — женщины. Это связано с тем, что приступы порфирии провоцируются повышением концентрации прогестерона и чаще всего приходятся на период за 2–4 дня до менструации.
Пусть синтеза гема включает в себя восемь ферментов, четыре из которых находятся в цитозоле, а четыре — в митохондриях (рис. 3) [6]. Мутации каждого могут приводить к порфирии.
Рисунок 3. Путь синтеза гема. Начало синтеза гема — реакция между сукцинил-КоА и глицином, при которой получается дельта-(ALA).
Основные промежуточные вещества, которые накапливаются при поломках этого пути — это аминолевулиновая кислота (ALA) и порфобилиноген (PBG). Они обладают нейротоксическим эффектом, поэтому острая печеночная порфирия выражается в первую очередь в неврологических нарушениях: судорогах, психозе, болях в животе и спине, острой полинейропатии. При тяжелом приступе возможна тошнота и рвота, расстройство сознания и даже кома. Также при тяжелой порфирии повышается вероятность развития рака печени, гипертензии, почечной недостаточности. У таких пациентов вероятность смерти в три раза выше по сравнению со средней по популяции [7].
Болезнь не такая уж редкая: ее частота — от 5 до 10 человек на 100 000, то есть в России, предположительно, 7–14 тысяч таких пациентов. Многие живут, не зная о болезни, так как обострения у них случаются редко и проходят сами. Однако у части пациентов обострения происходят регулярно и без быстрой лекарственной помощи могут привести к смерти.
Тяжелый приступ требует немедленной госпитализации, внутривенного введения гемина и симптоматических препаратов: опиатов, гипотонических растворов. Гемин — это комплекс железа с гемом и ионом хлора, восполняющий недостаток гема в организме больного порфирией и с помощью петли обратной связи снижающий синтез порфиринов. Гемин можно использовать и для профилактики частых приступов, однако постоянное введение гема приводит к гемохроматозу — избыточному накоплению железа в тканях и органах, что служит причиной печеночной и сердечной недостаточностей. Кроме того, части пациентов с порфирией гемин не помогает. Единственной потенциально излечивающей опцией была пересадка печени — непростая и не всегда доступная процедура, которая, конечно, влечет за собой собственные осложнения.
Стоимость годового лечения пациента с тяжелой порфирией в США доходит до $400 000 – 650 000 в год.
Очевидно, пациентам с острой печеночной порфирией требуются безопасные и эффективные лекарства, специфически направленные на причину заболевания. И теперь у них наконец-то появилась такая опция.
Гивосиран
Наборы для выделения РНК
У партнера нашего спецпроекта — компании Cytiva — есть наборы высокого качества RNAspin Mini Isolation Kit для выделения РНК из широкого спектра образцов: культивируемых клеток, тканей, бактерий, дрожжей. Выделяемого количества РНК (до 100 мкг) достаточно для дальнейшего использования в экспериментах, требующих высокого качества материала: например, ПЦР с обратной транскрипцией (RT-PCR), норзерн-блоттинг, микрочипы.
Очистка РНК осложняется лабильностью молекулы и повсеместным присутствием в клетках и межклеточном пространстве РНКаз. Поэтому оборудование для работы с РНК обрабатывается ингибиторами РНКаз, например, диэтилпирокарбонатом (DEPC). Для деградации геномной ДНК в состав набора входит ДНКаза I, которая добавляется на последнем этапе очистки РНК.
Рисунок 4. Видна разница в степени очистки препарата при использовании ДНКазы (дорожки 1) и без нее (дорожки 2). а — Электрофорез в денатурирующем геле. Видно, что без ДНКазы присутствует большое количество геномной ДНК. б — Результаты ПЦР с праймерами, специфичными к бета-актину. Видно, что обработка ДНКазой приводит к полному исчезновению полоски на уровне 720 кб.
RNASpin Mini Kit подходит для выделения из небольшого количества образца — массой от 0,3 мг. Для демонстрации того, что выделение из образцов разной массы не влияет на измеренный уровень синтеза РНК, проводили выделение РНК из образцов массой 0,3, 3 и 30 мг и последующую RT-PCR c праймерами, специфичными к актинину-4.
Рисунок 5. Синтез РНК актинина-4, выделенной из образцов разной массы коры надпочечников мыши. Слева — результаты из свежезамороженного образца. Справа — из образца, который хранили в растворе для последующего выделения РНК. Видно, что даже из образца массой 0,3 мг удается выделить достаточно РНК для анализа методом RT-PCR.
Материал предоставлен партнёром — компанией Cytiva
Успех компании Alnylam во многом обусловлен теми изобретениями, которые легли в основу ее продуктов. Они были сделаны основателем компании Томасом Тушлем (Thomas Tuschl) в конце 1990-х — начале 2000-х. Во-первых, для повышения стабильности РНК-дуплекса применили химическую модификацию нуклеотидов в составе молекулы: все остатки рибозы содержат в 2′ положении замену кислорода на фтор или на метокси-группу. Кроме того, некоторые остатки соединены фосфоротиоатной связью, то есть один из атомов кислорода фосфатной группы заменен на серу. Во-вторых, для того чтобы гивосиран лучше проникал именно в гепатоциты, на 3′-конце смысловой цепи находится разветвленная группа с тремя остатками N-ацетилгалактозамина (GalNAc). Эта группа связывается с асиалогликопротеиновым рецептором на гепатоцитах и обеспечивает проникновение молекулы внутрь клеток (рис. 6) [11].
Рисунок 6. Конъюгация GalNAc c двойной цепочкой РНК для обеспечения проникновения в клетки печени. ASGPR — асиалогликопротеиновый рецептор.
До того, как начать клинические исследования, гивосиран изучали на клетках (in vitro) и на млекопитающих (in vivo): мышах, крысах, кроликах и макаках резусах, где он показал свою высокую эффективность и безопасность.
Эффективность и безопасность гивосирана для людей изучали в клиническим исследовании на 98 пациентах, у которых перед включением в исследование было в среднем 7–8 приступов за последние 6 месяцев. Результаты оказались впечатляющими: за 6 месяцев исследования в группе гивосирана число приступов было в среднем 1,9, а в группе плацебо — 6,5. Также гивосиран снижал необходимость использования гемина и уменьшал уровни нейротоксических вещества ALA и PBG. Из побочных эффектов наиболее значимыми были реакции в месте подкожного введения препарата, они развивались у 25% пациентов. Также возможны почечная и печеночная токсичности. Большой плюс препарата — необходимость применения одной дозы всего лишь раз в месяц.
Компания получила регистрацию от FDA в ноябре 2019 года и тут же сообщила о том, что уже договорилась с несколькими страховыми компаниями о покрытии лечения страховкой. Стоимость гивосирана установлена на уровне $575 000, что компания оправдывает высокой эффективностью и малой распространенностью заболевания.
Пациентам со страховкой препарат достанется бесплатно или почти бесплатно. При оплате препарата будут использовать инновационную стратегию возмещения: полную стоимость пациент выплатит, только если в реальных условиях препарат покажет себя не хуже, чем в клинических исследованиях.
В 2020 году ожидается одобрение Европейского медицинского агентства, к 2025 году аналитики прогнозируют продажи в районе $500 млн.
Заключение
Успех гивосирана — еще один триумф тщательного научного подхода к поиску мишени, способа воздействия на нее и созданию эффективного средства такого воздействия. Препараты на основе РНК находятся в самом начале пути, и провалов пока было больше, чем успехов [12]. Однако за последние три года произошел сдвиг: начали регистрироваться препараты, доказавшие свою эффективность в качественных исследованиях. До сих пор это были лекарства от очень редких болезней, наследственных заболеваний печени или мышц. Это понятно, потому что в данные органы проще доставить РНК-препарат. Однако буквально только что, в декабре 2019 года, Alnylam сообщила об успехе препарата для лечения редкого наследственного заболевания почек.
Есть надежда на РНК-препараты и в более широких показаниях: The Medicines Company сообщила в ноябре о положительных промежуточных результатах исследования инклисирана (inclisiran), еще одного препарата на основе РНК-интерференции, который она приобрела у того же Alnylam. Это лекарство, блокирующее синтез фермента PCSK9 при сердечно-сосудистых заболеваниях, тем самым снижая в крови уровень липопротеинов низкой плотности. Против этой мишени на рынке уже есть несколько антител, и РНК-препарат может составить им достойную конкуренцию. Целый ряд компаний также исследует РНК-препараты против гепатита В.
Итак, мы видим, что эпоха РНК-терапии только начинается, и по мере накопления опыта и знаний в этой области нас ждет еще немало удивительных открытий и лекарств.
Читайте также:

