Вирусные заболевания при эпилепсии
Обновлено: 23.04.2024
Эпилепсия и COVID-19: ведение больных и оптимизация противоэпилептической терапии в условиях пандемии
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2020;120(10): 100‑107
В настоящее время нет данных о повышенной заболеваемости новой коронавирусной инфекцией (COVID-19) либо о более тяжелом течении болезни у пациентов с эпилепсией. Однако с учетом высокой распространенности эпилепсии у пациентов старше 60 лет, высокой коморбидности эпилепсии и целого ряда соматических заболеваний, необходимости сохранения возможности постоянного приема противоэпилептических препаратов и наблюдения за больными эпилепсией мы вправе ожидать целого ряда трудностей при ведении этих пациентов в условиях пандемии COVID-19. В статье рассматриваются основные принципы ведения пациентов с эпилепсией в условии пандемии COVID-19: необходимость соблюдения режима; сохранение регулярного непрерывного приема противоэпилептических препаратов, в том числе с учетом межлекарственных взаимодействий; перевод пациентов на внутривенные формы противоэпилептических препаратов при необходимости.
- SPIN РИНЦ: 7691-3288
- Scopus AuthorID: 7003326363
- ResearcherID: Y-6725-2018
- ORCID: 0000-0002-1170-6127
Дата принятия в печать:
По состоянию на апрель 2020 г. в мире количество подтвержденных случаев инфицирования SARS-CoV-2, возбудителем новой коронавирусной инфекции (COVID-19), превысило 2 млн. В большинстве случаев заболевание протекает как легкая форма острой респираторной вирусной инфекции. Однако в случае развития среднетяжелых и тяжелых форм дальнейшее ухудшение самочувствия пациента может происходить очень быстро, в течение нескольких часов, из-за развития двусторонней пневмонии, острой дыхательной недостаточности, острого респираторного дистресс-синдрома, сепсиса и септического (инфекционно-токсического) шока. Согласно мировому опыту, наиболее тяжелые формы заболевания развиваются у пациентов 60 лет и более, которые нередко страдают сердечно-сосудистыми заболеваниями, сахарным диабетом, хроническими обструктивными заболеваниями легких и другой хронической патологией, требующей постоянного приема лекарств [1—4].
Неврологические проявления COVID-19
Было показано, что для проникновения в клетку вирус SARS-CoV-2 использует рецепторы ангиотензинпревращающего фермента 2 (ACE2), имеющиеся в самых разных органах и тканях организма человека, в том числе в альвеолярных клетках легких, в сердце, почках, желудочно-кишечном тракте, а также в ЦНС, что делает головной мозг потенциальной мишенью для вируса [5]. Способность одного из представителей семейства короновирусов SARS-CoV проникать в головной мозг через обонятельный эпителий и вызывать нейрональную гибель была продемонстрирована на трансгенных мышах [6] и, судя по нередкому возникновению гипосмии у пациентов с COVID-19, свойственна и SARS-CoV-2 [7].
В ретроспективном исследовании Y. Li и соавт. [9] из 221 пациента у 11 развился ишемический инсульт, у 1 — тромбоз венозного синуса и еще у 1 — геморрагическое ОНМК. В группе риска по развитию инсульта были пациенты старшего возраста, с наличием сопутствующей патологии, склонностью к развитию выраженного воспалительного ответа и гиперкоагуляции. Согласно иным опубликованным исследованиям с меньшим количеством наблюдений, наиболее частыми неврологическими симптомами были головокружение, головная боль, снижение уровня сознания [10].
Авторы систематического обзора ЦНС-проявлений COVID-19 A. Asadi-Pooya и L. Simani [10] указывают на ряд недостатков проведенных исследований: отсутствие целенаправленных исследований именно неврологических симптомов, данных о проведении анализов цереброспинальной жидкости, электроэнцефалографии и др. Между тем каждый день появляются новые публикации о возможных редких (по крайней мере, сейчас) неврологических проявлениях новой коронавирусной инфекции — вирусного менингита/энцефалита [11], синдрома Гийена—Барре [12] и др., что подтверждает способность возбудителя повреждать нервную систему [13].
Таким образом, мы вправе ожидать развития неврологических симптомов у пациентов с COVID-19, в особенности у больных старшего возраста, с тяжелой формой заболевания, с наличием сопутствующей патологии.
Пациенты с эпилепсией — группа риска по COVID-19?
По данным International League Against Epilepsy, Epilepsy Society, Epilepsy Foundation, рекомендаций Британской Ассоциации Неврологов и др. источников, риск заболеть новой коронавирусной инфекцией для пациентов с эпилепсией соответствует общепопуляционному [14]. Больные с эпилепсией не склонны и к более тяжелому течению заболевания, за исключением людей со слабостью дыхательных мышц, малоподвижных, с наличием выраженных бульбарных нарушений [14, 15].
Необходимо отметить, что существует ряд редких форм эпилепсии, при которой пациенты становятся особенно уязвимы в случае подъема температуры или необходимости гормональной терапии (синдром Драве и др.). Наглядным примером, к сожалению, может служить недавняя смерть в возрасте 13 лет Charlotte Figi из США с синдромом Драве и значительным отставанием в развитии, ставшей в 2014 г. героиней сюжета компании CNN, у которой ранее применение каннабиноидов привело к резкому снижению количества приступов и улучшению темпов развития [16]. Девочка была госпитализирована в апреле 2020 г. с пневмонией, вероятным диагнозом COVID-19, нарушением дыхания и приступами, и, к сожалению, умерла [17]. При синдроме Драве в случае инфицирования COVID-19, как и при любой ОРВИ с подъемом температуры, рекомендуется рассмотреть возможность увеличения дозы ранее назначенных противоэпилептических препаратов (ПЭП) и вовремя применять жаропонижающие препараты (предпочтительно парацетамол, хотя подчеркивается, что в настоящее время не получено доказательств каких-либо преимуществ последнего перед ибупрофеном) [18].
В группу риска по тяжелому течению заболевания входят и люди старше 60 лет, распространенность эпилепсии среди которых, как известно, выше, чем в молодой взрослой популяции. С учетом высокой соматической коморбидности эпилепсии и целого ряда заболеваний (сердечно-сосудистых, болезней легких, сахарного диабета, инсультов и др.) [19—22] мы вправе ожидать более тяжелого течения заболевания у пациентов с эпилепсией и сопутствующей соматической патологией.
Повышение уровня стресса и проблема приверженности лечению
Как известно, нередко пациенты с эпилепсией страдают коморбидной патологией, в том числе психиатрической [20, 22—24], они более склонны к формированию суицидальных мыслей и чаще совершают попытки самоубийства [25]. В российской популяции число больных эпилепсией с депрессией, аффективно-тревожными и иными расстройствами также высоко, однако, как показывают наши наблюдения, большая часть больных избегают обращаться к психиатрам [22].
Пандемия COVID-19 представляет собой значительный стрессовый фактор, в особенности для пациентов с хроническими заболеваниями, которым необходимо соблюдать режим дня и постоянно принимать препараты. С учетом эпидемиологической ситуации им необходимо отказываться от плановых визитов к лечащему врачу. Уровень стресса значимо возрастает при необходимости соблюдения режима самоизоляции и тем более при заболевании пациента с эпилепсией новой коронавирусной инфекцией.
В настоящее время при целом ряде высокораспространенных хронических заболеваний в основе успеха лечения лежит соблюдение режима и регулярный прием препаратов пациентами [26]. Однако проблема низкой приверженности лечению зачастую является непреодолимым препятствием на пути достижения успеха. В 2003 г. ВОЗ разработала рекомендации по улучшению приверженности лечению у пациентов с рядом хронических заболеваний и состояний, требующих длительной фармакотерапии: бронхиальной астмой; онкологическими заболеваниями; депрессией; сахарным диабетом; эпилепсией; ВИЧ/СПИД; гипертензией; табакозависимостью; туберкулезом [27]. При этом под приверженностью длительному лечению, согласно проекту ВОЗ, понимается степень, в которой поведение человека (прием лекарств, соблюдение диеты и/или изменение образа жизни) соответствует согласованным с ним рекомендациям медицинского работника [27].
По данным ВОЗ, на момент создания рекомендаций в 2003 г. приверженность длительной терапии у больных с вышеуказанными хроническими заболеваниями в странах с высоким уровнем дохода была примерно на уровне 50%, а в развивающихся странах — еще ниже. N. Malek и соавт. [28] в своем обзоре указывали на уровень нарушения приверженности от 26 до 79%.
В ситуации резкого изменения режима сна и отдыха, возрастания стрессовой нагрузки, трудностей с доступностью амбулаторной помощи, в особенности при необходимости соблюдения режима самоизоляции, проблема с приверженностью лечению может возникнуть даже у самых дисциплинированных больных. Пациентам с эпилепсией желательно соблюдать общие для всех рекомендации: не концентрироваться на негативной информации; максимально сохранить привычный распорядок дня и круг общения; уделять внимание физическим нагрузкам; выбирать для просмотра в свободное время образовательные, развлекательные электронные и медиаресурсы. Крайне важно исключить прием алкоголя, депривацию сна и иные причины учащения приступов, продолжить постоянный прием ПЭП в соответствии с рекомендациями врача, отказаться от плановых визитов к эпилептологу при отсутствии учащения или утяжеления приступов, не менять схему терапии, а в случае ухудшения самочувствия вызывать бригаду Скорой медицинской помощи для выяснения необходимости госпитализации.
В 2005 г. S.-L. Lai и соавт. [29] опубликовали результаты исследования случаев прекращения пациентами с эпилепсией терапии ПЭП во время предыдущей эпидемии SARS в 2003 г. Из 227 пациентов 49 прекратили лечение. Из этих 49 пациентов приступы развились у 28 человек, причем у 4 из них речь шла о серийных приступах, а в 2 случаях — об эпилептических статусах. Как и следовало ожидать, в первую очередь приступы из-за отмены ПЭП возникали у пациентов с симптоматической эпилепсией, политерапией, не находящихся в медикаментозной ремиссии.
Необходимость учета межлекарственных взаимодействий
В настоящее время для лечения COVID-19 в РФ используется целый ряд препаратов: противовирусных, противомалярийных, антибактериальных. Проводятся клинические испытания новых лекарств, делаются попытки переливания плазмы от реконвалесцентов. Ведется непрерывный международный обмен рекомендациями и опытом применения препаратов. С актуальной, постоянно обновляющейся информацией по межлекарственному взаимодействию препаратов, применяющихся при лечении COVID-19 в разных странах, можно ознакомиться на сайте [31]. В опубликованных нами методических рекомендациях приведена таблица с данными по состоянию на 24.03.20 (табл. 1), на момент написания статьи есть обновление от 09.04.20 (табл. 2).
Таблица 1. Клинически значимые межлекарственные взаимодействия между ПЭП и основными препаратами, применяющимися при лечении пациентов с COVID-19 (данные на 24.03.20)
В статье рассмотрены вопросы, связанные с особенностями течения гриппа на фоне неврологических заболеваний: грипп при эпилепсии и других состояниях, характеризующихся повышенной судорожной готовностью, грипп при некоторых патологиях периферической нервной
Abstract. The article discusses issues related to the peculiarities of the course of influenza against the background of neurological diseases: influenza in epilepsy and other conditions characterized by increased convulsive readiness, influenza in some pathologies of the peripheral nervous system, influenza in neuromuscular diseases and multiple sclerosis, influenza and cerebral vascular pathology. In a number of patients with diseases of the nervous system, contact with influenza virus and infectious process are accompanied by an increased risk of the disease exacerbation, worsening the prognosis, need for hospitalization, and poor outcomes. The expediency and priority of influenza vaccine prophylaxis in persons with specific nosologies that are within the competence of a neurologist are discussed. In many cases, in neurological patients, vaccination is recognized as an effective measure to prevent the severe course of influenza and complicationы emergence. Doctors need in-depth knowledge of the indications and limitations of influenza vaccination in patients with nervous system disorders. For citation: Demianovskaya E. G., Vasiliev A. S. Features of the course of influenza in some categories of neurological patients // Lechaschy Vrach. 2021; 3 (24): 56-60. DOI: 10.51793/OS.2021.24.3.011
Резюме. В статье рассмотрены вопросы, связанные с особенностями течения гриппа на фоне неврологических заболеваний: грипп при эпилепсии и других состояниях, характеризующихся повышенной судорожной готовностью, грипп при некоторых патологиях периферической нервной системы, грипп при нервно-мышечных заболеваниях и рассеянном склерозе, грипп и сосудистая церебральная патология. У ряда пациентов с заболеваниями нервной системы инфицирование вирусом гриппа и развитие инфекционного процесса сопровождаются повышенным риском утяжеления течения заболевания, ухудшения прогноза, появления потребности в госпитализации, неблагоприятного исхода инфекции. Обсуждается целесообразность и приоритетность вакцинопрофилактики гриппа у лиц с конкретными нозологиями, относящимися к компетенции невролога. Вакцинопрофилактика во многих случаях признается эффективной мерой предупреждения тяжелого течения гриппа у неврологических больных и развития осложнений. Клиницисту необходимы углубленные знания показаний и ограничений вакцинопрофилактики гриппа у пациентов с патологией нервной системы.
Логично предположить, что неблагоприятные эффекты взаимодействия НС с вирусом гриппа носят реципрокный характер. Течение сезонного и пандемического гриппа у пациентов с уже имеющимися неврологическими заболеваниями может иметь свои значительные особенности. В реальной клинической практике наличие хронической патологии центральной или периферической НС может иметь большое значение для тактики ведения пациента и прогноза. Однако в литературе присутствуют весьма скудные описания особенностей течения гриппа на фоне неврологических заболеваний. Также предметом многолетней дискуссии остается целесообразность и приоритетность вакцинопрофилактики гриппа у лиц с конкретными нозологиями, относящимися к компетенции невролога.
Грипп при эпилепсии и других состояниях, характеризующихся повышенной судорожной готовностью
Исследование, проведенное в Баварии, показало, что хронические неврологические расстройства регистрируются у 8,2% детей, госпитализируемых по поводу гриппа. Наряду с другими сопутствующими патологиями (бронхиальная астма, ожирение) при заболеваниях НС пациентам чаще требовалась респираторная поддержка в виде подачи кислорода и искусственной вентиляции легких [10]. Австралийские авторы указывают на повышенный риск развития при респираторных инфекциях у детей с детским церебральным параличом (ДЦП) неконтролируемых судорожных приступов, при которых в свою очередь может усиливаться слюноотделение. Гиперсаливация особенно характерна для генерализованных тонико-клонических припадков. Повышенное слюноотделение и снижение уровня сознания увеличивают риск аспирации. Принимаемые противоэпилептические препараты, главным образом из-за их побочного действия в виде седативного эффекта, также увеличивают риск аспирации. Кроме того, бензодиазепины, особенно клоназепам, сами по себе усиливают слюноотделение. Поэтому при ведении пациентов с эпилепсией и тяжелым течением гриппа необходимо уделять внимание оптимизации противоэпилептической терапии, что может уменьшить риски респираторного заболевания за счет снижения вероятности аспирации [11].
По данным исследования, проведенного на Тайване, у взрослых эпилепсия была отнесена к разряду состояний, достоверно увеличивающих риск летального исхода при сезонном гриппе во всех возрастных группах (в том числе у взрослых и пациентов старшего возраста), особенно в период эпидемического подъема заболеваемости [12].
Грипп при некоторых патологиях периферической НС
Заболевания периферической НС обычно упоминаются совместно с гриппом в контексте осложнений гриппозной инфекции [13]. Особенно часто в литературе описываются связанные с гриппом случаи развития синдрома Гийена–Барре (СГБ) [14]. Не вызывает сомнений ключевая роль вируса гриппа в индукции синтеза аутоантител, направленных на антигены периферической НС. В частности, об этом свидетельствует выявление в крови пациентов во время острой стадии развития синдрома антител к периферическому миелину, способных фиксировать комплемент [15]. Предполагается, что также мишенью аутоиммунного процесса являются конъюгаты клеточных мембран, например ганглиозиды. А перенесенная гриппозная инфекция служит провоцирующим фактором, запускающим аутоиммунную реакцию. Кроме того, в нескольких работах было показано, что грипп или гриппоподобное заболевание могут также вызывать развитие синдрома Миллера–Фишера, который характеризуется патогенетическими механизмами, аналогичными таковым при СГБ [16].
Диабетическая полинейропатия при гриппе обсуждается в основном в свете того, что пациенты с сахарным диабетом (СД) имеют повышенный риск госпитализации и тяжелого течения инфекции по сравнению с лицами, не страдающими СД [18]. СД признан одним из часто встречающихся фоновых состояний и фактором риска осложнений гриппа H1N1 [19].
Грипп при нервно-мышечных заболеваниях
Миалгия является одним из самых частых внелегочных проявлений гриппа [20]. Вирус гриппа обладает тропизмом к мышечным клеткам, особенно незрелым, поэтому грипп-ассоциированные миозиты не являются редкостью в педиатрической практике, но поражения двигательных единиц встречаются и у взрослых. Большей склонностью к поражению мышц характеризуется грипп В [21]. В эксперименте во время гриппозной инфекции в скелетно-мышечной ткани повышалась экспрессия генов, участвующих в воспалении, и наиболее выраженной и длительной пиковой активностью этот процесс характеризовался у возрастных особей [22]. У людей повышение содержания креатинфосфокиназы в крови коррелировало с худшими исходами гриппа (длительность пребывания в отделении интенсивной терапии, увеличение частоты легочных и внелегочных осложнений) [23]. Это дает серьезные основания предполагать более тяжелое течение гриппа у пациентов с нервно-мышечными заболеваниями.
Действительно, в литературе описан клинический случай инфицирования гриппом у пациентки 5 лет со спинальной мышечной атрофией. Заболевание отличалось фульминантным дебютом, крайне тяжелым течением, ранним развитием признаков нарушения витальных функций (частота сердечных сокращений – 200 ударов в минуту и более, частота дыхания – 64 в минуту, насыщение крови кислородом – 66%), и, несмотря на своевременную госпитализацию и активное лечение в реанимационном отделении, наблюдался летальный исход. Авторы отмечают, что данная пациентка не была вакцинирована против гриппа [24].
Известно, что инфекции верхних дыхательных путей могут усугублять симптомы и в некоторых случаях провоцировать развитие миастенического криза [25]. Однако миастения является разновидностью иммунопатологического состояния с неврологическими проявлениями, когда вакцинация против гриппа должна проводиться с большой осторожностью. Эксперты Британской ассоциации неврологов считают, что у пациентов с миастенией любая вакцинация должна рассмат-риваться только по жизненным показаниям. Следует также учитывать, что при проведении иммуносупрессивной терапии эффективность вакцинации может быть снижена. Живые вакцины абсолютно противопоказаны при наличии миастении, введение аттенуированных вакцинных препаратов сопряжено с повышенным риском экзацербации заболевания. Но пациентам, нуждающимся в иммуносупрессивной терапии, при необходимости все же можно провести необходимую вакцинопрофилактику. Могут быть рассмотрены вакцинация против гриппа, а также пневмококка, Haemophilus influenzae и Varicella zoster, согласно региональному календарю прививок. Если возможно, при миастении следует планировать вакцинацию (с анализами крови для оценки иммунного ответа) до начала иммуносупрессивной терапии [26].
Грипп и рассеянный склероз
Кроме истинных обострений, которые может стимулировать грипп, известен симптом Ухтоффа – преходящее крат-ковременное ухудшение неврологических функций у пациентов с РС в ответ на повышение температуры тела. Точный механизм этого феномена остается неясным. Вероятно, он обусловлен сочетанием структурных и физиологических изменений в аксонах ЦНС при демиелинизации. Состояние является доброкачественным, от истинного обострения РС его отличает отсутствие отрицательной динамики на МРТ головного мозга, положительный эффект гипотермии и длительность не более 24 часов [32].
Грипп и сосудистая церебральная патология
Центры по контролю и профилактике заболеваний США (Centers for Disease Control and Prevention, CDC) рекомендуют регулярную вакцинацию против гриппа в качестве первого и очень важного шага по профилактике этой инфекции и возможного развития тяжелых осложнений, которые она способна вызвать у пациентов с хроническими неврологическими расстройствами [34]. Консультативный комитет по практике иммунизации США (United States Advisory Committee on Immunization Practices, ACIP) официально признает заболевания НС фактором риска тяжелого течения гриппа и рекомендует вакцинацию [35]. В целом в клинической практике этой рекомендации можно следовать, но с некоторыми оговорками.
Изложенный выше материал дает представление о том, что у некоторых категорий пациентов невролога рекомендация вакцинации против гриппа может считаться безусловной. Это, например, пациенты с сосудистой патологией головного мозга. В рандомизированном контролируемом исследовании, включавшем 439 пациентов, комплексный показатель сердечно-сосудистых исходов MACE (смерть или госпитализация по поводу острого коронарного синдрома, сердечной недостаточности или инсульта) был достоверно ниже у участников, прошедших вакцинацию против гриппа [36]. Однозначная рекомендация проходить вакцинопрофилактику касается и пациентов с расстройствами НС, развивающимися в результате СД. Американская диабетическая ассоциация (American Diabetes Association, ADA), CDC, а также ACIP рекомендуют лицам, страдающим СД, вакцинацию против сезонного гриппа, а Всемирная организация здравоохранения (ВОЗ) рекомендует пациентам с СД дополнительную иммунизацию против гриппа H1N1 путем однократного введения вакцины, чтобы минимизировать заболеваемость и смертность, связанные с данным возбудителем у этой категории больных [37, 38].
Одним из активно обсуждаемых вопросов является целесообразность вакцинопрофилактики гриппа у больных с РС в связи с опасениями развития обострения РС [42]. Риск рецидива после вакцинации против гриппа (сезонной и пандемической) рассматривался в нескольких исследованиях, которые не выявили связи между вакцинацией против гриппа и повышенным риском развития РС у взрослых [43, 44]. Пациентам с РС не рекомендуется введение живой аттенуированной вакцины [45]. Глюкокортикоиды, терифлуномид, интерферон бета, ритуксимаб и натализумаб не ухудшают иммунный ответ после вакцинации против гриппа 47. Но из соображений безопасности после пульс-терапии рекомендуется отложить вакцинацию как минимум на 2 недели. Применение митоксантрона, финголимода, азатиоприна может ухудшить иммуногенность и эффективность вакцины против гриппа 51. Пациентам, получающим митоксантрон/циклофосфамид, вакцинацию следует проводить между курсами приема препарата. При иммуносупрессивной терапии рекомендуется определение титра антител через 4 недели после вакцинации. Если титр антител не повышается, рекомендуется рассмотреть повторное введение вакцинного препарата [45].
При миопатиях позиция относительно вакцинации против гриппа зависит от конкретной нозологии. Так, при миопатии Салиха рекомендуется ежегодная вакцинация против гриппа и другие иммунизации, связанные с респираторными инфекциями [53]. При миастении введение любых вакцинных препаратов проводится с большой осторожностью, живые вакцины противопоказаны, о чем подробно говорилось выше.
Заключение
Таким образом, знание современных рекомендаций и позиции ведущих профессиональных сообществ по вопросу вакцинации неврологических больных против гриппа является реальной необходимостью для клинициста, работающего с данной группой пациентов. Но по данным онлайн-опроса, проведенного Всемирной федерацией неврологии, уровень подготовки в этом направлении оставляет желать лучшего. Большинство (82,7%) из 184 опрошенных неврологов заявили, что рекомендуют вакцинацию против гриппа пациентам с миастенией, но при этом менее половины респондентов (42,7%) рекомендуют ее при СГБ [54]. Парадоксальный пример, когда мировая практика противоречит рекомендациям, прямо изложенным CDC. Это свидетельствует о недостаточной информированности неврологов по вопросам вакцинопрофилактики гриппа и определяет необходимость включения данного раздела в программы образования врачей.
КОНФЛИКТ ИНТЕРЕСОВ. Авторы статьи подтвердили отсутствие конфликта интересов, о котором необходимо сообщить.
CONFLICT OF INTERESTS. Not declared.
Литература/References
Е. Г. Демьяновская* , ** , 1 , кандидат медицинских наук
А. С. Васильев**, кандидат медицинских наук
* ГБУЗ ИКБ № 1 ДЗМ, Москва, Россия
** ФГБУ ДПО ЦГМА УДП РФ, Москва, Россия
Особенности течения гриппа у некоторых категорий неврологических больных/ Е. Г. Демьяновская, А. С. Васильев
Для цитирования: Демьяновская Е. Г., Васильев А. С. Особенности течения гриппа у некоторых категорий неврологических больных // Лечащий Врач. 2021; 3 (24): 56-60. DOI: 10.51793/OS.2021.24.3.011
Теги: неврологические заболевания, судорожная готовность, вакцинопрофилактика гриппа
Что такое эпилепсия? Как классифицируется эпилепсия у детей? Как видоизменяются приступы эпилепсии в зависимости от возраста? Первые упоминания об эпилепсии относятся еще ко временам древнего Вавилона. Более века назад Джон
Что такое эпилепсия?
Как классифицируется эпилепсия у детей?
Как видоизменяются приступы эпилепсии в зависимости от возраста?

При рассмотрении этиологии и патогенеза эпилепсии у пациентов любого возраста немалая роль отводится наличию наследственной или приобретенной предрасположенности к болезни. Большое значение имеют разнообразные экзогенные воздействия (включая перенесенные вирусные, бактериальные и смешанные инфекции, черепно-мозговые травмы и т. д.).
Подходы к классификации эпилепсии у детей базируются на использовании общих критериев, принятых в 1981 году в городе Киото (Япония). Выделяют следующие заболевания:
- с парциальными (фокальными, локальными) припадками (простыми парциальными, сложными парциальными, парциальными со вторичной генерализацией);
- с генерализованными припадками (абсансами — типичными и атипичными, миоклоническими припадками, клоническими, тоническими, тонико-клоническими, атоническими);
- неклассифицируемыми эпилептическими припадками.
Американские неврологи J. H. Menkes и R. Sankar предлагают различать первичную (идиопатическую), вторичную (симптоматическую) и реактивную эпилепсии. Для всех перечисленных эпилепсий могут быть характерны генерализованные или парциальные (фокальные) приступы [1].
Кроме того, на сегодняшний день активно используется классификация эпилепсий, эпилептических синдромов и схожих заболеваний, принятая Международной лигой по борьбе с эпилепсией (1989) в г. Нью-Дели (Индия). Эта классификация предусматривает наличие следующих рубрик.
1. Локализационно-обусловленные формы (очаговые, фокальные, локальные, парциальные). 1.1. Идиопатические (с возрастзависимым началом): доброкачественная эпилепсия детского возраста с центрально-височными пиками (роландическая); эпилепсия детского возраста с затылочными пароксизмами; первичная эпилепсия чтения. 1.2. Симптоматические: хроническая прогрессирующая парциальная эпилепсия Кожевникова; приступы, характеризующиеся специфическими способами провокации; другие формы эпилепсии с известной этиологией или органическими изменениями в мозге (лобная, височная, теменная, затылочная). 1.3. Криптогенные.
3. Эпилепсии, не имеющие четкой классификации, как парциальные так и генерализованные. 3.1. Имеющие как генерализованные, так и парциальные проявления: судороги новорожденных; тяжелая миоклоническая эпилепсия раннего детского возраста; эпилепсия с непрерывными пик-волнами во время медленного сна; приобретенная эпилептическая афазия (синдром Ландау — Клеффнера); другие неклассифицируемые формы эпилепсии, не определенные выше. 3.2. Приступы, не имеющие четких генерализованных или парциальных признаков.
4. Специфические синдромы. 4.1. Ситуационно обусловленные приступы: фебрильные судороги; приступы, возникающие только по причине острых метаболических или токсических нарушений. 4.2. Изолированные приступы или изолированный эпилептический статус.
Клинические проявления эпилепсии у детей характеризуются многообразием. В этой связи имеет смысл рассмотреть лишь некоторые особенности эпилептических припадков, возникающих в детском возрасте.
Прежде всего, следует отметить, что у детей первого года жизни, в силу преимущественного функционирования стволовых структур мозга, обычно отмечаются тонические припадки, клонический же компонент приступа формируется в более старшем возрасте.
При генерализованных припадках дети обычно внезапно теряют сознание и падают, издавая стон или крик. Наступает тоническая фаза припадка, сопровождаемая резким напряжением всей мускулатуры: запрокидывание головы назад, цианоз лица с гримасой страха, расширение зрачков с отсутствием реакции на свет, сжимание челюстей, сгибание рук в локтевых суставах, сжимание кулаков, вытягивание нижних конечностей. Далее следует клоническая фаза: судороги верхних и нижних конечностей, головы, иногда происходят непроизвольное мочеиспускание и дефекация. Постепенно судороги становятся более редкими и менее выраженными (мускулатура расслабляется, снижаются сухожильные рефлексы). Дети перестают реагировать на окружающее, засыпают (или же приходят в сознание в состоянии полной амнезии).
Миоклонические судороги (инфантильные спазмы) характеризуются наличием своеобразных спазмов (преимущественно сгибательного типа), прогрессирующим течением, а также специфическими изменениями на электроэнцефалограмме (в виде гипсаритмии).
Проявления парциальных приступов у детей зависят от сохранности сознания во время припадка (простые парциальные припадки происходят без нарушения сознания, сложные же парциальные протекают в виде джексоновских судорог, адверсивных приступов и т. д. при нарушениях сознания).
Современные принципы диагностики эпилепсии у детей и подростков предполагают широкое использование таких методов, как электроэнцефалография (ЭЭГ), компьютерная томография (КТ), магнитно-резонансная томография (МРТ). При необходимости используют ЭЭГ-видеомониторинг, позитронно-эмиссионную томографию (ПЭТ), а также целый ряд биохимических, иммунологических и прочих специальных методов исследования. Диагноз эпилепсии считается подтвержденным при сочетании имеющихся у детей пароксизмальных приступов и специфических (эпилептиформных) изменений при проведении ЭЭГ-исследования.
Лечение эпилепсии у детей. Общие принципы терапии эпилепсии включают: 1) соблюдение общего и пищевого режима; 2) терапию антиконвульсантами и дополнительное индивидуальное медикаментозное лечение; 3) нейрохирургические методы; 4) психотерапевтические методы.
При назначении детям с эпилепсией антиконвульсантов следует придерживаться следующих основных принципов.
- Выбор препарата определяется типом приступов и потенциальной токсичностью препарата.
- Лечение следует начинать с назначения одного препарата, увеличивая его дозу до тех пор, пока приступы не прекратятся (или не проявится токсическое действие препарата). Если назначенное средство не позволяет осуществлять контроль над приступами, его постепенно отменяют (по мере назначения другого препарата и увеличения его дозы).
Еще 20 лет назад E. H. Reynolds и S. D. Shovron указывали, что переход с политерапии на монотерапию позволяет лучше контролировать судороги и улучшить показатели интеллектуального развития (когнитивные функции) у пациентов [6]. До них R. A. Hanson и J. H. Menkes провели сравнительный анализ эффективности моно- и политерапии. При этом оказалось, что лишь примерно в четверти случаев одного антиконвульсанта было недостаточно для контроля над судорогами и требовалось назначение второго препарата [7].
Диазепам (седуксен) и мидазолам (дормикум) являются основными средствами для лечения всех форм эпилептического статуса.
Кетогенная диета. Несмотря на появление новых, высокоэффективных антиконвульсантов, кетогенная диета, основанная на воспроизведении состояний кетоза и ацидоза при голодании, представляет собой вполне реальную альтернативу медикаментозному лечению при синдроме Леннокса—Гасто и других резистентных к терапии эпилептических синдромов. Механизм контроля за припадками при использовании данного метода диетотерапии остается неясным. Тем не менее в 90-х годах XX века популярность кетогенных диет в ряде стран значительно возросла [11]. Указанная диета считается особенно эффективной при лечении детей в возрасте 2—5 лет с малыми моторными припадками (у детей более старшего возраста сложно поддерживать состояние кетоза) [1]. В РФ кетогенные диеты пока используются чрезвычайно редко.
Нейрохирургические методы лечения эпилепсии. К сожалению, приходится констатировать, что в Российской Федерации нейрохирургические операции пока что не нашли широкого применения в лечении эпилепсии у детей. Тем не менее имеются данные, свидетельствующие об эффективности гемисфероэктомии при синдроме Расмуссена (хронический фокальный энцефалит) [1]. В современной мировой литературе также сообщается об использовании следующих видов нейрохирургических операций при различных резистентных к лечению эпилептических синдромах: передняя темпоральная лобэктомия; ограниченная темпоральная резекция, а также экстратемпоральная неокортикальная резекция [12, 13, 14].
Отдельное место среди хирургических методов лечения занимает стимуляция блуждающего нерва [15].
Эпилептический приступ может развиться у любого ребенка и в любое время. Об этом необходимо помнить, так как качество жизни пациентов может значительно ухудшиться вследствие многочисленных ограничений, связанных со спецификой болезни (касающихся физических нагрузок, занятий спортом, просмотра кино- и видеофильмов, ТВ, компьютерных игр и т. д.). Однако в промежутках между приступами, если исключить необходимость постоянного приема противоэпилептических препаратов, дети и подростки с эпилепсией ведут обычный образ жизни. Поэтому все усилия врачей должны быть направлены на максимальное сокращение числа припадков посредством назначения средств, обладающих минимальными побочными эффектами.
Литература
В. М. Студеникин, доктор медицинских наук, профессор
В. И. Шелковский
О. И. Маслова, доктор медицинских наук
С. В. Балканская
НЦЗД РАМН, Москва
Конвульсофин
Конвульсофин применяется при генерализованных припадках (абсансы, миоклонические и тонико-клонические припадки). Препарат эффективен при фокальных и вторично-генерализованных припадках.
Конвульсофин повышает содержание в ЦНС тормозного нейромедиатора (GABA), уменьшает возбудимость и судорожную готовность моторных зон головного мозга. Конвульсофин тормозит распространение эпилептического возбуждения в области корковых эпилептогенных очагов и повышает кортикальный судорожный порог.
Конвульсофин является кальциевой солью вальпроевой кислоты, что положительно влияет на его фармакокинетические и фармакодинамические свойства: более быстрая и предсказуемая абсорбция препарата в желудочно-кишечном тракте по сравнению с препаратами натриевой соли вальпроевой кислоты. Полагают, что при недостаточной эффективности лечения эпилепсии препаратами натриевой соли вальпроевой кислоты их замена на конвульсофин позволяет добиться клинического улучшения более чем у 30% больных. Терапия конвульсофином экономически оправдана, а возможность делить таблетки позволяет быстрее и легче подобрать нужную дозировку и повысить комплаентность терапии и качество жизни больных.
Финлепсин
Что такое юношеская миоклоническая эпилепсия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Агранович А. О., эпилептолога со стажем в 12 лет.
Над статьей доктора Агранович А. О. работали литературный редактор Вера Васина , научный редактор Татьяна Гаврилова (Уханова) и шеф-редактор Маргарита Тихонова
Определение болезни. Причины заболевания
Юношеской миоклонической эпилепсией (синдромом Янца) называют эпилептический синдром, который проявляется внезапными подёргиваниями в мышцах — миоклоническими приступами (от греч. "myos" — мышца, "klonos" — беспорядочное движение). Заболевание обычно развивается в подростковом возрасте.
Подёргивания в первую очередь возникают в мышцах верхнего плечевого пояса и рук. Сначала пациенты не обращают на них внимания, но со временем эпизоды возникают всё чаще и ухудшают качество жизни. Например, во время приступов из рук могут выпадать предметы. В дальнейшем появляются подёргивания ног, из-за которых человек может упасть.
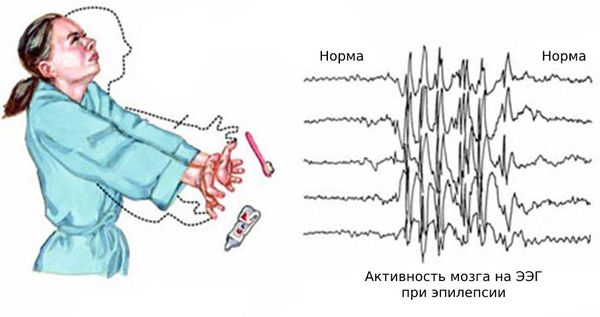
Нередко к этим эпизодам присоединяются генерализованные судорожные приступы — судороги возникают по всему телу и пациент теряет сознание. Также возникают абсансы — бессудорожные приступы с отключением сознания и амнезией на этот период. Как правило, частота генерализованных приступов невысокая: от одного за всю жизнь до раза в месяц. Подёргивания обычно случаются утром после пробуждения. Ярким провоцирующим фактором может стать недосыпание или вынужденное пробуждение. Также в трети случаев отмечается фотосенситивность — чувствительность к ритмическим вспышкам света.
Распространённость
Юношеская миоклоническая эпилепсия составляет 5–10 % среди всех эпилепсий и чуть больше четверти среди генетических генерализованных эпилепсий [5] . Заболевание проявляется в возрасте от 7 до 21 года, чаще в 11–15 лет, и более распространено среди женщин (61 %) [2] .
Причины заболевания
По классификации Международной противоэпилептической лиги за 2017 год, юношеская миоклоническая эпилепсия относится к генетическим болезням [1] . Заболевание имеет полигенное наследование, то есть контролируется двумя или более генами. Его развитие связано с локусами (участками ДНК): 6p11-12 (EJM1), 15q14 (EJM2), 6р21 (EJM3), 5q12-q14 (EJM4), 5q34-q35 (EJM5), 2q22-q23 (EJM6), 1p36 (EJM7), 3q26 (EJM8), 2q33-q36 (EJM9). Выделить ген, сильнее всего влияющий на развитие заболевание, пока не удалось [3] [4] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы юношеской миоклонической эпилепсии
Основным симптомом заболевания являются миоклонические вздрагивания (миоклонии) — патологические непроизвольные сокращения мышц или их групп [7] . Во время приступа пациенты испытывают ощущение, похожее на лёгкий удар током. В ответ на него возникают молниеносные движения в мышцах: от лёгкого подёргивания кончиков пальцев до патологического вздрагивания всего тела, которое может привести к падению.
Чаще всего подёргивания возникают в верхнем плечевом поясе: мышцах рук и плеч с обоих сторон. Из-за этого пациенты нередко выпускают предметы из рук, например разбивают кружки и роняют зубные щётки. Однако возможны различные вариации миоклоний.
Приступы учащаются в утренние часы, особенно при недосыпе или вынужденном пробуждении.
В 90 % случаев, помимо миоклонических эпизодов, отмечаются и генерализованные судорожные приступы [6] . После серии вздрагиваний в патологический процесс часто вовлекаются обе стороны тела.
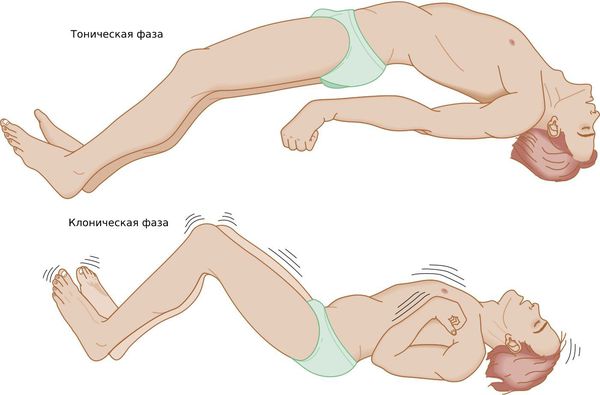
Генерализованный тонико-клонический приступ — состояние, при котором полностью отключается сознание. Приступ начинается с тонической фазы: напряжения в мышцах и специфического вскрикивания или хрипения. Руки полусогнуты и приподняты вверх или прижаты к телу. В этот момент из-за спазма дыхательной мускулатуры меняется цвет лица: оно синеет или сереет.
Далее развивается клоническая фаза, которая проявляется ритмичными подёргиваниями в конечностях. Она завершается полным мышечным расслаблением.
Третий вид эпилептических приступов при юношеской миоклонической эпилепсии — это абсансы [8] . Во время эпизода больной застывает, его взгляд устремлён в одну точку, сознание отключено. Состояние длится до 15 секунд и часто воспринимается окружающими как задумчивость. Сами пациенты могут не замечать эти приступы или воспринимать их как "провалы в памяти".
Патогенез юношеской миоклонической эпилепсии
Мозг человека состоит из двух основных типов клеток: нейронов и глии. Нейроны — это электрически возбудимые клетки, которые обрабатывают, хранят и передают информацию с помощью электрических и химических сигналов. Глиальные клетки играют в этом процессе вспомогательную роль.
Нейроны могут соединяться друг с другом и образовывать нервные сети. В пределах одного нейрона и его отростков информация передаётся в виде электрического возбуждения. В синапсе (месте контакта между нервными клетками) оно приводит к выделению различных химических веществ — нейромедиаторов.
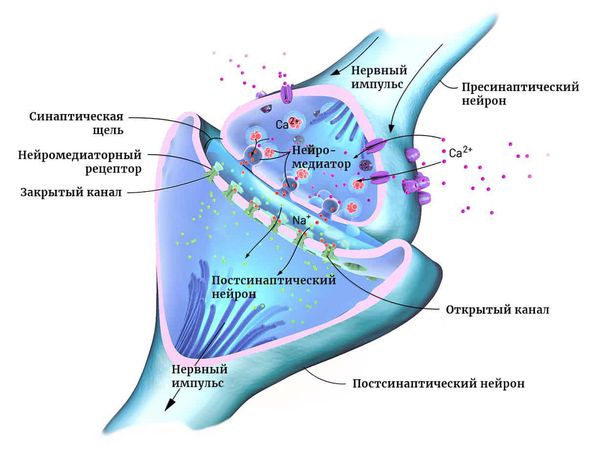
Нейромедиатор взаимодействует с рецепторами на мембране следующего нейрона. В результате в нём возникает электрическое возбуждение. Или не возникает — это зависит от конкретного нейромедиатора, активного в данный момент.
Чтобы заряд менялся в сторону возбуждения, в клетку должны поступать положительно и отрицательно заряженные ионы. Они проходят через ионные каналы в её мембране. Ионными каналами называют белки, образующие п о́ ру для обмена клетки с окружающей средой ионами K+, Na+ и другими [9] .
В нервных сетях между возбуждением и торможением работы нейронов поддерживается постоянный баланс. При сдвиге равновесия в сторону возбуждения происходит эпилептический приступ.
К юношеской миоклонической эпилепсии приводят мутации в генах ионных каналов. Однако выявлены нарушения и в других генах, также влияющих на процессы возбуждения в головном мозге [4] .
Классификация и стадии развития юношеской миоклонической эпилепсии
В Международной классификации болезней (МКБ-10) юношеская миоклоническая эпилепсия шифруется кодом G40.3 [10] .
В 2017 году Международная лига борьбы с эпилепсией (ILAE) обновила классификацию заболевания, выделив четыре уровня диагностики:
1. Определить тип приступа: фокальный (возникающий из одного очага), генерализованный и с неизвестным началом. Миоклонические, тонико-клонические приступы и абсансы относятся к генерализованным приступам.
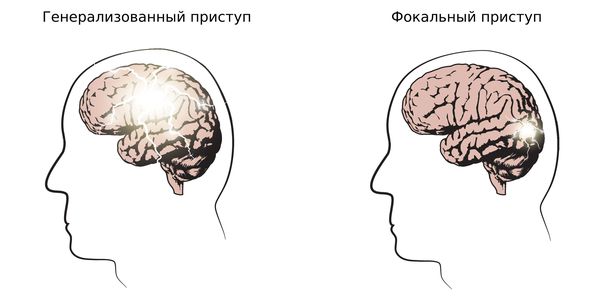
2. Установить тип эпилепсии: фокальная, генерализованная, сочетанная (фокальная + генерализованная) и неизвестная. Юношеская миоклоническая эпилепсия относится к генерализованной эпилепсии.
3. Определить эпилептический синдром. Юношеская миоклоническая эпилепсия как раз и является синдромом. Синдром включает типы приступов, возраст дебюта заболевания, характерные изменения на ЭЭГ, провоцирующие факторы и зачастую прогноз заболевания. Все эти факторы определяют лечебную тактику [11] .
4. Выявить причины заболевания: генетические, структурные, метаболические, иммунные, инфекционные и с неизвестной этиологией. Юношеская миоклоническая эпилепсия в большинстве случаев вызвана генетическими факторами.
Классификация юношеской миоклонической эпилепсии проводится в зависимости от течения заболевания. Главный критерий — это наличие миоклонических приступов. Также выделяют варианты течения с добавлением генерализованных судорожных приступов и/или абсансов.
Осложнения юношеской миоклонической эпилепсии
Пациенты часто не обращают внимания на патологические сокращения мышц, поэтому к неврологу и эпилептологу больной зачастую обращается после появления генерализованных тонико-клонических приступов. В результате противоэпилептические препараты назначают с опозданием. На фоне этого приступы могут учащаться и угрожать здоровью и жизни пациента травмами и утоплениями.
Серьёзным осложнением эпилепсии, в том числе и юношеской миоклонической эпилепсии, является внезапная смерть (SUDEP — Sudden Unexpected Death EPilepsy). Среди людей, страдающих эпилепсией, риск внезапной смерти в 20 раз выше, чем среди населения в целом [12] .
Точные причины SUDEP не установлены. Предполагается, что гибель пациентов связана с нарушением дыхания и развитием аритмии после приступа. Вероятность внезапной смерти при эпилепсии повышается при наличии генерализованных тонико-клонических приступов. Также важно, когда заболевание проявилось и сколько оно длится [12] .
При наличии дневных генерализованных приступов в течение предыдущего года риск развития SUDEP возрастает в 27 раз, ночных — в 15 раз. Проживание в одиночестве повышает риск внезапной смерти в 5 раз. Также SUDEP чаще встречается при злоупотреблении психоактивными веществами и алкоголем [13] .
Снизить риск внезапной смерти при эпилепсии можно, если придерживаться назначенного лечения: не пропускать приём противоэпилептических препаратов, не менять самостоятельно его частоту и дозировку [14] [15] .
Диагностика юношеской миоклонической эпилепсии
Основной диагностический критерий заболевания — это наличие миоклонических приступов.
Сбор анамнеза
На приёме врач спрашивает о необычных внезапных состояниях:
- вздрагиваниях в теле;
- дежавю — состоянии, при котором человек ощущает, что когда-то уже был в подобной ситуации или месте;
- потере сознания и т. д.
Пациенты могут не обращать внимания на такие симптомы и считать их своей особенностью. Абсансы и генерализованные тонико-клонические приступы с потерей сознания, особенно во сне, они могут и вовсе забывать. Поэтому при сборе анамнеза важно выяснить обстоятельства приступа не только у самих пациентов, но и у родственников и очевидцев.
Электроэнцефалограмма (ЭЭГ)
Основным способом диагностики эпилепсии является электроэнцефалограмма — метод исследования, при котором регистрируется суммарная электрическая активность клеток коры головного мозга.
Сейчас диагноз "эпилепсия" устанавливают с помощью длительного видео-ЭЭГ мониторинга — электроэнцефалограмма записывается параллельно с одной или несколькими видеокамерами, датчиком ЭКГ и при необходимости дополнительным контролем мышечной активности, частоты и глубины дыхания.
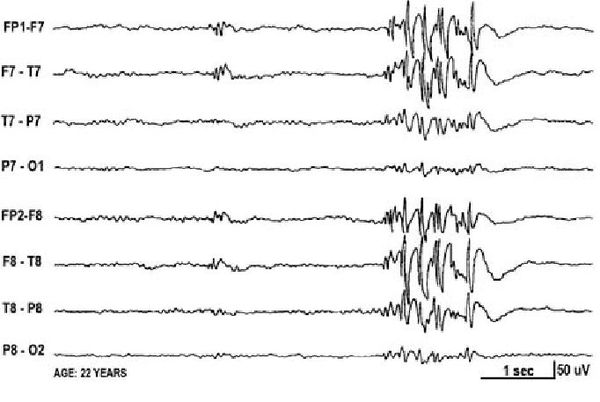
Основной фон биоэлектрической активности при юношеской миоклонической эпилепсии, как правило, соответствует возрастной норме. Патологическая активность проявляется короткими и генерализованными разрядами полиспайков (островолновых комплексов), которые регистрируются при миоклонических вздрагиваниях и полипик-волновыми комплексами между приступами.
При заболевании часто встречается феномен фотосенситивности. Для её выявления во время ЭЭГ пациента просят закрыть глаза и проводят ритмичную фотостимуляцию с частотой около 15 Гц [16] .
Эпилептическая фотосенситивность — это предрасположенность к приступам под влиянием света. Может протекать бессимптомно или проявляться эпилептическими приступами под воздействием провоцирующих факторов: видеоигр, работы за компьютером, просмотра телевизора, мигающего освещения в ночных клубах и света природного происхождения.
На МРТ патологические изменения в головном мозге при юношеской миоклонической эпилепсии не выявляются [17] .
Интеллект и неврологический статус при заболевании находятся в норме. Выражена эмоциональная неустойчивость и признаки невротического развития личности: резкая смена настроения, вспыльчивость и повышенная тревожность
Лечение юношеской миоклонической эпилепсии
Образ жизни
При эпилепсии следует соблюдать режим сна и бодрствования, исключить алкоголь и избегать резких вспышек света. Также нужно по возможности уменьшить стрессы, переживания и тревоги [20] .
Антиэпилептические препараты
Приём антиэпилептических препаратов (АЭП) позволяет устранить до 90 % приступов. Монотерапия (лечение одним препаратом) при юношеской миоклонической эпилепсии применяется в 79 % случаев, дуотерапия (двумя препаратами) — 17 %, политерапия (несколькими препаратами) — 4 % [16] .
Прекращать приём лекарств рекомендуется не ранее чем через пять лет полной клинико-нейрофизиологической ремиссии. Но даже спустя 4–7 лет ремиссии рецидивы после отмены терапии возникают у 70 % больных. Поэтому пациентам с юношеской миоклонической эпилепсией может быть рекомендован пожизненный приём АЭП [21] .

Ранее лидерами в лечении юношеской миоклонической эпилепсии являлись препараты вальпроевой кислоты. Они эффективны для прекращения приступов, но вызывают много побочных эффектов:
Также выявлено, что они обладают повышенным тератогенным эффектом по сравнению с другими АЭП. Тератогенное действие — это нарушение эмбрионального развития ребёнка при приёме препаратов матерью. Поэтому назначение вальпроатов, в особенности у молодых женщин, ограничено [18] .
В настоящее время препаратом выбора стартовой терапии является "Леветирацетам". Он хорошо переносится и эффективно устраняет все три вида приступов, в том числе сопровождающихся фотосенситивностью [19] .
Также используется препарат "Ламотриджин". Он эффективно подавляет генерализованные тонико-клонические судороги и абсансы, но в половине случаев способствует учащению миоклоний. Его применение в монотерапии у пациентов с частыми миоклоническими приступами ограничено, но лекарство можно использовать в комбинированной терапии [21] .
Помимо перечисленных препаратов, могут применяться "Топирамат", "Зонисамид", "Перампанел" и "Фенобарбитал".
Чтобы избежать учащения приступов и усиления симптомов, важно ограничить приём "Карбамазепина", "Окскарбазепина", "Фенитоина", "Габапентина" и "Вигабатрина". Эти лекарства могут повышать гипервозбудимость мембраны клеток головного мозга, что приводит к обострению состояния [21] .
Прогноз. Профилактика
Прогноз определяется индивидуально в зависимости от частоты приступов, эффективности АЭП, возраста начала заболевания и т. д. Лечение часто не помогает пациентами с тремя видами приступов [21] .
Без приёма противоэпилептических препаратов (АЭП) приступы могут сохраняться всю жизнь. Их частота, как правило, снижается только после 40 лет [20] .
Эффективность АЭП в предотвращении приступов достигает 90 %. При отмене терапии часто возникают рецидивы, поэтому потребуется длительный приём препаратов, иногда пожизненный.
Качество жизни значительно ухудшается при частых миоклонических и генерализованных тонико-клонических приступах, при которых пациенты рискуют получить травмы.
Профилактика
Особое внимание стоит уделить образу и режиму жизни пациента. Самыми мощными провоцирующими факторами являются недосыпание и злоупотребление алкоголем. А учитывая, что дебют заболевания приходится на подростковый возраст, молодые люди часто нарушают эти рекомендации, особенно в студенческие годы.
Пациент, у которого выявили фотосенситивность, предрасположен к приступам под воздействием мерцающего света. Поэтому им необходимо ограничить просмотр телевизора и работу за компьютером, исключить видеоигры и избегать посещения ночных клубов.
У всех пациентов с эпилепсией имеются определённые социальные ограничения: они не могут работать в некоторых сферах, водить автомобиль и нести военную службу. Все они определяются индивидуально соответствующими комиссиями.
Читайте также:

