Вирусный геном кодирует белки
Обновлено: 18.04.2024
Химический состав вирусов. Вирусные геномы. Виды вирусных геномов.
Химический состав вирусов отличается от других форм жизни необычайной простотой. Кроме геномной ДНК или РНК вирусы позвоночных содержат белки, масса которых составляет 57—90% массы вириона. Количество вирионных белков может колебаться в широких пределах в зависимости от сложности строения вируса. Среди белков, кодируемых вирусным геномом, различают структурные и неструктурные вирусспецифические белки. Первые входят в структуру вириона, вторые не входят. Структурными белками являются капсидные белки, белки оболочки и в некоторых случаях белки тегумента и ферменты.
У многих вирусов некоторые структурные вирусные белки не являются первичными продуктами генов, а образуются в результате посттрансляционного расщепления полипептида-предшественника вирусспецифическими и клеточными протеазами.
Неструктурными вирусными белками являются белки, кодируемые вирусным геномом, но не являющиеся составными частями вириона. Одни из них участвуют в репликации вирусных компонентов, другие — в сборке вирионов, третьи нарушают нормальный клеточный синтез. Они включают различные типы репликаз, связанные с репликацией ДНК, транскриптазы, транскрибирующие мРНК на геномной дцДНК или дцРНК или (-)оцРНК, вирусные протеазы, геликазы и лигазы. У ретро- и гепаднавирусов найдена обратная транскриптаза, транскрибирующая ДНК на матрице РНК. У ретровирусов найден уникальный фермент, участвующий в интеграции ДНК-продукта в хромосомальную ДНК клетки. Вирусы оспы, которые размножаются в цитоплазме и имеют много уникальных ферментов для процессинга РНК-транскриптов и репликации вирусной ДНК, мало зависят от метаболизма клетки. Вирусные белки имеют молекулярную массу 5-200 кД. Наиболее просто устроенные вирусы (вирусы-сателлиты, дефектные вирусы) кодируют синтез только одного белка, многие патогенные вирусы кодируют синтез 5—10 белков, крупные вирусы, такие как вирусы оспы, герпесвирусы, кодируют синтез до 200 белков. Хотя это немного по сравнению с клетками прои эукариотов (кодируют соответственно более 5000 и 100000 белков).
Разные вирусы демонстрируют различные варианты стратегии экспрессии своих генов и репликации геномов.
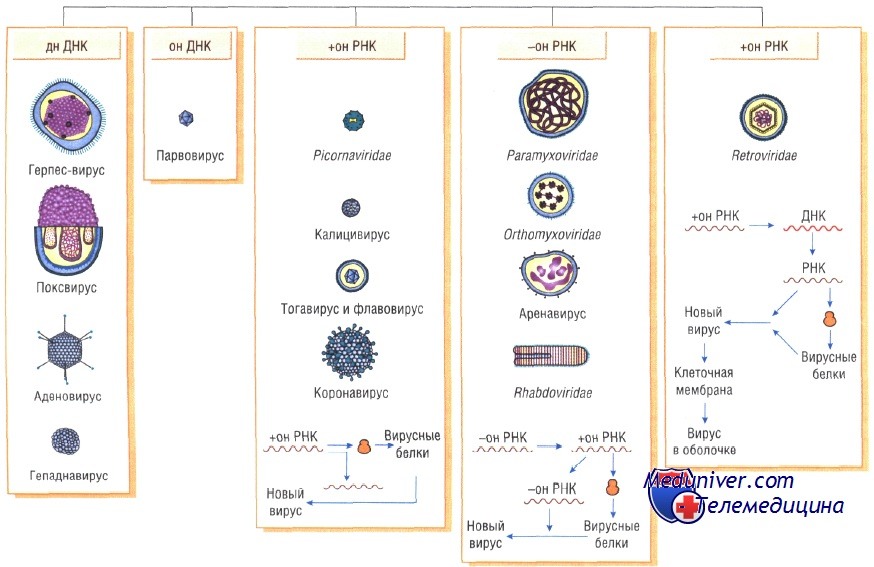
Вирусные геномы. Виды вирусных геномов.
Все вирусные геномы являются гаплоидными, т.е. содержат одну копию каждого гена. Исключение составляют ретровирусы, которые обладают диплоидным геномом. Геномы ДНК-вирусов позвоночных представлены одной двуспиральной молекулой за исключением парво- и цирковирусов.
Геномы полиома-, папиллома-, гепадна- и цирковирусов представлены кольцевой ДНК. ДНК гепаднавирусов частично двуспиральная, частично односпиральная. ДНК вирусов полиомы и папилломы является суперспиральной. Большинство линейных вирусных ДНК обладает способностью приобрести циркулярную конфигурацию, которая требуется для репликации по вращающемуся кольцевому механизму. Две цепи ДНК вируса оспы ковалентно связаны своими концами и при денатурации образуют большое одноцепочечное кольцо. У некоторых ДНК-вирусов (так же как у РНК-ретровирусов) имеются концевые повторяющиеся последовательности. Инвертированные концевые повторы обнаружены у адено- и парвовирусов. У адено-, гепадна- и парвовирусов, так же как у некоторых РНК-вирусов (пикорна- и калицивирусов), с 5'-концом генома ковалентно связан белок, играющий важную роль в его репликации.
Все РНК-вирусы позвоночных за исключением рео- и бирнавирусов имеют одноцепочечные геномы. Геном некоторых РНК-вирусов состоит из нескольких (2-12) уникальных фрагментов, каждый из которых кодирует, как правило, один белок. РНК-вирусы с односпиральным геномом могут иметь различную полярность. Если они имеют ту же полярность, что и мРНК, то они могут прямо индуцировать синтез вирусного белка и считаются положительно (+) полярными.
Если геномная нуклеотидная последовательность комплементарна мРНК, то они считаются отрицательно (—) полярными. К ним относятся: парамиксо-, рабдо-, фило-, ортомиксо-, арена- и буньявирусы. Все они имеют вирионную РНК-зависимую полимеразу (транскриптазу), которая в инфицированной клетке транскрибирует положительно-полярную РНК на матрице геномной вирусной РНК. У аренавирусов, по крайней мере, у одного рода буньявирусов, один из РНК-сегментов является двуполярным. Обычно у (+)полярных РНК-вирусов З'-конец имеет polyA-последовательность, а 5'-конец имеет кэп-структуру.
Размер геномов РНК-вирусов (одноцепочечных 1,7—21 т.н.; двуцепочечных — 18—27 т.п.н.) значительно меньше размера генома многих ДНК-вирусов. Поэтому РНК-вирусы, как правило, кодируют меньше белков, чем ДНК-вирусы. Масса генома различных вирусов находится в пределах от 1 % (орто- и пара-миксовирусы) до 32% (парвовирусы) от массы вириона.
Различные семейства вирусов позвоночных значительно различаются по структуре и функции генома. Основные типы вирусных геномов можно представить следующим образом:
1) двуцепочечной линейной молекулой ДНК с открытыми (герпесвирусы, аденовирусы, иридовирусы) или ковалентно связанными концами (вирусы оспы, асфаровирусы);
2) одноцепочечной линейной молекулой ДНК (парвовирусы);
3) одноцепочечной кольцевой молекулой ДНК (цирковирусы);
4) двуцепочечной кольцевой молекулой ДНК (папилломавирусы, полиомавирусы);
5) частично двуцепочечной кольцевой незамкнутой молекулой ДНК (гепаднавирусы);
6) одноцепочечной молекулой РНК, являющейся мРНК (положительно-геномные вирусы: пикорнавирусы, тогавирусы, флавивирусы, астровирусы, калицивирусы, коронавирусы, артеривирусы, нодавирусы);
7) одноцепочечной единой (рабдовирусы, парамиксовирусы, филовирусы, бор-навирусы) или фрагментированнои (ортомиксовирусы) линейной молекулой РНК, комплементарной мРНК — отрицательно-геномные вирусы;
8) одноцепочечной фрагментированнои кольцевой ковалентно несвязанной отрицательной или двуполярной РНК (буньявирусы, аренавирусы);
9) двуцепочечной линейной фрагментированнои молекулой РНК (реовирусы, бирнавирусы);
10) двумя идентичными линейными молекулами плюс-РНК, являющимися матрицами для синтеза ДНК (ретровирусы).
Молекулярная масса ДНК различных вирусов позвоночных варьирует в широких пределах: от 0,7—1,5 МД у цирковирусов и парвовирусов, до 150—200 МД у вирусов оспы. Молекулярная масса генома у РНК вирусов колеблется менее значительно - от 2,0 до 20,0 МД.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Обзор
У вирусов архей семейства Bicaudaviridae вирионы имеют крайне необычную морфологию: к одному или двум концам заостренного капсида прикрепляются белковые хвосты, длина которых может варьировать.
Автор
Редактор
Вирусы заражают все клеточные формы жизни, и археи — не исключение. Хотя сейчас известно гораздо меньше вирусов архей, чем вирусов бактерий и эукариот, разнообразие устройства их вирионов и используемых молекулярных механизмов поражает воображение: некоторые из них имеют вирионы в форме бутылки, у других генетический материал в вирионе хранится в форме А-ДНК, третьи обзавелись уникальным типом биологических мембран или используют для выхода из зараженной археи ранее неизвестные клеточные структуры. Наша статья посвящена этим пока еще малоизученным, но удивительно самобытным генетическим элементам.
Давно прошли те времена, когда археи считались обитателями исключительно тех мест, где никакая другая клеточная жизнь существовать не может, например, горячих источников. В действительности, архей можно найти везде, даже в желудочно-кишечном тракте человека, однако наиболее многочисленны они на глубоководьях морей и океанов. Так, показано, что археи, окисляющие ионы аммония до нитрата (они относятся к типу Thaumarchaeota) являются одной из самых многочисленных клеточных форм жизни в океанах. Неудивительно, что и вирусы архей также очень многочисленны: метагеномный анализ показал, что в некоторых зонах на долю вирусов архей приходится около 10% самых распространенных там вирусов. Объемы клеток архей, которые погибают из-за вирусов, тоже впечатляют: установлено, что в верхних 50 см океанического донного грунта клетки архей, лизированные вирусами, составляют до трети всей ежегодной биомассы погибших микробов, что соответствует 0,3–0,5 гигатоннам углерода ежегодно [1].
Все известные на данный момент вирусы архей имеют геномы, представленные ДНК: одноцепочечной или двухцепочечной, кольцевой или линейной. Недавно, однако, в горячих источниках Йеллоустонского национального парка, которые населены почти исключительно археей Sulfolobus solfataricus, с помощью метагеномики обнаружили вирусный РНК-геном, отдаленно напоминающий эукариотические РНК-вирусы, поэтому, возможно, существуют и РНК-содержащие вирусы архей.
Пока вирусы архей представлены 17 семействами. Стоит отметить, что вирусы архей, вообще-то, составляют две сильно различающиеся группы. К первой относят вирусы, которые структурно и генетически близки к вирусам бактерий и эукариот, а ко второй — вирусы, уникальные для архей и мало похожие на вирусы других клеточных форм. Практически все специфические для архей вирусы поражают представителей типа Crenarchaeota, а вирусы, близкие к бактериофагам и вирусам эукариот, чаще всего паразитируют на археях типа Euryarchaeota [1].
Строение вирусных частиц
Вирусы, специфичные для архей, нередко имеют вирионы необычной формы (рис. 1а).
Так, представители семейства Ampullaviridae имеют вирионы в виде бутылок из-под шампанского, причем поверх белков капсида они обтянуты липидной оболочкой. А у членов семейства Spiraviridae вирионы в виде спиралей. Столь необычная форма вирионов у вирусов этих двух семейств связана с особым способом упаковки генома при помощи белков капсида [1].

Рисунок 1а. Морфология вирионов вирусов, специфичных для архей. Просвечивающая электронная микроскопия.

Рисунок 1б. Морфология вирионов некоторых вирусов архей и бактерий
Некоторые специфичные для архей вирусы имеют веретеновидные капсиды. Среди них у вирусов семейства Fuselloviridae на одном из заостренных концов капсида находится пучок белковых филаментов, а у членов семейства Bicaudaviridae на одном или двух концах капсида — одиночные придатки в виде хвостов. Не менее удивительна морфология вирионов Guttaviridae: у этих вирусов вирионы тоже похожи на веретено, однако один их конец закруглен и имеет каплевидную форму [1].
У многих специфичных для архей вирусов нитчатые вирионы, которые могут нести специальные придатки, предназначенные для распознавания клеток архей. Иногда, как у вирусов семейства Tristromaviridae, капсид сформирован не одним, а тремя типами белков [1].
Некоторые вирусы, специфичные для архей, имеют сферические вирионы, причем иногда поверх капсида находятся липидная мембрана и еще один слой белков, из-за чего частицы принимают икосаэдрическую форму [1].
Вирионы Pleolipoviridae по строению похожи на везикулы, которые образуют многие археи: голая геномная ДНК находится внутри мембранного пузырька, который пронизан белками двух типов. Такие пузырьки могут содержать как одноцепочечную, так и двухцепочечную ДНК линейной или кольцевой формы [1].

Рисунок 2. Морфология вирионов вирусов архей, родственных бактериофагам и вирусам эукариот. Просвечивающая электронная микроскопия.
Чем можно объяснить столь необычную морфологию вирусов архей? Вирионы некоторых из них удалось не только рассмотреть под электронным микроскопом, но и детально изучить с помощью криоэлектронной микроскопии. Так ученые выяснили, что геномы некоторых вирусов архей в капсидах находятся в А-форме! Это первый известный случай, когда А-форма ДНК присутствует в живых организмах в нормальных условиях. Один из вирусов с геномом в виде А-ДНК, AFV1, имеет очень тонкую липидную оболочку с необычным химическим составом — главным ее компонентом является липид глицеролдибифитанилглицеролтетраэфир (GDGT-0), имеющий необычную U-образную конфигурацию (рис. 3). В мембране, состоящей их таких липидов, их гидрофильные головки обращены наружу, а гидрофобные дуги — внутрь. Наряду с фосфолипидным бислоем и монослоем архей такое строение можно считать третьим из известных типов биологических мембран [1].

Рисунок 3. Химическая структура GDGT-0 (вверху), его схематическое представление (внизу слева; красным цветом показаны гидрофильные головки) и модель (внизу справа) в U-образной конформации подпись
Геномы
Все выделенные на данный момент вирусы архей имеют ДНК-геномы (хотя, как отмечалось выше, в горячих источниках Йеллоустона с помощью метагеномики удалось найти РНК-геном возможного вируса архей). В большинстве случаев геном представлен двухцепочечной молекулой ДНК, и лишь у членов семейств Spiraviridae и Pleolipoviridae геномы состоят из одноцепочечной ДНК. Размеры геномов архейных вирусов варьируют от 5300 пар нуклеотидов (п.н.) у клававируса APBV1 (это один из мельчайших известных геномов ДНК-содержащих вирусов) до 143 800 п.н. у миовируса HGTV-1. Как правило, вирусы, специфичные для архей, имеют меньшие геномы, чем вирусы архей, родственные бактериофагам и вирусам эукариот [2].
Механизмы репликации геномов вирусов архей экспериментально изучены лишь для небольшого числа вирусов. Известно, что ДНК представителей порядка Caudovirales (которые, кстати, имеют самые большие геномы среди архейных вирусов) кодирует часть или даже все компоненты аппарата репликации ДНК: ДНК-полимеразы, белки скользящего зажима (PCNA), праймазы и хеликазы. Имеющие более скромные размеры геномов вирусы архей, как правило, кодируют белки, которые необходимы для привлечения аппарата репликации клетки-хозяина. Стоит, однако, отметить, что в геномах многих вирусов, специфичных для архей, не удалось найти белки, связанные с репликацией ДНК, так что они либо полностью зависимы от аппарата репликации клетки-хозяина, либо используют уникальные, пока еще не изученные механизмы репликации ДНК. Например, удалось показать, что и инициация, и терминация репликации генома липотриксвируса AFV1 связаны с рекомбинационными процессами [1].
Механизмы упаковки генома в капсид у вирусов архей детально не изучены. Тем не менее известно, что члены порядка Caudovirales имеют гомологи терминазы, которая упаковывает геномную ДНК в пустой капсид. Механизм формирования вирионов с использованием терминазы используют также вирусы бактерий и эукариот. Можно предположить, что упаковка генома в капсид у вирусов архей протекает так же, как и у бактериофагов и вирусов эукариот, а вот в плане репликации ДНК вирусы архей или целиком зависят от клетки-хозяина, либо используют уникальные, пока еще не изученные механизмы [1].
Взаимодействие с клеткой-хозяином
Выход зрелых вирионов из клетки архей во многих случаях напоминает отпочковывание от эукариотической клетки-хозяина у вируса гриппа, ВИЧ и вируса Эбола. Когда вирион покидает клетку археи, он забирает с собой фрагмент ее мембраны, который становится дополнительной оболочкой поверх капсида. У некоторых вирусов архей финальные стадии созревания вирионов происходят уже после выхода из клетки, когда капсид претерпевает морфологические перестройки [1].
У некоторых вирусов архей (а именно, представителей семейств Rudiviridae и Turriviridae) все стадии созревания вириона проходят в цитоплазме клетки. Новые вирусные частицы покидают клетку через специальные структуры с семиосевой симметрией на их поверхности, которые получили название вирусассоциированных пирамид (virus-associated pyramids, VAP). VAP образуются на внутренней поверхности мембраны зараженной клетки, проходят сквозь ее поверхностный S-слой и открываются на финальных этапах инфекции, давая возможность вирионам выйти из клетки (рис. 4) [1].

Рисунок 4. Вирусассоциированная пирамида. а и б — Пирамида на поверхности клетки археи Pyrobaculum oguniense в закрытой (а) и открытой (б) конформациях. в и г — Открытая пирамида вируса SIRV2 на поверхности Sulfolobus islandicus. а–в — Визуализация с помощью трансмиссионной электронной микроскопии. г — С помощью электронной криотомографии (CryoET).
Выход некоторых вирусов архей из клетки сопровождается ее лизисом. К их числу относятся вирусы семейства Tristromaviridae, которые, хотя и развиваются целиком в цитоплазме, каким-то образом ухитряются приобрести липидную оболочку. Примечательно, что сифовирус ψM2 кодирует фермент псевдомуреинэндоизопептидазу, который разрушает псевдомуреиновую клеточную стенку археи [1].
Эволюция и родственные связи
Вирусы, специфичные для архей, как правило, заражают только представителей типа Crenarchaeota. Они отличаются от всех других вирусов не только нестандартной морфологией вирионов, но и генетически: около 90% их генов не имеет гомологов в существующих базах данных. В геномах некоторых архейных вирусов не удалось найти ни одного белка, для которого существовал бы функционально охарактеризованный белок-гомолог.
Иногда, если гомологию не удается установить по нуклеотидным или аминокислотным последовательностям, на помощь приходят пространственные структуры. Действительно, для различных белков вирусов архей получили пространственные структуры, но ситуация от этого не стала яснее: оказалось, что во многих из них содержатся совершенно уникальные структурные мотивы. Более того, функции многих генов вирусов архей совершенно непонятны: так, оказалось, что фузелловирус SSV1 может спокойно обойтись без половины своих генов. Можно предположить, что такие неохарактеризованные гены-сироты кодируют белки, участвующие во взаимодействии вируса с клеткой архей, например, противодействующие системам CRISPR-Cas [1].
Впрочем, многие вирусы архей родственны некоторым бактериофагам и вирусам эукариот. Однако вирусы, специфичные для архей, стоят особняком среди всех ДНК-содержащих вирусов. Более того, различные группы вирусов, специфичных для архей, неродственны друг другу и эволюционируют независимо друг от друга. Высказывается предположение, что некоторые группы специфичных для архей вирусов появились на заре эволюции клеточной жизни и были впоследствии утрачены бактериями и эукариотами. Другие группы специфичных архейных вирусов могли появиться в момент обособления домена архей или даже позже, в отдельных группах архей [1].
Любопытно, что некоторые вирусы архей родственны лишенным капсидов мобильным генетическим элементам (например, плазмидам) . Эти вирусы, так же как и мобильные генетические элементы, имеют родственные гены основных белков репликативного аппарата [1], [2].
Несмотря на то, что мы только-только начинаем приподнимать завесу тайны над вирусами архей, многие уже известные особенности их морфологии или генетического аппарата поражают воображение. Несомненно, дальнейшее изучение вирусов архей при помощи метагеномики и других подходов подарит нам множество сюрпризов.

Обзор
Человеческая Т-клетка (синий), атакованная ВИЧ (желтый). Вирус ориентирован на Т-клетки, которые играют важную роль в иммунной реакции организма против вторжений, таких как бактерии и вирусы.
Автор
Редакторы

Вопрос о происхождении вирусов
Существует три основные теории возникновения вирусов:
Зарождение жизни. Идея последнего универсального общего предка: каким он мог бы быть и что ему предшествовало?

Рисунок 1. Схема трехдоменной классификации, предложенная Вёзе. В основании этой схемы должен находиться последний универсальный общий предок (англ. last universal common ancestor, LUCA).
Самый сильный аргумент в пользу существования LUCA — сохранившаяся общая система экспрессии генов (передачи наследственной информации от гена с образованием РНК или белков), одинаковая для всех живущих организмов. Все известные клеточные формы жизни используют один и тот же генетический код из 20 универсальных аминокислот и стоп-сигналов, закодированных в 64 кодонах (единицах генетического кода). Трансляция генетической информации в процессе синтеза белков по заданной матрице выполняется рибосомами, состоящими из трех универсальных молекул РНК и примерно 50 белков, из которых 20 так же одинаковы для всех организмов.
В 2010 году американский биохимик Даглас Теобальд математически проверил вероятность существования LUCA [6]. Он выбрал 23 белка, встречающихся у организмов из всех трех доменов, но имеющих разную структуру у различных видов. И исследовал эти белки у 12 различных видов (по четыре из каждого домена), после чего использовал компьютерное моделирование различных эволюционных сценариев, чтобы понять, при каком из них наблюдаемая картина будет наиболее вероятной. Оказалось, что концепция, включающая существование универсального предка, значительно вероятнее концепций, где его нет. Еще более вероятна модель, основанная на существовании общего предка, но допускающая обмен генами между видами [7].
Предположение о том, что LUCA был прокариотической клеткой, похожей на современные, часто принимается по умолчанию. Однако мембраны архей и бактерий имеют разное строение (рис. 2). Получается, что общий предок должен был обладать комбинаторной мембраной. Новая информация о мембранах LUCA появилась в 2012 году, когда несколько групп ученых подробно проанализировали историю генов всех ферментов биосинтеза компонентов липидов у бактерий, архей и эукариот [8].

Рисунок 2. Строение мембранных липидов бактерий (справа) и архей (слева)
Родственными у архей и бактерий оказались ферменты для синтеза терпеновых спиртов и пришивания полярных голов к спиртам. Значит, эти реакции мог проводить и LUCA. Проще всего было предположить, что липиды LUCA состояли из одного остатка терпенового спирта, остатка фосфата и полярной группы (серина или инозитола). Подобные липиды были синтезированы искусственно. Образующиеся из них мембраны обладают высокой подвижностью по сравнению с современными мембранами, хорошо пропускают ионы металлов и малые органические молекулы. Это могло позволять древним протоклеткам поглощать готовую органику из внешней среды даже без транспортных белков.
Реконструкции LUCA методами сравнительной геномики указывают на то, что это должен быть сложный организм без обширного ДНК-генома (геном, состоящий из нескольких сотен РНК-сегментов или ДНК провирусного типа). Но даже если считать возможность существования общего предка доказанной, остается загадкой, в какой среде он мог бы появиться.

Рисунок 3. Сценарий вирусного мира в гипотезе доклеточного происхождения вирусов подпись
Предполагается, что идеальные условия для формирования жизни существовали вблизи термальных геоисточников (морских или наземных) в виде сети неорганических ячеек, обеспечивающих градиенты температуры и рН, способствующих первичным реакциям, и предоставляющих универсальные каталитические поверхности для примитивной биохимии [10].
Эти отсеки могли быть населены разнородной популяцией генетических элементов. Вначале сегментами РНК. Затем более крупными и сложными молекулами РНК (один или несколько белок-кодирующих генов). А позднее и сегментами ДНК, которые постепенно увеличивались (рис. 3).
Такие простейшие генетические системы использовали неорганические соединения из раствора и продукты деятельности других генетических систем. Сначала они должны были подчиняться индивидуальному отбору ввиду большого разнообразия. Но ясно, что важным фактором такого отбора была способность передавать генетическую информацию, то есть, копировать себя. Присутствие одновременно в одной ячейке молекул, способных копировать РНК, кодировать полезные белки и управлять синтезом новых молекул, давало больше шансов выживать в каждой отдельной ячейке. И в такой системе рано или поздно должны были появиться паразитирующие элементы. А если это так, то вирусные элементы стоят у самых истоков эволюции [11].
Возникновение паразитов — неизбежное последствие эволюционного процесса

Рисунок 4. Схематическое представление структуры модели эволюции РНК-подобной системы. На втором этапе цепочки последовательностей начинают соединяться комплементарными связями сами с собой. В результате у двух видов (cat-C и cat-A) возникает вторичная структура молекулы, которая обладает каталитическим свойством. Она ускоряет собственную репликацию (или репликацию несвернувшихся соседей). Два вида при этом приобретают паразитические свойства (par-G и par-U). Пояснения в тексте.
Таким образом, паразитарные репликаторы способствуют эволюции разнообразия, вместо того, чтобы мешать этому разнообразию. Это также делает существующую систему репликатора чрезвычайно стабильной при эволюции паразитов.
Согласно гипотезе Черной Королевы, чтобы поддержать свое существование в постоянно эволюционирующем мире, вид должен реагировать на эти эволюционные изменения и должным образом приспосабливаться к среде. Поэтому, если мы говорим о вирусах как о паразитах, мы обязаны представлять себе взаимоотношения вируса с хозяином. В борьбе с вирусом хозяева развивают новые защитные механизмы, а паразиты отвечают, развивая механизмы для атаки и взлома защиты. Этот процесс может длиться бесконечно либо до вымирания одной из противоборствующих сторон. Так множественные системы защиты составляют существенную часть геномов всех клеточных организмов, а взлом защиты — одна из основных функций генов у вирусов с большими геномами .
Механизмы клеточной защиты против вирусов
Механизмы защиты от вирусов стандартны, поскольку все вирусы уникальны, и приспособиться к каждому не представляется возможным. Это такие механизмы как:
- Деградация РНК (вирусных и клеточных) — РНК-интерференция;
- Угнетение синтеза белков (вирусных и клеточных);
- Ликвидация зараженных клеток — апоптоз (программируемая клеточная смерть);
- Воспаление.
Получается, что клетка борется с вирусом, нарушая собственные обмен веществ и/или структуру. Защитные реакции клетки — это в основном самоповреждающие механизмы.
Вирус заражает конкретную клетку потому, что его механизмы нападения направлены именно против данного типа клеток. Это такие механизмы как:
- Угнетение синтеза клеточной РНК;
- Угнетение синтеза клеточных белков;
- Нарушение клеточной инфраструктуры и транспорта;
- Подавление/включение апоптоза и других видов клеточной смерти.
Схемы защитных приемов клетки и противозащиты вирусов во многом идентичны. Вирусы и клетки применяют одни и те же приемы. Для подавления синтеза вирусных белков клетка использует интерферон, а чтобы подавить образование интерферона, вирус угнетает синтез белков.
Поскольку узнавание вируса неспецифическое, клетка не может знать намерения конкретного вируса. Она может бороться с вирусом лишь стандартными приемами, поэтому ее оборонные действия часто могут быть чрезмерными.
Понятие о вирусном геноме, типы вирусных генов, концепция генов-сигнатур
В исследовании, проведенном вирусологом Евгением Куниным и его коллегами [16], анализ последовательностей вирусных геномов выявил несколько категорий вирусных генов, принципиально отличающихся по происхождению. Можно обсуждать, какая степень дробности классификации оптимальна, но четко различаются пять классов, укладывающихся в две более крупные категории.
Гены с четко опознаваемыми гомологами у клеточных форм жизни:
- Гены, присутствующие у узких групп вирусов (обычно это гены, гомологичные генам хозяев этих вирусов).
- Гены, консервативные среди большой группы вирусов или даже нескольких групп и имеющие относительно отдаленные клеточные гомологи.
Таким образом, отличительные особенности генов-сигнатур:
- Происхождение из первичного пула генов;
- Наличие лишь очень отдаленных гомологов среди генов клеточных форм жизни, из чего можно сделать вывод, что они никогда не входили в геномы клеточных форм;
- Необходимость для репродукции вирусов.
Из всего вышесказанного следует, что эти гены переходили от вируса к вирусу (или к элементу, подобному вирусу) на протяжении четырех миллиардов лет эволюции жизни, а вирусные геномы появились благодаря перемешиванию и подгонке друг к другу генов в гигантской генетической сети, которую представляет собой мир вирусов. Многочисленные гены клеточных форм жизни также пронизывают эту сеть, прежде всего благодаря геномам крупных вирусов, таких как NCDLV и крупным бактериофагам, которые позаимствовали множество генов от своих хозяев на разных этапах эволюции. Однако большинство заимствованных генов сами по себе не критичны для репликации и экспрессии вирусного генома (исключая некоторые случаи возможного неортологичного замещения генов-сигнатур); обычно эти гены участвуют во взаимодействии между вирусом и хозяином. Таким образом, несмотря на интенсивный взаимообмен генами с хозяевами, вирусы всегда происходят от других вирусов.
Вирусы, встроенные в геном, и горизонтальный перенос генов
В процессе эволюции многие вирусы встроились в геномы клеточных форм жизни путем горизонтального переноса генов (ГПГ). Впервые горизонтальный перенос был описан в 1959 году, когда ученые продемонстрировали передачу резистентности к антибиотикам между разными видами бактерий. В 1999 году Рави Джайн, Мария Ривера и Джеймс Лейк в своей статье писали о произошедшей значительной передаче генов между прокариотами [17]. Этот процесс, по-видимому, оказал некоторое влияние также и на одноклеточные эукариоты. В 2004 году Карл Вёзе опубликовал статью, в которой утверждал, что между древними группами живых организмов происходил массивный перенос генетической информации. В древнейшие времена преобладал процесс, который он называет горизонтальным переносом генов. Причем, чем дальше в прошлое, тем это преобладание сильнее [18].
Горизонтальный перенос генов — процесс, в котором организм передаёт генетический материал другому организму, не являющемуся его потомком. Горизонтальная передача генов реализуется через различные каналы генетической коммуникации — процессы конъюгации, трансдукции, трансформации, переноса генов в составе плазмидных векторов, вирусов, мобильных генетических элементов (МГЭ).
Трансдукция — перенос бактериофагом (агентами переноса генов, АПГ) в заражаемую клетку фрагментов генетического материала клетки, исходно содержавшей бактериофаг [19]. Такой бактериофаг обычно переносит лишь небольшой фрагмент ДНК хозяина от одной клетки (донор) к другой (реципиент). В зависимости от типа трансдукции — неспецифической (общей), специфической или абортивной, геном фага или хозяина-бактерии может быть изменен тем или иным образом:
- При неспецифической трансдукции (рис. 5) ДНК клетки-хозяина включаются в частицу фага (дополнительно к его собственному геному или вместо него);
- При специфической трансдукции гены фага замещаются генами хозяина;
- При абортивной трансдукции внесённый фрагмент ДНК донора не встраивается в ДНК хозяина-реципиента, а остаётся в цитоплазме и не реплицируется. Это приводит к тому, что при клеточном делении он передаётся только одной из дочерних клеток и затем теряется в потомстве.

Рисунок 5. Схема общей трансдукции
Наиболее известным примером специфической трансдукции служит трансдукция, осуществляемая фагом λ. Поскольку этот фаг при переходе в состояние профага включается в хромосому бактерий между генами, кодирующими синтез галактозы и биотина, именно эти гены он может переносить при трансдукции.
Вот несколько примеров важных эволюционных событий, связанных с молекулярным одомашниванием:
- Ферменты теломеразы, служащие для восстановления концевых участков хромосом, возможно, ведут свое происхождение от обратных транскриптаз, кодируемых ретровирусами и ретротранспозонами [22];
- Белки RAG, играющие ключевую роль в системе адаптивного иммунитета, по-видимому, происходят от прирученных транспозаз — ферментов, кодируемых транспозонами;
- Ген Peg10, необходимый для развития плаценты, был позаимствован древними млекопитающими у ретротранспозона (рис. 6) [23].

Рисунок 6. Роль гена Peg10 в эмбриональном развитии. Ученые под руководством Рюичи Оно из Токийского медицинского университета Японии показали, что у мышей с выключенным геном Peg10 нарушается развитие плаценты, от чего эмбрион погибает через 10 дней после зачатия [24].
В 2008 году в ходе целенаправленного поиска неиспорченных вирусных генов в геноме человека исследователи нашли два очень похожих друг на друга ретровирусных гена (их назвали ENVV1 и ENVV2), которые, по всей видимости, находятся в рабочем состоянии [25]. Это гены белков оболочки ретровируса. Каждый из них входит в состав своего эндогенного ретровируса (ЭРВ), причем все остальные части этих ЭРВ давно не функционируют.
Вирусные гены ENVV1 и ENVV2 у человека и обезьян работают в плаценте и, скорее всего, выполняют следующие функции:
Таким образом, как минимум три полезных применения нашли себе вирусные гены в плаценте приматов. Это показывает, что генетические модификации, которым ретровирусы подвергают организмы, в долгосрочной перспективе могут оказаться полезными или даже определить развитие вида. И с учетом всего вышесказанного древо доменов должно выглядеть как на схеме ниже (рис. 7).

Рисунок 7. Горизонтальный перенос генов в рамках трехдоменного дерева
Заключение
Возникновение паразитов — обязательная черта эволюционирующих систем репликаторов, а соревнование хозяев и паразитов движет эволюцию тех и других. Любой организм является результатом миллионов лет борьбы клеток с невероятно разнообразным миром вирусов. Их действия и их эволюция пронизывают всю историю клеточной эволюции, и сейчас меняется само наше представление о них. Когда-то вирусы считали деградировавшими клетками, но чем больше мы узнаем о вирусах, тем очевиднее, что их роль в общей эволюции значительна. И невероятно много нам еще предстоит узнать.

Обзор
здесь и далее рисунки Андрея Занкевича
Автор
Редактор

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Напомним, что РНК (рибонуклеиновая кислота) — это такая молекула, представляющая собой одну цепочку нуклеотидов. В составе каждого нуклеотида присутствует остаток моносахарида рибозы. На сегодняшний день известно множество разных типов РНК, которые выполняют совершенно разные функции: от кодирования клеточных белков (мРНК) до противовирусной защиты (некоторые микроРНК) [1–5]. РНК, входящие в состав многих вирусов, могут иметь ряд оригинальных функций, таких как регуляция времени экспрессии различных вирусных генов путем изменения пространственной организации цепи РНК или привлечение клеточных белковых комплексов.
Но бывает ли такое, что в пределах одной молекулы РНК одна ее часть, кодирующая некоторый белковый продукт, имеет положительную полярность, в то время как другая часть цепи представлена участком отрицательной полярности, кодирующим другой белок? Могла ли такая молекула возникнуть в процессе эволюции живых форм?
Ответ — да! И для того, чтобы разобраться, как функционируют такие молекулы, нам предстоит погрузиться в таинственный мир вирусов.
Давным-давно, в далекой-далекой галактике.
Как известно, все формы жизни обладают определенной наследственностью, которая определяет степень генетической идентичности живых объектов. В качестве молекул, ответственных за поддержание такой наследственной идентичности, выступают нуклеиновые кислоты (ДНК и РНК). Клеточные формы жизни для хранения и передачи информации используют только один тип нуклеиновых кислот — дезоксирибонуклеиновую кислоту (ДНК), в то время как вирусы в качестве основной молекулы наследственности могут использовать либо ДНК, либо РНК.
В случае ДНК-содержащих вирусов реализуется, как правило, Центральная догма молекулярной биологии в классическом виде: попав в клетку, ДНК удваивается в процессе репликации вирусного генома, на матрице ДНК в ходе транскрипции синтезируются мРНК, которые затем прочитываются рибосомой, синтезирующей по ним вирусные белки, то есть осуществляется трансляция. Далее вирусные белки ассоциируются с ДНК-геномом вируса в вирусную частицу (вирион), которая способна заражать новые клетки.
Очевидно, что РНК-содержащие вирусы используют иные стратегии размножения и, следовательно, реализации своего генома. Непривычные для большинства биологов молекулярные механизмы, которые используются такими вирусами, вероятно, унаследованы от далеких предков из того самого РНК-мира.
Размножение РНК-вирусов подразумевает использование разных типов РНК:
- геномная РНК находится внутри вириона, в зависимости от конкретного вируса, она может быть представлена (+)РНК, (–)РНК, (±)РНК, либо двухцепочечной РНК;
- комплементарная геномной РНК антигеномная РНК образуется в процессе репликации вирусов с одноцепочечным РНК-геномом и обладает полярностью, противоположной геномной РНК;
- субгеномная РНК (вирусная мРНК) имеет (+)полярность и является продуктом транскрипции геномной или антигеномной РНК. Как и подобает мРНК, субгеномная РНК участвует в процессе трансляционного синтеза белка.
Немного истории
Первым найденным РНК-вирусом стал бактериофаг f2, инфицирующий бактерию кишечную палочку (Escherichia coli) [7]. Выделенная геномная РНК фага f2 имела свойства мРНК, то есть она распознавалась рибосомой и могла транслироваться. На родственном РНК-бактериофаге Qβ была изучена РНК-зависимая РНК-полимераза (RdRp), которая, как оказалось, может синтезировать цепь РНК на матрице другой цепи РНК, то есть осуществлять репликацию вирусного РНК-генома! В ходе работы с РНК-бактериофагами f2 и его родственником Qβ были получены общие представления о биологии таких РНК-вирусов [8].
После РНК-бактериофагов были найдены (+)РНК-вирусы животных, такие, как вирус полиомиелита [9], [10], представитель группы пикорнавирусов. Подобные вирусы не содержат репликативных белков в составе вирусной частицы (вириона).
Встречаются вирусы, геном которых представлен двухцепочечной РНК. Как и в случае (–)РНК-вирусов, у дцРНК-вирусов во время репликации в клетке первым делом происходит синтез (+)цепи. Вирусные частицы этой группы также включают в свой состав RdRp.
Вирусы с двусмысленным РНК-геномом из семейства Bunyaviridae

Рисунок 1. Схематичное изображение структуры вириона флебовирусов
В семействе Bunyaviridae роды Phlebovirus, Tospovirus и Tenuivirus являются вирусами с двусмысленным РНК-геномом и, в отличие от остальных представителей семейства, имеют чуть более длинный S-сегмент генома (РНК S) (±)полярности. Род Tospovirus имеет вдобавок (+)участок на РНК M, который делает и эту РНК амбисенсной.
Флебовирусы
Вирусы рода Phlebovirus выделяют практически по всему миру и относят к нетаксономической группе арбовирусов, распространяющихся в членистоногих переносчиках и в позвоночных, на которых питаются переносчики. Члены этого рода переносятся кровососущими членистоногими. Инфекции не обходят стороной человека: вирусы сицилийской и неаполитанской москитных лихорадок широко распространены по территории Средиземноморья [15]. Среди симптомов таких инфекций — продолжительная сильная лихорадка, тошнота, рвота, диарея и головные боли. Вирус Тосканы, также переносимый москитами, обладает способностью проникать в нервную ткань и, вдобавок к вышеперечисленным симптомам, вызывает асептический менингит и менингоэнцефалит. Флебовирусы, переносимые клещами, например, вирус Бханджа, вирус тяжелой лихорадки с синдромом тромбоцитопении, или вирус Хартленд, вызывают серьезные вспышки инфекций среди людей [16].
Эти вирусы получили свое имя от латинского названия москитов (Phlebotominae), которые являются их основными переносчиками. Вирионы флебовирусов имеют диаметр 100-125 нанометров. Внутри вириона находятся три вирусных рибонуклеопротеина (вРНП), содержащих геномные сегменты, однако для вируса лихорадки долины Рифт (RVFV) было показано [17], что вирионы также могут содержать ещё три дополнительных вРНП, образованных цепочками антигеномных РНК, комплементарных геномным вирусным РНК. Рецептор-распознающий аппарат вирусов представлен гетеродимерами гликопротеинов Gn и Gc, которые организованным способом распределены по мембране вириона.
Структура генома флебовирусов
Геном флебовирусов как и других представителей семейства Bunyaviridae, включает три молекулы РНК: PHК L, РНК M, РНК S, имеющие на 5′- и 3′- концах уникальные для каждого геномного сегмента комплементарные последовательности. РНК L (–)полярности кодирует белок репликазы L. (–)РНК M кодирует предшественник гликопротеинов G1 и G2. (±)РНК S кодирует белок нуклеокапсида N на (–)полярном участке (ближе к 3′) и неструктурный белок NSs на (+)полярном участке (ближе к 5′) (рис. 2).

Рисунок 2. Схема структуры генома флебовирусов. Отмечены участки РНК, обладающие (–)- и (+)полярностью. Пунктирной линией обозначен сайт протеолиза белкового продукта.
NSs выполняет ряд функций, среди которых подавление индукции интерферона, усиление репликации и транскрипции вирусной РНК и определение круга хозяев [18]. NSs через цепочку белковых факторов способен приводить к инактивации противовирусной протеинкиназы R организма-хозяина [19].
Механизмы транскрипции и репликации РНК флебовирусов
Остановка транскрипции (–)участка РНК S определяется межгенным сигналом терминации. Похожие сигналы терминации находятся в 5′-концевой области РНК M и РНК L. В результате синтезируются кэпированные, но неполиаденилированные (и, следовательно, не такие стабильные, как клеточные мРНК) субгеномные РНК [18]. Также было показано [17], что в инфицированных клетках наблюдается ранняя экспрессия белка NSs, к тому же при детальном анализе состава вирионов обнаружили, что в вирусную частицу может упаковываться как три геномных цепи, так и еще три антигеномных цепи. Считается, что антигеномная РНК S присутствует в вирионе для осуществления ранней транскрипции мРНК, кодирующей NSs, поскольку этот неструктурный белок способен регулировать клеточные процессы, и чем раньше он начнёт работать в зараженной клетке, тем интенсивнее будет протекать вирусная инфекция.
Жизненный цикл флебовирусов
Жизненный цикл состоит из следующих стадий (рис. 3):

Рисунок 3. Схема, демонстрирующая основные этапы цикла флебовируса
Тосповирусы и тенуивирусы
Название рода Tospovirus происходит от сокращения названия вируса пятнистого увядания томатов (tomato spotted wilt virus, ТоSWV), впервые выделенного в 1930 году из зараженных растений томата. Этот вирус имеет очень широкий спектр хозяев и важное хозяйственное значение, борьба с ним ведется, в основном, за счет контроля численности трипсов.
Структура генома тосповирусов и тенуивирусов
Представители родов Тospovirus и Tenuivirus (тенуивирусы близки к тосповирусам, но не имеют липидной оболочки) являются единственными известными РНКвирусами растений с двусмысленным геномом [23]. Геном тосповирусов представлен тремя РНК-сегментами: большим, средним и малым (L, M, S). РНК L кодирует репликазу L. РНК S, подобно таковой у флебовирусов, кодирует белок нуклеокапсида N в (–)области и неструктурный белок NSs в (+)области. Эти области не пересекаются, они разделены межгенным некодирующим участком, содержащим сигналы терминации транскрипции. М-сегмент генома имеет принципиально отличную от РНК М флебовирусов структуру, являясь амбисенсной РНК. РНК М тосповирусов имеет область (–)полярности, в которой находится последовательность, кодирующая мРНК GnGc — предшественника поверхностных гликопротеинов, а также участок (+)полярности в 5′-области, кодирующий белок межклеточного транспорта NSm. Эти последовательности также разделены межгенным участком (рис. 4). Механизмы транскрипции и репликации РНК этих вирусов сходны с таковыми у флебовирусов [18].

Рисунок 4. Схема структуры генома тосповирусов. Отмечены участки РНК, обладающие (–)- и (+)полярностью. Пунктирной линией обозначен сайт протеолиза белкового продукта.
Отдельного внимания заслуживает неструктурный белок, закодированный в S-сегменте генома тосповирусов — NSs. Основной его функцией является супрессия противовирусного сайленсинга РНК, системы малых интерферирующих РНК [5], [24], распознающих вирусные РНК, что приводит к деградации последних [25]. Логично предположить, что синтез такого белка должен происходить как можно раньше, поэтому, возможно, по аналогии с белком NSs флебовирусов, ранняя транскрипция такой последовательности происходит в результате наличия в вирионе, помимо геномной цепи РНК S, еще и соответствующей ей антигеномной.
Вирусы с двусмысленным РНК-геномом из семейства Arenaviridae
Помимо семейства Bunyaviridae, амбисенсные РНК имеют представители семейства Arenaviridae. Аренавирусы являются таксономической группой вирусов позвоночных с сегментированным двусмысленным РНК-геномом. Вирусы, инфицирующие млекопитающих, определены в род Mammarenavirus, а заражающие рептилий — в роды Reptarenavirus и Hartmanivirus [26].
Вирионы аренавирусов, как и рассмотренных выше буньявирусов, плеоморфны, а их диаметр может варьировать от 40 до 200 нанометров в зависимости от вида, однако и частицы одного вида могут заметно различаться по размерам [27]. Границы вириона представлены липопротеидной оболочкой — производной клеточной мембраны, модифицированной равномерно распределёнными гликопротеиновыми комплексами (гетеродимерный гликопротеин GP1/GP2). Гликопротеины синтезируются в виде предшественника, который разрезается примерно пополам клеточной протеиназой на рецептор-распознающую субъединицу GP1 и трансмембранную субъединицу GP2. Последняя ответственна за слияние мембран при проникновении в цитоплазму [28]. В вирионе гликопротеины ассоциированны с лежащими на внутренней стороне мембраны молекулами матриксного белка Z, выстилающего внутреннюю поверхность мембраны, и белка нуклеокапсида N. Белок N способен связываться с РНК, распознавать кэп и ингибировать интерфероновый ответ. Структурный белок Z в клетке выполняет ряд функций (в том числе ингибирование трансляции клеточных мРНК и подавление апоптоза), являясь фактором созревания вирусных частиц (отвечает за инициацию сборки вирионов и за их отпочковывание).
Во время сборки вирусных частиц при формировании внешней оболочки иногда происходит захват субъединиц клеточных рибосом, по всей видимости, не играющих роли в вирусной инфекции (рис. 5).

Рисунок 5. Схематичное изображение структуры вириона аренавирусов
Значительная часть представителей семейства вызывает хронические и, как правило, бессимптомные инфекции у грызунов. При контакте человека с такими вирусами может развиваться острая и тяжелая инфекция, часто — геморрагическая лихорадка (например, в случае инфекции вирусом лихорадки Ласса, LasV). Вирус лимфоцитарного хориоменингита (LCMV), первый выделенный аренавирус, является нейроинвазивным. Попав в организм человека (например, через выделения грызунов), вирионы с током крови преодолевают гематоэнцефалический барьер центральной нервной системы и вызывают воспаления мозговых оболочек [29].
Структура генома аренавирусов

Рисунок 6. Схема структуры генома аренавирусов. Отмечены участки РНК, обладающие (–)- и (+)полярностью. Пунктирными линиями обозначены сайты протеолиза белковых продуктов.
РНК L на (–)участке несет последовательность, комплементарную гену репликазы L, и рамку матриксного и регуляторного белка Z на (+)участке в 5′-концевой части геномной РНК.
РНК S кодирует белок нуклеокапсида N в области (–)полярности и содержит рамку считывания GP1GP2 — предшественника поверхностных гликопротеинов GP1/GP2 (также в 5′-концевой части геномного сегмента).
Транскрипция и репликация генома аренавирусов
Переключение на репликацию связано с наличием белка N: когда его накапливается такое количество, что он начинает покрывать строящиеся цепи РНК, это, вероятно, влияет на конформацию репликазы и приводит к проскоку сигналов терминации транскрипции в виде межгенных шпилек. РНК S при репликации накапливается в больших количествах, так как нужно много копий белка нуклеокапсида, а также гликопротеинов (для экспрессии последних необходим предварительный синтез антигеномной РНК).
Заключение
Такая необычная организация двусмысленных геномных сегментов является интересным способом представления двух кодирующих последовательностей в одном геномном сегменте. На примере вирусов с двусмысленными РНК-геномами заметно, насколько изобретательной может быть эволюция вирусных РНК. Поскольку вирусы с двусмысленными РНК-геномами до сих пор удерживают определенную нишу, можно утверждать, что такой способ кодирования обладает некоторыми преимуществами по сравнению с более привычным для родственных вирусов способом, использующим только (–)РНК-сегменты.
Как возникли амбисенсные РНК и почему поддержались отбором, до сих пор остается одной из загадок современной вирусологии.
Благодарности от автора
Я благодарю доктора биологических наук, профессора кафедры вирусологии биологического факультета МГУ им. М.В. Ломоносова Аграновского Алексея Анатольевича за интересные и содержательные лекции по молекулярным процессам РНК-вирусов и вдохновение на написание данной статьи. Также выражаю благодарность художнику Андрею Занкевичу, чьи наглядные и яркие иллюстрации украшают данную статью.
Строение вирусов. Классификация вирусов
Вирусы классифицируют по типу генетического материала, способам репликации, строению и расположению структурных белков (капсидов), а также наличию или отсутствию оболочки.
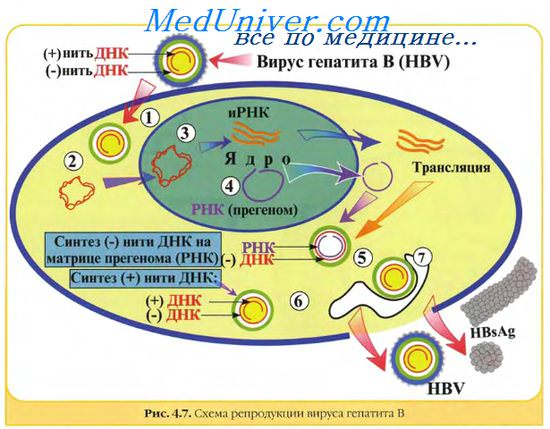
Генетическая структура и способы репликации ДНК-вирусы. Могут быть только двунитевыми и одноните-выми. К. первым относят вирус оспы, герпес-вирусы, аденовирусы, паповавирусы и полиомавирусы. Последние два вируса вызывают развитие доброкачественных (бородавки) и злокачественных (рак шейки матки) опухолей. Вирус гепатита В частично дву- и однонитевой. К однонитевым вирусам относят парвовирусы, вызывающие инфекционную эритему.
Репликация ДНК-вирусов обычно происходит в ядре клеток хозяина и сопровождается продукцией полимераз, воспроизводящих вирусную ДНК. При этом последняя не всегда встраивается в хромосомную ДНК хозяина.
РНК-вирусы. Эти вирусы содержат однонитевую РНК, но различаются по стратегии репродукции, (вирусы, содержащие плюс-однонитевую РНК и минус-однонитевую РНК). У плюс-однонитевых вирусов РНК транслируется в структурные белки и служит матрицей (мРНК) для РНК-зависимой РНК-полимеразы.
В состав минус-однонитевых вирусов входит собственная РНК-зависимая РНК-полимераза, продуцируемая на базе генома вируса мРНК. Последняя в свою очередь может быть матрицей для продукции вирусной (минус-однонитевой) РНК.
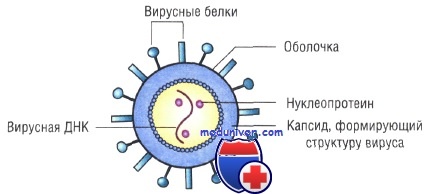
Строение капсидов вирусов. Вирусная нуклеиновая кислота покрыта белковой оболочкой, состоящей из повторяющихся единиц (капсида) с икосаэдрическим (кубическим) или спиральным типами симметрии. Капсиды вирусов с икосаэдрическим типом симметрии имеют практически сферическую форму. Спиральный тип симметрии свойствен РНК-вирусам, капсиды которых окружают нуклеиновую кислоту, располагающуюся в виде спирали.
Капсид состоит из повторяющихся компонентов (капсомеров), количество генов, кодирующих его, снижено, тем самым облегчён процесс сборки вируса.
Оболочка вирусов. В некоторых случаях нуклеиновая кислота и капсидные белки вируса (нуклеокапсид) окружены липидной оболочкой, состоящей из компонентов клетки хозяина или ядерных мембран. Мембрана клетки хозяина изменяется под действием белков, кодируемых вирусом, или гликопротеинов, выступающих в роли рецепторов для других клеток хозяина. Покрытые оболочкой вирусы чувствительны к действию веществ, растворяющих липидную мембрану (например, эфиров).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

