Вирусный иммунодефицит при герпесе что это
Обновлено: 23.04.2024
Герпетический энцефалит. Поражение нервной системы вирусом герпеса
К вирусам герпеса относятся:
• вирус простого герпеса I и II типов,
• вирус Варицелла-Зостер,
• цитомегаловирус,
• вирус Эпштейна-Барр.
Энцефалит, вызываемый вирусом простого герпеса, — самая частая спорадическая форма острого очагового энцефалита, возбудителем которой в подавляющем большинстве случаев служит вирус простого герпеса I типа.
Вопрос о том, возникает ли заболевание в результате первичното инфицирования вирусом через обонятельную систему или реактивации латентной вирусной инфекции, персистируюшей в организме, остается открытым.
Клиническая картина характеризуется лихорадкой, головной болью, спутанностью сознания, необычным поведением, сонливостью, менингеальным синдромом, эпилептическими припадками (генерализованными, сложными парциальными), афазией, очаговыми двигательными и чувствительными нарушениями, а также верхнекватрантной гемианопсисй.
На основании клинической картины герпетический энцефалит трудноотличим от других вирусных энцефалитов или заболеваний, с которыми проводится их дифференциальная диагностика.
Изменения в ЦСЖ также соответствуют общим изменениям при вирусных энцефалитах. Диагностически важными являются КТ и особенно МРТ.
На КТ выявляются гиподенсивные очаги, а на МРТ — очаги с измененной интенсивностью сигнала в медиальной области височных долей с распространением на латеральные отделы базальных ганглиев и инсулярную кору.
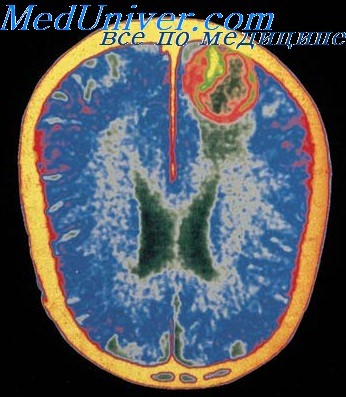
Одновременно наблюдается отек мозга, способный вызвать масс-эффект и привести к транстенториальпому вклинению. Возможны кровоизлияния в зоне воспаления. Поражение мозга в большинстве случаев резко асимметрично, поэтому дифференциальная диагностика с инсультом бывает затруднена.
Однако при инсультах практически не наблюла ется одновременного поражения зоны кровоснабжения средней (инсулярная кора, базальные ганглии) и задней (медиальные отделы височных долей) мозговых артерий. На ЭЭГ наблюдаются одно- или двусторонние периодические острые волны, регистрирующиеся каждые 2-3 секунды нал височными областями.
Серологическое исследование, выявляющее рост титра антител, не имеет значения для выбора лечения. Более раннее подтверждение диагноза можно получить с помощью ПЦР или биопсии мозга. Однако биопсия мозга редко бывает необходима лля диагностики.
Средством выбора является ацикловир (10 мг/кг в/в каждые 8 часов в течение 10 дней). С появлением ацикловира летальноегь снизилась с 60-70 до 30%. Эффективен также фоскарнет.
Вирус простого герпеса II типа вызывает генитальный герпес, но может также служить возбудителем асептического менингита, зостероподобной невропатии, вызывать задержку мочи, а у лип с иммунодефицитом — диффузный энцефалит. вирус оНоясывающего герпеса (варипелла-зостер) у детей вызывает ветряную оспу.
У взрослых может происходить реактивация вируса, приводящая к опоясывающему герпесу, что особенно часто наблюдается у пациентов с иммунодефицитом. Осложнением опоясывающего герпеса могут быть энцефалит или гранулематозный ангиит, поражающий крупные мозговые артерии. Может наблюдаться и ангиит более мелких сосудов.
Лечение состоит в применении ацикловира, валациклонира и фамцикловира, которые одинаково эффективны при заболеваниях, вызываемых вирусом варицелла-зостер.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
В статье представлены многолетние данные об особенностях течения патологии иммунной системы у детей различных возрастных групп (от 9 месяцев до 17 лет), инфицированных 4 типом герпеса – вирусом Эпштейна-Барр (ВЭБ). Убедительно продемонстрирована непосредственная связь между наличием инфекционного агента и реализацией многообразных проявлений заболеваний – от инфекционных до неопластических. Доступно разъяснены формулировки основных терминов в иммунологии и приведен диагностический алгоритм обследования детей на ВЭБ. Проведенные клинико-иммунологические исследования наглядно демонстрируют необходимость комплексного обследования детей с функциональными нарушениями в системе иммуногенеза с обязательной оценкой уровня инфекционной (вирусной) контаминации. Анализ результатов собственных клинико-иммунологических исследований позволяет предложить алгоритм комплексного обследования детей с функциональными нарушениями в системе иммуногенеза, включив в него изучение уровня вирусной нагрузки в качестве необходимого компонента.

1. Бархатова Т.В., Сенягина Н.Е., Краснов В.В. Распространенность маркеров герпес-вирусных инфекций при патологии почек у детей // Журнал инфектологии. – 2011. – 3 (3). - C. 46-51.
2. Дидковский Н.А., Малашенкова И.К. Синдром хронической усталости // Русский медицинский журнал. - 1997. - № 12. - С. 1.
3. Змушко Е.И., Белозеров Е.С., Митин Ю.А. Клиническая иммунология : руководство для врачей. – СПБ., 2001. – 576 с.
5. Лобзин Ю.В., Белозеров Е.С., Беляева Т.В., Волжанин В.М. Вирусные болезни человека. – СПб. : СпецЛит, 2015. – 400 с.
6. Малашенкова И.К., Дидковский H.A., Сарсаниа Ж.Ш. Выявление вирусоспецифических антител при хронической Эпштейна-Барр вирусной инфекции // Пятый Конгресс РААКИ. - М., 2002. - Т. 2. - С. 90.
9. Хаитов Р.М. Вторичные иммунодефициты: клиника, диагностика, лечение // Иммунология. - 1999. - № 1. - С. 14-17.
11. Evans A.S., Niederman J.C. 1982. Epstein-Barr virus // Viral Infection of Humans, Epidemiology and Control. – 2-nd ed. / Ed. A.S. Evans. - New York : Plenum Medical Book Company, 1982. - P. 253-281.
12. Hiroshi K., Makoto M., Yumi Y. et al. Quantitative Analysis of Epstein-Barr Virus Load by Using a Real-Time PCR Assay // J. Clin. Microbiol. - 1999. - Vol. 37 (1). - P. 132-136.
13. Human Herpesviruses: Biology, Therapy, and Immunoprophylaxis / Eds A. Arvin, G. Campadelli-Fiume et al. – Cambridge : Cambridge University Press, 2007 : 1432. - P. 929-935.
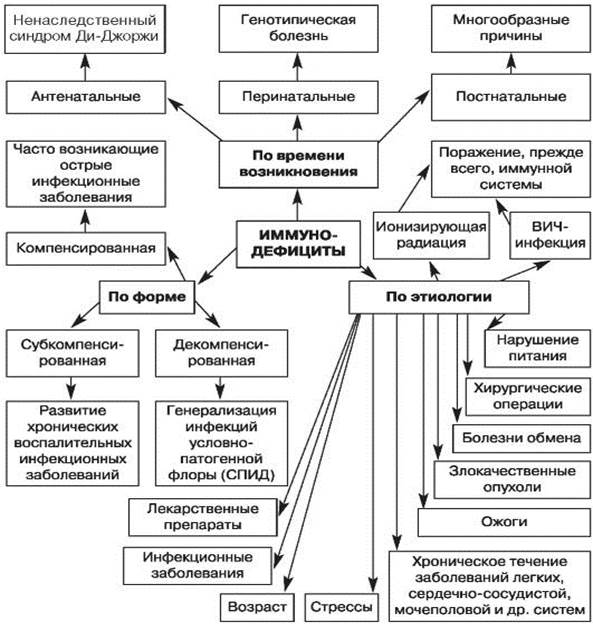
Рис. 1. Классификация вторичных иммунодефицитов по времени возникновения, этиологии, форме (по Белозерову Е.С. и др., 1992) [3]
Подводя итог в теоретической составляющей статьи – актуальности, необходимо обобщить следующее.
В педиатрии (17 лет 11 месяцев и 29 дней) в доминирующем большинстве речь идет об антенатальных и перинатальных иммунодефицитных болезнях, вторичных по отношению к анатомо-морфологическому субстрату иммунной системы – функциональных.
Таким образом, заключение врача-иммунолога должно быть сформулировано следующим образом. Антенатальная (или функциональная) иммунодефицитная болезнь, смешанного типа (или, при возможности, по отдельным звеньям, что мало вероятно), комбинированная индукция (инфекционная, гипоксическая и т.д.) с клиническими проявлениями основных синдромов – инфекционного, аллергического, аутоиммунного, неопластического и/или лимфопролиферативного.
Данные теоретические изыскания легли в основу целого цикла научно-исследовательских работ. Одно из таких исследований представлено в данной статье и посвящено исследованию иммуноиндуцирующей роли герпеса 4 типа - вируса Эпштейна-Барр у детей.
Цель: изучение особенностей клинических проявлений у детей с герпес-индуцированными формами иммунодефицитов (на примере 4 типа герпеса).

Рис. 2. Частота распределения клинических проявлений у детей с герпесиндуцированными иммунодефицитами

Рис. 3. Иммунологические особенности (типы распределения) у детей с герпесиндуцированными иммунодефицитами
ИФА, проведенный у детей, выявил 100% контаминацию вирусом ЭБ. Определялась следующая совокупность специфических антител:
- IgM к VCA (к капсидному антигену) – выявляются в крови в первые дни и недели болезни, максимально сохраняются до 3-4 недель;
- IgG к VCA (к капсидному антигену) – появляются в крови спустя 1-2 месяца от начала болезни, затем постепенно снижаются и сохраняются на пороговом (низком уровне) пожизненно. Повышение их титра характерно для обострения хронической ЭБВИ;
- IgM к EA (к раннему антигену) – появляются в крови в первую неделю заболевания, сохраняются в течение 2-3 месяцев и исчезают. Могут сохраняться в высоких титрах длительное время (более 3-4 месяцев), тревожно в плане формирования хронической формы ЭБВИ. Появление их при хронической инфекции служит индикатором реактивации;
- IgG к ЕA (к раннему антигену) – появляются к 3-4-й неделе заболевания, становятся максимальными на 4-6-й неделе болезни, исчезают через 3-6 месяцев. Появление высоких титров повторно указывает на активацию хронической инфекции;
- IgG к NA-1 или EBNA (к нуклеарному или ядерному антигену) – являются поздними, поскольку появляются в крови через 1-3 месяца после начала заболевания. При этом острофазные антитела выявлялись (IgM к VCA и IgM к EA) у 42 детей (13,1%), у 268 (83,7%) детей титры антител (IgG VCA + IgG к NA-1 или EBNA) значительно превышали нормативные и достигали значений более 160, у 10 (3,1%) детей диагностически значимых титров выявлено не было [9; 13] (рис. 4).

Рис. 4. Серологические исследования у детей с герпесиндуцированными иммунодефицитными болезнями
Клинические, иммунологические и этиологические сопоставления выявили следующие закономерности.
Отдельно хочется остановиться на методах ПЦР-диагностики. В литературе активно обсуждается вопрос об использовании ПЦР для исследований на инфекции семейства герпес в различных биологических субстратах. Здесь необходимо понимать, что данный метод, особенно при использовании его для исследования плазмы, имеет свои особенности – он всегда количественный! Определение качественное не имеет смысла, так как инфекция пожизненно персистирует в организме человека. Как у больных ЭБВИ, так и у носителей может быть положительная ПЦР. Поэтому для их дифференцировки проводится ПЦР-анализ с заданной чувствительностью: для носителей до 10 копий в пробе, а для активной инфекции – 100 копий в пробе. Специфичность данного метода хоть и достигает 100%, при этом не исключает ложноположительные результаты, т.к. ПЦР-анализ информативен только при размножении (репликации) вируса, то существует и определенный процент ложноотрицательных результатов с отсутствием репликации в момент исследования [5; 9].
В результате проведенного нами исследования, ПЦР крови всегда имела отрицательный результат, даже у детей с неопластическими процессами. Распределение ПЦР-положительных результатов у детей со слизистых оболочек (ротоглотка, нос) и мочи имело следующее цифровое распределение.
Положительные реакции с 3 биологических объектов имели 36 детей (11,25%), у 62 положительные ПЦР реакции были с зева и носа – 19,38%, у 43 детей диагностировали положительный результат только с зева (13.44%), и 71 ребенок имели положительные значения ПЦР со слизистой оболочки носа (22,19%). Положительные значения только в моче имели 51 ребенок (15,94%). Остальные дети (в количестве 57) имели отрицательный результат ПЦР-исследований с биологических сред.
Дети с неопластическими процессами, длительным субфебрилитетом, лейкемоидной реакцией, лимфоаденопатией имели признаки активации хронической инфекции, резкое увеличение CD95+ клеток, положительные маркеры наличия и обострения ВЭБ в ИФА и ПЦР-исследованиях.
Таким образом, все дети имели индуцированные формы функциональной иммунодефицитной болезни, доминирующей причиной которой являлся вирус ЭБ. Проведенные предварительные клинико-иммунологические исследования наглядно демонстрируют необходимость комплексного обследования детей с функциональными нарушениями в системе иммуногенеза с обязательной оценкой уровня инфекционной (вирусной) контаминации. Выявление основных причин трактуется необходимостью применения комплексных методов лечения, в т.ч. и с применением противовирусных препаратов.
Герпес - одно из наиболее распространенных заболеваний человека, возбудителем которого является вирус простого герпеса. В мире 90% населения заражены данным типом вируса. По данным многочисленных европейских исследований к 18 годам более 90 % жители городов инфицируются одним или несколькими штаммами по меньшей мере 7 клинически значимых вирусов (простого герпеса 1 и 2 типов, варицелла зостер, цитомегаловирусом, ЭпштейнБарр, герпеса человека 6 и 8го типов).
Особенность вируса простого герпеса в том, что он может скрыто находиться в организме долгое время и никак не проявлять себя. Герпес начинает активно рецидивировать, когда иммунитет человека ослаблен. Вот тогда и появляются характерные симптомы – мелкие болезненные пузырьки. Чаще всего герпес поражает кожу, глаза и наружные половые органы.
Общая информация о герпесе
Установлено, что женщины в возрасте 20-35 лет являются группами риска, в которых заболеваемость генитальным герпесом составляет 135,7 случаев на 100.000 населения данного пола и возраста. В Европе среди инфекций, передающихся половым путем он, занимает второе место после трихомониаза. В США ежегодно выявляется 20.000 больных. Известно, что инфицированность вирусом в мире у подростков к 13-14 годам достигает 75%, к 35 годам почти 90%.
Как происходит заражение
Источником заражения является больной человек, у которого вирус присутствует на эпителии слизистых оболочек.
При контакте с партнёром (заражение вирусом ВПГ-2 обычно происходит при половом контакте, ВПГ-1 при оральногенитальном и половом контактах) вирус проникает через эпителий слизистой оболочки партнёра и через повреждённую кожу.
Для вируса герпеса характерна склонность к обитанию в нервных клетках. По чувствительным нервам он приникает в нервные ганглии (скопления крупных нервных клеток, отростками которых и являются нервы), где инфекция приобретает скрытое течение.
Размножение инфекции
Размножение происходит в ядре поражённой клетки. Внедряясь в клетку, вирус герпес использует её структурные компоненты в качестве строительного материала, а также подчиняет себе синтезирующие системы клетки, "заставляя" вырабатывать вещества, необходимые для построения новых вирусов. После инфицирования клетки синтез новых вирусных белков начинается через 2 часа, а число их достигает максимума примерно через 8 ч. Наиболее быстрые темпы клонирования вирионов происходят в клетках эпителия и слизистых оболочек, крови и лимфатических тканей.
Передача вируса
Вирус передается главным образом контактным путем:
- прямой контакт (в том числе половой путь передачи),
- воздушно капельным,
- через предметы обихода и гигиены (общие полотенца, носовые платки и т.п.)
- вертикальным путями (от матери к плоду). Такое заражение может произойти во время родов (контакт с родовыми путями матери), трансплацентарно или же вирус проникает в полость матки через цервикальный канал шейки матки (восходящий путь).
Классификация вирусов
Согласно существующей международной классификации различают первичный и рецидивирующий генитальный герпес. Последний, в свою очередь, подразделяется на типичную и атипичную клинические формы и бессимптомное вирусовыделение.
Термин "генитальный герпес" возник в начале XX в. для обозначения очага поражения на коже и слизистых оболочках наружных половых органов. С развитием вирусологических методов исследования стали появляться сведения об "атипичных" формах болезни. Диагноз "атипичная форма генитального герпеса " ставится гинекологами для обозначения хронического воспалительного процесса внутренних гениталий (кольпит, вульвовагинит, эндоцервицит и т.д.) при наличии лабораторно подтвержденной герпетической природы заболевания, в отличие от "типичной" картины болезни, при которой на слизистой оболочке этих органов имеются очаги поражения с везикулезно-эрозивными элементами. Вместе с тем из этой группы выпадают герпетические поражения уретры, анальной области и ампулы прямой кишки, хотя эти органы анатомически и функционально тесно связаны с половой сферой.
Исследования, проведенные в Герпетическом Центре показали: диагностики вируса ВПГ сейчас осложняется из-за того, что в 65% случаев заболевание протекает атипично.
Как долго живет вирус?
Полностью сформированные и готовые к последующей репродукции “дочерние“ инфекционные вирионы появляются внутри инфицированной клетки через 10 ч, а их число становится максимальным через 15 ч. За все время своей жизни первичная (“материнская”) вирусная частица воспроизводит от 10 до 100 “дочерних” вирусных частиц, а в 1 мл содержимого герпетического пузырька находится от 1000 до 10 миллионов вирусных частиц. Вирионы чрезвычайно термостабильны – инактивируются (разрушаются) при 50-52 градусах в течение 30 мин, при 37,5 градусах – в течение 20ч, устойчивы при 70 град., длительно сохраняются в тканях,. На металлических поверхностях (монеты, дверные ручки, водопроводные краны) выживает в течение 2 ч, на пластике и дереве – до 3 ч, во влажных медицинских вате и марле в течение всего времени их высыхания при комнатной температуре (до 6 ч). Уникальным биологическим свойством вирусов является пожизненное сохранение вирусов в видоизмененной форме в нервных клетках регионарных (по отношению к месту внедрения вируса) ганглиев чувствительных нервов. Наиболее активны в этом отношении вирусы простого герпеса (лабиальный и генитальный), наименее – вирус Эпштейн-Барр.
Герпесвирусы способны привести к инфицированию плода во время беременности. Беременность очень часто является физиологическим иммуносупрессивным фактором (происходит закономерное снижение иммунитета). В цервикальном канале беременных женщин значительно увеличивает риск внутриутробного инфицирования плода, а также инфицированию ребёнка в родах. Вирус наиболее распространенная у беременных инфекция, передаваемая половым путем. Поэтому перед предполагаемой беременностью будущим мамам мы рекомендуем пройти обследование на наличие вируса простого герпеса и цитомегаловирусной инфекции на слизистых половых органов, определить наличие и уровень антител к этим вирусам и при необходимости получить курс профилактического лечения.
Органы и системы организма, которые может поражать вирус простого герпеса, и заболевания которые он вызывает:
Памятка при заболевании
Нужно помнить, что при появлении высыпаний человек становится остро заразным. Причем могут пострадать не только окружающие, но и сам больной человек. Например, с очага на губах грязными руками вирус герпеса может быть занесен в глаза или на половые органы.
Поэтому важно соблюдать следующие правила
- Не трогайте губы, пораженные высыпаниями. Если вы к ним прикоснулись, тщательно мойте руки.
- Пользуйтесь личным полотенцем и посудой.
- Если у вас поражены губы, не выдавливайте пузырьки и не отрывайте корочки. Это может вызвать дополнительное инфицирование кожи.
- Воздержитесь от поцелуев и орально-генитальных контактов.
- Если вы пользуетесь контактными линзами, не смачивайте их слюной для увлажнения.
- Противовирусный крем на губы наносите не пальцами, а косметическими палочками.
Профилактика
Профилактика герпеса заключается, прежде всего, в укреплении иммунитета. Желательно соблюдать режим сна и отдыха, не забывать про закаливание. В период эпидемий ОРВИ и гриппа важно избегать пребывания в людных местах.
Тем, у кого часто бывают обострения герпеса, рекомендуется проверить состояние иммунитета и пройти обследование, в том числе на наличие других скрытых инфекций.
Симптомы герпеса
К наиболее частым факторам, способным спровоцировать рецидив герпеса, относятся:
Вирус при этом может поражать любой участок кожи или слизистых оболочек организма. Но чаще всего при рецидиве мишенью становятся губы и слизистая носа. У некоторых герпес на лице возникает лишь изредка, являясь в основном косметическим недостатком. Но для людей с резко сниженным иммунитетом наличие в организме вируса может стать серьезной проблемой. Так, к примеру, у больных СПИДом, онкологических пациентов, людей, перенесших трансплантацию органов, обычный вирус герпеса может вызвать поражение внутренних органов.
Лечение герпеса
против вируса простого герпеса
(ВПГ) Ι и ΙΙ серотипов
Рецидивы, поражающие губы или слизистую носа, неплохо поддаются местному лечению кремом или мазью. В более тяжелых случаях врач может порекомендовать таблетки.
Необходимо помнить, что раннее начало лечения герпеса – залог успеха. Перед появлением пузырьков губы становятся очень чувствительными, возникает зуд и покалывание. И если заболевание начать лечить на стадии этих предвестников, то высыпания могут и не появиться, а выздоровление наступит в кратчайшие сроки.
На сегодня не существует лекарств, которые бы полностью уничтожали вирус герпеса в организме человека. Однако существует группа специальных противовирусных средств, эффективно подавляющих размножение ВПГ-I.
Если противовирусный крем начать использовать при уже имеющихся высыпаниях, заживление наступает быстрее, чем при лечении другими способами.
Клиника и диагностика поражений вирусом простого герпеса при иммунодефиците
Поражение лица и ротоглотки наиболее типично для реактивации герпесвирусной инфекции. Морфология герпетических высыпаний зависит от типа пораженной эпителиальной ткани. На красной кайме губ и коже лица первичными элементами являются мелкие везикулы, которые возникают последовательно, имеют тенденцию к быстрому слиянию и формированию крупного вялого пузыря. Эти элементы умеренно болезненны, типично ощущение жжения.
После отторжения некротизированного эпителия обнажаются эрозированные кровоточащие поверхности, по краям которых появляются новые мелкие везикулы, и элемент начинает расти от центральной части к периферии.
Суперинфицирование элементов часто приводит к возникновению глубоких некрозов, заживающих с формированием рубца. Поражение лица вирусом герпеса следует дифференцировать от поражения зигомицетами (Absidia, Rhisopus, Mucor) и Aspergillus, которые вызывают тяжелые некрозы тканей лица, расплавление хрящей и костей лицевого скелета с быстрым обезображиванием внешнего облика пациента.
На слизистой оболочке рта наиболее типичным является возникновение нескольких одинаковых поверхностных некротических элементов диаметром 1—3 мм, которые затем углубляются и увеличиваются в размерах, часто сливаются. В самых тяжелых случаях значительная площадь полости рта поражена крайне болезненными глубокими некрозами серого цвета с кровоточащими участками эрозий.
В прошлом, до введения всеобщей профилактики ацикловиром, у больных после ТКМ герпетические поражения ротоглотки нередко становились причиной обструкции верхних дыхательных путей, в связи с чем возникала необходимость в протективной интубации трахеи.
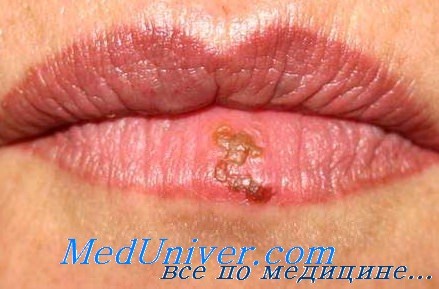
Процесс заживления глубоких некрозов часто проходит стадию отторжения фибриновых пленок с обнажением ригидных сосудов десен, что может быть чревато значительной кровопотерей, особенно у детей младшего возраста. Мы наблюдали кровотечения из язв на деснах в объеме до 400 мл в сутки. Кроме того, заживление язв нередко сопровождается обильной саливацией: потерей до 700—900 мл слюны в сутки, что может стать причиной обезвоживания у детей.
Знание закономерностей развития герпетического стоматита позволяет сделать вывод, что при нейтропении лечение его нельзя ограничивать ацикловиром: необходимо назначать препараты, активные в отношении стрептококков, анаэробов, грамотрицательной флоры и грибов. Монотерапии, отвечающей таким требованиям, не существует, поэтому при фебрильной нейтропении, сопровождающейся стоматитом, мы наряду с ацикловиром всегда используем бета-лактам с расширенным спектром антианаэробной активности (пиперациллин/тазобактам, имипенем, амоксициллин/клавуланат) либо к другим бета-лактамам добавляем метронидазол.
Часто драматического улучшения удается добиться при использовании клиндамицина или пенициллина. Кроме того, мы рекомендуем и сами всегда используем системную противогрибковую терапию.
Поражение вирусом простого герпеса пищевода
При распространении инфекции из полости ротоглотки поражается верхний сегмент пищевода. Другой путь — контаминация инфицированной герпес-вирусом слюной эрозированного (в результате желудочно-пищеводного рефлюкса или рвоты) пищевода. В этом случае поражается нижний сегмент пищевода. Клиническая картина среднего и дистального эзофагита очень типична: больные жалуются на ощущение кома за грудиной, сильное жжение и боли, которые значительно усиливаются после глотания и рвоты.
Следует отметить, что последняя локализация — одно из самых опасных проявлений герпесвирусной инфекции, поскольку именно дистальный эзофагит служит воротами для развития инвазивных бактериальных и грибковых инфекций. По морфологической картине (язвенно-некротические элементы, захватывающие все слои пищевода) отличить герпетическое поражение от цитомегаловирусного, бактериального или грибкового не представляется возможным. Без проведения биопсии установить точный микробиологический диагноз невозможно.
Если принято решение выполнить эзофагоскопию и биопсию, то для диагностики герпес-вирусного поражения необходимо получить биоптат эпителия края язвы, а для диагностики ЦМВ-поражения — ее дна. Это связано с тем, что герпес-вирус поражает эпителий, а цитомегаловирус — строму.
При герпетическом эзофагите, как и при герпетическом стоматите, особенно больным с фебрильной нейтропенией, наряду с ацикловиром всегда следует назначать антимикотик системного действия (амфотерицин В внутривенно в дозе 0,3—0,5 мг/кг в сутки, флюконазол внутривенно или внутрь, возможно вориконазол и итраконазол) и системные антибиотики, обладающие антианаэробной активностью.
Важную роль играют антацидная и антирефлюксная (ранитидин или омепразол, дофаминовые антагонисты) терапия и адекватное обезболивание наркотиками.
Поражение бронхиального дерева и легких вирусом простого герпеса
Чаще всего герпетический трахеобронхит развивается у иммунокомпрометированных больных с герпетическим эзофагитом, которые интубированы и находятся на искусственной вентиляции легких. Наблюдаются также фокальные герпетические пневмонии. Диффузные пневмонии с развитием дыхательной недостаточности, напротив, являются следствием диссеминированной герпетической инфекции у больных с глубоким дефицитом клеточного или гуморального иммунитета.
Поражение вирусом простого герпеса центральной нервной системы
Герпетический энцефалит — очень редкое проявление реактивации герпесвирусной инфекции у онкогематологических больных. Он не отличается от энцефалита у иммунокомпетентного хозяина, т. е. характеризуется энцефалитическим синдромом и признаками воспаления и некроза на компьютерных и ядерно-магнитных томограммах. Поражение спинного мозга вирусом герпеса является казуистикой. Описаны случаи восходящего поперечного миелита.
Диагностика поражений вируса простого герпеса
Известно несколько методов быстрой и специфической диагностики герпесвирусной инфекции. Классическим методом является выделение вируса, основанное на его цитопатическом действии на чувствительные культуры клеток млекопитающих. Этот метод достаточно быстрый (90 % позитивных результатов в первые 3 дня, 100% —в первые 7 дней культивирования) и весьма специфичный.
Существует более быстрый метод (комбинация иммуноферментного и культурального методов), которым выявляют наличие вирусных антигенов в чувствительной клеточной культуре, зараженной исследуемым материалом. Этот метод аналогичен описанному ранее методу shell vial для ЦМВ и позволяет получить результаты в течение суток.
Следует отметить, что, как и при ЦМВ-инфекции, серологические данные (наличие специфического IgM или повышение титра IgG) и выделение вируса простого герпеса со слюной не несут полезной оперативной информации. Особенно важно это при диагностике герпесвирусного энцефалита. Нам доводилось наблюдать неадекватную интерпретацию серологических тестов у больных с энцефалитическим синдромом и необоснованное назначение ацикловира в высоких дозах. Единственным надежным методом диагностики является проведение биопсии ткани головного мозга и вирусологического исследования.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Пример внутриутробной смешанной ЦМВ и герпес инфекции у новорожденного ребенка
Перинатальная вирусная инфекция смешанной этиологии характеризуется выраженной общеинфекционной симптоматикой, гипотрофией, персистирующим течением с обострениями, периодами лихорадки, диспептических явлений, полиорганной патологией, резистентностью к терапии.
В качестве типичного клинического примера Н.И. Михайловская приводит сведения о ребенке Д.
Девочка Д. (дата рождения 26.06.2004 года, история болезни 1969/2004). Клинический диагноз: Перинатальная персистирующая смешанная инфекция — цитомегаловирусная и вируса герпеса 6 типа, фаза репликации (перинатальное поражение ЦНС, гепатит, гипотрофия, анемия, кардиопатия).
Ребенок от 4 беременности, протекавшей гестозом и угрозой прерывания на протяжении всей беременности. Первая беременность закончилась самопрооизволь-ным выкидышем, вторая — срочными родами, третья — медицинским абортом. Девочка родилась в срок с признаками внутриутробной гипотрофии (вес 2550,0, длина 51 см), перинатальной энцефалопатии, с желтухой. С рождения получала лечение у невропатолога. В возрасте 3 месяцев (27.09) вес — 5 100,0, жалоб на ребенка не было. Сделана первая вакцинация АКДС и полиомиелита. Спустя сутки мама стала обращаться к специалистам по поводу выраженного беспокойства, нарушения сна, отказа ребенка от еды, упорного срыгивания, потери веса.
В возрасте 3,5 месяца госпитализирована в Детскую областную больницу, где выявлено повышение активности печеночных ферментов: АЛТ — 240 ед, ACT— 126 ед. Госпитализирована в Центр гепатологии, где у ребенка и у мамы исключена инфекция вирусов гепатитов А, В, С, D, anti-HIV, RW отрицательны. При исследовании в Центре молекулярной диагностики ЦНИИЭ МЗ РФ у ребенка обнаружены anti-CMV IgG в концентрации 93 ME /мл (при допустимой > 10,0). Анемия: НВ — 92 г/л гипохромия, анизоцитоз. УЗИ — гепатомегалия, стенки сосудов печени подчеркнуты, добавочная долька селезенки. НСГ — четвертый желудочек расширен, углублен, глубина передних рогов — 7 мм, умеренная дилятация боковых желудочков головного мозга.
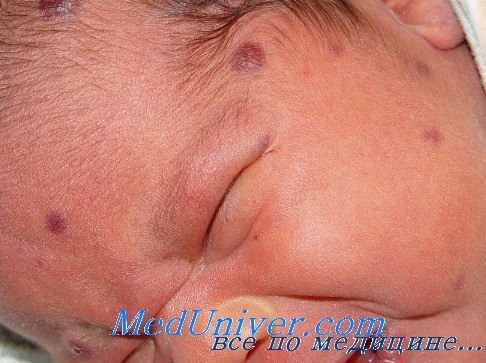
Диагностирована перинатальная цитомегаловирусная инфекция (поражение ЦНС — энцефалопатия с признаками вялотекущего энцефалита, гепатит, анемия). Проведены курсы противовирусной терапии (виферон, ацикловир), ликопида, гепатопротекторов, ак-тиферрина, выполнены назначения невропатолога. При обследовании в возрасте 5,5 месяцев (1.12.04) все функциональные пробы печени в норме. Повторно госпитализирована в возрасте 7 месяцев 8.02.2005 года. Со слов мамы за 3 недели до госпитализации — вакцинация против полиомиелита, после чего внезапное резкое ухудшение состояния, отказ от еды, потеря в весе. При поступлении состояние ребенка средней тяжести за счет интоксикации. Девочка вяла, беспокойна, не интересуется окружающим, крик монотонный, эмоционально не окрашен. Кожа бледна, с сероватым оттенком. Печень на 3—4—3 см выступает из подреберья, плотновата, болезненна, селезенка до 2 см.
Со стороны функциональных проб печени — резкое повышение активности цитолитических ферментов — АЛТ до 9 норм, ACT до 3 норм. Концентрация anti-CMV IgG повысилась до 177!! МЕ/мл. Для уточнения диагноза и тактики лечения девочка госпитализирована в Республиканскую детскую клиническую больницу. При обследовании выявлены маркеры смешанной вирусной внутриутробной инфекции: anti-CMV IgG 168 МЕ/мл, DNA CMV обнаружена в моче и слюне, DNA V. Herpes 6 типа — в крови. Микробиологическое исследование кала: лактозонегативная кишечная палочка (кп) 0, гемолизирующая кп 10* 9, обнаружены золотистый стафилококк, грибы рода Кандида, Клебсиелла, Цитробактер в высоких разведениях.
Допплерография печени и портальной системы — внутрипеченочные желчные протоки с фрагментарно уплотненными стенками. Стенки внутриорганного бассейна равномерно утолщены. УЗИ — Селезенка на верхней границе нормы, подчеркнут рисунок сосудов, почки — ЧЛК с уплотненными стенками. Специалистами РДКБ была назначена терапия: виферон по схеме не менее 6 месяцев, траумель по 1 /2 таблетки 3 раза между едой + хепель по 1 /2 таблетки 3 раза за 30 минут до еды, курсами по 2 месяца с перерывом в 1 месяц, поливалентный бактериофаг 2 курса по 4 дня, по схеме абомин, креон, гомеопатические препараты. Назначения невропатолога включали фенибут. Общее состояние и самочувствие ребенка улучшились, снизилась активности АЛТ и ACT (до 2—3 норм). Однако в возрасте 11 месяцев — вновь беспокойство, нарушение сна, снижение аппетита. За 5 месяцев девочка прибавила в весе лишь 700,0: вес в возрасте 6 месяцев— 7 500,0, в 8 месяцев— 7 300,0, в 9 месяцев — 7 000,0, в 11 месяцев — 8 200,0.
При поступлении в стационар состояние ребенка средней тяжести, явления интоксикации, клинико-лабораторная симптоматика гепатита.
Активность ферментов повысилась до 8 норм, появилась биохимическая симптоматика внутрипеченочного холестаза. Маркеры вирусов гепатитов А, В, С, D отрицательны. В анализах мочи — изостенурия, лейкоциты до 20 в поле зрения. Выписана с улучшением, с тенденцией к нормализации активности ферментов. Однако болезнь приняла хроническое течение, на фоне признаков вторичного иммунодефицитного состояния. Ребенок повторно направлен в РДКБ.
Таким образом, внутриутробная инфекция смешанной вирусной этиологии — цитомегаловирусная и вируса герпеса 6 типа — протекала у ребенка с признаками полиорганной патологии, приняла хроническое течение, осложнилась проявлениями вторичного иммунодефицитного состояния. Фактором, провоцирующим обострение в возрасте трех и шести месяцев, была вакцинация. Детям с признаками перинатальной вирусной инфекции показан медицинский отвод от живых вакцин сроком не менее 2 лет.
Читайте также:

