Вирусный кардит что это такое
Обновлено: 24.04.2024
Синдром первичного гиперальдостеронизма описал Конн (1955 г.) в связи с альдостеронпродуцирующей аденомой коры надпочечников (альдостеромой), удаление которой привело к полному выздоровлению больной. В настоящее время собирательное понятие первичного гиперальдостеронизма объединяет ряд близких по клиническим и биохимическим признакам, но различных по патогенезу заболеваний, в основе которых лежит чрезмерная и независимая (или частично зависимая) от системы ренин-ангиотензин продукция альдостерона клубочковой зоной коры надпочечников, сопровождающаяся артериальной гипертензией и миастенией.
Что провоцирует / Причины Первичного гиперальдостеронизма:
Причиной гиперальдостеронизма может быть гормонально-активная аденома коры надпочечников (альдостерома), двусторонняя гиперплазия клубочковой зоны коры надпочечников, множественные микроаденомы коры надпочечников. Гиперальдостеронизм может развиваться при хронических заболеваниях почек, гипертонической болезни, при некоторых опухолях почек.
Причиной гиперальдостеронизма может быть длительное употребление лекарственных препаратов (мочегонных, слабительных, контрацептивных).
Преходящее состояние гиперальдостеронизма наблюдается в период лютеиновой фазы менструального цикла, во время беременности, при ограничении натрия в диете.
В зависимости от причины в клинической практике различаются:
1) альдостеронизм с низкой секрецией ренина:
а) первичный гипералъдостеронизм в результате опухоли клубочкового слоя коры надпочечников (синдром Конна);
б) идиопатический гиперальдостеронизм (диффузная гиперплазия коры надпочечников);
в) дексаметазонзависимый гиперальдостеронизм (подавляемый глюкокортикоидами);
г) гиперальдостеронизм, вызванный эктопическими опухолями.
2) альдостеронизм с нормальной или повышенной секрецией ренина (вторичный гиперальдостеронизм):
а) симптоматическая артериальная гипертензия при реноваскулярной патологии, заболеваниях почек, гипертонической болезни;
б) ренинсекретирующие опухоли почек (опухоль Вильмса);
в) ятрогенный и физиологический гиперальдостеронизм:
— гиперальдостеронизм в период лютеиновой фазы менструального цикла, во время беременности;
— гиперальдостеронизм как результат ограничения натрия в диете, избыточного приема мочегонных, слабительных препаратов;
— состояния, сопровождающиеся гиповолемией (кровотечения и прием контрацептивов).
Патогенез (что происходит?) во время Первичного гиперальдостеронизма:
Патогенез заболевания связан с избыточной секрецией альдостерона. Действие альдостерона при первичном гиперальдостеронизме проявляется его специфическим влиянием на транспорт ионов натрия и калия. Связываясь с рецепторами, расположенными во многих секреторных органах и тканях (канальцы почек, потовые и слюнные железы, слизистая кишечника), альдостерон контролирует и реализует катионообменный механизм. При этом уровень секреции и экскреции калия определяется и лимитируется объемом реабсорбированного натрия. Гиперпродукция альдостерона, усиливая реабсорбцию натрия, индуцирует потерю калия, которая по своему патофизиологическому эффекту перекрывает влияние реабсорбированного натрия и формирует комплекс метаболических расстройств, лежащих в основе клиники первичного гиперальдостеронизма.
Общая потеря калия с истощением его внутриклеточных запасов приводит к универсальной гипокалиемии, а экскреция хлора и замена калия внутри клеток на натрий и водород способствуют развитию внутриклеточного ацидоза и гипокалиемического, гипохлоремического внеклеточного алкалоза.
Дефицит калия вызывает функциональные и структурные нарушения в органах и тканях: дистальном отделе почечных канальцев, в гладкой и поперечно-полосатой мускулатуре, в центральной и периферической нервной системе. Патологическое влияние гипокалиемии на нервно-мышечную возбудимость усугубляется гипомагниемией в результате торможения реабсорбции магния. Подавляя секрецию инсулина, гипокалиемия снижает толерантность к углеводам, а поражая эпителий почечных канальцев, делает их рефракторными к влиянию антидиуретического гормона. При этом нарушается ряд почечных функций и, прежде всего, снижается их концентрационная способность. Задержка натрия вызывает гиперволемию, подавляет продукцию ренина и ангиотензина II, повышает чувствительность сосудистой стенки к различным эндогенным прессорным факторам и, в конечном итоге, способствует развитию артериальной гипертензии. При первичном гиперальдостеронизме, обусловленном и аденомой, и гиперплазией коры надпочечников, уровень глюкокортикоидов, как правило, не превышает нормы, даже в тех случаях, когда морфологический субстрат гиперсекреции альдостерона включает не только элементы клубочковой зоны, но и пучковой. Иная картина при карциномах, которые характеризуются смешанным интенсивным гиперкортицизмом, а вариабельность клинического синдрома определяется преобладанием тех или иных гормонов (глюко- или минералокортикоидов, андрогенов). Наряду с этим истинный первичный гиперальдостеронизм может быть обусловлен высокодифференцированным раком коры надпочечников с нормальной продукцией глюкокортикоидов.
Патанатомия. Морфологически выделяют, по меньшей мере, 6 вариантов формы гиперальдостеронизма с низким уровнем ренина:
1) с аденомой коры надпочечника в сочетании с атрофией окружающей ее коры;
2) с аденомой коры надпочечника в сочетании с гиперплазией элементов клубочковой и/или пучковой и сетчатой зон;
3) на почве первичного рака коры надпочечника;
4) с множественным аденоматозом коры;
5) с изолированной диффузной или очаговой гиперплазией клубочковой зоны;
6) с узелковой диффузно-узелковой или диффузной гиперплазией всех зон коры.
Аденомы — в свою очередь разнообразного типа строения, как и изменения в окружающей их адреналовой ткани. Изменения в надпочечниках больных с неопухолевыми формами низкоренинового гиперальдостеронизма сводятся к гиперплазии диффузной или диффузно-узелковой одной, двух или всех зон коры и/или к выраженным явлениям аденоматоза, при которых очаговая гиперплазия сопровождается гипертрофией клеток и их ядер, увеличением ядерно-плазменного отношения, усилением оксифилии цитоплазмы и уменьшения содержания в ней липидов. Гистохимически для этих клеток характерны высокая активность ферментов стероидогенеза и уменьшение содержания цитоплазматических липидов, главным образом, за счет эфиров холестерина. Узелковые образования формируются чаще всего в пучковой зоне в основном из элементов ее наружных частей, которые образуют псевдоацинарные или альвеолярные структуры. Но клетки в узелковых образованиях обладают такой же функциональной активностью, как и клетки окружающей их коры. Гиперпластические изменения приводят к дву- и трехкратному увеличению массы надпочечника и к гиперсекреции альдостерона обоими надпочечниками. Это наблюдается более чем у 30% больных с гиперальдостеронизмом и низкой активностью ренина в плазме. Причиной такой патологии может быть выделенный у ряда больных с первичным гиперальдостеронизмом альдостеронстимулирующий фактор гипофизарного происхождения, хотя твердых доказательств этого нет.
Симптомы Первичного гиперальдостеронизма:
Клинические черты первичного гиперальдостеронизма слагаются из тяжелых расстройств электролитного баланса, нарушений функций почек и артериальной гипертензии. Наряду с общей и мышечной слабостью, нередко являющейся первым поводом для обращения к врачу, больных беспокоят головные боли, жажда и повышенное, преимущественно ночное, мочеотделение. Изменение уровней калия и магния увеличивает нервно-мышечную возбудимость и вызывает периодические приступы судорог различной интенсивности. Характерны парестезии в различных мышечных группах, подергивания мышц лица, положительные симптомы Хвостека и Труссо.
Обмен кальция, как правило, не страдает. Возникают периодические приступы резкой мышечной слабости, вплоть до полной обездвиженности нижних конечностей (псевдопараличи), продолжительностью от нескольких часов до нескольких дней. Одним из косвенных симптомов, имеющих диагностическое значение, является значительное повышение электрического потенциала в толстой кишке. Большинство симптомов гиперальдостеронизма (исключая гипертензию) носит неспецифический характер и определяется гипокалиемией и алкалозом.
Основные симптомы гиперальдостеронизма и их частота по материалам работ Конна:
1) гипертензия—100%;
2) гипокалиемия—100%;
3) гипохлоремический алкалоз — 100%;
4) повышение уровня альдостерона — 100%;
5) низкий уровень ренина — 100%;
6) протеинурия— 85%;
7) гипостенурия, резистентная к вазопрессину — 80%;
8) нарушение окисления мочи — 80%;
9) изменение ЭКГ — 80%;
10) повышенный уровень калия в моче — 75%;
11) мышечная слабость — 73%;
12) ночная полиурия — 72%;
13) гипернатриемия — 65%;
14) снижение толерантности к глюкозе — 60%;
15) головные боли — 51%;
16) ретинопатия — 50%;
17) жажда — 46%;
18) парестезии — 24%;
19) периодические параличи — 21%;
20) тетания — 21%;
21) общая слабость — 19%;
22) боли в мышцах — 10%;
23) бессимптомные формы — 6%;
24) отеки —3%.
Обращают на себя внимание бессимптомное течение заболевания у 6% больных и гипокалиемия у 100%. Вместе с тем в настоящее время известны нормокалиемические формы первичного гиперальдостеронизма. Сообщается и о казуистических нормо-тензивных вариантах заболевания, сохраняющего все другие черты типичного первичного гиперальдостеронизма. Важнейшим, а на ранних стадиях нередко и единственным, симптомом является артериальная гипертензия. Доминирующая в клинической картине в течение многих лет, она может маскировать признаки гиперальдостеронизма. Существование низкорениновой гипертонической болезни (10-420% всех больных гипертонической болезнью) особенно затрудняет распознавание первичного гиперальдостеронизма. Гипертензия может быть стабильной или сочетаться с пароксизмами. Уровень ее повышается с длительностью и тяжестью заболевания, но злокачественное течение отмечается нечасто. Гипертензия не реагирует на ортостатическую нагрузку, а при проведении пробы Вальсальвы ее уровень при первичном гиперальдостеронизме не возрастает в отличие от гипертензий иной этиологии. Введение спиронолактонов (верошпирон, альдактон) в суточной дозе 400 мг в течение 10—15 дней снижает гипертензию одновременно с нормализацией уровня калия. Последнее происходит только у больных с первичным гиперальдостеронизмом. Отсутствие этого эффекта ставит под сомнение диагноз первичного гиперальдостеронизма, исключая тех больных, у которых имеются выраженные явления атеросклероза. У половины больных отмечается ретинопатия, но течение ее доброкачественное, как правило без признаков пролиферации, дегенерации и кровоизлияний. Гипертензия левого желудочка и признаки его перегрузки на ЭКГ отмечаются в большинстве случаев. Однако сердечно-сосудистая недостаточность не характерна для первичного гиперальдостеронизма.
Осложнения. Осложнения обусловлены в основном гипертензионным и нейромышечным синдромами.
Возможны инфаркты, инсульты, гипертоническая ретинопатия, выраженная миастения. Изредка отмечается малигнизация опухоли.
Диагностика Первичного гиперальдостеронизма:
Диагностические критерии:
1) сочетание артериальной гипертензии и миастенического синдрома;
2) гипернатриемия, гипокалиемия, гиперкалийурия, гипонат-рийурия;
3) полиурия, изо- и гипостенурия. Реакция мочи щелочная;
4) увеличение уровня альдостерона в плазме и его экскреция с мочой;
5) увеличение размеров надпочечников при ультразвуковой сонографии (компьютерной томографии или ангиографии);
6) признаки гипокалиемии на ЭКГ.
Для уточнения диагноза проводятся функциональные пробы.
Проба с верошпироном делается больным, получающим достаточное количество хлористого натрия (до 6 г в сутки). Опредляют исходное содержание калия в сыворотке, после чего орально в течение 3 дней назначают верошпирон (по 400 мг/сут). Повышение содержания калия более чем на 1 ммоль/л подтверждает ги-перальдостеронизм.
Проба с нагрузкой хлористым натрием. В течение 3—4 дней больной получает не менее 9 г хлористого натрия в сутки. При гиперальдостеронизме отмечается снижение содержания калия в сыворотке.
Проба с фуросемидом. Больной внутрь принимает 0,08 г фуросемида, и через 3 ч определяют содержание ренина и альдостерона. Повышение уровня альдостерона и снижение ренина свидетельствует о первичном гиперальдостеронизме.
Дифференциальный диагноз проводится с заболеваниями, сопровождающимися синдромом артериальной гипертензии.
Гипертоническая болезнь. Общие признаки: головная боль, артериальная гипертензия, гипертрофия левого желудочка сердца. Отличия: при гиперальдостеронизме отмечается сочетание артериальной гипертензии и миастеноподобного синдрома с преходящими параличами, увеличение альдостерона в плазме крови и его экскреции с мочой, объемное образование или гиперплазия коры надпочечников.
Артериальная гипертензия почечного генеза. Общие признаки: стойкая артериальная гипертензия. Отличия: при артериальной гипертензии почечного генеза отсутствуют нейромышечные симптомы, отмечается резистентность к гипотензивным препаратам со стороны диастолического артериального давления. Выражен мочевой синдром (протеинурия, гематурия). Возможно повышение уровня креатинина крови, ускорение скорости оседания эритроцитов.
Лечение Первичного гиперальдостеронизма:
Лечение зависит от причин, обусловливающих гиперальдостеронизм. При первичном гиперальдостеронизме показано хирургическое лечение (одно- или двусторонняя адреналэктомия с последующей заместительной терапией). Предоперационная подготовка проводится антагонистами альдостерона (верошпироном), препаратами калия. При вторичном гиперальдостеронизме осуществляется длительное медикаментозное лечение спироно-лактонами, препаратами калия, ингибиторами синтеза глюкокортикоидов (элиптеном, аминоглютетиамидом).
Идиопатический и неопределенный альдостеронизм создают альтернативную ситуацию, при которой целесообразность хирургического лечения оспаривается многими авторами. Даже тотальная адреналэктомия одного надпочечника и субтотальная другого, устраняя гипокалиемию у 60% больных, не дает существенного гипотензивного эффекта. В то же время спиронолактоны на фоне низкосолевой диеты и добавления хлорида калия нормализуют уровень калия, снижают артериальную гипертензию. При этом спиронолактоны не только устраняют эффект альдостерона на почечном и других секретирующих калий уровнях, но и тормозят биосинтез альдостерона в надпочечниках. Почти у 40% больных хирургическое лечение оказывается полностью эффективным и оправданным. Аргументами в его пользу могут быть дороговизна пожизненного использования больших доз спиронолактонов (до 400 мг ежедневно), а у мужчин частота развития импотенции и гинекомастии вследствие антиандрогенного эффекта спиронолактонов, имеющих близкую к стероидам структуру и подавляющих синтез тестостерона по принципу конкурентного антагонизма. Эффективность хирургического лечения и восстановление нарушенного метаболического баланса в определенной степени зависит от длительности заболевания, возраста больных и степени развития вторичных сосудистых осложнений.
Однако и после успешного удаления альдостеромы гипертензия остается у 25% больных, а у 40% — рецидивирует через 10 лет.
При солидных размерах опухоли, большой длительности заболевания с интенсивными метаболическими расстройствами через некоторое время после операции могут появиться эпизоды гипо-альдостеронизма (слабость, склонность к обморокам, гипонатриемия, гиперкалиемия).
Хирургическому лечению должно предшествовать длительное лечение спиронолактонами (1—3 месяца по 200—400 мг ежедневно) до нормализации уровня электролитов и устранения ги-пертензии. Наряду с ними или вместо них могут быть использованы калийсберегающие диуретики (триампур, амилорид).
Гипотензивный эффект спиронолактонов при первичном альдостеронизме потенцируется каптоприлом.
Длительное введение спиронолактонов несколько активизирует подавленную ренин-ангиотензинную систему, особенно при двусторонней гиперплазии, и тем самым осуществляется профилактика послеоперационного гипоальдостеронизма.
Независимо от этиологии заболевания диета должна содержать ограниченное количество поваренной соли и продукты, богатые калием (картофель, курагу, рис, изюм).
К каким докторам следует обращаться если у Вас Первичный гиперальдостеронизм:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Первичного гиперальдостеронизма, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .

Эпикардит, перикардит, эндокардит – этими терминами обобщается большая группа сердечнососудистых заболеваний, при которых воспаляются те или иные оболочки сердца. Этиология может быть как инфекционной (причиной становятся вирусные или бактериальные патогены), так и иной, – аллергической, ревматической, вторичной (при каком-либо поражении и последующем присоединении инфекции), либо идиопатической, т.е. неустановленной.
2. Причины
Как с очевидностью вытекает из названия, непосредственной причиной воспаления в данном случае является жизнедеятельность болезнетворных вирусов, причем спектр возможных вирусных патогенов в данном случае весьма широк (корь, энтеровирусы, вирус Коксаки, краснуха и т.д.). Фактором риска врожденного вирусного кардита, который клинически может проявиться спустя годы, является инфекция, перенесенная матерью в период вынашивания беременности.
Но даже если иммунной системе удается полностью подавить активность патогена, в тканях миокарда еще длительное время сохраняются нарушения обмена протеинов и нуклеиновых кислот.
3. Симптомы и диагностика
Вирусным кардитам присуща как общевоспалительная, так и специфическая симптоматика.
К общим симптомам относятся недомогание, утомляемость, субфебрильная температура (реже встречается более выраженная гипертермия с лихорадочным компонентом), потливость, головная боль и т.д.
На поражение миокарда указывают боли в сердце (которые в данном случае могут широко варьировать как по характеру, так и по выраженности), иногда в степени стенокардического приступа, а также аритмия, одышка, усиленное и учащенное сердцебиение, цианотичность носогубного треугольника, ослабленный пульс.
В большинстве случаев сердечная недостаточность при вирусных кардитах не является жизнеугрожающей, однако при присоединении воспаления мозговых оболочек (энцефаломиокардит) состояние больного может значительно утяжелиться неврологической симптоматикой. Нередко специфической симптоматике сопутствуют также проявления нефрита, васкулита и т.д.
Для диагностики важен, в первую очередь, анамнез. Производится стандартный осмотр, аускультация сердечных тонов, назначаются общеклинические и иммунологические анализы крови.
4. Лечение
В остром периоде вирусного кардита (или при обострении хронического) больного следует госпитализировать. После купирования острой симптоматики пациент переводится на амбулаторное лечение и наблюдение; в дальнейшем – эффективно санаторно-курортное лечение.
В остром состоянии ребенку необходим щадящий режим с минимальной физической активностью сроком, как минимум, 1-2 недели. Разрабатывается и назначается индивидуальная диета, которая обязательно включает богатые калием продукты при строгом исключении любых стимуляторов.
Собственно противовирусная терапия, увы, в настоящее время малоэффективна, и ее возможности (гиперболизируемые, в том числе, маркетинговой политикой) зачастую переоцениваются населением. В частности, препараты интерферона имеет смысл назначать только на ранних стадиях вирусного кардита.
Основу терапевтической стратегии составляют нестероидные, а в некоторых случаях и гормональные противовоспалительные средства. Иногда показаны антикоагулянты, сердечные гликозиды, гипотензивные диуретики, антиаритмические препараты и т.д.
Очень важно соблюдать все меры профилактики, предписанные врачом во избежание тяжелых осложнений и рецидивов вирусного кардита.
Неревматические кардиты у детей – воспалительные поражения одной или нескольких оболочек сердца, не связанные с ревматической или другой системной патологией. Течение неревматического кардита у детей сопровождается тахикардией, одышкой, цианозом, аритмией, сердечной недостаточностью, отставанием в физическом развитии. При диагностике неревматического кардита у детей учитываются клинические, лабораторные, электрокардиографические, рентгенологические данные. В терапии неревматического кардита у детей используются сердечные гликозиды, НВПС, гормоны, мочегонные, метаболические, противовирусные и антимикробные препараты.
Общие сведения
Неревматические кардиты у детей – группа воспалительных заболеваний сердца, преимущественно инфекционно-аллергической этиологии. Целесообразность выделения неревматических кардитов в педиатрии обусловлена не только изолированным, но и часто сочетанным поражением 2-х и 3-х оболочек сердца у детей. Среди неревматических кардитов в детской кардиологии встречаются миокардиты, перикардиты, эндокардиты, а также миоперикардиты и панкардиты. Истинная распространенность неревматических кардитов в детской популяции неизвестна; по данным аутопсии, патология обнаруживается у 3-9% детей. Неревматическими кардитами болеют дети различных возрастных групп, однако среди них преобладают дети раннего возраста, преимущественно мальчики.

Причины неревматических кардитов у детей
Неревматический кардит у ребенка может быть обусловлен инфекционными или аллергоиммунологическими факторами. Среди инфекционных агентов преобладают вирусы (ECHO, Коксаки А и В, аденовирусы, вирусы гриппа типа А или В), встречаются бактерии (стрептококки, стафилококки), риккетсии, грибы, ассоциированная флора. Причиной врожденного кардита у ребенка выступают внутриутробные инфекции, воздействующие на плод. Бактериальные неревматические кардиты у детей нередко являются осложнением назофарингеальной инфекции, сепсиса, гематогенного остеомиелита, дифтерии, сальмонеллеза.
Кардиты аллергоиммунологической этиологии могут развиваться как следствие вакцинации, введения сывороток, приема лекарственных препаратов. Довольно часто прослеживается инфекционно-аллергическая природа поражения сердца. Примерно у 10% детей этиология неревматического кардита так и остается невыясненной.
Предрасполагающими факторами, на фоне которых активизируется вирусно-бактериальная микрофлора, повышается восприимчивость к токсинам и аллергенам, изменяется иммунологическая реактивность, могут выступать интоксикации, перенесенные ребенком инфекции, переохлаждения, психоэмоциональные и физические перегрузки, предшествующие хирургические манипуляции на сердце и сосудах, тимомегалия. У части детей с неревматическими кардитами обнаруживаются наследственные нарушения иммунной толерантности.
Классификация неревматических кардитов у детей
Таким образом, в зависимости от этиологии различают вирусные, бактериальные, паразитарные, грибковые, аллергические, идиопатические неревматические кардиты у детей. Разновидностью инфекционно-аллергического кардита служит миокардит Абрамова-Фидлера.
С учетом фактора времени кардиты делятся на врожденные (ранние и поздние) и приобретенные. По длительности течение кардита может быть острым (до 3-х месяцев), подострым (до 18 месяцев), хроническим (более 18 месяцев); по степени тяжести – легким, среднетяжелым и тяжелым.
Исходом и осложнениями неревматических кардитов у детей могут являться выздоровление, сердечная недостаточность (левожелудочковая, правожелудочковая, тотальная), гипертрофия миокарда, кардиосклероз, нарушение ритма и проводимости, тромбоэмболия, легочная гипертензия, констриктивный перикардит и пр.
Симптомы неревматических кардитов у детей
Врожденные кардиты
Ранний врожденный неревматический кардит обычно манифестирует сразу после рождения или в первом полугодии жизни. Ребенок рождается с умеренной гипотрофией; с первых дней жизни у него отмечается вялость и быстрая утомляемость при кормлении, бледность кожных покровов и периоральный цианоз, беспричинное беспокойство, потливость. Тахикардия и одышка, выраженные в покое, еще более усиливаются при сосании, плаче, дефекации, купании, пеленании. Дети с врожденными неревматическими кардитами рано и заметно отстают в наборе веса и физическом развитии. Уже в первые месяцы жизни у детей выявляется кардиомегалия, сердечный горб, гепатомегалия, отеки, рефрактерная к терапии сердечная недостаточность.
Клиника позднего врожденного неревматического кардита у детей развивается на 2-3 году жизни. Часто протекает с поражением 2-х или 3-х оболочек сердца. Признаки кардиомегалии и сердечной недостаточности выражены в меньшей степени, по сравнению с ранним кардитом, однако в клинической картине преобладают явления нарушения ритма и проводимости (трепетания предсердий, полная атриовентрикулярная блокада сердца и др.). Наличие у ребенка судорожного синдрома указывает на инфекционное поражение ЦНС.
Приобретенные кардиты
Острый неревматический кардит чаще развивается у детей раннего возраста на фоне перенесенного инфекционного процесса. Неспецифическая симптоматика характеризуется слабостью, раздражительностью, навязчивым кашлем, приступами цианоза, диспепсическими и энцефалитическими реакциями. Остро или постепенно возникает левожелудочковая недостаточность, характеризующаяся одышкой и застойными хрипами в легких. Клиническую картину неревматического кардита у детей обычно определяют различные нарушения ритма и проводимости (синусовая тахикардия или брадикардия, экстрасистолия, внутрижелудочковые и атриовентрикулярные блокады).
Диагностика
Распознавание неревматического кардита у детей должно проходить при обязательном участии детского кардиолога. При сборе анамнеза важно установить связь манифестации заболевания с предшествующей инфекцией или другими возможными факторами.
Постановке диагноза неревматического кардита у детей помогает совокупность клинико-инструментальных данных. Электрокардиография при кардитах не демонстрирует каких-либо патогномоничных признаков; обычно у детей выявляются длительно сохраняющиеся нарушения ритма сердца, АВ-блокады, блокады ножек пучка Гиса, признаки гипертрофии левых отделов сердца.
При рентгенографии органов грудной клетки выявляется кардиомегалия, изменение формы сердечной тени, усиление легочного рисунка за счет венозного застоя, признаки интерстициального отека легких. Результаты УЗИ сердца у ребенка демонстрируют дилатацию полостей сердца, снижение сократительной активности миокарда левого желудочка и фракции выброса.
При проведении иммунологического анализа крови отмечается повышение иммуноглобулинов (IgM и IgG), нарастание титров вирусных антител. Наиболее точные диагностические сведения возможно получить при эндомиокардиальной биопсии сердечной мышцы.
Врожденные неревматические кардиты у детей необходимо дифференцировать от врожденных пороков сердца (прежде всего, открытого атривентрикулярного канала, аномалии Эбштейна, синдрома Бланда-Уайта-Гарланда), перинатальной гипоксии. Приобретенные неревматические кардиты требуют разграничения с ревматизмом, кардиомиопатией, аритмиями другого генеза, констриктивным перикардитом, пролапсом митрального клапана у детей, опухолями сердца.
Лечение неревматических кардитов у детей
Терапия неревматического кардита у детей предусматривает стационарное и реабилитационное амбулаторное лечение. В период госпитализации ограничивается двигательная активность ребенка - постельный режим соблюдается в течение 2-4 недель. Основу питания составляет диета с повышенным содержанием солей калия и витаминов. Ребенку показаны занятия ЛФК под контролем инструктора.
Медикаментозную терапию неревматического кардита у детей составляют НПВС, глюкокортикостероиды, сердечные гликозиды, диуретики, препараты метаболического действия, антиагреганты, антикоагулянты, антиаритмические средства, ингибиторы АПФ и др. Если известен этиологический фактор неревматического кардита, ребенку назначается соответствующее этиотропное лечение (иммуноглобулины, интерфероны, антибиотики).
На амбулаторном этапе показаны реабилитационные мероприятия в условиях санатория кардиоревматологического профиля. Диспансерное наблюдение детей, перенесших острый и подострый неревматический кардит, проводится в течение 2-3 лет; врожденный и хронический варианты требуют пожизненного наблюдения. Профилактические прививки детям, перенесшим неревматический кардит, проводятся после снятия с диспансерного учета; хронический кардит является противопоказанием к вакцинации.
Прогноз и профилактика неревматических кардитов у детей
При благоприятном развитии событий постепенно регрессируют симптомы сердечной недостаточности, уменьшаются размеры сердца, нормализуется сердечный ритм. Легкие формы неревматического кардита у детей обычно заканчиваются выздоровлением; при тяжелых летальность достигает 80%. Факторами, отягощающими прогноз, служат прогрессирующая сердечная недостаточность, кардиосклероз, легочная гипертензия, стойкие нарушения ритма и проводимости.
Профилактика врожденного неревматического кардита у детей заключается в предупреждении внутриутробного инфицирования плода. Исключить развитие приобретенного кардита позволяет закаливание ребенка, лечение очаговых инфекций, предупреждение поствакцинальных осложнений.
Миокардит – воспаление мышечной оболочки сердца (миокарда), чаще ревматического, инфекционного или инфекционно-аллергического характера. Течение миокардита может быть острым или хроническим. Острый миокардит проявляется одышкой, цианозом, отеками на ногах, набуханием вен на шее, болями в сердце, сердцебиением, аритмиями. Часто развитию миокардита предшествует перенесенная инфекция (дифтерия, ангина, скарлатина, грипп и др.). В дальнейшем возможны рецидивы заболевания (при ревматическом миокардите), развитие сердечной недостаточности и тромбоэмболий сосудов различных органов.
Общие сведения
Миокардит – воспаление мышечной оболочки сердца (миокарда), чаще ревматического, инфекционного или инфекционно-аллергического характера. Течение миокардита может быть острым или хроническим. Острый миокардит проявляется одышкой, цианозом, отеками на ногах, набуханием вен на шее, болями в сердце, сердцебиением, аритмиями. Часто развитию миокардита предшествует перенесенная инфекция (дифтерия, ангина, скарлатина, грипп и др.). В дальнейшем возможны рецидивы заболевания (при ревматическом миокардите), развитие сердечной недостаточности и тромбоэмболий сосудов различных органов.
Частота заболеваемости миокардитом намного выше статистической из-за поздней диагностики и латентных форм, когда заболевание протекает стерто или в легкой форме. Признаки воспалительного процесса в миокарде в 4–9% случаев обнаруживаются только на аутопсии (по результатам патологоанатомических исследований). От острого миокардита умирает от 1 до 7% больных, у людей молодого возраста в 17-21% случаев он становится причиной внезапной смерти.
Миокардит приводит к развитию сердечной недостаточности и нарушению ритма сердца, что является ведущими причинами летального исхода. Миокардиты встречаются чаще у молодых людей (средний возраст пациентов 30 – 40 лет), хотя заболевание может возникнуть в любом возрасте. Мужчины заболевают миокардитом несколько реже женщин, но у них чаще развиваются тяжелые формы заболевания.

Причины миокардита
Миокардиты включают большую группу заболеваний сердечной мышцы воспалительного генеза, проявляющихся поражением и нарушением функции миокарда. Частой причиной миокардита являются различные инфекционные заболевания:
- вирусные (вирусы Коксаки, гриппа, аденовирусы, герпеса, гепатита В и С);
- бактериальные (коринеобактерии дифтерии, стафилококки, стрептококки, сальмонеллы, хламидии, риккетсии);
- грибковые (аспергиллы, кандиды),;
- паразитарные (трихинеллы, эхинококки) и др.
Тяжелая форма миокардита может возникать при дифтерии, скарлатине, сепсисе. Высокой кардиотропностью обладают вирусы, вызывающие миокардит в 50% случаев. Иногда миокардит развивается при системных заболеваниях соединительной ткани: системной красной волчанке, ревматизме, васкулитах, ревматоидном артрите, при аллергических заболеваниях. Также причиной миокардита может служить токсическое воздействие некоторых лекарственных препаратов, алкоголя, ионизирующее излучение. Тяжелое прогрессирующее течение отличает идиопатический миокардит невыясненной этиологии.
Провоцирующими моментами возникновения миокардита являются острые инфекции (чаще вирусные), очаги хронической инфекции; аллергозы, нарушенные иммунологические реакции; токсическое воздействие на организм (лекарств, алкоголя, наркотиков, ионизирующего излучения, при тиреотоксикозе, уремии и др.).
Патогенез
Миокардит в большинстве случаев сопровождается эндокардитом и перикардитом, реже воспалительный процесс затрагивает только миокард. Повреждение миокарда может возникать при прямом миокардиоцитолитическом действии инфекционного агента; под влиянием токсинов, циркулирующих в крови (в случае системной инфекции); и как результат аллергической или аутоиммунной реакции. Нередко встречаются инфекционно-аллергические миокардиты.
Иммунные нарушения, наблюдаемые при миокардите, проявляются расстройством всех звеньев иммунитета (клеточного, гуморального, фагоцитоза). Инфекционный антиген запускает механизм аутоиммунного повреждения кардиомиоцитов, приводящий к значительным изменениям миокарда: дистрофическим изменениям мышечных волокон, развитию экссудативных или пролиферативных реакций в интерстициальной ткани. Следствием воспалительных процессов при миокардите является разрастание соединительной ткани и развитие кардиосклероза. При миокардите заметно снижается насосная функция сердечной мышцы, что часто носит необратимый характер и приводит к тяжелому состоянию недостаточности кровообращения, нарушениям сердечного ритма и проводимости, служит причиной инвалидности и летального исхода в молодом возрасте.
Классификация
В зависимости от механизма возникновения и развития миокардита выделяют следующие формы:
- инфекционные и инфекционно-токсические (при гриппе, вирусах группы Коксаки, дифтерии, скарлатине и др.);
- аллергические (иммунные) (сывороточный, инфекционно-аллергический, трансплантационный, лекарственный, миокардиты при системных заболеваниях);
- токсико-аллергические (при тиреотоксикозе, уремии и алкогольном поражении сердца);
- идиопатические (невыясненной природы).
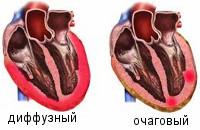
По распространенности воспалительного поражения миокардиты делятся на диффузные и очаговые. По течению различают острые, подострые, хронические (прогрессирующие, рецидивирующие) миокардиты. По степени тяжести - легкий, миокардит средней тяжести, тяжелый.
По характеру воспаления выделяют экссудативно-пролиферативный (воспалительно-инфильтративный, васкулярный, дистрофический, смешанный) и альтернативный (дистрофически-некробиотический) миокардиты. В развитии инфекционного миокардита (как наиболее часто встречающегося) выделяют 4 патогенетические стадии:
- Инфекционно-токсическая
- Иммунологическая
- Дистрофическая
- Миокардиосклеротическая
По клиническим вариантам (по преобладающим клиническим симптомам) различают миокардиты:
- малосимптомный
- болевой или псевдокоронарный
- декомпенсационный (с нарушением кровообращения)
- аритмический
- тромбоэмболический
- псевдоклапанный
- смешанный
Симптомы миокардита
Клиническая симптоматика миокардита зависит от степени поражения миокарда, локализации, остроты и прогрессирования воспалительного процесса в сердечной мышце. Она включает проявления недостаточности сократительной функции миокарда и нарушения ритма сердца. Инфекционно-аллергический миокардит в отличие от ревматического начинается обычно на фоне инфекции или сразу после нее. Начало заболевания может протекать малосимптомно или латентно.
Основные жалобы пациентов - на сильную слабость и утомляемость, одышку при физической нагрузке, боли в области сердца (ноющие или приступообразные), нарушения ритма (сердцебиение, перебои), повышенную потливость, иногда боль в суставах. Температура тела обычно субфебрильная или нормальная. Характерными проявлениями миокардита являются увеличение размеров сердца, понижение артериального давления, недостаточность кровообращения.
Кожные покровы у больных миокардитом бледные, иногда с синюшным оттенком. Пульс учащенный (иногда уреженный), может быть аритмичным. При выраженной сердечной недостаточности наблюдается набухание шейных вен. Возникает нарушение внутрисердечной проводимости, которое даже при небольших очагах поражения может стать причиной аритмии и привести к летальному исходу. Нарушение сердечного ритма проявляется суправентрикулярной (наджелудочковой) экстрасистолией, реже приступами мерцательной аритмии, что заметно ухудшает гемодинамику, усиливает симптомы сердечной недостаточности.
В большинстве случаев в клинической картине миокардита преобладают лишь отдельные из перечисленных выше симптомов. Примерно у трети пациентов миокардит может протекать малосимптомно. При миокардитах, возникающих на фоне коллагеновых заболеваний, а также вирусной инфекции часто возникает сопутствующий перикардит. Идиопатический миокардит имеет тяжелое, иногда злокачественное течение, приводящее к кардиомегалии, тяжелым нарушениям ритма и проводимости сердца и сердечной недостаточности.
Осложнения
При длительно текущем миокардите развиваются склеротические поражения сердечной мышцы, возникает миокардитический кардиосклероз. В случае острого миокардита при тяжелых нарушениях работы сердца быстро прогрессирует сердечная недостаточность, аритмия, становящиеся причиной внезапной смерти.
Диагностика
Существенные трудности в диагностике миокардитов вызывает отсутствие специфических диагностических критериев. Мероприятия по выявлению воспалительного процесса в миокарде включают:
- Сбор анамнеза
- Физикальное обследование пациента - симптомы варьируют от умеренной тахикардии до декомпенсированной желудочковой недостаточности: отеки, набухание шейных вен, нарушение ритма сердца, застойный процесс в легких.
- ЭКГ - нарушение сердечного ритма, возбудимости и проводимости. ЭКГ-изменения при миокардите не являются специфичными, так как сходны с изменениями при различных заболеваниях сердца.
- ЭхоКГ - выявляется патология миокарда (расширение полостей сердца, снижение сократительной способности, нарушение диастолической функции) в разной степени в зависимости от тяжести заболевания.
- Общий, биохимический, иммунологический анализы крови не являются столь специфичными при миокардите и показывают увеличение содержания α2 и γ - глобулинов, повышение титра антител к сердечной мышце, положительную РТМЛ (реакцию торможения миграции лимфоцитов), положительную пробу на С-реактивный белок, повышение сиаловых кислот, активности кардиоспецифичных ферментов. Исследование иммунологических показателей должно проводиться в динамике.
- Рентгенография легких помогает обнаружить увеличение размеров сердца (кардиомегалию) и застойные процессы в легких.
- Бакпосев крови для выявления возбудителя, или ПЦР диагностика.
- Эндомиокардиальная биопсия при помощи зондирования полостей сердца, включающая гистологическое исследование биоптатов миокарда, подтверждает диагноз миокардита не более чем в 37% случаев в связи с тем, что может иметь место очаговое поражение миокарда. Результаты повторной биопсии миокарда дают возможность оценить динамику и исход воспалительного процесса.
- Сцинтиграфия (радиоизотопное исследование) миокарда является физиологичным исследованием (прослеживается естественная миграция лейкоцитов в очаг воспаления и нагноения).
- Магнитно-резонансная томография (МРТ сердца) с контрастированием дает визуализацию воспалительного процесса, отека в миокарде. Чувствительность данного метода составляет 70-75%.
Лечение миокардита
Острая стадия миокардита требует госпитализации в отделение кардиологии, ограничения физической активности, строгого постельного режима на 4 - 8 недель до достижения компенсации кровообращения и восстановления нормальных размеров сердца. Диета при миокардите предполагает ограниченное употребление поваренной соли и жидкости, обогащенное белковое и витаминизированное питание для нормализации метаболических процессов в миокарде.
Терапию миокардита проводят одновременно по четырем направлениям, осуществляя этиологическое, патогенетическое, метаболическое симптоматическое лечение. Этиологическое лечение направлено на подавление инфекционного процесса в организме. Терапию бактериальных инфекций проводят антибиотиками после выделения и определения чувствительности патогенного микроорганизма. При миокардитах вирусного генеза показано назначение противовирусных препаратов.
Необходимым условием успешного лечения миокардитов служит выявление и санация инфекционных очагов, поддерживающих патологический процесс: тонзиллита, отита, гайморита, периодонтита, аднексита, простатита и др. После осуществления санации очагов (хирургической или терапевтической), курса противовирусной или антибактериальной терапии необходимо проведение микробиологического контроля излеченности.
В патогенетическую терапию миокардитов включают противовоспалительные, антигистаминные и иммуносупрессивные препараты. Назначение нестероидных противовоспалительных средств осуществляется индивидуально, с подбором дозировок и длительности курса лечения; критерием отмены служит исчезновение лабораторных и клинических признаков воспаления в миокарде. При тяжелом, прогрессирующем течении миокардита назначаются глюкокортикоидные гормоны. Антигистаминные средства способствуют блокированию медиаторов воспаления.
Для улучшения метаболизма сердечной мышцы при миокардитах применяют препараты калия, инозин, витамины, АТФ, кокарбоксилазу. Симптоматическое лечение миокардитов направлено на устранение аритмий, артериальной гипертензии, симптомов сердечной недостаточности, профилактику тромбоэмболий. Длительность лечения миокардита определяется тяжестью заболевания и эффективностью комплексной терапии и составляет в среднем около полугода, а иногда и дольше.
Прогноз
При латентном малосимптомном течение миокардита возможно самопроизвольное клиническое излечение без отдаленных последствий. В более тяжелых случаях прогноз миокардитов определяется распространенностью поражения миокарда, особенностями воспалительного процесса и тяжестью фонового заболевания.
При развитии сердечной недостаточности у 50% пациентов отмечается улучшение по результатам лечения, у четверти наблюдается стабилизация сердечной деятельности, у оставшихся 25% состояние прогрессирующе ухудшается. Прогноз при миокардитах, осложненных сердечной недостаточностью, зависит от выраженности дисфункции левого желудочка.
Неудовлетворительный прогноз отмечается при некоторых формах миокардитов: гигантоклеточном (100%-ая смертность при консервативной терапии), дифтерийном (смертность составляет до 50–60%), миокардите, вызванном болезнью Шагаса (американским трипаносомозом) и др. У этих пациентов решается вопрос о трансплантации сердца, хотя и не исключается риск развития повторного миокардита и отторжения трансплантата.
Профилактика
Для снижения риска заболеваемости миокардитом рекомендуется соблюдать меры предосторожности при контакте с инфекционными больными, санировать очаги инфекции в организме, избегать укусов клещей, осуществлять вакцинацию против кори, краснухи, гриппа, свинки, полиомиелита.
Пациенты, перенесшие миокардит, проходят диспансерное наблюдение у кардиолога 1 раз в 3 месяца с постепенным восстановлением режима и активности.
Общие сведения
Инфекционный эндокардит возникает при наличии следующих условий: транзиторной бактериемии, повреждения эндокарда и эндотелия сосудов, изменения гемостаза и гемодинамики, нарушения иммунитета. Бактериемия может развиваться при имеющихся очагах хронической инфекции или проведении инвазивных медицинских манипуляций.
Ведущая роль в развитии подострого инфекционного эндокардита принадлежит зеленящему стрептококку, в острых случаях (например, после операций на открытом сердце) – золотистому стафилококку, реже энтерококку, пневмококку, кишечной палочке. За последние годы изменился состав инфекционных возбудителей эндокардита: возросло число первичных эндокардитов острого течения, имеющих стафилококковую природу. При бактериемии золотистым стафилококком инфекционный эндокардит развивается почти в 100% случаев.
Эндокардиты, вызванные грамотрицательными и анаэробными микроорганизмами и грибковой инфекцией, имеют тяжелое течение и плохо поддаются антибактериальной терапии. Грибковые эндокардиты возникают чаще при длительном лечении антибиотиками в послеоперационном периоде, при долго стоящих венозных катетерах.
Адгезии (прилипанию) микроорганизмов к эндокарду способствуют определенные общие и местные факторы. В число общих факторов входят выраженные нарушения иммунитета, наблюдающиеся у пациентов при иммунносупрессивном лечении, у алкоголиков, наркоманов, людей пожилого возраста. К местным относятся врожденные и приобретенные анатомические повреждения клапанов сердца, внутрисердечные гемодинамические нарушения, возникающие при пороках сердца.
Большинство подострых инфекционных эндокардитов развивается при врожденных пороках сердца или при ревматических поражениях сердечных клапанов. Гемодинамические нарушения, вызванные пороками сердца, способствуют микротравме клапанов (преимущественно митрального и аортального), изменению эндокарда. На клапанах сердца развиваются характерные язвенно-бородавчатые изменения, имеющие вид цветной капусты (полипозные наложения тромботических масс на поверхности язв). Микробные колонии способствуют быстрому разрушению клапанов, может происходить их склерозирование, деформация и разрыв. Поврежденный клапан не может функционировать нормально - развивается сердечная недостаточность, которая очень быстро прогрессирует. Отмечается иммунное поражение эндотелия мелких сосудов кожи и слизистых, приводящее к развитию васкулитов (тромбоваскулитов, геморрагического капилляротоксикоза). Характерно нарушение проницаемости стенок кровеносных сосудов и появление мелких кровоизлияний. Нередко отмечаются поражения более крупных артерий: коронарных и почечных. Часто инфекция развивается на протезированном клапане, в этом случае возбудителем чаще всего бывает стрептококк.
Развитию инфекционного эндокардита способствуют факторы, ослабляющие иммунологическую реактивность организма. Заболеваемость инфекционным эндокардитом постоянно растет во всем мире. К группе риска относятся люди, имеющие атеросклеротические, травматические и ревматические повреждения сердечных клапанов. Высокий риск заболевания инфекционным эндокардитом имеют пациенты с дефектом межжелудочковой перегородки, коарктацией аорты. В настоящее время увеличилось число больных с протезами клапанов (механическими или биологическими), искусственными водителями ритма (электрокардиостимуляторами). Количество случаев инфекционного эндокардита увеличивается по причине применения длительных и частых внутривенных вливаний. Часто инфекционным эндокардитом болеют наркоманы.

Классификация инфекционных эндокардитов
По происхождению различают первичный и вторичный инфекционный эндокардит. Первичный обычно возникает при септических состояниях различной этиологии на фоне неизмененных клапанов сердца. Вторичный - развивается на фоне уже имеющейся патологии сосудов или клапанов при врожденных пороках, заболевании ревматизмом, сифилисом, после операции по протезированию клапанов или комиссуротомии.
По клиническому течению выделяют следующие формы инфекционного эндокардита:
- острая - длительность до 2 месяцев, развивается как осложнение острого септического состояния, тяжелых травм или медицинских манипуляций на сосудах, полостях сердца: нозокомиальный (внутрибольничный) ангиогенный (катетерный) сепсис. Характеризуется высокопатогенным возбудителем, выраженными септическими симптомами.
- подострая – длительность более 2 месяцев, развивается при недостаточном лечении острого инфекционного эндокардита или основного заболевания.
- затяжная.
У наркоманов клиническими особенностями инфекционного эндокардита являются молодой возраст, стремительное прогрессирование правожелудочковой недостаточности и общей интоксикации, инфильтративное и деструктивное поражение легких.
У пожилых пациентов инфекционный эндокардит обусловлен хроническими заболеваниями органов пищеварения, наличием хронических инфекционных очагов, поражением сердечных клапанов. Различают активный и неактивный (заживленный) инфекционный эндокардит. По степени поражения эндокардит протекает с ограниченным поражением створок сердечных клапанов или с поражением, выходящим за пределы клапана.
Выделяют следующие формы течения инфекционного эндокардита:
- инфекционно-токсическая - характерна транзиторная бактериемия, адгезия возбудителя на измененный эндокард, образование микробных вегетаций;
- инфекционно-аллергическая или иммунно-воспалительная - характерны клинические признаки поражения внутренних органов: миокардита, гепатита, нефрита, спленомегалии;
- дистрофическая – развивается при прогрессировании септического процесса и сердечной недостаточности. Характерно развитие тяжелых и необратимых поражений внутренних органов, в частности - токсическая дегенерация миокарда с многочисленными некрозами. Поражение миокарда возникает в 92 % случаев затяжного инфекционного эндокардита.
Симптомы инфекционного эндокардита
Течение инфекционного эндокардита может зависеть от срока давности заболевания, возраста пациента, типа возбудителя, а также от ранее проводимой антибактериальной терапии. В случаях высокопатогенного возбудителя (золотистый стафилококк, грамотрицательная микрофлора) обычно наблюдается острая форма инфекционного эндокардита и раннее развитие полиорганной недостаточности, в связи с чем клиническая картина характеризуется полиморфизмом.
У большинства пациентов с инфекционным эндокардитом выявляется поражение сердечной мышцы (миокардит), функциональные шумы, связанные с анемией и повреждением клапанов. При поражении створок митрального и аортального клапанов развиваются признаки их недостаточности. Иногда наблюдается стенокардия, изредка отмечается шум трения перикарда. Приобретенные пороки клапанов и поражение миокарда приводят к сердечной недостаточности.
При подострой форме инфекционного эндокардита возникают эмболии сосудов мозга, почек, селезенки оторвавшимися со створок сердечных клапанов тромботическими наложениями, сопровождающиеся образованием инфарктов в пораженных органах. Обнаруживаются гепато- и спленомегалия, со стороны почек - развитие диффузного и экстракапиллярного гломерулонефрита, реже - очагового нефрита, возможны артралгии и полиартрит.
Осложнения инфекционного эндокардита
Осложнениями инфекционного эндокардита с летальным исходом являются септический шок, эмболии в головной мозг, сердце, респираторный дистресс-синдром, острая сердечная недостаточность, полиорганная недостаточность.
При инфекционном эндокардите часто наблюдаются осложнения со стороны внутренних органов: почек (нефротический синдром, инфаркт, почечная недостаточность, диффузный гломерулонефрит), сердца (пороки клапанов сердца, миокардит, перикардит), легких (инфаркт, пневмония, легочная гипертензия, абсцесс), печени (абсцесс, гепатит, цирроз); селезенки (инфаркт, абсцесс, спленомегалия, разрыв), нервной системы (инсульт, гемиплегия, менингоэнцефалит, абсцесс головного мозга), сосудов (аневризмы, геморрагический васкулит, тромбозы, тромбоэмболии, тромбофлебит).
Диагностика инфекционного эндокардита
При сборе анамнеза у пациента выясняют наличие хронических инфекций и перенесенных медицинских вмешательств. Окончательный диагноз инфекционного эндокардита подтверждается данными инструментальных и лабораторных исследований. В клиническом анализе крови выявляется большой лейкоцитоз и резкое повышение СОЭ. Важной диагностической ценностью обладает многократный бакпосев крови для выявления возбудителя инфекции. Забор крови для бактериологического посева рекомендуется производить на высоте лихорадки.
Данные биохимического анализа крови могут варьировать в широких пределах при той или иной органной патологии. При инфекционном эндокардите отмечаются изменения в белковом спектре крови: (нарастают α-1 и α-2-глобулины, позднее – γ-глобулины), в иммунном статусе (увеличивается ЦИК, иммуноглобулин М, снижается общая гемолитическая активность комплемента, нарастает уровень противотканевых антител).
Ценным инструментальным исследованием при инфекционном эндокардите является ЭхоКГ, позволяющее обнаружить вегетации (размером более 5 мм) на клапанах сердца, что является прямым признаком инфекционного эндокардита. Более точную диагностику проводят при помощи МРТ и МСКТ сердца.
Лечение инфекционного эндокардита
При инфекционном эндокардите лечение обязательно стационарное, до улучшения общего состояния пациента назначается постельный режим, диета. Главная роль в лечении инфекционных эндокардитов отводится медикаментозной терапии, главным образом, антибактериальной, которую начинают сразу после бакпосева крови. Выбор антибиотика определяется чувствительностью к нему возбудителя, предпочтительнее назначение антибиотиков широкого спектра действия.
В терапии инфекционного эндокардита хороший эффект оказывают антибиотики пенициллинового ряда в комбинации с аминогликозидами. Трудно поддается лечению грибковый эндокардит, поэтому назначается препарат амфотерицин В в течение длительного времени (несколько недель или месяцев). Также используют другие средства с антимикробными свойствами (диоксидин, антистафилококковый глобулин и др.) и немедикаментозные методы лечения – плазмаферез, аутотрансфузию ультрафиолетом облученной крови.
При сопутствующих заболеваниях (миокардите, полиартрите, нефрите) к лечению добавляются негормональные противовоспалительные средства: диклофенак, индометацин. При отсутствии эффекта от медикаментозного лечения показано хирургическое вмешательство. Проводится протезирование клапанов сердца с иссечением поврежденных участков (после стихания остроты процесса). Оперативные вмешательства должны проводиться кардиохирургом исключительно по показаниям и сопровождаться приемом антибиотиков.
Прогноз при инфекционном эндокардите
Инфекционный эндокардит — одно из наиболее тяжелых сердечно-сосудистых заболеваний. Прогноз при инфекционном эндокардите зависит от множества факторов: имеющихся поражений клапанов, своевременности и адекватности терапии и др. Острая форма инфекционного эндокардита без лечения заканчивается смертельным исходом через 1 – 1,5 месяца, подострая форма - через 4–6 месяцев. При адекватной антибактериальной терапии летальность составляет 30%, при инфицировании протезированных клапанов — 50%. У пожилых пациентов инфекционный эндокардит протекает более вяло, часто сразу не диагностируется и имеет худший прогноз. У 10-15% больных отмечается переход болезни в хроническую форму с рецидивами обострения.
Профилактика инфекционного эндокардита
За лицами с повышенным риском развития инфекционного эндокардита устанавливается необходимое наблюдение и контроль. Это касается, прежде всего, пациентов с протезированными клапанами сердца, врожденными или приобретенными пороками сердца, патологией сосудов, с инфекционным эндокардитом в анамнезе, имеющих очаги хронической инфекции (кариес, хронический тонзиллит, хронический пиелонефрит).
Развитие бактериемии может сопровождать различные медицинские манипуляции: оперативные вмешательства, урологические и гинекологические инструментальные обследования, эндоскопические процедуры, удаление зубов и др. С профилактической целью при этих вмешательствах назначают курс антибиотикотерапии. Необходимо также избегать переохлаждения, вирусных и бактериальных инфекций (гриппа, ангины). Необходимо проведение санации очагов хронической инфекции не реже 1 раза в 3 - 6 месяцев.
Читайте также:

