Вирусы которые снижают иммунитет ребенка
Обновлено: 25.04.2024
Нужно ли лечить ОРВИ у детей? Препараты для повышения иммунитета
Почти 90% всех инфекционных заболеваний это - острые респираторные вирусные инфекции (ОРВИ), к которым также относится и грипп. Особенно таким простудным заболеваниям подвержены дети, они заболевают простудой в 4 раза чаще, чем взрослые. В среднем ежегодно от острых респираторных заболеваний (ОРЗ), в том числе ОРВИ и гриппа, страдает порядка 40 млн. населения России, и эта цифра не сильно изменяется из года в год. Однако можно смело предположить, что число заболевших на деле гораздо выше, ведь очень многие предпочитают лечиться дома и не посещать врача. Некоторые и вовсе принимают ОРЗ за обычную аллергию.
В частой заболеваемости детей ОРВИ есть определенная тенденция, и она сложилась не случайно. Как правило, дети до 9 месяцев практически не болеют, особенно, если они получают материнское молоко. На самом деле иммунитет ребенка пока слаб, но сказывается его поддержка в виде особых защитных белков иммунной системы матери, которые малыш получил, еще будучи в утробе. Кроме того, некоторые защитные белки попадают в организм ребенка из материнского молока. Таким образом, то, что иммунная система пока не в состоянии получить сама, приходит к ребенку от мамы. Однако срок жизни этих защитный белков ограничен, и с момента их гибели ребенок становится уязвим для инфекционных агентов.
Также риск развития ОРВИ значительно возрастает, если ребенок находится на искусственном вскармливании, если он родился недоношенным, при беременности с осложнениями. К сожалению, сегодня все это перестало быть редкостью.
Склонность детей к ОРВИ является причиной того, что их организм только "знакомится" с бактериями и вирусами. "Знакомство" это и есть простуда, и происходит оно повсеместно: дома, в детском саду, на улице, в транспорте, в школе. Поэтому оградить ребенка от бактерий и вирусов, вызывающих ОРЗ, просто невозможно, да это и не нужно, ведь в скором времени иммунитет ребенка будет знаком со многими из них и сможет давать адекватный ответ, защищая организм от этих инфекций.

Повышение иммунитета как метод лечения ОРВИ у детей

Лечение ОРВИ, безусловно, комплексное. В него входят методы борьбы с интоксикацией - обильное питье, приём витамина С для того, чтобы защитить сосуды от негативных влияний вируса. Возможно применение и некоторых противовирусных препаратов, однако это эффективно в первые часы заболевания, когда вирус еще не успел размножиться в клетках и разрушить их. Отдельное место в терапии ОРВИ отводится иммуномодуляторам - лекарствам, которые стимулируют работу иммунной системы. Они заслуживают внимательного рассмотрения.
Стимулировать иммунитет способны препараты на растительной основе, такие как элеутерококк, женьшень, боярышник, "Иммунал", содержащий экстракт эхинацеи. Последний препарат проходил множество клинических исследований, показал отличные результаты при отсутствии побочных эффектов и нежелательных реакций у пациентов, переносящих ОРВИ. Он показан для применения с четырехлетнего возраста. Все эти препараты стоят недорого, поэтому доступны и безвредны благодаря своему натуральному происхождению. Их можно использовать для профилактики или уже в первые часы болезни. Хорошим иммуностимулирующим эффектом обладает также прополис. Помните, что профилактический прием средств, стимулирующих работу иммунной системы, необходимо начинать за несколько недель до начала сезона заболеваний, так как иммунитету требуется определенное время на выработку защитных клеток и белков.
Довольно широко при ОРВИ применяются лекарства, в состав которых входит интерферон - белок, вырабатываемый клетками человека в ответ на вторжение вируса. Интерфероны защищают организм от вирусных атак, поэтому при бактериальной инфекции прием этих препаратов лишается смысла. В аптеках продаются лекарства, содержащие уже готовый интерферон, полученный от донора ("Лейкинферон", "Виферон", "Гриппферон"). Особенно приятно, что они универсальны в борьбе с любыми вирусами, чего не скажешь о многих противовирусных препаратах. Для детей старшего возраста (примерно с 3 лет) разрешается применение стимуляторов выработки собственного интерферона ("Арбидол", "Кагоцел", "Циклоферон").
Стоит ли делать прививки ребенку, если он часто болеет?
- Вернуться в оглавление раздела "Профилактика заболеваний"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Чтобы разобраться с этим, сначала нужно понять, как иммунная система устроена и какие бывают виды иммунитета.
по теме

Мнение
Кто отвечает за работу различных видов иммунитета?
- Костный мозг. Это центральный орган иммуногенеза. В костном мозге образуются все клетки, участвующие в иммунных реакциях.
- Тимус (вилочковая железа). В тимусе происходит дозревание некоторых иммунных клеток (Т-лимфоцитов) после того, как они образовались в костном мозге.
- Селезенка. В селезенке также дозревают иммунные клетки (B-лимфоциты), кроме того, в ней активно происходит процесс фагоцитоза — когда специальные клетки иммунной системы ловят и переваривают проникших в организм микробов, фрагменты собственных погибших клеток и так далее.
- Лимфатические узлы. По своему строению они напоминают губку, через которую постоянно фильтруется лимфа. В порах этой губки есть очень много иммунных клеток, которые также ловят и переваривают микробов, проникших в организм. Кроме того, в лимфатических узлах находятся клетки памяти — это специальные клетки иммунной системы, которые хранят информацию о микробах, уже проникавших в организм ранее.
Таким образом, органы иммунной системы обеспечивают образование, созревание и место для жизни иммунных клеток. В нашем организме есть много их видов, вот основные из них.

по теме
Эпидемия
Учёные выяснили, как вирусы обманывают иммунитет
Как наша иммунная система понимает устройство антигена и подбирает подходящее для него антитело?
После этого успешно справившийся с задачей B-лимфоцит превращается в плазматическую клетку и начинает в большом количестве синтезировать антитела. Они поступают в кровь, разносятся по всему организму и связываются со всеми проникшими бактериями, вызывая их гибель. Кроме того, бактерии с прилипшими антителами гораздо быстрее поглощаются макрофагами, что также способствует уничтожению инфекции.
Есть ли еще какие-то механизмы?
Специфический иммунитет не был бы столь эффективен, если бы каждый раз при встрече с инфекцией организм в течение двух недель синтезировал необходимое антитело. Но здесь нас выручает другой механизм: часть активированных Т-хелпером В-лимфоцитов превращается в так называемые клетки памяти. Эти клетки не синтезируют антитела, но несут в себе информацию о структуре проникшей в организм бактерии. Клетки памяти мигрируют в лимфатические узлы и могут сохраняться там десятилетиями. При повторной встрече с этим же видом бактерий благодаря клеткам памяти организм намного быстрее начинает синтезировать нужные антитела и иммунный ответ запускается раньше.
Таким образом, наша иммунная система имеет целый арсенал различных клеток, органов и механизмов, чтобы отличать клетки собственного организма от генетически чужеродных объектов, уничтожая последние и выполняя свою главную функцию — поддержание генетического гомеостаза.
Нет, настоящий иммунодефицит — это серьезное заболевание, при нем в организме часто появляются инфекционные заболевания, которые протекают тяжело. Речь совсем не про ОРВИ. Иммунодефицитом врачи также называют состояние, при котором один или несколько факторов иммунной системы перестают защищать организм. В целом термин можно назвать собирательным, потому что причины, по которым эти факторы перестают работать, могут быть разными.
Глобально иммунодефициты можно разделить на три группы.
Их не стоит бояться, врачи определяют их как нормальное состояние человека. Физиологические иммунодефициты сигнализируют, что организм проходит через разные этапы жизнедеятельности. Они могут быть в детстве, во время беременности или в старости. Лечить их не нужно, просто важно понимать, что в это время люди болеют чаще. Поддерживать организм в эти периоды можно только с помощью вакцинации и здорового образа жизни.
Они возникают чаще всего в результате генетической поломки. Допустим, ребенок рождается с поломанным участком гена, отвечающего за какой-то из компонентом иммунной системы. В таком случае у него может не быть определенных клеток или белковых факторов, из-за этого ребенок начинает часто и тяжело болеть.
Современной медицине известно более 250 видов ПИД. Британское общество иммунологии отмечает, что в мире насчитывается около 6 миллионов людей с этим заболеванием, однако точное количество больных с ПИД установить невозможно — порядка 70—90 % из них остаются не диагностированными. Группа исследователей следила за жизнью 235 пациентов с первичным иммунодефицитом на протяжении 22 лет, за это время 32 из них умерли.
В России один из 500 россиян рождается с первичным иммунодефицитом. В российском регистре Национальной ассоциации экспертов в области ПИДС состоит 3017 пациентов.
Само название говорит о том, что изменения в иммунной системе появились не при рождении, а вторично — в результате какого-то патологического процесса или воздействующих факторов. Яркий пример вторичного иммунодефицита — это люди с ВИЧ-инфекцией. Изначально здоровый человек инфицируется вирусом, поражающим клетки иммунной системы, в результате развивается иммунодефицит. К этой же группе могут относиться пациенты с онкологическими заболеваниями, получающие химиотерапию. Вторичный иммунодефицит, как правило, протекает на фоне других заболеваний. Развитие иммунодефицитного состояния затрудняет их лечение, способствует формированию осложнений. Помимо ВИЧ к этой группе можно отнести лучевую болезнь, лимфопролиферативные заболевания, то есть связанные с клетками лимфоидной природы. Вторичный иммунодефицит, в отличие от ПИД, может пройти без лечения, например, если исчезнет воздействующий фактор.
Может ли человек с первичным иммунодефицитом вылечиться?
У некоторых людей с ПИД действительно нет шансов на полное выздоровление. Медицина может предложить им только поддерживающую терапию, направленную на борьбу с инфекцией. Но случается, что у самых тяжелых пациентов с первичным иммунодефицитом есть шанс на полное выздоровление. Это может произойти благодаря трансплантации гемопоэтических стволовых клеток от донора. Поэтому важно, чтобы как можно больше человек вступали в регистр доноров костного мозга.
Насколько опасны вторичные иммунодефициты?
Если говорить о ВИЧ, то без антиретровирусной терапии прогноз неблагоприятный. У человека могут развиться не только тяжелые инфекции, но и онкологические заболевания на последних стадиях (уже при СПИДе). Если говорить о вторичных иммунодефицитах, которые формируются в результате химиотерапии, то они проходят самостоятельно, как только заканчивается курс лечения.
Иммунодефициты легко распознать? Бывает ли, что врачи начинают лечить здоровых людей, думая, что у них иммунодефицит?
Важно понимать, что иммунодефицит — это тяжело протекающие инфекционные заболевания бактериального, грибкового и вирусного характера. И речь не про ОРЗ и ОРВИ. У людей с ним зачастую в анамнезе несколько пневмоний, синуситов, абсцессов, тяжелый кандидоз кожи и слизистых, тяжелое течение герпетических вирусов.
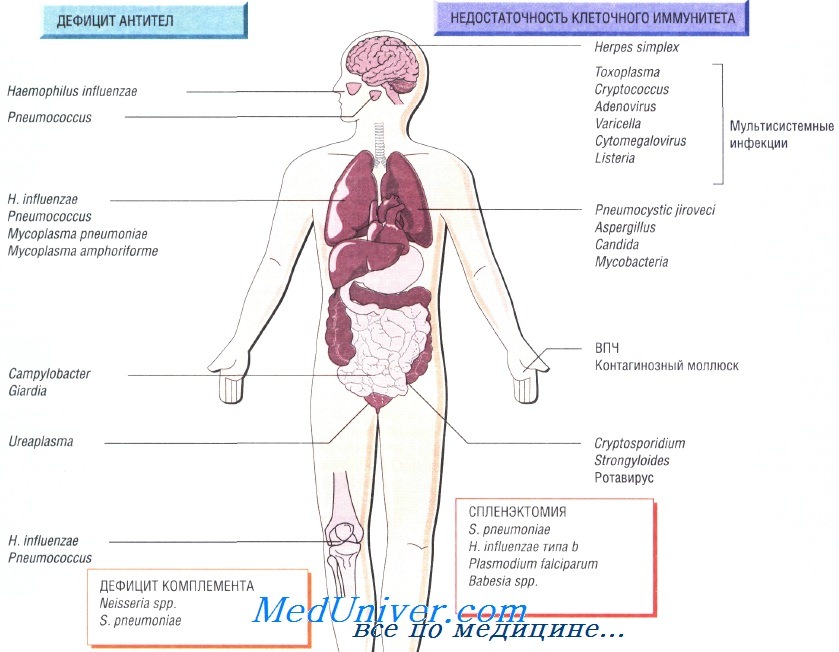
Инфекционные заболевания у пациентов со сниженным иммунитетом. Инфекции при иммунодефиците
Различные методы лечения или наследственная патология иммунной системы могут способствовать развитию инфекционного заболевания, обусловленного слабовирулентными штаммами микроорганизмов, или возникновению тяжёлых инфекций, связанных с патогенными возбудителями.
Недостаточность иммунной системы обычно возникает в результате воздействия нескольких факторов. Например, при нейтропении, развивающейся у пациентов, перенёсших пересадку костного мозга, повышена восприимчивость организма к бактериальным инфекциям, в то время как внутривенная катетеризация способствует развитию инфекции, вызванной Staphylococcus epidermidis.
Медицинские манипуляции часто нарушают физические барьеры на пути инфекции (например, катетеризация).
Нейтропения как причина инфекции при иммунодефиците
Гранулоцитопению обычно наблюдают при острой лейкемии или её лечении. Риск развития инфекции зависит от длительности и тяжести нейтропении. Бактериемию у таких больных обнаруживают в 40—70% случаев. Наиболее часто выделяют гра-мотрицательные бациллы (бактерии семейства Enterobacteriaceae и рода Pseudomonas). Они распространяются по организму в результате повреждения кишечника противоопухолевыми препаратами и облучением.
Кроме того, в этиологии сепсиса важную роль играют фамположительные микроорганизмы (S. epidermidis, S. mitis, S. oralis, S. aureus, Corynebacterium jeikeium и представители рода Enterococcus).
Несмотря на то что в большинстве случаев развитие кандидоза обусловлено приёмом антибактериальных препаратов, у пациентов с нейтропенией грибковые инфекции могут возникать de novo. В последнее время всё чаше сообщают о микозах, вызванных дрожжевыми грибами, такими как Candida krusei (характерна природная устойчивость к действию противогрибковых средств), различными видами родов Aspergillus (вызывают инвазивные заболевания) и Fusarium, а также Pseudallescheria boydii и Trichosporon beigelii.
Лечение лихорадки у пациентов с нейтропенией. Эмпирическая терапия включает карбапенем (или цефтазидим) и амикацин. Если лихорадка не исчезает, то дополнительно назначают гликопептидный антибиотик. Позже, если лихорадка сохраняется, высока вероятность развития микозов, поэтому для лечения используют амфотерицин В и итраконазол.
Профилактика инфекции у пациентов с нейтропенией. Вероятность развития инфекции у пациентов с нейтропенией заметно снижается, если в больнице их помещают в индивидуальный бокс и снабжают стерилизованной пищей и водой. Большое значение имеет соблюдение стерильного режима не только медицинским персоналом (мытьё рук и использование одноразовых резиновых перчаток), но и посетителями (ношение халатов и масок). Воздух, поступающий в палату, необходимо пропускать сквозь фильтр специальной очищающей от грибковых спор системы.
Приём нистатина и амфотерицина В внутрь позволяет снизить вероятность развития грибковой инфекции. Достаточно эффективные препараты — флуконазол и итраконазол. В некоторых медицинских центрах применяют профилактическую терапию 4-фторхинолонами, действие которых направлено против факультативных анаэробов кишечника (при сохранении анаэробной флоры).
Причины инфекций при иммунодефиците
Недостаточность Т-клеточного иммунитета как причина инфекции при иммунодефиците
Недостаточность Т-клеточного иммунитета может быть обусловлена ВИЧ-инфекцией, противоопухолевой химиотерапией, приёмом глюкокортикоидных препаратов или трансплантацией органов. Врождённый дефицит обнаруживают достаточно редко. Он может быть связан только с недостаточностью функции Т-лимфоцитов или сопровождаться гипогаммаглобулинемией.
Возбудители инфекции при недостаточности Т-клеточного иммунитета. Основные возбудители — внутриклеточные патогенные микроорганизмы и паразиты:
• Toxoplasma gondii, Strongyloides stercoralis;
• Mycobacterium tuberculosis, M. avium-intracellulare;
• Listeria monocytogenes, Cryptococcus neoformans, Pneumocystis jiroveci;
• вирусы простого герпеса, цитомегаловирус, вирус опоясывающего герпеса и кори.
При осложнении кори гигантоклеточной пневмонией и энцефалитом у таких больных заболевание может приобрести угрожающий жизни характер.
Диагностика инфекции при недостаточности Т-клеточного иммунитета. Для диагностики инфекционных заболеваний применяют различные методы исследования. Для посева у пациентов отбирают не менее, чем два образца крови, взятых из разных мест.
Гиппогаммаглобулинемия как причина инфекции при недостаточности Т-клеточного иммунитета
Пациенты, страдающие сцепленной с Х-хромосомой агамма-глобулинемией, входят в группу повышенного риска заражения различными инфекциями в первые 6 мес своей жизни, в то время как люди с другим иммунодефицитом имеют повышенный риск на протяжении всей жизни. Функциональная гипогаммаглобулинемия возникает у больных с множественной миеломой.
Возбудителями рецидивирующих респираторных заболеваний у таких людей считают Streptococcus pneumoniae, недавно открытую Mycoplasma amphoriforme и не имеющего капсулы Haemophilus influenzae (вызывает бронхоэктазию). Персистирующие инфекции вызывают представители родов Giardia, Cryptosporidium и Campylobacter. Снизить частоту возникновения рецидивирующих инфекций помогает внутривенное введение иммуноглобулина.
Недостаточность комплемента как причина инфекции при недостаточности Т-клеточного иммунитета
Врождённую недостаточность комплемента наблюдают достаточно редко. Недостаточность последних компонентов системы комплемента (С7—С9) вызывает потерю способности лизировать грамотрицательные бактерии, в связи с чем повышается восприимчивость пациента к рецидивирующим инфекциям, вызванным микроорганизмами рода Neisseria. Недостаточность альтернативного пути системы комплемента приводит к развитию тяжёлых стрептококковых инфекций (S. pneumoniae), например менингита.
Приобретённая недостаточность системы комплемента часто возникает при системной красной волчанке.
Маннозасвязывающий лектин путь активации комплемента. Широкий спектр бактерий, грибов, вирусов и простейших прикрепляются к клеткам организма хозяина посредством маннозасвязывающего лектина. Есть данные, что при некоторых видах его недостаточности именно эти микроорганизмы вызывают наиболее частые и тяжёлые заболевания у людей с определёнными генотипами.
Инфекции возникающие после спленэктомии
Ежегодно после удаления селезёнки в 1% случаев наблюдают развитие тяжёлого сепсиса, при этом чаще всего заболевание возникает у младенцев и детей. Самую высокую смертность отмечают после спленэктомии, выполненной по поводу лимфомы и талассемии. У пациентов с серповидно-клеточной анемией развивается функциональная аспления. Риск развития сепсиса может со временем снизиться, но никогда не исчезнет окончательно.
Наиболее распространённый возбудитель инфекций (две трети всех случаев) — Streptococcus pneumoniae, но Н. influenzae и Е. coli также играют важную роль в этиологии инфекционных заболеваний у таких пациентов. Кроме того, спленэктомия повышает восприимчивость организма к инфекции, вызванной Capnocytophaga canimorsis (особенно после укусов собак). Малярия также может протекать крайне неблагоприятно (фульминантная форма).
Профилактика инфекции после спленэктомии. После удаления селезёнки всем пациентам необходимо провести вакцинацию, направленную против S. pneumoniae, менингококков и Н. influenzae типа В. Более эффективна иммунизация с использованием белковых конъюгированных вакцин. В некоторых случаях для профилактики применяют пенициллин V (в низких дозах).
Пациентов следует предупреждать о том, чтобы они сообщали своему лечащему врачу о любых признаках лихорадки, а также проинструктировать их относительно приёма антибиотиков (во избежание задержки лечения).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Вирусные инфекции нервной системы у детей при ослабленном иммунитете
Оппортунистические инфекции ЦНС могут возникать у иммуноослабленных детей, и спектр инфекций зависит от особенностей нарушения клеточного иммунитета, врожденных или ятрогенных (Cunha, 2001). Все большее число детей появляется с ятрогенной этиологией иммунной недостаточности различной степени выраженности — от тяжелого иммунного подавления при трансплантации органов до хронического применения стероидов при воспалительных состояниях.
Инфицирование оппортунистическими возбудителями, обычно непатогенными для человеческого организма, может быть необычным нарушением, вторичным при обычных вирусных патогенах. В целом большему риску подвержены дети с Т-клеточной лимфоцитарной недостаточностью, у которых может встречаться широкий спектр вирусных, бактериальных, грибковых и протозойных инфекций. Дети с В-клеточным дефицитом в меньшей степени повержены риску инфицирования ЦНС, однако возможен общеизвестный синдром хронической энтеровирусной инфекции.
а) Замедленный тип острого коревого энцефалита при ослабленном иммунитете. Острый замедленный коревой энцефалит наблюдался в основном у пациентов с ослабленным иммунитетом (Murphy и Yunis, 1976), хотя изредка он встречается у детей с явно нормальными иммунными механизмами. В отличие от обычного постинфекционного энцефаломиелита, вирус кори в большом количестве выявляется в тканях мозга, а нуклеокапсиды видны при электронной микроскопии в ядрах глии и нейронах. Воспалительная реакция выражена в различной степени, но чаще слабая (Lacroix et al, 1995). Заболевание развивается через 2-6 месяцев после кори или контакта со случаями кори. Наиболее явным симптомом часто являются эпилептические припадки и во многих случаях первыми проявлениями является epilepsia partialis continua (Aicardi et al., 1977; Luna et al., 1990; Barthez Carpentier et al., 1992).
Быстро развивается прогрессирующее ухудшение с оглушенностью и комой и характерными очаговыми симптомами, особенно гемиплегией.
Продолжают появляться новые неврологические симптомы разной продолжительности. У некоторых пациентов отмечается ретинопатия (Haltia et al., 1977). Диагностика может быть затруднена, в связи с нормальными или слегка измененными показателями ликвора. В большинстве случаев отмечают интратекальный синтез специфических противокоревых антител и высокий титр антител против вируса кори в плазме крови и СМЖ. У детей с наиболее тяжелым подавлением иммунитета выработка антител, однако, может быть ослаблена.
б) Герпесвирусные инфекции человека. Все герпесвирусные инфекции могут стать причиной тяжелого заболевания у иммунодефицитных детей с ослабленной функцией Т-лимфоцитов, включая реципиентов органов при трансплантации, ВИЧ-инфицированных детей и детей с врожденным иммунодефицитом. Заболевание может возникать в результате первичной инфекции у неиммуннизированных детей или как результат реактивации латентной инфекции в период иммунной недостаточности. Болезнь может ограничиваться одним органом или распространяться, вовлекая многие органы с высоким уровнем вирусемии в плазме. Несмотря на доступность противовирусной терапии, полное выздоровление часто зависит от улучшения функции иммунной системы.
Нарушающие зрение вирусные ретиниты вызываются в первую очередь представителями семейства вирусов герпеса; в клинические синдромы входят острый ретинальный некроз (ОРН) (Bonfioli и Eller, 2005), прогрессирующий наружный ретинальный некроз (ПНРН) (Purdy et al., 2003), мультифокальный хориоидит, серпигинозный хориоидит и другие вирусные ретинопатии (ЦМВ ретинит, смотри ниже). При активном иммунитете наиболее распространенным считается ВПГ ретинит, тогда как вирус ветряной оспы в равной степени поражает пациентов с нормальным и ослабленным иммунитетом.
В связи с плохим проникновением лекарственных форм в ткани глаза при системной терапии из-за ограниченного кровоснабжения, при лечении тяжелых заболеваний необходимы как системные назначения, так и прямое внутриглазное введение противовирусных препаратов (Scott et al., 2002).
• Цитомегаловирус. При тяжелой иммунной депрессии может развиваться диссеминированная форма цитомегаловирусной инфекции. Обычно наблюдается высокий уровень вирусемии в крови. Инфекция может поражать головной мозг, сетчатку глаза, легкие, костный мозг, печень и кишечник. При лечении могут быть эффективны ганцикловир, фоскарнет или цидофовир; однако из-за их токсичности требуется тщательный метаболический контроль. Ганцикловир относится к средствам первого выбора после фоскарнета и цидофовира; для более долгосрочной поддерживающей иммуносупрессивной терапии подходит пероральный прием валганцикловира (Kimberlin, 2002; Griffiths, 2004).
ЦМВ ретинит хорошо распознается при прогрессировании ВИЧ-инфекции; при ее наличии у новорожденных, в отличие от взрослых или более старших детей, в первую очередь поражается макула, а не периферическая сетчатка, тем самым непосредственно угрожая центральному зрению (Wren et al., 2004). Другие проявления ЦМВ инфекции в центральной нервной системе у детей с иммунодефицитом включают очаговый или генерализованный энцефалит, паралич черепных нервов, поперечный миелит, радикулит и синдром Гийена-Барре. Успех терапии зависит от ответа вовлеченного органа, также как от уровня вирусемии. У ВИЧ-инфицированных пациентов цитомегаловирусное заболевание ЦНС, включая ретинит, может принять остро симптоматическое течение, в момент начала противовирусной терапии, как проявление синдрома восстановления воспалительного иммунитета (IRIS). IRIS наиболее характерен для пациентов, которые начали лечение в стадии прогрессирующей болезни и с очень низким уровнем CD4, что требует тщательного наблюдения при лечении ЦМВ, ВИЧ и иммунной перестройке для уменьшения симптомов (Griffiths, 2004).
• Вирус простого герпеса. Тяжелая инфекция ВПГ может иметь место у детей с ослабленным иммунитетом. Чаще всего поражаются ротовая полость, кожа, легкие и кишечник, в то время специфическое поражение ЦНС редко. Высокие дозы внутривенного ацикловира должны иметь эффект, хотя возможно развитие резистентности при повторной экспозиции, особенно при низких оральных дозах. ПЦР-исследование ликвора на ВПГ имеет важное значение в постановке диагноза и контроле лечения у иммуносупрессивных пациентов (Cinque et al., 1998).
• Вирус герпеса человека 6 и 7 типов. Реактивация ВГЧ-6 встречается приблизительно в 50% всех пересадок костного мозга и у 20-30% реципиентов паренхиматозных органов через 2-3 недели после процедуры. Клинические симптомы заключаются в лихорадке, кожной сыпи, пневмонии, подавлении костного мозга, энцефалите и отторжении трансплантата (Yoshikawa, 2003). Развитие лимбического энцефалита связано с высокой вирусной нагрузкой в крови ДНК ВГЧ-6 после трансплантации (Ogata et al., 2006). ВГЧ-7 виремия после пересадки стволовых клеток также была ассоциирована с энцефалитом (Chan et al., 2004). Эффект может быть от применения ганцикловира.
• Вирус Эпштейна-Барр. Инфекция ВЭБ способна вызывать тяжелые, часто заканчивающиеся смертью заболевания в некоторых семьях с потенциально фатальной чувствительностью к ВЭБ, передаваемой по наследству как Х-сцепленный ген. Это заболевание, известное как Х-сцепленный лимфопролиферативный синдром (ХЛС) (Grierson и Purtilo, 1987), может принимать форму смертельного инфекционного мононуклеоза, злокачественной лимфомы, приобретенной гипо- и агаммаглобулинемии и вирус-ассоциированного гемофагоцитарного синдрома (Tiab et al., 2000, Gilmour и Gaspar, 2003). Поврежденный ген XLP был определен и обозначен SH2D1A; он кодирует адаптерный белок SAP (белок сигнальной лимфоцитарной молекулосвязанной активации — SLAM-ассоциированный); измерение этого белка может быть использовано в диагностике состояния (Gilmour et al., 2000).
С XLP связан высокий уровень заболеваемости, и во всех случаях исход неблагоприятный. В настоящее время аллогенная трансплантация стволовых клеток остается единственным лечебным мероприятием (Lankester et al., 2005).
Похожий синдром моно- и поликлональной лимфоцитарной пролиферации, обусловленный ВЭБ, известный как посттрансплантационное лимфопролиферативное заболевание (ПТЛЗ), может развиваться при ослабленном иммунитете, особенно у реципиентов пересаженных органов (Randhawa et al., 1992). ПТЛЗ может проявляться полиорганными поражениями, нечасто вовлекая ЦНС. Поражение мозга у реципиентов с ПТЛЗ дает неблагоприятный прогноз; однако изолированное вовлечение ЦНС имеет лучший прогноз, чем одновременное поражение ЦНС и внечерепных органов (Buell et al., 2005). Исследование детей после трансплантации печени показало, что мониторинг вирусной нагрузки ВЭБ при раннем вмешательстве может уменьшить количество случаев ПТЛЗ (Lee et al., 2005).
Комбинированное лечение с иммунной модуляцией, противовирусными средствами и анти-В-клеточными моноклональными антителами ритуксимаба обеспечивает определенный эффект (Nozzoli et al., 2006).
У пациентов с более прогрессирующей ВИЧ-иммуносупрессией ВЭБ может привести к развитию лимфомы. Это может быть изолированная лимфома ЦНС или же поражение ЦНС при более распространенном заболевании (Nadal et al., 1994). В настоящее время проводится разработка более эффективного лечения вызываемой ВЭБ лимфомы у пациентов с ВИЧ, включая противовирусную терапию, химиотерапию и иммуномодулирующее лечение.
в) Полиомавирусная инфекция человека. JC-вирус — это человеческий нейротропный полиомавирус, который вызывает прогрессивную мультифокальную лейкоэнцефалопатию (ПМЛ), смертельное демиелинизирующее заболевание у иммунодефицитных пациентов. Сообщалось о случаях у детей с ВИЧ, после лечения злокачественных новообразований и у детей с врожденной иммунной недостаточностью (Redfearn et al., 1993; Bezrodnik et al., 1998; Angelini et al., 2001; Nuttall et al., 2004; Demir et al., 2005). Заболевание может начинаться медленно как расстройство с когнитивным нарушением или быстро прогрессировать с припадками, гемипарезом, нарушениями двигательных функций или с утратой зрения. На МРТ черепа могут быть распространенные повреждения белого и серого вещества. Исход без лечения и восстановления иммунитета обычно смертельный через несколько месяцев. Пациенты с прогрессирующей формой ВИЧ могут развить острую симптоматику ПМЛ вскоре после начала противовирусной терапии, что рассматривается как еще одно проявление синдрома воспалительного восстановления иммунитета (Nuttall et al., 2004).
г) Полиовирусная инфекция (дикий и поствакцинальный тип). Полиовирус у пациентов с ослабленным иммунитетом может вызвать развитие типичной картины паралитического полиомиелита. Имеются описания случаев при Х-сцепленной гипогаммаглобулинемии (Wright et al., 1977) и нарушении Т-клеточного звена иммунитета. В качестве исключения может иметь место более диффузное заболевание с вовлечением головного мозга и очагами кальцификации в зрительном бугре после вакцинации живым аттенуированным вирусом (Davis et al., 1977).
д) Хроническая энтеровирусная инфекция у детей с Х-сцепленной гипогаммаглобулинемией. Дети с Х-сцепленной гипогаммаглобулинемией (болезнью Брутона) часто страдают от вирусных инфекций ЦНС в сочетании с бактериальными осложнениями (гнойным менингитом). Наиболее распространенными возбудителями этих инфекций являются энтеровирусы (Cooper et al., 1983). Характерным клиническим проявлением является хронический лимфоцитарный менингит с различными признаками поражения мозга, такими как нарушение сознания и очаговые припадки или неврологический дефицит. Другие симптомы включают в себя прогрессирующую миелопатию, миелопатию, прогрессирующую до энцефалопатии, простую энцефалопатию, ретинопатию, нейросенсорную тугоухость и дерматомиозит (Rudge et al., 1996). Течение хроническое, нередко с летальным исходом. Диагностика по результатам ПЦР-исследования ликвора или же по биопсии ткани в некоторых случаях, а для контроля эффективности можно использовать количественную оценку ПЦР (Quartier et al., 2000).
Интратекальное и внутрижелудочковое введение гаммаглобулинов может помочь уменьшить симптомы, но не выводит инфекцию (Erlendsson et al., 1985; Johnson et al., 1985).
Читайте также:

