Вирусы могут размножаться с помощью митоза
Обновлено: 24.04.2024
И это неудивительно хотя бы потому, что вирусы — штука довольно непонятная. Неясно даже, считать их живыми или нет. С одной стороны, это просто хрупкий набор молекул, который не может существовать автономно, без живой клетки. Он не производит и не накапливает энергии, а также не поддерживает постоянства внутренней среды — ее попросту нет. Но когда вирус попадает в клетку, он проходит жизненный цикл, копирует себя и эволюционирует. Невидимое глазу нечто существует в огромном количестве, постоянно меняется, переходит от одних хозяев к другим и причиняет страдания разной степени тяжести всему человечеству.
Как устроены вирусы?
РНК-содержащие вирусы можно разделить на собственно РНК-вирусы и ретровирусы. Первые — это вирусы гриппа, бешенства, гепатита С, а также коронавирусы и вирус Эбола. Они содержат РНК и используют для размножения РНК-зависимую РНК-полимеразу, с ее помощью на исходной молекуле РНК сразу синтезируется новая. А к ретровирусам относится, например, ВИЧ. Он содержит РНК, но в ходе жизненного цикла она превращается в ДНК и встраивается в геном клетки-хозяина. После чего новая РНК синтезируется уже на основе молекулы ДНК — то есть так же, как у нас.
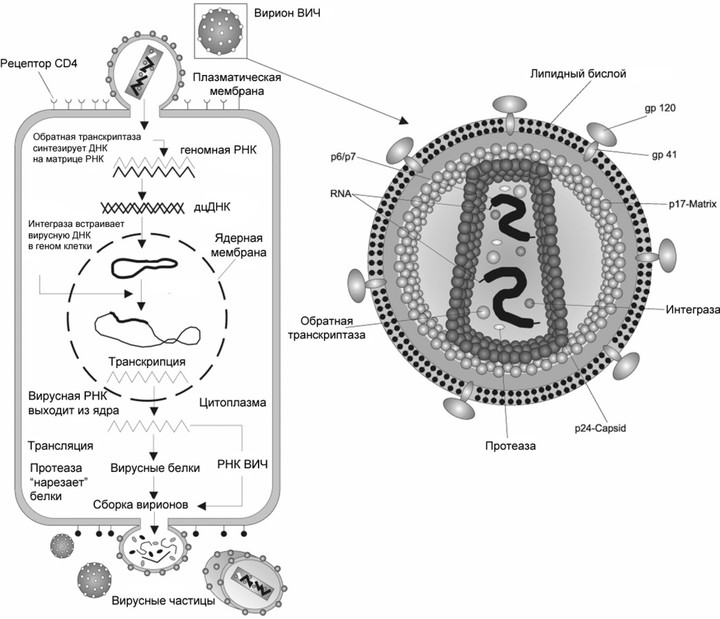
Жизненный цикл вируса, на примере вируса иммунодефицита
Как с ними бороться?
Еще одна стратегия — активная и пассивная иммунопрофилактика. Активная — это простая и всем знакомая вакцинация. Человеку вводят неактивную форму вируса или его кусочек, в организме срабатывает иммунный ответ и синтезируются антитела, которые защитят человека в будущем, если он когда-нибудь встретится с настоящим живым вирусом. Но вакцину не всегда можно создать, да и уже существующие порой не работают на все сто. Так, вакцина от гриппа защищает только от нескольких — самых распространенных в текущем сезоне — штаммов (видов) вируса. Пассивная иммунопрофилактика — это введение готовых антител тем, кто уже встретился с вирусом или с большой вероятностью сделает это. Такие лекарства существуют для респираторно-синцитиального вируса (рекомендованы недоношенным младенцам) и ветряной оспы (для людей с подавленным иммунитетом).
И, наконец, последняя стратегия на случай, если ничто не помогло и человек заболел, — антивирусные препараты. Их развитие подстегивали научный прогресс и насущные проблемы. Чтобы придумать противовирусный препарат, нужно сначала изучить вирус и его жизненный цикл и выбрать возможные мишени для атаки. Причем такие, чтобы они как можно сильнее отличались от человеческих аналогов. Иначе лекарство будет бороться и с вирусами, и с невинными человеческими клетками, вызывая сильные побочные эффекты.
В 80-е произошло другое громкое открытие — вирус иммунодефицита человека. Это породило шквал научных работ, посвященных разработке новых противовирусных лекарств. К тому времени связанный с ним СПИД уже распространился по миру, а в США началась эпидемия.
Какие бывают антивирусные препараты?
Их можно разделить на 13 групп, причем к шести относятся различные лекарства против ВИЧ. Это ингибиторы входа вируса в клетку, вирусных ферментов интегразы и протеазы, а также три вида ингибиторов вирусного фермента обратной транскриптазы, или ревертазы. Все они действуют на разные этапы жизненного цикла вируса:
1. Проникновение в клетку
Это первое, что должен сделать вирус, попав в организм. То, какую клетку он поразит, определяется рецептором на ее поверхности. У ВИЧ это рецептор CD4, который есть у Т-хелперов, макрофагов, а также некоторых других видов клеток. Кроме него в связывании вируса и его проникновении участвуют: рецепторы CXCR4 и CCR5 со стороны клетки и поверхностные гликопротеины gp120 и gp41 — со стороны вируса.
Сейчас FDA (американское Управление по санитарному надзору за качеством пищевых продуктов и медикаментов) одобряет четыре лекарства, работающие на этой стадии. Каждый связывается с каким-то из участников процесса и мешает его работе. Например, к этой группе принадлежит самый новый препарат против ВИЧ — фостемсавир, его одобрили в США в июле 2020 года. В организме он превращается в активную форму темсавир, соединяется с вирусным гликопротеином gp120 и мешает ему связаться с клеточным рецептором CD4. Другой препарат — ибализумаб — связывается с самим CD4, причем так, что рецептор не может участвовать в проникновении вируса, но выполняет свою нормальную иммунную функцию — связывает и узнает антигены на поверхности антигенпрезентирующих клеток.
Подобные препараты также используются для лечения респираторно-синцитиального вируса, вирусов ветряной оспы и простого герпеса. Они тоже действуют на вирусные гликопротеины и их связывание с клеточными рецепторами. К этой же группе можно отнести препараты для пассивной иммунопрофилактики антителами.
2. Подготовка к размножению, часть 1
Когда вирус попал в клетку, он должен в ней размножиться, то есть создать копии себя, используя ресурсы самой клетки. Так как ВИЧ — ретровирус, его генетический материал — РНК, которая должна достроиться до двухцепочечной ДНК и встроиться в ДНК клетки. Процесс достраивания называется обратной транскрипцией, и для него необходим вирусный фермент обратная транскриптаза, ее еще называют ревертазой. Это самая популярная мишень препаратов против ВИЧ, которые делятся на две группы: нуклеозидные и ненуклеозидные.
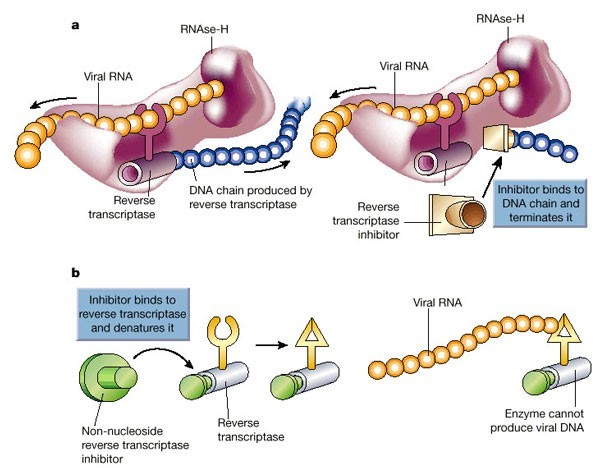
Механизм дейсвтия ингибиторов обратной транскриптазы
3. Подготовка к размножению, часть 2
Чтобы наконец размножиться, ВИЧ, уже в виде молекулы ДНК, необходимо встроиться в геном клетки-хозяина. В этом участвует другой вирусный фермент — интеграза. Ее ингибируют несколько одобренных лекарств, причем они часто используются вместе с другим препаратом — кобицистатом. Он никак не действует на вирус, но ингибирует некоторые ферменты печени и увеличивает биодоступность самих антивирусных препаратов.
4. Созревание
Другие препараты
Есть три группы антивирусных препаратов, которые мы еще не упоминали. Во-первых, это ингибиторы белков NS5A и NS5B вируса гепатита С, которые играют важную роль в репликации РНК вируса. Во-вторых, лекарства против вируса гриппа: три ингибитора вирусного белка нейраминидазы и один ингибитор РНК-полимеразы вируса. И, наконец, сборная солянка препаратов, которые не действуют прицельно на вирусные компоненты. Это интерфероны, а также иммуностимуляторы и ингибиторы митоза клеток.
Первые заслуживают особого внимания из-за обилия отечественных лекарств против гриппа и простуды на их основе. FDA одобряет инъекции (!) интерферонов только для лечения гепатита B и С, причем на практике они используются очень осторожно из-за серьезных побочных эффектов. Отечественные противовирусные препараты с интерферонами, которые выпускаются в форме мазей, спреев и суппозиториев, вряд ли работают. И слава богу. Иммуностимуляторы и ингибиторы митоза клеток выпускаются в виде мазей и используются для лечения генитальных бородавок, то есть папилломавируса человека.
Наука не стоит на месте, и разработка противовирусных препаратов продолжается, подстегиваемая новыми вирусами, эпидемиями, а также развитием резистентности к существующим лекарствам. Но по-прежнему самыми изученными и многочисленными препаратами остаются ингибиторы вирусных обратной транскриптазы или ДНК-полимеразы и протеазы. Для разработки других стратегий борьбы ученым еще предстоит изучить детали работы вирусов — как давно известных, так и совершенно новых.
Да, вирусы остаются источником зловещих идей в популярной культуре. Но существующих препаратов и методов уже достаточно, чтобы мы могли избежать заражения, быстро вылечиться или свести негативные последствия болезни к нулю.
Одни вирусы способны интегрироваться в геном клетки-мишени и таким образом оставаться во всех дочерних клетках, которые будут в будущем получены после ее деления. К таким вирусам относятся гаммаретровирусы и лентивирусы. Другие делать этого не умеют (например, адено- и аденоассоциированные вирусы). Но для производства белков и репликации (размножения) все они используют клетку и ее синтетический аппарат.
Как это работает?
Для того чтобы вирус мог проникнуть в клетку, белки его оболочки должны связаться с мембранными белками клетки-мишени. Важно отметить, что проникает вирус только в те клетки, которые могут в дальнейшем помочь его репликации. Вирус ВИЧ живет в клетках иммунной системы, вирус гепатита С — в клетках печени. Есть особые вирусы, которые поражают только растения или даже только бактерии.
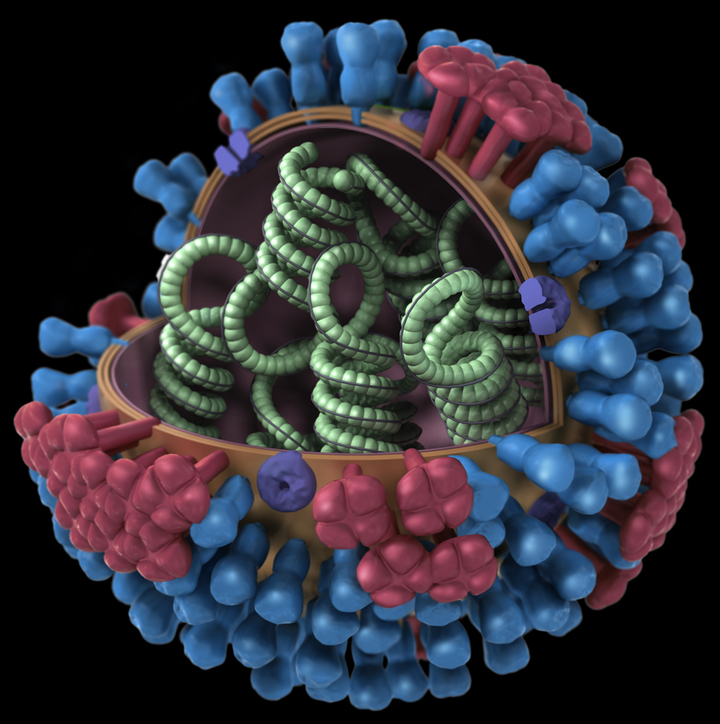
Строение вируса гриппа. Под оболочкой вириома - генетический материал вируса, необходимый для его воспроизводства в клетке.
Содержащие неактивный вирус и оставшиеся в живых клетки иногда сохраняют возможность нормального функционирования. В этом случае клетки могут быть заражены, но вирус проявит себя спустя длительный период времени. Так устроен герпес.
В зависимости от того, каким типом нуклеиновой кислоты представлен генетический материал, выделяют ДНК-содержащие вирусы и РНК-содержащие вирусы. И тут стоит остановиться на классификации.
Типы вирусов. Коротко о главном
Современная типология вирусов содержит 7 классов и была предложена Дэвидом Балтимором еще в 1971 году. С тех пор, впрочем, она была уточнена и расширена, в том числе советскими учеными. И выглядит в настоящее время таким образом:
Вирусы, содержащие двухцепочечную ДНК
Описание
Для репликации вирусу необходимо попасть в ядро клетки-мишени и воспользоваться ее ДНК-полимеразой. Иногда вирус вызывает незапланированное деление самое клетки, то есть становится онкогенным. Эти вирусы хорошо изучены.
Пример: Вирус герпеса, адено- и папилломавирусы
Вирусы, содержащие одноцепочечную ДНК
Описание
Попадая в ядро клетки, вирусы образуют двухцепочечную ДНК, после чего реплицируются так же, как вирусы класса I.
Пример: Парво- и цирковирусы
Вирусы, в которых РНК способна к репликации (редупликации)
Описание
Вирусы этого класса могут размножаться в цитоплазме клетки, им не нужна молекула ДНК. Каждый ген, находящийся в РНК вируса, кодирует только один вирусный белок.
Пример: Бирна- и реовирусы
Вирусы, содержащие одноцепочечную (+) РНК
Описание
Из геномной (+) РНК на рибосомах хозяина создаются вирусные белки. В одном фрагменте РНК могут быть закодированы разные белки, что увеличивает сложность вируса без удлинения генов.
Пример: Пикорнавирусы (полиомиелит, гепатит А) и коронавирусы
Вирусы, содержащие одноцепочечную (–) РНК
Описание
(–) РНК этих вирусов предварительно должна быть транскрибирована в (+) РНК вирусными РНК-полимеразами, после чего может начаться синтез вирусных белков. Вирусы этого класса делятся еще на две группы, в зависимости от их генома и места его репликации (цитоплазма или ядро).
Пример: Филовирусы, аренавирусы (геморрагическая лихорадка Ласса), ортомиксовирусы (вирусы гриппа) и так далее.
Вирусы, содержащие одноцепочечную (+) РНК, реплицирующиеся через стадию ДНК
Описание
Такие вирусы используют фермент обратную транскриптазу для превращения (+) РНК в ДНК, которая встраивается в геном хозяина ферментом интегразой. Дальнейшая репликация происходит при помощи полимераз клетки хозяина.
Пример: Ретровирусы (в том числе ВИЧ)
Вирусы, содержащие двухцепочечную ДНК, реплицирующиеся через стадию одноцепочечной РНК
Описание
Молекула ДНК замкнута в кольцо и является матрицей для синтеза мРНК и дополнительных молекул РНК, которые используются при репликации вирусного генома обратными транскриптазами.
Пример: Колимовирусы (вызывают инфекции растений) и гепаднавирусы (например, гепатит В)
Вакцинация и лечение
Как правило, организмы умеют бороться с паразитирующими на них вирусами. На примере млекопитающих и человека мы обычно говорим о главном инструменте — врожденном иммунитете.
Впрочем, наиболее эффективен этот вид защиты в отношении бактериальных инфекций и не может обеспечить продолжительную и надежную защиту, особенно от инфекций вирусных.
Именно поэтому огромное значение имеет приобретенный иммунитет, в результате которого клетки иммунной системы обучаются вырабатывать специфические к вирусу антитела, способные уничтожать как саму вирусную частицу, так и зараженные ею клетки.
Еще одна врожденная система борьбы с вирусными инфекциями — внутриклеточная. Как правило, клетка способна распознать чужеродную РНК в своей цитоплазме, куда ее сперва и доставляют многие вирусы, и имеет специальные комплексы для ее деградации. Но часть вирусов научились обходить и эту ловушку. К примеру, ротавирусы, которые даже внутри клетки сохраняют капсид с геномной РНК.
Миссия: уничтожить
Основная сложность в лечении вирусных заболеваний заключается в том, что они используют естественные функции клеток-мишеней для своего размножения, поэтому ученым зачастую оказывается не так-то просто придумать препарат, который будет токсичен для вируса и безопасен для самой клетки. Если такой безопасности достичь не удастся, лекарство будет иметь слишком много побочных эффектов, повреждающих сам организм, что окажется нецелесообразно для использования.

Сравнение жизненных циклов ВИЧ и вируса гриппа. Если первый использует обратную транскрипцию и живет в клетках иммунной стистемы, вирион второго, проникая в эпительные клетки дыхательных путей целиком - а именно там он и обитает - распадается уже внутри клетки, а репликация вирусной РНК происходит в ядре с помощью вирусных полимераз PA, PB1 и PB2 путем комплементарного копирования.
По принципу действия противовирусные препараты подразделяются на две группы: стимулирующие иммунную систему атаковать вирусы (например, за счет индукции синтеза белков-интерферонов) и атакующие вирусы напрямую. Препараты второй группы различаются по этапу жизненного цикла вируса, на котором они активны: это препараты, препятствующие проникновению вируса в клетку, препятствующие размножению вируса внутри клетки и препятствующие выходу копий вируса из клетки.
Еще один класс противовирусных препаратов блокирует ферменты, необходимые для создания и модификаций белков вируса. Такие лекарства называют протеазными ингибиторами.
Вместо заключения: а могут ли вирусы приносить пользу?
Безусловно, да. Несмотря на то, что вирусы ассоциируются у большинства людей с однозначным вредом, они могут приносить и пользу — если речь идет о так называемых вирусных векторах и терапевтических подходах на их основе.
Исследователи давно научились помещать в белковую оболочку вируса интересующие их нуклеиновые кислоты, чтобы доставлять нужный ген в клетки, а также убирать те гены, которые делают вирус опасным для организма.
Это позволило сделать возможной генную терапию, помогающую бороться с заболеваниями, вызванными известными генетическими мутациями. Создание вирусных векторов — достаточно непростая задача, к тому же ограниченная свойствами самих вирусных частиц: количеством помещающейся генетической информации, местом ее вставки, стабильностью. Кроме того, вирусный вектор, используемый в медицине, не должен вызывать иммунного ответа или критично влиять на жизнедеятельность клетки. Тем не менее эти сложности решаются, поэтому уже одобрен ряд вполне успешных и безопасных генных терапий. А в качестве основы для вирусных векторов чаще всего используются ретро-, ленти-, адено- и аденоассоциированные вирусы.

Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.

Обзор
Авторы
Редакторы
Вообще, вирусы прекрасны. Они прекрасно выглядят и прекрасно приспособлены к использованию в своих целях любых живых организмов: животных, растений, грибов, простейших, бактерий и архей. И даже неклеточных созданий, братьев-вирусов.
Вирусы — это паразиты, которые не могут размножаться вне живых клеток. Окружающая среда по отношению к ним недружелюбна, и в ней они в виде ничего не делающих частиц коротают время до встречи с подходящей клеткой-хозяином. Вирусные частицы, или вирионы, не относят к живым организмам, потому что они не имеют клеточного строения, не могут обеспечивать себя энергией и производить белки для построения своих частиц. А вот бактерии, которые тоже часто на ком-то паразитируют, всё это умеют и потому с полным правом считаются живыми существами.
Отличаются ли вирусы от бактерий размерами?

Вирус табачной мозаики и аденовирус.

Бактериофаг Т2.
Как вирусы устроены?

Вирус осповакцины и вирус Pf1.

Фаг ФХ174 и вирус гриппа.
Как вирусы размножаются?

Схема жизненного цикла вируса.
Все ли вирусы — злодеи?
Люди боятся и не любят вирусы за то, что те вызывают тяжелые, иногда смертельные болезни, от которых практически нет лекарств: сложно, не повредив клетку, убить засевшего в ней паразита, который не делает почти ничего сам, а пользуется обычными клеточными системами. Многие вирусы умеют искусно уходить от иммунного надзора, превращаясь в медленных убийц. Они вызывают хронические инфекции, иногда скрытые, которые десятилетиями никак не проявляются, но исподволь готовят почву, например, для развития рака. И всё же человек, накопив нужное количество знаний, научился бороться с некоторыми из самых опасных вирусов — с помощью прививок [5]. К сожалению, привиться от всех тяжелых вирусных болезней пока нельзя, потому что многие вирусы очень изменчивы.
От вирусов страдает не только человек, но и животные, и растения. Однако такие сложные живые организмы сталкивались с вирусами уже с момента своего возникновения и потому приспособились к совместному сосуществованию с большинством из них. Да и вирусу, как правило, незачем убивать хозяев — тогда ведь придется всё время искать новых, и если в скученных бактериальных сообществах это не так уж и сложно, то вот в человеческих.
Но если отвлечься от добрых и злых, с точки зрения человека, дел вирусов, то нужно признать, что на этих невидимках во многом держится наш мир: они переносят свои и чужие гены от организма к организму, увеличивая генетическое разнообразие, регулируют численность сообществ живых существ и просто необходимы для круговорота биогенных элементов, ведь вирусы — самые многочисленные биообъекты на нашей планете.
Полноформатную раскраску можно скачать по этой ссылке.

Чтобы жизненный цикл эукариот, обладающих половым процессом, мог продолжаться, должен был развиться механизм, посредством которого из диплоидных клеток снова могли образовываться гаплоидные. Таким механизмом стал мейоз – особый вид клеточного деления, при котором число хромосом в дочерних клетках уменьшается вдвое по сравнению с родительской клеткой.
В статье Ю.Ф.Богданова, крупнейшего специалиста по эволюции мейоза, рассматриваются современные представления о происхождении механизмов мейотического деления у эукариот.

В ходе митоза (а также в ходе второго деления мейоза) хромосомы вступают в метафазу поодиночке, и нити веретена деления присоединяются к каждой хромосоме с двух сторон.
Именно благодаря указанным особенностям первого деления мейоза и обеспечивается уменьшение числа хромосом: к полюсам клетки расходятся не сестринские хроматиды, а гомологичные хромосомы, по одной из каждой пары (см. схему).
Эти ключевые особенности первого деления мейоза развились на основе одного и того же ароморфоза – возникновения так называемого синаптонемного комплекса (СК).
Одним из этих исходных блоков стал уже имевшийся к тому времени у эукариот механизм митоза, другим – механизм репарации (починки повреждений) ДНК, основанный на гомологичной рекомбинации (см.: Глазер В.М. Гомологичная генетическая рекомбинация ). Суть процесса в том, что поврежденный участок одной молекулы ДНК заменяется его неповрежденной копией, взятой из другой (гомологичной) молекулы ДНК.

Упрощенная схема одного из вариантов гомологичной рекомбинации (обмена участками между гомологичными молекулами ДНК) с образованием соединения Холлидея. Показаны две двухцепочечные молекулы ДНК. Тут важно не перепутать: каждая молекула ДНК состоит из двух параллельных цепей нуклеотидов (двойная спираль); в состав одной хроматиды входит одна молекула ДНК; каждая хромосома (вплоть до анафазы II) состоит из двух хроматид. Соответственно, каждая пара гомологичных хромосом (например, в метафазе I) состоит из ДВУХ хромосом, ЧЕТЫРЕХ хроматид, ЧЕТЫРЕХ молекул ДНК, ВОСЬМИ нуклеотидных цепочек. Рекомбинация происходит между хроматидами отцовской и материнской хромосом. На этом рисунке показана рекомбинация у одного из вирусов, у эукариот во время мейоза все несколько иначе и сложнее
Починка разрывов ДНК – одна из основ мейоза
Механизмы репарации и рекомбинации ДНК – очень древние, они должны были возникнуть еще на заре жизни.
Жизненный цикл древних эукариот (как и многих прокариот), вероятно, состоял из двух фаз и двух соответствующих типов метаболизма: 1) вегетативная фаза (условия благоприятны, клетки размножаются митозом); 2) фаза споруляции (условия стали неблагоприятными, клетки превращаются в споры). У низших эукариот – например, у дрожжей, - перед споруляцией происходит мейоз, и из получившихся гаплоидных клеток образуются споры.
Становление мейоза в ходе эволюции, так же как и сам мейоз в жизненном цикле современных организмов, начинается с репарации повреждений (разрывов) ДНК. Разрывы эти в начале мейоза возникают не сами собой – их создает специальный фермент, эндонуклеаза SPO11. Этот фермент является модификацией другого белка – ДНК-топоизомеразы VI, унаследованной эукариотами от своих прокариотических предков – архей.
Белковые оси хромосом
В клетках эукариот, делящихся путем митоза, сестринские хроматиды (образовавшиеся в результате репликации исходной молекулы ДНК) соединены посредством белков-когезинов. Чтобы хроматиды могли разойтись к полюсам клетки (в анафазе митоза), когезины должны гидролизоваться и исчезнуть из межхроматидного пространства.
Синаптонемные комплексы. Ароморфоз.
Происхождение белков СК


Сравнительный анализ структуры белков СК показал, что они возникли независимо у предков современных эукариот, давших начало разным крупным таксонам (растений, грибов, животных).
Почему в первом делении мейоза сестринские хроматиды не расходятся?
С фактами и теориями, касающимися происхождения мейоза, можно ознакомиться в статьях Ю.Ф.Богданова и его коллег:
Читайте также:

