Вирусы могут участвовать в злокачественном
Обновлено: 26.04.2024
Рак – бич человечества. По смертности он занимает второе место после сердечно-сосудистых заболеваний, по страху, который внушает людям – первое. Тысячи исследователей стремятся понять его причины, найти пути к его профилактике и лечению. Десятки институтов и сотни лабораторий во всем мире работают над этой проблемой, пытаясь достичь успеха в ее понимании и прогресса в профилактике и лечении этого заболевания.
Современной науке известны некоторые факторы, вызывающие развитие злокачественных опухолей и, вместе с тем, ученые вынуждены констатировать, что основная часть злокачественных опухолей возникает спонтанно, то есть без видимой связи с индуцирующими агентами. К факторам, способным вызывать развитие опухоли, относятся: различные канцерогенные вещества, наследственная предрасположенность, ионизирующее излучение и опухолеродные вирусы.
Вирусно-генетическая теория возникновения опухолей, предложенная еще в 40-х годах ХХ века Л.И. Зильбером, получила за прошедшие годы многочисленные подтверждения. В настоящее время, очевидно, что хотя вирусы и не являются единственной причиной рака, но они играют большую роль в возникновении злокачественных заболеваний как у человека, так и у животных. Характерной особенностью опухолевых заболеваний, ассоциированных с вирусами, является длительный латентный период, от момента инфекции до проявления заболевания могут пройти годы и даже десятилетия.
Согласно современным данным, этиологическими агентами около 15% опухолевых новообразований человека являются вирусы. К таким вирусам относятся: вирус Т-клеточного лейкоза/лимфомы (human T-leukemia/lymphoma virus), вирус иммунодефицита человека (ВИЧ), вирус папилломы человека (ВПЧ), вирусы гепатита В и С, вирус Эпштейна-Барр (ВЭБ) и другие. Важно отметить, что некоторые вирусы ассоциированы с опухолями только одной локализации, тогда как другие — с разными злокачественными новообразованиями, что, вероятно, обусловлено тропизмом вирусов к клеточным системам определенного типа.
Вирус Т-клеточного лейкоза/лимфомы (HTLV-1). HTLV-1 – это онкогенный вирус, способный вызывать Т-клеточный лейкоз/лимфому у взрослых, а также тропический спастический парапарез и ряд других неонкологических заболеваний.
Существуют 3 основных пути передачи инфекции от инфицированных лиц:
- с молоком матери;
- при половом контакте;
- с переливаемой кровью при гемотрансфузиях.
Основными методами диагностики вирусов гепатита В и С являются методы иммуноферментного анализа и полимеразной цепной реакции.
Вирус папилломы человека (ВПЧ, human papilloma virus). В середине 70-х гг. прошлого века было высказано предположение, что вирус папилломы человека является этиологическим агентом рака шейки матки, и эта область онкологии и вирусологии получила стремительное развитие. Действительно, к настоящему моменту роль ВПЧ в развитии рака шейки матки не вызывает сомнений. Многочисленные исследования доказали, что не менее 95% злокачественных опухолей шейки матки содержат разновидности ВПЧ, принадлежащие к так называемым типам "высокого онкогенного риска" (ВПЧ 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 типов). Среди них максимальной онкогенной активностью обладают ВПЧ 16 и 18 типов. Действительно, ВПЧ достаточно часто (примерно в 30% случаев) выявляется у абсолютно здоровых женщин. Однако не у всех женщин, зараженных вирусом папилломы человека, возникает дисплазия шейки матки и рак шейки матки. Примерно у 80% женщин иммунная система организма в течение 2 лет после инфицирования сама избавляется от вируса. Таким образом, носительство этих вирусов свидетельствует не о злокачественном процессе как таковом, а о многократно повышенном риске его возникновения.
Диагностика ВПЧ-инфекции обладает очень высокой клинической значимостью. Она позволяет выявить тех пациенток, для которых жизненно необходимы активные, комплексные меры, направленные на профилактику и раннюю диагностику рака шейки матки. Самым надежным диагностическим тестом по выявлению всех 12 онкогенных типов вируса папилломы человека в настоящее время является метод полимеразной цепной реакции в режиме реального времени.
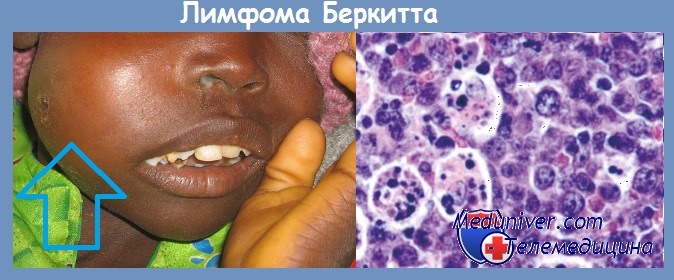
Вирус Эпштейна-Барр (ВЭБ). Известен широкий спектр патологических состояний, представленный опухолями лимфоидного и эпителиального происхождения, в возникновении которых ВЭБ принимает непосредственное участие. Доказано, что этот вирус причастен к возникновению не только лимфомы Беркитта, но и ряда других злокачественных и доброкачественных новообразований, таких, как рак носоглотки, лимфома Ходжкина, инфекционный мононуклеоз и многие другие.
Согласно некоторым исследованиям, ВЭБ широко циркулирует среди населения, о чем свидетельствует высокий процент людей, имеющих в крови антитела к ВЭБ - 50% детей и 85% взрослых. Но поскольку инфекция, как правило, протекает бессимптомно, сложилось ошибочное мнение о невысокой заболеваемости ВЭБ-инфекцией.
Вирус герпеса человека 8 типа (HHV-8). В настоящее время считается доказанной его роль в возникновении саркомы Капоши, выпотной лимфомы полостей тела и болезни Кастельмана. В геноме HHV-8 содержится ряд генов, продукты которых играют важную роль в регуляции размножения и жизнеспособности клеток; повышение их активности приводит к возникновению опухоли.
Следует понимать, что HHV-8 является всего лишь фактором риска развития вышеуказанных заболеваний. Если человек инфицирован HHV-8, то это не означает, что у него обязательно разовьётся саркома Капоши или лимфома.
Сам по себе вирус герпеса 8 типа опасности для здорового человека практически не представляет. Большинство людей с нормальным иммунитетом, инфицированных этим вирусом, не отмечают каких-либо проявлений, и он не оказывает на них никакого вредного влияния.
Свое негативное действие HHV-8 может проявить только в случае стойкого снижения иммунитета (иммунодепрессии), и то лишь у больных СПИДом (зараженных вирусом ВИЧ) или при длительном лечении, снижающем иммунитет (после пересадки органов и тканей, лучевой терапии). По данным статистики у 45% людей, имеющих HHV-8 и ВИЧ в течение 10 лет развилась саркома Капоши. У людей с нормальным иммунитетом вирус герпеса человека никак себя не проявляет. Он не влияет на состояние здоровья.
Таким образом, несмотря на различную организацию онкогенных вирусов человека они обладают рядом общих биологических свойств, а именно:
- вирусы лишь инициируют патологический процесс, усиливая процессы деления клеток и генетическую нестабильность инфицированных ими клеток;
- у инфицированных онкогенными вирусами лиц возникновение опухоли, как правило, событие нечастое: один случай новообразования возникает среди сотен, иногда тысяч инфицированных;
- от момента инфицирования до возникновения опухоли имеет место продолжительный латентный период, длящийся годами, иногда десятилетиями;
- у большинства инфицированных лиц возникновение опухоли не является обязательным, но они могут составить группу риска, с более высокой вероятностью ее возникновения;
- для злокачественной трансформации инфицированных клеток необходимы дополнительные факторы и условия, приводящие к прогрессированию наиболее агрессивного опухолевого клона.
Такими дополнительными факторами, играющими роль сопутствующих канцерогенов, могут быть: злоупотребление алкоголем, табакокурение, коинфекция генитальным герпесом, малярия, нитрозамины в продуктах питания, пестициды.
На сегодняшний день основными методами лабораторной диагностики являются метод иммуноферментного анализа (ИФА) и метод полимеразной цепной реакции (ПЦР). Первый позволяет выявить белок вируса либо антитела к нему, которые выделяет организм в ответ на инфицирование. При помощи метода ПЦР мы можем выявить генетический материал самого вируса.
Метод иммуноферментного анализа является стандартным методом лабораторной диагностики.
Следует также отметить, что не всегда возможно определение вирусных белков в плазме крови. В таких случаях методом ИФА можно диагностировать только наличие антител в плазме крови пациента. Однако, важно помнить, что антитела могут вырабатываться в довольно длительный срок. Так, например, при инфицировании ВИЧ антитела вырабатываются в течение 6 месяцев, в случае гепатита С этот период может длиться до года, а антитела к вирусу Эпштейна-Барр (иммуноглобулины класса G) присутствуют у большого количества практически здоровых людей и их диагностика обладает низкой прогностической значимостью.
Полимеразная цепная реакция (ПЦР) — метод молекулярной биологии, позволяющий обнаружить возбудителя заболевания на основе его генетической информации.
ПЦР диагностика дает возможность существенно ускорить и облегчить диагностику различных заболеваний, в частности, вирусов гепатита В, С, D, цитомегаловирусной инфекции, вируса Эпштейна-Барр, вируса простого герпеса, а также хламидиоза, микоплазмоза, уреаплазмоза и т.п. При помощи данного метода вирусные инфекции можно обнаружить уже через 5–7 дней после заражения, за недели или месяцы до того, как появятся антитела или первые симптомы. Метод ПЦР позволяет выявить даже единичные клетки возбудителя, благодаря многократному увеличению последовательностей ДНК.
Полимеразная цепная реакция - это один из самых точных методов лабораторной диагностики. Его чувствительность составляет 95–99%, а специфичность достигает 100%.
Таким образом, достижения науки в области онкологии внесли определенную ясность в понимание механизмов возникновения некоторых злокачественных новообразований и все же большую часть из них не удается увязать с инфицированностью тем или иным вирусом, что создает большое поле деятельности современным онкологам в направлении дальнейшего изучения механизмов развития онкологических заболеваний.
Все вышеуказанные методы диагностики существуют у нас в РНПЦ онкологии и медицинской онкологии им. Н.Н.Александрова. В лаборатории клинической молекулярной генетики и иммунологических методов диагностики можно пройти обследование на вирусы герпеса,цитомегаловируса, Эпштена-Барра, вирусы гепатита В и С, а также пройти обследование на инфицирование вирусом папилломы человека, данные исследования может пройти любой человек обратившийся в центр.
ДНК-вирусы как причина развития рака - вирусный канцерогенез
В канцерогенезе также могут участвовать ДНК-содержащие вирусы. Наиболее крупные ДНК-содержащие вирусы принадлежат к группе герпесвирусов. Первым вирусом, выделенным из культуры опухолевых клеток, был вирус Эпштейна-Баррра (ЭБВ).
Вирус был получен из культуры опухолевых клеток больных лимфомой Беркита. В культуре in vitro ЭБВ вызывает бесконечную пролиферацию человеческих В-лимфоцитов. Вирусные гены, встраиваясь в геном этих клеток, инициируют пролиферацию путем активации клеточных генов-регуляторов роста (онкогенов).
В крови больных лимфомой Беркита обнаруживается более высокий, чем у здоровых людей, титр антител к антигенам вирусной оболочки и к мембранным антигенам. В то же время в африканских странах среди множества детей, инфицированных этим вирусом, лимфома развивается только в единичных случаях.
Механизм онкогенеза этого заболевания не может быть объяснен только вирусным заражением. К тому же, за пределами африканского континента регистрируются случаи заболевания лимфомой Беркита, абсолютно не связанные с инфицированием вирусом ЭБВ. По-видимому, ЭБВ также может принимать участие в патогенезе карциномы носоглотки, так как клетки этой опухоли экспрессируют вирусные антигены EBNA-1.
При исследованиях саркомы Капоши, развивающейся у больных СПИДом, в 1994 г. из ее клеток был выделен новый герпесвирус. Первоначально вирус получил название герпес-вируса саркомы Капоши (ГСК), впоследствии он был переименован в герпесвирус человека серотип 8 (ГВЧ 8). Вирус обнаруживается в веретеновидных клетках саркомы Капоши практически при всех случаях заболевания.
ГВЧ 8 был также найден в опухолевых клетках первичной эффузионной лимфомы и в клетках многоочаговой болезни Кастлемана. Данный вирус кодирует синтез циклина, который является промотором клеточного деления, чем и объясняется высокая пролиферативная активность инфицированных клеток.
Человеческие папилломавирусы (ПВЧ) вызывают кожные бородавки и ряд доброкачественных папиллом. Это весьма обширный класс вирусов, и некоторые его представители могут в той или иной степени участвовать в развитии злокачественных опухолей. Большинство вирусов вызывает лишь ограниченную пролиферацию клеток, но ряд серотипов может вызвать и развитие злокачественных новообразований.
Наибольшую опасность с точки зрения онкологии представляют серотипы 16, 18, 31 и 33. Более 90% опухолей карциномы шейки матки in situ обнаруживают в своих клетках генные последовательности вирусов ПВЧ. Эти вирусы также играют значительную роль в возникновении инвазивных и многоочаговых плоскоклеточных раков кожи, которые часто развиваются у больных после долгосрочных курсов иммуносупрессивной терапии.
Механизмы вирусного канцерогенеза в этом случае изучены недостаточно. В исследованиях доказано, что существует вероятность включения вирусной ДНК в клетки базального эпителия. Обычно в клеточную ДНК внедряются восемь ранних и два поздних гена. Ранние гены Е6 и Е7 вызывают пролиферацию клеток.
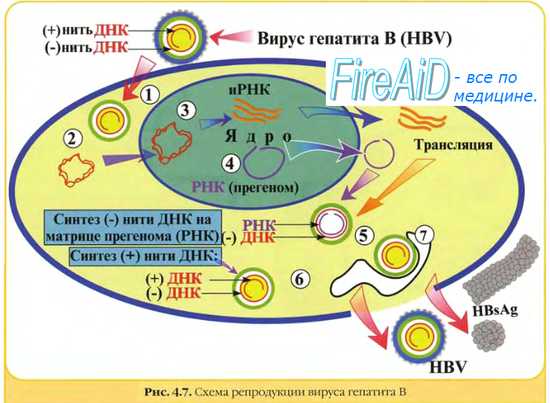
Вирус гепатита В четко связывают с развитием печеночно-клеточного рака. Риск развития этого заболевания у инфицированных вирусом в 200 раз превышает таковой у неинфицированных людей. Механизмы зарождения рака не до конца понятны: считается, что вирус вызывает бесконечную пролиферацию клеток, хотя зараженные вирусом клетки уничтожаются иммунной системой организма. Возможно, что пролиферирующие клетки становятся чувствительными к другим канцерогенам, например к афлатоксину.
Подытоживая вышесказанное, можно заключить, что основным механизмом канцерогенного воздействия является повреждение молекул ДНК и нарушения процессов ее репарации. Если не происходит исправления первичных повреждений ДНК, ошибки со временем начинают накапливаться, что ведет к дестабилизации структуры хромосом и к соматическим мутациям. Большинство таких мутаций летальны для клетки.
Однако, если часть клеток выживает, происходит постепенное накопление клеточной массы с опухолевым фенотипом, что в итоге приводит к клиническим проявлениям. Большой вклад в понимание этого процесса внесли современные исследования механизмов регулировки клеточного цикла и недавнее открытие регуляторных белков, которые запрещают клетке делиться, если ее геном сильно поврежден.
Для развития опухоли может быть недостаточно единичных мутаций в генах-регуляторах деления, но накопление массы ошибок в регуляторных генах может привести к фатальным последствиям. Особенно критичны мутации в генах, регулирующих клеточное деление, так называемых онкогенах. Очень опасны также мутационная инактивация генов, подавляющих клеточное деление — генов-подавителей опухоли, и мутации в генах, кодирующих белки, запрещающие деление при повреждении клеточного генотипа.
Накопление числа жизнеспособных мутаций по одному или нескольким из этих генов приводит к общей клеточной дезорганизации и к потере контроля над клеточным делением. В следующем разделе мы рассмотрим механизмы действия онкогенов и наиболее важные моменты контроля над клеточным циклом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
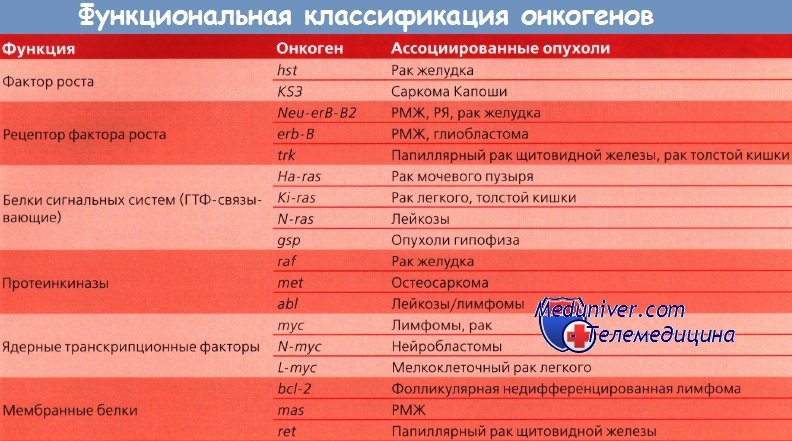
Онкогены и их функциональная классификация
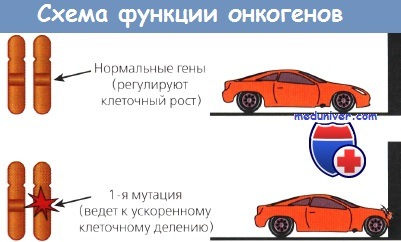
За последние 25 лет произошел существенный прогресс в нашем понимании молекулярных механизмов развития злокачественных опухолей. Идентифицировано три типа генов, нарушения в которых приводят к раку: доминантные трансформирующие, или онкогены; рецессивные трансформирующие, или опухолевые супрессоры; гены, ответственные за репарацию ДНК. Многие онкогены были впервые выделены как формы протоонкогенов онкогенных РНК-содержащих вирусов.
На протяжении многих лет известно, что вирусы способны вызывать злокачественные опухоли у животных. Это наблюдение послужило стимулом к обширным исследованиям, направленным на выявление генов, которые вызывают рак и переносятся вирусами, и генов человека, повреждающихся при развитии злокачественных опухолей. В итоге обнаружили удивительный факт, что гены, вовлеченные в канцерогенез, часто представляют собой измененные формы вирусных генов.
Другие протоонкогены кодируют внутриклеточные белки, ответственные за усиление митогенного сигнала; третьи — кодируют белки, вовлеченные в контроль клеточного деления и находящиеся под контролем ядра. Такие онкогены могут быть активированы посредством нескольких механизмов: возможна амплификация гена и активация его копий; в редких случаях наблюдается траислокация гена на другую хромосому, где он попадает под контроль чужого промотора и стимулирует неконтролируемый рост. Три группы онкогенов находятся под разным контролем.
Первая группа включает пептидные факторы роста и их рецепторы, как, например, эпидермальный или тромбоцитарный.
Эти пептиды служат скорее костимуляторами опухолевого роста, чем факторами, непосредственно инициирующими опухолевую трансформацию. По мере расшифровки механизмов, стимулирующих опухолевую прогрессию, все более реальной становится молекулярно-нацеленная (таргетная) терапия, направленная непосредственно против продуктов этих генов или против белков, активируемых ростовыми факторами. Так разработаны препараты:
1) трастузумаб (Герцептин) — моноклональные антитела, блокирующие Her-2/neu;
2) иматиниба мезилат (Гливек) — препарат, частично блокирующий активность c-kit, BCR-ABL и некоторых других тирозинкиназ;
3) цетуксимаб (Эрбитукс) — моноклональные антитела, связывающиеся с рецептором эпидермального фактора роста;
4) гефитиниб (Пресса) — низкомолекулярный ингибитор некоторых изоформ рецептора эпидермалыюго фактора роста.

Другой класс онкогенов происходит из немембранных внеядерных факторов роста, передающих каскадные сигналы внутри клетки. К ним относятся G-белки и белки семейства ras. Наконец, некоторые онкогены кодируют ядерные регуляторные белки, например myc. Схематическое изображение функций онкогенов представлено на рисунке.
Открытие человеческих аналогов вирусных генов привело к формулировке многообещающей гипотезы, согласно которой злокачественные опухоли человека, включая большинство невирусной этиологии, могут возникать вследствие мутаций, превращающих полезные протоонкогены в опасные онкогены. В подтверждение этой гипотезы показано, что повреждение даже одного аллеля таких протоонкогенов достаточно для злокачественной трансформации некоторых клеток in vitro. Подобные доминантные мутации ведут к гиперэкспрессии нормального гена и, следовательно, гиперпродукции нормального белка или же к синтезу его аберрантной формы, обладающей повышенной активностью.
В любом случае результатом оказывается усиление стимулирующих сигналов внутри клетки, даже в отсутствие стимулирующих воздействий извне.
Парадоксально, но первым ключом к выявлению некоторых онкогенов стало исследование РНК-содержащих онкогенных вирусов животных, не вызывающих опухолей у человека. Эти ретровирусы, инфицирующие кур, грызунов, кошек и обезьян, оказались крайне высокоонкогенными: развитие опухоли часто наблюдали уже при первом контакте. У одного из вирусов этой группы, вируса саркомы кур Рауса, выявлен ген, ответственный за злокачественное перерождение инфицированных клеток. Этот тип трансформирующих онкогенов был назван вирусным онкогеном.
Единственный онкоген вируса саркомы Рауса, проникая в клетки кур, способен нарушать и перестраивать их метаболизм, направляя его по пути злокачественной трансформации.
В 1976 г. Varmus и Bishop показали, что онкоген вируса саркомы Рауса в действительности вовсе не есть вирусный ген, а происходит от предсуществовавшего клеточного гена, захваченного предком вируса саркомы Рауса. Однажды встроив его в свой геном, вирус далее использовал этот ген для трансформации клеток млекопитающих.
Более ранние предки вируса саркомы Рауса были способны реплицироваться в инфицированных клетках, но не могли трансформировать ее; туморогенный потенциал был приобретен после захвата нормального клеточного гена — протоонкогена. В связи с этим значение работы Varmus и Bishop гораздо больше, чем просто исследование вируса саркомы Рауса: показано существование гена в нормальном геноме клеток млекопитающих, обладающем трансформирующим потенциалом при соответствующей активации, в данном случае ретровирусом.
Информация, полученная при исследовании ретровирусов и онкогенов, существенно помогла в изучении причин злокачественных новообразований. Ретровирусы, так же как вирус саркомы Рауса, неинфекционны для человека и, соответственно, не могут активировать протоонкогены человека. Однако возможны альтернативные механизмы их активации. Эффекты, сходные с производимыми вирусом в последовательности ДНК, могут быть вызваны химическими или физическими воздействиями.
Это было подтверждено в начале 80-х годов прошлого столетия: в геноме опухолевых клеток были выявлены мутированные гены (протоонкогены). Во всех случаях причиной превращения протоонкогена в активный онкоген оказались изменения последовательности гена. Например, онкоген ras образуется из протоонкогена-предшественника в клетках рака мочевого пузыря человека вследствие замены одной пары нуклеотидных оснований; онкоген myc появляется во многих злокачественных новообразованиях в результате амплификации.
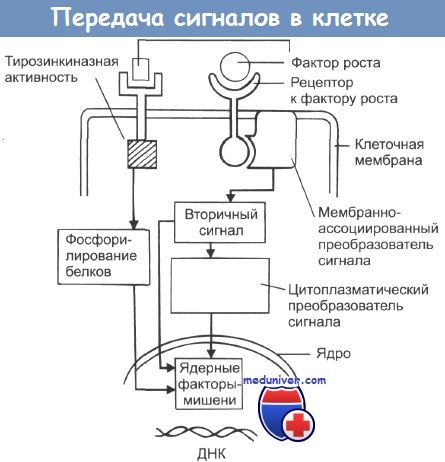
В последующем были изучены механизмы, посредством которых большинство, если не все онкогены вызывают трансформацию клеток. Это стало возможным благодаря определению путей, посредством которых клетки регулируют свой собственный рост. Рост иделение нормальной клетки вткани контролируется преимущественно ее окружением. В норме клетка редко или даже никогда не определяет скорости своего деления, а только реагирует на сигналы от окружающих клеток.
Эти сигналы, стимулирующие или подавляющие рост, передаются посредством ростовых факторов, выделяемых окружающими клетками. Ростовые факторы попадают в межклеточное пространство и связываются с рецепторами на поверхности клеток-мишеней. Клетки реагируют на сигналы ростовых факторов активацией механизмов синтеза клеточных структур, удвоением ДНК и делением. Нормальная клетка никогда не запускает программу роста, если она не получила внешнего сигнала. Каждая клетка обладает сложной системой, позволяющей ей получать ростовые сигналы, обрабатывать их и запускать программу деления. Эта система состоит из большого количества белков, ответственных за получение ростовых сигналов и передачу их в клетку. К этим белкам относятся:
1) рецепторы на клеточной поверхности, распознающие наличие во внеклеточном пространстве ростовых факторов и передающие сигнал во внутриклеточное пространство;
2) белки внутриклеточной сигнальной системы, которые активируются поверхностными рецепторами и затем передают сигнал дальше в клетку;
3) ядерные транскрипционные факторы, активирующиеся в ответ на сигнал, переданный белками внутриклеточной сигнальной системы, и, в свою очередь, активирующие широкий спектр клеточных генов.
Активирующиеся гены руководят программой роста клетки; именно эти гены определяют те события, которые вместе взятые приведут к делению клетки. Протоонкогены кодируют многие белки в этой сложной сигнальной системе, позволяющей нормальной клетке отвечать на экзогенные ростовые факторы. Белки онкогенов участвуют в сигнальной системе, отбирая ее неправильно функционирующие версии нормальных компонентов, и вызывают ее постоянную стимуляцию в отсутствие внешних ростовых сигналов. В результате клетка постоянно растет, даже если окружающая среда не содержит каких-либо факторов, в норме необходимых для клеточного роста.
Некоторые исследователи указывают, что в злокачественной клетке должны присутствовать как минимум две мутации в протоонкогенах, причем только строго определенные мутации могут вызывать злокачественную трансформацию. Это связано с тем, что отдельные онкогены, даже если они служат важными регуляторами клеточного метаболизма, сами по себе не способны индуцировать злокачественное новообразование. Данная точка зрения подтверждается выявлением в опухолевых клетках более 10 различных онкогенов. Однако при тщательном исследовании ожидаемые нарушения обнаруживают лишь примерно в 20 % опухолей.
Ни одна опухоль не несет ни одной пары сочетанных нарушений из выявляемых в культивируемых линиях злокачественных клеток. Предполагается также, что врожденные мутации, ответственные за предрасположенность людей к раку, не есть онкогены. Это объясняется существованием рецессивных антионкогенов, получивших название генов-супрессоров, тоже играющих крайне важную роль в развитии опухолей.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
РНК-вирусы как причина развития рака - вирусный канцерогенез
Открытие вирусов, вызывающих злокачественные опухоли у животных, произошло еще на рубеже XIX и XX веков. В 1910 г. Пейтон Рауш обнаружил, что бесклеточный фильтрат из тканей птичьей саркомы может вызывать развитие аналогичной саркомы у цыплят. Примерно в это же время была доказана вирусная природа птичьего миелобластоза. Позднее было обнаружено, что часто проходит весьма значительный латентный период между инфицированием вирусом и развитием рака.
Тем не менее вплоть до 1960-х годов не существовало четких доказательств того, что инкорпорация вирусной ДНК в геном клетки является необходимым условием развития злокачественной трансформации, как не было и случаев выделения вирусной ДНК из раковых клеток.
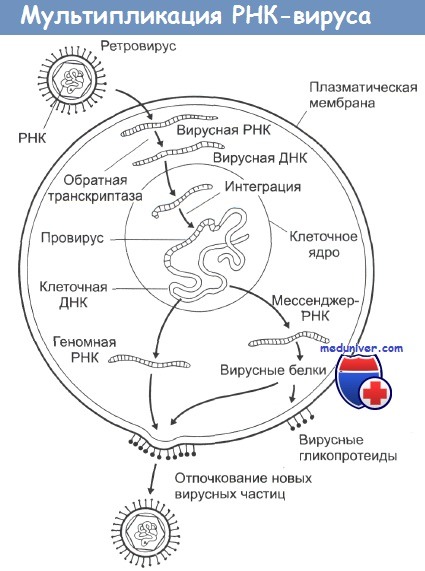
РНК-содержащие вирусы вызывают развитие целого ряда различных опухолей у животных, при этом наиболее распространена индукция этими вирусами лимфом, лейкемий и сарком. Типичная структура таких вирусов - это две идентичные цепочки молекул РНК в сочетании с ферментом обратная транскриптаза, одетых в гликопротеиновую оболочку. При инфицировании вирусом его обратная транскриптаза заставляет клетки синтезировать ДНК, комплементарную вирусной РНК.
Эта ДНК затем встраивается в клеточные хромосомы, и на ее основе клетка уже сама начинает синтез новых вирусных белков, вирусных обратных транскриптаз и элементов гликопротеиновой оболочки. Из-за механизма их действия этот тип вирусов получил название ретровирусы. Все они имеют весьма схожий внешний вид на электронных микрофотографиях и являются самыми маленькими из известных вирусов.
Некоторые из ретровирусов (например, вирусы птичьего лейкоза, кошачьей и мышиной лейкемии) содержат в себе только три гена и обладают очень длительным инкубационным периодом с момента заражения до возникновения опухоли. Другие вирусы (например, вирус саркомы Рауса (ВСР)) вызывают очень быструю злокачественную трансформацию и могут быть выделены из культуры опухолевых клеток.
Показано, что вирус ВСР содержит особый ген (v-src), способный вызывать трансформацию фибробластов in vitro. Этот ген кодирует наработку протеинкиназы, которая фосфорилирует тирозин. К сожалению, действие этой протеинкиназы запускает целый каскад различных метаболических процессов, и очень сложно оценить, какой именно из них ведет к злокачественной трансформации.
В настоящее время известно, что и нормальные, и злокачественные клетки содержат в своем генотипе участки ДНК, сходные или идентичные ряду последовательностей онкогенных РНК-содержащих вирусов. Такие участки получили название клеточных прото-онкогенов (чтобы отличать их от вирусных онкогенов). Постулируется, что активация этих участков, возникающая в результате канцерогенного воздействия, запускает целую цепочку событий, ведущую в итоге к злокачественной трансформации клетки. Считается также, что ретровирусы инкорпорировали эти клеточные участки в свой геном в процессе эволюции.
В настоящее время мы лучше понимаем механизмы действия продуктов вирусной активации. Примером такого продукта является протеинкиназа, активируемая геном sre, а также целый ряд других вирус-индуцированных канцерогенов. Это и рецепторы к эпидермальному фактору роста, продуцируемые геном v-erb, и тромбоцитарный фактор роста (ТФР), кодируемый фрагментами гена v-sis, и целый ряд связывающихся с ядром клетки белков, продукцию которых вызывает вирус птичьей лейкемии.
Как нормальные, так и раковые клетки содержат в себе участки последовательностей ДНК, гомологичные РНК онкогенных вирусов. Если происходит экспрессия или активация под действием канцерогенов этих клеточных онкогенов, это ведет к злокачественной трансформации клеток.
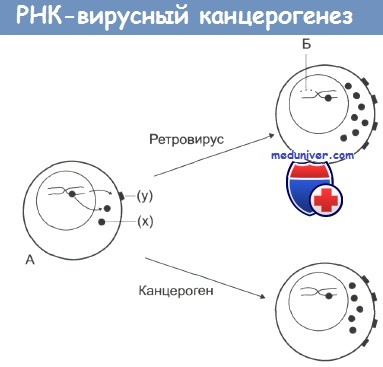
Онкогенная и злокачественная трансформация.
На стадии А нормальная клетка, которая характеризуется низкой протоонкогенной активностью, продуцирует фактор роста (х) или белки дифференцировки или рецепторы (у).
Канцерогены повышают активность протоонкогенов, что дает начало неопластической трансформации.
По другому механизму: при заражении ретровирусом происходит внедрение в ДНК клетки вирусных промоторов или онкогенов (Б), что также ведет к увеличению онкогенной активности и последующей злокачественной трансформации.
Первым ретровирусом, для которого была однозначно доказана связь со злокачественными новообразованиями, был вирус Т-клеточной лейкемии человека (ВТКЛ-1), выделенный из клеток хронической кожной Т-лимфомы. Этот вирус довольно широко распространен, может передаваться половым путем, через кровь, особенно в среде наркоманов, и от беременной женщины к плоду. Первоначально эндемический ареал циркуляции данного вируса был в основном представлен тропическими странами, однако в настоящее время в США серопозитивная реакция на вирус обнаруживается у каждого из 4000 человек населения. Кроме Т-клеточной лейкемии вирус вызывает тропический спастический паралич.
После 20 лет наблюдения за серопозитивными пациентами оценено, что риск развития последнего заболевания составляет около 5%. Один из вирусных генов, а именно tax-ген, вызывает увеличение продукции клеточного интерлейкина-2 (ИЛ-2) и его рецепторов, что является основным фактором, стимулирующим деление Т-клеток.
Ретровирусы могут вызывать опухолевые заболевания не напрямую, а опосредованно, как это было показано для вируса иммунодефицита человека (ВИЧ-1), вызывающего развитие СПИДа. Случаи развития рака у ВИЧ-инфицированных рассмотрены в одном из обзоров. Отмечается, что у ВИЧ-инфицированных наиболее часто развиваются три типа опухолей: мгновенная или высокозлокачественная В-клеточная лимфома; саркома Капоши (СК, которую вызывает другой вирус — герпесвирус ГСК, или герпесвирус 8); карцинома шейки матки.
До разработки эффективных методов терапии ВИЧ-инфицированных более 40% из них заболевали тем или иным видом рака. Тем не менее связь этого вируса с развитием онкологических заболеваний скорее всего косвенная и опосредована развитием общей хронической иммунодепрессии организма, которая и позволяет другим канцерогенным вирусам вызывать рак. В-клеточные лимфомы также характеризуются довольно сложным патогенезом. Хотя В-клетки не поражаются вирусом ВИЧ-1, они могут быть мишенью для других типов вирусов, например для вируса Эпштейна-Барра (ВЭБ). Рак шейки матки у женщин также развивается на основе вторичной вирусной инфекции — вируса папилломы человека (ВПЧ), на фоне общей иммунодепрессии, вызванной ВИЧ-1. По причине общего снижения иммунных реакций организма все эти опухоли развиваются особенно быстро и агрессивно.
Показано, что РНК-содержащий вирус гепатита С значительно увеличивает риск заболевания гепатоклеточной карциномой. У больных, инфицированных этим вирусом, риск развития раковой опухоли возрастает в 100 раз, но механизмы его канцерогенного действия в настоящее время почти не изучены. Если больной заражен еще и вирусом гепатита В, риск развития рака печени возрастает многократно. На земном шаре одним или обоими из этих вирусов заражено около миллиарда человек.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Шведские и немецкие вирусологи выяснили как работает иммунитет, почему возникает болезнь Альцгеймера и что способствует заражению ВИЧ. Оказалось, что причина – в белках.

Александр Попандопуло, студент медицинского института УЛГУ. Редактор А. Герасимова
Студент медицинского факультета УЛГУ. Интересы: современные медицинские технологии, открытия в области медицины, перспективы развития медицины в России и за рубежом.
- Запись опубликована: 06.01.2020
- Reading time: 2 минут чтения
Вирусы и белки, попавшие в организм, влияют друг на друга. Одни делают возбудителей более опасными, а другие гасят их вредное воздействие.
Вирус в оболочке – как работает иммунитет
Многие инфекционные заболевания, вызываемые вирусами, формируют у переболевших стойкий иммунитет, поэтому заболеть ими дважды невозможно. Иммунная система вырабатывает антитела, препятствующие развитию инфекции, которые сохраняются пожизненно.
Ученые из Стокгольмского университета выяснили, что секрет такой защиты кроется во взаимодействии вирусов и белков. Чтобы понять, как всё это происходит, нужно представить себе теннисный мяч, который упал в смесь молока и кукурузных хлопьев. Его поверхность тут же покрывается липкой массой. Тоже происходит и с вирусами, попавшими в организм, при их взаимодействии с белками.
Для проведения исследования был использован респираторно-синцитиальный вирус , вызывающий инфекции дыхательных путей, в основном, у детей. К этому возбудителю после первого случая заражения формируется иммунитет. У взрослых вызванные им заболевания практически не встречаются, поскольку более 90% населения переболело этой инфекцией в детском возрасте, приобретя невосприимчивость.

Респираторно-синцитиальный вирус
Чтобы понять, как работает иммунная защита, ученые поместили вирусы в плазму крови. Так называется её жидкая часть, лишенная кровяных телец. Результат показал, как работает иммунитет:
- При помещении возбудителей в плазму, взятую у детей, которые не болели этой инфекцией, ничего происходило – вирусы продолжали плавать, оставаясь такими же опасными и активными.
- При погружении вирусов в плазму взрослого человека, переболевшего этим заболеванием, на их оболочку прилипали антитела, как мокрые хлопья на теннисный мяч. В результате микроорганизмы теряли свою активность и способность заражать.
Взаимодействие вирусов и белков приводит к болезни Альцгеймера
При этом заболевании ухудшаются память, внимание и мышление. Больные становятся беспомощными, нуждаются в уходе и контроле. Ученые давно выяснили, что при болезни Альцгеймера в головном мозге появляется , который откладывается в виде бляшек и разрывает связь между нервными клетками. С накоплением этих белковых соединений связывают слабоумие, сопровождающее болезнь Альцгеймера.
Исследователи решили узнать, не виновато ли в этом процессе взаимодействие белков и вирусов. Оказалось, что такая связь существует. Вирусы, чаще всего – герпеса, проникающие в центральную нервную систему, склеивают между собой белки, из которых формируются длинные волокна. Из этого материала и образуется бета-амилоид, который откладывается в виде бляшек в головном мозге.
Для проведения эксперимента ученые взяли две пробирки с плазмой, в которые были помещены белки, формирующие бета-амилоид. В одну из них был помещен вирус герпеса. Оказалось, что под его влиянием процесс идет гораздо быстрее, что указывает на провоцирующую роль возбудителей в возникновении болезни. Чтобы подтвердить результат, учёные ввели вирусы герпеса в мозг мышей – в результате у животных очень быстро развилась болезнь Альцгеймера.
Белки в плазме
Эксперимент не только показывает механизм развития болезни Альцгеймера, но и проливает новый свет на опасность герпеса. Оказывается, что возбудитель может вызвать не только высыпания на губах и половых органах, но и слабоумие.
Вирус СПИДа так же, как и герпес, может атаковать нервную систему. Возникает нейроСПид, из-за которого 50% ВИЧ-инфицированных страдают ухудшением памяти, депрессией, нарушением концентрации и ослаблением внимания.
Результаты этих исследований сподвигли ученых на проведение экспериментов, в ходе которых вирусы будут помещать в различные белковые жидкости. Это позволит понять, как можно снизить заразность возбудителей, усилить работу иммунной системы и предотвратить болезни, спровоцированные возбудителями.
Читайте также:

