Вирусы обладают избирательной активностью
Обновлено: 19.04.2024
Чем шире распространяется пандемия коронавируса, тем больше ясности относительно ареала поражения им. И всё больше вопросов касательно источника происхождения COVID-19.
Вирус обходит государства, стоящие в стороне от главных проблем мировой политики, и распространяется на территории, где сталкиваются интересы мировых игроков. Конечно, и другие страны задеваются пандемией, но говорить об особой опасности для них не приходится.
Вот некоторые цифры из немецкого источника за 24 марта:
В настоящее время болеют
Очень страдает от нашествия вируса Иран, с которым у КНР нет ни общей границы, ни оживлённого обмена людьми. И в этом случае эпидемия в Иране выгодна Вашингтону, который отказывается снимать антииранские экономические санкции. Смертность от эпидемии в Иране превысила среднемировые показатели более чем вдвое и составила 7,8%. В администрации США сообщили, что позволять Ирану продавать нефть для покупки лекарств и оборудования не будут.
Ситуация, аналогичная иранской, может сложиться в воюющей Сирии. Обе эти страны являются объектами повышенного интереса США.
Возьмём Италию и Испанию – две страны в Европе, наиболее поражённые пандемией. Правительство Италии вошло в конфликт с Брюсселем и не идёт на уступки по вопросам выплаты госдолга и дефицитного бюджета. Еврокомиссия отказалась одобрять итальянский вариант предложений по этому вопросу. Наметилась угроза выхода Италии из ЕС. На этом фоне и разворачивается драма с разрастанием эпидемии в стране пиний и пенсионеров. Италия ставит скорбный рекорд по уровню жертв – более 10% умерших от числа заболевших. В соседних Австрии, Швейцарии, Германии масштабы пандемии несравнимо меньше.
Примерно такое же положение в Испании, которую постоянно трясёт каталонский сепаратизм.
Отдельно надо говорить о той драме, что разворачивается в США. По имеющейся информации, к 26 марта Соединённые Штаты Америки вышли на первое место в мире по количеству выявленных заболеваний коронавирусом. Здесь эпидемия становится аргументом демократов в идущей предвыборной схватке с Трампом. Некоторые СМИ предсказывают Америке к лету-осени миллионы заболевших и сотни тысяч умерших, называя такие цифры: на 330 млн. граждан США – 55 тыс. заражённых и 379 погибших. Для сравнения: последние три года число смертей в ДТП в США держится на уровне 40 тыс. человек. А козырными картами Трампа являются низкая безработица и поддержка национального бизнеса; по этим составляющим социально-экономического положения Америки пандемия и наносит главный удар.
Фото: REUTERS/Jose Luis Saavedra
Если Вы заметите ошибку в тексте, выделите её и нажмите Ctrl+Enter, чтобы отослать информацию редактору.
Резюме: актуальность проблемы респираторных вирусных заболеваний обусловлена их чрезвычайно широким распространением, зачастую тяжелым течением, возможностью развития жизнеугрожающих осложнений и высоким экономическим ущербом, наносимым обществу в целом. В статье в сравнительном аспекте рассматриваются различные лекарственные средства, используемые в комплексной терапии острых респираторных вирусных инфекций у детей.
Ключевые слова: респираторные инфекции, индукторы интерферона, иммуномодуляция, дети, Циклоферон®
Abstract: the urgency of the problem of respiratory viral diseases is due to their extremely high spread, often severe, the possibility of developing life-threatening complications and the high economic damage caused to society as a whole. The article in a comparative aspect discusses the various drugs, used for the prevention and treatment of acute respiratory viral infections in children.
Keywords: respiratory infections, interferon inductors, immunomodulation, children, Cycloferon®
Этиологическими факторами данной группы заболеваний являются около 300 эпителиотропных вирусов, из которых наиболее часто встречающимися у детей являются риновирусы, парагрипп, аденовирусы, грипп. В последние годы нарастает удельный вес таких возбудителей, как корона-, бока- и метапневмовирусы. Также ежегодно увеличивается доля различных микст-инфекций, вызывающих более тяжелое по течению респираторное заболевание, что существенно усложняет диагностику и лечение таких пациентов.
Клинические симптомы респираторных вирусных инфекций у детей во многом похожи и проявляются различной по степени тяжести и длительности лихорадкой, интоксикацией, катаральным синдромом и поражением дыхательных путей (табл. 1).
Таблица 1. Тропизм различных вирусов, вызывающих ОРВИ
| Вирус | Наиболее часто поражаемый орган |
| Гриппа | Трахея, носоглотка, сосуды |
| Парагриппа | Гортань |
| Аденовирус | Глотка, конъюнктива, кишечник |
| Риновирус | Полость носа |
| Реовирус | Носоглотка, кишечник |
| Коронавирус | Носоглотка, бронхи, кишечник |
| РС-вирус | Бронхиолы, альвеолы |
| Бокавирус | Носоглотка, кишечник |
| Метапневмовирус | Носоглотка, трахея, бронхи |
При гриппе на первый план выходит выраженный интоксикационный синдром и лихорадка, аденовирусная инфекция характеризуется болью в горле, конъюнктивитом, продуктивным кашлем, нередко - развитием обструктивного синдрома и болями в животе; при парагриппе часты ларингиты с развитием стеноза гортани, а при респираторно-синцитиальной инфекции -бронхит и/или бронхиолит с выраженным и длительным обструктивным синдромом. Однако различия симптоматики в зависимости от этиологии вирусного заболевания не всегда четко различимы, следовательно, практикующему врачу важно иметь в своем арсенале средства, одинаково эффективные для профилактики и лечения как гриппа, так и других ОРВИ.
Выбор метода лечения ОРВИ у детей зависит от возраста ребенка, клинической картины заболевания, выраженности симптомов, степени тяжести и наличия осложнений. Лечение обязательно должно включать режим, диету, медикаментозную и немедикаментозную терапию. Лекарственная терапия респираторных заболеваний у детей ориентирована на использование всего арсенала современных препаратов, отвечающих определенным критериям [3, 4]:
- высокая эффективность относительно большинства возбудителей;
- минимальный спектр побочных эффектов;
- отсутствие токсичности;
- сочетание противовирусного и иммуномодулирующего эффекта;
- наличие различных лекарственных форм;
- этиотропные, действующие на возбудителя заболевания;
- патогенетические (иммуномодулирующие), исправляющие нарушения системы иммунитета, возникающие и развивающиеся в процессе болезни;
- симптоматические, предназначенные для купирования отдельных симптомов заболевания.
Таблица 2. Механизм действия различных противовирусных препаратов, применяемых при ОРВИ
| Действие | Механизм действия | Препарат |
| Ингибиторы нейраминидазы | Конкурентно и избирательно ингибирует нейроминидазу, что нарушает проникновение вируса в здоровые клетки, тормозит выход вирионов из инфицированной клетки | Осельтамивир, занамивир |
| Блокатор М-йонного канала (адамантаны) | Блокирует специфические ионные М-2 каналы, что приводит к нарушению процесса дезинтеграции вириона и высвобождению рибонуклеопротеида | Ремантадин, орвирем |
| Блокатор слияния, индуктор ИФН | Ингибирует слияние липидной вирусной оболочки с клеточной мембраной | Арбидол |
| Ингибитор РНК и ДНК вирусов | Конкурентное подавление образования гуанозин трифосфата, приводящее к нарушению синтеза вирусных РНК и ДНК | Рибавирин |
Так, ингибиторы нейраминидазы обладают избирательной активностью только против вирусов гриппа типа А и В, эффективны при назначении не позднее 48 ч от начала клинических симптомов заболевания, оказывают раздражающее действие на слизистую оболочку респираторного и пищеварительного тракта, вызывают тяжелые аллергические реакции вплоть до развития токсического эпидермального некролиза, а также имеют высокую стоимость. Препараты из группы адамантинов также обладают избирательной активностью против вируса гриппа А, вызывают побочные эффекты со стороны желудочно-кишечного тракта в виде тошноты и рвоты, нервной системы, проявляющиеся галлюцинациями и психозом, аллергическими реакциями. Кроме того, все противовирусные препараты эффективны только при раннем их применении, не позже 24-48 ч и приводят к возникновению штаммов вирусов с низкой чувствительностью или резистентностью к терапии. Лекарственная устойчивость является результатом мутаций вирусов и развивается, как правило, при многократном использовании препарата [5, 6].
Основными патогенетически действующими группами препаратов являются интерфероны и их индукторы. Интерфероны - это группа биологически активных белков или гликопротеидов, синтезируемых клеткой в процессе защитной реакции на чужеродные агенты (экзогенные и/или эндогенные). Образование и действие интерферона составляет важнейший механизм врожденного (естественного) иммунитета. Доказано, что течение и исход вирусных инфекций во многом зависит от способности системы интерферона быстро реагировать на внедрение возбудителя [7]. Всего в настоящее время описано более 100 различных эффектов интерферонов, основными из которых являются:
- подавление роста внутри- и внеклеточных инфекционных агентов вирусной и невирусной (хламидии, простейшие, бактерии) природы;
- антипролиферативная активность;
- антитуморогенный эффект;
- антимутагенный эффект;
- антитоксическое действие;
- радиопротективный эффект;
- иммуномодулирующий эффект(подавление или усиление продукции антител, стимуляция макрофагов, усиление фагоцитоза и др.).

Рис. 1. Побочные эффекты препаратов интерферонового ряда
Таблица 3. Классификация индукторов интерферона (Ершов Ф.И., Романцов М.Г., Петров А.Ю., 2008)
| Химическая природа | Препарат |
| А. Синтетические соединения с основной интерферон-индуктивной активностью | |
| Низкомолекулярные: Флуореноны Акриданоны Олигопептиды Производное имидазо (4,5-С) квинолина | Амиксин Циклоферон® аллокин-альфа имиквимод |
| Полимеры (дс-РНК) | Полудан, полигуацил |
| Б. Природные соединения с основной интерферон-индуктивной активностью | |
| Полифенолы | Кагоцел, мегосин, саврац рагосин, гозалидон |
| Полимеры (дс-РНК) | Ридостин, ларифан |
| Производные флавонидов и аминокислот | протефлазид |
| В. Иммунотропные препараты с вторичной интерферон-индуктивной активностью | |
| Т-миметики | Тимоген, тактивин, изопринозин, гроприносин, иммунофан |
| Иммуномодуляторы бактериального происхождения - эубиотики | Лактобактерин, биоспорин |
| Вакциноподобные препараты | Бронхомунал, рибомунил, ИРС-19, уроваксом |
| Липополисахариды | Пирогенал, продигиозан |
| Производные нуклеиновых кислот | Натрия нуклеинат |
| Препараты пурина и пиримидина | Метилурацил, пентоксил |
| Производные бензимидазола | Дибазол |
| Производные индола | Арбидол |
| Растительные иммунокорректоры | Родиола розовая, экстракт эхинацеи |
| Г. Препараты других фармакологических групп с вторичной интерферон-индуктивной активностью | |
| Метилксантины | Теофиллин, эуфиллин, дипиридамол, кофеин |
| Производные изохинолина | Папаверин, дротавирин |
| Производные бензофурана | Кордарон |
| Производные хромена | Интеркордин |
Среди индукторов интерферона в профилактике и лечении ОРВИ у детей широко применяется препарат Циклоферон®, являющийся синтетическим производным акридонуксусной кислоты. Препарат повышает уровень интерферона α/β-типа в органах и тканях, содержащих лимфоидные элементы: в слизистой тонкого кишечника, селезенке, печени, легких, активирует стволовые клетки костного мозга, стимулируя образование гранулоцитов, преодолевает гематоэнцефалический барьер. Циклоферон® обладает чрезвычайно широким спектром биологической активности: прямым противовирусным, иммуномодулирующим и противовоспалительным действиями. Прямая противовирусная активность Циклоферона® доказана относительно различных респираторных вирусов и гриппа А и В, вируса простого герпеса 1-го и 2-го типов, цитомегаловируса, гепатитов В и С, клещевого энцефалита, вируса папилломы человека. Препарат нарушает репликацию вирусов, блокирует инкорпорацию вирусных ДНК и РНК в капсиды, что приводит к увеличению количества дефектных вирусных частиц и снижает вирус-индуцированный синтез белка в клетках. Иммунотропное действие препарата реализуется путем активации фагоцитов, Т-лимфоцитов и NK-клеток, нормализации баланса между CD4+- и СБ8+-клетками, снижении уровня В-лимфоцитов в периферической крови, с одновременным повышением синтеза высокоаффинных антител и индукции синтеза мРНК для ИФН-γ[12; 13]. Противовоспалительное действие Циклоферона® обусловлено ингибированием основных провоспалительных цитокинов (IL-1-p, IL-8, IL-10 и TNF-ot).
Циклоферон® относится к ранним индукторам интерферона, так как пик его выработки приходится на период от 4 до 8 ч с момента приема, что позволяет рекомендовать препарат для купирования вирусного заболевания на ранней стадии или в качестве экстренной профилактики. Кроме того, Циклоферон® хорошо сочетается с симптоматическими препаратами, вакцинами, химиопрепаратами, препаратами интерферона, усиливая действие последних и уменьшая побочные эффекты от их применения, что позволяет получить оптимальный фармакотерапевтический эффект. Исследование эффективности применения Циклоферона® в комплексном лечении ОРВИ у детей, проведенное Е.И. Кондратьевой, выявило более быстрое купирование симптомов интоксикации и выраженности катаральных явлений, обусловленное противовоспалительным и цитопротективным действием на слизистую оболочку дыхательных путей, а также увеличением уровня секреторного IgA. М.В. Гаращенко в своем исследовании отмечает почти 10-кратное уменьшение числа заболевших ОРВИ в период эпидемического подъема заболеваемости на фоне применения Циклоферона® (6 и 58% соответственно), а также более легкое течение и отсутствие осложнений [14; 15].
Помимо высокой эффективности, препарат отличается высоким профилем безопасности, который подтверждается отсутствием токсичности, аллергенности, мутагенности, хорошей растворимостью в биологических средах и проникновением в ткани, быстрым выведением из организма и отсутствием кумуляции [16].
Таким образом, широкий спектр биологической активности при низкой токсичности, наличие иммуномодулирующего действия позволяют рекомендовать Циклоферон® как препарат первой линии в лечении острых респираторных инфекций у детей. Для наибольшей эффективности рекомендуется начинать применять Циклоферон® как можно раньше, дополняя его препаратами направленного этиотропного действия и иммуномодуляторами, что обеспечит достижение оптимального фармакотерапевтического эффекта.

В 1957 г. ученые обнаружили, что клетки, зараженные вирусом, вырабатывают особое вещество, угнетающее размножение как гомологичных, так и гетерологичных вирусов, которое они назвали интерфероном. Если иммунная система обеспечивает белковый гомеостаз и через него устраняет чужеродную генетическую информацию, то система интерферона непосредственно воздействует на чужеродную генетическую информацию, устраняя ее из организма на клеточном уровне, и тем самым обеспечивает нуклеиновый гомеостаз. Система интерферона тесно взаимодействует с иммунной системой.
Интерфероны закодированы в генетическом аппарате клетки. Гены для человеческого фибробластного интерферона располагаются во 2-й, 9-й и длинном плече 5-й хромосомы, а ген, регулирующий транскрипцию - в коротком плече той же хромосомы. Ген, детерминирующий восприимчивость к действию интерферона, локализован в 21-й хромосоме. Ген для α-интерферона располагается в 9-й хромосоме, для γ-интерферона - в 11-й хромосоме.
Система интерферона не имеет центрального органа, так как способностью вырабатывать интерферон обладают все клетки организма позвоночных животных, хотя наиболее активно вырабатывают его клетки белой крови.
Интерферон спонтанно не продуцируется интактными клетками и для образования его нужны индукторы, каковыми могут быть вирусы, бактериальные токсины, экстракты из бактерий и грибов, фитогемагглютинины, синтетические вещества - поликарбоксилаты, полисульфаты, декстраны, но наиболее эффективными индукторами интерферона являются двунитчатые РНК: двунитчатые вирусные РНК и двунитчатые синтетические сополимеры рибонуклеотидов (поли-ГЦ, поли-ИЦ) и др. Индукция интерферона происходит вследствие дерепрессии его генов.
Типы интерферонов. Известны три типа интерферонов человека: α-интерферон, или лейкоцитарный интерферон, который продуцируется лейкоцитами, обработанными вирусами и другими агентами; β-интерферон, или фибробластный интерферон, который продуцируется фибробластами, обработанными вирусами и другими агентами. Оба эти интерферона принадлежат к типу 1. Более сильный γ-интерферон, или иммунный интерферон, принадлежит к типу 2. Имеется несколько подтипов α-интерферона, и общее число их у человека доходит до 25. Сравнительная характеристика интерферонов человека приведена в таблице. Активность интерферонов измеряется в международных единицах (ME). Одна единица соответствует количеству интерферона, которое ингибирует репродукцию вируса на 50 %.
При индукции интерферонов синтезируется два и более его типов. Так, при индукции интерферона на лимфобластах образуется 87 % лейкоцитарного и 13 % фибробластного интерферона, при индукции интерферона на фибробластах имеют место обратные соотношения. Между тремя типами интерферонов могут существовать синергические взаимодействия.
Таблица 2
Сравнительная характеристика интерферонов человека
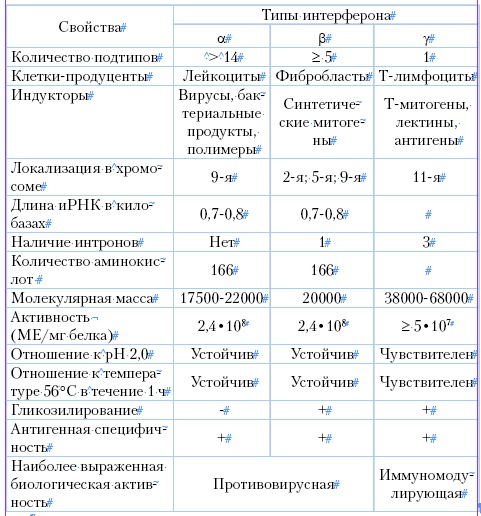
Свойства интерферонов. Интерфероны обладают видотканевой специфичностью. Это означает, что интерферон человека действует только в организме человека, но неактивен в организме других биологических видов. Конечно, барьеры видовой специфичности не абсолютны: интерферон человека проявляет некоторую активность в тканях человекообразных обезьян, а куриный интерферон в организме близких видов семейства куриных. Однако активность интерферона в гетерогенных организмах резко снижается.
Поэтому можно заключить, что интерфероны, появившиеся у позвоночных, эволюционировали вместе с хозяевами. Интерферон является относительно устойчивым белком и хорошо переносит кислую среду (рН 2,2), что используется для выделения его и очистки. Антигенные свойства интерферонов мало выражены, в связи с чем, антитела к нему удается получить лишь после многократных иммунизаций.
Интерфероны не обладают специфичностью в отношении вирусов и действуют угнетающе на репродукцию различных вирусов, хотя разные вирусы обладают неодинаковой чувствительностью к интерферону. Чувствительность к нему обычно совпадает с индуцирующей активностью к интерферону. Наиболее часто применяемыми индукторами интерферона и тест-вирусами для его титрования являются рабдовирусы (вирус везикулярного стоматита), парамиксовирусы, тогавирусы. Продукция интерферона зависит также от характера применяемых клеток. Существуют клетки, дефектные по нескольким генам интерферона.
Интерфероны оказывают антивирусное, противоопухолевое, иммуномодулирующее и многие другие действия. Наиболее изучено их антивирусное действие, и именно на вирусных моделях выяснены биологические и другие свойства интерферонов.
Интерферон оказывает противоопухолевое действие при парентеральном введении в больших дозах, связанное с подавлением им цитопролиферативной активности. Добавление интерферона к культуре нормальных клеток сопровождается уже через 2 ч угнетением в них синтеза ДНК. При вирусиндуцированных опухолях интерферон угнетает репродукцию онковирусов и одновременно подавляет цитопролиферативную активность.
Интерферон является регулятором различных механизмов иммунного ответа, оказывая стимулирующее или угнетающее действие на иммунные реакции.
Механизм действия интерферона. Интерферон связывается с клеточными рецепторами, находящимися на плазматической мембране, что служит сигналом для дерепрессии соответствующих генов. В результате индуцируется синтез особой протеинкиназы PKs, которая присутствует в следовых количествах во всех клетках млекопитающих и активируется низкими концентрациями двунитчатой РНК, а в зараженных вирусами клетках - вирусными репликативными комплексами.
Протеинкиназа фосфорилирует а-субъединицу инициирующего фактора трансляции eIF-2, и фосфорилирование блокирует активность инициирующего фактора. В результате иРНК, связанная с инициирующим комплексом, не может связаться с большой рибосомальной субъединицей, и поэтому ее трансляция блокируется. Инициирующий фактор eIF-2 в одинаковой степени необходим для трансляции как клеточных, так и вирусных иРНК, однако преимущественно блокируется трансляция вирусных иРНК, связанных с вирусными двунитчатыми РНК-структурами, в результате локальной активации протеинкиназы.
В обработанных интерфероном клетках индуцируется синтез фермента - синтетазы, которая катализирует 2,5-олигоадениловую кислоту, переключающую действие клеточных нуклеаз на разрушение вирусных иРНК. Таким образом, вирусные иРНК подвергаются разрушению нуклеазами. Блокирование интерфероном стадии инициации трансляции и разрушение иРНК обусловливают его универсальный механизм действия при инфекциях, вызванных вирусами с разным генетическим материалом.
Применение интерферонов. Интерфероны применяются для профилактики и лечения ряда вирусных инфекций. Их эффект определяется дозой препарата, однако высокие дозы интерферона оказывают токсическое действие. Интерфероны широко применяются при гриппе и других острых респираторных заболеваниях. Препарат эффективен на ранних стадиях заболевания, применяется местно, например путем закапывания или введения с помощью ингалятора в верхние дыхательные пути в концентрациях до 3∙104-5∙104 ед 2-3 раза в день. При конъюнктивитах интерферон применяют в виде глазных капель. Интерфероны оказывают терапевтическое действие при гепатите В, герпесе, а также при злокачественных новообразованиях. При этих заболеваниях назначают более высокие концентрации. Препарат применяется парентерально - внутривенно и внутримышечно в дозе 105 ед на 1 кг массы тела. Более высокие дозы оказывают побочное действие (повышение температуры, головная боль, выпадение волос, ослабление зрения и т.д.). Интерферон может вызвать также лимфопению, задержку созревания макрофагов, у детей - тяжелые шоковые состояния, у больных с сердечно-сосудистыми заболеваниями - инфаркт миокарда. Очистка интерферона значительно снижает его токсичность и позволяет применять высокие концентрации. Очистка осуществляется с помощью аффинной хроматографии с использованием моноклональных антител к интерферону.
Генноинженерный интерферон. Генноинженерный лейкоцитарный интерферон получают в прокариотических системах (кишечной палочке). Биотехнология получения интерферона включает следующие этапы:
1) обработка лейкоцитарной массы индукторами интерферона;
2) выделение из обработанных клеток смеси иРНК;
3) получение суммарных комплементарных ДНК (кДНК) с помощью обратной транскриптазы;
4) встраивание кДНК в плазмиду кишечной палочки и ее клонирование;
5) отбор клонов, содержащих гены интерферона;
6) включение в плазмиду сильного промотора для успешной транскрипции гена;
7) экспрессия гена интерферона, т.е. синтез соответствующего белка;
8) разрушение прокариотических клеток и очистка интерферона с помощью аффинной хроматографии.
Получены высокоочищенные и концентрированые препараты интерферона, которые испытываются в клинике.
Человеческий лейкоцитарный интерферон, нативный и концентрированный, предназначен для профилактики и лечения гриппа и других вирусных респираторных заболеваний.
Лейкоцитарный интерферон - видоспецифический белок, синтезируемый лейкоцитами человека в ответ на воздействие вируса-интерфероногена. Интерферон не обладает избирательной противовирусной активностью и действует практически на все вирусы.
Для приготовления интерферона используют лейкоциты свежеполученной донорской крови. Под воздействием вируса - интерфероногена лейкоциты, находящиеся в культуральной среде, синтезируют интерферон. Затем лейкоциты удаляют центрифугированием, вирус инактивируют. Препарат является нативным интерфероном. Для получения концентрированного нативный интерферон дополнительно очищают методом хроматографического разделения на колонках с сефадексом.
Интерферон выпускают в сухом виде в ампулах. Нативный сухой интерферон представляет собой пористый порошок серовато-коричневого цвета, который легко растворяется в дистиллированной воде. Растворенный препарат имеет розовато-красный цвет с опалесценцией. Допускается слабый коричневый оттенок раствора. Концентрированный сухой препарат - пористый порошок серовато-белого цвета, также легко растворяющийся в дистиллированной воде. Раствор препарата имеет сероватый цвет с опалесценцией, допустим слабый желтовато-коричневый оттенок. Посторонние примеси содержаться не должны.
Человеческий лейкоцитарный интерферон выпускают вирусологически и бактериологически стерильным. Противовирусная активность нативного препарата должна быть не менее 32 единиц, концентрированного - 100 единиц. Активность определяется титрованием на первичной культуре клеток кожно-мышечной ткани эмбриона человека с вирусом везикулярного стоматита.
Противопоказаний к применению препарата нет. Интерферон нереактогенен, не вызывает побочных явлений.
Препарат хранят при температуре 4 °С. Срок годности 1 год. По истечению его может быть проведен переконтроль в институте, изготовившем данную серию препарата. При сохранении физических свойств и активности срок годности препарата может быть продлен еще на 3 месяца.
Вирусы гриппа - РНК-содержащие вирусы - относятся к сем. Orthomyxoviridae и разделяются на вирусы А, В и С (табл. 1).
Сравнительная характеристика вирусов гриппа
| Критерии | Тип А | Тип В | Тип С |
| Тяжесть заболевания | ++++ | ++ | + |
| Природный резервуар | Есть | Нет | Нет |
| Пандемии человека | Вызывает | Не вызывает | Не вызывает |
| Эпидемии человека | Вызывает | Вызывает | Не вызывает (лишь спорадические заболевания) |
| Антигенные изменения | Шифт, дрейф | Дрейф | Дрейф |
| Сегментированный геном | Да | Да | Да |
| Чувствительность к ремантадину | Чувствительны | Не чувствительны | Не чувствительны |
| Чувствительность к занамивиру | Чувствительны | Чувствительны | - |
| Поверхностные гликопротеины | 2 (HA, NA) | 2 (HA, NA) | 1(HA) |
Вирус гриппа имеет сферическую форму и размер 80-120 нм. Сердцевина представлена одноцепочечной отрицательной цепью РНК, состоящей из 8 фрагментов, которые кодируют 11 вирусных белков.
Вирусы гриппа А широко распространены в природе и поражают как людей, так и целый ряд млекопитающих и птиц. Вирусы гриппа типов В и С выделены только от человека.
Эпидемически значимыми являются 2 подтипа вируса гриппа А — H3N2 и H1N1 и вирус гриппа типа В (А.А. Соминова с соавт, 1997; О.М. Литвинова с соавт., 2001). Итогом такой ко-циркуляции явилось развитие в один и тот же эпидсезон в различных странах эпидемий гриппа различной этиологии. Гетерогенность популяции эпидемических вирусов возрастает также за счет дивергентного характера изменчивости вирусов гриппа, что приводит к одновременной циркуляции вирусов, относящихся к различным эволюционным ветвям (О.М. Литвинова с соавт., 2001). В этих условиях создаются предпосылки для одновременного инфицирования человека различными возбудителями, что приводит к формированию смешанных популяций и реассортации как между вирусами ко-циркулирующих подтипов, так и среди штаммов в пределах одного подтипа (О.И. Киселев с соавт., 2000).
Классификация типов вирусов гриппа основана на антигенных различиях двух поверхностных гликопротеинов — гемагглютинина (НА) и нейраминидазы (NА). Согласно этой классификации вирусы гриппа и подразделяют на 3 типа — вирусы гриппа типа А, типа В и типа С. Различаются 16 подтипов НА и 9 подтипов NА.
Рис. 1. Классификация вирусов гриппа А и виды животных и птиц - промежуточные и конечные хозяева в цепи передачи инфекции к человеку.
Недавно открыт 16 подтип (Н16) гемагглютинина
Примечание: ∗ НА 7 и NА 7-NА8 выявили и у лошадей
На рис. 1 представлены подтипы вирусов гриппа типа А и их промежуточные хозяева и природные резервуары (перелетные птицы). К основным хозяевам вирусов гриппа А относятся те виды, которым свойственна заболеваемость гриппом.
В популяции человека до настоящего времени выявлены вирусы гриппа А только трех подтипов с НА1, НА2 и НА3. При этом вирусы содержат только два типа нейраминидазы - NА1 и NА2 (рис.1). Доказана их стабильная циркуляция в течении прошлого столетия, начиная с пандемии 1918 г (R.G. Webster et al., 1978; K.G. Nicholson et al., 2003).
Вирусы гриппа А (в меньшей степени В) обладает способностью к изменению структуры НА и NА. Для вируса гриппа А характерны два типа изменчивости:
- точечные мутации в вирусном геноме с соответствующим изменением в НА и NА (антигенный дрейф);
- полная замена одного или обоих поверхностных гликопротеинов (НА и NА) вируса путем реассортации/рекомбинации (антигенный шифт), в результате которого появляется принципиально новый вариант вируса, способный вызвать гриппозные пандемии.
Для вируса гриппа В антигенная изменчивость ограничивается только дрейфом, т.к. он, по-видимому, не имеет природного резервуара среди птиц и животных. Для вируса гриппа С характерна большая стабильность антигенной структуры и с ним связаны лишь локальные вспышки и спорадические случаи заболевания.
Представляет определенный интерес появление новых штаммов вируса гриппа в человеческой популяции и связанные с ними пандемии (рис. 2). На рис. 2 представлены основные антигенные шифты, ассоциированные с панедмиями ХХ века, вызванные вирусами гриппа А:
- в 1918 г пандемия была вызвана вирусом типа H1N1;
- в 1957 г - H2N2 штаммом А/Singapore/1/57;
- в 1968 г - H3N2 штаммом A/Hong Kong/1/68;
- в 1977 г - H1N1 штаммом A/USSR/1/77 (многие ученые не рассматривали это как пандемию, но с появлением этого штамма сложилась ситуация с одновременной ко-циркуляцией 2 штаммов вируса гриппа А - H3N2 и H1N1).
Рис. 2. Возникновение новых штаммов вируса гриппа в человеческой популяции и связанные с ними пандемии
Каковы же механизмы происхождения пандемических штаммов и какие биологические характеристики необходимы для появления высокопатогенного вируса с пандемическим потенциалом?
Для вирусов гриппа А характерна высокая частота возникновения реассортантов в результате смешанного заражения, что обусловлено сегментированностью вирусного генома. Преобладание реассортанта определенного генного состава считается результатом селекции, при которой из обширного набора разных реассортантов отбирается именно такой, который наиболее приспособлен к репродукции в данных условиях (Н.Л. Варич с соавт., 2009). Штаммоспецифические свойства геномных сегментов могут оказать сильное влияние на генный состав реассортантов в неселективных условиях. Другими словами, отличительной особенностью вирусов гриппа является то, что в восьми из генных сегментов, особенно в гене НА, происходят частые и непредсказуемые мутации. Реассортация играет важную роль в появлении новых вариантов вирусов, в частности в происхождении пандемических штаммов. И иногда нельзя исключить возможность появления на протяжении пандемии вируса с более высокой вирулентностью.
Современные исследования показали, что генная структура нового вируса А/H1N1 является сложной и в его состав, как мы уже отмечали во введении, входят гены свиного гриппа, поражающего свиней Северной Америки; гены свиного гриппа, поражающего свиней Европы и Азии; гены птичьего гриппа; гены человеческого гриппа. По сути, гены нового вируса получены из четырех различных источников. Микрофотография вируса гриппа А/H1N1 представлена на рис. 4.
Рис. 4. Микрофотография вируса гриппа А/H1N1
- реассортации между вирусами гриппа животных/птиц и человека;
- непосредственной адаптации вируса животных/птиц к человеку.
Для понимания происхождения пандемических вирусов гриппа важное значение имеет изучение свойств природного резервуара инфекции и путях эволюции этого семейства вирусов при смене хозяина. Уже хорошо известно и это можно утверждать, что водоплавающие птицы являются природным резервуаром вирусов гриппа А (адаптированные к этим промежуточным хозяевам в течение многих столетий), о чем свидетельствует носительство всех 16 подтипов НА этого вируса. Через фекалии птиц, которые в воде могут сохраняться более 400 дней (Грипп птиц…, 2005), вирусы могут передаваться другим видам животных при употреблении воды из водоема. (K.G. Nicholson et al., 2003). Это подтверждается филогенетическим анализом последовательностей нуклеиновых кислот разных подтипов вирусов гриппа А от различных хозяев и из различных географических регионов.
Для цитирования: Никифорова Г.Н., Свистушкин В.М., Дедова М.Г. Возможности местной терапии инфекционно-воспалительных заболеваний ЛОР-органов. РМЖ. 2015;6:346.
Инфекционно-воспалительные заболевания ЛОР-органов до сих пор остаются наиболее распространенными патологическими процессами, отличающимися упорным течением, несмотря на значительные успехи современной клинической медицины. Нозологические формы инфекции ЛОР-органов достаточно разнообразны – различные виды наружных и средних отитов, заболевания верхних отделов дыхательной трубки: риносинуситы, тонзиллофарингиты, ларингиты. Большое клиническое и социальное значение патологии верхних отделов дыхательных путей и уха обусловлено ее чрезвычайной распространенностью. В связи с резистентностью ряда возбудителей к антимикробным препаратам данные заболевания могут часто рецидивировать, принимать затяжное, хроническое течение, в ряде случаев возникает риск формирования синдрома системного воспалительного ответа (SIRS – systemic inflammatory response syndrome) и развития тяжелых, угрожающих жизни осложнений.
Проблема выбора этиотропной терапии, а также вида, способа применения и дозы лекарственного средства при лечении больных с инфекционной патологией ЛОР-органов является актуальной. При назначении антимикробных препаратов врачу необходимо ответить на ряд важных вопросов:
- нужна ли в конкретном клиническом случае этиотропная терапия и если да, то местная или системная;
- какой конкретно вид препарата и по какой схеме необходимо использовать;
- доказана ли эффективность данного препарата в контролируемых клинических исследованиях.
Основные параметры, которым должно соответствовать противомикробное лекарственное средство, – высокая активность против наиболее часто встречающихся возбудителей данной патологии, бактерицидное действие, минимальный риск селекции устойчивых микроорганизмов, достаточная аккумуляция в патологическом очаге, безопасность, хорошая переносимость, простота использования. Широкое и неадекватное использование системной антибактериальной терапии является главной причиной развития резистентности микроорганизмов. Феномен бактериальной устойчивости представляет большую проблему в терапии инфекционных заболеваний населения и создает реальную угрозу здравоохранению во всем мире. Необходимо менять тактику назначения системных антибиотиков – они должны использоваться только в случаях абсолютной необходимости, с соблюдением оптимальных дозировок и продолжительности лечения.
С учетом вышеизложенного большее значение приобретает местная антимикробная терапия, при которой обеспечивается доставка оптимальной дозы активного ингредиента непосредственно на слизистую оболочку дыхательных путей или в очаг воспаления. Преимуществами местной терапии при инфекционно-воспалительных заболеваниях верхних отделов дыхательных путей и уха являются простота и доступность введения в зону патологических изменений, высокая концентрация лекарственного вещества в очаге воспаления при малой общей дозе препарата, минимальный риск системных побочных эффектов.
Арсенал подобных средств в настоящее время достаточно скуден. В этом аспекте определенный интерес у врачей вызывает антимикробный химиопрепарат гидроксиметилхиноксалиндиоксид (Диоксидин); химическая формула – C10H10N2O4. Диоксидин является производным ди-N-окиси хиноксалина, обладает антибактериальной и антипротозойной активностью, характеризуется высокими реакционными свойствами, повышенной способностью к поляризации и окислительно-восстановительным реакциям. Производные ди-N-окиси хиноксалина интенсивно разрабатывались и изучались еще с 1960-х гг. как в России, так и в других странах. В частности, за рубежом в этот период были созданы такие препараты, как квиндоксин, меквидокс, карбадокс, темадокс, олахиндокс, обладающие высокой антимикробной активностью и имеющие широкий спектр действия.
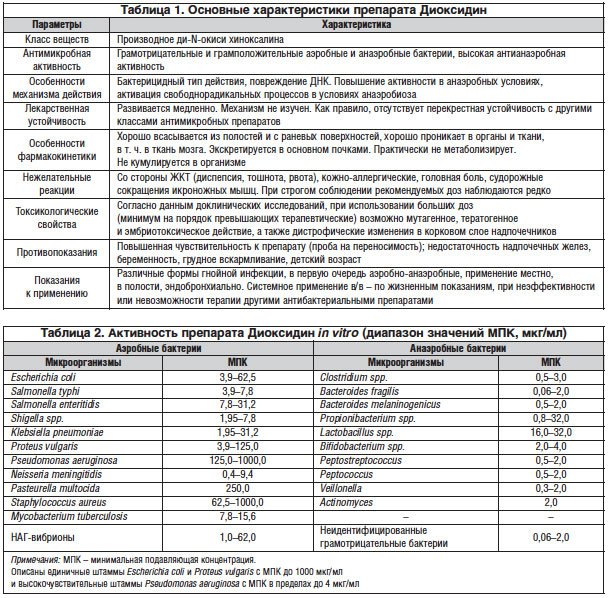
Во Всесоюзном научно-исследовательском химико-фармацевтическом институте (в настоящее время – Центр по химии лекарственных средств (ЦХЛС ВНИХФИ), Москва) коллективом авторов под руководством А.С. Елиной в 1972 г. в результате фундаментальных поисковых исследований были синтезированы 2 производных ди-N-окиси хиноксалина, одним из которых является Диоксидин. Второй препарат – хиноксидин, по существу, является лекарственной формой Диоксидина для применения внутрь, т. к. действующее начало хиноксидина – его основной метаболит Диоксидин. Диоксидин выпускается только в Российской Федерации, регистрационный номер: Р N003934/01-040411, форма выпуска – раствор для внутриполостного и наружного применения. Основные характеристики Диоксидина представлены в таблице 1 [19].
Диоксидин обладает избирательной активностью в отношении различных микроорганизмов – бактерий, вирусов, грибов, простейших. Высокая химиотерапевтическая активность in vivo на модельных инфекциях, близких по патогенезу к патологическим процессам у человека (гнойные менингиты, пиелонефрит, септикопиемии), вызванных штаммами аэробных бактерий, устойчивыми к препаратам других классов (в т. ч. полирезистентными), включая штаммы Pseudomonas aeruginosa и метициллиноустойчивых стафилококков, обусловила возможность разработки Диоксидина как лекарственного препарата [1, 16, 17]. Дополнительным основанием рекомендации для использования Диоксидина в клинической практике явилась его высокая активность в отношении анаэробных бактерий [4, 15, 22].
По данным ряда исследований, Диоксидин характеризуется широким антибактериальным спектром и бактерицидным типом действия [1, 4, 15, 17, 19, 22, 23]. Активность препарата in vitro представлена в таблице 2. Повреждение биосинтеза ДНК микробной клетки с глубокими нарушениями структуры нуклеоида происходит уже при субингибирующих концентрациях Диоксидина [14, 27].
Активность Диоксидина значительно повышается в анаэробных условиях. Данный феномен характерен для всех производных ди-N-окиси хиноксалина с антимикробной активностью и не описан для других классов антимикробных веществ [27]. В анаэробных условиях, в т. ч. в инфицированном организме, Диоксидин, как и другие производные ди-N-окиси хиноксалина, активирует свободнорадикальные процессы, индуцируя образование так называемых активных форм кислорода [8, 21, 27]. Вероятно, именно данное свойство Диоксидина лежит в основе не только высокой антимикробной активности препарата in vivo, но и ряда других его биологических свойств [19].
Особенностью Диоксидина как антимикробного агента является отсутствие корреляции эффектов in vitro (при определении в аэробных условиях) и в инфицированном организме. В ряде экспериментов было продемонстрировано, что Диоксидин практически не метаболизируется, а специально синтезированные, теоретически возможные метаболиты Диоксидина не обладают антибактериальным действием [5, 15, 16]. Диоксидин хорошо проникает в различные органы и ткани, экскретируется главным образом почечными механизмами и при повторных введениях не кумулирует, однако его фармакокинетика у человека изучена не в полном объеме [5, 15, 16, 23, 25, 26]. Активность препарата при введении внутрь и парентерально на различных моделях экспериментальных инфекций позволяет рассмативать его как истинный химиотерапевтический препарат [15]. Несмотря на длительный (более чем 30 лет) период применения Диоксидина для лечения гнойно-воспалительных процессов в клинической практике эффективность данного препарата сохранилась – следовательно, резистентность микроорганизмов к нему практически не развивается. Это подтверждает результат многоцентрового исследования, проведенного в 2011 г. Диоксидин в терапевтических концентрациях активен в отношении (93%) исследованных штаммов микроорганизмов [13].
Полученные результаты данного мультицентрового исследования свидетельствуют о необходимости и целесообразности использования Диоксидина в качестве антимикробного препарата для местного лечения бактериальных инфекций. При условии обеспечения адекватных тканевых концентраций в комплексной антимикробной терапии гнойно-воспалительных процессов Диоксидин применяется в виде 5% мази и 0,5 и 1% раствора для наружного применения [13].
В Институте медицинской генетики РАМН специально проводился анализ цитогенетических свойств Диоксидина для решения вопроса о возможности его применения в медицинской практике. Исследования показали, что при местном применении в рекомендуемых терапевтических дозах Диоксидин не повышает частоты мутаций в клетках крови человека, т. е. противопоказаний для наружного применения Диоксидина нет.
Опубликованы данные о хорошей переносимости препарата при местном применении. При терапии Диоксидином не отмечено нефротоксического и ототоксического действия, а также отрицательного влияния на функцию печени. Частота побочных эффектов монотерапии Диоксидином – менее 3% (1% раствор для внутриполостного и наружного применения). Побочные явления, которые наблюдались при местном применении, были рассмотрены как несерьезные и спонтанно исчезали в течение лечения [9, 19]. Согласно инструкции по медицинскому применению Диоксидина, максимальная суточная доза препарата для введения в полости – 70 мл 1% раствора. Терапевтическая доза при местной терапии (введение в каплях) в 150 раз меньше предельно допустимой (1 мл – 20 капель, соответственно на 1 введение 3 капли – 0,15 мл, по 3 капли 3 р./сут – 0,45 мл).
Клинические данные по итогам широкого изучения терапевтической эффективности Диоксидина более чем у 6 тыс. больных в 24 клиниках различного профиля при разных формах гнойной инфекции в урологической, хирургической и оториноларингологической практике показывают эффективность препарата при применении местно, при введении в полости, эндобронхиально, ингаляционно и в/в. Эти результаты опубликованы [1–3, 6, 7, 10–12, 17, 18, 20, 24, 26]. Показания для соответствующего способа применения препарата определялись характером патологического процесса, причем в первую очередь Диоксидин назначали в случаях тяжелых форм гнойной инфекции, при резистентности возбудителя к другим антимикробным агентам.
В Московском НИИ уха, горла, носа и речи Диоксидин широко применялся с 1970-х гг. для лечения гнойно-воспалительной патологии ЛОР-органов: синуситов, хронического тонзиллита, обострения хронических ларингитов и ларинготрахеитов, хронических гнойных средних отитов, а также в лечении ран при заживлении вторичным натяжением в послеоперационном периоде. Данный клинический опыт использования Диоксидина в оториноларингологии свидетельствует о высокой эффективности и безопасности препарата при местном использовании. Диоксидин хорошо переносится больными, не вызывает выраженного дисбактериоза и может быть рекомендован к использованию в практике ЛОР-врача [6].
Показаниями к внутриполостному и наружному использованию Диоксидина являются гнойные бактериальные инфекции, вызванные чувствительной микрофлорой, при неэффективности других химиотерапевтических средств или их плохой переносимости. Противопоказания: индивидуальная непереносимость препарата, надпочечниковая недостаточность, в т. ч. в анамнезе, беременность, период лактации, детский возраст до 18 лет. С осторожностью Диоксидин применяется при почечной недостаточности.
В оториноларингологии возможно использование различных лекарственных форм Диоксидина: для местного лечения – 5% мазь, для введения в полости – 0,5 и 1% водные растворы в ампулах и флаконах. Возможные области применения препарата в оториноларингологии: гнойные риносинуситы, абсцессы перегородки носа, фурункулы, карбункулы, сикоз преддверия носа, хронический тонзиллит, паратонзиллярные, парафарингеальные абсцессы, острый ларингит и обострение хронических воспалительных процессов в гортани, канюленосительство, средние перфоративные отиты, заболевания слуховой трубы, наружные отиты, состояния после вскрытия отогематомы, флегмоны шеи, медиастиниты, травмы и состояния после хирургических вмешательств на верхних отделах дыхательных путей и уха и некоторые другие патологические состояния. Средние сроки использования Диоксидина при заболеваниях ЛОР-органов – 7–10 дней.
Таким образом, высокая эффективность, практическое отсутствие микробной резистентности, безопасность при местном использовании, хорошая переносимость позволяют рекомендовать Диоксидин в качестве топического средства для лечения ряда инфекционно-воспалительных процессов в оториноларингологии.
- Антибактериальные препараты: Сб. науч. тр. ВНИХФИ / под ред. Е.Н. Падейской. М., 1984. 159 с.
- Ашбель С.И., Куприянова Т.С. Раны и раневая инфекция: Мат-лы Междунар. конф. М., 1998. С. 77–85.
- Блатун Л.А., Костюченок Б.М., Шимкевич Л.Л. и др. Раны и раневая инфекция: Мат-лы Междунар. конф. М., 1998. С. 98–108.
- Большаков Л.В. Динамика чувствительности клинических штаммов бактерий к диоксидину с 1984 по 1988 г. // Антибиотики и химиотерапия. 1990. № 35 (9). С. 17–18.
- Буданова Л.И., Вигдорчик М.М., Елина А.С. и др. // Хим.-фарм. журнал. 1980. № 1. С. 10–11.
- Дайняк Л.Б., Цырульникова Л.Г., Загорянская М.Е., Кунельская В.Я. Раны и раневая инфекция: Мат-лы Междунар. конф.. М., 1998. С. 108–113.
- Даценко Б.М., Блатун Л.А., Перцев И.М. и др. Современные возможности и перспективы местного медикаментозного лечения ран: Мат-лы Всесоюз. конф. М., 1991. С. 20–22.
- Дурнев А.Д., Дубовская О.Ю., Нигарова Э.А. и др. Роль свободных радикалов кислорода в механизме мутагенного действия диоксидина // Хим.-фарм. журнал. 1989. № 23 (11). С. 1289–1291.
- Инструкция по медицинскому применению препарата диоксидин.
- Кузьменко В.В., Першин Г.Г., Поляков Д.И. Раны и раневая инфекция: Мат-лы Междунар. конф. М., 1998. С. 85–89.
- Лопаткин Н.А., Даренков А.Ф., Ненашева Н.П. Раны и раневая инфекция: Мат-лы Междунар. конф. М., 1998. С. 93–97.
- Лукомский Г.И., Овчинников А.А., Жигалкин Г.В. и др. Раны и раневая инфекция: Мат-лы Междунар. конф. М., 1998. С. 58–66.
- Отчет о результатах оценки активности in vitro антимикробного препарата диоксидин на базах НЦССХ им. А.Н. Бакулева, при участии НИИ нейрохирургии им. акад. Н.Н. Бурденко, НИИ хирургии им. А.В. Вишневского, ЦИТО им. Н.Н. Приорова, МОНИКИ им. М.Ф. Владимирского.
- Падейская Е.Н., Тюрин В.С., Першин Г.Н., Быков А.С. Субмикроскопические изменения в клетках кишечной палочки и стафилококка под влиянием диоксидина // Фармакология и токсикология. 1974. Т. 37. № 1. С. 80–85.
- Падейская Е.Н., Шипилова Л.Д., Буданова Л.И. и др. Фармакокинетика диоксидина, проникновение препарата в органы и ткани при однократном и повторном введении // Хим.-фарм. журнал. 1983. № 6. С. 667–671.
- Падейская Е.Н. Производные хиноксалина и сульфаниламида в химиотерапии бактериальных инфекций: Дисс. . докт. мед. наук. М., 1983.
- Падейская Е.Н. // Новые лекарственные препараты. Экспресс-информация. 1989. № С. 1–18.
- Падейская Е.Н. Диоксидин 25 лет в клинической практике. Значение и место среди других антибактериальных средств // В мире лекарств. 1999. № 2 (4). С. 42–46.
- Падейская Е.Н. Антибактериальный препарат диоксидин: особенности биологического действия и значение в терапии различных форм гнойной инфекции // Инфекции и антимикробная терапия. Сложные вопросы антимикробной химиотерапии. 2001. Т. 3. № 5.
- Петровский Б.В., Богомолова Н.С., Сорокина В.И. Раны и раневая инфекция: Мат-лы Междунар. конф. М., 1998. С. 66–73.
- Пономарева Т.Р., Дронова О.М. Антибактериальные препараты: Сб. тр. ВНИХФИ. М., 1984. С. 23–27.
- Пономарева Т.Р. Чувствительность клинических штаммов бактерий к диоксидину in vitro в аэробных и анаэробных условиях // Антибиотики и медицинская биотехнология. 1987. № 3. С. 199–202.
- Пономарева Т.Р., Малахова В.А., Ананьев В.С. Вопросы антибактериальной терапии инфекционных осложнений в неинфекционной клинике: Мат-лы Всесоюз. сем. М., 1987. С. 67–68.
- Сологуб В.К., Морозов С.С., Резницкая Н.И. Раны и раневая инфекция: Мат-лы Междунар. конф. М., 1998. С. 90–93.
- Холодов Л.Е., Аминова И.Ю., Тагиров Р.Ф., Яковлев В.П. Методы индивидуализации и оптимизации применения лекарств на основе изучения фармакокинетики: Мат-лы Всесоюзн. конф. Тбилиси, 1982. Ч. II. С. 99–103.
- Яковлев В.П., Блатун Л.А., Звягин Ф.Ф. Раны и раневая инфекция: Мат-лы Междунар. конф. М., 1998. С. 193–195.
- Suter W., Russelet A., Knusel F. // Agents Chemother. 1978. Vol. 13 (5). Р. 770–783.
Читайте также:

